Idiopatická superficiální sideróza – kazuistika
Idiopathic Superficial Siderosis – a Case Report
Superficial siderosis (SS) of the central nervous system (CNS) is a rare, progressive, irreversible and debilitating disorder in which hemosiderin – a blood degradation product – is deposited in the subpial layers of the brain and spinal cord, leading to loss of neurons and myelin and development of neurological deficit. Clinical presentation of SS is characterized by a typical triad of symptoms consisting of adult-onset slowly progressive cerebellar ataxia, signs of myelopathy and sensorineural hearing impairment. MR imaging shows a characteristic T2 hypointensity around the brain stem, cerebellum, and spinal cord. The authors present a case of a woman with progressive hearing impairment from 53 years of age and gradual development of deteriorating paleocerebellar and spinal symptoms. Despite extensive imaging, the source of bleeding has never been identified.
Key words:
siderosis – magnetic resonance – ferritin – haemosiderin – cerebellar ataxia – deafness
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
D. Krajíčková 1; L. Klzo 2; A. Krajina 2
Působiště autorů:
LF UK a FN Hradec Králové
Neurologická klinika
1; LF UK a FN Hradec Králové
Radiologická klinika
2
Vyšlo v časopise:
Cesk Slov Neurol N 2013; 76/109(6): 759-762
Kategorie:
Kazuistika
Souhrn
Superficiální sideróza (SS) centrálního nervového systému (CNS) je vzácné, progredující, ireverzibilní a invalidizující onemocnění, u kterého se hemosiderin – rozpadový produkt krve – ukládá v subpiální vrstvě mozku a míchy, což vede k rozpadu neuronů a vývoji neurologického deficitu. Typický klinický obraz SS je charakterizován triádou příznaků sestávající z pomalu progredující mozečkové ataxie, projevů myelopatie a poruchy sluchu z postižení VIII. mozkového nervu. Vyšetření magnetickou rezonancí (MR) ukazuje charakteristické T2 hypointenzity na povrchu mozkového kmene, mozečku a míchy. Autoři prezentují případ ženy s projevy progresivního zhoršování sluchu od 53 let věku a postupným rozvojem stále se zhoršující paleocerebelární a míšní symptomatiky, u níž jasný zdroj krvácení nebyl navzdory rozsáhlému diagnostickému pátrání nalezen.
Klíčová slova:
superficiální sideróza – magnetická rezonance – ferritin – hemosiderin – mozečková ataxie – hluchota
Úvod
SS charakterizovaná depozity rozpadových produktů hemoglobinu v subarachnoidálním prostoru na povrchu mozku a míchy, jež svědčí pro chronické krvácení, zůstává navzdory tomu, že poprvé byla popsána již před více než 100 lety [1], stále do jisté míry záhadným onemocněním. Problém spočívá v tom, že v anamnéze nemocných většinou chybí masivní subarachnoideální krvácení a anamnesticky či s pomocí vyšetřovacích metod zjišťované patologie, jako intrakraniální nádory, stavy po operacích těchto nádorů či jiných neurochirurgických operacích, prodělané úrazy hlavy a páteře, kavernomy, amyloidová angiopatie aj., které jsou interpretovány jako příčina chronického krvácení do subarachnoidálních prostor, u naprosté většiny nemocných tento důsledek nemají. Bližší porozumění tomuto onemocnění je ztíženo tím, že se jedná o onemocnění velmi vzácné. Největší soubor 30 nemocných se SS byl v letech 1989 – 2004 shromážděn na Mayo klinice [2]. Levy at al v roce 2012 odhadli celkový počet nemocných se SS v USA na 50 osob [3]. První popis SS v České republice byl publikován v roce 2005 v tomto časopise [4]. Preferenční ukládání hemosiderinových depozit intrakraniálně v oblasti zadní jámy a na povrchu míchy vysvětluje dominující klinické příznaky spočívající v mozečkové ataxii, hluchotě z postižení VIII. mozkového nervu a projevech myelopatie.
Kazuistika
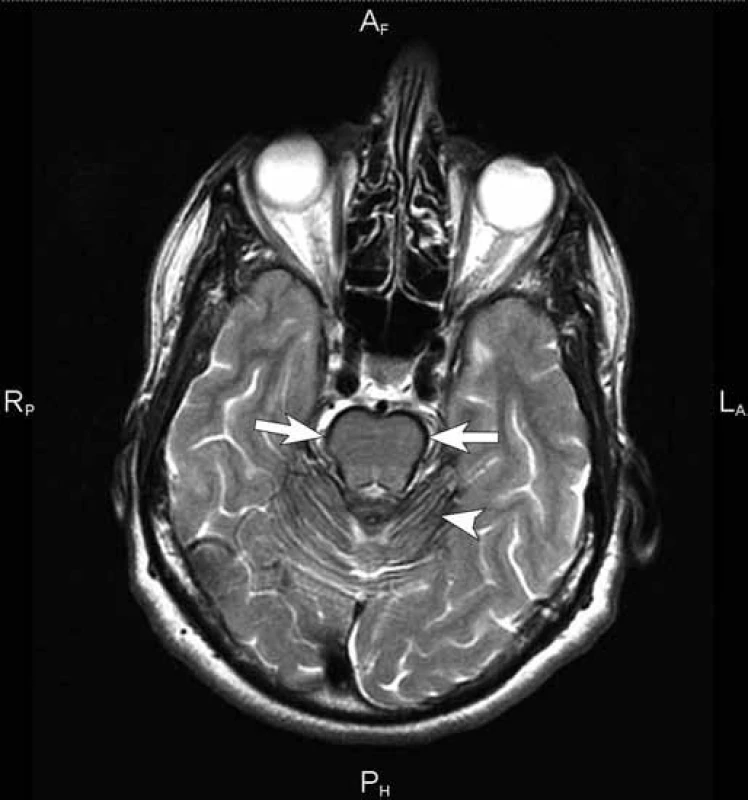
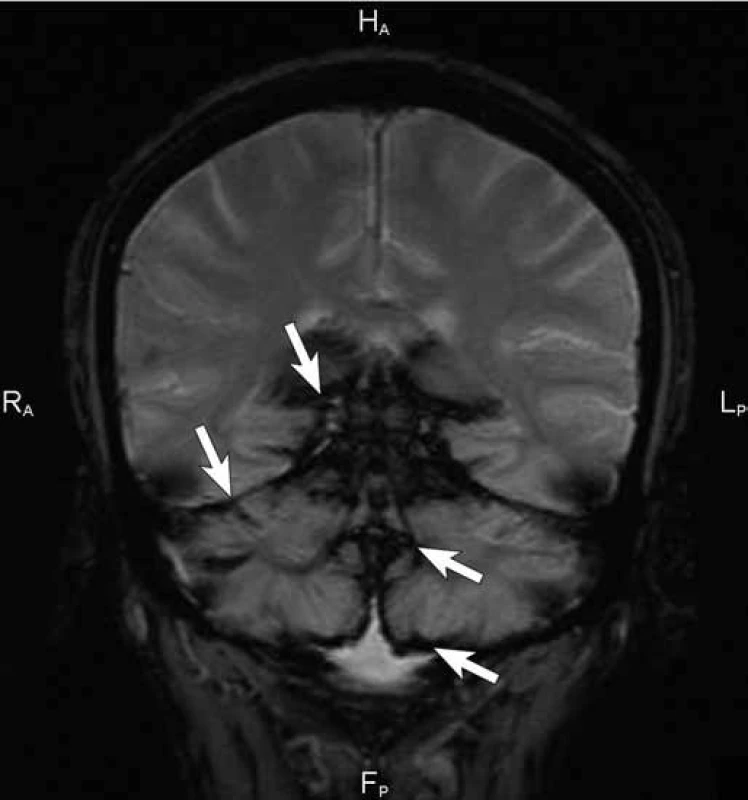
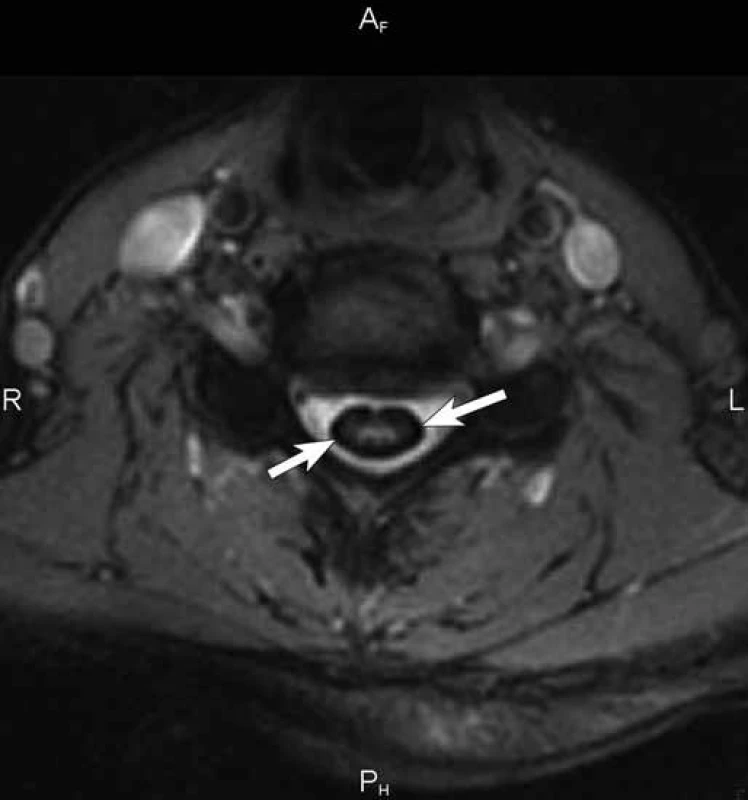
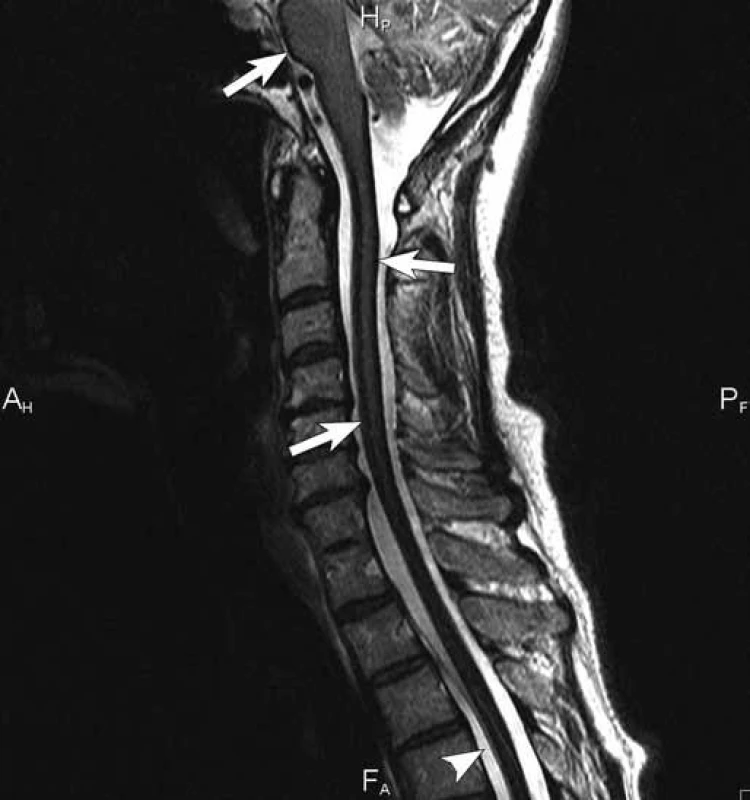
Čtyřiapadesátiletá žena byla poprvé neurologicky vyšetřena počátkem května 2007 na doporučení ORL ambulance pro asi rok progredující poruchu sluchu vpravo s pocitem tahu k pravé straně. Předchorobí nemocné kromě apendektomie v dávné minulosti a lehké hypotyreózy na substituční terapii bylo negativní. V objektivním neurologickém nálezu kromě smíšené nedoslýchavosti vpravo byla jen lehce ataktická chůze, kterou si nemocná neuvědomovala. Byla přijata k diagnostické hospitalizaci, během níž doplněná MR mozku včetně intrakranální MRA kromě 15 × 10 mm velké neexpandující arachnoidální cysty v mostomozečkovém koutu vpravo ukázala masivní depozita hemosiderinu na povrchu mozku s maximem v zadní jámě lební a piální krajině, menší depozita byla i v Sylviových fizurách oboustranně (obr. 1, 2). Likvor, který při lumbální punkci vytékal pod normálním tlakem, byl lehce xantochromní s drobným sedimentem erytrocytů, spektrofotometricky bylo prokázáno stopové množství bilirubinu a hladina bílkoviny byla lehce zvýšena na 0,6 g/ l. Katetrizační mozková panangiografie neprokázala žádnou cévní patologii v oblasti mozku a krční míchy. Kontrolní MR mozku včetně intrakraniální MRA o šest týdnů později zobrazila identickou extenzivní stranově symetrickou siderózu leptomening, dominující na povrchu mezencefala, pontu a horní oblongaty. O čtyři měsíce později, v září 2007, jsme zopakovali katetrizační panangiografii mozku, doplněnou o zobrazení spinálních tepen kaudálně do úrovně Th3 k vyloučení eventuálního zdroje krvácení v páteřním kanálu, znovu s kompletně negativním nálezem. Následně bylo realizováno MR vyšetření celé páteře, kde byly dominujícím nálezem rozsáhlé splývající T2 hypointenzity na povrchu míchy zvýrazňující se na sekvenci gradientního echa (obr. 3). Dalším významným nálezem byl obraz adhezivní arachnoiditidy v oblasti kaudy, mícha byla difuzně atrofická. Vedlejším nálezem byla plošná epidurální kolekce v úrovni Th2 až Th6 v délce kraniokaudálně 8 cm, ventrodorzálně do 4 mm, nepůsobící kompresi míchy (obr. 4). Kontrastní MRA zaměřená na aortu a páteřní kanál neprokázala přítomnost cévní malformace v páteřním kanálu jako zdroj krvácení ani v této oblasti. V dalších letech opakované MR mozku v lednu 2010 a páteře v srpnu 2010 a v lednu 2013 prokázaly v čase stacionární nález leptomeningeální siderózy.
Navzdory stacionárnímu radiologickému obrazu klinický syndrom ve stejném období významně progredoval. Tři roky od prvního neurologického vyšetření v červnu 2010 byly kromě progredující poruchy sluchu s 50% ztrátou již přítomny známky myelopatie s kvadruhyperreflexií, masivně pozitivním příznakem Babinski, imperativní mikcí a zřetelně ataktická chůze s rozšiřováním báze. V únoru 2013, tedy šest let od prvních příznaků horšícího se sluchu, nebyla nemocná již schopna chodit bez pomoci hole, chůze byla těžce spasticko‑ataktická, mozečková axiální ataxie byla patrna i vsedě, nově byl přítomen nystagmus I. st. v obou temporálních pohledech. Kontrolní ORL vyšetření v únoru 2013 potvrdilo těžkou smíšenou poruchu sluchu vpravo se ztrátami 65 dB na 500 Hz a hluchotou na 4 kHz, zůstala kochleární rezerva jen v nízkých frekvencích do 25 dB, na levé straně zjištěna jen lehká percepční nedoslýchavost odpovídající věkové normě.
V historii nemocné nelze vysledovat ataku silné bolesti hlavy nebo páteře, neprodělala intrakraniální nebo spinální operaci, jediným úrazem byl asi tři roky před prvními příznaky úder hlavy o skříňku, který hodnotila jako banální.
Diskuze
SS je výsledek chronického krvácení do subarachnoidálního prostoru s ukládáním depozit rozpadových produktů krve – hemosiderinu – v subpiální vrstvě mozku a míchy. Depozita hemosiderinu obsažená v makrofázích v perivaskulárních prostorách a podél stěny piálních cév vedou k rozpadu neuronů, glióze a demyelinizaci [5,6], a tím ke vzniku neurologických příznaků.
Nejčastěji dochází k první manifestaci onemocnění v páté a šesté životní dekádě. Uvádí se, že klinické příznaky se objevují v průměru 15 let od události [5], která by mohla být zdrojem krvácení, pokud je v historii nemocného vůbec přítomna. Od té chvíle se pak onemocnění stává chronickým a nezadržitelně progreduje. Typický klinický obraz je představován kombinací progresivního zhoršování sluchu z postižení n. VIII a pozvolna se zhoršující mozečkové ataxie a/ nebo myelopatie. Jednostranné či oboustranné postižení sluchu je přítomno u 81 % nemocných, stejně často jako mozečková ataxie, a 53 % nemocných má klinické známky myelopatie [7]. Pouze u 39 % nemocných jsou vyjádřeny všechny tři symptomy. Postižení sluchu progreduje v průměru 12 let k úplné hluchotě a 27 % pacientů je během 11 let upoutáno na lůžko [5]. Klinický obraz odráží skutečnost, že depozita hemosiderinu jsou preferenčně nahromaděna v zadní jámě. Selektivní vulnerabilita VIII. a o něco méně často I. mozkového nervu pravděpodobně souvisí s délkou jejich intrakraniálního myelinizovaného úseku, která je činí senzitivními k ukládání hemosiderinových depozit [7].
Diagnostickou metodou zásadního významu pro SS je MR, která zobrazí T2 hypointenzity zejména na povrchu mozečku, mozkového kmene a míchy, často také v oblasti Sylviových fisur nebo mozkové konvexity. Výraznější je tento nález na cílené sekvenci gradientního echa T2* (obr. 2), případně na sekvenci nejcitlivější k artefaktům z nehomogenity magnetického pole – na susceptibilně vážených obrazech (SWI). Detekce hemosiderinových depozit v jiných oblastech je vzácná, případně vázána na zdroj krvácení (např. cévní malformaci, tumor či aneuryzma). Téměř pravidlem je mozečková atrofie, hlavně v horním vermis, a díky tomu je zřetelně více vyjádřena symptomatika paleocerebelární s chůzovou ataxií než neocerebelární. Před érou MR bylo ve světové literatuře popsáno asi 40 případů SS, které byly diagnostikovány většinou post mortem nebo jako pozorování během operace [8]. Se zavedením MR do každodenní praxe jsou nyní diagnostikovány i preklinické případy.
Likvor nemocných se SS jeví známky proběhlého nebo méně často čerstvého krvácení, bývá xantochromní s příměsí erytrocytů a zvýšenou hladinou bílkoviny. Vzhledem k epizodické povaze krvácení však likvor při jediné punkci známky krvácení vykazovat nemusí.
Navzdory extenzivnímu pátrání se u 35 – 50 % nemocných nepodaří potenciální zdroj krvácení nalézt [2,7]. Anamnéza prodělaného subarachnoidálního krvácení je vzácná, nejčastěji zjišťovanou potenciálně kauzální událostí v předchorobí je úraz hlavy, páteře nebo intrakraniální či intraspinální operace. V souboru 30 nemocných z Mayo kliniky mělo úrazovou anamnézu 17 nemocných (57 %) a šest nemocných (20 %) dříve prodělalo nějakou neurochirurgickou operaci (např. resekci mozečkového astrocytomu, excizi mozečkového kavernomu, zavedení zkratu pro normotenzní hydrocefalus nebo cystu 4. komory) [2]. Někdy je za možný zdroj chronického krvácení považována cerebrální amyloidová angiopatie, zejména forma spojená s mutací trans-thyretinového genu, a to pro typické postižení cév v kortikální a subkortikální vrstvě [7,9 – 11]. Amyloidová angiopatie se však dominantně projevuje krvácením v supratentoriálních částech mozku, infratentoriální oblasti bývají postiženy raritně. Mozková a spinální angiografie většinou jasný zdroj krvácení nezobrazí; spíše bývají nejrůznější nálezy neurčité významnosti, jako jsou kavernom blízko k povrchu mozku bez známek rozsáhlejšího krvácení, vývojová žilní anomálie mozečku (žilní angiom) nebo známky fibromuskulární dysplazie na vnitřní karotické tepně.
Patogeneze SS spočívá v sekvestraci štěpných produktů hemu v glii a mikroglii. Tyto buňky iniciálně akumulují ferritin, ve vodě rozpustný protein, ve kterém 24 polypeptidových podjednotek chrání centrální krystalické jádro oxyhydroxidu železa. Ferritin funguje jako zásobní forma železa v organizmu, jedna molekula je schopna v závislosti na okolní koncentraci pojmout až 4 500 atomů. Jakmile množství dostupného železa přesáhne schopnost buněk syntetizovat ferritin, začne vznikat hemosiderin, který je spíše odpadovou, nerozpustnou a nemetabolizovatelnou formou železa. Proces syntézy ferritinu a hemosiderinu je pravděpodobně po krátkou dobu protektivní. Příčinou pozdější neurotoxicity jsou nejspíše volné, nevázané ionty železa, které jsou považovány za mediátor buněčné apoptózy mechanizmem štěpení volných kyslíkových radikálů. Zdá se, že preferenční postižení určitých struktur CNS souvisí s přítomností buněk se speciální enzymatickou výbavou pro štěpení hemu, jako je Bergmannova mikroglie v molekulární vrstvě mozečkového vermis. Zásadní roli gliových buněk v tomto procesu potvrdila přítomnost ferritinových granulí a hemosiderinových deposit tři až šest měsíců po intratékální aplikaci erytrocytů králíkům [12,13].
Logickou léčebnou strategií SS se jeví eliminace zdroje krvácení do subarachnoidálních prostor. Očekávaný efekt chirurgické léčby kromě skutečnosti, že pravděpodobný zdroj krvácení (neoplazma, cévní malformaci, pseudomeningokélu) identifikujeme jen u části nemocných, limituje opakované pozorování, že většinou ani úspěšná chirurgická léčba předpokládané příčiny nevedla ke stabilizaci stavu a nezabránila progresi neurologického deficitu. Existuje pouze jediná kazuistika referující o reverzibilitě SS po chirurgickém ošetření durálního defektu, který byl považován za zdroj krvácení [14]. Veškeré dosavadní pokusy s farmakoterapií dopadly buď jednoznačně neúspěšně (kortikosteroidy, selegiline, antioxidanty – vitamin C a E) nebo rozpačitě – v případě chelátorů železa [15]. V r. 2011 byly publikovány výsledky pilotní studie s deferipronem, chelátorem železa, který byl po dobu 90 dnů podáván 10 nemocným se SS. Navzdory tomu, že po této době u devíti z nich MR dokumentovalo zmenšení depozit hemosiderinu, pouze čtyři nemocní uváděli subjektivní zlepšení, které nebylo objektivizováno, protože většina nemocných neprodělala kontrolní neurologické vyšetření [3].
Závěr
SS je vzácné a stále ještě záhadné onemocnění, jež nezadržitelně progreduje k invalidizaci. Je způsobeno ukládáním hemosiderinu v subpiální vrstvě mozku a míchy. Jasný zdroj chronického krvácení do subarachnoidálních prostor většinou, stejně jako u naší nemocné, nenacházíme.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Dagmar Krajíčková, CSc.
Neurologická klinika
LF UK a FN
Sokolská 581
500 05 Hradec Králové
e-mail: dagmar.krajickova@fnhk.cz
Přijato k recenzi: 14. 3. 2013
Přijato do tisku: 12. 6. 2013
Zdroje
1. Gautham R. Superficial siderosis of the CNS. Baylor Neurology Case of the Month [on-line]. Available from URL: http:/ / www.bem.tcm.edu/ neurol/ challeng/ pat46/ selftest.html.
2. Kumar N, Cohen-Gadol AA, Wright RA, Miller GM, Piepgras DG, Ahlskog JE. Superficial siderosis. Neurology 2006; 66 (8): 1144 – 1152.
3. Levy M, Llinas RH. Pilot safety trial of deferiprone in 10 subjects. Stroke 2012; 43(1): 120 – 124.
4. Brabcová L, Ulmanová O, Viták T, Faltýnová E, Roth J.Superficiální hemosideróza centrálního nervstva: klinicko‑patologický přehled a kazuistika. Cesk Slov Neurol N 2005; 68/ 101(5): 349 – 352.
5. Fearnley JM, Stevens JM, Rudge P. Superficial siderosis of the central nervous system. Brain 1995; 118(Pt 4): 1051 – 1066.
6. Aquilina K, Kumar R, Lu J, Rawluk D. Superficial siderosis of the central nervous system following cervical nerve root avulsion: the importance of early diagnosis and surgery. Acta Neurochir 2005;147(3): 291 – 297.
7. Levy M, Turtzo Ch, Llinas RH. Superficial siderosis: a case report and review of the literature. Nat Clin Pract Neurol 2007; 3(1): 54 – 58.
8. Kumar N. Neuroimaging in superficial siderosis: an in‑depht look. AJNR Am J Neuroradiol 2010; 31(1): 5 – 14.
9. Feldman HH, Maia LF, Mackenzie IR, Foster BB, Martzke J, Woolfenden A. Superficial siderosis: a potencial diagnostic marker of cerebral amyloid angiopathy in Alzheimer disease. Stroke 2008; 39(10): 2894 – 2897.
10. Linn J, Herms J, Dichgans M, Brückmann H, Fesl G,Freilinger T. Subarachnoid hemosiderosis and superficial cortical hemosiderosis in cerebral amyloid angiopathy. AJNR Am J Neuroradiol 2008; 29(1): 184 – 186.
11. Ellie E, Camou F, Vital A, Rummens C, Grateau G,Delpech M et al. Recurrent subarachnoid hemorrhage associated with a new transthyretin variant (Gly53Glu). Neurology 2001; 57(1): 135 – 137.
12. Koeppen AH, Dickson AC, Chu RC, Thach RE. The pathogenesis of superficial siderosis of the central nervous system. Ann Neurol 1993; 34(5): 646 – 653.
13. Koeppenn AH, Michael SC, Li D. The pathology of superficial siderosis of the central nervous system. Acta Neuropathol 2008; 116(4): 371 – 382.
14. Kumar N, Lane JI, Piepgras DG. Superficial siderosis: sealing the defect. Neurology 2009; 72(7): 671 – 673.
15. Scheid R, Frisch S, Schroeter ML. Superficial siderosis of the central nervous system – treatment with steroids? J Clin Pharm Ther 2009; 34(5): 603 – 605.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2013 Číslo 6
Nejčtenější v tomto čísle
- Frontotemporálna lobárna degenerácia z pohľadu nových klinicko‑patologických korelácií
- Tuberózní skleróza u dětí sledovaných od novorozeneckého věku pro prenatální nález rhabdomyomů srdce – dvě kazuistiky
- Expanze pineální krajiny
- Zlomeniny kondylu okciputu
