Léčebný potenciál lamotriginu v terapii epilepsie v dětství a adolescenci
Therapeutical Potential of Lamotrigine in the Therapy of Childhood Epilepsy. A Review
Lamotrigine (LTG) has been applied as a broad-spectrum AE in children above 2 years of age since 2002. It is indicated for add-on therapy of epilepsies with partial and generalized seizures, including tonic-clonic seizures and seizures associated with Lennox-Gastaut’s syndrome (LGS). After managing seizures by means of a combined therapy, simultaneous application of other antiepileptic drugs (AEDs) may be terminated and LTG monotherapy continues. Since 2005 LTG has been also indicated as monotherapy for typical absence seizures. In children and adolescents over 12 years of age, the indication spectrum is the same as that in adults. Childhood epilepsy, if compared with adult age, has got a number of specific features – distinct metabolism of AEs, different spectrum of seizures, incidence of epileptic syndromes linked to age and development, more types of seizures within one epilepsy, and potentially negative influence of non-compensated seizures and adverse effects (AE) of AEs on cognitive profile, behavior and development of a young patient. The report has given evidence of LTG effects on seizures and its acceptable tolerability in childhood. There are mentioned methods of how to avoid the most serious AE and unfavourable drug interactions. It does not substitute a Summary of information about the preparation (SIP).
Key words:
lamotrigine – epilepsy – seizure – cognition – behavior – adverse effects – worsening of seizures
Autoři:
H. Ošlejšková
Působiště autorů:
LF MU a FN Brno
; Klinika dětské neurologie, Centrum
pro epilepsie, Dětská nemocnice
Vyšlo v časopise:
Cesk Slov Neurol N 2007; 70/103(5): 495-504
Kategorie:
Přehledný referát
Souhrn
Lamotrigin (LTG) je od roku 2002 používán jako širokospektré antiepileptikum u dětí starších 2 let. Je indikován ke kombinované léčbě epilepsií s parciálními a generalizovanými záchvaty, včetně záchvatů tonicko-klonických a záchvatů v rámci Lennox-Gastautova syndromu, a od roku 2005 také jako monoterapie typických absencí. U dětí a adolescentních pacientů nad 12 let je indikační spektrum stejné jako v dospělosti. Dětská epilepsie má oproti dospělému věku řadu specifik – rozdílný metabolizmus antiepileptik (AE), jiné spektrum záchvatů, výskyt epileptických syndromů s věkovou vazbou a vývojem, často více typů záchvatů v rámci jedné epilepsie a potenciálně negativní vliv nekompenzovaných záchvatů a nežádoucích účinků (NÚ) antiepileptika na kognitivní profil, behaviorální projev a vývoj malého pacienta. Článek přináší důkazy o efektu LTG na záchvaty a jeho akceptovatelné tolerabilitě v dětství a upozorňuje na postupy, jak se vyvarovat nejdůležitějších NÚ a nepříznivých lékových interakcí LTG. Nenahrazuje souhrn informací o přípravku (SPC).
Klíčová slova:
lamotrigin – epilepsie – epileptický záchvat – kognice – chování – nežádoucí účinek – horšení záchvatů
Úvod
Epilepsie a epileptické záchvaty jsou častým chronickým neurologickým onemocněním v průběhu celého lidského života, ale nejvyšší incidenci zaznamenáváme právě v dětství. Její prevalence je udávaná různě, nejčastěji 4-6 na 1 000 dětí [1,2], práce Waalera uvádí 5,1 na 1 000 dětí [3].
LTG byl jedním z prvních nových AE, který obohatil spektrum klasických AE užívaných v terapii dětských epilepsií do konce 90. let minulého století. Je ceněn pro účinnost na široké spektrum dětských epileptických záchvatů parciálních (PS) i generalizovaných (GS) a je hojně užíván u dětí starších 2 let. Navíc je v současnosti i cenově srovnatelný s klasickými AE. Jistě přispívá ke zlepšení celkové prognózy malých pacientů s epilepsií a přitom má přijatelný profil NÚ.
Následující článek rekapituluje specifika a management využití LTG v pediatrické a adolescentní epileptologii, přináší důkazy o jeho efektu a upozorňuje na nejdůležitější NÚ a nežádoucí lékové interakce a na způsob, jak jim předcházet.
Specifika pediatrické epileptologie
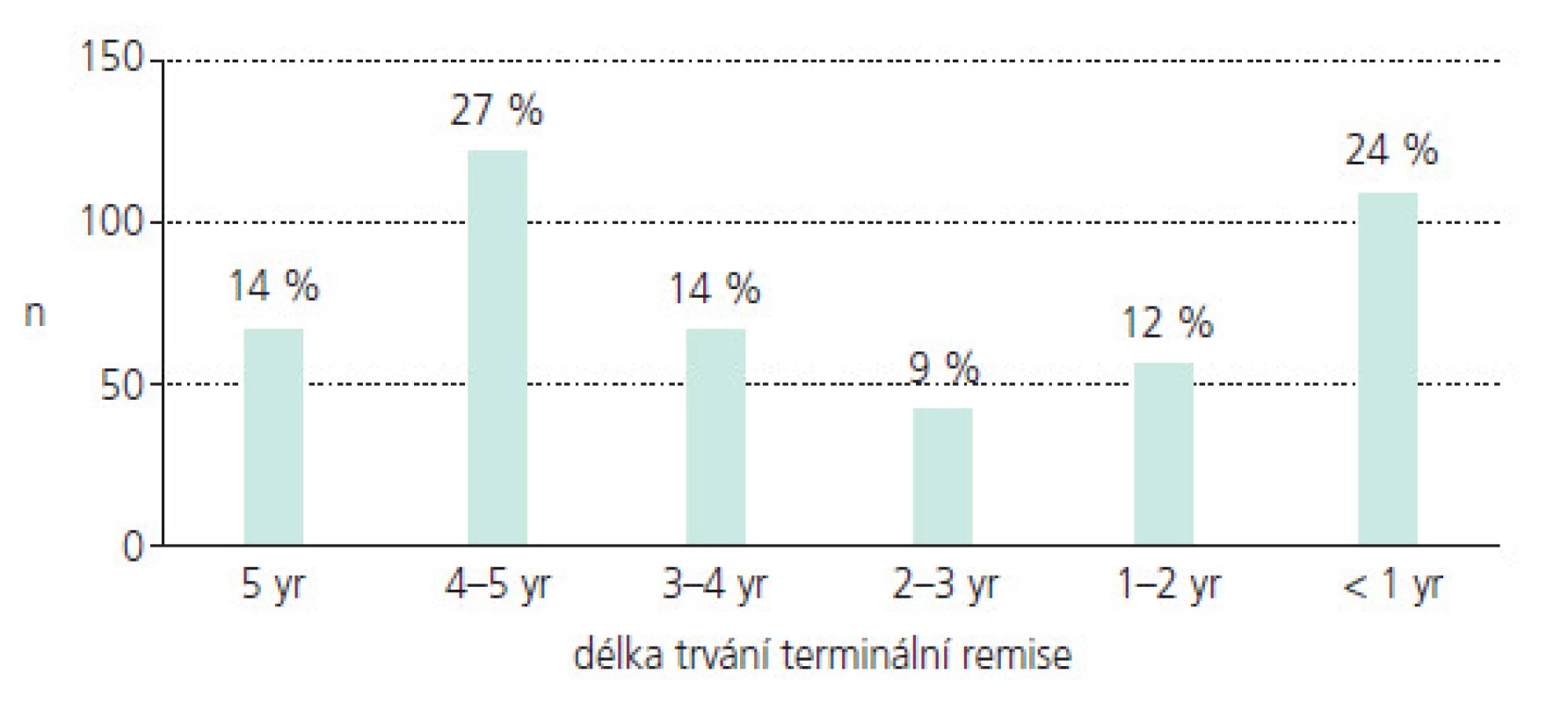
Nízký věk, růst a vývoj jsou faktory odlišující epilepsii v dětství a dospělosti a modifikující její prognózu [4-7]. Nejdůležitějším cílem dětského epileptologa je potlačení záchvatů. Distribuce záchvatových typů je různá v různých věkových kategoriích. Do 5 let věku mírně převažují generalizované záchvaty. U pacientů do 15 let je již zastoupení parciálních a generalizovaných záchvatů zhruba rovnocenné [4]. Z etiologického hlediska jsou u dětí a mladých dospělých nejčastější epilepsie idiopatické [4]. Nepotlačené epileptické záchvaty v dětství mohou mít neblahý vliv na psychomotorický vývoj a intelekt, schopnost vzdělávání a chování, stejně tak jako na šanci získat zaměstnání v dospělosti a na rodinné a sociální vztahy malých pacientů [8]. Bohužel i při adekvátní léčbě zůstává zhruba 20-30 % pacientů nekompenzovaných [9] a i u těch dětí, které dosáhnou plné kompenzace záchvatů, je délka remise různá a často nedostatečná. Ukazují to výsledky prospektivní dánské studie, která sledovala velkou skupinu 453 dětí s nově diagnostikovanou epilepsií po dobu 5 let. I při adekvátní terapii mělo 24 % dětí, tedy 1 dítě ze 4, délku plné kontroly záchvatů kratší než 1 rok a pouze 14 % dětí mělo remisi 5 let (obr. 1) [10]. Některé děti jsou navíc handicapovány i NÚ léčby, které mohou mít rovněž vliv na vyvíjející se centrální nervový systém (CNS) a v některých případech mohou rovněž negativně modifikovat schopnost učení, paměť a chování. Proto stejně důležitým cílem jako plná kompenzace záchvatů je i eliminace či minimalizace NÚ léčby.
V dětské epileptologii mohou být příčiny neúspěchu mnohdy i objektivní. Stejně jako u dospělých pacientů je i u dětí a mladistvých zásadní farmakoterapie. Rozhodně preferujeme monoterapii před polyterapií. U řady epileptických syndromů s věkovou vazbou se ale vyskytuje současně několik záchvatových typů, proto se mnohdy racionální polyterapii nevyhneme. Při terapeutických úvahách je žádoucí před klasifikací epileptických záchvatů upřednostnit syndromologický klasifikační přístup. Správná klasifikace epilepsie v dětství má zásadní dopad na výběr správného léku a zlepší individuální prognózu epilepsie. Dokladovatelné je to u benigní epilepsie s rolandickými (centro – temporálním) hroty (BERS). V případě této epilepsie s normálně příznivým průběhem může nasazení karbamazepinu (CBZ) neblaze modifikovat její průběh a prognózu a měnit ji do obrazu atypické benigní rolandické epilepsie nebo indukovat negativní myoklonické záchvaty. Je to i přesto, že se na úrovni klasifikace záchvatů jedná o PS s případnou sekundární generalizací (sGS) a terapie CBZ se jeví jako indikovaná [11,12,13]. Vlivem postnatálně pokračujícího vývoje CNS se mnohdy s věkem i individuálně vyvíjí a mění typy epileptických záchvatů i syndromů, a tím některá původně účinná AE pozbývají účinnost. Dobrým příkladem je geneze Ohtaharova syndromu do syndromu Westova (WS) a později do Lennoxova-Gastautova syndromu (LGS). Jmenované epilepsie navíc patří mezi katastrofické dětské epileptické encefalopatie, které jsou typické velmi nepříznivým průběhem, a terapeutické úspěchy i při správném postupu jsou výjimkou.
Epilepsie v dětství a mládí je jednoznačně závažným zdravotním i sociálním problémem. U řady dětských i mladých pacientů je to počátek celoživotního onemocnění. Naštěstí nejzávažnější důsledky záchvatů, jakým je úmrtí, včetně syndromu náhlé smrti (SUDEP, sudden unexpected death in epilepsy) se v dětství a mládí vyskytují s menší incidencí než v dospělosti [14]. V oblasti osvěty bylo už uděláno mnoho, ale přesto někteří mladí pacienti s epilepsií stále pociťují určitou sociální stigmatizaci a předsudky.
Indikační spektrum lamotriginu v dětství a adolescenci
LTG je považován za širokospektré AE a před uvedením do klinické praxe u dětí a mladistvých byla jeho účinnost a bezpečnost prokázána řadou dvojitě – slepých randomizovaných klinických studií. V současnosti je příznivá i jeho cena, která díky nástupu generických preparátů od poloviny roku 2005, významně klesla. Od roku 2002 je LTG u dětských pacientů od 2 let indikován ke kombinované léčbě epilepsií s parciálními a generalizovanými záchvaty, včetně záchvatů tonicko-klonických (GTCS) a záchvatů v rámci LGS. Poté, co se při kombinované terapii podaří epilepsii zvládnout, lze ukončit souběžnou aplikaci ostatních AE a pokračovat monoterapií LTG, což se týká především pacientů nad 12 let věku a starších dívek, kdy je vhodné vzhledem k možnému otěhotnění ukončení původní léčby vaplroátem (VPA) či karbamazepinem (CBZ). Od roku 2005 je LTG indikován i jako monoterapie u typických absencí (TA). U dětí a adolescentních pacientů nad 12 let je indikační spektrum stejné jako v dospělosti, tedy kombinovaná farmakoterapie nebo monoterapie epilepsie s PS a GS, včetně GTCS a záchvatů spjatých s LGS a monoterapie TA. Od roku 2002 je u pacientů starších 18 let indikován k prevenci poruch nálady (epizod deprese, manie, hypomanie a smíšených epizod). Hlavním mechanizmem antiepileptického účinku je blokáda na napětí závislých Na-kanálů, jejímž výsledkem je stabilizace neuronální membrány s inhibicí uvolnění excitačních aminokyselin, zvláště glutamátu a aspartátu, které jsou asociovány se záchvatovou aktivitou [15,16]. Tento hlavní mechanizmus účinku nevysvětluje účinnost LTG u primárně generalizovaných záchvatů typu absencí a myoklonií.
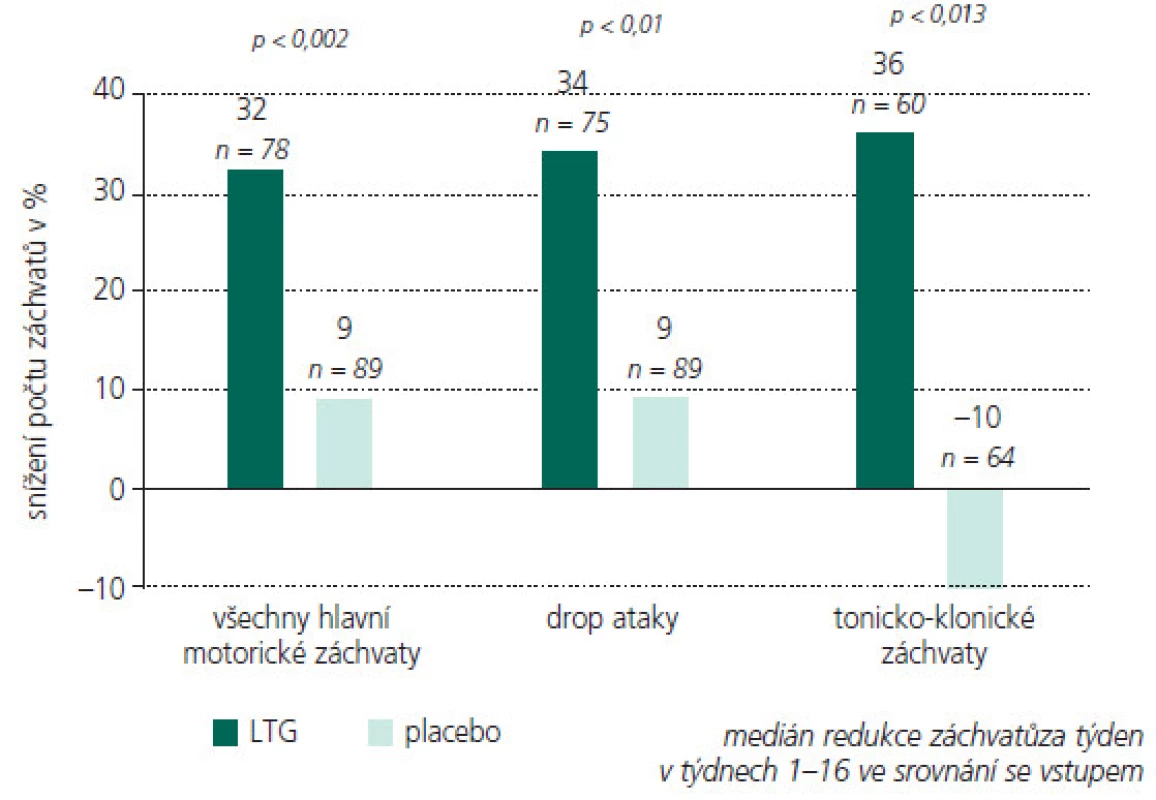
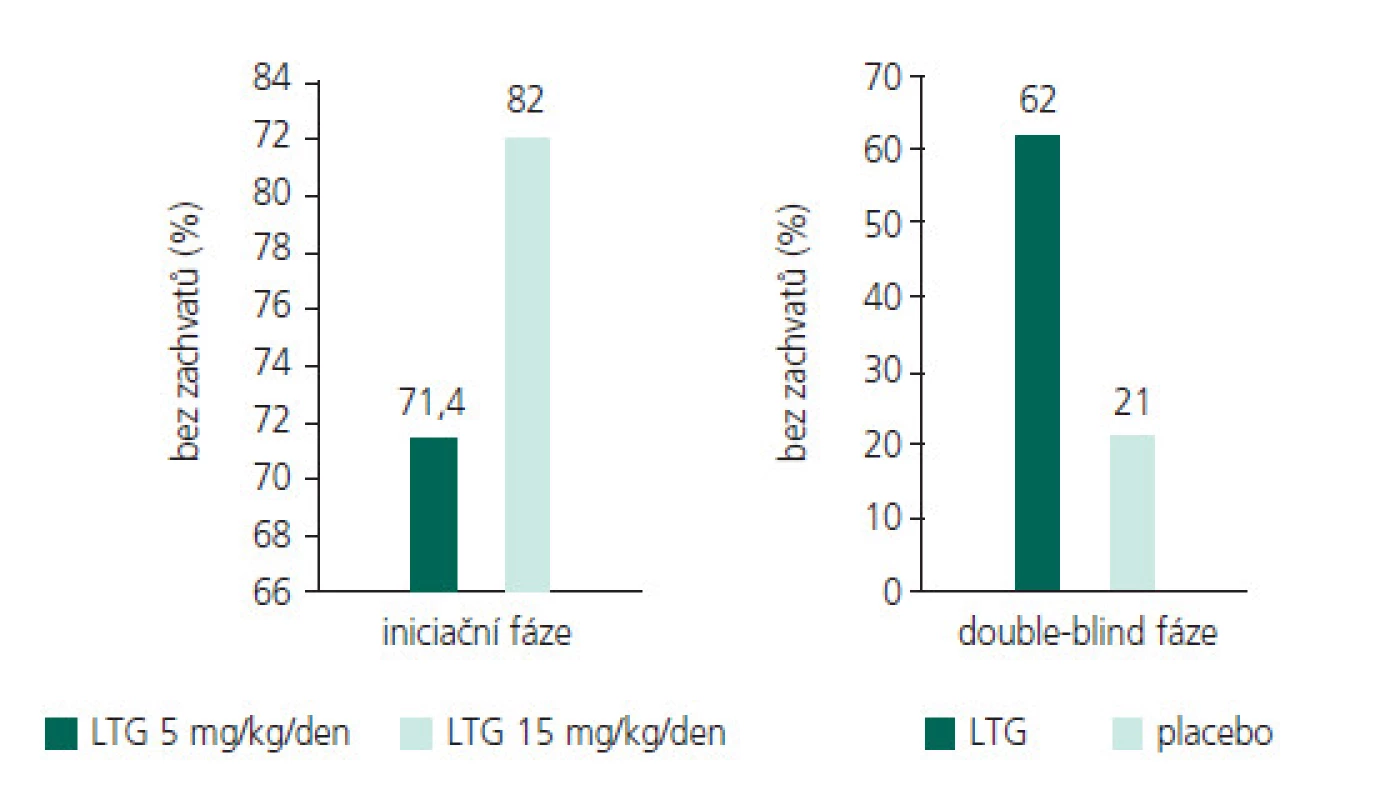
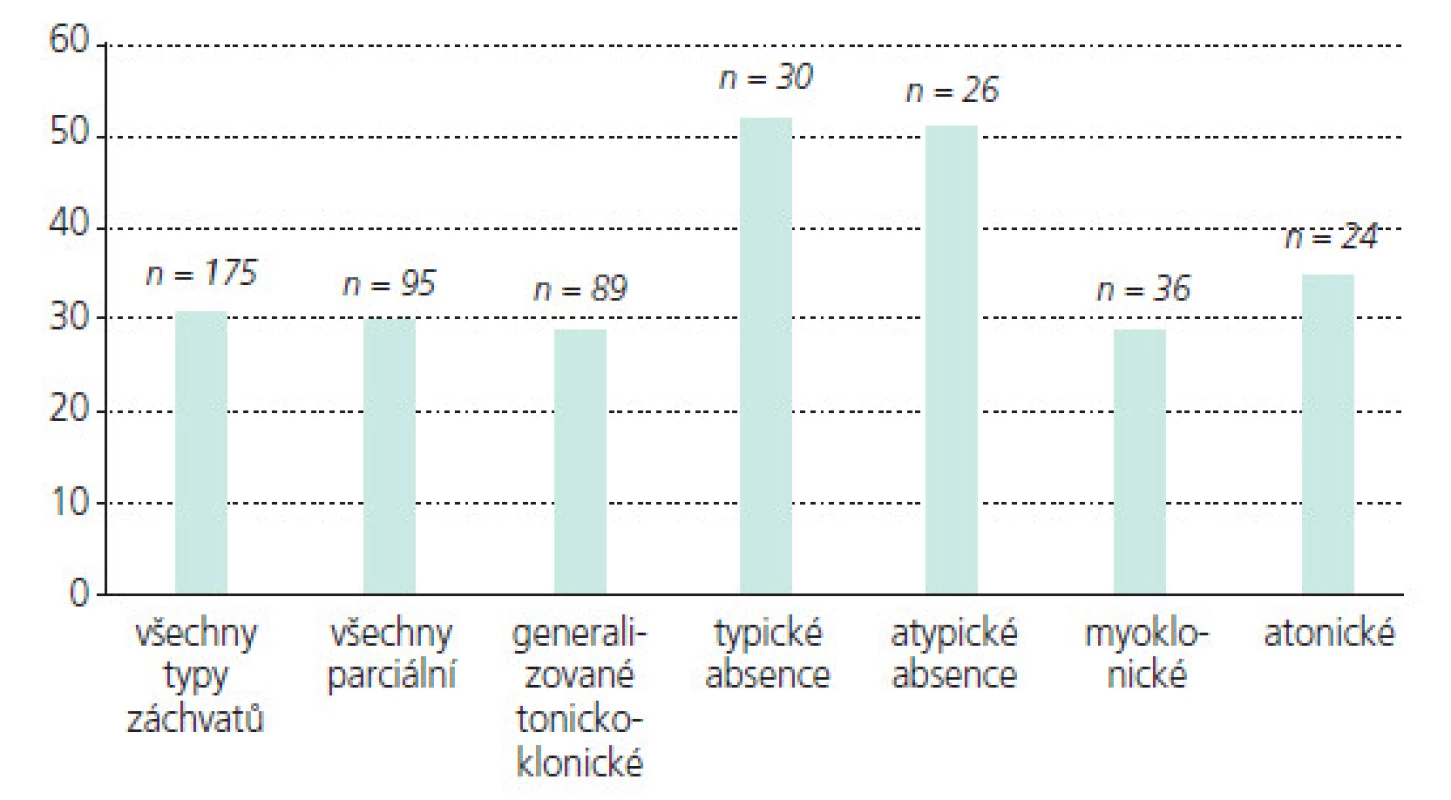
Účinnost lamotriginu na různé typy záchvatů a epilepsií
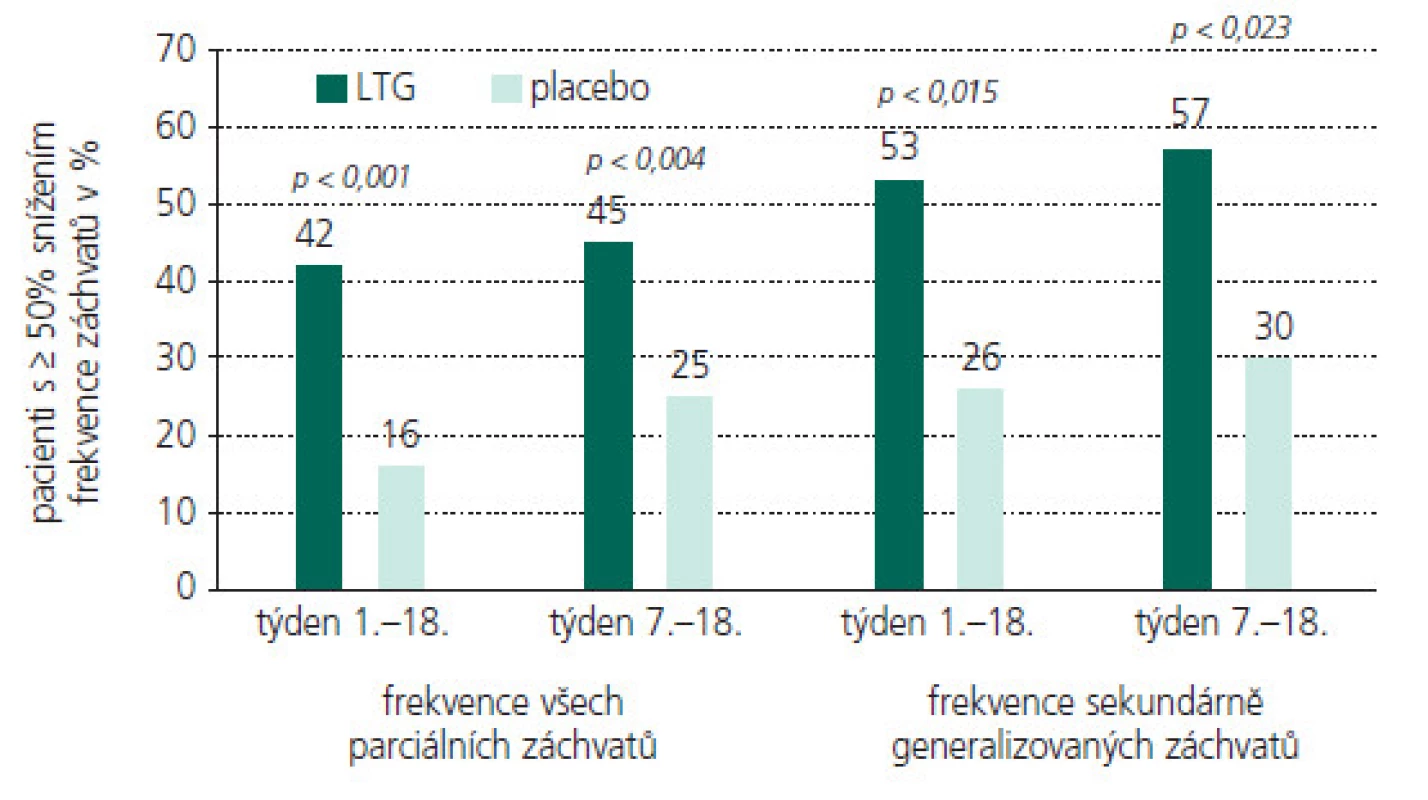
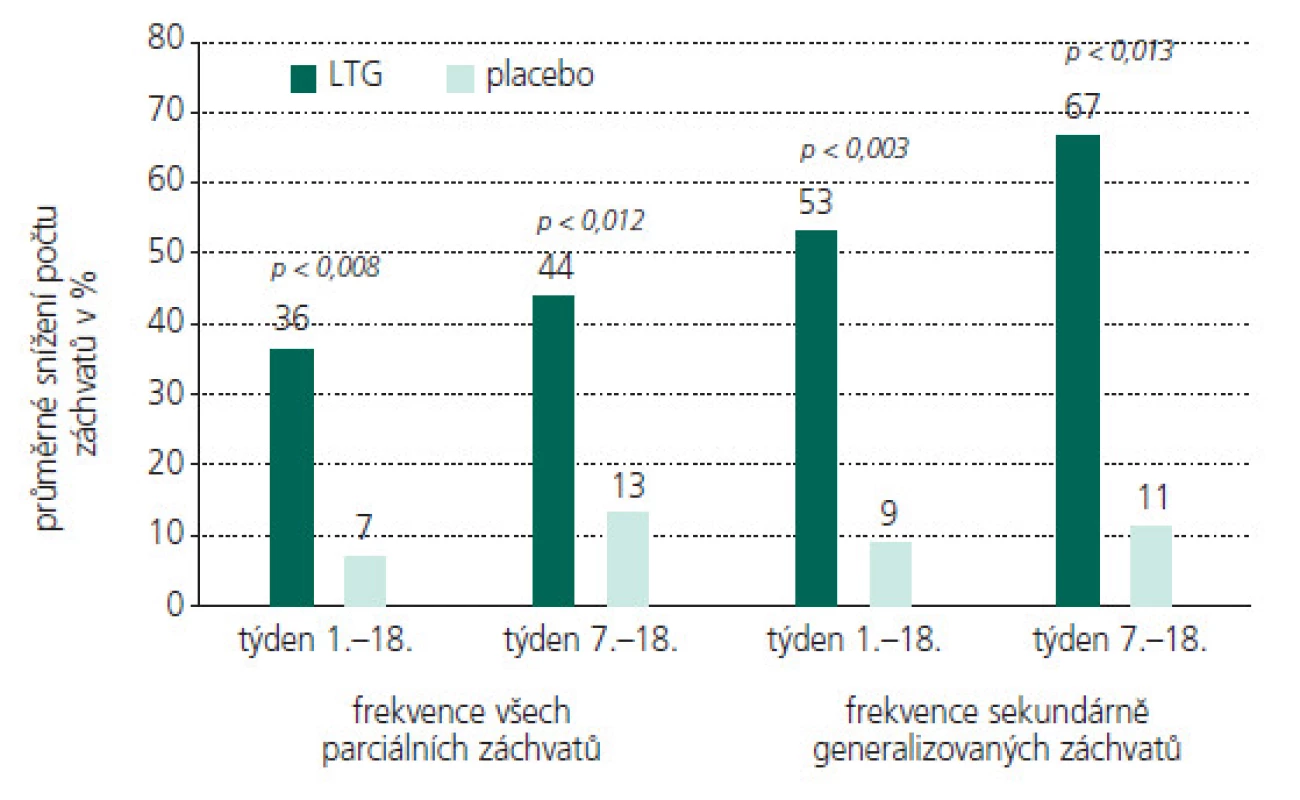
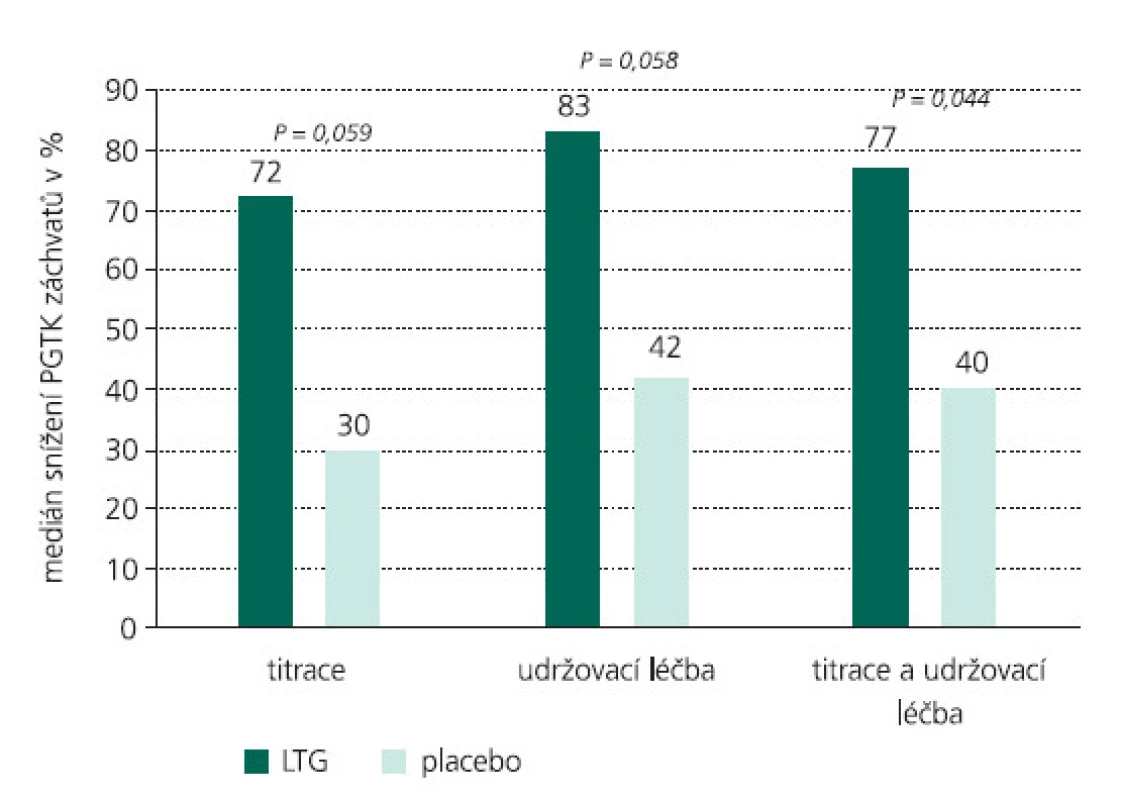
V tab. 1. a-e souhrnně a přehledně rekapituluji zásadní studie prokazující širokospektrou účinnost LTG u dětí a mladistvých u záchvatů parciálních, sekunárně generalizovaných, primárně genaralizovaných tonicko-klonických záchvatů, záchvatů v rámci Lennoxova–Gastautova syndromu, juvenilní myoklonické epilepsie (JME), Westova syndromu (WS, infantilní spazmy IS) a Rettova syndromu (RS). Uvádím studie s přídatnou terapií i monoterapií, všímám si případného velmi vítaného dalšího pozitivního efektu LTG na chování a náladu léčených pacientů. U kontrolovaných studií posuzujících efekt přídatné terapie LTG na chování se ukázalo signifikantní zlepšení chování, řeči, nonverbální komunikace a hrubé motoriky u dětí a adolescentů s LGS a u pacientů s dobře kompenzovanou epilepsií a poklesem EEG epileptických výbojů. Některé otevřené studie rovněž popisují pozitivní efekt LTG na chování a náladu u dětí s epilepsií, ale některé přinášejí i negativní reference.





Nejdůležitější nežádoucí účinky lamotriginu v dětství a adolescenci
Asi nejobávanějším NÚ při použití LTG v dětství je závažný kožní exantém (rash). Je obvykle makulopapulózní a šíří se z obličeje na trup i končetiny. Mohou se vyskytnout i iniciální systémové projevy: malátnost, nevolnost, teplota, bolesti kloubů a svalů, lymfadenopatie a eozinofilie. Četnost závažného exantému, který vyžaduje hospitalizaci a přerušení terapie LTG, je u pediatrických pacientů vyšší než u dospělých. Kromě závislosti na věku je prokázáno, že riziko exantému stoupá při kombinaci LTG s VPA, překročením iniciální doporučené dávky a rychlosti titrace LTG. Samozřejmě ještě vyšší riziko přináší kombinace těchto chyb. Data z mnoha studií shrnují, že incidence exantému asociovaného s hospitalizací u dětí pod 12 let je od 1:300 do 1:100, zatímco v dospělosti je obvykle udávána incidence 1 na 1000 [43]. Vzácně (u jednoho promile pacientů) byly popsány i velmi závažné a dokonce život ohrožující kožní reakce, které zahrnují erythema bulosum multiforme, Stevensův-Johnsonův syndrom a toxickou epidermální nekrolýzu. Většina závažných kožních reakcí se objeví mezi 2.-4. týdnem od začátku léčby LTG, pozdější výskyt je spíše ojedinělý. V naprosté většině reakce odezní po ukončení terapie, vzácně však mohou zůstat jizvy a zcela ojediněle byla dokonce popsána i úmrtí. Opatrnosti je třeba zvláště u dětí s výrazně pozitivní anamnézou pro alergické reakce. Při dodržování pravidel administrace LTG se riziko exantému významně minimalizovalo [44,45]. Idiosynkratické reakce typu exantému jsou individuální a obtížně předvídatelné. Mohou být nezávislé na dávce léků a vzniknout při prvním i opakovaném podání LTG, a proto je vždy při jeho nasazení nutné pacienta a především jeho rodiče na iniciální příznaky hypersenzitivity upozornit s tím, že to může být i horečka či lymfadenopatie. Pokud se symptomy hypersenzitivity objeví, musí pacient vyhledat lékaře, a pokud nebude zjevná jiná etiologie, je nutností léčbu LTG ukončit. Oproti studiím s placebem je LTG asociován jen s mírným zvýšením rizika CNS vázaných NÚ, jako je závrať, tremor, ataxie a diplopie, s gastrointestinálními NÚ (nauzea) a s NÚ spjatými s vylučovacím systémem (infekce). Incidence je nižší při monoterapii než při kombinované terapii. Výsledky placebem kontrolovaných studí s přídatnou terapií ukazují, že 85 % pacientů léčených LTG hlásí NÚ a ve skupině s placebem je to 83 % [43,46]. Časné nežádoucí účinky, které pozorujeme již v průběhu titrace, můžeme obvykle očekávat a jsou částečně závislé na dávce. Opatření, které problém řeší, je zpomalení titrace a snížení dávky. Chronické nežádoucí účinky u terapie LTG prakticky nevídáme a zpožděné NÚ zejména teratogenita má při monoterapii LTG lepší profil než u AE 2. generace. VPA a CBZ jsou v tomto smyslu hodnoceny jako jednoznačně rizikové, což potvrzují výsledky z různých těhotenských registrů. Zmíněné riziko výrazně narůstá při kombinované terapii s CBZ, ale především s VPA. 13 studií u 1096 dětí s různými typy záchvatů prokázalo, že většina nežádoucích účinků asociovaných s terapií LTG je mírné až střední intenzity a nejsou důvodem k ukončení léčby LTG.
Management lamotriginu v dětství a adolescenci
Metabolizmus AE je závislý na věkové kategorii a je fyziologicky různý nejen v dětství a adolescenci, ale i dokonce v různých dětských věkových kategoriích. Už tak málo přehlednou fyziologickou situaci absorpce, distribuce, vazby na plazmatické proteiny, clearence a poločasu AE u dětí a mladistvých ještě dále komplikují patologické stavy a zevní vlivy. Všeobecně lze říci, že novorozenci metabolizují AE pomalu a je snadnější je intoxikovat. Po několika týdnech života se intenzita metabolizmu většiny AE zvyšuje a optimální sérové hladiny lze docílit jen podáváním vyšších dávek. Později se potřeba vyšších dávek postupně snižuje, protože se metabolizmus léků stává pomalejším. Tyto změny nemusejí být výhodné. Například u adolescentů, kteří pokračují v medikaci z dětství, se může objevit nechtěné předávkování [47].
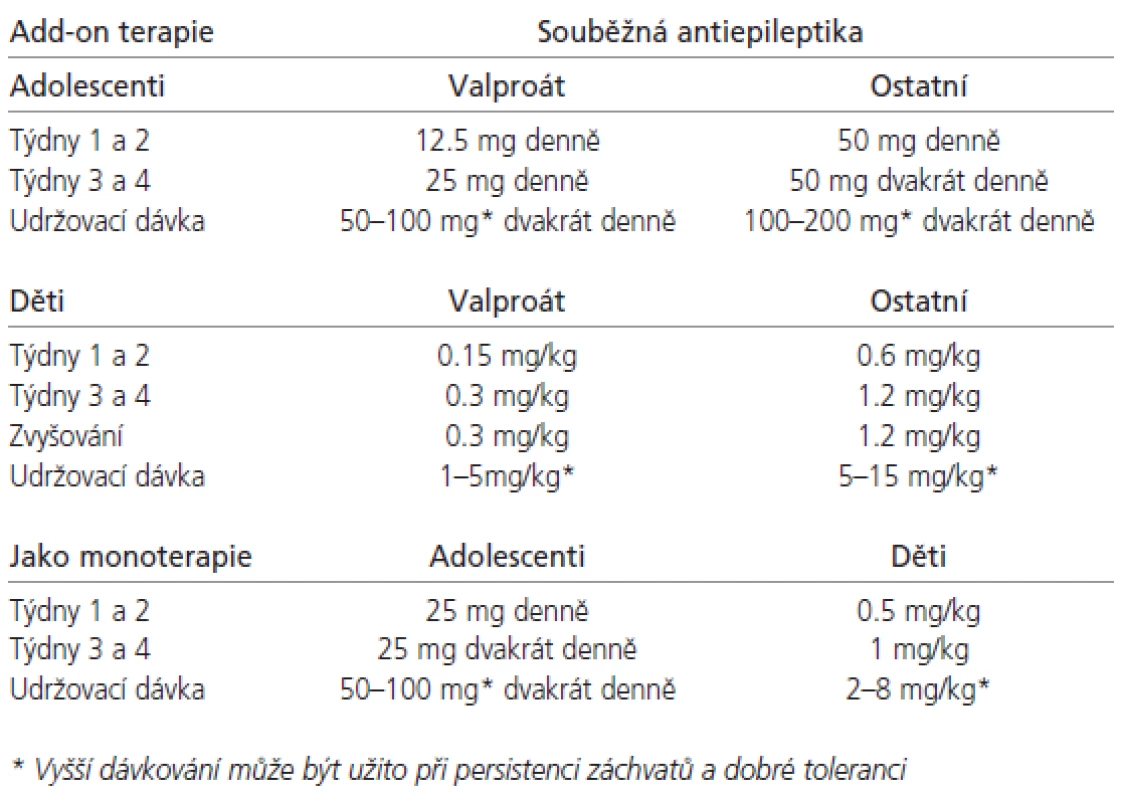
U mladších dětí není zatím užívání LTG doporučeno, i když existují reference [48] a v dohledné době se tak má stát. U pacientů ve věku 2-12 let užívajících VPA, ať už samostatně či v kombinaci, je doporučeno iniciální dávkování 0,15 mg/kg/d v jedné dávce po 2 týdny, a pak velmi pomalá titrace dle doporučení na udržovací dávku 1-5mg/kg/d 1-2x denně, maximálně 200 mg/d. U dětí stejné věkové kategorie s medikací AE indukujícími jaterní enzymy je iniciální dávka 0,6 mg/kg/d ve dvou denních dávkách s velmi pomalou titrací dle doporučení na udržovací dávku 5-15 mg/kg/d ve dvou denních dávkách. U dětí starších 12 let je dávkování stejné jako u dospělých pacientů. Při současném podávání VPA je iniciální dávka 12,5 mg první 2 týdny a pak pomalá postupná titrace dle doporučených schémat až do udržovací dávky 100-200 mg jednou denně nebo ve dvou dílčích dávkách. Pokud užívají induktory jaterních enzymů, iniciální dávka je 25-50 mg a udržovací 200-400 mg/d. Výše konečné dávky se u dětí i mladistvých řídí i individuální snášenlivostí a v indikovaných případech může přesáhnout i doporučené hranice. V pediatrické epileptologii velmi vítáme tzv. „baby friendly“ lékové formy, což jsou v případě preparátu Lamictal žvýkací 2, 5 a 25 miligramové tablety. Praktická jsou i balení pro add-on nasazení. V žádném případě nedoporučuji titrovací schéma překračovat, protože to významně zvyšuje bezpečnost a tolerabilitu LTG, ale je pravdou, že pomalá titrace je určitou nevýhodou LTG, zvláště u pacientů, kde jsou záchvaty velmi aktivní. V těchto případech je nutností kvalitní informovanost rodičů či opatrovníků s vysvětlením důvodů opatrnosti.
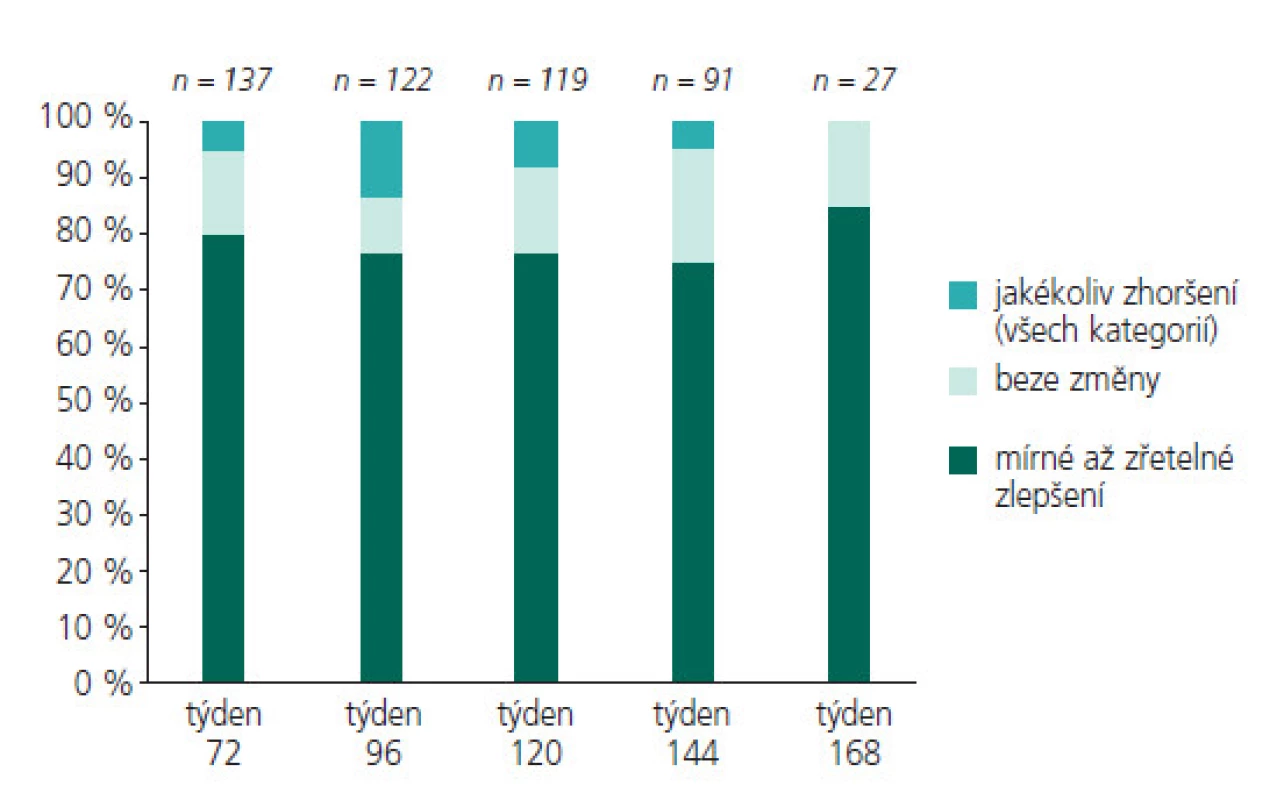
LTG podléhá četným lékovým interakcím. V praxi asi nejvýznamnější je si uvědomit, že silně interferuje s VPA (inhibitor jaterních enzymů) s výsledkem elevace sérové hladiny LTG, a proto dávka LTG, pokud je s VPA kombinován, musí být redukována zhruba na polovinu zvláště u dětí pod 30 kg váhy. Pokud se vysazují původní AE s cílem monoterapie LTG, nebo pokud se naopak do kombinace AE zahrnující LTG přisazují jiná AE, je nutné brát v úvahu možnost ovlivnění farmakokinetiky LTG oběma směry. O možných interakcích s ostatními AE informuje práce Maye et al [49]. Převedení z kombinace VPA+LTG na monoterapii LTG možné je, ale patří mezi nejsložitější: je třeba počítat s faktem, že po úplném vysazení VPA je nutno k udržení stejné plazmatické hladiny LTG jeho dávku zvýšit až na dvojnásobek. Převedení na monoterapii LTG z kombinace s AE indukujícím jaterní enzymy (CBZ, fenytoin, fenobarbital-PB a primidon) je také možné, ale v konečné fázi je dobré dávku LTG snížit (dle tolerance a efektu). Vhodná není současná konverze 2 či více AE. Při nevysvětlitelných negativních výkyvech dosud kompenzovaných záchvatů a výskytu nežádoucích účinků je u dětských a mladých pacientů velkou pomocí možnost vyšetření sérových hladin LTG s doporučeným rozmezím 1,5-10 (-20) µg/ml. Pomáhá rozpoznávat věkově podmíněnou aktivitu metabolizmu LTG a správně postupovat při změnách léčby, zvláště těch spojených s vysazováním či přisazováním jiných AE. Taktéž odhalí nespolupráci pacienta, se kterou se setkáváme hlavně v adolescenci, kdy rodiče užívání tablet už často s důvěrou ponechávají na svých dětech, ale ty je někdy neberou vůbec nebo je berou nepravidelně. U dětí a adolescentů obecně vídáme menší podíl komorbidit a tím i komedikací než v dospělosti. Opatrní musíme být při nasazení hormonální antikoncepce, kdy je možné snížení hladiny LTG, a to by mohlo vést k výskytu záchvatu. S opačným problémem se můžeme setkat při vysazení HAK.
Možnost zhoršování epilepsií lamotriginem
LTG patří k širokospektrým AE, a proto je jeho potenciál k selektivnímu (specifickému) horšení záchvatů či syndromů velmi nízký. Horšením rozumíme zvýšení počtu či intenzity stávajících záchvatů, nebo objevení se zcela nového typu záchvatů. Selektivita zhoršování může být specifická dle typu záchvatu, ale často jen dle typu syndromu. Dané AE tedy nutně nehorší určitý typ záchvatu u všech typů syndromů. Jedná se o celkem dobře předvídatelný efekt, a proto je lépe LTG v těchto několika málo případech nenasazovat vůbec. Zhoršení myoklonických záchvatů popisují nečetné práce u těžké myoklonické epilepsie Dravetové (SMEI)[50].U tohoto syndromu musíme mít však na mysli jeho celkově katastrofický průběh. Zcela ojedinělé reference existují i o zhoršování myoklonií u JME [51,52].Z idiopatických fokálních epilepsiíje vhodnáopatrnost ubenigní rolandické epilepsie s centro–temporálními/rolandickými hroty (BECTS, BERS). Jedná se o syndrom dětského věku výrazně náchylný k selektivní agravaci hlavně CBZ a PB.V literatuře existuje i ojedinělá reference o obdobně nepříznivém efektu LTG [53,54].
Závěr
V péči dětského epileptologa jsou děti a mladiství od novorozeneckého věku až do adolescence, což představuje vysokou náročnost na správné terapeutické přístupy, které jsou v některých případech odlišné od dospělosti. LTG je širokospektrým a cenově poměrně příznivým AE, který je v pediatrické epileptologii hojně užíván. Určitou nevýhodou je nutnost pomalého zvyšování dávky a dodržení a znalost doporučených dávkovacích, titračních postupů a interakcí zvyšuje jeho tolerabilitu a bezpečnost. Je účinný na řadu parciálních i generalizovaných záchvatů a v některých případech zlepšuje i kognitivně behaviorální profil malého nebo mladého pacienta.
Přijato k recenzi: 20. 4. 2007
Přijato do tisku: 4. 9. 2007
prim. MUDr. Hana Ošlejšková
Klinika dětské neurologie LF MU a FN Brno
Dětská nemocnice
Černopolní 9,
625 00 Brno
e-mail: hoslej@fnbrno.cz
Zdroje
1. Cowan LD, Bodensteiner JB, Leviton A, Doherty L. Prevalence of the epilepsies in children and adolescents. Epilepsia 1989; 30: 94-106.
2. Eriksson KJ, Koivikko MJ. Prevalence, Classification, and Severity of Epilepsy and Epileptic Syndromes in Children. Epilepsia 1997; 38(12): 1275-82.
3. Waaler PE, Blom BH, Skeidsvoll H, Mykletun A. Prevalence, Classification, and Severity of Epilepsy in Children in Western Norway. Epilepsia 2000; 41(7): 802-810.
4. Hauser WA. Seizure disorders: the changes with age [review]. Epilepsia 1992; 33(Suppl 4): S6-14.
5. Sillanpää M. Children with epilepsy as adults: outcome after 30 years of follow-up. Acta Pediatr Scand 1990; Suppl 368: 1-78.
6. Sillanpää M. Long-term autcome of epilepsy. Epileptic Disord 2000; 2: 79-88.
7. Chevrie JJ, Aicardi J. Convulsive disorders in the first year of life: neurologic and mental autcome and mortality. Epilepsia 1978; 19: 67-74.
8. Shinnar S, Pellock JM. Update on the epidemiology and prognosis of pediatric epilepsy. J Child Neurol 2002 Jan; 17(Suppl 1): S4-17.
9. Pugh CB, Garnett WR. Current issues in the treatment of epilepsy. Clinical Pharmacy 1991; 10: 335-58.
10. Arts WF, Brouwer OF, Peters AC, Stroink H, Peeters EA, Schmitz PI et al. Course and prognosis of childhood epilepsy: 5-year follow-up of the Dutch study of epilepsy in childhood. Brain 2004; 127: 1774-1784.
11. Guerrini R, Belmonte A, Strumia S, Hirsch E. Exacerbation of epileptic negative myoclonus by carbamazepine or phenobarbital in children with atypical benign rolandic epilepsy. Epilepsia 1995; 36(Suppl 3): S65.
12. Parmeggiani L, Seri S, Bonanni P, Guerrini R. Electrophysiological characterization of spontaneus and carbamazepine-induced epileptic negative myoclonus in benign childhood epilepsy with centro-temporal spikes. Clin Neuropharmacol 2004 Jan; 115(1): 50-58.
13. Elger C, Bauer J, Scherrmann J, Widman G. Aggravation of focal epilepsies by antiepileptic drugs. Epilepsia 1998; Suppl 3: S15-S18.
14. O´Donaghue MF, Sander JW. The mortality associated with epilepsy with particular reference to sudden unexpected death: a review. Epilepsia 1997; 38: 31-46.
15. Leach MJ, Randall AD, Stefani A et al. Lamotrigin: mechanism of action. In: Levy RH, Mattson RH, Meldrum BS et al (Eds). Antiepileptic drugs. 5th ed. Philadelphia: Lippincott Williams & Wilkins 2002: 363-369.
16. Leach MJ et al. Lamotrigine: mechanisms of action. In: Levy RH et al (Eds). Antiepileptic drugs. 4th ed. New York: Raven Press 1995: 861-869.
17. Duchowny M, Pellock JM, Graf WD et al. A placebo-controlled trial of lamotrigine add-on therapy for partial seizures in children. Neurology 1999; 53: 1724-1731.
18. Duchowny M, Kustra RP, Warnock B et al. Onset of action of lamotrigine in children with partial seizures. Poster presented at the Annual Meeting of the Child Neurology Society, Ottawa, Canada, October 13-16, 2004.
19. Parmeggiani L, Belmonte A, Ferrari AR et al. Add-on lamotrigine treatment in children and young adults with sever partial epilepsy: an open, prospective, long-term study. J Child Neurol 2000; 15: 671-674.
20. Bitton V, Sackellares JC, Vuong A et al. Double-blind, placebo-controlled study of lamotrigine in primary generalized tonic-clonic seizures. Neurology 2005; 65: 1737-1743.
21. Trevathan E, Kerls SP, Hammer AE et al. Double-blind, placebo-controlled evaluation of lamotrigine adjunctive therapy in children and adolescents with primary generalized tonic-clonic seizures. Poster presented at the 57th Annual Meeting of the American Academy of Neurology, Miami Brach, FL, April 9-16, 2005.
22. Trevathan E, Kerls SP, Hammer AE, Vuong A, Messenheimer JA. Lamotrigine Adjunctive Therapy Among Children and Adolescents With Primary Generalized Tonic-Clonic Seizures. Pediatrics 2006; 118; 371-378.
23. Frank LM, Enlow T, Holmes GL et al. Lamictal (lamotrigin) monotherapy for typical absence seizures in children. Epilepsia 1999; 40: 973-979.
24. Morris GL, Hammer AE, Kustra RP et al. Lamotrigine for patients with juvenile myoclonic epilepsy following prior treatment with valproate: results of an open-label study. Epilepsy Behav 2004; 5(4): 509-512.
25. Timmings PL, Richens A. Efficacy of lamotrigine as monotherapy for juvenile myoclonic epilepsy: pilot study results. Epilepsia 1993; 34(Suppl 2): S160.
26. Sharpe C, Buchanan N. Juvenile myoclonic epilepsy: diagnosis, management and outcome. Med J Aust 1995; 162: 133-134.
27. Veggiotti P, Cieuta C, Rex E, Dulac O. Lamotrigine in infantile spasms. Lancet 1994; 344: 1375-1376.
28. Uldall P, Hansen FJ, Tonnby B. Lamotrigine in Rett syndrome. Neuropediatrics 1993; 24: 339-340.
29. Schimschock JR, Hammer AE, Kustra RP et al. Effects of lamotrigine monotherapy in patients with newly diagnosed juvenile myoclonic epilepsy: An open-label study. Curr Ther Res 2005; 66(3):230-237.
30. Eriksson AS, Nergårdh A, Hoppu K. The efficacy of lamotrigine in children and adolescents with refractory generalized epilepsy: a randomized, double-blind, crossover study. Epilepsia 1998; 39: 495-501.
31. Motte J, Trevathan E, Arvidsson JFV et al. Lamotrigine for generalized seizures associated with the Lennox-Gastaut syndrome. N Engl J Med 1997; 337:1807-1812.
32. Donaldson JA, Glauser TA, Olberding LS. Lamotrigine adjunctive therapy in childhood epileptic encephalopathy (The Lennox Gastaut Syndrome). Epilepsia 1997; 38: 68-73.
33. Dulac O, Kaminska A. Use of Lamotrigine in Lennox-Gastaut and Related Epilepsy Syndromes. J Child Neurol 1997; 12(Suppl 1): S23-28.
34. Besag FMS, Wallace SJ, Dulac O et al. Lamotrigine for the treatment of epilepsy in childhood. J Pediatr 1995; 127: 991-997.
35. Besag FM, Dulac O, Alving J, Mullens EL. Long-term safety and efficacy of lamotrigine (Lamictal) in paediatric patients with epilepsy. Seizure 1997; 3: 51-56.
36. Schlumberger E, Chavez F, Palacios L, Rey E, Pajot N, Dulac O. Lamotrigine in treatment of 120 children with epilepsy. Epilepsia 1994; 35: 359-367.
37. Uvebrant P, Bauziene R. Intractable epilepsy in children. The efficacy of lamotrigine treatment, including non-seizure-related benefits. Neuropediatrics 1994; 25: 284-289.
38. Steinhoff BJ, Ueberall MA, Siemes H et al. The LAM-SAFE Study: Lamotrigine versus carbamazepine or valproic acid in newly diagnosed focal and generalized epilepsies in adolescents and adults. Seizure 2005; 14: 597-605.
39. Pressler R, Robinson RO, Wilson GA, Binnie CD. Treatment of interictal epileptiform discharges can improve behavior in children with behavioral problems and epilepsy. J Pediatr 2005; 146: 112-117.
40. Franz DN, Tudor C, Leonard J et al. Lamotrigine therapy of epilepsy in tuberous sclerosis. Epilepsia 2001; 42(7): 935-940.
41. Coppola G, Pascotto A. Lamotrigine as add-on drug in children and adolescents with refractory epilepsy and mental delay: an open trial. Brain Dev 1997; 19: 398-402.
42. Buchanan N. The efficacy of lamotrigine on seizure control in 34 children, adolescents and young adults with intellectual and physical disability. Seizure 1995; 4: 233-236.
43. Messenheimer JA, Giorgi L, Risner M et al. The Tolerability of lamotrigine in children. Drug Saf 2000; 22: 303-312.
44. Messenheimer JA. Rash in adult and pediatric patients treted with lamotrigin. Can J Neurol Sci 1998; 25: S14-S18.
45. Dooley J, Camfield P, Gordon K et al. Lamotrigin – induced rash in children. Neurology 1996; 38: 68-73.
46. Levy RH, Mattson RH, Meldrum BS, Perucca E. Antiepileptic drugs. 5th ed. Philadelphia: Lippincott Williams & Wilkins; 2002.
47. Morselli PL, Pippenger CE, Penrg JK. Antiepileptic drug therapy in pediatrics. New York: Raven Press Leach 1983.
48. Pina-Garza JE, Womble G, Blum D et al. Safety and efficacy of lamotrigine in infants age 1-24 months with partial seizures – interim open-label results. Poster presentation at the annual meeting of the American Epilepsy Society, Seattle, WA. December 6-12, 2002.
49. May TW, Rambeck B, Jurgens U. Serum concentrations of lamotrigine in epileptic patients: the influence of dose and comedication. Ther Drug Monit 1996; 18(5): 523-531.
50. Guerrini R, Dravet C, Genton P, Belmonte A, Kaminska A, Dulac O. Lamotrigine and seizure aggravation in severe myoclonic epilepsy. Epilepsia 1998; 39(5): 508-512.
51. Crespel A, Genton P, Berramdane M, Coubes P, Monicard C, Baldy-Moulinier M, Gelisse P. Lamotrigine associated with exacerbation or de novo myoclonus in idiopatic generalized epilepsies. Neurology 2005 65(5): 762-764.
52. Biraben A, Allain H, Scarabin JM, Schück, Edan G. Exacerbation of juvenile myoclonic epilepsy with lamotrigin. Neurology 2000; 55(11): 1758.
53. Cerminara C, Montanaro ML, Curatolo P, Seri S. Lamotrigine-induced seizure aggravation and negative myoclonus in idiopathic rolandic epilepsy. Neurology 2004; 63(2): 373-375.
54. Ošlejšková H. Zhoršování epileptických záchvatů a epilepsií antiepileptiky – je to možné? Česk Slov Neurol N 2007; 70/103(2): 137–142.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2007 Číslo 5
Nejčtenější v tomto čísle
- Léčba epileptických syndromů u dětí
- Hodnocení edému terče zrakového nervu
- Jsou některé kontraindikace lumbální punkce dnes již obsoletní? Kazuistika
- Transforaminální lumbo-sakrální mezitělová fúze (TLIF) s instrumentací: prospektivní studie s minimálně 20měsíčním sledováním
