Perorální kladribin v léčbě roztroušené sklerózy – data z celostátního registru ReMuS®
Oral cladribine in the treatment of multiple sclerosis – data from the national registry ReMuS® registry
Aim: Our objective was to share our first clinical experience with oral cladribine gathered through the analysis of data of the national ReMuS® registry. Patients and methods: Our sample includes data of all patients who initiated oral cladribine treatment since September 1, 2018 till December 31, 2020. We also analyzed, in more detail, the subgroup of 222 patients who were assumed to complete the full cumulative dose. Our analyses included relapses, disability, employment status and financial social support, and also MRI activity in the subgroup. Data were obtained from all 15 centers for treatment of MS and analyzed in terms of descriptive statistics. Results: A total sample comprised of 436 patients, 75.5% of them females, mean age 37.0 years, and mean weight 71.9 kg. Mean duration since the disease onset was 8.4 years with a mean baseline EDSS (Expanded Disability Status Scale) score of 2.8. Mean annualized relapse rate was 1.07 prior to treatment initiation. After treatment initiation, the confirmed disability progression was not reached in 90% of patients until 20.8 (90th quantile) months after follow up. Approximately three quarters of patients stayed relapse-free in year one and two. In the defined subgroup, 85% of patients had no significant MRI activity. A switch to another disease-modifying drug was performed in 12 patients. Conclusion: In accordance with the pivotal trials, our data demonstrate a high proportion of patients without relapses, disability progression and MRI activity, and a very low proportion of patients with a treatment change.
Keywords:
Multiple sclerosis – oral cladribine – therapeutic response – patient registry
Autoři:
D. Horáková 1
; M. Vachová 1,2; A. Tvaroh 2,3; J. Drahota 1,4; A. Mazouchová 4,5; J. Mareš 6; I. Woznicová 7; D. Zimová 8; J. Libertínová 9; A. Martinková 10; E. Recmanová 11; M. Grunermelová 12; M. Vališ 13; J. Adámková 14; R. Ampapa 15; Y. Benešová 16; M. Dufek 17; M. Peterka 13,18; E. Kubala Havrdová 1
Působiště autorů:
Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
1; Neurologické oddělení, Krajská zdravotní a. s. – Nemocnice Teplice o. z.
2; Merck spol. s r. o., Praha
3; Nadační fond IMPULS, Praha
4; Katedra ekonomické statistiky, Vysoká škola ekonomická v Praze
5; Neurologická klinika LF UP a FN Olomouc
6; Neurologická klinika FN Ostrava
7; Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha
8; Neurologická klinika 2. LF UK FN Motol, Praha
9; Neurologická klinika Nemocnice Pardubického kraje, a. s., Pardubice
10; Neurologické oddělení Krajské nemocnice Tomáše Bati, a. s., Zlín
11; Neurologická klinika 3. LF UK a Fakultní Thomayerovy nemocnice v Krči, Praha
12; Neurologická klinika LF UK a FN Hradec Králové
13; Neurologické oddělení, Nemocnice České Budějovice, a. s.
14; Neurologické oddělení, Nemocnice Jihlava, p. o.
15; Neurologická klinika LF UK a FN Plzeň
15; Neurologická klinika LF MU a FN Brno
16; Neurologická klinika LF MU a FN u sv. Anny, Brno
17
Vyšlo v časopise:
Cesk Slov Neurol N 2021; 84(6): 555-561
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccsnn2021555
Souhrn
Cíl: Podělit se o první klinické zkušenosti s léčbou perorálním kladribinem formou analýzy dat z národního registru ReMuS®. Soubor a metodika: Předkládáme analýzu souboru všech pacientů, kteří zahájili léčbu perorálním kladribinem v období od 1. 9. 2018 do 31. 12. 2020, a detailnější analýzu podsouboru 222 pacientů, kteří užili plnou kumulativní dávku. Analýzy zahrnují relapsy, disabilitu, zaměstnanost a sociální dávky, v podsouboru pak také MR aktivitu. Data byla získána ze všech 15 center pro léčbu demyelinizačních onemocnění a vyhodnocena metodami deskriptivní statistiky. Výsledky: Celý soubor obsahuje 436 pacientů (75,5 % žen) věkového průměru 37,0 let a hmotnosti 71,9 kg. Průměrná doba trvání nemoci byla 8,4 roku, vstupní Expanded Disability Status Scale (EDSS) skóre 2,8, roční výskyt relapsů 1,07 před zahájením léčby. U 90 % pacientů nedošlo po 20,8 (90. kvantil) měsíce k progresi disability, v prvním a druhém roce po zahájení léčby zůstaly bez relapsu přibližně tři čtvrtiny pacientů. U 85 % pacientů v definované podskupině nedošlo k významné MR aktivitě. Změna léčby na jiný lék modifikující průběh nemoci proběhla u 12 pacientů. Závěr: V souladu s registračními studiemi ukazují naše data vysoký podíl pacientů bez relapsů, bez progrese postižení a bez aktivity na MR, dále pak velmi nízký podíl pacientů se změnou léčby.
Klíčová slova:
roztroušená skleróza – perorální kladribin – terapeutická odpověď – registr pacientů
Úvod
Perorální kladribin (Mavenclad, Merck KGaA, Darmstadt, Německo) je v Evropské unii indikován k léčbě dospělých pacientů s vysoce aktivní relabující RS. V ČR je léčivý přípravek (LP) Mavenclad hrazen od listopadu 2018 u pacientů s relabující-remitentní RS (RRRS) se známkami nepříznivé prognózy onemocnění, u kterých došlo navzdory léčbě nejméně jedním lékem první linie k rozvoji alespoň jednoho středně těžkého nebo těžkého relapsu v rozsahu maximálně 2letých léčebných cyklů. Při intoleranci nebo nežádoucích účincích této léčivé látky je možné pacienta převést na léčbu jinou léčivou látkou druhé linie léčby RRRS. Léčba kladribinem není hrazena pacientům s absolutní hraniční hodnotou skóre Expanded Disability Status Scale (EDSS) nad 5,5. Léčba kladribinem také není hrazena, pokud pacient neodpovídá na léčbu, např. při dvou těžkých relapsech za rok nebo při trvalé progresi v EDSS (zvýšení EDSS během 12 měsíců mimo ataku o 1, pokud předchozí EDSS bylo 4,5 a více, nebo při ztrátě schopnosti chůze, tedy dosažení hodnoty EDSS nad 6,5) [1]. Jde o lék s pulzním podáváním – doporučená kumulativní dávka je 3,5 mg/kg tělesné hmotnosti v průběhu 2 let podávaná ve dvou ročních pulzech. Každý léčebný pulz zahrnuje 2 léčebné týdny – jeden na začátku prvního měsíce a jeden na začátku druhého měsíce příslušného léčebného roku, z nichž každý představuje 4 nebo 5 dnů, během kterých dostane pacient v jedné denní dávce jednu nebo dvě 10mg tablety v závislosti na své tělesné hmotnosti. Po dokončení dvou léčebných pulzů není nutná žádná další léčba kladribinem během 3. a 4. roku [2].
Účinnost kladribinu byla potvrzena 2letou klinickou studií CLARITY a její extenzí v dalších 2 letech [3,4]. Dlouhodobá data od pacientů z těchto studií s mediánem délky sledování 10 let ukázala, že u 94,6 % pacientů přetrvává EDSS < 7 a u 83,7 % < 6 [5]. Nicméně je nezbytné – i vzhledem k nákladnosti této léčby – průběžně analyzovat data o její účinnosti a bezpečnosti z klinické praxe.
Cílem tohoto článku je seznámit odbornou veřejnost s daty z celostátního registru pacientů s RS. Registr ReMuS® byl založen Nadačním fondem IMPULS v roce 2013 za odborné podpory Sekce klinické neuroimunologie a likvorologie České neurologické společnosti České lékařské společnosti Jana Evangelisty Purkyně (SKNIL ČNS ČLS JEP). V současnosti je v registru ReMuS® zapojeno všech 15 center pro léčbu RS v ČR a registr monitoruje více než 90 % všech pacientů léčených přípravky modifikujícími přirozený průběh nemoci (disease modifying drugs; DMD).
Soubor a metodika
Předkládáme analýzu dat pacientů z registru ReMuS®, kteří zahájili léčbu LP Mavenclad v období od 1. 9. 2018 do 31. 12. 2020 (soubor A). Data byla exportována k 30. 6. 2021. Byly zhodnoceny základní demografické údaje – pohlaví, věk, hmotnost – a dosavadní charakteristiky RS – doba trvání onemocnění od prvních příznaků, vstupní úroveň neurologického deficitu na rozšířené škále disability (EDSS), relapsy, zaměstnanost, sociální dávky a léčba DMD předcházející zahájení LP Mavenclad. Následně byly popsány změny těchto hodnot v období po podání LP Mavenclad.
Relapsy byly hodnoceny za čtyři 6měsíční období (0–6, 6–12, 12–18 a 18–24 měsíců), a pak i souhrnně za 0–12 měsíců a 0–24 měsíců po nasazení léčby. Závažnost relapsů byla definována na základě úhradových kritérií (tab. 1).

U pacientů, kteří zahájili léčbu LP Mavenclad v období od 1. 9. 2018 do 30. 11. 2019, tedy s delší dobou sledování (podsoubor B), byly hodnoceny EDSS, zaměstnanost a sociální dávky a dále aktivita na MR. Délka období byla zvolena tak, aby zařazení pacienti měli v době exportu dat ukončeny oba léčebné pulzy.
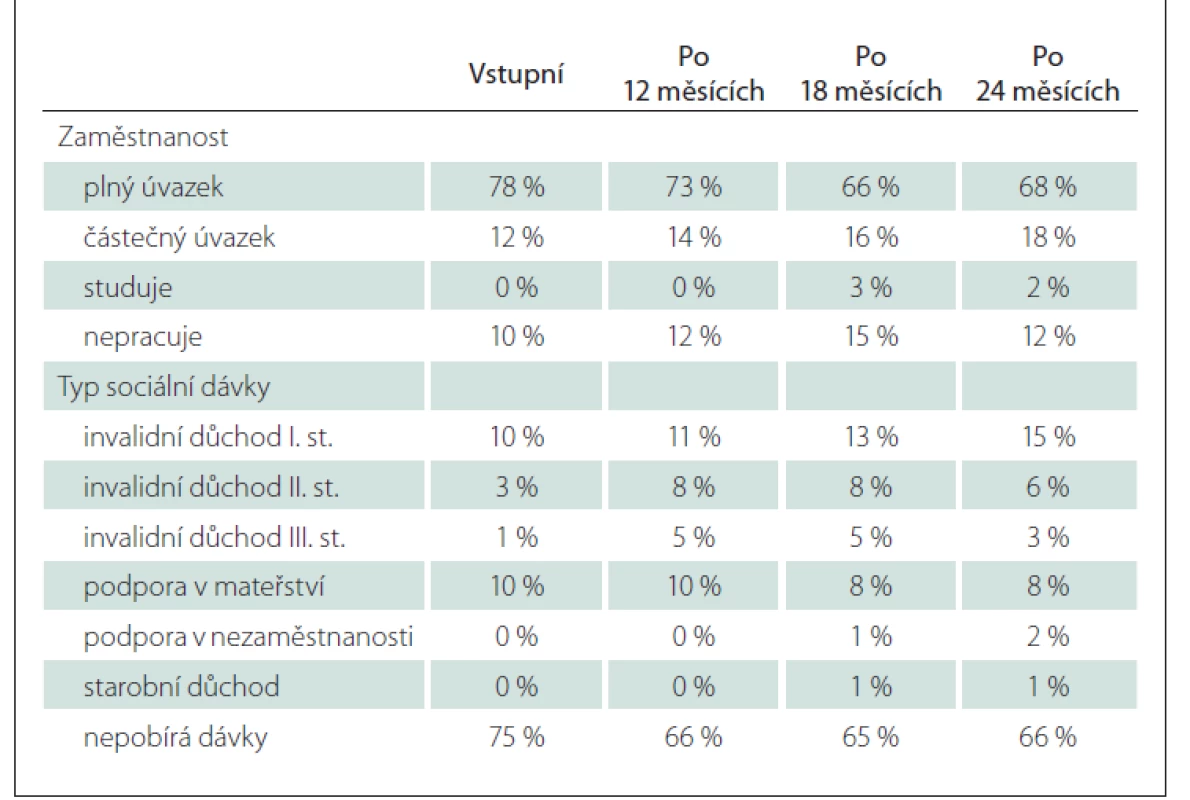
EDSS bylo hodnoceno při zahájení léčby a dále v 6měsíčních intervalech (6, 12, 18, 24 měsíců). V případě, že hodnoty EDSS nebyly zaznamenány ke každému časovému bodu, byly odvozeny pomocí lineární extrapolace ze známých hodnot. Zaměstnanost a sociální dávky byly hodnoceny po 12, 18 a 24 měsících po zahájení LP Mavenclad v kategoriích, jak jsou zaznamenávány v registru ReMuS® – viz dále.
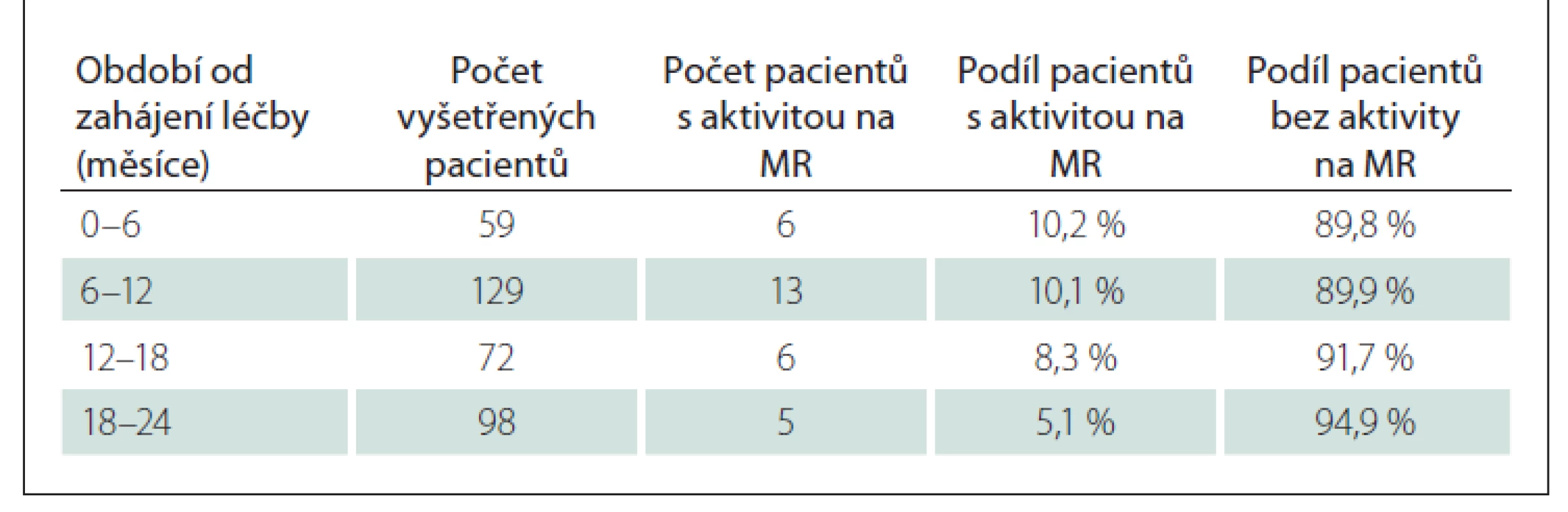
Data o aktivitě na MR nejsou do registru ReMuS® povinně reportována, proto byla pro účel této analýzy doplněna individuálně. S ohledem na odlišnosti v metodice a časování vyšetření MR v jednotlivých centrech a zároveň na potřebu praktického vodítka při rozhodování o změně léčby na základě aktivity MR bylo zvoleno zhodnocení nálezu MR ošetřujícím neurologem dotazem: „Došlo od minulého vyšetření MR ke zhoršení aktivity na MR, která by vyžadovala změnu léčby ve smyslu změny na jiný DMD nebo podání dalšího pulzu kladribinu nad rámec doporučeného dávkování?“ Příkladem této významné aktivity byly dvě a více nových T2 lézí na MR mozku nebo jedna a více nových T2 lézí na MR míchy při zvážení lokalizace a velikosti (dle autorů Meuth et al [6]). Hodnotící neurolog odpovídal ANO/NE. Žádná jiná kritéria pro hodnocení aktivity na MR nebyla použita.
Výsledky
Vstupní charakteristika onemocnění
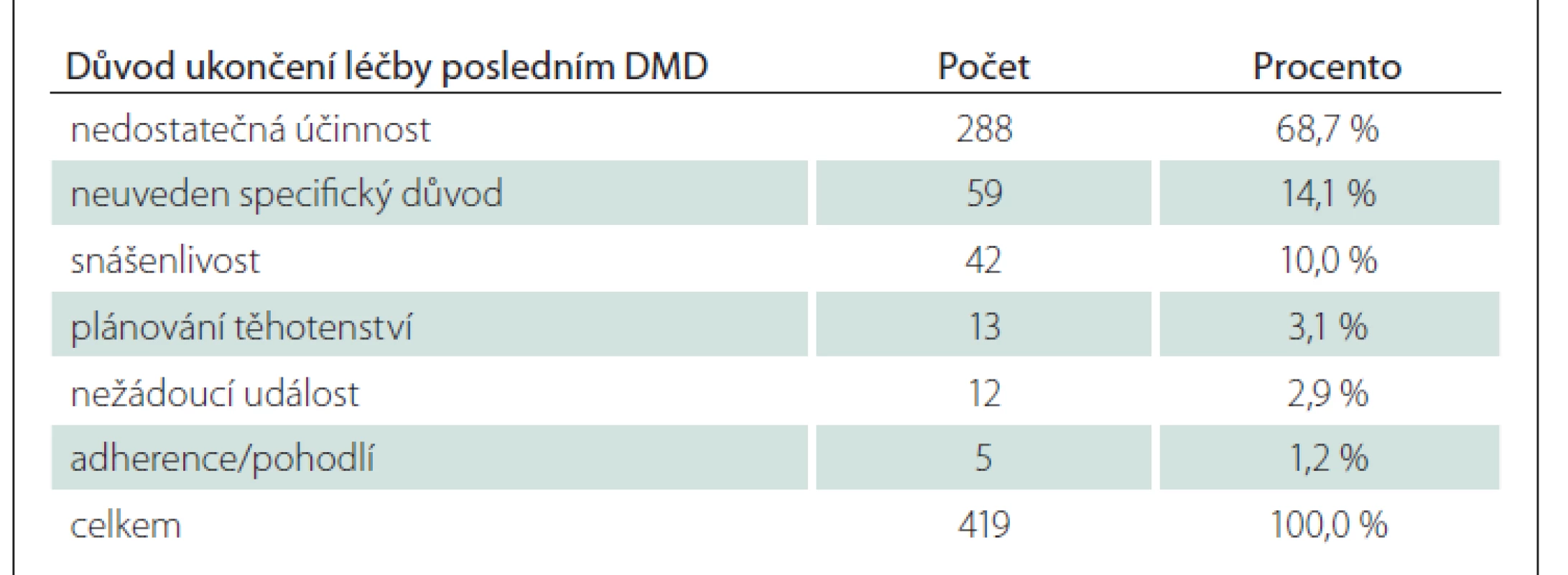
Ve sledovaném období začalo užívat LP Mavenclad 436 pacientů (soubor A), z nichž bylo 329 žen (75,5 %), průměrný věk byl 37,0 let a průměrná hmotnost 71,9 kg. Průměrná doba trvání nemoci od prvních příznaků do zahájení léčby LP Mavenclad byla 8,4 roku, průměrné EDSS 2,8. Podsoubor B zahrnuje 222 pacientů – z toho 156 žen (70,3 %) – s průměrným věkem 37,3 let, průměrnou hmotností 71,9 kg, průměrnou dobou trvání nemoci 8,5 roku a průměrným EDSS 2,8 (medián 2,5). Více detailů se nachází v tab. 2. V celém souboru předcházela LP Mavenclad u 296 pacientů léčba DMD základní linie (interferony b, glatiramer acetát nebo teriflunomid), u 123 pacientů eskalační léčba (dimethyl fumarát, fingolimod, natalizumab, rituximab, ocrelizumab nebo alemtuzumab) a u 17 pacientů nebyla uvedena žádná DMD léčba – jde zřejmě o pacienty zařazené do klinických hodnocení bez znalosti, zda užívali účinnou látku či placebo. Přehled důvodů ukončení léčby posledním DMD před nasazením LP Mavenclad je v tab. 3. Nejčastěji (68,7 %) šlo o nedostatečnou účinnost. Mavenclad byl nasazován zejména jako druhý lék, méně jako třetí lék v pořadí. U všech pacientů byl medián počtu DMD nasazených před zahájením léčby LP Mavenclad 1,0 a průměr 1,6. Maximální hodnota byla čtyři, tedy u některého z pacientů byl LP Mavenclad nasazen až jako pátý lék.
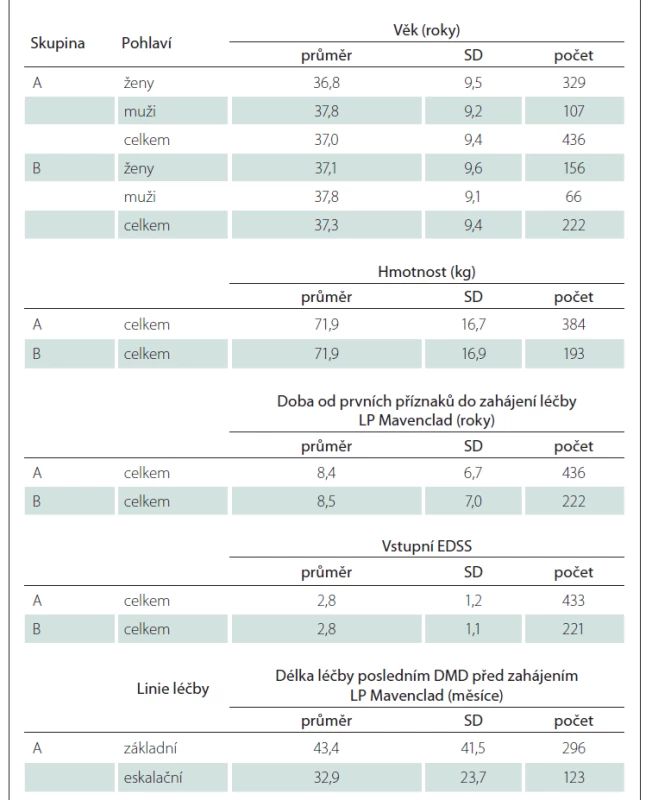
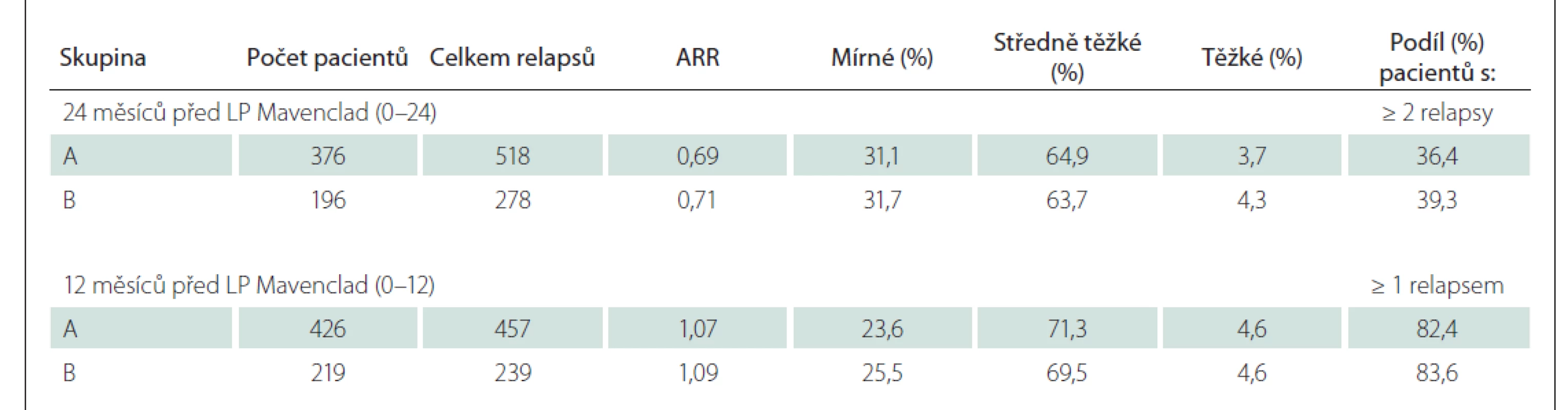
V období 24, resp. 12 měsíců před zahájením LP Mavenclad bylo sledováno 376, resp. 426 pacientů, u nichž byl počátek prvních projevů RS nejdříve 24, resp. 12 měsíců před zahájením léčby LP Mavenclad, a tak lze sledování celých 24, resp. 12 měsíců považovat za kompletní. Průměrný roční výskyt relapsů (annual relapse rate; ARR) byl 0,69, resp. 1,07 v období 24, resp. 12 měsíců před zahájením LP Mavenclad. Přibližně dvě třetiny relapsů bylo středně těžkých. Počet relapsů a jejich četnost podle závažnosti před zahájením léčby LP Mavenclad ve skupině A i podskupině B ukazuje tab. 4.
Průběh onemocnění po zahájení léčby LP Mavenclad
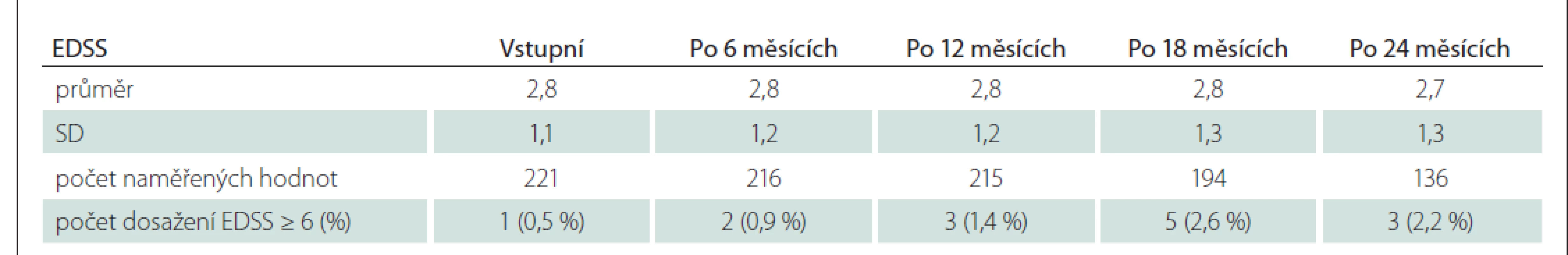
Změny disability nebývají příliš dynamické, proto zde uvádíme pouze vývoj EDSS v podskupině B s delší dobou sledování (až 24 měsíců od zahájení LP Mavenclad). Průměrné EDSS lehce pokleslo ze vstupních 2,8 (počet hodnot 221) na 2,7 po 24 měsících (počet hodnot 136) – detaily v tab. 5. Dále bylo sledováno, u kolika pacientů došlo k dosažení hodnoty EDSS 6,0 a více, tedy k ukončení podmínek úhrady. Počty pro časové body po 6 měsících jsou uvedeny rovněž v tab. 5. Ke konfirmované progresi disability (tzn. přetrvávající minimálně po dobu 6 měsíců – metodika dle Kalinčíka et al [7]) nedošlo u 90 % pacientů ani po 20,8 (90. kvantil) měsíce od zahájení léčby. Tato progrese byla pozorována jen u 14 (6,3 %) pacientů z podskupiny B, a to průměrně po 8,6 měsíce.
Analýza relapsů byla provedena s využitím dat všech pacientů (skupina A) i v podskupině B. V předem definovaných 6- i 12měsíčních intervalech zůstala v obou skupinách většina pacientů bez relapsu a rovněž ARR se držel na nízké hodnotě, relapsy byly převážně mírné nebo středně těžké (detailně viz tab. 6). Do 12 měsíců po zahájení LP Mavenclad došlo ke dvěma těžkým relapsům, tedy ke splnění kritérií pro ukončení úhrady před podáním druhého pulzu, pouze u jednoho z 320 pacientů s dokončeným 12měsíčním sledováním.
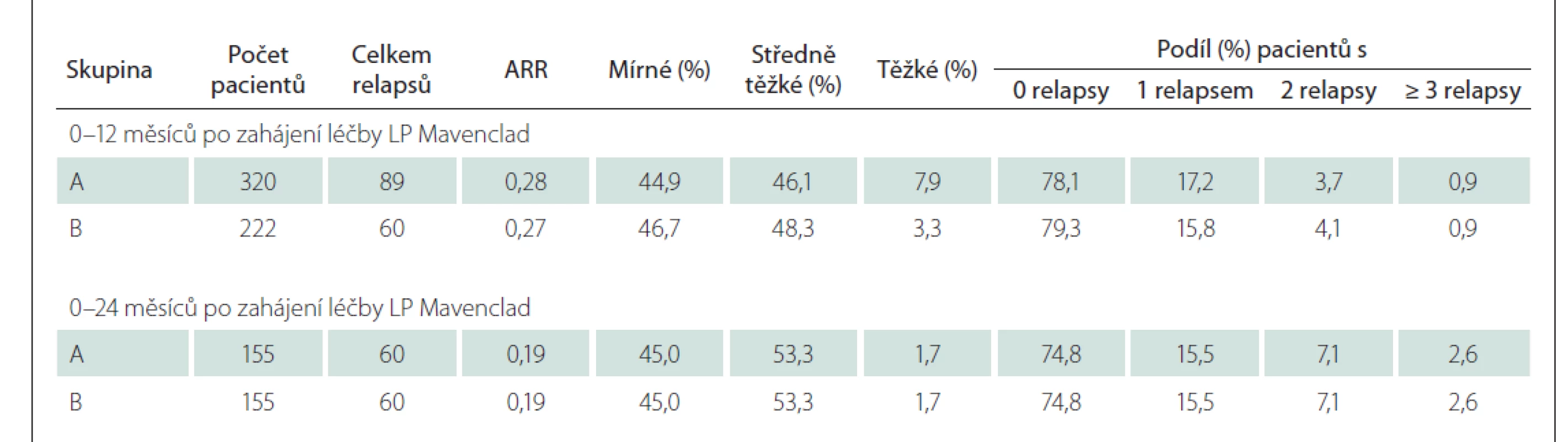
ARR – roční míra relapsů; LP – léčivý přípravek
Magnetickorezonanční aktivita onemocnění
Nálezy na MR byly sbírány od 222 pacientů v podskupině B. Z analýzy byla vyřazena data 21 pacientů – 16 z nich nemělo dostupný MR sken před zahájením LP Mavenclad a pět pacientů mělo pouze vstupní MR. Analyzováno tedy bylo 201 pacientů, u kterých bylo hodnoceno 465 vyšetření MR (průměrně 2,3 vyšetření na jednoho pacienta). Medián délky sledování byl 21,1 měsíce, průměrná doba sledování 19,7 měsíce (směrodatná odchylka [SD] 5,0). Nejkratší doba sledování byla 9,1 měsíce a maximální byla 30,7 měsíce. Celkem u 171 (85,1 %) pacientů nedošlo k aktivitě na MR označené hodnotícím neurologem za významnou. Pokud k MR aktivitě došlo, tak nastala v průměru za 10,8 měsíce od zahájení léčby, medián byl 10,2 měsíce, minimum 0,8 měsíce a maximum 22,8 měsíce. Podíl pacientů s významnou aktivitou v časových intervalech od zahájení léčby LP Mavenclad ukazuje tab. 7.
Zaměstnanost a sociální dávky
Vývoj zaměstnanosti a sociálních dávek byl rovněž hodnocen v podskupině 105 pacientů se známými údaji a dobou sledování 24 měsíců. V době zahájení léčby většina pacientů pracovala na plný úvazek (78 %) a nepobírala sociální dávky (75 %). Podíl těchto pacientů během 24 měsíců mírně poklesl na 68, resp. 65 %. Vstupní stav a vývoj jsou uvedeny v tab. 8.
Změna léčby u pacientů po léčbě LP Mavenclad
U 12 pacientů došlo ve sledovaném období ke změně léčby z LP Mavenclad na jiný lék – u 10 na monoklonální protilátky, 1 na fingolimod a 1 na glatiramer acetát. Průměrná délka trvání léčby LP Mavenclad u těchto pacientů byla 15,4 měsíce, průměrné vstupní EDSS 2,9. U tří z nich došlo v průběhu sledovaného období ke konfirmované progresi EDSS, u osmi z nich minimálně k jednomu relapsu. U čtyř ze sedmi pacientů se sledováním MR byla zaznamenána aktivita na MR.
Diskuze
Díky účasti všech 15 RS center představujeme analýzu souboru o maximální možné velikosti, konkrétně 436 pacientů, kteří zahájili léčbu LP Mavenclad v reálné klinické praxi v ČR v období mezi 1. 9. 2018 a 31. 12. 2020 a kteří jsou současně sledováni v registru ReMuS®.
Ve srovnání s registrační studií CLARITY jde o populaci srovnatelnou věkem (37,0 vs. 37,9 let), průměrnou hmotností (71,9 vs. 68,1 kg) a vstupním EDSS (2,8 vs. 2,8). V našem souboru byl vyšší podíl žen (75,5 vs. 68,8 %), delší trvání onemocnění (8,4 vs. 7,9 let) a mnohem vyšší podíl pacientů s dokumentovanou předchozí léčbou alespoň jedním DMD (96,1 vs. 26,1 %), což je dáno indikačním omezením úhrady. Ve studii CLARITY měli všichni zařazení pacienti alespoň jeden relaps v posledních dvanácti měsících před zahájením, v našem souboru bylo takových pacientů 82,4 % při vstupním ARR 1,07 [8].
Námi publikovaná data dokumentují vysokou účinnost této léčby v souladu s výsledky studie CLARITY – ve 2letém období bylo 74,8 % pacientů bez relapsu (vs. 79,7 % pacientů v CLARITY) a stabilní EDSS zůstalo u více než 90 % pacientů po dobu sledování. V heterogenních podmínkách klinické praxe se navíc podařilo nasbírat data ukazující vysoký podíl pacientů bez významné aktivity na MR dle hodnocení ošetřujícím lékařem.
Přibližně u jedné desetiny pacientů byl pozorován relaps nebo významná MR aktivita v prvních 6 a 12 měsících po zahájení léčby LP Mavenclad. Vzhledem k dynamice selektivní imunorekonstituce navozené kladribinem, kdy ještě nelze předpokládat maximální účinek na lymfocyty, bývá aktivita v tomto období označována jako reziduální a dle doporučení by u těchto pacientů měl být podán druhý pulz kladribinu, aby bylo dosaženo doporučené kumulativní dávky a tím i plného efektu léčby [6,9].
V klinických hodnoceních ani v praxi léčba kladribinem samozřejmě nevede k navození remise u 100 % pacientů, proto vyvstává otázka, jak dále léčit pacienty, u nichž po podání plné dávky kladribinu dojde k projevům aktivity onemocnění.
Typy terapeutické odpovědi a možnostmi další léčby se zabývají publikace německých [6] a – s přihlédnutím na naše podmínky – také českých autorů [10]. V případě pokračující aktivity onemocnění je nutné zvážit její charakter (relaps, progrese disability, pouze aktivita na MR), závažnost (především u relapsů jejich závažnost a četnost) a její výskyt v čase (reziduální aktivita), to vše s přihlédnutím k dosavadnímu průběhu onemocnění a léčby pomocí DMD před podáním kladribinu (např. rebound onemocnění po vysazení fingolimodu apod.). Je nutné si uvědomit, že i přes remisi navozenou kladribinem se stále jedná o pacienty s vysoce aktivní RS, často předléčené více DMD.
Při přetrvávání aktivity i po dokončeném druhém léčebném pulzu se v praxi nabízejí dvě možnosti, a to 1) změnit léčbu na jiný vysoce efektivní DMD (monoklonální protilátky, modulátory S1P receptorů), nebo 2) podat další pulz kladribinu. Přestože ani pro jednu z uvedených možností zatím nemáme dostatek evidence, je nutné tuto situaci řešit, protože přetrvávající aktivita RS může způsobit nevratné poškození zdraví jednotlivých pacientů.
Ohledně změny léčby na jiný DMD dosud nejdelší sledování ukázalo, že 63,3 % pacientů nevyžadovalo podání další DMD léčby ani v době 10 let od podání perorálního kladribinu v registračních studiích [5]. V našem souboru je sledování zatím v průměru 2leté. Během této doby došlo ke změně léčby pomocí DMD pouze u 12 ze 436 pacientů, z nichž u osmi došlo k alespoň jednomu relapsu. Jednoznačná pravidla pro to, jak pokračovat ve 3. a dalším roce, zatím chybí a z tohoto hlediska bude velmi důležité průběžné hodnocení dat z reálné klinické praxe. V úvahu bude nutné brát různý mechanizmus účinku jednotlivých DMD, jejich bezpečnostní profil, aspekty plánování těhotenství [11] a v neposlední řadě riziko těžšího průběhu COVID-19 u pacientů léčených anti CD 20 monoklonálními protilátkami [12] a nedostatečné humorální odpovědi na očkování, jak bylo publikováno u ocrelizumabu a fingolimodu [13], s případnou potřebou přeočkování.
Druhé možnosti pokračování v léčbě pulzy kladribinu, zejména u pacientů, u kterých dojde k návratu aktivity s delším časovým odstupem, zatím v praxi brání indikační omezení úhrady na maximálně dva roční léčebné pulzy, jak je uvedeno v úvodu. Přitom souhrn údajů o LP Mavenclad nevylučuje opakované použití, ani nelimituje maximální počet pulzů. Je potřeba dodržet doporučené kontraindikace a dávkování (doporučená kumulativní dávka 3,5 mg/kg tělesné hmotnosti v průběhu 2 let podávaná jako jeden léčebný pulz v dávce 1,75 mg/kg za rok). Naše výsledky ve shodě s uvedenými klinickými studiemi potvrzují, že by opakované podání pulzů kladribinu bylo v praxi zvažováno u minoritního podílu pacientů. Nicméně s rostoucí délkou období od zahájení léčby kladribinem bude riziko návratu aktivity onemocnění, především MR, zřejmě narůstat, především v 5. roce a dalších letech od zahájení léčby kladribinem, jak ukázaly výsledky extenze studie CLARITY [4].
V ČR je LP Mavenclad dostupný od konce roku 2018 a od té doby již několik stovek pacientů zahájilo tuto pulzní léčbu. Blíží se doba, kdy první pacienti dosáhnou konce 4letého léčebného období, u malého procenta pacientů přitom dochází k projevům aktivity RS. Současná indikační omezení úhrady u těchto pacientů neumožňují pokračování v léčbě perorálním kladribinem. Na základě výsledků klinických studií, názoru expertů i námi publikovaných dat z registru se domníváme, že by pokračování v léčbě kladribinem bylo pro určitou část pacientů přínosem a její praktická dostupnost by měla být garantována. Přitom je třeba zdůraznit, že všichni pacienti musí být i nadále pečlivě monitorováni, vč. pravidelných MR vyšetření alespoň 1× ročně, a nadále musí být sbírána data cestou registru ReMuS® s pravidelným vyhodnocováním účinnosti a do budoucna i bezpečnosti léčby.
Závěr
Námi prezentovaná data z celostátního registru ukazují, že perorální kladribin je vysoce účinný DMD s vysokým potenciálem navození remise RS. Jeho praktické výhody vyplývají z příznivého bezpečnostního profilu, jednoduchého schématu kontrolních vyšetření, možnosti plánování otěhotnění, nízkého rizika infekčních komplikací vč. COVID-19 a zachované odpovědi na očkování proti COVID-19. Přestože klinické studie prokázaly jeho účinnost a bezpečnost i u dosud neléčených pacientů, platná indikační omezení úhrady jej staví do eskalační linie léčby u dosud předléčených pacientů. V současné době vyvstává otázka praktické dostupnosti pokračování v léčbě kladribinem v ČR. I nadále trvá nutnost pravidelného monitoringu a sběru dat z reálné klinické praxe. Pouze tato data mohou pomoci při upřesňování dlouhodobých léčebných strategií.
Etické principy
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Vyšetření magnetickou rezonancí proběhla v rámci pravidelného klinického sledování. Všichni pacienti souhlasili se sběrem a zpracováním dat v rámci celostátního registru pacientů s RS (ReMuS®) a podepsali informovaný souhlas.
Finanční podpora
Sběr dat v registru ReMuS®, který je spravován Nadačním fondem IMPULS, je částečně podporován nezávislým grantem společnosti Merck spol. s. r. o.
Konflikt zájmů
Aleš Tvaroh je zaměstnancem společnosti Merck spol. s. r. o.
Ostatní autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. MUDr. Dana Horáková, Ph.D.
Neurologická klinika
Centrum klinických neurověd
1. LF UK a VFN v Praze
U Nemocnice 499/2
128 08 Praha 2
e-mail: dana.horakova@vfn.cz
Přijato k recenzi: 14. 10. 2021
Přijato do tisku: 9. 12. 2021
Zdroje
1. Indikační omezení úhrady LP Mavenclad. [online]. Dostupné z URL: https: //www.sukl.cz/modules/medication/detail.php?code=0222414&tab=prices.
2. Souhrn údajů o přípravku Mavenclad. [online]. Dostupné z URL: https: //www.sukl.cz/modules/medication/detail.php?code=0222414&tab=texts.
3. Giovannoni G, Cook S, Rammohan K et al. Sustained disease-activity-free status in patients with relapsing-remitting multiple sclerosis treated with cladribine tablets in the CLARITY study: a post-hoc and subgroup analysis. Lancet Neurol 2011; 10 (4): 329–337. doi: 10.1016/S1474-4422 (11) 70023-0.
4. Giovannoni G, Keller B, Jack D. Durability of NEDA status in patients with relapsing multiple sclerosis receiving cladribine tablets: CLARITY Extension [abstract]. Neurology 2019; 92 (15 Suppl): P3.2-100.
5. Giovannoni G, Leist T, Aydemir A et al. CLASSIC-MS: Long-term efficacy and real-world treatment patterns for patients receiving cladribine tablets-interim data with 8–14 years’ follow-up. [online]. Available from URL: https: //medical.emdserono.com/content/dam/web/health-care/biopharma/web/USMI/congress-presentations/Cladribine-2-Giovannoni-G-et-al-CLASSIC-MS-Long-term-Efficacy-and-Real-World-Treatment-Phase-III-Parent.pdf.
6. Meuth SG, Bayas A, Kallmann B et al. Long-term management of multiple sclerosis patients treated with cladribine tablets: an expert opinion. Expert Opin Pharmacother 2020; 21 (16): 1965–1969. doi: 10.1080/ 14656566.2020.1792885.
7. Kalincik T, Cutter G, Spelman T et al. Defining reliable disability outcomes in multiple sclerosis. Brain 2015: 138 (11): 3287–3298. doi: 10.1093/brain/awv258.
8. Giovannoni G, Comi G, Cook S et al. A placebo-controlled trial of oral cladribine for relapsing multiple sclerosis. N Engl J Med 2010; 362 (5): 416–426. doi: 10.1056/NEJMoa0902533.
9. Sørensen PS, Centonze D, Giovannoni G et al. Expert opinion on the use of cladribine tablets in clinical practice. Ther Adv Neurol Disord 2020; 13: 1–17. doi: 10.1177/1756286420935019.
10. Ampapa R, Dufek M, Hradílek P et al. Léčba roztroušené sklerózy perorálním kladribinem. Neurol Praxi 2021; 22 (3): 178–182.
11. Zapletalová O, Krejsek J. Roztroušená skleróza mozkomíšní, těhotenství, mateřství a kojení. Cesk Slov Neurol N 2019; 82/115 (2): 161–165. doi: 10.14735/am csnn2019161.
12. Stastna D, Menkyova I, Drahota J et al. Multiple sclerosis, neuromyelitis optica spectrum disorder and COVID-19: a pandemic year in Czechia. Mult Scler Relat Disord 2021; 54: 103104. doi: 10.1016/j.msard.2021.103 104.
13. Achiron A, Mandel M, Dreyer-Alster S et al. Humoral immune response to COVID-19 mRNA vaccine in patients with multiple sclerosis treated with high-efficacy disease-modifying therapies. Ther Adv Neurol Disord 2021; 14: 17562864211012835. doi: 10.1177/17562864211012 835.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2021 Číslo 6
Nejčtenější v tomto čísle
- Stiff -person syndrom
- Normotenzní hydrocefalus
- Synukleinopatie a jejich laboratorní biomarkery
- Perorální kladribin v léčbě roztroušené sklerózy – data z celostátního registru ReMuS®
