Autoimunitní encefalitidy – kazuistiky
Autoimmune Encephalitis – Case Reports
Introduction:
Autoimmune encephalitis is a heterogeneous group of neurological diseases manifested by acute onset of epileptic seizures, cognitive impairment, memory dysfunction or psychiatric symptoms due to inflammation of limbic (or extralimbic) structures mediated by autoimmune antibodies. The anti-NMDAr encephalitis, characterized by symptoms of diffuse cortical structures impairment, differs clinically from this etiopathogenicly heterogenous entity. According to its association with neoplasm, we can distinguish paraneoplastic and non-paraneoplastic LE.
Methodology:
We retrospectively analysed patient records and identified five cases suspected of autoimmune encephalitis.
Conclusion and discussion:
Patients with an acute onset of epileptic seizures accompanied by cognitive impairment and psychiatric symptoms should undergo neurological assessment, EEG, lumbar puncture including detection of antibodies against intracellular antigens (onconeural paraneoplastic antibodies), detection of antibodies against membrane and synaptic antigens and magnetic resonance of the brain. Immunotherapy should be started immediately when non-paraneoplastic limbic encephalitis is considered. Negative findings in cerebrospinal fluid do not exclude autoimmune brain inflammation. In paraneoplastic limbic encephalitis, surgical and anticancer therapy is the first-line treatment. Onset of secondary epilepsy cannot be excluded after a series of acute symptomatic seizures. Cooperation of neurologists, infectionists and psychiatrists is essential.
Key words:
autoimmune diseases – autoantibodies – encephalitis – paraneoplastic syndromes – epilepsy – limbic encephalitis – NMDAr encephalitis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
V. Jakubčiaková; J. Slonková
Působiště autorů:
Neurologická klinika LF OU a FN Ostrava
Vyšlo v časopise:
Cesk Slov Neurol N 2016; 79/112(6): 707-714
Kategorie:
Kazuistika
doi:
https://doi.org/10.14735/amcsnn2016707
Souhrn
Úvod:
Autoimunitní encefalitidy jsou heterogenní skupina neurologických onemocnění s akutně vzniklými epileptickými záchvaty, kognitivním deficitem, poruchami paměti nebo psychiatrickými příznaky při postižení limbických (případně extralimbických) struktur zánětem na podkladě tvorby autoimunitních protilátek. Od etiopatogeneticky různorodé skupiny limbických encefalitid (LE) se klinicky vyčlenila anti-NMDAr encefalitida s projevy difuzního postižení kortikálních struktur. LE můžeme dále dělit dle souvislosti s onkologickým onemocněním na neparaneoplastické (NPLE) a paraneoplatické limbické encefalitidy (PLE).
Metodika:
Retrospektivní analýzou pacientů bylo identifikováno pět případů s podezřením na autoimunitní encefalitidu.
Závěr a diskuze:
Pacienti s akutním vznikem epileptických záchvatů sdružených s rozvojem kognitivního deficitu a psychických změn by měli podstoupit následující vyšetření: neurologické, EEG, lumbální punkce vč. stanovení panelu protilátek proti membránovým a synaptickým antigenům exprimovaných v CNS, protilátek proti dobře charakterizovaným onkoneurálním antigenům a MR mozku. Při podezření na NPLE by měla být imunoterapie zahájena neprodleně. Negativní výsledek vyšetření likvoru autoimunitní zánět mozku nevylučuje. Při PLE je primární terapií chirurgicko-onkologická léčba. Rozvoj sekundární epilepsie po sérii akutních symptomatických záchvatů není vyloučen. Multioborová klinická spolupráce neurologů, infektologů a psychiatrů je nezbytná.
Klíčová slova:
autoimunita – autoprotilátky – encefalitida –paraneoplastické syndromy – epilepsie – limbická encefalitida – NMDAr encefalitida
Úvod
Autoimunitní encefalitidy (AIE) jsou poměrně vzácná heterogenní skupina neurologických onemocnění, při kterých autoimunitní zánět napadá převážně určité struktury centrální nervové soustavy (CNS). V případě postižení limbických struktur mluvíme o limbických encefalitidách (LE), o nichž se poprvé v literatuře zmínil Brierley v roce 1960. Popisuje zánětlivou reakci postihující hipokampus, amygdalu, frontobazální a inzulární oblast a projevující se záchvaty, psychiatrickými příznaky a subakutním progredujícím postižením krátkodobé paměti, které může vyústit do demence [1]. Dělení LE je poměrně komplikované, podle typu a lokalizace antigenu, přítomnosti či nepřítomnosti onkologického onemocnění, podle izolovaného onemocnění CNS či sdružení s jiným autoimunitním systémovým onemocněním. Četnost výskytu v populaci zatím není statisticky přesněji známa, nicméně je možné, že mnoho případů je skryto pod akutními psychiatrickými diagnózami bez další širší diagnostiky. Dle průkazu protilátek lze LE dělit na A1. syndromy s protilátkami proti intracelulárním antigenům, kam patří LE s dobře charakterizovanými onkoneurálními autoprotilátkami (anti-Hu, anti-Ma2, anti-CV2/ CRMP5, anti-amfifyzin) a LE s protilátkami anti-GAD; A2. na syndromy s povrchovými protilátkami proti membránovým a synaptickým antigenům (anti-LGI1, anti-caspr-2, anti-AMPA, anti-GABAB). B. Zvláštní klinickou jednotkou je anti-NMDAr difuzní kortikální encefalitida, pro kterou je typický průkaz protilátek proti ionotropnímu podtypu glutamátového antigenu anti-NMDAr patřícího mezi membránové a synaptické antigeny [2].
Klinické symptomy AIE se typicky rozvíjejí během pár týdnů nebo měsíců a časná detekce je složitá. Časné stanovení diagnózy je pro klinickou prognózu klíčové [3,4]. Z pohledu onkologických onemocnění rozlišujeme paraneoplastické LE (PLE) a neparaneoplastické LE (NPLE). PLE mají horší prognózu závislou na odpovědi na terapii základního onkologického onemocnění. NPLE vykazují dobrou odpověď na včasně zahájenou imunoterapii [2,5]. V případě PLE je syndrom sdružený převážně s malobuněčným karcinomem plic (SCLC), karcinomem prsu, tumory testes, teratomy, Hodgkinovým lymfomem a tymomy. Neurologické příznaky předchází diagnózu malignity v 60– 75 % těchto pacientů [6,7]. U diagnostikovaných LE je vždy na místě myslet na možnou souvislost s malignitou a původní negativní nálezy ověřovat v čase [8]. V určitých případech může být slabá pozitivita protilátek proti membránovým a synaptickým antigenům sdružena i s jiným neurologickým onemocněním bez encefalitidy, jako je tomu např. u pozitivity anti-CASPR2 u neuromyotonie [9].
Etiopatogeneze
U PLE můžeme při základním onkologickém onemocnění diagnostikovat tvorbu dobře charakterizovaných onkoneurálních protilátek proti intracelulárním antigenům anti-Hu, anti-Ma2, anti-CV2, anti-amfifyzin a anti-GAD. Tyto protilátky obvykle spouští mechanizmy T buněčné cytotoxicity a nezvratné poškození neuronů, a proto je prognóza špatná. Výjimkou je přítomnost anti-GAD protilátek, kdy výskyt tumoru není běžný a je možné uzdravení, i když pacienti hůře odpovídají na imunoterapii [3]. Druhou skupinou detekovatelných protilátek jsou protilátky proti povrchovým membránovým a synaptickým antigenům VGKC-komplexu (anti-LG1, anti-CASPR2, anti-contactin-2), anti-AMPA, anti-GABAB a anti-glycinovým receptorům. Tato kategorie je spojena s malignitami v menším procentu, ale např. anti-GABAB pozitivita je až v 60 % sdružena s přítomností tumoru a onkologický skríning je na místě [8]. Klinicky, terapeuticky a prognosticky odlišná jednotka s anti-NMDAr protilátkami může být sdružena ve vyšším procentu s teratomem ovaria s dobrou odpovědí na terapii [10,11].
Diagnostika a diferenciální diagnostika
Klíčové příznaky u AIE zahrnují epileptické záchvaty, afektivní změny a poruchy paměti, které jsou běžné u psychiatrických poruch a mohou být mylně léčeny jen symptomaticky [5]. U LE v EEG bývá nález epileptické aktivity nad temporálními laloky unilaterálně nebo bilaterálně, s pomalými vlnami fokálně nebo difuzně [7]. Na MR mozku jsou charakteristické hyperintenzní signálové změny v T2 vážených obrazech a FLAIR sekvencích v mediální temporální oblasti s maximem postižení amygdaly, hipokampů a temporálních pólů. Pozorována bývá atrofizace postižených oblastí. U pacientů s anti-NMDAr encefalitidou jsou klinicky příznaky poruchy paměti, afektivních změn a epileptických záchvatů provázeny často extrapyramidovým syndromem, hypoventilací a autonomní nestabilitou. V EEG jsou popisovány pro tuto jednotku specifické vlny tzv. extreme delta brushes s normální strukturou mozku nebo pouze nespecifickými změnami v MR obraze [12]. Normální MR nález diagnózu AIE nevylučuje [2]. Biochemický nález v lumbální punkci (LP) je často nespecifický. Lymfocytární pleiocytózu zachytíme asi u 40 % klasických PLE. Záchyt pleiocytózy je vyšší v počátcích onemocnění. Může být přítomno zvýšení celkové bílkoviny (CB), u některých syndromů může být prokázána intratékální syntéza protilátek a oligoklonálních pásů [13,14]. Vyšetření celotělové FDG-PET/ CT má význam ve skríningu okultních neoplazií. Zásadní diagnostický význam má vyšetření dobře charakterizovaných onkoneurálních protilátek a protilátek proti membránovým a synaptickým antigenům [2]. Diferenciální diagnostiku LE naleznete v tab. 1 [4].
![Diferenciální diagnostika LE [4].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/3dc7f1d0044ed28f278752a917beee2e.png)
Léčba
Léčbu AIE lze rozdělit na symptomatickou terapii, imunoterapii a v případě PLE také onkologickou léčbu [15].
Metodika a popis souboru
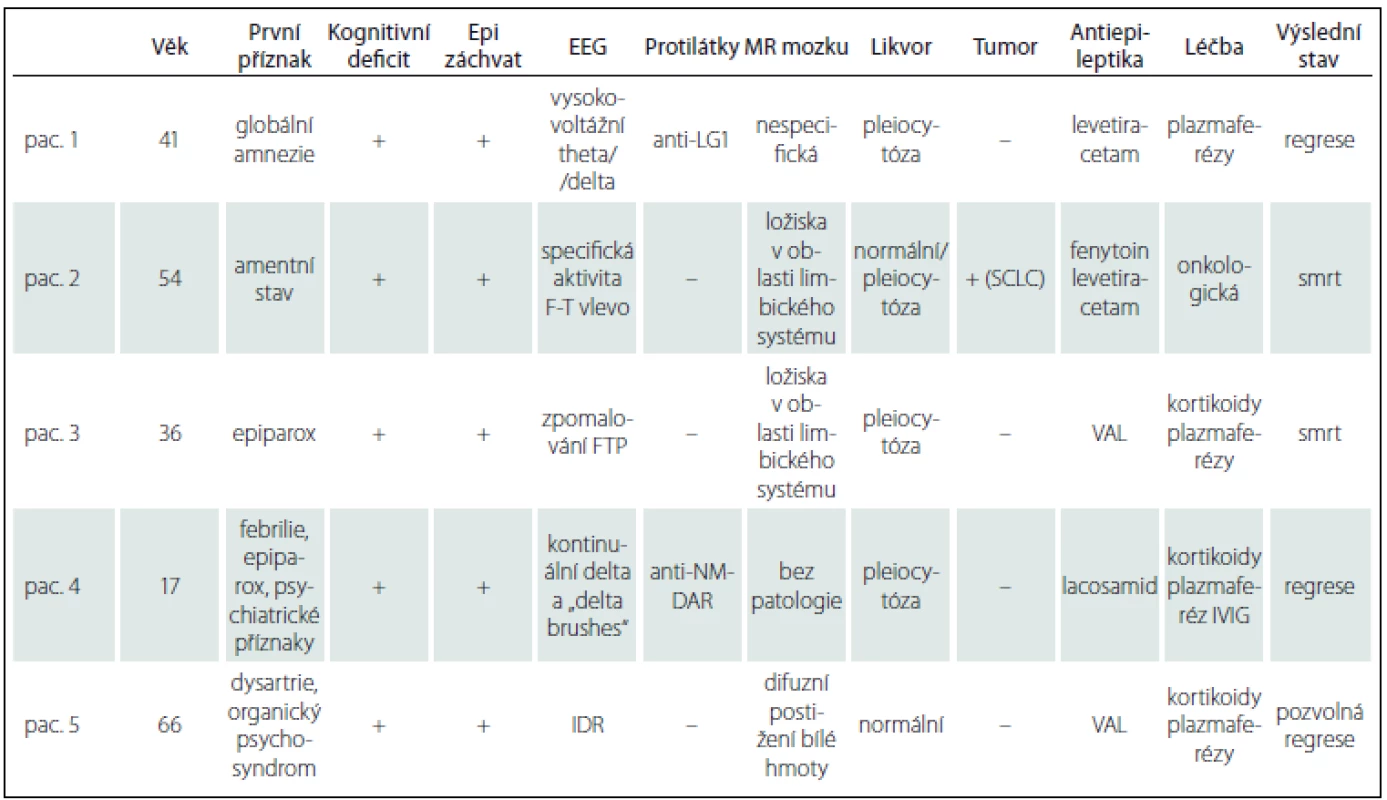
Retrospektivní analýzou případů v letech 2011– 2015 se vstupní anamnézou akutní poruchy kognitivních funkcí, paměti, abnormního chování, s průvodními epileptickými záchvaty při vyloučení traumatu, akutního bakteriálního či virového zánětu a progresivního ložiskového onemocnění mozku bylo identifikováno pět pacientek, u kterých byla stanovena diagnóza AIE. Elektroencefalografie byla provedena na přístroji Alien, software Truscan. V některých případech byl proveden video-EEG monitoring se zachycením iktálního záznamu. Vyšetření panelu protilátek bylo realizováno v certifikované laboratoři nejprve v Oxfordu, později ve FN v Motole, Praha. MR byla provedena na přístroji Avanto, sekvence T1, T2, FLAIR a DWI. V souboru je zařazeno pět žen ve věku od 17 do 66 let. U všech pacientek byl v úvodu přítomen akutní epileptický syndrom a kognitivní deficit nebo psychiatrické příznaky. Na těchto kazuistikách je možné vidět široké spektrum klinických příznaků, záchytu autoimunitních protilátek, nálezů na MR a v EEG.
Kazuistiky
Pacientka 1
Žena, 41 let, prodělala v prosinci 2012 parciální epileptický záchvat v zaměstnání, s poměrně rychlým rozvojem poruchy paměti. Asi čtyři týdny před záchvatem byla vyšetřována na interním oddělení nemocnice v místě bydliště pro „nechutenství“ a „ poruchy polykání“ bez zjištění morfologické či funkční příčiny. Po epileptickém záchvatu byla akutně vyšetřena počítačovou tomografií (CT) mozku s normálním nálezem. Provedenou LP byla zjištěna lymfocytární pleiocytóza. Pro suspekci na herpetickou encefalitidu byla přeložena na kliniku infekčního lékařství, kde byla léčena acyklovirem a ampicilinem. S akutním a velmi těžkým kognitivním deficitem, poruchami paměti spolu s nálezem střídavě bilaterálního iktálního nekonvulzívního fokálního theta rytmického vzorce v EEG nálezu byla s podezřením na AIE přeložena na neurologickou kliniku. Video-EEG monitoring zachytil specifický iktální záznam charakteru parciálního nekonvulzívního epileptického statu, byla přítomna vysokovoltážní theta/ delta rytmizující specifická abnormita s ostrou složkou z temporální oblasti zleva i zprava, v bdělosti převaha pravé strany, ve spánku z levé, na frekvenčně nepravidelném pozadí záznamu (obr. 1). Semiologicky se jednalo o parciální simplexní záchvaty s epigastrickými aurami charakteru pocitu stahování hrdla. Ve výsledcích LP vyloučena virová či bakteriální etiologie vč. polymerázové řetězové reakce (PCR), acyklovir byl vysazen a zaveden levetiracetam (LEVE) 500 mg dvakrát denně s dobrou klinickou odpovědí. Byla provedena kontrolní LP s výsledkem pozitivity protilátek anti-LG1. Nález MR mozku v únoru 2013 byl v normě. Kognitivní skríning prokázal deficit těžkého stupně (MMSE 16/ 30 bodů, ACE-R 58/ 100). Onkologický skríning byl negativní. Byla zahájena léčba metylprednizolonem intravenózně. Stav byl akutně komplikován rozvojem steroidního diabetes mellitus, s terapií inzulinem. Bylo provedeno pět výměnných plazmaferéz (PE). Došlo k regresi symptomatiky a kognitivního deficitu: v 3/ 2013 MMSE 28/ 30 bodů, ACE-R 78/ 100 bodů. Kontrolní EEG v březnu 2013 bylo s výrazným zlepšením. Pacientka byla dimitována na medikaci LEVE 1 000 mg pro die a piracetam 3 600 mg pro die. V dalším průběhu po šesti měsících od zahájení léčby při redukci a vysazení LEVE došlo k recidivě epigastrických příznaků, bez zachycení EEG interiktálního abnormního vzorce v nativním skalpovém vyšetření, LEVE byl opět navýšen a ponechán v dávce 1 000 mg/ den. Dále je pacientka kompenzovaná, terapii si nepřeje měnit.
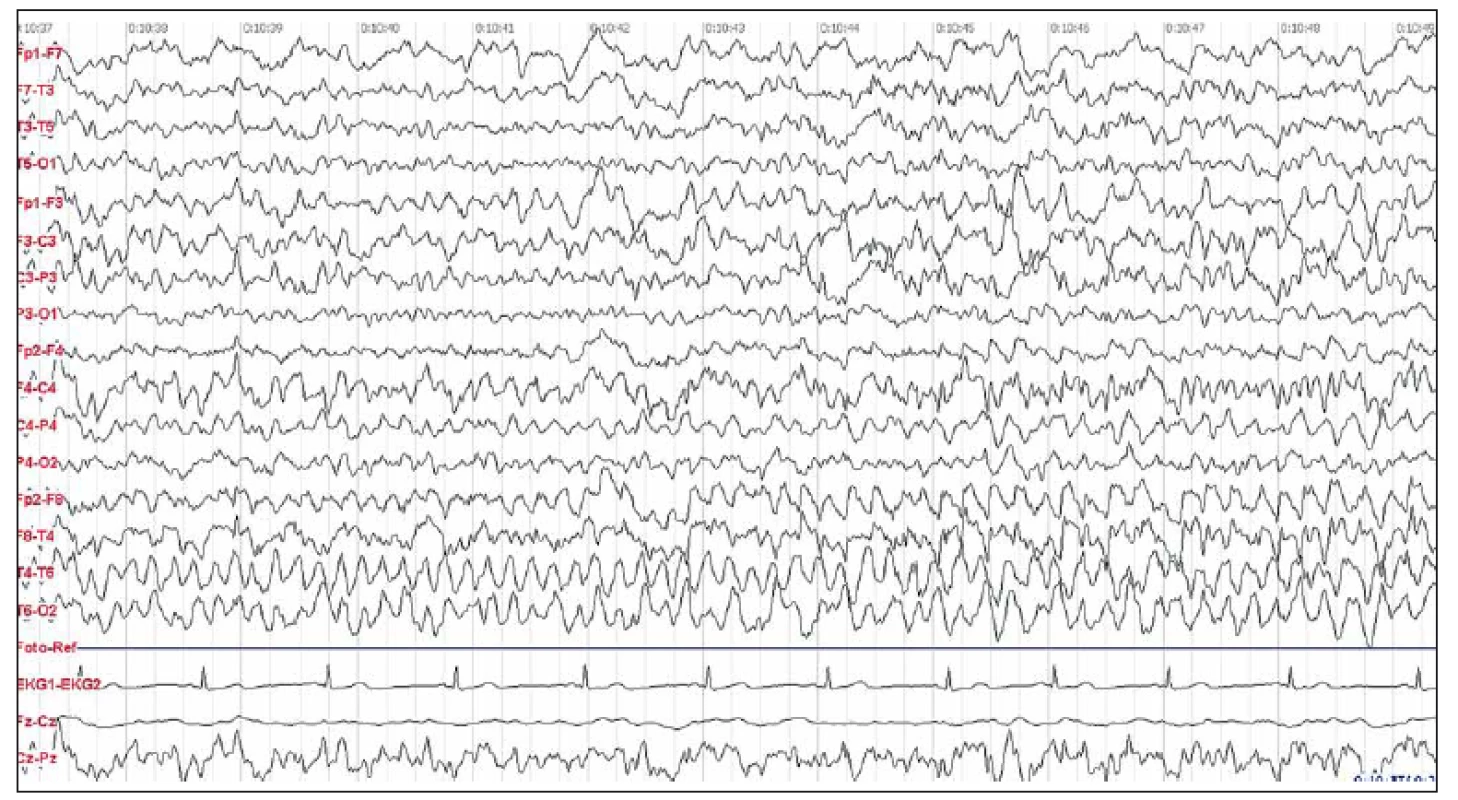
Pacientka 2
Žena, 54 let, u které se po respiračním infektu v zahraničí od začátku února 2011 rozvinuly změny osobnosti, poruchy afektivity a amentní stav. Následně prodělala generalizovaný epileptický záchvat. Na interiktálním elektroencefalogramu zachycena specifická aktivita frontotemporálně vlevo. Nasazen acyklovir, ale LP a MR mozku byly s normálními nálezy. S odstupem jednoho měsíce již bylo popsáno postižení limbických struktur v MR obraze. V akutním stavu byl aplikován bolus kortikoterapie, po kompletním vyšetření v zahraničí, vč. PET skenů, s diagnostikovaným primárním tumorem plic, byla tato terapie následně vysazena. Byla nasazena symptomatická antiepileptická medikace LEVE a fenytoin (PHE). V České republice následně plánováno došetření bronchoskopií a onkologická léčba. Pro akutní progresi psychiatrických symptomů, halucinace, agresi až obraz akutní organické psychózy byla nutná akutní hospitalizace v psychiatrické léčebně. Za příznaků zhoršení a epileptického stavu byla pacientka přeložena na anesteziologicko-resuscitační oddělení, dále pak přeložena na Neurologickou kliniku LF OU a FN Ostrava. V EEG bez iktálních epileptických grafoelementů. Následně PHE vysazen. Kontrolní LP prokazuje přítomnost pěti oligoklonálních pásů v likvoru, žádný v séru, bez pleiocytózy. Cytologií likvoru byly nalezeny ojedinělé plazmatické buňky nevylučující serózní zánět, testy na přítomnost onkoneurálních, membránových a synaptických protilátek (laboratoř Oxford) byly s negativním výsledkem. Na kontrolní MR mozku s odstupem dvou měsíců od začátku příznaků byl popsán stále nález bilaterální LE. Po extubaci přetrvávala dezorientace, psychoorganicita a halucinace. Byla indikována primární onkologická terapie. Imunoterapie typu výměnné plazmaferézy nebo aplikace imunoglobulinů nebyla indikována z důvodu nedostatečných informací o efektu této terapie a spíše převládání názoru o možnosti negativního vlivu na chování primárního tumoru. Kombinace chemoterapie s imunomodulační terapií není onkologicky indikována [16]. Pacientka byla po domluvě přeložena na kliniku plicních nemocí a tuberkulózy, kde se podrobila dolní levostranné lobektomii. Histologicky byl verifikován malobuněčný karcinom plic. Následně absolvovala první cyklus chemoterapie etoposidem a cisplatinou. V klinickém obrazu přetrvával kognitivní deficit. Pro následnou recidivu epileptického záchvatu jsme doporučili navýšení LEVE na 2000 mg pro die s dobrým efektem. V závěru propuštěna do domácí a ambulantní léčebné péče. Na doporučený druhý cyklus chemoterapie se nedostavila pro celkově zhoršující se stav (redukce hmotnosti, celková slabost) a následně v srpnu 2012 doma zemřela.
Pacientka 3
Žena, 36 let, v období hormonální stimulační léčby pro neplodnost měla od července 2010 progredující výpadky paměti a byla po generalizovaném epileptickém záchvatu hospitalizována na neurologii v místě bydliště. EEG záznam s difuzně zpomalenou aktivitou do pásma theta/ delta, MR mozku popisuje mnohočetná ložiska v oblasti limbického systému a obou kapsul (obr. 2). V likvoru byla popsána lymfocytární pleiocytóza. Byla vyslovena suspekce na LE. Kortikoterapií a intravenózně podaným valproátem (VAL) s převodem na perorální formu se stav stabilizoval. Kortikoterapie byla následně vysazena. S odstupem čtyř měsíců v prosinci 2010 došlo ke zhoršení stavu. Pacientka byla hospitalizována na Neurologické klinice LF OU a FN Ostrava v únoru 2011, v kontrolní LP nález lymfocytární pleiocytózy. Na kontrolní MR mozku nález již těžké atrofie amygdalohipokampálního komplexu bilaterálně (obr. 3). Klinicky výrazně bradypsychická, s poruchou krátkodobé paměti, MMSE 24/ 30. V EEG záznamu zachycena abnormní frekvenční labilita se sporadickým zpomalováním fronto-temporo-parietálně bilaterálně. Zjištěna elevace onkologického markeru CA125 a elevace thymidinkinázy. Gynekologické vyšetření v normě; PET negativní. Onkoneurální protilátky a protilátky proti membránovým a synaptickým antigenům negativní (laboratoř Oxford). Klinicky progrese do obrazu kvadrupyramidové symptomatologie a těžkého kognitivního deficitu. Pro akutní respirační selhání nutná intubace a později tracheostomie. Provedena třikrát PE se zlepšením vigility. Stav nicméně i nadále progredoval, opakovaně komplikace sepsemi, které se staly důvodem úmrtí srpnu 2011. Proběhla zdravotní pitva se závěrem: 37letá žena s klinicky udávanou LE v oblasti kapsuly a limbického systému mozku, se stavem po opakovaných bronchopneumoniích a opakovaných septických stavech, zmírá na sepsi. Histopatologický nález CNS popisuje: mozková tkáň z oblasti limbického systému se známkami perivaskulárního i pericelulárního edému, místy perivazálně s prořídnutím mozkové tkáně, pod ependymem a kolem cév se nachází výrazně nahloučená corpora amylacea, ojediněle perivazálně přítomny zrnéčkové buňky s pigmentem, a místy dochází k perivazálnímu zmnožení mikroglií. V periferních kapilárách místy známky leukostázy. Mykotické hyfy nebyly prokázány. Tyto změny odpovídají degenerativnímu obrazu atrofie.
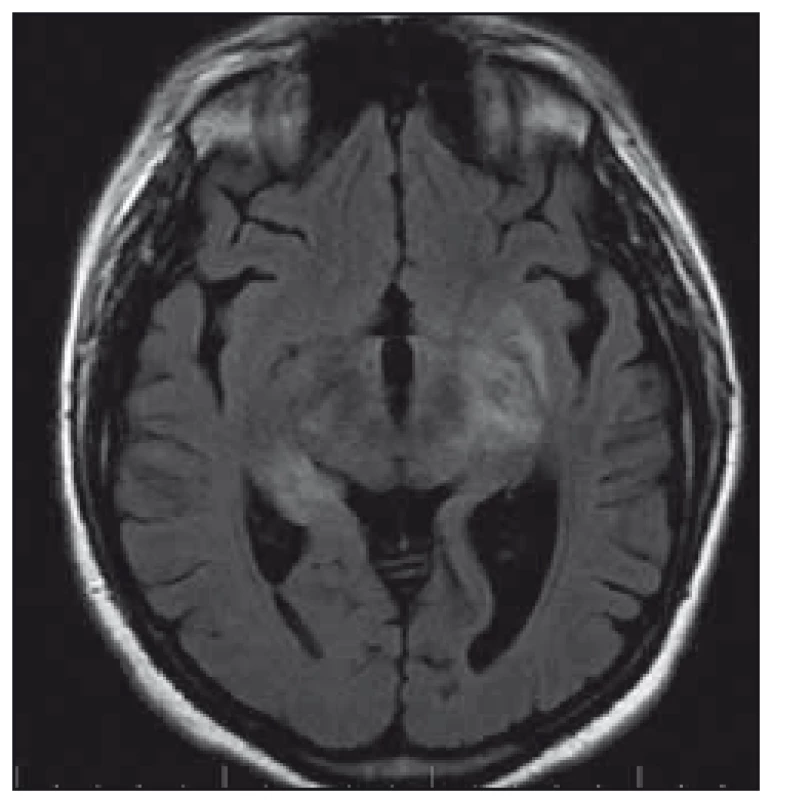
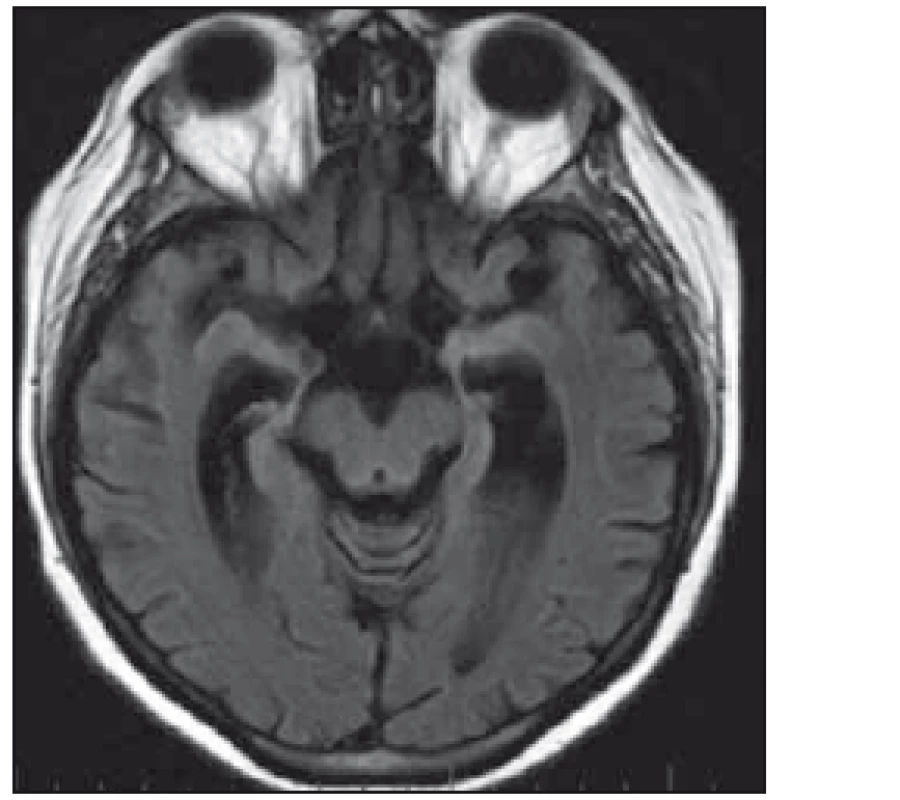
Pacientka 4
Popisujeme 17letou ženu s anamnézou profylaktického užití meflochinu a postvakcinační reakcí (žlutá zimnice) s febriliemi v předchorobí v prosinci 2012. V zahraničí (Afrika) došlo ke vzniku opakovaných epileptických záchvatů, s klonickými záškuby levostranných končetin a následně afektivním raptem, které vedly k akutní hospitalizaci a vyšetření CT mozku v zemi pobytu. Morfologicky bez patologie, léčena dexametazonem a benzodiazepiny intravenózně, stav zlepšen. Následně po návratu do České republiky rozvoj neuropsychiatrických symptomů, zrakové pseudohalucinace, porucha řeči, agresivita a těžká insomnie. Pacientka byla začátkem roku 2013 s obrazem akutní katatonie hospitalizována na psychiatrickém oddělení. MR mozku byla v normě. Nasazena neuroleptika, opakovaně elektrokonvulzivní terapie, uzavřeno jako akutní psychóza s katatonií. Po podání benzodiazepinů zlepšen spánek. V akutním stavu bylo provedeno neurologické konziliární vyšetření s indikací k provedení LP, z důvodu zlepšení celkového stavu ale nebylo provedeno, dimitována. Pokračovala ve školní docházce, s výrazně zhoršeným prospěchem proti předchorobí. Po osmi měsících došlo k recidivě epileptického paroxyzmu, opět s následnou výraznou poruchou řeči, ale také dysgrafie, dyskalkulie a dyslexie. EEG vyšetření s typickým obrazem tzv. extreme delta brushes vln s převahou vlevo (obr. 4). Nasazen lacosamid (LCM) 300 mg pro die, před dosažením optimální účinné dávky byla pro progresi parciálních epileptických záchvatů s komplexní symptomatologií akutně hospitalizována na jednotce intenzivní péče a do terapie přidán krátce venózní VAL 1 000 mg pro die. Provedena LP s nálezem sedmi oligoklonálních pásů v likvoru a čtyř v séru svědčící pro velmi lehkou intratékální syntézu oligoklonálního IgG. Prokázána diskretní syntéza volných lehkých řetězců, výhradně typu kappa a byla prokázána pozitivita anti-NMDAR protilátek. Zahájili jsme imunoterapii metylprednizolonem intravenózně (celkově 4,5 g) a sérií pěti PE s dobrým klinickým efektem, zejména byla pozorována zlepšená expresivní složka poruchy řeči s fluentnějším projevem. V ambulantní péči jsme pokračovali intravenózní aplikací imunoglobuliny šestkrát co měsíc v celkové dávce 60 g. Dávka byla vzhledem k hmotnosti snížena, nicméně stav se nadále lepšil a stabilizoval. V kontrolní LP byl konstatován pokles až negativita titru anti-NMDAr protilátek. Oligoklonální pásy a protilátky negativní, reziduálně dva lehké řetezce kappa, bez jednoznačné klinické interpretace zánětlivého onemocnění CNS. V kontrolním EEG jsme popsali výboje specifické aktivity typu hrot–vlna (SW) temporálně bilaterálně, byla také pozorována paroxyzmální delta aktivita s převahou vlevo. Onkologický skríning je i nadále negativní, PET CT vyšetření popisuje při negativitě MR mozku patologický nález v oblasti CNS, charakteru rozdílného metabolizmu bazálních ganglií (hyper) a mozkové kůry (hypo) při vzájemném srovnání, s obtížnou interpretací klinického významu z důvodu dlouhodobého trvání od začátku onemocnění. Nádorové ložisko v organizmu nebylo identifikováno a teratom ovaria je dosud negativní (MR pánve). Došlo ke zlepšení klinického stavu za přispění soustavné neurologické a logopedické péče, zlepšila si prospěch ve škole, postupně jsme pozorovali lepšení EEG nálezu. Doporučili jsme postupné vysazení antiepileptické léčby (AED) a následně redukování a vysazení kortikoterapie. LCM pacientka užívala do konce roku 2015, kortikoterapie k březnu 2016 vysazována. Dynamika změn titrů protilátek v likvoru jistě může pomoci v rozhodování o stabilitě onemocnění, interpretace jejich případné přítomnosti může vést k diskuzi o vedení, délce a dávkování terapie.
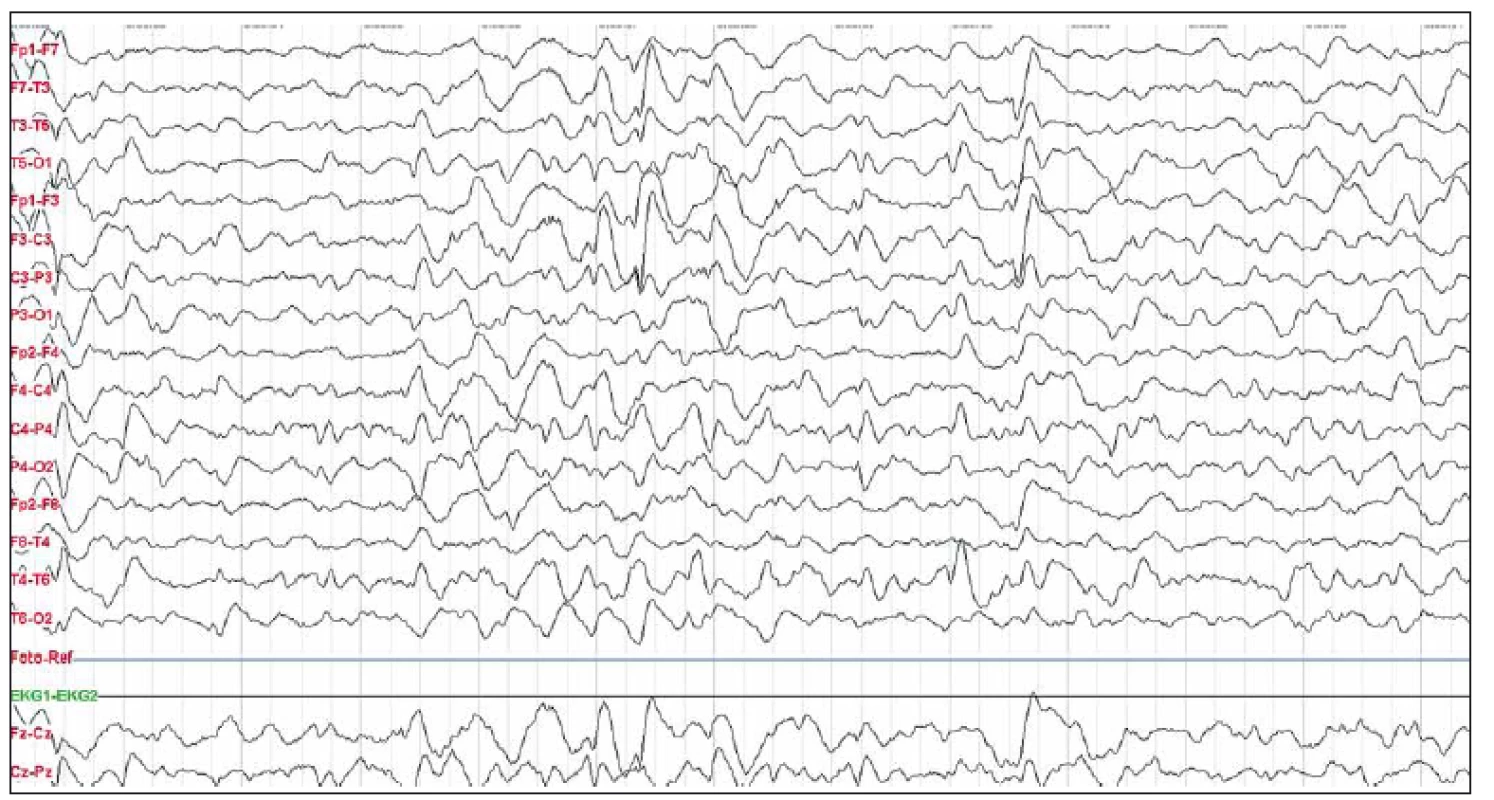
Pacientka 5
Žena, 66 let, léčena opiáty pro chronický vertebrogenní algický syndrom po operaci bederní páteře (failed back surgery syndrome) s náhlým rozvojem malátnosti a zhoršením řeči. Na EEG je přítomna pomalá delta aktivita a areaktivní pozadí. CT mozku neprokazuje ložiskové změny. Odmítání perorálního příjmu vedlo k dehydrataci s projevy intoxikace opiáty, uremie, myoglobinemie, hodnoceno jako akutní renální selhání při rhabdomyolýze. Po rehydrataci se stav zlepšil. Následně ale nastal rozvoj tonicko-klonických epileptických záchvatů, centrální pravostranné hemiparézy s progresí psychoorganicity. Nasazen VAL a acyklovir pro suspekci na herpetickou encefalitidu. Provedena LP s normálním nálezem. Na kontrolním EEG byla vyjádřena intermitentní rytmická delta aktivita. Na MR mozku 31. den od začátku příznaků bylo vyjádřeno rozsáhlé téměř difuzní postižení bílé hmoty, diferenciálně diagnosticky jsme pomýšleli na progresivní multifokální leukoencefalitidu (PML). Vyšetření PCR na JC virus bylo negativní. Podezření na AIE vedlo k zahájení kortikoterapie, bylo podáno celkově 3,5 g metylprednizolonu. Skríning dobře charakterizovaných onkoneurálních protilátek a protilátek proti synaptickým a membránovým antigenům byl negativní. Klinicky došlo k progresi psychoorganicity, poruchy řeči a komunikace (až obraz globální afázie), kolísání vědomí, nestabilních projevů emocí a paranoii. Rozvoj pseudochabé kvadruplegie a příznaky vegetativní dysautonomie. Selhání peristaltiky, byla zavedena nazogastrická sonda. Po terapii sérií pěti PE bylo konstatováno zlepšení kognitivních a emočních funkcí, pacientka začala slovně intermitentně srozumitelně komunikovat. V dalším průběhu došlo k mírné regresi motorického deficitu s přetrváváním těžké levostranné hemiparézy a inhibičním organickým psychosyndromem; MMSE 23/ 30 bodů. Přeložena na neurologické oddělení v místě bydliště, k rehabilitaci a následně do domácí péče, kde stav nadále neměnný, bez recidivy epileptického záchvatu, ponechána na medikaci VAL 2 × 500 mg denně. Při překladu ponechána dávka prednizonu 20 mg tbl. v dávce 60 mg denně s doporučením postupné redukce. Bylo vysazeno po zjištění negativity protilátek sdružených s AIE. Klinicky by tato pacientka odpovídala anti-NMDAr typu onemocnění, nicméně morfologicky dle MR nálezu by spíše vedla k diagnóze AIE s nálezem postižení i extralimbických struktur. O rehospitalizaci jsme nebyli ošetřujícím neurologem z místa bydliště požádáni a biopsie mozku pro věk a finální stabilitu stavu nebyla indikována. Výsledky pozorování jsou uvedeny v tab. 2.
Diskuze
Sdělení popisuje pět pacientek, u kterých jsme z klinického obrazu a dalších pomocných vyšetření usoudili, že se jedná o AIE, i když identifikace autoimunitní protilátky nebyla vždy možná. Aktuální spektrum dle dostupné nabídky certifikovaných laboratoří zahrnuje panel protilátek proti membránovým a synaptickým antigenům metodou nepřímé imunofluorescence (anti-NMDAR, anti-AMPAR1, anti-AMPAR2, anti-GABABR, anti-LG1, anti-caspr-2) a protilátek anti-NMDAR metodou nepřímé fluorescence, s možností konfirmovat vyšetření v zahraničí. Panel dobře charakterizovaných onkoneurálních (paraneoplastických) protilátek zahrnuje anti-Hu, anti-Yo, anti-Ri, anti-Ma2/ Ta, anti-CV2/ CRMP5, anti-amfifyzin metodou Western blot a nepřímou imunofluorescencí a vyšetření anti-GAD protilátek a anti-TPO. Lze předpokládat, že u pacientů negativních dle tohoto spektra jde o proces způsobený doposud neidentifikovanými protilátkami nebo v tomto případě není protilátkami zprostředkovaná imunitní reakce dominantní. V terapii jsme postupovali dle dostupných literárních údajů: v první linii pulzy metylprednizolonu intravenózně a sérií PE, případně podáváním intravenózních imunoglobulinů. K uváděné ad-on terapii (cyklofosfamid, rituximab) jsme ani v jednom případě nepřistoupili. O ukončení terapie by mělo pomoci rozhodnout kontrolní vyšetření likvoru s posouzením dynamiky změn či konstatování snižování titru či negativity protilátek [15]. Onemocnění není vázáno na pohlaví a věk, jinými autory již byli popsáni nemocní muži i děti [17,18]. Na průběh nemoci, jak uvádí dostupná literatura, může mít vliv premorbidní stav a komorbidity pacienta, přítomnost a typ autoprotilátky, délka trvání nemoci, doba od prvních příznaků po zahájení imunoterapie, přítomnost okultního tumoru nebo titr protilátek [17]. U pacientky 1 a pacientky 4 došlo k dobré regresi nemoci. U pacientky 5 s netypickým víceložiskovým postižením bílé hmoty v MR obraze a s popisovanou klinikou epileptických záchvatů a alterací psychického stavu jsme se setkali s příznivým efektem imunitní terapie, bez průkazu přítomnosti protilátek autoimunitního typu. MR obraz může být ale v úvodu vzniku příznaků či během terapie normální [18]. V případě pacientky 4 byla imunoterapie zahájena až v odstupu osmi měsíců od prvních příznaků v důsledku iniciálně stanovené psychiatrické diagnózy (akutní psychóza), ale i přesto po stanovení diagnózy anti-NMDAR encefalitidy a zahájení imunoterapie a terapie antikonvulzivy došlo k regresi nemoci, s možností terapii postupně redukovat a vysadit. U této pacientky je pravidelně co 12 měsíců prováděna MR pánve v rámci skríningu teratomu ovarií se zatím negativními výsledky. Ve dvou případech došlo k úmrtí pacientek. U pacientky 2 došlo k úmrtí v důsledku primárního tumoru plic. V literatuře nenacházíme jednoznačná data k indikaci imunoterapie do všeobecného léčebného doporučení, ale jistě je možné individuálně zvážit tuto terapii dle aktuálního stavu a prognózy. Nelze ji ale kombinovat s chemoterapií [16]. Pacientka 3 zemřela po 13 měsících od prvních příznaků s klinickým obrazem finálně areaktivního kómatu a umělé plicní ventilace, se selháním oběhu a dechu, podloženým těžkou oboustrannou atrofií limbických struktur bez průkazu specifických protilátek, a to ani konfirmačním testem. Ani při intenzivní imunoterapii první linie nedošlo ke zlepšení stavu a pro celkově špatný stav se sepsí jsme k terapii druhé linie nepřistoupili. Dvě pacientky (1 a 5) jsou nadále léčeny antikonvulzivy. Pacientka 3 (anti-NMDAR pozitivita) byla recentně z AED vysazena a kortikoterapie redukována s cílem vysazení. Epileptické záchvaty mohou být považovány za symptomatické, tudíž s dobrou prognózou k odeznění po stabilizaci primárního autoimunitního zánětlivého onemocnění, nicméně klinická zkušenost nás vede k obezřetnosti a jistě nelze vyloučit ani rozvoj sekundární epilepsie v důsledku trvalých změn limbické oblasti. V čase se budeme jistě muset při bližším studiu těchto jednotek také vyjadřovat k reaktivitě na terapii, jak imunologické, tak antikonvulzivní a z epileptologického hlediska případně posuzování farmakorezistence.
Závěr
Pacienti s akutním vznikem záchvatů sdružených s rozvojem kognitivního deficitu a psychických změn by měli být směřováni preferenčně k neurologickému vyšetření, k EEG, k analýze likvoru vč. odběru vzorku na vyšetření dobře charakterizovaných onkoneurálních protilátek, panelu protilátek proti membránovým a synaptickým antigenům, a k MR mozku. Imunoterapie (aplikace metylprednizolonu, výměnných plazmaferéz či IVIG) by měla být zahájena neprodleně po stanovení hypotézy autoimunitní (limbické, extralimbické) či anti-NMDAr encefalitidy. Negativní výsledek vyšetření likvoru autoimunitní zánět mozku nevylučuje. Při paraneoplastickém postižení je primární terapií hledání a odstranění nádorového ložiska a onkologická léčba. Multioborová klinická spolupráce neurologů, infektologů a psychiatrů je nezbytná.
Seznam použitých zkratek
AED – antiepileptická léčba
AIE – autoimunitní encefalitida
ACE-R – Addenbrooke’s Cognitive Examination
anti-GABAB – protilátky proti collapsing response mediator protein 5
anti-LG1 – protilátky proti leucin-rich glioma inactivated protein 1
anti-NMDAR – protilátky proti N-metyl-D-aspartát glutamátovým receptorům
anti-VGKC – protilátky proti komplexu napěťově řízených draslíkových kanálů
CT – počítačová tomografie
EEG – elektroencefalografie
FDG-PET – pozitronová emisní tomografie s využitím 18fluoro-deoxyglukózy
FLAIR – Fluid-Attenuated Inversion Recovery
FTP – fronto-temporo-parietálně
GAD – dekarboxyláza kyseliny gamma-aminomáselné
IDR – intermitentní delta aktivita
IVIG – intravenózní globulin
LCM – lacosamid
LE – limbická encefalitida
LEVE – levetiracetam
LP – lumbální punkce
MMSE – Mini-Mental State Examination
MR – magnetická rezonance
MRA – magnetická rezonance s angiografií
NAIM – non-vaskulární autoimunitní zánětlivá meningoencefalitida
NPLE – neparaneoplastická limbická encefalitida
PCR – polymerázová řetězová reakce
PE – plazmaferéza
PHE – fenytoin
PLE – paraneoplastická limbická encefalitida
PML – progresivní multifokální leukoencefalitida
SCLC – malobuněčný karcinom plic
VAL – valproát
Děkujeme všem, kteří se podíleli na této práci: MU Dr. Janě Slonkové za odbornou konzultaci a poskytnutí elektroencefalografických záznamů, pracovišti Radiodiagnostického ústavu (Pracoviště magnetické rezonance FN Ostrava) za poskytnutí MR snímků. Za poskytnutí podrobného histologického nálezu limbického systému děkuji doc. MU Dr. Janě Dvořáčkové, Ph.D., přednostce Ústavu patologie FN Ostrava.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Veronika Jakubčiaková
Neurologická klinika
LF OU a FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: veronika.jakubciakova@fno.cz
Přijato k recenzi: 28. 1. 2016
Přijato do tisku: 21. 3. 2016
Zdroje
1. Brierley JB, Corsellis JA, Hierons R, et al. Subacute encephalitis of later adult life mainly affecting the limbic areas. Brain 1960;83:357– 68.
2. Krýsl D, Marušič P. Autoimunitní limbické encefalitidy. Neurol Praxi 2012;13(3):160– 4.
3. Vincent A, Bien CG, Irani SR, et al. Autoantibodies associated with diseases of the CNS: new developments and future challenges. Lancet Neurol 2011;10(8):759– 72. doi: 10.1016/ S1474-4422(11)70096-5.
4. Anderson NE, Barber PA. Limbic encephalitis – a review. J Clin Neurosci 2008;15(9):961– 71. doi: 10.1016/ j.jocn.2007.12.003.
5. Bien CG, Elger CE. Limbic encephalitis: a cause of temporal lobe epilepsy with onset in adult life. Epilepsy Behav 2007;10(4):529– 38.
6. Gultekin SH, Rosenfeld MR, Voltz R, et al. Paraneoplastic limbic encephalitis: neurological symptoms, immunological findings and tumour association in 50 patients. Brain 2000;123(7):1481– 94.
7. Lawn ND, Westmoreland BF, Kiely MJ, et al. Clinical, magnetic resonance imaging, and electroencephalographic findings in paraneoplastic limbic encephalitis. Mayo Clin Proc 2003;78(11):1363– 8.
8. Lancaster E, Lai M, Peng X, et al. Antibodies to the GABAB receptor in limbic encephalitis with seizures: case series and characterisation of the antigen. Lancet Neurol 2010;9(1):67– 76.
9. Paterson RW, Zandi MS, Armstrong R, et al. Clinical relevance of positive voltage-gated potassium channel (VGKC)-complex antibodies: experience from a tertiary referral centre. J Neurol Neurosurg Psychiatry 2014;85(6):625– 30. doi: 10.1016/ S1474-4422(09)70324-2.
10. Vincent A, Buckley C, Schott JM, et al. Potassium channel antobody-associated encephalopathy: a potentially immunotheraphy-responsive form of limbic encephalitis. Brain 2004;127(3):701– 12.
11. Wandinger KP, Saschenbrecker S, Stoecker W, et al. Anti-NMDA-receptor encephalitis: a severe, multistage, treatable disorder presenting with psychosis. J Neuroimmunol 2011;231(1– 2):86– 91. doi: 10.1016/ j.jneuroim.2010.09.012.
12. Hirsch LJ, Schmitt SE, Friedman D, et al. Extreme delta brush: a unique EEG pattern in adults with anti-NMDA receptor encephalitis. Neurology 2012;79(11):1094– 100. doi: 10.1212/ WNL.0b013e3182698cd8.
13. Psimaras D, Carpentier AF, Rossi C. Cerebrospinal fluid study in paraneoplastic syndromes. J Neurol Neurosurg Psychiatry 2010;81(1):42– 5. doi: 10.1136/ jnnp.2008.159483.
14. Stourac P, Kadanka Z, Palyza V. Paraneoplastic neurological syndromes – patient’s cohort profile in Czech Republic. Acta Neurol Scand 2001;104(2):72– 7.
15. Krýsl D, Elišák M. Autoimunitní encefalitidy. Cesk Slov Neurol N 2015;78/ 111(1):7– 23. doi: 10.14735/ amcsnn20157.
16. Lewerenz J, Frank L. Paraneoplastic neurological syndromes. Cerebrospinal fluid in clinical neurology. Cham: Springer International Publishing 2015:353– 85.
17. Elišák M, Krýsl M. Neurologické syndromy sdružené s protilátkami proti membránovým a synaptickým antigenům. Cesk Slov Neurol N 2015;78/ 111(4):453– 8. doi: 10.14735/ amcsnn2015453.
18. Libá Z, Hanzalová J, Sebroňová V, et al. Anti-N-metyl-D-aspartát receptorová encefalitida. Cesk Slov Neurol N 2014;77/ 110(5):624– 30. doi: 10.14735/ amcsnn2014 624.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2016 Číslo 6
Nejčtenější v tomto čísle
- Přední osteofyty krční páteře způsobující polykací a dechové potíže – dvě kazuistiky
- Deprese u vybraných neurologických onemocnění
- Autoimunitní encefalitidy – kazuistiky
- Chirurgická liečba rozsiahlej fibróznej dysplázie v kraniofaciálnej oblasti – kazuistika
