Použití optické koherenční tomografie u roztroušené sklerózy
The Use of Optical Coherence Tomography in Multiple Sclerosis
Optical coherence tomography is fast, non-invasive and reproducible imaging technique that provides detailed measurements of retinal structures. Retinal pathology in multiple sclerosis (MS) includes consequences of optic neuritis as well as diffuse degenerative changes. Thinning of retinal nerve fiber layer, decrease in total macular volume and loss of retinal ganglion cell layer correlate with visual acuity, brain atrophy measures and cognitive changes. Anterior visual pathway became a model of neuroaxonal injury in MS and is used to test neuroprotective effects of new therapies. The paper provides an overview of the physics of optical coherence tomography and its application in MS.
Key words:
optical coherence tomography – multiple sclerosis – retinal nerve fibre layer – total macular volume
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
V. Matušková 1; J. Lízrová Preiningerová 2; D. Vysloužilová 1; M. Michalec 1; Z. Kasl 3; E. Vlková 1
Působiště autorů:
Oční klinika LF MU a FN Brno
1; Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
2; Oční klinika LF UK a FN Plzeň
3
Vyšlo v časopise:
Cesk Slov Neurol N 2016; 79/112(1): 33-40
Kategorie:
Přehledný referát
doi:
https://doi.org/10.14735/amcsnn201633
Souhrn
Optická koherenční tomografie je bezkontaktní, rychlá a dobře reprodukovatelná zobrazovací metoda, jejíž pomocí získáváme detailní obraz struktury sítnice. Patologické změny na sítnici v souvislosti s roztroušenou sklerózou (RS) zahrnují jak následky zánětu očního nervu, tak i odraz difuzních neurodegenerativních změn. Úbytek vrstvy retinálních nervových vláken, atrofie makuly a specifické ubývání vrstvy gangliových buněk korelují se změnou zrakové ostrosti, s atrofií mozku a s kognitivními změnami u pacientů s RS. Přední část zrakové dráhy se stala modelem neuroaxonálního poškození u RS a začíná být využívána k monitoraci progrese RS a k testování neuroprotektivního účinku léků. Článek shrnuje principy optické koherenční tomografie a jejího použití u RS.
Klíčová slova:
optická koherenční tomografie – roztroušená skleróza – tloušťka nervových vláken – celkový objem makuly
Úvod
Roztroušená skleróza (RS) je chronické autoimunitní onemocnění centrálního nervového systému. Je jedním z nejčastějších důvodů nevratného neurologického postižení u mladých lidí. V České republice touto nemocí trpí až 16 000 pacientů [1]. Postižení zrakových funkcí v různých formách je přítomno u 80 % pacientů s RS. Optická neuritida (ON) je první příznak RS u 15 % pacientů a v průběhu onemocnění se vyskytne až u 50 % pacientů [2]. Při post mortem analýze byly demyelinizační plaky ve zrakovém nervu objeveny u 94– 99 % pacientů s RS [3]. Také vizuální evokované potenciály (VEP), které až donedávna byly jedinou možnou vyšetřovací metodou poskytující informace o integritě zrakové dráhy, svědčí o subklinickém postižení zrakové dráhy až u 70– 80 % pacientů s RS [4].
Zobrazovací metody sítnice, v níž se odráží patologie mnohých degenerativních, metabolických, cévních i neurologických onemocnění [5], dosáhly v posledním desetiletí významného pokroku a vyšetření optickou koherenční tomografií (OCT) se stalo běžnou součástí vyšetření oka i u pacientů s RS.
Cílem tohoto článku je představit OCT jako novou zobrazovací metodu v oboru neurologie a shrnout možnosti použití OCT k diagnostickým a výzkumným účelům v oboru RS.
Princip OCT
OCT je bezkontaktní, rychlá a dobře reprodukovatelná zobrazovací metoda, jejíž pomocí získáváme detailní obraz struktury sítnice [5]. OCT je někdy také pro dokonalost zobrazení nadneseně nazývána in vivo histologie sítnice [6].
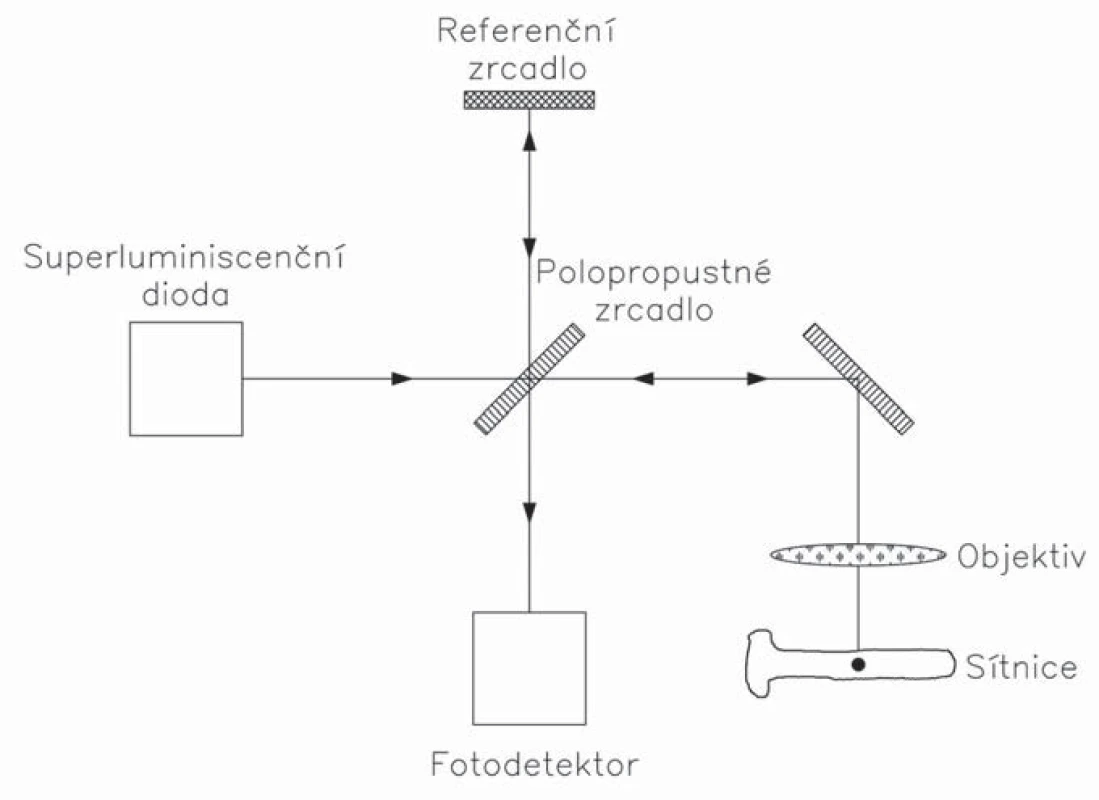
OCT pracuje na principu nízkokoherenční interferometrie [7]. Využívá elektromagnetické záření z oblasti infračerveného světla, nejčastěji nad 800 nm. Průnik světla do tkání závisí na vlnové délce – čím je delší, tím světlo proniká hlouběji. Laserový paprsek je vyslán superluminiscenční diodou, následně je na polopropustném zrcadle rozdělen na dva paprsky. Jeden z nich je vyslán proti sítnici a odražené světlo je zachyceno detektorem. Druhý paprsek je referenční, má určitou vlnovou délku a je známa vzdálenost, kterou urazí. Podle rozdílu mezi optickými drahami dochází k fázovému posunu odražených paprsků. U „time domain“ OCT (TD-OCT) je prostorové skenování umožněno mechanickým pohybem referenčního zrcadla (obr. 1). U novější generace „spectral domain“ přístrojů (SD-OCT) interferující paprsek dopadá na difrakční mřížku, kde se paprsek rozloží na frekvenční spektrum, které je snímáno spektrometrem. Prostorová informace je potom odvozena z Fourierovy transformace výstupního spektra. Tento systém zvýšil počet získaných skenů ze 400 skenů za sekundu u TD-OCT na 18 000– 50 000 skenů za sekundu u SD-OCT. Díky vysoké vzorkovací frekvenci SD-OCT jsou minimalizovány artefakty, které vznikají při pohybech oka. Některé přístroje navíc využívají při skenování systém eye trackingu. Přístroj tak monitoruje pohyb sítnice, resp. několika konkrétních struktur a snímá data jen v okamžiku, kdy je sítnice v požadované pozici.
Pro dobrou reprodukovatelnost jednotlivých měření musí být sken dobře centrován na papilu zrakového nervu nebo foveu a při následných kontrolách musí být umístěn na sítnici ve stejné pozici jako první, tzv. referenční sken. Data musí být snímána ve vysoké kvalitě (tzv. signal-to-noise ratio), obvykle více než 20 dB [8,9]. Měření může být zkresleno věkem, refrakční vadou nebo axiální délkou bulbu [10]. Neprůhlednost optických médií (pokročilý šedý zákal či zákal sklivce), neschopnost pacienta sledovat fixační bod (závažné postižení žluté skvrny) či neovladatelné mimovolné pohyby pacienta limitují možnost vyšetření OCT.
RNFL a TMV
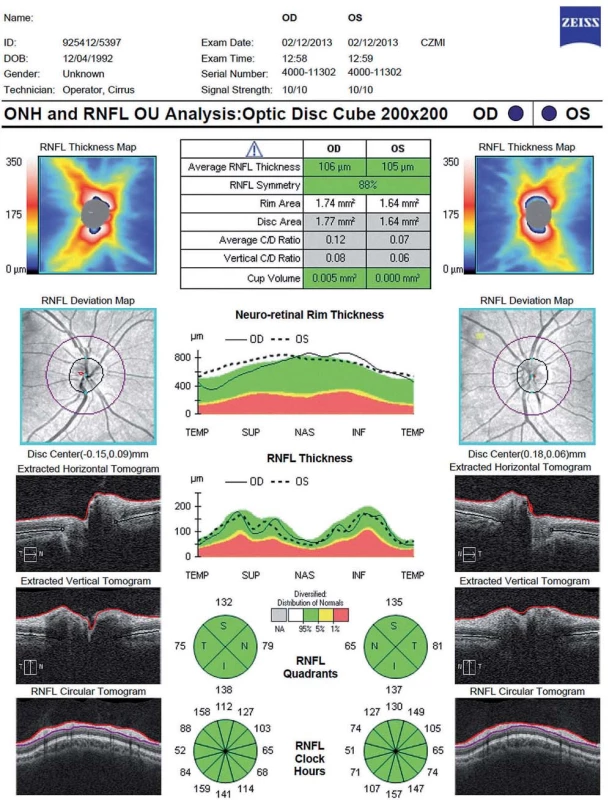
První parametr, který se začal sledovat u pacientů s RS, je tloušťka vrstvy nervových vláken (Retinal Nerve Fibre Layer; RNFL) v peripapilární oblasti. Tato vrstva se nachází mezi vnitřní limitující membránou a vrstvou jader gangliových buněk. Obsahuje převážně axony gangliových buněk, které nejsou obaleny myelinem až do jejich průchodu skrz lamina cribrosa. Při prvním snímání je kružnice o průměru 3,45 mm vyšetřujícím manuálně centrována na střed papily zrakového nervu [11]. Tloušťka RNFL je graficky zpracována ve formě linie umístěné na barevně kódovaném pozadí znázorňujícím normu pro daný věk a pohlaví. Hodnocení je prováděno v jednotlivých částech kružnice, buď ve 12 segmentech, jeden odpovídá 15 stupňům, nebo jednotlivých kvadrantech (S – superior, N – nasal, I – inferior, T – temporal) (obr. 2).
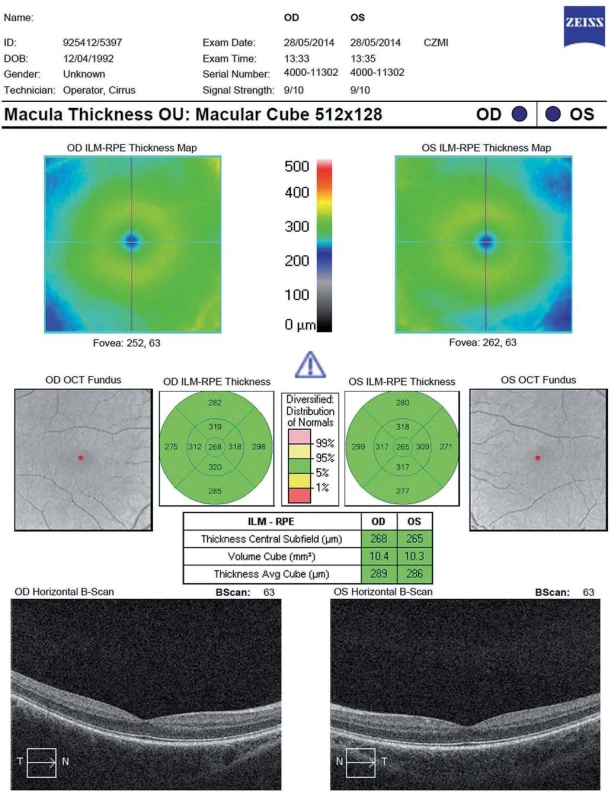
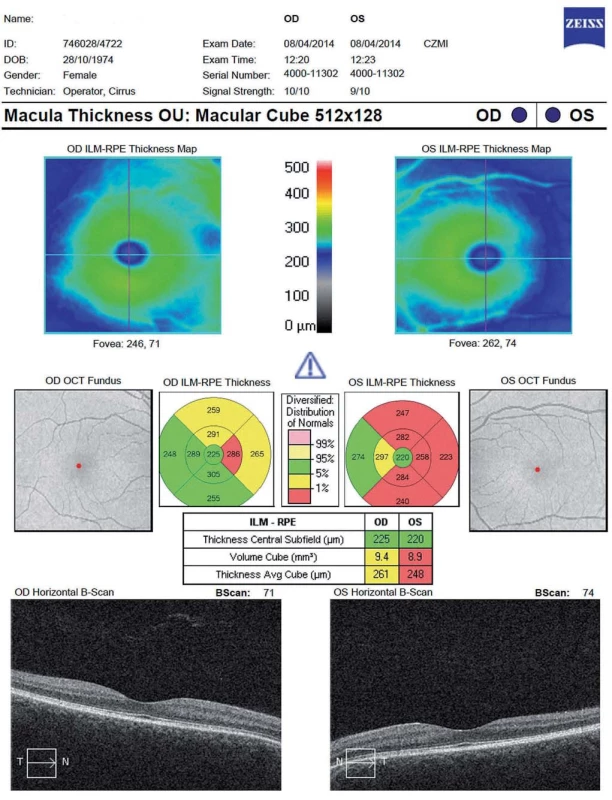
Další měřený parametr je celkový objem makuly (Total Macular Volume; TMV). Trojrozměrný obraz makuly je tvořen sérií horizontálních či vertikálních řezů. TMV se kvantifikuje v kruhu o průměru 6 mm centrovaném na foveu a zahrnuje všechny vrstvy sítnice od vnitřní limitující membrány až po retinální pigmentový epitel (obr. 3). Mnohé SD-OCT přístroje umožňují segmentaci až 10 vrstev sítnice (vnitřní limitující membrána, vrstva nervových vláken, vrstva gangliových buněk, vnitřní plexiformní vrstva, vnitřní nukleární vrstva, zevní plexiformní vrstva, zevní jaderná vrstva, zevní limitující membrána, vrstva fotoreceptorů a retinální pigmentový epitel (obr. 4). TMV dává nepřímou informaci o ztrátě gangliových buněk, případně dalších vrstev. Rozpoznání změn v jednotlivých strukturách sítnice je důležité po přesnější pochopení patogeneze onemocnění.
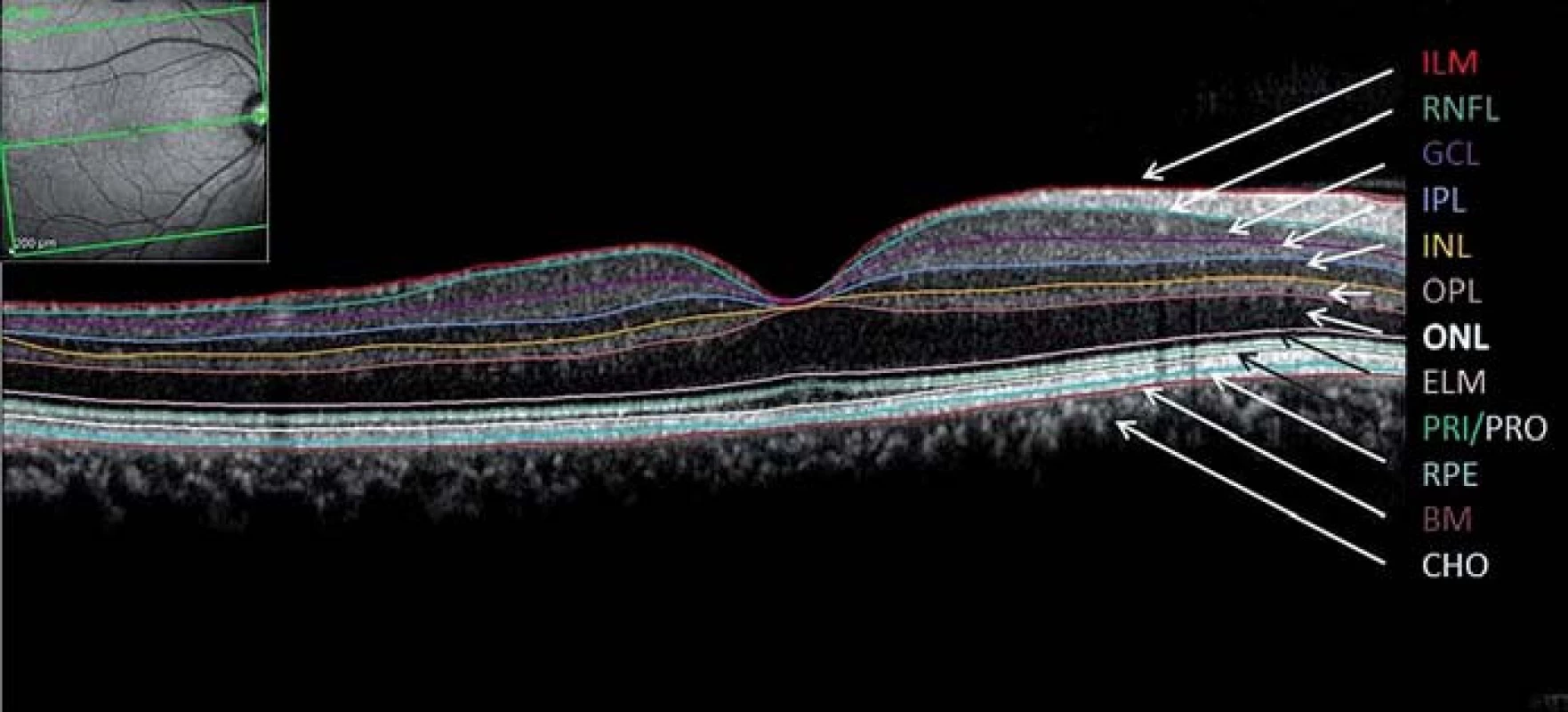
Při popisu jednotlivých OCT skenů využíváme kvalitativní a kvantitativní analýzu [12]. Kvalitativní analýza posuzuje morfologii jednotlivých složek sítnice. Naměřená latence odrazů paprsků je barevně kódována a následně je zkonstruován dvojrozměrný obraz průřezu tkání. Barevná mutace výsledného obrazu slouží k jednodušší diferenciaci jednotlivých vrstev sítnice. Vysoce reflektující tkáně (retinální pigmentový epitel, jadrové vrstvy) se zobrazují červeně až bíle, naopak tkáně s nízkou mírou odrazu paprsku nebo tekutina jsou zobrazeny modře až černě. Kvantitativní analýza představuje měření tloušťky sítnice či jejích jednotlivých vrstev. Toto měření můžeme provádět v jednotlivých skenech nebo pomocí série radiálních lineárních skenů zrekonstrujeme mapu dané oblasti. V neurooftalmologii využíváme nejčastěji volumometrické měření – objem peripapilární oblasti a objem komplexu gangliových buněk. Pro jednodušší orientaci jsou naměřené hodnoty znázorněny v barevné topografické mapě.
OCT nálezy u pacientů s RS
RS je charakteristická heterogenitou průběhu, klinických projevů a komplexitou patogeneze onemocnění. K poškození axonů centrálního nervového systému (CNS) dochází fokálně (v místě lézí) i difuzně (v bílé a šedé hmotě CNS). V patogenezi se uplatňuje zánět, demyelinizace s následnou astrogliózou a proces neurodegenerace [13]. Ztráta axonů a nervových buněk je nositelem trvalého neurologického postižení [14]. Pomocí OCT můžeme u pacientů s RS zobrazit jak následky zánětu očního nervu, tak i odraz difuzních neurodegenerativních změn [15].
Následky ON
První práci o měření úbytku retinálních nervových vláken pomocí OCT u pacientů s RS publikovali Parisi et al v roce 1999 [16]. V souboru 14 pacientů s RS po ON porovnávaném s kontrolní zdravou skupinou pozorovali v postiženém oku ztenčení jak průměrné peripapilární RNFL (pRNFL), tak úbytek RNFL v temporálním kvadrantu. Ve studii ukázali, že tloušťka pRNFL koreluje s nálezy na pattern elektroretinogramu (latencí vlny P50 a amplitudou P50–N95) [16]. Další studie prokazující ztenčení vrstvy RNFL po ON shrnuli Petzold et al v roce 2010. Jejich metaanalýza dat převážně z TD-OCT ukázala, že v oku postiženém ON u RS dochází k poklesu pRNFL průměrně o 20,38 µm (95% CI 17,91–22,86) [17]. Pokles zrakové ostrosti se projeví až při dosažení prahové hodnoty 75 um [18]. Úbytek pRNFL v oku po ON je dobře patrný ve třetím měsíci po nástupu příznaků a progreduje až do 6– 12 měsíce [19]. Huang-Link et al popsali vývoj RNFL u čtyř pacientů s akutní ON. Vrchol nárůstu RNFL následkem otoku byl patrný první měsíc od vzniku neuritidy, během následujících dvou měsíců došlo k rychlému poklesu otoku (tzv. pseudo-atrofie) a edém zcela ustoupil do šesti měsíců od počátku ataky [20]. Na počátku ON může edém v okolí papily překrývat probíhající neurodegenerativní změny. Ve fázi ústupu edému nemůžeme odlišit ztenčení RNFL v důsledku ústupu akutního otoku od ztenčení způsobeného ztrátou axonů.
Ztenčení vrstvy RNFL u pacientů s RS prokázal i Michalec et al. Ztenčení bylo patrné u pacientů s anamnézou ON, ale i u pacientů bez diagnostikované ON [21]. Novější práce zaměřené na segmentaci vrstev sítnice demonstrují, že úbytek vrstvy gangliových buněk je měřitelný již měsíc od počátku ON [22].
OCT můžeme využít k diferenciální diagnostice RS a neuromyelitis optica (NMO). Závažnost postižení a vzorec úbytku RNFL následkem ON se u pacientů s RS a u pacientů s NMO významně liší, ačkoliv se klinicky tyto dvě jednotky na počátku příznaků od sebe nedají jednoduše odlišit. Úbytek RNFL po ON u pacientů s RS je přítomen typicky v temporálním, případně v temporálním horním a temporálním dolním kvadrantu, zatímco ostatní kvadranty zůstávají nepostiženy (obr. 5). U NMO je postižena téměř celá peripapilární oblast vč. nazální poloviny a celkový pokles pRNFL je výraznější (v průměru o 31 um) [23]. Proto by u pacientů s nálezem rozsáhlé peripapilární atrofie RNFL měla být důsledně a opakovaně provedena vyšetření k vyloučení NMO.
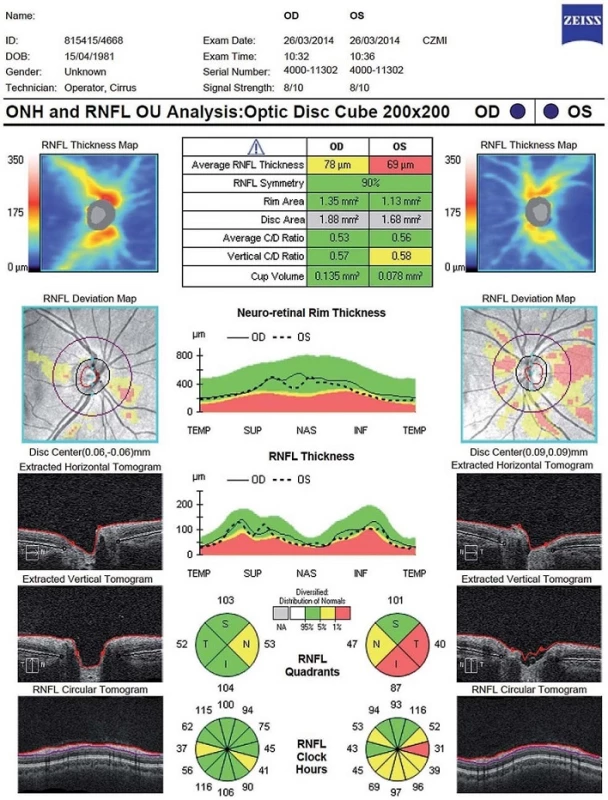
Snížení objemu sítnice v oblasti makuly (TMV) následkem ON bylo pozorováno již ve studiích používajících TD-OCT [17]. Použití segmentačních algoritmů u SD-OCT přístrojů ukázalo, že ztenčení TMV nastává primárně ve vrstvě gangliových buněk a je pozorovatelné 1– 3 měsíce od počátku rozvoje ON [20,24,25] (obr. 6).
Základní představa, že poškození očního nervu zánětem vede k retrográdní degeneraci vláken s následným ztenčením vrstvy RNFL a gangliových buněk, přetrvává [26]. Saidha et al však v roce 2011 demonstrovali, že existují pacienti s RS, u nichž je přítomna významná atrofie vnitřní a vnější nukleární vrstvy s relativním ušetřením gangliové vrstvy a RNFL. Tento patologický nález nelze vysvětlit retrográdní degenerací a je mu přisuzována možná primární patologie sítnice u části pacientů s RS [27].
Neurodegenerativní změny oka u pacientů s RS
Atrofie sítnice je pozorována u pacientů s RS i v očích bez anamnézy ON [28,29]. Podrobnou metaanalýzu na toto téma publikovali Petzold et al [17]. Ztenčení vrstvy RNFL v časných stadiích RS, u primárně progresivní RS i u sekundárně progresivní RS [30– 32] nasvědčuje tomu, že se nejedná jen o následek zánětlivých epizod, ale o neurodegenerativní proces. Snížení TMV a RNFL koreluje s mírou mozkové atrofie a mírou postižení kognice [33]. Přední část zrakové dráhy se tak stává modelem neurodegenerace u pacientů s RS a je využívána k testování efektu neuroprotektivních léčiv [34].
Závěr
OCT je široce dostupné, rychlé a neinvazivní vyšetření, které detailně zobrazuje patologické změny sítnice v souvislosti s RS. Hodnota OCT jako diagnostického i výzkumného nástroje je nesporná, avšak při jeho aplikaci je nutno pamatovat na jeho omezení. OCT zobrazuje anatomické změny sítnice, nikoliv její funkční stav. Nehraje tedy zásadní roli v procesu diagnózy akutní ON. VEP dosud zůstávají nejdůležitější vyšetřovací metodou pro detekci klinické a subklinické ON [4]. Analýza změn v jednotlivých vrstvách sítnice umožňuje lepší pochopení procesu neurodegenerace a hodnocení neuroprotektivního účinku léků [35]. Jednoznačná kritéria, která by definovala roli OCT v péči o pacienty s RS, nejsou zatím stanovena.
Podpořeno grantem IGA MZ ČR NT13239-4/ 2012 a projektem PRVOUK-P26/ LF1/ 4.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 9. 7. 2015
Přijato do tisku: 19. 11. 2015
MUDr. Veronika Matušková, Ph.D., FEBO
Oční klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: v.matuskova@email.cz
Zdroje
1. Havrdová E. Roztroušená skleróza. 1. vyd. Praha: Mladá Fronta 2013.
2. The Optic Neuritis Study Group. Visual function5 years after optic neuritis: experience of the OpticNeuritis Treatment Trial. Arch Ophthalmol 1997; 115(12): 1545– 1552.
3. Ikuta F, Zimmerman HM. Distribution of plaques in seventy autopsy cases of multiple sclerosis in the United States. Neurology 1976; 26(2): 26– 28.
4. Di Maggio G, Santangelo R, Guerrieri S, Bianco M, Ferrari L, Medaglini S et al. Optical coherence tomography and visual evoked potentials: which is more sensitive in multiple sclerosis? Mult Scler 2014; 20(10): 1342– 1347. doi: 10.1177/ 1352458514524293.
5. Abràmoff MD, Garvin MK, Sonka M. Retinal imaging and image analysis. IEEE Trans Med Imaging 2010; 3: 169– 208.
6. Scoles D, Gray D, Hunter J, Wolfe R, Gee B, Geng Y et al. In vivo imaging of retinal nerve fiber layer vasculature: imaging-histology comparison. BMC Ophthalmology 2009; 9: 1– 9. doi: 10.1186/ 1471-2415-13-76.
7. Drexler W, Fujimoto JG. State-of-the-art retinal optical coherence tomography. Prog Retin Eye Res 2008; 27(1): 45– 88.
8. Tewarie P, Balk L, Costello F, Green A, Martin R, Schippling S et al. The OSCAR-IB consensus criteria for retinal OCT quality assessment. PLoS One 2012; 7(4): e34823. doi: 10.1371/ journal.pone.0034823.
9. Schippling S, Balk LJ, Costello F, Albrecht P, Balcer L, Calabresi PA et al. Quality control for retinal OCT in multiple sclerosis: validation of the OSCAR-IB criteria. Mult Scler 2015; 21(2): 163– 170. doi: 10.1177/ 1352458514538110.
10. Patel NB, Garcia B, Harwerth RS. Influence of anterior segment power on the scan path and RNFL thickness using SD-OCT. Invest Ophthalmol Vis Sci 2012; 53(9): 5788– 5798. doi: 10.1167/ iovs.12-9937.
11. Faghihi H, Hajizadeh F, Hashemi H, Khabazkhoob M. Agreement of two different spectral domain optical coherence tomography instruments for retinal nerve fiber layer measurements. J Ophthalmic Vis Res 2014; 9(1): 31– 37.
12. Sakata LM, Deleon-Ortega J, Sakata V, Girkin CA. Optical coherence tomography of the retina and optic nerve – a review. Clin Experiment Ophthalmol 2009; 37(1): 90– 99. doi: 10.1111/ j.1442-9071.2009.02015.x.
13. Lucchinetti CF, Bruck W, Rodriguez M, Lassmann H. Distinct patterns of multiple sclerosis pathology indicates heterogeneity on pathogenesis. Brain Pathol 1996; 6(3): 259– 274.
14. Trapp BD, Bo L, Mork S, Chang A. Pathogenesis of tissue injury in MS lesions. J Neuroimmunol 1999; 98(1): 49– 56.
15. Balk LJ, Petzold A. Current and future potential of retinal optical coherence tomography in multiple sclerosis with and without optic neuritis. Neurodegener Dis Manag 2014; 4(2): 165– 176. doi: 10.2217/ nmt.14.10.
16. Parisi V, Manni G, Spadaro M, Colacino G, Restuccia R, Marchi S et al. Correlation between morphological and functional retinal impairment in multiple sclerosis patients. Invest Ophthalmol Vis Sci 1999; 40(11): 2520– 2527.
17. Petzold A, de Boer JF, Schippling S, Vermersch P, Kardon R, Green A et al. Optical coherence tomography in multiple sclerosis: a systematic review and meta-analysis. Lancet Neurol 2010; 9(9): 921– 932. doi: 10.1016/ S1474-4422(10)70168-X.
18. Costello F, Coupland S, Hodge W, Lorello GR, Koroluk J, Pan YI et al. Quantifying axonal loss after optic neuritis with optical coherence tomography. Ann Neurol 2006; 59(6): 963–969.
19. Costello F, Hodge W, Pan YI, Eggenberger E, Coupland S, Kardon RH. Tracking retinal nerve fiber layer loss after optic neuritis: a prospective study using optical coherence tomography. Mult Scler 2008; 14(7): 893– 905. doi: 10.1177/ 1352458508091367.
20. Huang-Link YM, Al-Hawasi A, Lindehammar H. Acute optic neuritis: retinal ganglion cell loss precedes retinal nerve fiber thinning. Neurol Sci 2015; 36(4): 617– 620. doi: 10.1007/ s10072-014-1982-3.
21. Michalec M, Praksová P, Hladíková M, Matušková V, Vlková E, Štourač P et al. Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie. Cesk Slov Neurol N 2016; 78/ 112(1): 41–50.
22. Kupersmith MJ, Garvin MK, Wang JK, Durbin M, Kardon R. Retinal ganglion cell layer thinning within one month of presentation for optic neuritis. Mult Scler 2015: pii: 1352458515598020.
23. Green AJ, Cree BA. Distinctive retinal nerve fibre layer and vascular changes in neuromyelitis optica following optic neuritis. J Neurol Neurosurg Psychiatry 2009; 80(9): 1002– 1005. doi: 10.1136/ jnnp.2008.166207.
24. Syc SB, Saidha S, Newsome SD, Ratchford JN, Levy M, Ford E et al. Optical coherence tomography segmentation reveals ganglion cell layer pathology after optic neuritis. Brain 2012; 135(2): 521– 533. doi: 10.1093/ brain/ awr264.
25. Watson GM, Keltner JL, Chin EK, Harvey D, Nguyen A, Park SS. Comparison of retinal nerve fiber layer and central macular thickness measurements among five different optical coherence tomography instruments in patients with multiple sclerosis and optic neuritis. J Neuroophthalmol 2011; 31(2): 110– 116. doi: 10.1097/ WNO.0b013e3181facbbd.
26. Shindler KS, Ventura E, Dutt M, Rostami A. Inflammatory demyelination induces axonal injury and retinal ganglion cell apoptosis in experimental optic neuritis. Exp Eye Res 2008; 87(3): 208– 213. doi: 10.1016/ j.exer.2008.05.017.
27. Saidha S, Syc SB, Ibrahim MA, Eckstein C, Warner CV, Farrell SK et al. Primary retinal pathology in multiple sclerosis as detected by optical coherence tomography. Brain 2011; 134(2): 518– 533. doi: 10.1093/ brain/ awq346.
28. Trip SA, Schlottmann PG, Jones SJ, Li WY, Garway-Heath DF, Thompson AJ et al. Optic nerve atrophy and retinal nerve fibre layer thinning following optic neuritis: evidence that axonal loss is a substrate of MRI-detected atrophy. Neuroimage 2006; 31(1): 286– 293.
29. Costello F, Hodge W, Pan YI, Eggenberger E, Freedman MS. Using retinal architecture to help characterize multiple sclerosis patients. Can J Ophthalmol 2010; 45(5): 520– 526. doi: 10.3129/ i10-063.
30. Gelfand JM, Goodin DS, Boscardin WJ, Nolan R, Cuneo A, Green AJ. Retinal axonal loss begins early in the course of multiple sclerosis and is similar between progressive phenotypes. PLoS One 2012; 7(5): e36847. doi: 10.1371/ journal.pone.0036847.
31. Costello F, Hodge W, Pan YI, Freedman M, DeMeulemeester C. Differences in retinal nerve fiber layer atrophy between multiple sclerosis subtypes. J Neurol Sci 2009; 281(1– 2): 74– 79. doi: 10.1016/ j.jns.2009.02.354.
32. Henderson AP, Trip SA, Schlottmann PG, Altmann DR, Garway-Heath DF, Plant GT et al. An investigation of the retinal nerve fibre layer in progressive multiple sclerosis using optical coherence tomography. Brain 2008; 131(1): 277– 287.
33. Dorr J, Wernecke KD, Bock M, Gaede G, Wuerfel JT, Pfueller CF et al. Association of retinal and macular damage with brain atrophy in multiple sclerosis. PLoS One 2011; 6(4): e18132. doi: 10.1371/ journal.pone.0018132.
34. Greenberg BM, Frohman E. Optical coherence tomography as a potential readout in clinical trials. Ther Adv Neurol Disord 2010; 3(3): 153– 160. doi: 10.1177/ 1756285610368890.
35. Frohman EM, Costello F, Stuve O, Calabresi P, Miller DH, Hickman SJ et al. Modeling axonal degeneration within the anterior visual system: implications for demonstrating neuroprotection in multiple sclerosis. Arch Neurol 2008; 65(1): 26– 35. doi: 10.1001/ archneurol.2007.10.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2016 Číslo 1
Nejčtenější v tomto čísle
- Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
- Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
- Komplikace kranioplastik po dekompresivní kraniektomii
- Indikace dekompresivní kraniektomie