Diagnostika epileptických záchvatů
Diagnosis of Epileptic Seizures
Following a first seizure, it is important to establish whether this was an epileptic or non-epileptic seizure, and to ascertain possible cause of an epileptic seizure. With respect to further management, diagnostic or therapeutic, it is crucial to differentiate non-epileptic from epileptic seizures and to identify provoked epileptic seizures (acute symptomatic). Patient history with a detailed description of the course of a seizure and circumstances under which it happened is instrumental in discriminating between the different types of seizures. Complementary investigations can further support the diagnostic process. Acute symptomatic seizures represent up to 40% of all single epileptic seizures and occur in close chronological proximity to an ongoing central nervous system injury of various origins. The source can easily be identified – most frequently this is an acute cerebrovascular event, craniocerebral injury, inflammatory CNS disorder, while primarily extracerebral effects are also important – toxic and metabolic disorders and drug or alcohol abuse. Unprovoked or reflex single epileptic seizures in patients with persisting predisposition and a high risk (> 60%) of relapse may, according to the new definition, be regarded as epilepsy and long-term antiepileptic treatment may be initiated. MRI under appropriate protocol should always be performed after the first unprovoked seizure. The risk of seizure recurrence can be estimated based on patient history as well as any EEG or physical examination abnormity that suggests an injury of the CNS. Antiepileptic treatment is indicated in patients with a single seizure if there is a high risk of recurrence or an increased likelihood of severe complications of further seizures.
Key words:
seizures – epilepsy – diagnosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
P. Marusič; H. Krijtová
Působiště autorů:
Neurologická klinika 2. LF UK a FN Motol, Praha
Vyšlo v časopise:
Cesk Slov Neurol N 2015; 78/111(3): 253-262
Kategorie:
Minimonografie
doi:
https://doi.org/10.14735/amcsnn2015253
Souhrn
Po prvním záchvatu je nutné určit, zda se jednalo o záchvat epileptický nebo neepileptický, a v případě záchvatu epileptického pátrat po možné akutní příčině. Odlišení záchvatů neepileptických a také identifikace záchvatů epileptických provokovaných (akutních symptomatických) je z hlediska stanovení dalšího postupu, ať již diagnostického či terapeutického, zcela zásadní. Pro odlišení jednotlivých typů záchvatů jsou rozhodující údaje v anamnéze se zaměřením na detailní popis průběhu záchvatu a okolností jeho vzniku, poté i výsledky pomocných vyšetření. Akutní symptomatické záchvaty představují až 40 % všech prvních epileptických záchvatů a vznikají v těsné časové souvislosti s probíhajícím postižením centrálního nervového systému (CNS) různé povahy. Jejich příčina je jasně identifikovatelná – nejčastěji se jedná o akutní cévní mozkové příhody, kraniocerebrální poranění, zánětlivá onemocnění CNS, významné jsou ale i vlivy primárně extracerebrální – toxické a metabolické poruchy, užívání léků nebo alkoholu. Pokud jde o první epileptický záchvat neprovokovaný nebo reflexní, je možné jej v případech přetrvávající predispozice s vysokým (> 60 %) rizikem opakování dle nově přijaté definice považovat za epilepsii, případně i zahájit dlouhodobou léčbu antiepileptiky. Po prvním neprovokovaném záchvatu by mělo být vždy doplněno vyšetření mozku magnetickou rezonancí v adekvátním protokolu. Z hlediska posouzení rizika opakování záchvatu má kromě anamnestických údajů význam i případná abnormita v EEG či odchylky v objektivním nálezu svědčící pro postižení CNS. Zahájení léčby je po prvním záchvatu indikováno při vysokém riziku opakování či při zvýšené pravděpodobnosti závažných komplikací dalšího záchvatu.
Klíčová slova:
záchvaty – epilepsie – diagnóza
Úvod
Diferenciální diagnostika záchvatů a epilepsií patří vzhledem k častému výskytu těchto jednotek v populaci mezi každodenní činnosti neurologa ať již v ambulantním zařízení, na centrálních příjmech nemocnic či na lůžkovém oddělení. Zejména iniciální diferenciální diagnostika záchvatů je rozhodující pro správnou indikaci dalších vyšetření a případné zahájení léčby. Odlišení záchvatů neepileptických a také identifikace záchvatů epileptických provokovaných (akutních symptomatických) činí v klinické praxi někdy obtíže. Důvodem je většinou kombinace nedostatečných nebo neadekvátně odebraných anamnestických údajů, tlak okolí podmíněný dramatičností záchvatu a často i práce v časovém stresu. V takové konstelaci lze sklouznout k rychlému, ale bohužel příliš zkratkovitému úsudku. Diferenciální diagnostika záchvatů vyžaduje systematičnost a trpělivost při odběru anamnestických údajů a identifikaci možných akutních příčin, při určité zkušenosti nemusí ale nutně zabrat mnoho času.
Níže uvedená stať má čtenářům pomoci získat základní přehled, jak systematicky postupovat. Podrobněji je rozpracována analýza jednotlivých příznaků a údajů se zaměřením na odlišení záchvatů neepileptických. V další části se ve větším detailu zmiňujeme o problematice epileptických záchvatů provokovaných (akutních symptomatických), která je v klinické praxi stále poněkud přehlížena. V závěru navrhujeme optimální vyšetřovací postup a poukazujeme na význam nálezů pomocných vyšetření, problematiku stanovení diagnózy epilepsie podle její nové definice a indikace k zahájení dlouhodobé léčby antiepileptiky.
Definice a epidemiologie
Epilepsie není jedna nemoc, jde o heterogenní skupinu často velmi odlišných nozologických jednotek – epilepsií a epileptických syndromů, které začínají v různém věku, z různých příčin, projevují se různými typy epileptických záchvatů v různé frekvenci, mají variabilní průběh a individuálně reagují na léčbu. Epileptické záchvaty vznikají v důsledku synchronizovaných výbojů neuronů a projevují se přechodnou poruchou funkce mozku. Při vzniku a šíření záchvatů se uplatňují různé patofyziologické mechanizmy a jsou postiženy různé části nebo systémy mozku. Tato různorodost je odpovědná za množství klinicky odlišných typů záchvatů, které mohou mít nesrovnatelný stupeň závažnosti.
Zatímco všichni nemocní epilepsií trpí epileptickými záchvaty, ne všichni jedinci, u nichž se epileptické záchvaty objeví, mají epilepsii. Epileptické záchvaty, které se vyskytnou v souvislosti s akutním onemocněním postihujícím mozek primárně (např. cévní příhoda nebo trauma) anebo sekundárně (příčiny systémové – toxické či metabolické), se nazývají záchvaty provokované nebo akutní symptomatické. Ty se nemusí již nikdy opakovat, pokud je příčina odstraněna nebo pokud je akutní fáze onemocnění překonána. Incidence provokovaných záchvatů je 29– 39 na 100 000 obyvatel na rok [1,2] a představují asi 40 % všech prvních záchvatů [3]. Ve světové literatuře jsou termíny „akutní symptomatický“ a „provokovaný“ používány jako synonyma. Oproti tomu u nás je někdy jako záchvat „provokovaný“ nesprávně označován i ten, jenž nemá závažnou akutní příčinu a objeví se např. po běžné spánkové deprivaci. Záchvaty následující po spánkové deprivaci je nutné považovat za záchvaty neprovokované, neboť dosud nebylo prokázáno, že by nedostatek spánku mohl být samostatným podkladem pro rozvoj akutního symptomatického záchvatu [4]. Také záchvaty reflexní (provokované specifickým podnětem), např. fotosenzitivní, nejsou považovány z tohoto pohledu za záchvaty akutní symptomatické – „provokované“ [5].
Neprovokované záchvaty se vyskytují v nepřítomnosti zjevné akutní příčiny nebo podnětu, který u běžné populace epileptický záchvat nevyvolá. Jejich etiologie může být nejasná (kryptogenní), genetická (idiopatické, nově genetické epilepsie) nebo mohou být důsledkem „starší“ léze či progresivního postižení mozku (symptomatické, nově strukturální a metabolické epilepsie). Jejich incidence je 61 na 100 000 obyvatel na rok [6]. Mohou být ojedinělé nebo se mohou opakovat. Všichni pacienti s prvním záchvatem sice potenciálně mohou mít epilepsii, ale ta se ve skutečnosti vyvine jen asi u poloviny z nich. Přibližně 6 % populace prodělá během života alespoň jeden epileptický záchvat a kumulativní incidence epilepsie, která představuje riziko onemocnění během celého života, je kolem 3 % [6].
Nově přijatá klinická definice epilepsie zahrnuje kromě klasické situace dvou a více neprovokovaných záchvatů v odstupu delším než 24 hod také případy ojedinělého neprovokovaného nebo reflexního záchvatu s vysokou (více než 60 %) pravděpodobností jeho opakování. Pravděpodobnost více než 60 % je srovnatelná s rizikem po dvou záchvatech neprovokovaných, které se pohybuje v rozmezí 60– 90 % [5]. Přetrvávající vysoká predispozice pro opakování záchvatu může být stanovena např. anamnestickými údaji nebo ovlivněna nálezem EEG abnormity či epileptogenní léze na MR mozku. Diagnózu epilepsie také přiznáme pacientovi s definovaným epileptickým syndromem, ať již měl jen jeden neprovokovaný záchvat (např. benigní epilepsie s centro‑temporálními hroty) nebo výjimečně v případech, kdy nelze žádný zjevný záchvat identifikovat (např. syndrom s kontinuálními hroty a vlnami ve spánku či Landau‑ Kleffnerův syndrom).
Diferenciální diagnostika – základní schéma
Pokud se v literatuře hovoří o „prvním záchvatu“, jedná se většinou o záchvat konvulzivní, tedy primárně nebo sekundárně generalizovaný tonicko‑klonický záchvat (Generalize Tonic Clonic Seizure; GTCS). Ten sice není nejčastějším typem epileptických záchvatů obecně, ale představuje dramatickou událost a je nejčastějším typem v případě akutního symptomatického (provokovaného) záchvatu. Často jím také sama epilepsie začíná nebo až teprve tento typ záchvatu přivede pacienta k lékaři. Bezvědomí s křečemi však může mít i jinou příčinu.
Důležitost správné iniciální diferenciální diagnostiky podtrhuje skutečnost, že 20– 30 % pacientů s epilepsií přicházejících na vyšetření do center pro epilepsie má tuto diagnózu stanovenu chybně [7]. Ve většině případů lze správnou diagnózu záchvatových stavů stanovit získáním detailní anamnézy nebo díky možnosti záchvat pozorovat. Určení diagnózy závisí významně na schopnostech pacienta a/ nebo jeho okolí dostatečně záchvat popsat. Klinická manifestace epilepsií a epileptických syndromů zahrnuje mnoho stavů s poruchou vědomí a/ nebo chování. Nedostatečná zkušenost a/ nebo znalost je příčinou chyb a stanovení falešně pozitivní či negativní diagnózy.
Pro stanovení diagnózy a léčebného postupu je třeba zodpovědět následující otázky:
- Jedná se o záchvat epileptický? Pokud ne, o jaký typ neepileptického záchvatu se jedná?
- Jedná se o záchvat epileptický akutní symptomatický? Pokud ano, co je jeho příčinou?
- Pokud je záchvat neprovokovaný, jedná se skutečně o první záchvat v životě?
- Jedná se o záchvat fokální či generalizovaný? Jsou známky léze (akutní, starší či progresivně se vyvíjející) na CT nebo MR? Je v EEG ložisková pomalá a/ nebo epileptiformní abnormita?
- O jakou epilepsii nebo epileptický syndrom se jedná? Jaké je riziko opakování záchvatu? Máme zahájit terapii nebo vyčkat?
Seřazení výše uvedených otázek sice víceméně odpovídá postupu při vyšetřování, nicméně je nelze řešit odděleně; často již na začátku vyšetřovacího postupu známe odpovědi na většinu otázek a naopak k některým zdánlivě již zodpovězeným se musíme vracet. K odpovědi na výše uvedené potřebujeme získat zejména detailní popis záchvatu/ záchvatů a okolností, při kterých se vyskytly, dále osobní, farmakologickou a případně i sociální anamnézu.
Důkladné posouzení zahrnuje aktivní pátrání po okolnostech vzniku, průběhu záchvatu a postiktálních příznacích. Velkou úlohu při zjišťování anamnestických údajů mají lékaři záchranné služby. Ti by měli zjistit vše, co svědci události o nemocném vědí (užívání léků, recentní potíže, abúzus) a co v průběhu záchvatu viděli. Bývá užitečné očité svědky kontaktovat i dodatečně a vyzpovídat je osobně, třeba jen telefonicky.
Záchvaty neepileptické
V iniciální diagnostice záchvatů je nutné odlišit záchvaty neepileptické, které se obecně dělí na dvě velké skupiny – somaticky podmíněné a psychogenní (tab. 1).

Somaticky podmíněné neepileptické záchvaty mohou mít různorodou etiologii i klinický obraz. Nejčastějšími z této skupiny jsou synkopy, které během svého života až 40 % populace prodělá aspoň jednou. Synkopy jsou typicky charakterizované krátkou (do 20 s) poruchou vědomí, která je způsobená mozkovou hypoperfuzí, s následnou rychlou úpravou stavu [8]. Výjimečně mohou synkopy trvat i déle (až minuty) a také mohou být v některých případech doprovázeny následnou alterací, např. při dlouhotrvající hypoperfuzi nebo u seniorů. Synkopy jsou často doprovázeny křečemi (konvulzivní synkopy) s polymorfními motorickými projevy, jako např. myokloniemi, tonickými či klonickými křečemi, generalizovanou extenční nebo flekční posturou [9]. Etiologie synkop je různorodá – mohou být reflexní (nervově zprostředkované), kardiální nebo se vyskytují při ortostatické hypotenzi. K jejich rozpoznání je třeba znát typické vyvolávající okolnosti a etiologii synkop, provést základní interní vyšetření včetně EKG a aktivně se ptát na jiné doprovodné příznaky, např. bolesti na hrudi nebo dušnost. Odlišení synkop od epileptických záchvatů může být v některých případech vcelku snadné (tab. 2). Je nutné si ale uvědomit, že pacient přivezený do nemocnice se stanovenou diagnózou GTCS může mít i infarkt myokardu a naopak pacient stěžující si na bolesti mezi lopatkami mohl prodělat GTCS a způsobit si při něm kompresivní frakturu hrudního obratle. Nejčastější jsou synkopy reflexní – ty mohou být vazovagální (podmíněné podnětem emočním, bolestivým či ortostatickým), situační (podmíněné např. kašlem nebo mikcí) nebo vyvolané nepřiměřenou stimulací karotického sinu. Synkopy jsou obecně benigní onemocnění, ovlivňují ale nepříznivě kvalitu života a některé typy jsou sdruženy se zvýšenou morbiditou a mortalitou (synkopy kardiální). Pacienti se synkopou tvoří cca 1 % ze všech vyšetřených případů na centrálních (urgentních) příjmech nemocnic [8]. Diagnosticky komplikovaná je situace, kdy je synkopa navozena poruchou srdečního rytmu při epileptickém záchvatu – iktální bradykardií či asystolií, která je podmíněna epileptickou aktivací autonomních center v centrálním nervovém systému (CNS). Takovou synkopu lze považovat za neepileptický záchvat v rámci záchvatu epileptického.
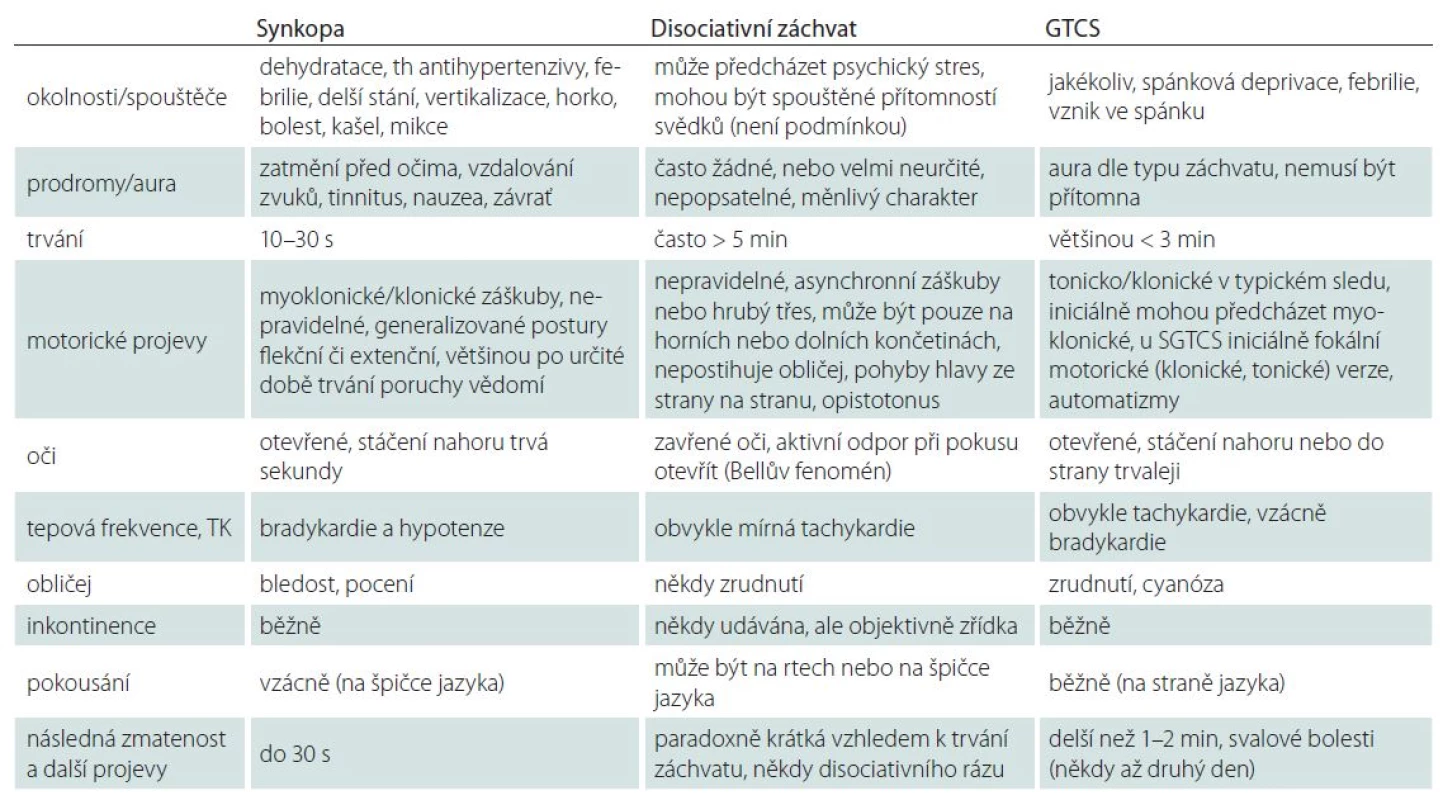
Psychogenní neepileptické záchvaty jsou různého typu (tab. 1). Vyskytují se sice v populaci celkově méně často než synkopy, o to víc mohou být diagnosticky záludnější. Nejvýznamnější z pohledu diferenciálně diagnostického jsou záchvaty disociativní. Ty jsou často (až v 80 %) protrahované – delší než 5 min, a mohou být tedy interpretovány a následně léčeny jako status epilepticus, včetně i.v. podání anestetik s nutností intubace a umělé plicní ventilace, a tudíž s rizikem iatrogenního poškození. Odlišení záchvatů disociativních vyžaduje jisté zkušenosti. Uvádějí se některé typické znaky – zavřené oči během záchvatu a aktivní svírání víček, prudké otáčení hlavy ze strany na stranu, chvění nebo třes končetin a celého těla, asynchronní pohyby končetin, chybějící postparoxyzmální alterace, trvání delší než 5 min (tab. 2). Tato vodítka mohou vzbudit naše podezření, ale jednoznačné potvrzení by mělo být (pokud se záchvaty opakují) provedeno vždy s pomocí video‑ EEG monitorování. Je nutné též vědět, že u jednoho pacienta se mohou záchvaty epileptické a neepileptické kombinovat.
Okolnosti výskytu záchvatu a jeho klinické projevy
Zásadní je situace, ve které záchvat vznikl – zde je nutné postupovat detailně, téměř vteřinu po vteřině, se snahou vytvořit si jasnou představu o sekvenci všech událostí, jako kdybychom celou situaci sledovali ve filmu. Podobně jako při popisu vlastního záchvatu je žádoucí kombinace údajů od pacienta a svědků události, pokud byli a jsou dostupní. V nejasných situacích se vyplatí aspoň telefonicky stav se svědkem probrat. Důležitá je informace o typické dispozici (např. nevyspání, interkurentní infekt, dehydratace, horko) a případném bezprostředním podnětu – spouštěči záchvatu, např. postavení se, dlouhé stání, odběr krve, bolestivý zákrok, psychický stres, či typickém specifickém spouštěči reflexních epileptických záchvatů, např. blikající světlo.
Klinické projevy záchvatu je opět nezbytné získat od pacienta i od svědků události a sestavit si obdobný film z průběhu záchvatu. Subjektivní popis pacienta je zásadní pro odlišení synkopy (typické prodromy) i některých záchvatů epileptických, pokud pacient líčí typickou auru. U záchvatů neepileptických psychogenních je naopak popis často velmi neurčitý, může být i měnlivý. Důležité informace z průběhu záchvatu jsou charakter poruchy vědomí a případně motorických projevů (automatizmů nebo křečí) – je nutné odlišit klonické záškuby od hrubého tremoru končetin (případně s vlastním předvedením těchto projevů) a upřesnit, ve které fázi poruchy vědomí se objevily a jaké bylo jejich trvání a dynamika. Například u konvulzivní synkopy se křeče typicky objevují až po určité době trvání poruchy vědomí, někdy až ke konci, kdy si je dokonce pacient sám částečně uvědomuje. Informace o stavu očí a víček pacienta v průběhu záchvatu je často dle popisu nepřesná, nicméně pokud sami můžeme záchvat pozorovat, je pro synkopu typické pomalé netonické stočení bulbů vzhůru, u GTCS dochází k tonickému stočení vzhůru nebo ke straně, u disociativních záchvatů jsou oči zavřeny a pacient se aktivně brání jejich otevření. Významným údajem může být cyanóza typická pro GTCS nebo bledost svědčící spíše pro synkopu. Iniciální „výkřik“ (ve skutečnosti tonická kontrakce vedoucí k výdechu při uzavřené hlasové štěrbině) je typickým projevem GTCS, nemusí ale být vždy vyjádřen. Údaj o vzniku záchvatu ze spánku je z anamnézy relativně nespolehlivý, rovněž i údaj o případné inkontinenci. K té navíc může dojít při kterémkoli typu záchvatu.
Délka trvání je často udávána pacientem i svědky nepřesně, je nutné si také ujasnit, ke které fázi záchvatu se vyjadřují. Svědci někdy např. udávají trvání záchvatu včetně pozáchvatové alterace, ale údaje o obou je nutné získat odděleně. Delší pozáchvatová alterace v trvání minut svědčí spíše pro epileptický záchvat, naopak nepřiměřeně krátká alterace po dlouhém „konvulzivním“ záchvatu budí podezření na disociativní záchvat. U synkop je alterace krátká, ale je nutné vyloučit, že nedošlo k protrahované mozkové hypoperfuzi, např. pokud byl pacient podržen vsedě nebo při pádu zaklíněn. Rovněž synkopy u seniorů mohou vykazovat delší pozáchvatovou alteraci, obdobně kombinace synkopy a následné komoce mozkové.
Pokousání jazyka je významný, ale sám o sobě nedostatečný údaj. Musíme se cíleně ptát na lokalizaci pokousání – pro epileptický záchvat je patognomické pouze pokousání jazyka laterálně, v jiné lokalizaci je nález nespecifický [10]. Příznakem svědčícím pro proběhlý GTCS jsou myalgie objevující se někdy až druhý den po záchvatu. Poranění je možné u všech typů záchvatů, dokonce i u disociativních záchvatů, u kterých se ale nevyskytují popáleniny.
Obecně je nutné zdůraznit, že výše uvedené příznaky mohou být samy o sobě nespolehlivé, a je proto důležité posuzovat je v kontextu klinického obrazu záchvatu. Možností, jak přispět ke zlepšení diagnostiky při opakovaných záchvatech, je také natočení záchvatu na mobilní telefon a případně otestování postiženého dle instrukcí lékaře, samozřejmě s prioritou poskytnutí adekvátní první pomoci. Následná analýza záznamu lékařem může nahradit nedostatečně přesný popis od svědka události.
Rizikové faktory pro vznik záchvatů v anamnéze
Důležitá je anamnéza osobní a zejména farmakologická. V osobní pátráme po možných předchozích inzultech mozku, které by mohly podmiňovat epilepsii, po jiných chorobách, jež by mohly naopak souviset se záchvaty neepileptickými, ať somatickými či psychogenními. Důležitý je dotaz na užívané léky a dobu jejich nasazení, rovněž i na přerušení dlouhodobého užívání léků, zejména benzodiazepinů nebo barbiturátů. Významná je anamnéza toxikologická, informace od pacienta mohou být nízké validity, ale lze je často objektivizovat informací od blízkých osob.
Akutní symptomatické záchvaty
Pokud je vyloučena možnost neepileptického záchvatu, vzniká logicky předpoklad, že se jednalo o záchvat epileptický. V tom případě je nutné nejprve pomýšlet na záchvat akutní symptomatický (provokovaný). Epileptické záchvaty lze dle doporučení ILAE klasifikovat jako provokované neboli akutní symptomatické (ASZ), pokud vznikají v těsné časové souvislosti s právě probíhajícím postižením CNS [2,4,11]. Koncepce ASZ vychází z předpokladu, že mezi nimi a záchvaty neprovokovanými existuje zásadní rozdíl především v prognóze – mají sice vyšší časnou mortalitu, která je závislá na jejich příčině, ale je nižší riziko vzniku dalších neprovokovaných záchvatů, tedy rozvoje epilepsie. Předpokládá se též odlišná patogeneze nepochybně se lišící podle etiologie akutního postižení. Příčina je jasně identifikovatelná, riziko vzniku ASZ je ovlivněno především rozsahem a lokalizací mozkového postižení, i když významnou roli mohou hrát i další faktory, např. genetická dispozice, komorbidity nebo věk, případně se může podílet více akutních příčin současně. I pacienti s epilepsií mohou prodělat ASZ a není zatím objasněno, zda jsou k těmto záchvatům náchylnější [4].
Většinou se za období, kdy ASZ vznikají, považuje arbitrárně doba od inzultu až sedm dní po jeho vzniku, zejména u etiologie, jako je cévní mozková příhoda (CMP), kraniocerebrální poranění nebo neurochirurgický výkon. V individuálních případech lze za akutní symptomatický záchvat považovat i ten, který vznikne s odstupem delším, např. při komplikacích primárního postižení. U některých etiologií je kritické období určeno pomocí jiných kritérií – např. známkami aktivity onemocnění (neuroinfekce, autoimunitní onemocnění). U metabolických poruch jsou kritéria pro abnormní hodnoty rovněž arbitrární, užívaná především pro účely epidemiologických studií, a je nutné, aby odběr krve potvrzující danou poruchu byl proveden do 24 hod po záchvatu [4].
Etiologii ASZ lze obecně rozdělit do dvou skupin: primární – cerebrální (např. strukturální léze mozku) a sekundární – extracerebrální, tzn. přechodné vlivy vnějšího či vnitřního prostředí [12]. Akutní symptomatické záchvaty představují až 40 % všech „prvních“ epileptických záchvatů. Jejich incidence má z hlediska věku pacientů dva vrcholy – nejčastěji se vyskytují u novorozenců a dětí do jednoho roku věku, dále u jedinců nad 75 let [1,2,13]. ASZ mohou mít semiologicky různý charakter, i když převažují záchvaty generalizované tonicko‑klonické a záchvaty fokální se sekundární generalizací.Záchvaty se mohou objevit izolovaně, kumulovaně a mohou mít i podobu epileptického statu (SE). Údaje o incidenci akutního symptomatického SE se mezi jednotlivými autory liší. Prospektivní studie dětských i dospělých pacientů z Richmondu (Virginia, USA) uvádí incidenci všech SE 41/ 100 000 obyvatel/ rok a akutní symptomatické SE tvořily více než polovinu případů [14]. Velmi obecně lze říci, že zatímco u dětí převažují staty konvulzivní, u dospělých a zejména seniorů přibývá nekonvulzivních statů. Americké studie uvádějí incidenci SE u seniorů až 86/ 100 000 obyvatel/ rok [14]. Vzhledem ke stárnutí populace mají tato čísla klinický význam, zvláště přihlédneme‑li k tomu, že SE má v této věkové skupině vysokou morbiditu a mortalitu.
Mezi nejčastější příčiny ASZ patří cerebrovaskulární onemocnění, dále kraniocerebrální poranění, CNS infekce, léky, toxiny, alkohol a metabolické poruchy (graf 1). Febrilní záchvaty je sice možné rovněž zařadit mezi ASZ, ale představují zcela specifickou problematiku, neboť vznikají na základě interakcí mezi zevními vlivy (horečka) a vnitřními faktory různého charakteru (především genetickými).

Cerebrovaskulární příčiny
Nejčastější příčinou ASZ v dospělosti a zejména u seniorů jsou CMP všech typů. Skutečné riziko vzniku ASZ u CMP není známo, liší se výsledky populačních a nemocničních studií. Dle největších z nich se uvádí výskyt ASZ mezi 4,2– 6,1 %, přičemž většina záchvatů (50– 78 %) proběhne během prvních 24 hod [15– 21]. O něco vyšší riziko se uvádí u krvácení než u ischemických CMP [15]. Studie se většinou zabývaly fokálními záchvaty s motorickou symptomatikou a GTCS. Teprve zavedení kontinuálního monitorování EEG na JIP ukázalo, že zejména u krvácení je uváděné riziko podhodnocené, neboť po započítání dříve nerozpoznaných záchvatů a nekonvulzívních statů stoupá výskyt až k 28 % [22]. Za rizikové faktory pro vznik ASZ u ischemických CMP se považuje kortikální lokalizace a rozsah ischemie, podobně u hemoragií je to lobární lokalizace [19]. Akutní encefalopatie hypertenzní (vč. eklampsie) nebo syndrom PRES (Posterior Reversible Encephalopathy Syndrome) mohou být doprovázeny ASZ [23].
Kraniocerebrální poranění
Riziko vzniku ASZ u kraniocerebrálního poranění je srovnatelné s jeho výskytem u CMP, u některých typů poranění je ale výrazně vyšší [24,25]. Podobně jako u CMP, zavedení kontinuálního EEG monitorování prokázalo u středně těžkých až těžkých mozkových traumat výskyt ASZ (zejména nekonvulzivních) až ve 22 % případů [22]. Většina záchvatů proběhne během prvních 24 hod. Riziko vzniku ASZ závisí jednoznačně na závažnosti poranění a zvyšuje se v přítomnosti traumatických krvácení (subdurální, epidurální nebo parenchymové). Dále je toto riziko vyšší u poranění s impresivní frakturou a s kontuzí mozkové tkáně, u pacientů s poruchou vědomí – GCS nižší než 10, u penetrujících poranění a také 24 hod po předchozím ASZ [26]. Nezávislý rizikový faktor je alkoholizmus.
Zánětlivá onemocnění mozku
Akutní symptomatické záchvaty jsou častým prvním nebo časným příznakem infekčního onemocnění CNS různého typu. Nejrizikovější jsou virové záněty, zejména encefalitida způsobená herpes simplex virem – cca 50 % pacientů [27]. Riziko se zvyšuje při těžším klinickém stavu nemocných (GCS pod 12) a v přítomnosti neurologického deficitu. Kromě celé řady infekčních chorob (bakteriálních, virových, parazitárních, mykotických, prionových) mohou být ASZ a akutní symptomatický SE projevem autoimunitních onemocnění CNS: roztroušená skleróza, neurolupus, systémové vaskulitidy s postižením CNS, primární angiitis CNS, autoimunitní a paraneoplastické encefalitidy. Zejména oblast paraneoplastických a neparaneoplastických limbických a extralimbických encefalitid je v poslední době často zdůrazňována [28].
Metabolické poruchy
Různé metabolické poruchy mohou být provázeny ASZ. Recentně byly arbitrárně stanoveny hodnoty, při kterých je možné přisuzovat vznik záchvatu metabolické poruše (tab. 3). Tyto hodnoty jsou velmi přísné a jsou určeny zejména pro epidemiologické účely, proto dávají přednost specificitě před senzitivitou. Při vzniku ASZ hraje nicméně významnou roli i rychlost rozvoje poruchy.
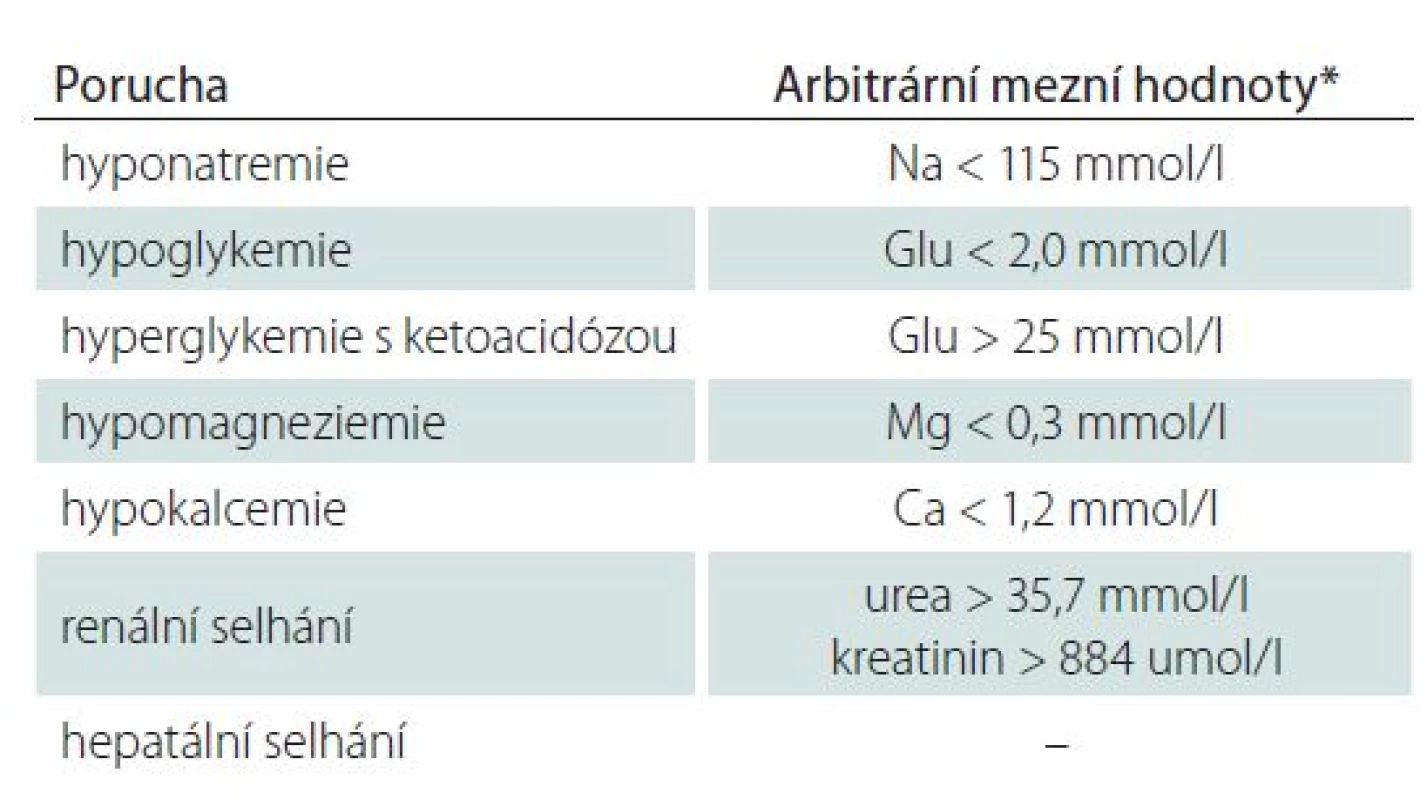
Častou příčinou ASZ může být hyponatremie. Významnou roli hraje její rychlý rozvoj, neboť chronickou situaci tolerují pacienti často bez potíží.
U hypoglykemie vznikají různé neurologické symptomy často, z nich nejčastější jsou GTCS [4]. Zvláště v noci mohou uniknout pozornosti pacientů prodromální příznaky hypoglykemie a může dojít k rozvoji záchvatu. Pacienti poznají noční hypoglykemii podle ranní hyperglykemie a opocení. Při hyperglykemii se častěji záchvaty vyskytují u formy nonketotické spojené s hyperosmolalitou, než u hyperglykemie s ketoacidózou [4]. Záchvaty u nonketotické hyperglykemie se manifestují většinou u pacientů s dosud nediagnostikovaným diabetem – převážně mají fokální ráz s postižením horních končetin, jsou klonické, stimulus senzitivní (precipitované pohybem) a kumulované [29]. Léčí se inzulinem a antiepileptika (např. fenytoin) je naopak mohou zhoršit.
Pro vznik záchvatu při hypokalcemii je rozhodující hladina kalcia ionizovaného, která závisí na pH krve. Při alkalóze hladina ionizovaného kalcia klesá, neboť se zvyšuje jeho vazba na albumin. Je proto třeba opatrnosti např. při korekci metabolické acidózy u pacienta s renální insuficiencí a hraniční hladinou ionizovaného kalcia – při změně pH může výše popsaným mechanizmem dojít ke kritickému poklesu hladiny ionizovaného kalcia a tak k iatrogenně navozenému ASZ. Mezi hlavní příčiny hypomagnezemie patří nedostatečný příjem, průjmy, abúzus laxativ, malabsorpce, chronická renální insuficience, alkohol, léky aj.
U renálního selhávání se ASZ vyskytují až u 10 % pacientů. Etiologicky může hrát roli extrémní urémie nebo elektrolytová dysbalance. Záchvaty se vyskytují zejména u hemodialyzovaných nemocných, kdy existuje celá řada faktorů, které se mohou na jejich vzniku podílet, jako např. uremická encefalopatie, maligní hypertenze, dysekvilibrační syndrom, hypokalcemie, hypoglykemie, hyponatremie. Kromě metabolických příčin je nutné myslet i na vznik mozkového krvácení u dialyzovaných pacientů v souvislosti s podáváním heparinu nebo na polékovou etiologii záchvatů. Naopak u hepatálního selhávání nejsou ASZ příliš časté (vysvětluje se mj. tvorbou endogenních benzodiazepinů) a pokud se vyskytnou, tak většinou v souvislosti s hyperamonemií.
Chronický alkoholizmus
U většiny pacientů s chronickým abúzem alkoholu se epileptické záchvaty (ASZ) objevují v rámci abstinenčních příznaků, obvykle 6– 48 hod od posledního napití. Jde o velmi častý jev, dle některých prací postihující až 30 % alkoholiků, ve kterém hraje vedle genetické dispozice významnou roli i množství konzumovaného alkoholu a frekvence abstinencí. Záchvaty – nejčastěji generalizované tonicko‑klonické – se mohou objevit i v kumulacích či v podobě status epilepticus. Typické abstinenční příznaky (psychické, motorické, autonomní) nemusí být vyjádřeny [30]. Záchvaty v souvislosti s akutní intoxikací alkoholem jsou sice vzácnější, ale rovněž možné [31]. U chronických alkoholiků může být příčinou záchvatů též jiná sekundární metabolická porucha, jako je například hypoglykemie či hyponatremie. Nelze zapomínat i na nemetabolické příčiny, jako je např. mozkové krvácení. Chronický alkoholizmus představuje také rizikový faktor pro vznik ASZ z jiných příčin.
Léky
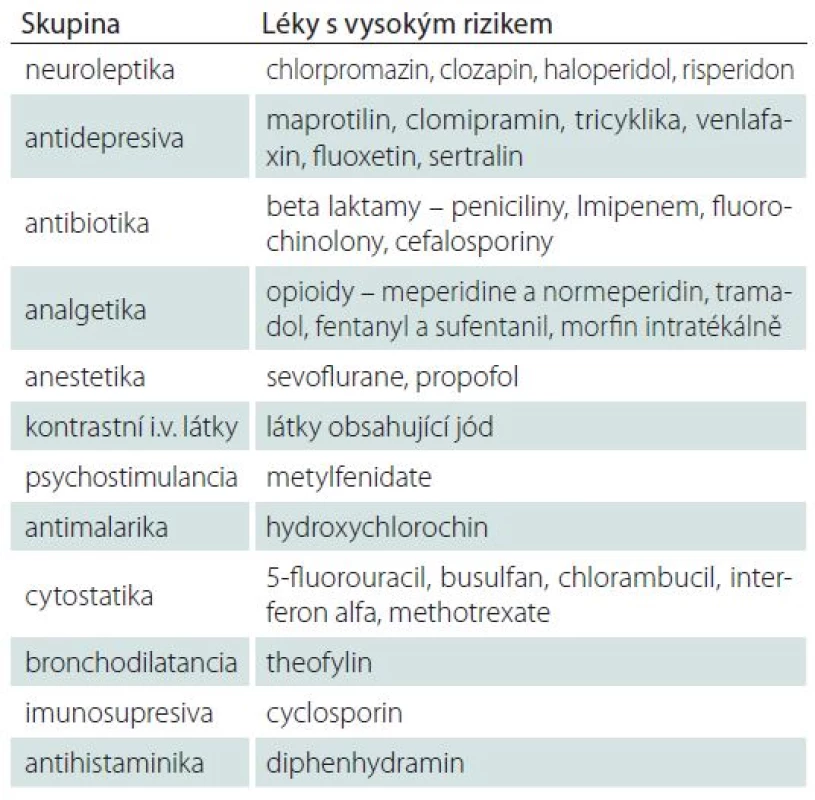
Souvislost ASZ s léky byla rozpoznána teprve ve druhé polovině 20. století. Záchvaty se mohou vyskytnout i u pacientů užívajících léky v terapeutické dávce, riziko závisí na velikosti dávky a stoupá při intoxikaci. Mezi nejčastěji uváděné látky vyvolávající záchvaty při intoxikaci patří bupropion, diphenhydramin, tricyklická antidepresiva, tramadol, amfetaminy, izoniazid a venlafaxin [32]. Léky s významným prokonvulzivním potenciálem jsou uvedeny v tab. 4. Tento výčet ale není úplný a je vždy nutné po zjištění farmakologické anamnézy zkontrolovat v Souhrnu údajů o přípravku (případně i na webu), nakolik má který lék popisováno zvýšené riziko vzniku záchvatů. Prokázat kauzální souvislost záchvatu s užívaným lékem může být obtížné, souvislost je jednoznačná až při opakování záchvatu po opakované expozici danému léku. Vždy je proto nezbytné pacienta komplexně vyšetřit a vyloučit další možné příčiny záchvatu. Akutní symptomatické záchvaty i SE mohou vznikat též v souvislosti s vysazením některých léků, typicky po vysazení barbiturátů či benzodiazepinů, u seniorů i pod obrazem de novo absence statu [33].
Pacienti by měli být vždy vyšetřeni neurologicky i interně, z pomocných vyšetření je nutné provést akutně základní laboratorní vyšetření a EKG. Toxikologický skríning by měl být proveden tehdy, pokud se vyskytnou okolnosti vzbuzující podezření na toxickou encefalopatii. CT mozku je akutně indikováno vždy, zejména je‑li podezření na lézi CNS [34]. Naopak MR vyšetření mozku nemusí být (a téměř nikdy není) indikováno urgentně, mělo by být ale vždy doplněno v případech, kdy jde o první neprovokovaný epileptický záchvat [35]. Vyšetření likvoru je u dospělých pacientů indikováno při podezření na infekci CNS (např. při horečce), ale u pacientů s imunodeficitem by mělo být doplněno vždy, pokud se neprokáže jiná příčina [36– 39]. Vyšetření EEG je indikováno v případech diferenciálně-diagnosticky obtížných a při podezření na nekonvulzivní status epilepticus. U akutních symptomatických záchvatů může být indikována krátkodobá léčba antiepileptiky, zejména v situacích, kdy přetrvává vyvolávající příčina a je vysoké riziko závažných záchvatů, které by mohly pacienta významně ohrozit, nebo u pacientů s iniciální kumulací záchvatů nebo epileptickým statem. Délka podávání antiepileptik v krátkodobé profylaxi je individuální, většinou se pohybuje v řádu dnů až týdnů.
Přehlížené záchvaty v anamnéze
Položíme‑li otázku, zda se jedná o první záchvat, pacientovi či jeho příbuzným, může se nám dostat zavádějící odpovědi. GTCS je dramatická událost, kterou si nemocní ani jejich okolí často nespojí s nevýraznými („malými“) záchvaty, jež mohou záchvatu „velkému“ předcházet. Dle některých prací byl prokázán předchozí výskyt „malých“ záchvatů u 7– 28 % pacientů, kteří byli vyšetřeni po zdánlivě prvním záchvatu [40,41]. Vždy se proto musíme ptát cíleně na výskyt jiných typů záchvatů. U idiopatických generalizovaných epilepsií unikají pozornosti pacientů myoklonie, jejichž výskyt často předchází prvnímu GTCS při juvenilní myoklonické epilepsii. Jedná se většinou o izolované záškuby horních končetin, které se objevují typicky po probuzení. Pacienti jim někdy říkají „tiky“ nebo je považují za nešikovnost, neboť při záškubu něco zvrhnou, upustí, vylijí apod. Je možné je popsat jako „elektrický výboj“. Absence sice častěji dovedou pacienta na vyšetření, ale pokud jsou jen lehkého stupně, mohou být považovány za roztržitost nebo zhoršenou pozornost, a proto je vhodné se na ně cíleně ptát. Absence mohou být provázeny myokloniemi víček či stáčením bulbů vzhůru.
GTCS může být prvním projevem onemocnění i u pacientů s fokální epilepsií, je proto nutné pátrat po předchozích záchvatech fokálních, které mohly unikat pozornosti. Je užitečné pacientům popsat různé typy aury (somatosenzorické, psychické, vegetativní, zrakové, sluchové, čichové atd.) i některé záchvaty s typickým průběhem – např. temporální záchvat začínající epigastrickou aurou nebo pocitem prožitého s následnou amnézií a oroalimentárními automatizmy. Pokud na základě anamnestických údajů zjistíme, že pacient prodělal již dříve jeden či více neprovokovaných záchvatů, jedná se o epilepsii.
Etiologie epileptického záchvatu a epilepsie
Na základě všech dostupných informací se snažíme klasifikovat typ záchvatu a při zvážení všech informací pak i typ epilepsie či epileptického syndromu. Především je nutné určit, zda se jedná o epilepsii fokální či generalizovanou. To nám umožňuje lépe se rozhodnout o léčbě a pacientovi poskytnout informace o prognóze jeho onemocnění.
V akutní fázi pátráme především po právě probíhajícím postižení CNS. Jako skríning odhalující nejzávažnější možné příčiny akutních symptomatických záchvatů je nutné provést CT mozku. Akutně provedené CT může změnit léčebný postup v 9– 17 % případů [34]. Při pátrání po potenciální příčině epilepsie je ale MR vyšetření jednoznačně senzitivnější a odhalí změny, které jsou na CT nedetekovatelné, např. kavernomy, nízkostupňové tumory, fokální kortikální dysplazie nebo hipokampální sklerózu. U každého pacienta po prvním neprovokovaném záchvatu je proto indikováno MR vyšetření. Důležité je, aby toto vyšetření bylo provedeno ve speciálním protokolu, který umožní identifikovat maximum výše uvedených epileptogenních lézí již v iniciální fázi diagnostiky. Základní protokol MR vyšetření u pacientů s epilepsií by měl dle doporučeného postupu Epistop z roku 2013 obsahovat: sagitální T1 vážené obrazy v 3D akvizici (izotropické, 1mm řezy), axiální FLAIR, T2 vážené obrazy a DWI, koronární FLAIR a T1 vážené obrazy (nebo IR‑ TSE) v rovině kolmé na podélnou osu hipokampů. Podání kontrastní látky (gadolinium) se doporučuje pouze při nálezu léze nebo při klinickém podezření na neurokutánní syndrom [35]. Práce Wellmera et al publikovaná na základě analýzy MR vyšetření několika tisíc pacientů s epileptogenními lézemi doporučuje navíc gradientní sekvenci citlivou na hemosiderin v axiální rovině a tloušťku řezů u všech sekvencí ≤ 3 mm [42]. Sekvence DWI v této práci doporučována není, ale vzhledem k její nízké časové náročnosti a významu při diferenciální diagnostice některých akutních symptomatických záchvatů (např. odlišení akutní ischemie) považujeme za vhodné ji v protokolu ponechat. Časná identifikace epileptogenní léze nejen poskytne správné podklady pro stanovení etiologie záchvatu nebo epilepsie, ale v některých případech může významně pomoci při predikci prognózy a případné farmakorezistence.
Mezi základní pomocná vyšetření patří EEG, které by mělo být optimálně provedeno do 24 hod po prvním GTCS, neboť se tím zvýší jeho senzitivita – záchyt epileptiformní abnormity z 34 na 51 % [40]. Pokud je nález na EEG provedeném za standardních podmínek (v bdělém stavu) normální nebo nespecifický, je vhodné doplnit EEG po spánkové deprivaci, čímž se zvýší záchyt až na 61 % [40]. V některých případech postačuje ke zvýšení výtěžnosti zachycení spánkových stadií, např. u epilepsie temporálního laloku, spánková deprivace pak výrazně aktivuje specifickou EEG abnormitu u genetických generalizovaných epilepsií – většinou pro tyto účely postačuje částečná spánková deprivace. Epileptiformní abnormita v EEG napomáhá rozlišit epilepsii fokální od generalizované, rovněž abnormní pomalá příměs může poukázat na lézi nebo difuzní encefalopatii. Při ložiskové příměsi pomalých vln je riziko opakování záchvatu vyšší.
Detailní popis charakteristik a klasifikace jednotlivých typů epilepsií a epileptických syndromů již přesahuje rozsah tohoto článku, jejich znalost nám často může pomoci již v iniciální fázi diagnostiky záchvatových stavů. Typický klinický obraz může významně podpořit úvahu, že se o epilepsii jedná, na druhé straně zkratkovité závěry nejsou žádoucí. Pacient s epilepsií může být současně postižen i jiným, neepileptickým typem záchvatů.
Rozhodnutí o zahájení léčby
Při rozhodování o léčebném postupu po neprovokovaném záchvatu je nutné posoudit jednak riziko, že se záchvaty budou opakovat, jednak možný dopad těchto záchvatů porovnat s rizikem možných nežádoucích účinků antiepileptik. To vše s přihlédnutím k postoji samotného pacienta.
Riziko opakování záchvatů významně závisí na různých faktorech a je nejvyšší během šesti měsíců po prvním záchvatu. Do dvou let se záchvat opakuje u 40– 50 % nemocných, což představuje 80– 90 % všech recidiv [43].
Kumulace více záchvatů během 24 hod riziko relapsu nezvyšuje, přistupujeme k ní tedy stejně jako k záchvatu izolovanému [44,45]. Předcházející akutní symptomatický záchvat představuje nízké riziko (do 3 %) opakování záchvatu, pokud je jeho příčina reverzibilní (např. metabolická). Vede‑li však tento iniciální inzult k významnému poškození mozku, je riziko významně vyšší [46].
Jako nejvýznamnější faktory zvyšující pravděpodobnost následného rozvoje epilepsie se uvádí neurologická abnormita a abnormní EEG nález. Pojem „neurologická abnormita“ zahrnuje všechny známky, které svědčí pro proběhlé postižení CNS, jako je např. údaj o prodělaném inzultu v anamnéze, známky starší léze na zobrazovacích vyšetřeních, ložiskový nález při objektivním vyšetření nebo přítomnost mentální retardace [47]. Abnormní změny na EEG zvyšují riziko opakování, i když se jedná pouze o fokální výskyt pomalých vln, nicméně specifické epileptiformní projevy zvyšují riziko výrazněji [47].
Za další rizikové faktory z hlediska opakování se považují fokální záchvaty, status epilepticus a vznik prvního záchvatu ze spánku [43], a to zejména při anamnéze předchozího inzultu či léze prokázaná na zobrazovacích vyšetřeních [41].
Neexistují jednoznačné údaje o vlivu věku, pozitivní rodinné anamnézy a výskytu febrilních záchvatů.
Diagnózu epilepsie po prvním neprovokovaném záchvatu lze dle nově přijaté definice v klinické praxi stanovit pouze v případech, kdy jsou údaje o míře rizika pro opakování záchvatu dostupné – například u pacienta, u kterého se po ischemické CMP v odstupu několika měsíců objeví první neprovokovaný epileptický záchvat. V tomto případě je riziko opakování záchvatu dle publikovaných údajů > 70 % [11]. V řadě jiných případů ale údaje o míře rizika pro opakování záchvatu dostupné nejsou – například u pacienta s fokální kortikální dysplazií prokázanou při MR vyšetření – a v takovém případě nelze tedy diagnózu epilepsie po prvním záchvatu stanovit [5]. Se stanovením diagnózy epilepsie (a tudíž i míry rizika opakování záchvatů) souvisí bezprostředně i rozhodnutí o zahájení dlouhodobé léčby antiepileptiky, ale doporučuje se posoudit tyto klinické situace nezávisle. V některých případech je totiž možné, že stanovíme diagnózu epilepsie, ale po dohodě s pacientem léčbu nezahájíme, např. při výskytu záchvatů v dlouhém časovém odstupu (několik let) nebo u záchvatů pacienta významně neobtěžujících. Naopak léčba může být zahájena po prvním neprovokovaném záchvatu, i když se podle definice o epilepsii nejedná – obecně tehdy, když je vysoké riziko opakování záchvatu, jeho závažného průběhu (např. když první záchvat probíhal pod obrazem epileptického statu) nebo komplikací (např. u starších pacientů žijících osaměle, při antikoagulační léčbě, osteoporóze) [3].
Při rozhodování o zahájení léčby je možné řídit se také výsledky studie MESS – prognostickým modelem, který po vyhodnocení roztřídil pacienty do tří rizikových skupin podle neurologické abnormity a EEG nálezu [48]. Nízké riziko (20– 30 %) opakování měli pacienti po ojedinělém záchvatu beze změn v EEG a bez podezření na postižení CNS. Střední riziko měli pacienti tehdy, pokud bylo abnormní buď pouze EEG nebo neurologický nález. Vysoké riziko (60– 70 %) měli pacienti s abnormitou v EEG a současně s dalšími změnami svědčícími pro neurologické postižení. Prospěch ze zahájení léčby měli pacienti s vysokým až středním rizikem. Zahájení antiepileptické léčby po prvním záchvatu snižuje riziko výskytu záchvatů v následujícím období asi na polovinu [43], nicméně dle různých studií neovlivňuje dlouhodobý vývoj a prognózu epilepsie [49]. V tomto smyslu je třeba též pacienta informovat a při rozhodování o zahájení terapie přihlédnout zejména k jeho názoru.
Při výběru vhodného antiepileptika se postupuje dle běžných pravidel – podle typu záchvatu, profilu nežádoucích účinků, věku, pohlaví, komorbidity a komedikace (rizika lékových interakcí) [50]. Při zahájení léčby po prvním záchvatu chybí ale informace o výchozí frekvenci záchvatů. Je tedy obtížné i po několika měsících (nebo i letech) léčby jednoznačně vyhodnotit její účinnost – správný výběr léku i zvolenou udržovací dávku.
V situaci, kdy na základě dostupných anamnestických údajů není možné jednoznačně rozhodnout, zda se o epileptický záchvat jednalo či nikoliv, se nejprve snažíme získat další informace. Pokud ani poté nejsme schopni rozhodnout, co se vlastně pacientovi přihodilo, je třeba svoji pochybnost v diagnostickém závěru vyjádřit. Někdy teprve čas ukáže, o jaký záchvat se jednalo. Zahájení terapie v nejasných situacích není indikováno.
Pacienti by měli být po prvním záchvatu důkladně poučeni o situaci, ve které se ocitli – o možném dalším vývoji, doporučeném režimu. Měli by být také poučeni, jak postupovat, když se záchvat bude opakovat.
Poděkování patří MUDr. Davidu Krýslovi, Ph.D., MUDr. Martinu Tomáškovi a MUDr. Martinu Elišákovi za dříve publikované články či přednesené přednášky, které se staly zdrojem pro přípravu této minimonografie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 21. 4. 2015
Přijato do tisku: 4. 5. 2015
doc. MUDr. Petr Marusič, Ph.D.
Neurologická klinika
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: petr.marusic@fnmotol.cz
Recenzenti
prof. MUDr. Milan Brázdil, Ph.D.
MUDr. Miroslav Moráň
MUDr. Jana Zárubová
doc. MUDr. Petr Marusič, Ph.D.
Docent Marusič promoval v roce 1990 na Fakultě všeobecného lékařství Univerzity Karlovy v Praze. Již během pregraduálního studia se pod vedením prof. MU Dr. Pavla Mareše, DrSc. a doc. MU Dr. Dany Marešové, CSc. zapojil do vědecké činnosti v oblasti experimentální epileptologie a po absolvování fakulty v ní pokračoval současně se specializací v klinické neurologii. Ta postupně převážila, ale problematika epileptologie hlavním zájmem zůstala – absolvoval zahraniční stáže na amerických pracovištích (Yale, Cleveland), ve FN Motol se svými spolupracovníky založil video‑ EEG monitorovací jednotku a epileptochirurgický program pro dospělé pacienty. V roce 2004 obhájil dizertační práci na téma „Modely komplexních parciálních záchvatů – elektrofyziologická a behaviorální korelace se záchvaty u pacientů s epilepsií“, v roce 2009 pak habilitační práci na téma „Klinický význam fokální kortikální dysplazie u pacientů s epilepsií temporálního laloku“. Docent Marusič se řadu let podílí na vzdělávacích a vědeckých akcích tuzemských i zahraničních a publikoval desítky prací v odborném tisku. Od roku 2012 je přednostou Neurologické kliniky 2. LF UK a FN Motol. Byl zvolen předsedou České ligy proti epilepsii odborné společnosti ČLS JEP pro období 2015– 2019.
Zdroje
1. Loiseau J, Loiseau P, Duche B, Guyot M, Dartigues JF, Aublet B. A survey of epileptic disorders in southwest France: seizures in elderly patients. Ann Neurol 1990; 27(3): 232– 237.
2. Annegers JF, Hauser WA, Lee JR, Rocca WA. Incidence of acute symptomatic seizures in Rochester, Minnesota, 1935– 1984. Epilepsia 1995; 36(4): 327– 333.
3. Seneviratne U. Management of the first seizure: an evidence-based approach. Postgrad Med J 2009; 85(1010): 667– 673. doi: 10.1136/ pgmj.2009.082883.
4. Beghi E, Carpio A, Forsgren L, Hesdorffer DC, Malmgren K, Sander JW et al. Recommendation for a definition of acute symptomatic seizure. Epilepsia 2010; 51(4): 671– 675. doi: 10.1111/ j.1528‑ 1167.2009.02285.x.
5. Fisher RS, Acevedo C, Arzimanoglou A, Bogacz A, Cross JH, Elger CE et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia 2014; 55(4): 475– 482. doi: 10.1111/ epi.12550.
6. Hauser WA, Annegers JF, Kurland LT. Incidence of epilepsy and unprovoked seizures in Rochester, Minnesota: 1935– 1984. Epilepsia 1993; 34(3): 453– 468.
7. Benbadis S. The differential diagnosis of epilepsy: a critical review. Epilepsy Behav 2009; 15(1): 15– 21. doi: 10.1016/ j.yebeh.2009.02.024.
8. Task Force for the Diagnosis and Management of Syncope. Guidelines for the diagnosis and management of syncope (version 2009). Eur Heart J 2009; 30(21): 2631– 2671. doi: 10.1093/ eurheartj/ ehp298.
9. Lempert T, Bauer M, Schmidt D. Syncope: a videometric analysis of 56 episodes of transient cerebral hypoxia. Ann Neurol 1994; 36(2): 233– 237.
10. Brigo F, Storti M, Lochner P, Tezzon F, Fiaschi A, Bongiovanni LG et al. Tongue biting in epileptic seizures and psychogenic events: an evidence‑based perspective. Epilepsy Behav 2012; 25(2): 251– 255. doi: 10.1016/ j.yebeh.2012.06.020.
11. Hesdorffer DC, Benn EK, Cascino GD, Hauser WA. Is a first acute symptomatic seizure epilepsy? Mortality and risk for recurrent seizure. Epilepsia 2009; 50(5): 1102– 1108. doi: 10.1111/ j.1528‑ 1167.2008.01945.x.
12. Shorvon S, Guerrini R. Acute symptomatic seizures – should we retain the term? Epilepsia 2010; 51(4): 722– 723. doi: 10.1111/ j.1528‑ 1167.2010.02501.x.
13. Hauser WA. Seizure disorders: the changes with age. Epilepsia 1992; 33 (Suppl 4): S6– S14.
14. DeLorenzo RJ, Hauser WA, Towne AR, Boggs JG, Pellock JM, Penberthy L et al. A prospective, population‑based epidemiologic study of status epilepticus in Richmond, Virginia. Neurology 1996; 46(4): 1029– 1035.
15. Bladin CF, Alexandrov AV, Bellavance A, Bornstein N, Chambers B, Cote R et al. Seizures after stroke: a prospective multicenter study. Arch Neurol 2000; 57(11): 1617– 1622.
16. Camilo O, Goldstein LB. Seizures and epilepsy after ischemic stroke. Stroke 2004; 35(7): 1769– 1775.
17. Giroud M, Gras P, Fayolle H, Andre N, Soichot P, Dumas R. Early seizures after acute stroke: a study of 1,640 cases. Epilepsia 1994; 35(5): 959– 964.
18. Gupta SR, Naheedy MH, Elias D, Rubino FA. Post-infarction seizures. A clinical study. Stroke 1988; 19(12): 1477– 1481.
19. Kilpatrick CJ, Davis SM, Tress BM, Rossiter SC, Hopper JL, Vandendriesen ML. Epileptic seizures in acute stroke. Arch Neurol 1990; 47(2): 157– 160.
20. Labovitz, DL, Hauser, WA, Sacco RL. Prevalence and predictors of early seizure and status epilepticus after first stroke. Neurology 2001; 57(2): 200– 206.
21. Lamy C, Domigo V, Semah F, Arquizan C, Trystram D, Coste J et al. Early and late seizures after cryptogenic ischemic stroke in young adults. Neurology 2003; 60(3): 400– 404.
22. Vespa PM, Nuwer MR, Nenov V, Ronne‑ Engstrom E, Hovda DA, Bergsneider M et al. Increased incidence and impact of nonconvulsive and convulsive seizures after traumatic brain injury as detected by continuous electroencephalographic monitoring. J Neurosurg 1999; 91(5): 750– 760.
23. Datar S, Singh T, Rabinstein AA, Fugate JE, Hocker S. Long‑term risk of seizures and epilepsy in patients with posterior reversible encephalopathy syndrome. Epilepsia 2015; 56(4): 564– 568. doi: 10.1111/ epi.12933.
24. Annegers JF, Hauser WA, Coan SP, Rocca WA. A population‑based study of seizures after traumatic brain injuries. N Engl J Med 1998; 338(1): 20– 24.
25. Salazar AM, Jabbari B, Vance SC, Grafman J, Amin D, Dillon JD. Epilepsy after penetrating head injury. I. Clinical correlates: a report of the Vietnam Head Injury Study. Neurology 1985; 35(10): 1406– 1414.
26. Jennett B. Epilepsy and acute traumatic intracranial hematoma. J Neurol Neurosurg Psychiatry 1975; 38(4): 378– 381.
27. Misra UK, Tan CT, Kalita J. Viral encephalitis and epilepsy. Epilepsia 2008; 49 (Suppl 6): 13– 18. doi: 10.1111/ j.1528‑ 1167.2008.01751.x.
28. Krýsl D, Elišák M. Autoimunitní encefalitidy. Cesk Slov Neurol N 2015; 78/ 111(1): 7– 23. doi: 10.14735/ amcsnn20157.
29. Tiamkao S, Janon C, Sawanyawisuth K, Pratipanawatr T, Jitpimolmard S. Prediction of seizure control in non‑ketotic hyperglycemic induced seizures. BMC Neurol 2009; 9: 61. doi: 10.1186/ 1471‑ 2377‑ 9‑ 61.
30. Hughes JR. Alcohol withdrawal seizures. Epilepsy Behav 2009; 15(2): 92– 97. doi: 10.1016/ j.yebeh.2009.02.037.
31. Hillbom M, Pieninkeroinen I, Leone M. Seizures in alcohol‑ dependent patients: epidemiology, pathophysiology and management. CNS Drugs 2003; 17(14): 1013– 1030.
32. Thundiyil JG, Kearney TE, Olson KR. Evolving epidemiology of drug‑induced seizures reported to a Poison Control Center System. J Med Toxicol 2007; 3(1): 15– 19.
33. Veran O, Kahane P, Thomas P, Hamelin S, Sabourdy C, Vercueil L. De novo epileptic confusion in the elderly: a 1‑year prospective study. Epilepsia 2010; 51(6): 1030– 1035. doi: 10.1111/ j.1528‑ 1167.2009.02410.x.
34. Harden CL, Huff JS, Schwartz TH, Dubinsky RM, Zimmerman RD, Weinstein S et al. Reassessment: neuroimaging in the emergency patient presenting with seizure (an evidence‑based review): report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2007; 69(18): 1772– 1780.
35. Soubor minimálních diagnostických a terapeutických standardů u pacientů s epilepsií. EpiStop 2013. [online]. Dostupné z URL: http:/ / www.epistop.cz/ images/ ZOO_DOWN/ EPI_standard_2013_web.pdf.
36. Krumholz A, Wiebe S, Gronseth G, Shinnar S, Levisohn P, Ting T et al. Practice Parameter: evaluating an apparent unprovoked first seizure in adults (an evidence‑based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Epilepsy Society. Neurology 2007; 69(21): 1996– 2007.
37. Sempere AP, Villaverde FJ, Martinez‑ Menéndez B, Cabeza C, Peña P, Tejerina JA. First seizure in adults: a prospective study from the emergency department. Acta Neurol Scand 1992; 86(2): 134– 138.
38. ACEP Clinical Policies Committee, Clinical Policies Subcommittee on Seizures. Clinical policy: critical issues in the evaluation and management of adult patients presenting to the emergency department with seizures. Ann Emerg Med 2004; 43(5): 605– 625.
39. Holtzman DM, Kaku DA, So YT. New‑ onset seizures associated with human immunodeficiency virus infection: causation and clinical features in 100 cases. Am J Med 1989; 87(2): 173– 177.
40. King MA, Newton MR, Jackson GD, Fitt GJ, Mitchell LA,Silvapulle MJ et al. Epileptology of the first‑ seizure presentation: a clinical, electroencephalographic and magnetic resonance imaging study of 300 consecutive patients. Lancet 1998; 352(9133): 1007– 1011.
41. Hauser WA, Rich SS, Annegers JF, Anderson VE. Seizure recurrence after a 1st unprovoked seizure: an extended follow‑up. Neurology 1990; 40(8): 1163– 1170.
42. Wellmer J, Quesada CM, Rothe L, Elger CE, Bien CG, Urbach H. Proposal for a magnetic resonance imaging protocol for the detection of epileptogenic lesions at early outpatient stages. Epilepsia 2013; 54(11): 1977– 1987. doi: 10.1111/ epi.12375.
43. Berg AT. Risk of recurrence after a first unprovoked seizure. Epilepsia 2008; 49 (Suppl 1): 13– 18. doi: 10.1111/ j.1528‑ 1167.2008.01444.x.
44. Kho LK, Lawn ND, Dunne JW, Linto J. First seizure presentation: do multiple seizures within 24 hours predict recurrence? Neurology 2006; 67(6): 1047– 1049.
45. Commission on Epidemiology and Prognosis, International League Against Epilepsy. Guidelines for epidemiologic studies on epilepsy. Epilepsia 1993; 34(4): 592– 596.
46. Pohlmann‑Eden B, Beghi E, Camfield C, Camfield P. The first seizure and its management in adults and children. BMJ 2006; 332(7537): 339– 342.
47. Berg AT, Shinnar S. The risk of seizure recurrence following a first unprovoked seizure: a quantitative review. Neurology 1991; 41(7): 965– 972.
48. Kim LG, Johnson TL, Marson AG, Chadwick DW. Prediction of risk of seizure recurrence after a single seizure and early epilepsy: further results from the MESS trial. Lancet Neurol 2006; 5(4): 317– 322.
49. Leone MA, Solari A, Beghi E. Treatment of the first tonic‑ clonic seizure does not affect long‑term remission of epilepsy. Neurology 2006; 67(12): 2227– 2229.
50. Hovorka J. Farmakologická léčba epilepsie. Cesk Slov Neurol N 2010; 73/ 106(4): 351– 373.
51. Krijtová H, Krýsl D, Marusič P. Akutní symptomatické záchvaty a akutní symptomatický status epilepticus – definice, příčiny a léčba. Neurol Praxi 2011; 12(4): 203– 208.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2015 Číslo 3
Nejčtenější v tomto čísle
- Addenbrookský kognitivní test – orientační normy pro českou populaci
- Míšní šok – od patofyziologie ke klinickým projevům
- Diagnostika epileptických záchvatů
- Vzduchová embolie mozku – kazuistika

