Kolaterální cirkulace mozku – potenciální cíl terapie mozkových infarktů
Cerebral Collateral Circulation – Potential Target for Cerebral Infarction Management
Leptomeningeal (pial) collaterals are native anastomoses that cross- connect the distal- most arterioles within the branches of the main cerebral arteries. They represent a potential emergency backdoor to maintain blood flow to the brain during an acute ischemic stroke. In addition, support of collateral circulation represents an attractive concept of stroke therapy. So far, neurologists mostly paid attention to recanalization therapies but neglected cerebral collateral circulation as a therapeutic target. This theme is very topical not only for cerebrovascular neurologists. The purpose of this article is to summarize information on a) anatomy and (patho)physiology of cerebral collateral circulation, b) diagnostics of collateral circulation including scoring systems using widely- available CT angiography, and c) pharmacological and non‑pharmacological therapies aimed at augmenting cerebral collateral circulation.
Key words:
stroke – collateral circulation – reperfusion – induced hypertension
Autoři:
O. Volný 1–3; R. Mikulík 1,3
Působiště autorů:
Mezinárodní centrum klinického výzkumu (ICRC), Brno
1; Anatomický ústav LF MU, Brno
2; I. neurologická klinika LF MU a FN u sv. Anny v Brně
3
Vyšlo v časopise:
Cesk Slov Neurol N 2013; 76/109(3): 307-314
Kategorie:
Přehledný referát
Souhrn
Kolaterální mozková cirkulace na úrovni leptomeningeálních kolaterál představuje důležitý systém nativních (preexistujících) anastomóz. Leptomeningeální (neboli piální) kolaterály představují systém drobných distálních arteriol, které propojují hlavní tepny mozkové cirkulace. Právě tyto kolaterály představují potenciální „zadní vrátka“ k udržení dostatečné perfuze v podmínkách akutní ischemické cévní mozkové příhody (CMP). Stav kolaterálního řečiště je jedním z prognostických ukazatelů pacientů s akutní CMP. Navíc terapeutická podpora kolaterální cirkulace představuje atraktivní koncept léčby. Jelikož kolaterální mozkové cirkulaci u pacientů s akutním uzávěrem mozkové tepny nebyla dosud věnována dostatečná pozornost na rozdíl od rekanalizační terapie, považujeme toto téma za velmi aktuální a přínosné nejen pro neurology specializující se na cerebrovaskulární onemocnění. Cílem sdělení je seznámit čtenáře s informacemi o: a) anatomii a (pato)fyziologii cévního zásobení mozku se zaměřením na kolaterální cirkulaci, b) s možnostmi zobrazení kolaterál pomocí široce rozšířené a dostupné CT angiografie včetně užívaných skórovacích škál, c) se současnými terapeutickými možnostmi ovlivnění mozkové cirkulace farmakologickou a nefarmakologickou cestou.
Klíčová slova:
cévní mozková příhoda – kolaterální cirkulace – reperfuze – indukovaná hypertenze
Úvod
Potvrzení prospěchu trombolytické terapie a dokumentování efektivity mechanických extraktorů u pacientů s akutním mozkovým infarktem soustředily pozornost neurologů na obnovení fyziologické cirkulace mozku pomocí rekanalizačních metod [1– 3]. Dosažení úplné rekanalizace vede všeobecně k lepší prognóze pacientů s akutním mozkovým infarktem [4]. Je však také známa skutečnost, že v individuálních případech rekanalizace prognózu nezlepší a naopak nedosažení rekanalizace ji nezhorší. Proto musí existovat i další mechanizmy, které ovlivňují prognózu u akutního mozkového infarktu. Jedním z významných mechanizmů může být kolaterální mozková cirkulace [5].
Kolaterální řečiště ovlivňuje prognózu a výsledný stav pacientů s akutním mozkovým infarktem. Pacienti s lepšími kolaterálami mají vyšší šanci na dosažení lepšího výsledného stavu [6,7]. Představa o využití kolaterální cirkulace jako terapeutického cíle u pacientů s akutním mozkovým infarktem je tudíž velmi atraktivní.
Cílem tohoto sdělení je podat souhrnné informace o anatomii, fyziologii, patofyziologii a o klinickém významu kolaterální cirkulace, včetně současných možností jejího terapeutického ovlivnění.
Anatomie a fyziologie kolaterální cirkulace mozku
Kolaterální mozková cirkulace na úrovni leptomeningeálních kolaterál představuje důležitý systém nativních (preexistujících) anastomóz. Piální neboli leptomeningeální kolaterály představují systém arteriol, které navzájem propojují řečiště hlavních tepen mozkové cirkulace. Právě tyto kolaterály představují potenciální „zadní vrátka“ k udržení dostatečné perfuze v podmínkách akutní ischemické cévní mozkové příhody. Akutní uzávěr způsobí změnu tlakových gradientů a tato změna vede k ovlivnění průtoku krve a k zapojení kolaterální cirkulace, tzv. nábor kolaterál (recruitment), a to i v podmínkách částečného uzávěru mozkové tepny [7]. Úspěšnost náboru kolaterál v prvé řadě závisí na anatomických předpokladech přítomných před vznikem CMP a na některých dalších mechanizmech, které nejsou dosud zcela vysvětleny.
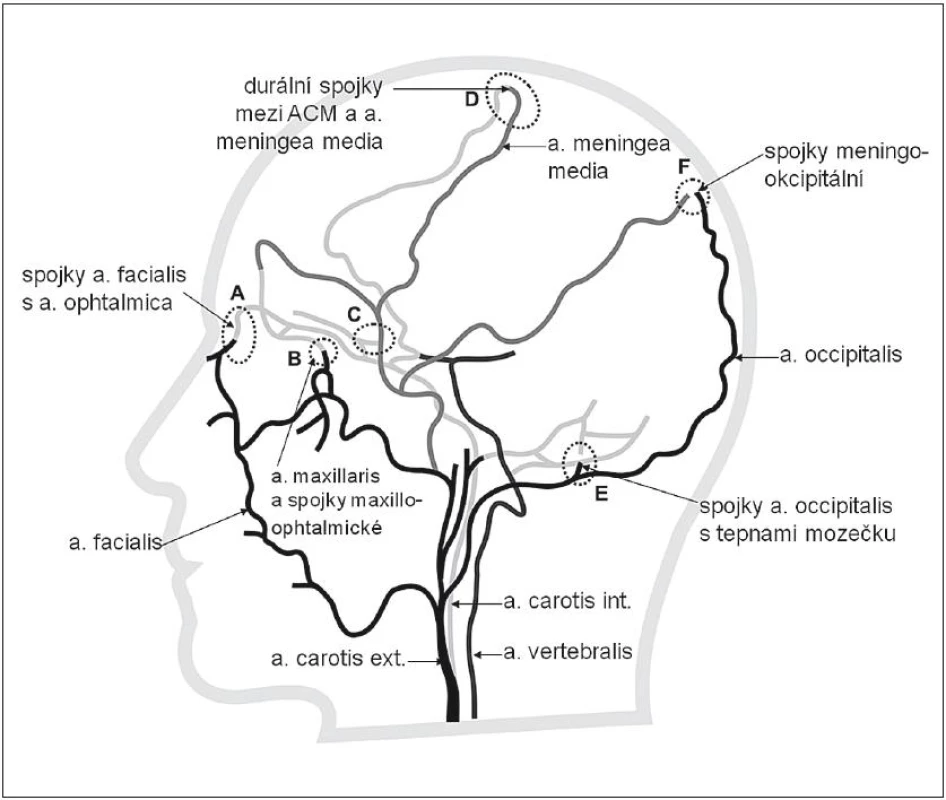
Z anatomického pohledu jsou kolaterální cesty pro arteriální krev vytvořeny na několika úrovních. Systém kolaterál mozkové cirkulace ukazují obr. 1 a 2.
- Obr. 1 znázorňuje extrakraniální kolaterály mezi povodím a. carotis interna (ACI)a externa (ACE).
- Obr. 2 znázorňuje intrakraniální kolaterály na úrovni Willisova okruhu (např. mezi střední a zadní mozkovou tepnou), intrakraniální kolaterály na konvexitě mozku (tzv. leptomeningeální kolaterály mezi konečnými větvemi přední, střední a zadní mozkové tepny) a kolaterály na úrovni mozečkové cirkulace mezi aa. cerebelli superiores a aa. cerebri posteriores (tepenné spojky na úrovni tectum cerebelli).
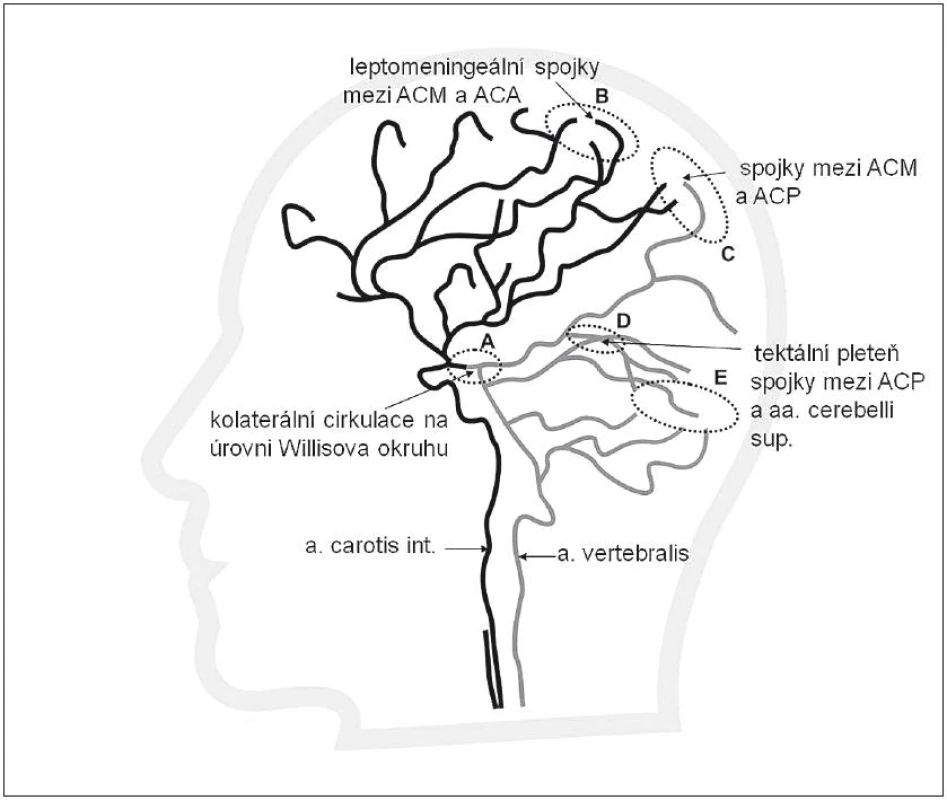
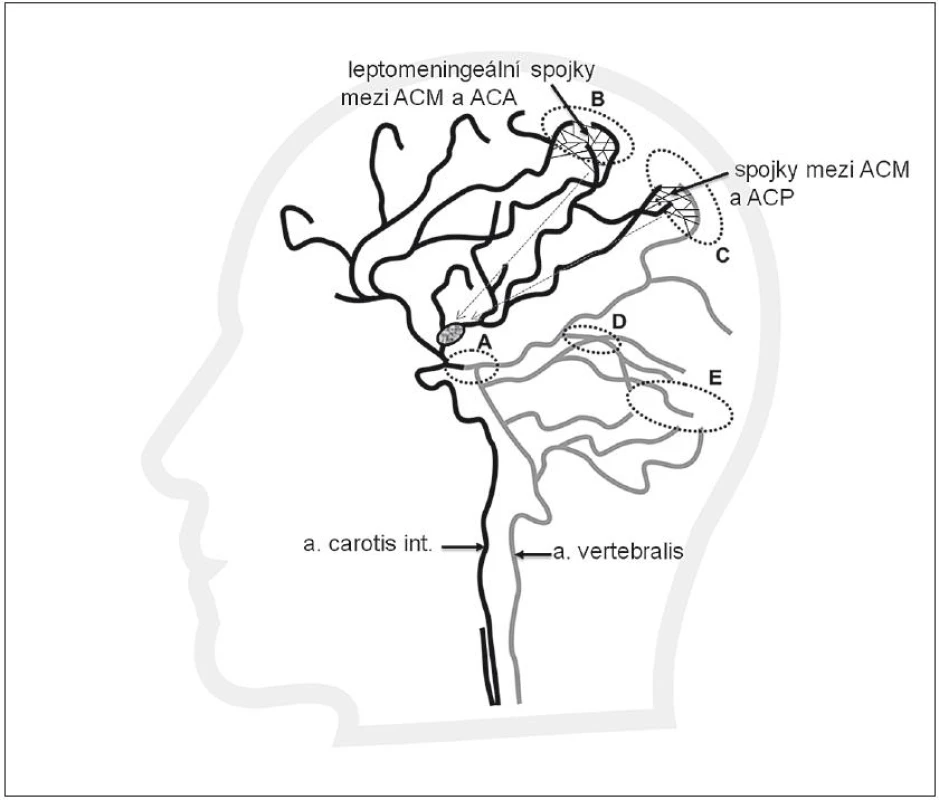
Jelikož většina mozkových infarktů je způsobena tepenným uzávěrem nad úrovní Willisova okruhu, představují leptomeningeální kolaterály (obr. 2) významný kolaterální systém. Leptomeningeální kolaterály jsou anatomicky uloženy v pia mater. Pia (omozečnice) je tenká vazivová blána, která leží na povrchu mozku a proniká do všech zářezů a záhybů na jeho povrchu. Kolaterály přicházejí jako různě bohatě vytvořené arteriolární větve hlavních mozkových tepen ACA, ACM a ACP a vytvářejí v pia mater individuálně bohatou síť s různou kapacitou. Právě přes leptomeningeální kolaterály dochází ke zpětnému (retrográdnímu) plnění při okluzi, např. v povodí ACM. Krev do okludovaného povodí ACM může přitékat cestou kolaterál vytvořených mezi ACM a povodím ACA a ACP. Obr. 3 znázorňuje uzávěr ACM, bohaté kolaterály a retrográdní náplň ACM. Obr. 4 znázorňuje chudé kolaterální řečiště.
Další kolaterály mezi ACI a ACE a na úrovni Willisova okruhu se uplatňují především při uzávěrech a stenózách tepen pod Willisovým okruhem (tj. ACI nebo a. vertebralis). Nejčastěji jde o důsledek dlouhodobě se vyvíjejících tepenných uzávěrů, typicky v oblasti odstupu vnitřní karotidy nebo vertebrální tepny.
Podrobnější studium kolaterálního řečiště umožnil rozvoj zobrazovacích metod, a to zejména neinvazivních angiografických vyšetření, jako jsou MR angiografie a CT angiografie. V následující části textu podáváme informace o možnostech klasifikace funkčnosti kolaterálního řečiště pomocí klasické CT angiografie a o významu funkce kolaterálního řečiště pro výsledný klinický stav pacienta.
Diagnostika stavu kolaterálního řečiště
Vztah kolaterální cirkulace a klinického stavu pacientů
Hodnocení leptomeningeálních kolaterál se opírá o zobrazení toku distálně od místa uzavřené tepny. K zobrazovacím metodám patří CT angiografie (nebo MR angiografie), perfuzní CT, cerebrální angiografie a neurosonografie.
Ačkoliv digitální subtrakční angiografie (DSA) umožňuje hodnocení dynamiky kolaterální cirkulace, základem klasifikačních schémat pro hodnocení kolaterál se stala CT angiografie. Důvodem je, že CT vyšetření je základním vyšetřením u každého pacienta s CMP. Proto v této kapitole uvádíme tři užívaná CT klasifikační schémata: dle autorů Schramma [8], Rosenthala et al [9] a Tana [10]. Všechna zde uvedená schémata využívají semikvantitavního způsobu hodnocení na základě srovnání náplně teritoria tepny v kontralaterální hemisféře s teritoriem v povodí okludované tepny.
Limitací CT angiografie je statické zobrazení mozkové cirkulace. Statické zobrazení cirkulace může vést k podhodnocení stavu leptomeningeálních kolaterál. Důvodem je zpoždění v retrográdní náplni povodí uzavřené tepny. Dynamické zobrazení mozkové cirkulace je možné pomocí dynamické CT angiografie – tato technika však není v běžné klinické praxi příliš rozšířena. Novinku představuje technika tzv. multi‑phase CT angiografie, která na rozdíl od dynamické CT angiografie může být provedena na kterémkoliv přístroji CT bez nutnosti speciálního softwarového vybavení. Technika byla vyvinuta na pracovišti Foothills Medical Centre – Calgary Stroke Program. Její validita je právě testována ve studii ConNECT: A prospective cohort study assesing leptomeningeal Collateral status and variability in patiens with acute aschemic stroke using CT. Radiační dávka pro multi‑phase CTA přitom nepřesahuje 6,5 mSV [11].
CTA klasifikační skóre
1. Skóre dle Schramma pracuje jen se dvěma variantami hodnocení: „špatné (0)“verzus „dobré (1)“ kolaterály. Schramm demonstroval na skupině 20 pacientů s akutním mozkovým infarktem, že pacienti s dobrým kolaterálním řečištěm (n = 7) měli průměrnou hodnotu modifikované Rankinovy škály (mRS) = 0 za 3 měsíce po CMP a pacienti se špatným kolaterálním řečištěm (n = 13) měli mRS v průměru 4 [8].
V jiné studii dosáhli pacienti s „dobře vytvořeným“ kolaterálním řečištěm mRS = 0– 1 ve 40 % případů, což bylo signifikantně více než 8 % pacientů, kteří dosáhli mRS = 0– 1 při špatném kolaterálním řečišti [12].
2. Skóre dle Rosenthala užívá 5bodovou škálu: „výrazně horší (1), horší (2), stejné (3), lepší (4), výrazně lepší kolaterály (5)“. Rosenthal et al prokázali, že stupeň kolaterálního řečiště je prediktorem výsledného stavu u pacientů s akutním mozkovým infarktem v případě nedostatečné rekanalizace, ale zároveň neovlivňuje výsledný stav v případě dosažení úplné rekanalizace. Tento nález podporuje hypotézu, že kolaterální řečiště zlepšuje prognózu pacientů pouze v případě nedostatečné rekanalizace tepny [9].
Zjednodušené Rosenthalovo skóre: „horší, stejné, lepší kolaterály“ bylo následně použito v práci Lima [6]. Ve studii bylo dokumentováno, že stupeň kolaterálního řečiště je nezávislým prediktorem výsledného stavu. Kolaterální řečiště lepší o 1 stupeň uvedené klasifikace zvyšovalo šanci na dosažení mRS = 0– 2 až o 93 %.
3. Skóre dle Tana hodnotí zapojení kolaterál procentuálně: „0 – kolaterály nepřítomné, 1 – kolaterální plnění < 50 % ischemického ložiska, 2 – kolaterální plnění > 50 % ischemického ložiska, 3 – normální plnění ložiska, tj. 100 %“. Tan prokázal, že pacienti, kteří dosáhli mRS po 3 měsících 0– 2, měli průměrné kolaterální skóre 2,5 (n = 38) a dosáhli rekanalizace v 58 % (22 pacientů). Pacienti s výsledným mRS = 3 a více měli průměrné kolaterální skóre < 2 (n = 47) a dosáhli kompletní rekanalizace jen v 32 % (15 pacientů) [10].
Způsob hodnocení stavu kolaterální cirkulace pro klinické využití je ukázán na obr. 5– 7, kde jsou demonstrovány rozdíly v kolaterální cirkulaci u tří pacientů. Na obr. 5a, b je patrné diskrétní plnění tepen a rovněž špatné zapojení kolaterál ve srovnání s obr. 6a, b, kde jsou kolaterály vytvořené lépe. U pacientů je zhodnocena kolaterální cirkulace podle uvedených skóre. Na planárních CTA řezech u obr. 5a a 6a je zakreslena lokalizace trombu v ACM a na obr. 5b a 6b tepny na konvexitě mozku a ve fossa lateralis cerebri (fossa Sylvii) plněné cestou leptomeningeálních kolaterál.

Hodnocení kolaterální cirkulace zahrnuje
- Zhodnocení anatomie Willisova okruhu, např. přítomnost komunikant, hypoplazie úseku A1 či P1.
- Lokalizace uzávěru na CT angiografii.
- Určení přítomnosti retrográdní náplně k distální části trombu (retrográdní náplň na CT angiografii nepřímo svědčí pro zapojení kolaterál).
- Na zdrojových snímcích CT angiografie zhodnocení bohatosti větvení postižené a nepostižené tepny. V případě ACM je bohatost větvení nejlépe hodnotitelná ve fossa Sylvii. Za normální situace je bohatost větvení na obou stranách podobná. Čím více se obraz na postižené straně blíží obrazu na nepostižené straně, tím jsou kolaterály lépe zapojeny a retrográdní náplň je výraznější. Je potřeba si uvědomit, že v případě bohatě vinutých větví ACM bude na zdravé straně vypadat větvení ACM bohatší, než je ve skutečnosti. Důvodem je, že jedna tepna může být na jednom planárním řezu zobrazena jako svítící body vícekrát. Také je nutné mít na vědomí možný zbytkový antegrádní tok při neúplném uzávěru tepny (hodnocení směru toku na CTA ale není možné).
- Změření délky trombu na CT. Z výzkumného pohledu může velikost trombu ovlivňovat zapojení kolaterál různými mechanizmy, např. blokádou kolaterál svou lokalizací nebo uvolňováním vazoaktivních substancí do periferie mozkové cirkulace. Navíc bylo prokázáno, že samotná délka trombu změřená na CT je významná pro predikci úspěšnosti trombolýzy. Zatímco pravděpodobnost kompletní rekanalizace u trombů délky do 5 mm je 40 % a více, u trombů delších než 8 mm je pravděpodobnost kompletní rekanalizace prakticky nulová [13].
Možnosti ovlivnění kolaterál u pacientů s akutním mozkovým infarktem
Pacienti s lepšími kolaterálami mají vyšší šanci na dosažení lepšího výsledného stavu. Terapeutické posílení kolaterální cirkulace je žádoucí, jelikož může vést ke zlepšení prognózy a výsledného stavu pacientů, a to nejen zajištěním přívodu živin a kyslíku do oblasti postižené ischemií (jak demonstrováno výše), ale též dalšími mechanizmy:
- zvýší dostupnost a průnik trombolytika k trombu, protože kolaterály představují přídatnou distribuční cestu pro podané farmakum,
- odplavením menších trombů do periferie cirkulace a
- lepším zapojením fyziologických trombolytických procesů.
Zobrazovacími metodami lze zhodnotit stav kolaterál a na základě jejich zhodnocení nepřímo predikovat úspěšnost trombolýzy. Kompletní rekanalizace po i.v. trombolýze se u pacientů s chudými kolaterálami pohybuje průměrně kolem 15 %. U pacientů s dobrými kolaterálami dle CTA je pravděpodobnost kompletní rekanalizace již dvojnásobná – téměř 30 %. U pacientů s bohatými kolaterálami se pohybuje kolem 40 %, a to bez ohledu na použitý trombolytický protokol [6,7,14,15].
Klinicky je možné efekt trombolytické léčby sledovat pomocí dynamiky změn NIHSS v čase [5]. Efekt trombolýzy a přítomnost průtoku se dají sledovat pomocí transkraniální dopplerometrie (TCD). Studie [16] sledovala přítomnost flow diversion (FD+/ FD– ) dle TCD a hodnotila efekt trombolýzy a pokles NIHSS v čase u pacientů s izolovaným uzávěrem M1 segmentu. U 75 % pacientů (35/ 47 pacientů) s dobrými kolaterálami a FD+ bylo zjištěno 22 % zlepšení vstupního NIHSS během 90 min od zahájení trombolýzy. Naopak u FD– pacientů se špatnou kolaterální cirkulací byl zjištěn jen 0,5% pokles NIHSS během 90 min od podání trombolytika. Rozdíl byl statisticky významný (p = 0,017). Z toho vyplývá, že pacienti s dobrými kolaterálami po podání trombolytika i.v. mají časnější a výraznější zlepšení neurologického deficitu [16]. Naopak pacienti s proximální okluzí v segmentu M1 ACM a chudými kolaterálami mají téměř 4krát vyšší riziko zhoršení klinického stavu během hospitalizace, a to v prvních hodinách následujících po iktu [17].Pacienti s proximální okluzí a špatnými kolaterálami z i.v. trombolýzy nemají výrazný profit. U těchto pacientů je po podání trombolýzy v terapeutickém okně nutné zvážit indikaci mechanické intervence, která představuje pro tyto pacienty šanci dosáhnout lepší výsledný stav [1,2,4,14].
Kolaterální cirkulaci je teoreticky možné ovlivnit postupy nefarmakologickými (A) a farmakologickými (B).
A. Nefarmakologické postupy
- parciální balónková okluze aorty (studie SENTIS)
- elektrostimulace ganglion pterygopalatinum
- extrakorporální kontrapulzace
- polohování pacienta
1. Studie SENTIS a NeuroFlo® katétr
Balónková kontrapulzace je používána v kardiologii u pacientů se srdečním selháním k redistribuci krve do koronárních tepen. Podobným mechanizmem může dojít ke zvýšení perfuze mozku při použití balónkové parciální obstrukce abdominální aorty. Parciální obstrukce je dosaženo pomocí invazivního výkonu, kdy je zaveden dvoubalónkový katétr (NeuroFlo®) do sestupné aorty tak, že jeden balónek je pod a druhý nad odstupem renálních tepen. Oba balónky mohou být nafouknuty nezávisle na sobě (subrenální balónek vždy jako první). Parciální závěr aorty by se měl pohybovat kolem 70 % lumina tepny a délka insuflace 45 min, max. 60 min.
Příznivý efekt na perfuzi mozku je přisuzován redistribuci srdečního výdeje z dolních partií těla a kapacitního venózního řečiště přímo do mozku. Výsledky na zvířecích modelech, na základě kterých byl katétr konstruován, prokázaly, že při parciální okluzi descendentní aorty dochází k signifikantnímu zvýšení perfuze mozku, a to bez výraznějšího zvýšení systémového krevního tlaku [18].
Účinnost a bezpečnost NeuroFlo® katétru v léčbě pacientů s mozkovým infarktem byla testována v pilotní studii SENTIS. Pacienti (n = 500) s mozkovým infarktem do 14 hod od vzniku příznaků byli randomizováni buď ke standardní léčbě, nebo k zavedení NeuroFlo® katétru na dobu 45 min.
U pacientů léčených NeuroFlo® katétrem byla prokázána jen o 17 % vyšší šance, že dosáhnou příznivého výsledného stavu za 3 měsíce od vzniku příznaků definovaného jako: NIHSS 0– 1 a zároveň mRS 0– 1. Tento výsledek je nesignifikantní (OR = 1,17, CI = 0,81– 1,67; p = 0,407). Navíc např. mRS 0– 1 za 3 měsíce dosáhlo srovnatelně v obou skupinách 32 % pacientů. Výskyt závažných nežádoucích účinků byl obdobný v obou skupinách (44 vs 43 %). Výskyt neurologických komplikací byl častější u pacientů léčených konzervativně (24 vs 28 %), zatímco výskyt renálních komplikací byl častější u pacientů léčených katétrem (3,9 vs 1,6 %) [19].
Post‑hoc analýza identifikovala subpopulaci pacientů, kteří by z léčby katétrem mohli mít prospěch. Jednalo se o pacienty s intervencí do 5 hod od vzniku příhody, starší 70 let, s úvodním NIHSS mezi 8 až 14 a s fibrilací síní v anamnéze. Efekt léčby NeuroFlo® katétrem v této skupině pacientů ale musí být prokázán v následujících studiích.
2. Elektrostimulace ganglion pterygopalatinum
Přes dutinu ústní ve zvířecím experimentu vede k vazodilataci na ipsilaterální straně, patrně cestou autonomní vazomotorické inervace mozkových tepen [20]. Multicentrická, randomizovaná studie sledující vliv stimulace na mozkovou cirkulaci u člověka právě probíhá.
3. Extrakorporální kontrapulzace
Pomocí nafukovacích vaků synchronizovaných se srdeční akcí představuje neinvazivní obdobu aortální balónkové kontrapulzace. Externí kontrapulzace byla zkoušena u pacientů s akutní a subakutní CMP v několika čínských studiích provedených v letech 1988 až 2003. Délka aplikace extrakorporální kontrapulzace se pohybovala od 1 do 72 hod (obvykle 35 aplikací 1 hod denně) [21]. Výsledky všech 22 studií prokázaly příznivý výsledný stav hodnocený dle Chinese Stroke Scale. Sledování zaměřená na zlepšení průtoku krve mozkem po extrakorporální kontrapulzaci vždy prokázaly signifikantní zvýšení průtoku. Jedna ze studií prokázala zvýšení průtoku ze 46 ml/ 100 g/ min na 56 ml/ 100 g/ min ve skupině 40 pacientů. Ačkoliv kvalita studií provedených v Číně je obtížně hodnotitelná, zejména z důvodu publikace výsledků v čínštině, výsledky ukazují, že by tato neinvazivní metoda mohla vést ke zlepšení výsledného stavu u pacientů s CMP. Bezpečnost a účinnost je však zapotřebí zhodnotit v randomizovaných a nezávisle provedených klinických studiích.
4. Polohování pacienta
Ideální poloha hlavy z pohledu biomechaniky a fyziologie cirkulace byla kalkulována v matematickém modelu cirkulace lidského mozku. Vychází z několika jevů: k ideální perfuzi ischemického ložiska dochází na základě optimální rovnováhy přítoku krve, tlaku v intersticiálním prostoru a dobrém odtoku venózní krve z dutiny lební cestou mozkových vén, splavů tvrdé pleny a vena jugularis interna. Z matematického modelu a navazujících výpočtů a plyne, že hemodynamicky ideální by byla poloha s 5 až 6° „head- down tilt“, tj. pozice se sklopením hlavy pod úroveň těla, horizontálním uložením těla a mírnou elevací dolních končetin. Opačná pozice „head- up tilt“ by naopak mohla vést k poklesu cerebrální perfuze pro omezení průtoku krčními žilami [22,23].
Klinická studie zaměřená na změny průtoku po akutní CMP sledovala změny mean flow velocity (MFV) a pulsatility index (PI) polohováním hlavy u 20 pacientů (60 ± 15 let, medián NIHSS = 14). Pomocí transkraniálního dopplerovského měření byly sledovány změny průtoku při poloze hlavy 30°, 15° a 0° nad úrovní lůžka. Při snižování polohy hlavy a přibližování k poloze head- down tilt došlo průměrně k 20% zvýšení MFV (p < 0,025). Přitom krevní tlak ani tepová frekvence polohováním hlavy ovlivněny nebyly. To by znamenalo, že poloha hlavy nemá vliv na periferní cévní rezistenci. Bezprostřední zlepšení neurologického stavu hodnocené jako pokles o více než 3 body NIHSS snížením polohy hlavy nastalo u 3 pacientů z 20 (15 %) [24]. Polohování pacienta představuje na první pohled jednoduchou metodu bez nutnosti intervence, která by mohla vést ke změně toku krve a lepšímu zapojení kolaterál bez poklesu mozkové perfuze. Zatím nevyřešeným problémem zůstává bezpečná délka setrvání pacienta v této pozici a zahájení vhodné farmakoterapie. Rovněž dosud chybí randomizovaná studie s „head- down tilt“ pozicí.
B. Farmakologické postupy
Koncepčně jsou farmakologické postupy založeny na indukované hypertenzi. Jednou z experimentálních farmakologických možností, jak zvýšit krevní tlak (TK), je podání alfa 1 agonisty fenylnefrinu, který zvyšuje kolaterální cirkulaci a oxygenaci penumbry v myším modelu CMP. V experimentu došlo k 48% redukci velikosti infarktu po jednu hodinu trvajícím uzavření ACM ve skupině, ve které byl systolický tlak farmakologicky zvýšen o 30 % oproti normálnímu TK [25]. Na indukci hypertenze byla zaměřena zajímavá studie sledující její efekt a riziko intracerebrální hemoragie u pacientů s akutní CMP, u kterých byla použita farmakologicky indukovaná hypertenze. Indukovanou hypertenzi podstoupilo 16 ze 138 pacientů (12 %; věk 68 ± 15,3 let) s neúplnou rekanalizací po trombolýze za splnění podmínek nepřítomnosti intracerebrální hemoragie (ICH) dle CT. Hypertenze byla indukována kontinuálně podávaným fenylnefrinem nebo noradrenalinem. Cílový systolický tlak byl udržován mezi 140 až 180 mmHg po dobu následujících 24 hod. Výsledky ukázaly, že indukovaná hypertenze v uvedeném rozmezí nezvyšuje riziko ICH. Pacienti s indukovanou hypertenzí měli stejné riziko ICH jako pacienti bez indukce (normotenzní), u kterých indukovaná hypertenze nebyla použita, OR = 0,98; 95% CI = 0,11– 8,55. Hodnocení mRS prokázalo podobný výsledný klinický stav při propuštění, OR = 1,85; 95% CI = 0,50– 6,84. V terapii mozkových infarktů u člověka se indukovaná hypertenze standardně nepoužívá [26].
Závěr
Kolaterální mozková cirkulace na úrovni leptomeningeálních kolaterál představuje důležitý systém preexistujících anastomóz, které propojují hlavní tepny mozkové cirkulace. Právě tyto anastomózy představují potenciální „zadní vrátka“ k udržení dostatečné perfuze v podmínkách akutní ischemické cévní mozkové příhody. Kolaterální řečiště je možné kvantifikovat, v praxi nejsnáze pomocí CT angiografie. Znalost hodnocení kolaterál je pro neurology důležitá, jelikož může být prakticky využita v klinické praxi pro zpřesnění prognózy pacientů s akutním mozkovým infarktem. Kolaterální cirkulace rovněž reprezentuje atraktivní terapeutický cíl budoucnosti. Zda tento cíl bude možné jednou využít k léčbě, je potřeba potvrdit dalšími validními studiemi. Řada studií již tento potenciál naznačila a řada studií právě probíhá.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Ondřej Volný
Mezinárodní centrum klinického výzkumu (ICRC)
Pekařská 53
656 91 Brno
e-mail: Ondrej.Volny@seznam.cz
Zdroje
1. Fields JD, Lutsep HL, Smith WS. MERCI Multi MERCI Investigators. Higher degrees of recanalization after mechanical thrombectomy for acute stroke are associated with improved outcome and decreased mortality: pooled analysis of the MERCI and Multi MERCI trials. AJNR Am J Neuroradiol 2011; 32(11): 2170– 2174.
2. Kang DH, Hwang YH, Kim YS, Park J, Kwon O, Jung C. Direct thrombus retrieval using the reperfusion catheter of the penumbra system: forced- suction thrombectomy in acute ischemic stroke. AJNR Am J Neuroradiol 2011; 32(2): 283– 287.
3. Feng W, Vasquez G, Suri MF, Lakshminarayan K, Qureshi AI. Repeated- measures analysis of the National Institute of Neurological Disorders and Stroke rt- PA stroke trial. J Stroke Cerebrovasc Dis 2011; 20(3): 241– 246.
4. Smith WS. Safety of mechanical thrombectomy and intravenous tissue plasminogen activator in acute ischemic stroke. Results of the multi Mechanical Embolus Removal in Cerebral Ischemia (MERCI) trial, part I. AJNR Am J Neuroradiol 2006; 27(6): 1177– 1182.
5. Mikulik R, Ribo M, Hill MD, Grotta JC, Malkoff M, Molina C et al. Accuracy of serial National Institutes of Health Stroke Scale scores to identify artery status in acute ischemic stroke. Circulation 2007; 115(20): 2660– 2665.
6. Lima FO, Furie KL, Silva GS, Lev MH, Camargo EC,Singhal AB et al. The pattern of leptomeningeal collaterals on CT angiography is a strong predictor of long‑term functional outcome in stroke patients with large vessel intracranial occlusion. Stroke 2010; 41(10): 2316– 2322.
7. Liebeskind DS. Collateral circulation. Stroke 2003; 34(9): 2279– 2284.
8. Schramm P, Schellinger PD, Fiebach JB, Heiland S, Jansen O, Knauth M et al. Comparison of CT and CT angiography source images with diffusion- weighted imaging in patients with acute stroke within 6 hours after onset. Stroke 2002; 33(10): 2426– 2432.
9. Rosenthal ES, Schwamm LH, Roccatagliata L, Coutts SB, Demchuk AM, Schaefer PW et al. Role of recanalization in acute stroke outcome: rationale for a CT angiogram‑based „benefit of recanalization“ model. AJNR Am J Neuroradiol 2008; 29(8): 1471– 1475.
10. Tan IY, Demchuk AM, Hopyan J, Zhang L, Gladstone D, Wong K et al. CT angiography clot burden score and collateral score: correlation with clinical and radiologic outcomes in acute middle cerebral artery infarct. AJNR Am J Neuroradiol 2009; 30(3): 525– 531.
11. Menon BK, Smith EE, Modi J, Patel SK, Bhatia R, Watson TW et al. Regional leptomeningeal score on CT angiography predicts clinical and imaging outcomes in patients with acute anterior circulation occlusions. AJNR Am J Neuroradiol 2011; 32(9): 1640– 1645.
12. Bang OY, Saver JL, Buck BH, Alger JR, Starkman S,Ovbiagele B et al. Impact of collateral flow on tissue fate in acute ischaemic stroke. J Neurol Neurosurg Psychiatry 2008; 79(6): 625– 629.
13. Riedel CH, Zimmermann P, Jensen- Kondering U, Stingele R, Deuschl G, Jansen O. The importance of size: successful recanalization by intravenous thrombolysis in acute anterior stroke depends on thrombus length. Stroke 2011; 42(6): 1775– 1777.
14. Bang OY, Saver JL, Kim SJ, Kim GM, Chung CS, Ovbiagele B et al. Collateral flow predicts response to endovascular therapy for acute ischemic stroke. Stroke 2011; 42(3): 693– 699.
15. Tissue plasminogen activator for acute ischemic stroke. The national institute of neurological disorders and stroke rt- pa stroke study group. N Engl J Med 1995; 333(24): 1581– 1587.
16. Kim YS, Meyer JS, Garami Z, Molina CA, Pavlovic AM, Alexandrov AV. Flow diversion in transcranial Doppler ultrasound is associated with better improvement in patients with acute middle cerebral artery occlusion. Cerebrovasc Dis 2006; 21(1– 2): 74– 78.
17. Maas MB, Lev MH, Ay H, Singhal AB, Greer DM, Smith WS et al. Collateral vessels on CT angiography predict outcome in acute ischemic stroke. Stroke 2009; 40(9): 3001– 3005.
18. Shuaib A, Butcher K, Mohammad AA, Saqqur M, Liebeskind DS. Collateral blood vessels in acute ischaemic stroke: a potential therapeutic target. Lancet Neurol 2011; 10(10): 909– 921.
19. Tilley BC, Marler J, Geller NL, Lu M, Legler J, Brott Tet al. Use of a global test for multiple outcomes in stroke trials with application to the National Institute of Neurological Disorders and Stroke t- PA Stroke Trial. Stroke 1996; 27(11): 2136– 2142.
20. Suzuki N, Hardebo JE, Kahrström J, Owman C. Selective electrical stimulation of postganglionic cerebrovascular parasympathetic nerve fibers originating from the sphenopalatine ganglion enhances cortical blood flow in the rat. J Cereb Blood Flow Metab 1990; 10(3): 383– 391.
21. Han JH, Wong KS. Is counterpulsation a potential therapy for ischemic stroke? Cerebrovasc Dis 2008; 26(2): 97– 105.
22. Pranevicius M, Pranevicius O. Cerebral venous steal: blood flow diversion with increased tissue pressure. Neurosurgery 2002; 51(5): 1267– 1273.
23. Aries MJ, Bakker DC, Stewart RE, De Keyser J, Elting JW, Thien T et al. Exaggerated postural blood pressure rise is related to a favorable outcome in patients with acute ischemic stroke. Stroke 2012; 43(1): 92– 96.
24. Wojner- Alexander AW, Garami Z, Chernyshev OY,Alexandrov AV. Heads down: flat positioning improves blood flow velocity in acute ischemic stroke. Neurology 2005; 64(8): 1354– 1357.
25. Shin HK, Nishimura M, Jones PB, Ay H, Boas DA, Moskowitz MA et al. Mild induced hypertension improves blood flow and oxygen metabolism in transient focal cerebral ischemia. Stroke 2008; 39(5): 1548– 1555.
26. Cordina SM, Majidi S, Chaudhry SA, Hassan AE,Rodriguez GJ, Qureshi AI et al. Safety of Induced Hypertension in Acute Ischemic Stroke Patients with Suboptimal Recanalization after Endovascular Thrombolysis. Stroke 2012; Abstract 3086.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2013 Číslo 3
Nejčtenější v tomto čísle
- Mechanizmy spasticity a její hodnocení
- Lidské prionové nemoci v České republice – 10 let zkušeností s diagnostikou
- Myozitida s inkluzními tělísky se slabostí šíjových svalů a pozitivním efektem imunoglobulinu – kazuistika
- Extrakraniálně metastazující meningeomy
