Úloha neurootologa v záchytu poradiačních komplikací u pacientů s vestibulárním schwannomem léčených Leksellovým gama nožem
The Role of a Neurootologist in Identification of Post-radiation Complications in Patients with Vestibular Schwannoma Treated with Leksell Gamma Knife
Purpose:
The results of audiological-otoneurological tests before treatment of patients with vestibular schwannoma with the Leksell gamma knife were compared with findings after the treatment. The results were assessed in correlation with PC volumetry and brain MRI. Changes to the tumor size were monitored and the treatment effect evaluated. We focused on the detection of complications including deterioration of hearing, tinnitus, vertigo, instability, manifestation of neuropathy n. V, development of paresis n. VII, hyporesorptive hydrocephalus.
Patients and methods:
Between 1999 and 2009, 27 patients were fully neurootologically examined before the treatment and subsequently and repeatedly after the treatment. The follow-up after radiosurgery was 20–132 months, 50 months on average.
Results:
Treatment success rate was 81%; enlargement of the tumor was detected in 5 (19%) cases. Three of the five patients with enlarged tumors were successfully treated with reirradiation, one patient was treated using microsurgery (postoperative complications occurred), and one patient was successfully treated with corticosteroids. We detected one patient with hyporesorptive hydrocefalus progression. Total number of complications detected made up 22%.
Conclusions:
Monitoring of the otoneurological profile contributed to detection of some complications associated with the treatment with the Leksell gamma knife. Detection of complications is significant for the patient’s prognosis. The results testify to the significance of involving a neurootologist in the treatment and monitoring of patients with vestibular schwannoma.
Key words:
vestibular schwannoma – radiosurgery – gamma knife
Autoři:
R. Holý 1; J. Skutil 2; M. Navara 1; P. Praženica 1; P. Fundová 1; A. Hahn 2
Působiště autorů:
ORL klinika 3. LF UK a ÚVN – Vojenská FN Praha
1; ORL klinika 3. LF UK a FN Královské Vinohrady, Praha
2
Vyšlo v časopise:
Cesk Slov Neurol N 2013; 76/109(2): 191-196
Kategorie:
Krátké sdělení
Souhrn
Cíl:
Porovnání výsledků audiologických a otoneurologických testů před radiochirurgií Leksellovým gama nožem u pacientů s vestibulárním schwannomem a po ní. Výsledky byly hodnoceny v korelaci s MR mozku a PC volumometrií. Sledovali jsme změnu velikosti nádoru a vyhodnocovali efekt léčby. Zaměřili jsme se na záchyt komplikací léčby ve smyslu zhoršení sluchu, tinnitu, vertiga, instability, projevů neuropatie n. V, vzniku poruchy funkce n. VII, hyporesorpčního hydrocefalu.
Soubor a metodika:
Dvacet sedm pacientů sledovaných v letech 1999–2009. Provedeno komplexní neurootologické vyšetření před léčbou a po ní. Follow-up po radiochirurgii byl 20–132 měsíců, průměr 50 měsíců.
Výsledky:
Úspěšnost léčby byla 81 %, u 5 (19 %) nemocných došlo ke zvětšení nádoru. Z toho byli tři pacienti úspěšně léčeni reiradiací, jedna pacientka byla léčena úspěšně mikrochirurgicky s pooperačními komplikacemi a jeden pacient léčen úspěšně kortikosteroidy. Zachytili jsme jednu pacientku s progresí hyporesorpčního hydrocefalu. Celkový záchyt komplikací tvořil 22 %.
Závěr:
Monitoring otoneurologického profilu přispěl k odhalení některých komplikací léčby Leksellovým gama nožem. Záchyt komplikací je pro další osud pacienta významný. Výsledky studie ukazují na potřebnou roli neurootologa ve sledování pacientů s vestibulárním schwannomem.
Klíčová slova:
vestibulární schwannom – radiochirurgie – gama nůž
Úvod
Vestibulární schwannom (VS) je nezhoubný nádor vycházející z ektodermu Schwannovy pochvy vestibulární porce osmého hlavového nervu. Při růstu nádor nejprve rozšíří ústí vnitřního zvukovodu a poté expanduje do mostomozečkového koutu (MMK), kde může komprimovat mozkový kmen, kraniální nervy V, VII, V, IX, X a mozeček [1–3]. Prvními příznaky bývají ušní šelest a postupná porucha sluchu, vestibulární příznaky se dostavují později. Symptomatologie nemusí vůbec korelovat s růstem nádoru a jeho velikostí, příčinou pozdní diagnostiky mohou být právě mírné obtíže v rozporu se značnými rozměry tumoru [4–8]. Neléčený VS je potenciálně letální. Útlak mozkového kmene, hydrocefalus a smrt může nastat po 5 až 15 letech růstu nádoru. VS tvoří 7–8 % všech intrakraniálních nádorů a 75–90 % všech nádorů MMK. Nejčastější výskyt je ve věku mezi 30 a 60 lety, dvakrát častěji u žen. Roční incidence je přibližně 9,4–17,4 případů na 1 000 000 obyvatel [1,9–11]. V praxi bychom měli u každé náhle vzniklé senzorineurální poruchy sluchu či u asymetrické nitroušní nedoslýchavosti nebo jednostranného tinnitu pokaždé pomýšlet na VS, a proto provádíme kompletní kochleovestibulární testy. Vždy indikujeme MR mozku [4–6,12–14]. Standardní léčebným postup je mikrochirurgická operace s radikálním odstraněním nádoru s minimálními následky, kterou u nás zavedl Eduard Zvěřina v roce 1983 [15–22]. Alternativním způsobem léčby pro VS do velikosti 3 cm je radiochirurgie Leksellovým gama nožem (LGN) [1,9–11,23–27] či stereotaktická radioterapie (Cyberknife, X-nůž) [1,61–63]. V indikovaných případech lze VS pouze sledovat pomocí kontrolních MR mozku každých 6–12 měsíců [1,61–63]. Dosud bylo na celém světě léčeno LGN přes 52 000 pacientů s VS, což je asi 10 % všech indikací pro léčbu LGN [9–11,29–35]. Radiochirurgie LGN je pro pacienta bez rizika mortality, riziko morbidity je relativně malé [1,9–11,28–30,36].
Materiál a metoda
Za období 1999–2009 jsme vyšetřili na ORL klinice 3. LF UK a ÚVN celkem 53 pacientů s diagnózou VS. Dvacet sedm z nich bylo indikováno k léčbě LGN. Všichni byli komplexně otoneurologicky vyšetřeni před léčbou, následně po léčbě v rozmezí 2–24 měsíců proběhla první kontrola a u většiny z nich i opakovaná kontrola. Léčba LGN byla provedena v Nemocnici Na Homolce v Praze na oddělení stereotaktické neurochirurgie. Z 27 pacientů bylo 15 (56 %) mužů a 12 (44 %) žen, ve věku 28–80 let, průměrný věk pacientů byl 54 roků, nádor byl zaznamenán 13krát vlevo a 14krát vpravo. Maximální výskyt osm (30 %) nemocných byl v šesté dekádě. U všech nemocných byla odebrána komplexní anamnéza, provedeno celkové ORL vyšetření, otomikroskopické vyšetření, vyšetření hlavových nervů s důrazem na projevy neuropatie n. trigeminus a na funkci lícního nervu, kompletní baterie audiologických a vestibulárních testů – tónový a slovní audiogram, tympanometrie, vyšetření výbavnosti stapediálního reflexu, vyšetření kmenových potenciálů (BERA), vestibulární vyšetření pomocí videonystagmografie (VNG) včetně všech běžný zkoušek: spontánní nystagmus, optokinetický nystagmus, polohovací a polohové testy, rotační pendl test, kalorická bitermální zkouška vodou, posturografie [4–8,13,14]. U všech byla indikována MR mozku [4–6,8,12,13,37–39]. Vyhodnocovali jsme změny kochleovestibulárních nálezů. Sledovali jsme pacienty i v časném období od 2. do 24. měsíce po léčbě. Výsledky jsme hodnotili v korelaci i s vyšetřením MR mozku před léčbou a po ní. Pomocí MR a PC volumometrie jsme vyhodnocovali efektivitu této léčebné modality ve smyslu zastavení růstu nádoru či jeho zmenšení nebo zvětšení. Zaměřili jsme se na odhalení komplikací léčby včetně přechodných – zhoršení sluchu, tinnitu, vertiga, instability, projevů neuropatie n. V, vzniku poruchy funkce n. VII nebo vzniku hyporesorpčního hydrocefalu [4–6,13,35,37]. Záchyt komplikací je pro další osud pacienta významný. Indikace léčby LGN u našich pacientů vzešla z konziliárního vyšetření neurochirurgem, event. otochirurgem a radiochirurgem. Neurootolog měl úlohu diagnostickou a má mít svou roli ve sledovacím období.
Výsledky
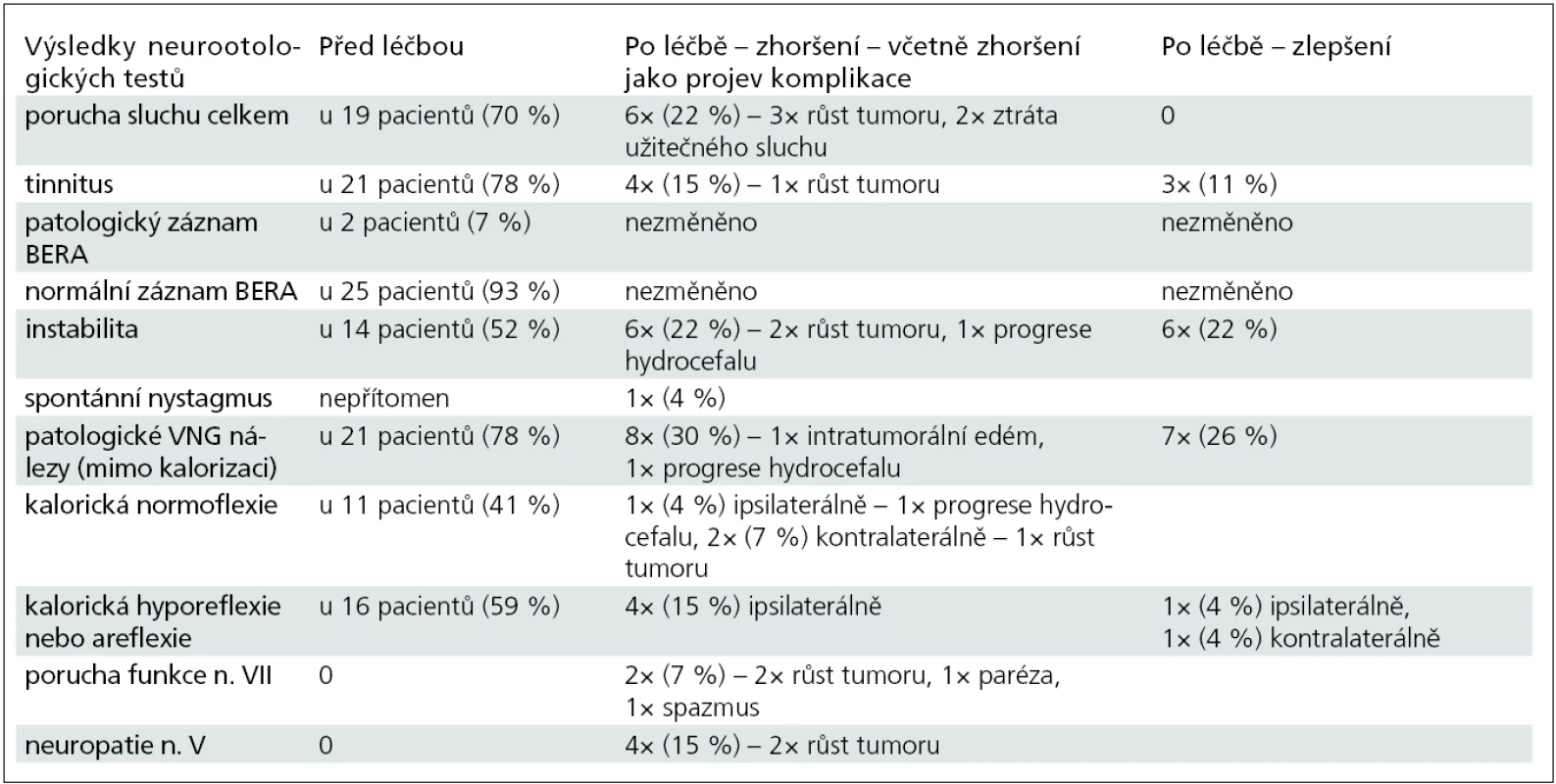
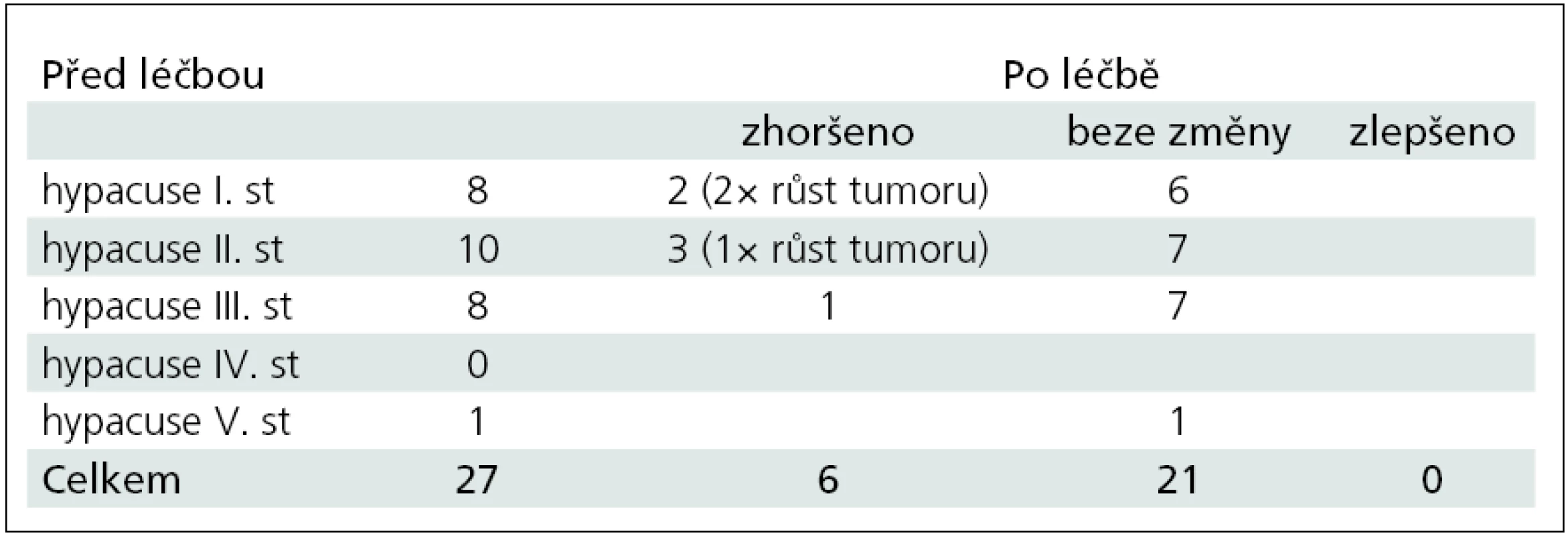
Výstupní hodnoty z provedených audiologických,VNG testů a MR vyšetření před odesláním na léčbu LGN a v období po radiochirurgii jsou komentovány v následujícím textu a tab. 1. Iniciálními symptomy byly: percepční nedoslýchavost u 11 (40,7 %) nemocných, ušní šelest u 5 (18,5 %) pacientů, ušní šelest + percepční nedoslýchavost u 6 (22,2 %) pacientů, instabilita u jednoho (3,7 %) nemocného, ušní šelest + percepční nedoslýchavost + instabilita u 1 (3,7 %) nemocného. Nauzea u 1 pacienta (3,7 %), dyskomfort v uchu u 1 pacienta (3,7 %) a obtíže s C páteří se vyskytly u 1 (3,7 %) nemocného. Porucha sluchu před léčbou byla zjištěna celkově u 19 (70 %) pacientů. K hodnocení tónových audiogramů bylo použito Gardner-Robertsonovy klasifikace [1,2,9–11,34,40–46]. Sluchové postižení a jeho změny jsou detailně popsány v tab. 2. Další patologické VNG nálezy před léčbou (mimo kalorickou hyporeflexii a areflexii) byly tyto: sakády u sledovacích očních pohybů 10×, patologický nález při torzním testu 10×, patologické nálezy u polohových a polohovacích testů 5×, porušený optokinetický nystagmus 3×, patologický nález při pendl testu 3×. Ke korelaci velikosti VS je užívána Koosova klasifikace podle stadií. Pro srovnání velikosti nádoru před léčbou a po ní se taktéž užívá PC volumometrie [18,19,22,47]. U našich 27 pacientů byla zjištěna velikost tumoru dle Koose: I. stadium 6×, II. stadium 11×, III. stadium 9×, IV. stadium 1×. Při kalorickém testu byla zjištěna normoreflexie u 11 (41 %) pacientů, z toho u VS I. stadia 4×, II. stadia 3×, III. stadia 4×. V souboru našich 27 pacientů jsme zaznamenali úspěch léčby celkově u 22 (81 %) pacientů, z toho nezměněnou velikost nádoru v 9 (33 %) případech, zmenšení ve 13 (48 %) a zvětšení u 5 (19 %) nemocných. Změny velikosti VS po léčbě jsou zobrazeny v grafu 1. Z pěti pacientů se zvětšeným nádorem byli tři úspěšně léčeni reiradiací, a to průměrně 37 měsíců od primární radiochirurgie se zastavením dalšího růstu ozářeného ložiska. Jedna pacientka byla léčena 41. měsíc po radiochirurgii mikrochirurgicky s pooperačními komplikacemi nakonec úspěšně a jeden pacient léčen úspěšně kortikosteroidy pro poradiační intratumorální edém vzniklý jeden rok po léčbě LGN. Zachytili jsme jednu pacientku s progresí hyporesorpčního hydrocefalu úspěšně léčenou shuntovou operací (tab. 3). Kontrolu po radiochirurgii naší ORL klinice absolvovali tři pacienti jednou, 18 pacientů dvakrát, pět pacientů třikrát a jeden pacient čtyřikrát. Follow-up po radiochirurgii byl 20–132 měsíců, s průměrem 50 měsíců. U devíti pacientů byl follow-up do 24 měsíců od léčby, u 10 pacientů 25–54 měsíců, u čtyř pacientů 55–84 měsíců a u čtyř pacientů 85–132 měsíců.

Statistika
Posuzovali jsme, zda se statisticky významně léčbou změnila velikost tumoru. Provedli jsme neparametrický Wilcoxonův test pro dva závislé výběry. Závěr: Wilcoxonovým testem se nepodařilo prokázat, že by se na zvolené hladině významnosti 0,05 velikost tumoru před léčbou a po ní lišila.
Dále jsme sledovali závislost výsledku léčby na velikosti tumoru před léčbou. Byl použit Fisherův test. Závěr: výsledek léčby je statisticky významně na hladině významnosti 0,1 závislý na velikosti tumoru před léčbou. U malých nádorů do 400 mm3 je léčba LGN vždy úspěšná (100 %), tumor se zmenšil nebo se jeho růst zastavil.
Dále jsme hodnotili Fisherovým testem, zda provedená radiochirurgie statisticky významně ovlivňuje sluch, tinnitus, instabilitu, VNG nálezy. Závěr: u instability byla změna léčbou statisticky významná na hladině významnosti 0,01. U těch pacientů, u kterých se instabilita vyskytovala před radiochirurgií, došlo léčbou ke změně u 71,4 % (zlepšeno u 42,9 % a zhoršeno u 28,5 %), stejný stav zůstal pouze u 28,6 %. U těch pacientů, kde instabilita před léčbou nebyla přítomna, zůstal stejný stav bez instability u 84,6 % a zhoršení nastalo u 15,4 %. U ostatních příznaků nebyla prokázána statistická významnost jejich změny po léčbě na zvolené hladině významnosti 0,05.
Kazuistiky
Kazuistika 1
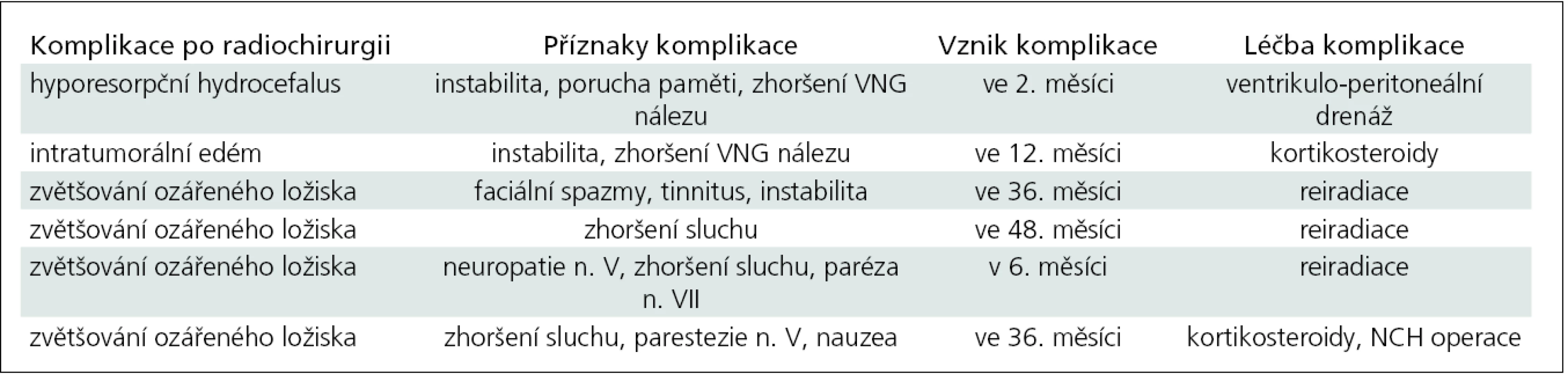
Jednasedmdesátiletá žena s VS III. stupně vlevo rozměry 18 × 20 × 20 mm a PC volumometrie 3 600 cmm. Ozáření tumoru referenční dávkou na okraji nádorového ložiska 12 Gy na 50% izodóze. U pacientky se po léčbě LGN zhoršil hyporesorpční hydrocefalus, který se klinicky projevil dva měsíce po radiochirurugii. Hydrocefalus byl patrný i před radiochirurgickou léčbou, ale byl klinicky němý. Po léčbě byla pacientka neschopna chůze, dostavila se porucha paměti, při VNG vyšetření se změnila kalorická hyporeflexie na areflexii na straně nádoru. Komplikace se úspěšně vyřešila ventrikuloperitoneální drenáží. Poslední kontrola proběhla 36 měsíců od radiochirugie s kontrolním CT, které bylo hodnoceno jako přetrvávání hydrocefalu, ale bez klinické symptomatologie. Sluch se nemění, instabilita neprogreduje.
Kazuistika 2
Šestatřicetiletá žena s VS III. stupně vlevo dle MR mozku s PC volumometrií (rozměry 22 × 31 × 23 mm a objem 5 400 cmm). Nádor cíleně ozářen LGN dávkou 24 Gy v maximu a minimální referenční okrajová dávka na 50% izodóze 12 Gy. Po jednom roce a po dvou letech od radiochirurgie LGN došlo k zmenšování nádoru o 15 %. Komplikace se objevila tři roky od radiochirurgie LGN. Došlo ke zvětšení o 16 % provázené prudkým zhoršením sluchu na straně tumoru, vznikem parestezií n. V na straně nádoru, nauzeou. VNG bez změny. Nasazeny na dva měsíce kortikosteroidy k vyloučení poradiační intratumorální edémové reakce. Po dvou měsících kontrolní MR mozku a PC volumometrie ukázaly na další pomalý růst VS o 22 % oproti stavu před léčbou LGN. Tento růst byl indikací k neurochirurgické mikrochirurgické operaci provedené 41 měsíců od léčby LGN. Při operaci byl odstraněn nádor. Pooperačně pátý den vznik komplikace – pneumocefalus s útlakem třetí komory a parézy n. VII dle House-Brackmanna III. st., narůstala cefalgie. Devátý den byla provedena úspěšná revizní operace s plastikou vnitřního zvukovodu. Pacientka absolvovala úspěšnou rehabilitaci mimického svalstva vpravo. Po třech měsících od ukončení hospitalizace při kontrole byla bez obtíží, pouze trvá těžká porucha sluchu, VNG beze změn, pacientka chodí do zaměstnání.
Diskuze
Provedli jsme analýzu dat získaných z kochleovestibulárních testů před léčbou LGN a po ní. Zajímavý je dvakrát nález normálního BERA záznamu, a to u pacienta s nádorem I. stadia, ale stejně tak i u pacienta s nádorem III. stadia. Při VNG testech byla zjištěna kalorická normoreflexie u nádoru velikosti I. stadia čtyřikrát, II. stadia třikrát, III. stadia čtyřikrát. Vztah mezi velikostí nádoru a patologickým nálezem při BERA a VNG vyšetření nebyl potvrzen. Dle Hahna a Pichaniče stěžejní místo ve vestibulárním vyšetření má kalorická zkouška, která ve většině případech vykazuje hyporeflexii na straně léze, avšak normoreflexie nevylučuje objemný nádor [4–6,8,37]. V literatuře popisovanou Bruns-Stewartovu disociaci nystagmu u pokročilých stadií onemocnění jsme nezaznamenali [8]. MR mozku je prováděna u každého pacienta se suspekcí na retrokochleární lézi, a to i při normálním BERA nálezu a normálním VNG záznamu [13,18,19,22]. V našem souboru byl zastaven růst nádoru v 81 %, po léčbě nádor nezměnil svoji velikost u 33 %, zmenšil se u 48 % a zvětšil se u 19 % nemocných. Ke zmenšení objemu nádoru po této léčbě může dojít za několik měsíců, ale také i za 10 let. Během jednoho roku lze zmenšení VS pozorovat v 32 %, za dva roky ve 40 %, za čtyři roky v 64 % a za 10 let v 97 %. K recidivě zvětšení nádorové masy VS dochází po této léčbě do pěti let, později se již nepozoruje [29,35]. K zástavě růstu VS dochází v 95 % a mortalita samotné léčby je nulová [1,9,11,35,45,48,49].
Na oddělení stereotaktické a radiační neurochirurgie v Nemocnici Na Homolce v Praze bylo v období 1992–2002 radiochirugicky léčeno 476 pacientů a v období 1992–2011 1 203 pacientů s VS [1,9–11]. S odstupem dvou let po léčbě LGN se nádor zmenšil v 41 %, neuropatie n. V se objevila u 5 % nemocných, paréza n. VII u 2 % pacientů, zhoršení sluchu u 17 %, hyporesorpční hydrocefalus se nově rozvinul u 7 % pacientů. [1,9–11,35]. Nemocní po radiochirurgii jsou zváni ke kontrole za 24 až 36 měsíců. Pak se kontroly prodlužují na interval za 36–60 měsíců. V případě komplikací je frekvence kontrol častější. [35,44,46,50–55]. Výsledky centra v Pittsburgu v USA dosahují zastavení růstu nádoru v 97 %, k poradiační neuropatii n. VII dochází v 1 % a užitečný sluch si zachová 50–77 % pacientů. Po léčbě LGN se nádor zmenšil v 73 % a k rozvoji hydrocefalu dochází u 3 % pacientů [26,35,53–60].
Odhalili jsme celkem šest komplikací po radiochirurgii (22 %) v souboru 27 pacientů. Jednalo se o hyporesorpční hydrocefalus zvládnutý úspěšně ventrikulo-peritoneální drenážní operací, dále pak o poradiační intratumorální edém řešený úspěšně kortikosteroidní terapií. Komplikace ve smyslu dalšího zvětšování ozářeného ložiska se vyřešily úspěšně reiradiací a NCH operací (tab. 3).
Ke zvětšení ozářeného ložiska po radiochirurgické léčbě LGN může dle Liščáka et al dojít ze tří příčin:
- může se jednat o pokračující růst ozářeného ložiska neboli selhání léčby,
- může se jednat o přechodný intratumorální edém, který pozorujeme obvykle první rok po léčbě LGN a do dvou let odeznívá,
- po léčbě zářením, včetně radiochirurgie LGN, může nádorová buňka projít ještě několika mitózami a poté se růst ozářeného ložiska zastaví. Je dokumentováno, že po léčbě se nádor může ještě do cca dvou let mírně zvětšit, ale pak už v růstu nepokračuje [1,35].
V rozboru našich pacientů po reiradiaci, která proběhla 26 až 48 měsíců po primární léčbě LGN, se jednalo o první typ příčiny selhání léčby. Důležité je, že další progrese růstu tumoru, poruchy sluchu ani instability se po reiradiaci již dále nevyskytovaly. Otoneurolog objevil tyto komplikace, což vedlo k časnému zahájení kortikosteroidní terapie poradiačního intratumorálního edému a napomohlo k indikaci reiradiace nádoru, a tím k zastavení dalšího růstu ozářeného ložiska. U pěti ze šesti pacientů byly komplikace úspěšně zvládnuty. Pouze u jedné pacientky kortikoterapie nezabránila dalšímu zvětšování nádoru, což vedlo k mikrochirurgické neurochirurgické operaci.
V praxi je zvýraznění subjektivních obtíží pacienta indikací k časnému provedení kompletních kochleovestibulárních testů a časnější kontrole u radiochirurga, tedy dříve než za 24–36 měsíců od léčby LGN. V literatuře se nám nepodařilo zaznamenat doporučení ani vyšetřovací protokoly v takovémto rozsahu. V zahraničí je běžné sledovaní audiologické podle Gardner-Robertsonovy klasifikace poruchy sluchu, sledování subjektivního vnímání vertiga, observace funkce lícního nervu podle klasifikace House-Brackmanna, projevy neuropatie n. V, dále je monitorována změna velikosti nádoru a eventuální rozvoj hyporesorpčního hydrocefalu pomocí MR mozku a PC volumometrie, a to v intervalech po 24–36 měsících, čtyřech, sedmi, 10, 20 letech od léčby LGN [18,27]. Díky získaným výsledkům (některé podpořeny statistickou významností) se nám jeví jako účelný námi zvolený monitoring neurootologického profilu, včetně sledování kritického časného období do 24. měsíce od radiochirurgie.
Závěr
Naše výsledky ukazují na vhodnost monitorovat neurootologický profil u pacientů s VS, a to i v časném kritickém období po radiochirurgii. Může to být v klinické praxi přínosné k včasnému záchytu možných komplikací léčby LGN. Neurootolog je platným členem sledovacího týmu odborníků, který se zabývá léčbou pacientů s VS.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
as. MUDr. Richard Holý
ORL klinika 3. LF UK a ÚVN
U Vojenské nemocnice 1200
169 02 Praha 6
e-mail: richard.holy@uvn.cz
Přijato k recenzi: 10. 4. 2012
Přijato do tisku: 21. 8. 2012
Poděkování
Moje poděkování patří v první řadě prim. doc. MUDr. Romanovi Liščákovi, CSc., a doc. MUDr. Vilibaldu Vladykovi, CSc., z pracoviště stereotaktické a radiační neurochirurgie Nemocnice Na Homolce v Praze za spolupráci při léčbě společných pacientů a za velmi cenné připomínky k rukopisu. Dále moje poděkování náleží prof. MUDr. Eduardovi Zvěřinovi, DrSc., a plk. prof. MUDr. Vladimírovi Benešovi, DrSc., za věcné připomínky a rady jak k problematice vestibulárního schwannomu, tak i k rukopisu. Nakonec bych velmi rád poděkoval za pomoc se statistickým zpracováním dat Ing. Aleně Dohnalové z Fyziologického ústavu 1. LF UK v Praze.
Zdroje
1. Liščák R. Vestibulární schwannom. In: Liščák R et al. Radiochirugie gama nožem, principy a neurochirurgické aplikace. Praha: Grada Publishing 2009: 93–108.
2. Sartor K. MR Imaging of the skull and brain: a correlative text atlas. 1st ed. New York (NY): Springer Verlag 1992: 354–366.
3. Bednář B et al. Patologie I. 1st ed. Praha: Avicenum 1982: 415–416.
4. Hahn A, Dutka J. Comprehensive diagnosis of tumours of the statoacoustic nerve. Cesk Otolaryngol 1989; 38(2): 65–69.
5. Hahn A. Neurootologische Befunde bei Patienten mit Akustikusneurinomen [dissertation]. Würzburg (Germany): die Bayerische Julius-Maximilians Univ 1993.
6. Hahn A, Fundova P, Schneider D. Audiovestibular findings prior to and after acoustic neuroma surgery. Int Tinnitus J 2000; 6(1): 67–69.
7. Molčan M. Vertigo – základy diagnostiky a liečby. 1st ed. Košice: Elfa 2002: 106–109.
8. Pichanič M. Klinická otoneurológia. 1st ed. Martin: Osveta 1992: 235–254.
9. Liščák R, Vladyka V, Urgošík D, Šimonová G, Novotný J jr, Bareš K. Neurinom akustiku a jeho léčba Leksellovým gama nožem. Otorinolaryngol Foniat 1998; 47: 103–105.
10. Liščák R, Novotný J jr, Vladyka V. Rizikové faktory radiochirurgické léčby neurinomu akustiku pomocí gama nože. Cesk Slov Neurol N 1999; 62/95(5): 277–283.
11. Liscak R, Vladyka V, Simonová G, Novotný J. Radiosurgical treatment of meningioma with the Leksell gamma knife. Cas Lek Cesk 1995; 134(17): 534–538.
12. Šmilauer T, Kluh J, Zvěřina E, Betka J. Přínos BERA k diagnostice neurinomu akustiku. Otorinolaryngol Foniat 2001; 50: 99–102.
13. Holy R, Navara M, Dosel P, Fundova P, Prazenica P, Hahn A. Hyperbaric oxygen therapy in idiopathic sudden sensorineural hearing loss (ISSNHL) in association with combined treatment. Undersea Hyperbar Med 2011; 38(2): 137–142.
14. ÚVN (CZ). Směrnice pro vyšetřování vestibulární činnosti. Praha: Ústřední vojenská nemocnice v Praze ORL oddělení 1985: 1–44.
15. Koval J, Molcan M, Bowdler AD, Sterkers JM. Retrosigmoid transmeatal approach: an anatomic study of an approach used for preservation of hearing in acoustic neuroma surgery and vestibular neurotomy. Skull Base Surg 1993; 3(1): 16–21.
16. Samii M, Matthies C. Management of 1000 vestibular schwannomas (acoustic neuromas): hearing function in 1000 tumor resection. Neurosurgery 1997; 40(2): 248–262.
17. Tos M, Thomsen J, Harmsen A. Results of translabyrinthine removal of 300 acoustic neuromas related to tumour size. Acta Otolaryngol Suppl 1988; 452: 38–51.
18. Skrivan J, Zverina E, Betka J, Kluh J, Kraus J. Our surgical experience with large vestibular schwannomas. Otolaryngol Pol 2004; 58(1): 69–72.
19. Zverina E. Acoustic neuroma – vestibular schwannoma – personal experience of up-to-date management. Cas Lek Cesk 2010; 149(6): 269–276.
20. Urgošík D, Živný B, Zvěřina E, Fusek I, Stejskal L, Plas J. Elektrofyziologické sledování funkce n. VII. při operacích neurinomu n. VIII. Cesk Slov Neurol N 1994; 57/90(1): 17–21.
21. Wowra B, Horstmann GA, Cibis R, Czempiel H. Profile of ambulatory radiosurgery with the gamma knife system. 2: Report of clinical experiences. Radiologe 1997; 37(12): 1003–1015.
22. Talfer S, Dutertre G, Conessa C, Desgeorges M, Poncet JL. Surgical treatment of large vestibular schwannomas (stages III and IV). Eur Ann Otorhinolaryngol Head Neck Dis 2010; 127(2): 63–69.
23. Leksell L. The stereotactic method and radiosurgery of the brain. Acta Chir Scand 1951; 102(4): 316–319.
24. Leksell L. Cerebral radiosurgery. I. Gammathalamotomy in two cases of intractable pain. Acta Chir Scand 1968; 134(8): 585–595.
25. Leksell L. A note on the treatment of acoustic tumors. Acta Chir Scand 1971; 137(8): 763–765.
26. Lunsford LD, Niranjan A, Flickinger JC, Maitz A, Kondziolka D. Radiosurgery of vestibular schwannomas: summary of experience in 829 cases. J Neurosurg 2005; 102 (Suppl): 195–199.
27. Nakaya K, Niranjan A, Kondziolka D, Kano H, Khan AA, Nettel B et al. Gamma knife radiosurgery for benign tumors with symptoms from brainstem compression. Int J Radiat Oncol Biol Phys 2010; 77(4): 988–995.
28. Conley GS, Hirsch BE. Stereotactic radiation treatment of vestibular schwannoma: indications, limitations, and outcomes. Curr Opin Otolaryngol Head Neck Surg 2010; 18(5): 351–356.
29. Battista RA. Gamma knife radiosurgery for vestibular schwannoma. Otolaryngol Clin North Am 2009; 42(4): 635–654.
30. Bertalanffy A, Dietrich W, Aichholzer M, Brix R, Ertl A, Heimberger K et al. Gamma knife radiosurgery of acoustic neurinomas. Acta Neurochir 2001; 143(7): 689–695.
31. Fukuoka S, Takanashi M, Hojyo A, Konishi M, Tanaka C, Nakamura H. Gamma knife radiosurgery for vestibular schwannomas. Prog Neurol Surg 2009; 22: 45–62.
32. Petit JH, Hudes RS, Chen TT, Eisenberg HM, Simard JM, Chin LS. Reduced-dose radiosurgery for vestibular schwannomas. Neurosurgery 2001; 49(6): 1297–1306.
33. Régis J, Delsanti C, Roche PH, Thomassin JM, Pellet W. Functional outcomes of radiosurgical treatment of vestibular schwannomas: 1000 successive cases and review of the literature. Neurochirurgie 2004; 50(2–3): 301–311.
34. Régis J, Tamura M, Delsanti C, Roche PH, Pellet W, Thomassin JM. Hearing preservation in patients with unilateral vestibular schwannoma after gamma knife surgery. Prog Neurol Surg 2008; 21: 142–151.
35. Liscak R, Vladyka V, Urgosik D, Simonova G, Vymazal J. Repeated treatment of vestibular schwannomas after gamma knife radiosurgery. Acta Neurochir (Wien) 2009; 151(4): 317–324.
36. Kliesch S, Vogelgesang S, Benecke R, Horstmann GA, Schroeder HW. Malignant brain oedema after radiosurgery of a medium-sized vestibular schwannoma. Cen Eur Neurosurg 2010; 71(2): 88–91.
37. Hahn A, Bares K, Holcat M. Diagnosis of tumors of the statoacoustic nerve. Cesk Otolaryngol 1985; 34(4): 236–239.
38. House JW, Brackmann DE. Facial nerve grading system. Otolaryngol Head Neck Surg 1985; 93(2): 146–147.
39. Havlík R, Kollár A, Lejska M. Návrh diagnostického algoritmu při podezření na nádor VIII. hlavového nervu. Otorinolaryngol a Foniat 2000; 49: 101–104.
40. Franzin A, Spatola G, Serra C, Picozzi P, Medone M, Milani D et al. Evaluation of hearing function after Gamma Knife surgery of vestibular schwannomas. Neurosurg Focus 2009; 27(6): E3.
41. Gardner G, Robertson JH. Hearing preservation in unilateral acoustic neuroma surgery. Ann Otol Rhinol Laryngol 1988; 97(1): 55–66.
42. Kim CH, Chung KW, Kong DS, Nam DH, Park K, Lee JI et al. Prognostic factors of hearing preservation after gamma knife radiosurgery for vestibular schwannoma. J Clin Neurosci 2010; 17(2): 214–218.
43. Neuhas O, Saleh A, van Oosterhout A, Siebler M. Cerebellar infarction after gamma knife radiosurgery of a vestibular schwannoma. Neurology 2007; 68(8): 590.
44. Niranjan A, Mathieu D, Flickinger JC, Kondziolka D, Lunsford LD. Hearing preservation after intracanalicular vestibular schwannoma radiosurgery. Neurosurgery 2008; 63(6): 1054–1062.
45. Norén G. Long-term complications following gamma knife radiosurgery of vestibular schwannomas. Stereotact Funct Neurosurg 1998; 70 (Suppl 1): 65–73.
46. Lasak JM, Klish D, Kryzer TC, Hearn C, Gorecki JP, Rine GP. Gamma knife radiosurgery for vestibular schwannoma: early hearing outcomes and evaluation of the cochlear dose. Otol Neurotol 2008; 29(8): 1179–1186.
47. Osborn AG. Diagnostic Neuroradiology. 1st ed. St. Louis (MO): Mosby 1994: 626–630.
48. Chung WY, Liu KD, Shiau CY, Wu HM, Wang LW, Guo WY et al. Gamma knife surgery for vestibular schwannoma: 10-year experience of 195 cases. J Neurosurg 2005; 102 (Suppl): 87–96.
49. Iwai Y, Yamanaka K, Shiotani M, Uyama T. Radiosurgery for acoustic neuromas: results of low-dose treatment. J Neurosurgery 2003; 53(2): 283–288.
50. Gabert K, Régis J, Delsanti C, Roche PH, Facon F, Tamura M et al. Preserving hearing function after Gamma Knife radiosurgery for unilateral vestibular schwannoma. Neurochirurgie 2004; 50(2–3): 350–357.
51. Massager N, Nissim O, Delbrouck C, Delpierre I, Devriendt D, Desmedt F et al. Irradiation of cochlear structures during vestibular schwannoma radiosurgery and associated hearing outcome. J Neurosurg 2007; 107(4): 733–739.
52. Mohammed TA, Ahuja MS, Ju SS, Thomas J. Normal pressure hydrocephalus after gamma knife radiosurgery for vestibular schwannoma. J Postgrad Med 2010; 56(3): 213–215.
53. Jeon CJ, Kong DS, Nam DH, Lee JI, Park K, Kim JH. Communicating hydrocephalus associated with surgery or radiosurgery for vestibular schwannoma. J Clin Neurosci 2010; 17(7): 862–864.
54. Pirouzmand F, Tator C, Rutka F. Management of hydrocephalus associated with vestibular schwannoma and other cerebellopontine angle tumors. Neurosurgery 2001; 48(6): 1246–1254.
55. Roche PH, Khalil M, Soumare O, Régis J. Hydrocephalus and vestibular schwannomas: considerations about the impact of gamma knife radiosurgery. Prog Neurol Surg 2008; 21: 200–206.
56. Ogunrinde OK, Lunsford LD, Flickinger JC, Kondziolka DS. Cranial nerve preservation after stereotactic radiosurgery for small acoustic tumors. Arch Neurol 1995; 52(1): 73–79.
57. Flickinger JC, Kondziolka D, Niranjan A, Lunsford LD. Results of acoustic neuroma radiosurgery: an analysis of 5 years‘ experience using current methods. J Neurosurg 2001; 94(1): 1–6.
58. Pollack AG, Marymont MH, Kalapurakal JA, Kepka A, Sathiaseelan V, Chandler JP. Acute neurological complications following gamma knife surgery for vestibular schwannoma. Case report. J Neurosurg 2005; 103(3): 546–551.
59. Peker S, Ozduman K, Kilic T, Pamir MN. Relief of hemifacial spasm after radiosurgery for intracanalicular vestibular schwannoma. Minim Invasive Neurosurg 2004; 47(4): 235–237.
60. Yang I, Sughrue ME, Han SJ, Fang S, Aranda D, Cheung SW et al. Facial nerve preservation after vestibular schwannoma Gamma Knife radiosurgery. J Neurooncol 2009; 93(1): 41–48.
61. Sakamoto GT, Blevins N, Gibbs IC. Cyberknife radiotherapy for vestibular schwannoma. Otolaryngol Clin North Am 2009; 42(4): 665–675.
62. Betka J, Zvěřina E, Lisý J, Chovanec M, Kluh J, Kraus J. Vestibulární schwannom. Otorinolaryngol a Foniat 2008; 57: 221–225.
63. Sameš M, Vachata P. Historie a současnost chirurgie baze lební. Cesk Slov Neurol N 2003; 66/99(5): 315–322.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2013 Číslo 2
Nejčtenější v tomto čísle
- Creutzfeldtova-Jakobova choroba
- Spinocerebelární ataxie typ 7 (SCA7) – kazuistika
- Lymeská borelióza jako příčina bilaterální neuroretinitidy s výraznou jednostrannou hvězdicovitou makulopatií u osmileté dívky
- Elektrofyziologické vyšetření pánevního dna
