Výskyt epileptického záchvatu pri intraoperatívnej stimulácii mozgu – naše skúsenosti
Occurence of Epileptic Seizures during Intraoperative Brain Stimulation – Our Experience
Aim of the study:
To evaluate the relationship between intraoperative epileptic seizures evoked by direct electric stimulation of the brain and symptomatic epilepsy and parameters of the stimulation.
Methods:
The authors present monocentric retrospective analysis of 106 patients (50 men, 56 woman), in the age 15–82 years (average 52 years) who underwent surgery for pathological lesions localized within or near eloquent regions of the brain (low-grade glioma – 17, high-grade glioma – 34, metastasis – 29, meningioma – 19, others – 7) with utilization of direct cortical and subcortical stimulation at the authors’ institution between 2000–2009. For intraoperative mapping and monitoring of central structures of the brain continuous biphasic bipolar stimulation was used with frequency 100 or 50 Hz, pulse duration 1 ms, maximum intensity up to 18 mA, or stimulation with train of 5 pulses, interstimulus interval 2–4 ms, pulse width 0.4 ms, maximum intensity up to 30 mA, and repetition of trains 1 or 5 Hz. Evoked activity in contralateral muscles was monitored by EMG recording or by visual observation.
Results:
When patients with low-grade glioma had symptomatic epilepsy before operation, the risk of induction of intraoperative epileptic seizure was significantly higher (p = 0.06), in comparison to patients without epileptic seizure preoperatively or to patients with other pathologic lesion of the brain. Continuous stimulation with frequency 100 Hz and train with 5 Hz repetition rate evoked intraoperative focal epileptic seizures more often than continuous stimulation with frequency 50 Hz and train with 1 Hz repetition rate. However differences were not statistically important.
Conclusion:
The authors found significantly higher incidence of intraoperative focal epileptic seizures in patients with low grade glioma who had manifested epileptic seizures preoperatively.
Key words:
direct cortical stimulation – motor evoked potentials – stimulation induced seizures – symptomatic epilepsy
Autoři:
T. Galanda 1; J. Bullová 2; M. Klúzová 1; J. Mištinová 3; M. Galanda 1
Působiště autorů:
Neurochirurgická klinika SZU a FNsP F. D. Roosevelta, Banská Bystrica
1; Oddelenie anestéziológie a intenzívnej medicíny FNsP F. D. Roosevelta, Banská Bystrica
2; I. rádiologická klinika LF UK a UN Bratislava
3
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(6): 748-753
Kategorie:
Krátké sdělení
Poďakovanie Za štatistické spracovanie chceme poďakovať MUDr. Petrovi Jombíkovi, PhD., z neurologického odd. zvolenskej nemocnice.
Souhrn
Cieľ:
Posúdenie vzťahu vzniku intraoperačných epileptických záchvatov evokovaných priamou elektrickou stimuláciou mozgu k symptomatickej epilepsii a parametrom stimulácie.
Metódy:
Autori uvádzajú monocentrickú, retrospektívnu analýzu 106 operovaných chorých, 50 mužov, 56 žien vo veku 15–82 rokov (priemer 52 rokov) operovaných v rokoch 2000–2009 pre patologický proces lokalizovaný v elokventných oblastiach mozgu (nízkostupňový glióm – 17, vysokostupňový glióm – 34, metastáza – 29, meningeómy – 19, iné – 7). Pre intraoperatívne mapovanie centrálnych oblastí mozgu bola použitá kontinuálna bifázická bipolárna stimulácia 100 alebo 50 Hz, dĺžka impulzu 1 ms, do 18 mA alebo stimulácia train 5 impulzov, interval 2–4 ms, dĺžky impulzu 0,4 ms, s maximom amplitúdy do 30 mA pri opakovaní trainu o frekvencii 5 alebo 1 Hz. Evokovaná aktivita v kontralaterálnych svalových skupinách bola snímaná pomocou elektromyografie (EMG) a sledovaná vizuálne.
Výsledky:
Ak chorí s nízkostupňovým gliómom mali symptomatickú epilepsiu, možnosť vzniku intraoperačného epileptického záchvatu bola signifikantne vyššia (p = 0,06) ako u chorých bez epileptického záchvatu v predoperačnom období alebo s iným patologickým procesom mozgu. Kontinuálna stimulácia 100 Hz a train aplikovaný o frekvencii 5 Hz evokovala intraoperačne fokálne epileptické záchvaty častejšie ako kontinuálna stimulácia 50 Hz či train o frekvencii 1 Hz. Rozdiely však neboli štatisticky významné.
Záver:
Autori zistili signifikantne vyšší výskyt intraoperačných fokálnych epileptických záchvatov u chorých s nízkostupňovým gliómom, u ktorých sa predoperačne vyskytol epileptický záchvat.
Klíčová slova:
priama stimulácia mozgového kortexu – motorické evokované potenciály – stimuláciou indukované záchvaty – symptomatická epilepsia
Úvod
Pri operáciách mozgu, keď sa patologický proces nachádza v blízkosti alebo priamo invaduje funkčne významné mozgové oblasti, je nevyhnutné presne stanoviť hranice, prekročením ktorých pri resekcii už vzniká riziko následného trvalého neurologického postihnutia chorého. Napriek súčasným významným pokrokom v neurochirurgii pre lokalizáciu motorických a rečových funkcií zostáva „zlatým štandardom“ priama elektrická stimulácia mozgovej kôry a podkôria [1]. Evokovaný epileptický záchvat môže komplikovať priebeh operačného zákroku [2,3]. Sledovali sme jeho výskyt pri operáciách, kde sme použili pre mapovanie mozgového kortexu priamu elektrickú stimuláciu.
Materiál a metódy
Na Neurochirurgickej klinike SZU v Banskej Bystrici od septembra 2000 do septembra 2009 u 106 pacientov, 50 mužov, 56 žien v rozmedzí od 15 do 82 rokov (priemerný vek 52 rokov) bolo pri operáciách využité mapovanie a monitorovanie mozgových funkcií, u ktorých sa chorobný proces nachádzal pri alebo priamo v elokventných oblastiach mozgu, zasahujúcich do oblasti precentrálnej (28 chorých), postcentrálnej (33), v suplementárnej motorickej oblasti (5), frontotemporálne (7), frontoparietálne (28) a v hĺbke v centrálnej časti (4 chorí). Všetci pacienti mali pred-operačne urobenú magnetickú rezonanciu (MR), od roku 2002 s neuronavigáciou pre optimálne lokalizovanie kraniotómie a prístupu k léziám mozgu s vytvorením možnosti stimulácie primárneho motorického kortexu. Poloha patologického procesu bola peroperačne sledovaná pomocou vyšetrenia ultrazvukom (SONO). Anestéza bola vedená buď ako awake craniotomy (32 pacientov), alebo ako endotracheálna (74 pacientov) s úvodným podaním krátkodobých myorelaxancií podľa odporúčaných postupov [3–6]. Pre funkčné mapovanie elokventných oblastí mozgu bola použitá priama elektrická stimulácia [3,7–9]. Stimulácia sa robila pomocou prístrojov Osiris Inomed a N 50 Fischer, Nemecko. Pre kontinuálnu stimuláciu bola nastavená frekvencia 100 alebo 50 Hz, šírka stimulačných impulzov bola v rozhraní medzi 0,4 až po 1 ms a aplikovaná 1 až 2 sekundy. Stimulácia skupinou 4 až 6 impulzov – train – bol aplikovaný monopolárne alebo bipolárne, monofázicky s anodálnym pravouhlým impulzom o trvaní 0,2 až 0,5 ms, s interstimulačným intervalom (ISI) 2 až 4 ms, čo zodpovedá frekvencii 250 až 500 Hz. Train stimulácie sa opakovali vo frekvencii 1 Hz (train 1 Hz); alebo 5 Hz (train 5 Hz).
Bipolárne sme stimulovali kortex aj v subkortikálnej oblasti pomocou špeciálnej elektródy, ktorá bola navrhnutá na našom pracovisku (na hrote elektródy dva prstencovité kontakty v šírke 2 mm, vzdialené 2 mm, vyrobila firma Inomed, Nemecko). Stimuláciu sme začínali v oblasti precentrálneho gyru, bola robená štandardným spôsobom [3,10,11], konštantným prietokom prúdu, postupným zvyšovaním hladiny stimulácie až do získania požadovanej svalovej motorickej odpovede (obr. 1). Ak motorická odpoveď nebola vyvolaná (kontinuálna stimulácia maximálne do 18 mA, train 30 mA), stimulovaná oblasť bola považovaná za funkčne neaktívnu. Pohybové odpovede boli kontrolované vizuálne a snímané elektromyograficky pármi ihlových elektród z vybraných svalov na kontralaterálnej hornej a dolnej končatine (svalové skupiny tenaru, hypotenaru, flexorov predlaktia, ďalej m. biceps brachialis a m. triceps brachialis a na dolnej končatine m. tibialis anterior, m. gastrocnemius a m. quadriceps femoris), na tvári (m. orbicularis oris, m. orbicularis oculi – nie pri awake operácii) a ipsilaterálne na kontrolu EMG záznamu svalové skupiny tenaru a m. tibialis anterior [12,13]. Pre monitorovanie, subkortikálnu stimuláciu a pre mapovanie rečových a kognitívnych funkcií (s dobou stimulácie 4 s) sme využívali parametre stimulácie, ktoré vyvolávali svalové motorické odpovede pri mapovaní precentrálneho závitu mozgu [3,12,14,15].
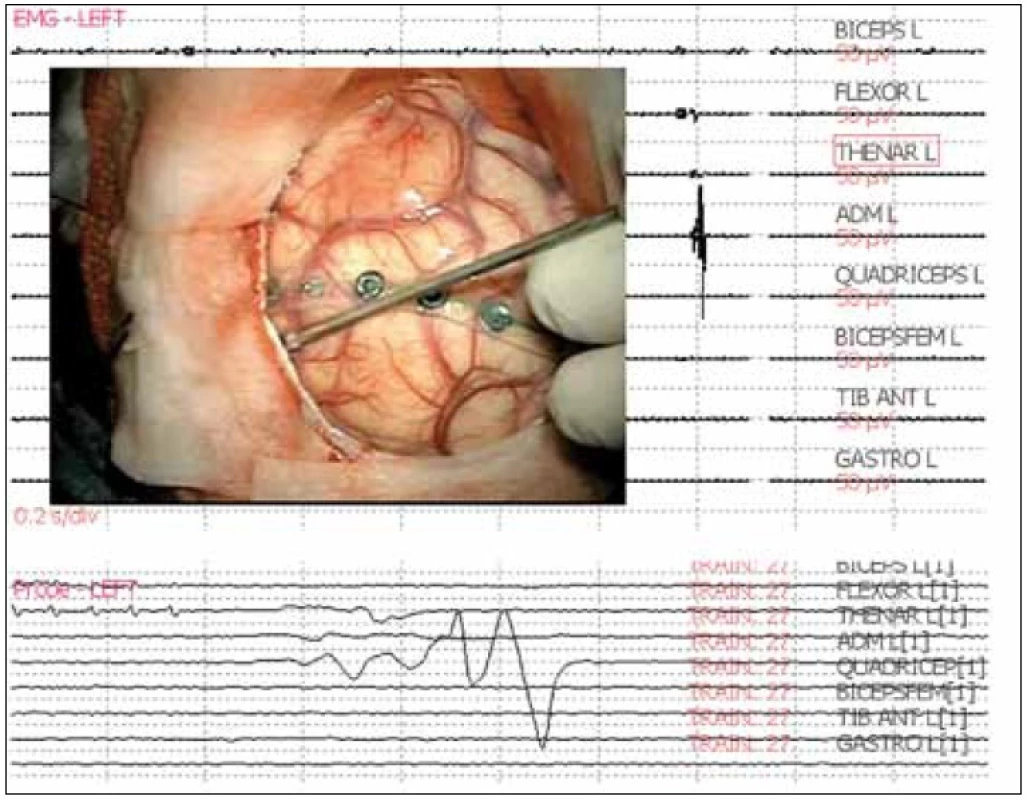
Počas aplikácie stimulácie sme sledovali výskyt evokovaných epileptických záchvatov. Za záchvat sme považovali nález, keď po ukončení stimulačného podnetu na mozgu pretrvávala svalová aktivita pozorovaná v EMG zázname či vizuálne (obr. 2). Okamžite bol na povrch mozgu aplikovaný ľadový plný fyziologický roztok alebo Ringerov roztok, ktorý záchvat v sekundách ukončil [3,12,16–18]. U všetkých chorých sme mohli pokračovať v operačnom zákroku aj stimulačnom monitorovaní funkcií. Znížili sme amplitúdu podnetu alebo sme prešli na menej dráždivý spôsob stimulácie (zníženie frekvencie stimulačných impulzov, stimulácia formou train) [3,10,12].
Pre štatistickú analýzu bol použitý Pearsonov chí-kvadrát v kontingenčnej tabuľke.
Výsledky
Ak sme pri kontinuálnej stimulácii použili frekvenciu stimulácie 100 Hz, pri dĺžke impulzu 1 ms, došlo k vyprovokovaniu fokálneho epileptického záchvatu u 12 z 56 chorých, pri použití frekvencie 50 Hz u 1 zo 17 chorých. Pri použití stimulácie train 4 až 6 impulzov, ktoré sa opakovali vo frekvencii 5 Hz, vznikol epileptický záchvat u 8 zo 48 chorých, avšak pri frekvencii 1 Hz ani u jedného zo 16 chorých. Po výskyte epileptického záchvatu pri stimulácii 100 Hz sme u 7 pacientov pokračovali train stimuláciou. Rozdiely vyvolania záchvatu pri rôznych frekvenciách stimulácie boli štatisticky vyhodnotené a sú nesignifikantné.
Ak sme chorých rozdelili podľa histopatologickej diagnózy a prítomnosti epileptických záchvatov (tab. 1), počas operácie sa najčastejšie vyskytol epileptický záchvat u chorých s nízkostupňovým gliómom (LGG, Low-Grade Glioma) 7/17.
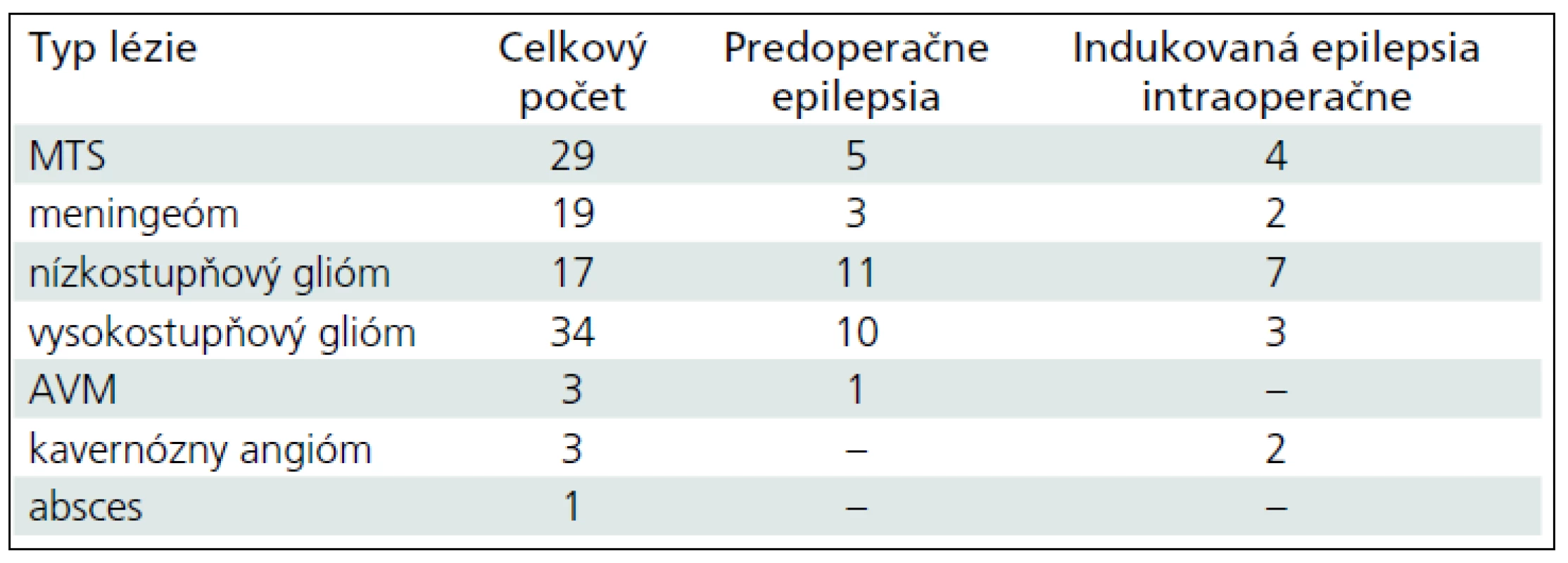
Z celkového počtu 17 chorých s diagnózou LGG malo 11 predoperačne epileptický záchvat. Ak mal pacient pred operáciou záchvat, tak sa počas zákroku vyskytol častejšie (6/11), ako keď pred operáciou záchvat nemal (vyprovokovaný len 1 záchvat u 6 chorých). Frekvencia epileptického záchvatu vyprovokovaná peroperačne u LGG so symptomatickou epilepsiou bola signifikantne vyššia ako u ostatných pacientov s predoperačným výskytom epilepsie. Výsledok bol na hladine významnosti p = 0,06; čo je pre neparametrické testy s malým počtom pozorovaní akceptovateľné. Frekvencia výskytu záchvatu u pacientov s LGG bez symptomatickej epilepsie sa v tomto teste nelíšila od ostatných pacientov, ktorí boli predoperačne bez epilepsie. Jeden chorý, u ktorého sa počas operácie vyskytol záchvat, mal pred operáciou ľahký neurologický deficit, ostatní pacienti boli bez neurologického deficitu.
Pri diagnóze vysokostupňového gliómu gr. III a IV (HGG) sme záchvaty počas zákroku zaznamenali podstatne zriedkavejšie (3/34), podobne u chorých operovaných pre metastatické procesy (4/29) a meningeómy (2/19 ) (graf 1a, b).


Pri operácii kavernózneho angiómu lokalizovaného priamo v gyrus praecentralis sme u dvoch chorých použili neurostimuláciu, u oboch chorých sa vyskytol záchvat. U jednej chorej pri lézii v gyrus postcentralis k evokovaniu záchvatu nedošlo. Pri iných patologických procesoch (absces, arteriovenózna malformácia (AVM)) sa záchvat nevyskytol. Len v jednom prípade (HGG) sa fokálny záchvat začal šíriť do okolitých svalových skupín, ale ustúpil po aplikácii ľadového Ringerovho roztoku na mozog.
Priemerný vek pacientov, ktorí mali epileptický záchvat počas operácie, bol pri diagnóze LGG 38 rokov, HGG 61 rokov, metastáz 54 rokov, meningeómov 58 rokov, kavernóznych angiómov 41 rokov.
Diskusia
Vznik epileptického záchvatu pri priamej mozgovej stimulácii nespôsobuje trvalé následky, ale môže byť pre chorého nebezpečný už len z dôvodu jeho výskytu na operačnom stole s fixovanou hlavou, kraniotómiou, mozgom, v ktorom sa nachádza expanzívny proces – pri pokračujúcom záchvate môže dôjsť k zvýšeniu intrakraniálneho tlaku, herniácii mozgového tkaniva [2,3,16].
Ak však aplikujeme na mozog pri vzniku epileptického záchvatu ľadový Ringerov alebo plný fyziologický roztok, zvyčajne v priebehu sekúnd dôjde k potlačeniu záchvatu [3,12,16–18]. Aj z tohto dôvodu je dôležité počas stimulácie mozgu dôsledne sledovať EMG záznam a chorého aj vizuálne [10,12]. Okamžite, pri prvých príznakoch vzniku záchvatu (po skončení aplikácie stimulácie pretrváva svalová aktivita), aplikovať ľadový roztok. Musí byť pripravený k okamžitému použitiu s prítomnou ľadovou drťou, ktorá sa však na mozgové tkanivo neaplikuje. Je výhodné, ak sa počas stimulácie mozgu súčasne zaznamenáva EMG so svalových skupín, kde očakávame stimulačné odpovede. Ako ukazuje aj naša skúsenosť, EMG dovoľuje detegovať navodené aktivity vo svaloch predtým, ako ich môžeme sledovať vizuálne a zároveň umožňuje zaznamenávať šírenie aktivity do susedných svalových skupín [19,20]. Keďže aktivácia svalov môže začať vznikať aj v oblasti, ktorú nemáme monitorovanú EMG, odporúča sa sledovať chorého aj vizuálne [12]. Výnimočne môže dôjsť ku generalizácii epileptického záchvatu, vtedy je potrebné intravenózne podať bolus anestetik (propofol), prípadne myorelaxanciá, ktoré však môžu ovplyvniť ďalší priebeh mapovania a monitorovania mozgu [3,16,17].
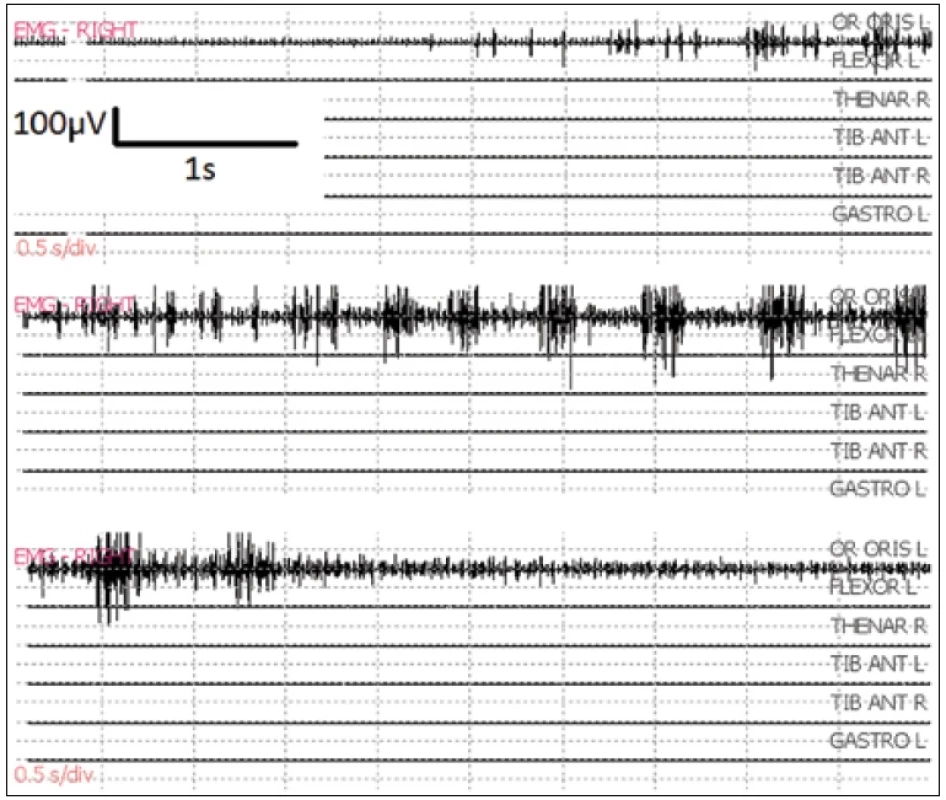
Priloženie stripu so 6 až 8 elektródami na povrch mozgu v oblasti, kde sa robí stimulácia, so súčasným sledovaním elektrokortikografického záznamu (ECoG), nám môže odhaliť zvýšenú dráždivosť mozgu. Po skončení stimulácie sa prejaví vznikom následných výbojov (after discharges), ako to potvrdzujú aj naše skúsenosti, ktoré máme z posledných rokov. Pokiaľ sa objavia viac ako 2 až 3 následné výboje a vyskytujú sa už pri nízkych hodnotách stimulačného pôvodu, môžu predznamenávať vznik epileptického záchvatu (obr. 3a, b) [3,10,17]. Aj my sme zaznamenali zvýšený výskyt následných výbojov pri vyššej frekvencii stimulácie (100 Hz, čiastočne i 50 Hz), pri dlhšom stimulačnom impulze (1 ms) a jej predĺženej aplikácii na mozgový kortex [10,21]. Ak sa pri kontinuálnej stimulácii (50 alebo 100 Hz) objaví tendencia k vzniku záchvatov, je možné zvoliť stimuláciu pomocou train modu. Nepozorovali sme vznik záchvatov pri stimulácii train 1 Hz, ale pri stimulácii train 5 Hz boli častejšie (8/48).


Pri hodnotení následných výbojov pri stimulácii kortexu mozgu je dôležité, či sa nachádzajú elektródy stripu na mozgovom závite, ktorý sa stimuluje. Postupne zvyšujúcou sa stimuláciou navodený následný výboj zvyčajne zostáva lokalizovaný na gyrus, na ktorý bola priložená stimulačná elektróda, nešíri sa do okolia. V prípade vzniku epileptického fokálneho záchvatu, záchvat tiež môže zostať lokalizovaný. Preto stimulačná elektróda a snímací ECoG strip majú byť uložené tak, že rešpektujú anatomické usporiadanie (gyrus). Dnes pri identifikácii gyrus praecentralis využívame neuronavigáciu, zvrat fázy pre optimálne uloženie ECoG stripu a miesta stimulácie. Ak je strip uložený mimo funkčne významného kortexu, pri stimulácii v tejto oblasti môžu vzniknúť následné výboje či fokálny epileptický záchvat, ale bez klinických či EMG prejavov. Ak sa stimulácia tejto kvality a kvantity aplikuje na gyrus praecentralis, môže spôsobiť okamžitý rozvoj klinického fokálneho epileptického záchvatu, preto je potrebné znížiť hodnotu stimulačného impulzu.
Pri zavádzaní metódy mapovania mozgového kortexu v 90. rokoch sme na stimuláciu používali klasickú stereotaktickú elektródu a frekvenciu 100 Hz [12].
Výhodou kontinuálnej stimulácie 100 Hz, ale aj train 5 Hz je ľahšia vybaviteľnosť svalovej motorickej odpovede, najmä, ak je neistota pri stimulačnom teste – negatívna odpoveď – napriek predpokladanej lokalizácii v oblasti gyrus praecentralis. V tomto prípade používame aj tento druh stimulácie. Pri evokovaní prvých subklinických EMG odpovedí stimuláciu ukončujeme. Dnes súčasne elektrokortikograficky sledujeme výskyt následných výbojov. V prípade pretrvávania a šírenia sa následných výbojov neodkladne aplikujeme ľadový Ringerov roztok na mozgový povrch [3,9,17]. Pre vyšší výskyt fokálneho epi záchvatu pri tejto frekvencii, aj keď vždy kontrolovaného, dnes 100 Hz používame len výnimočne.
Uvádza sa, že vznik následných výbojov v rôznych oblastiach mozgu je možné vyvolať pri rôznej intenzite stimulačného podnetu [10,21,22]. U niektorých chorých je možné aktivovať požadované funkcie mozgu len stimuláciou prekračujúcou hodnoty prúdu, pri ktorom vznikajú následné potenciály [23]. Preto niektoré pracoviská nesledujú vznik následných potenciálov, ale len klinické odpovede na stimuláciu [24].
Vznik epileptických výbojov, ktoré nie sú spojené s konvulziami – nekonvulzívny epileptický záchvat – môže podstatne ovplyvniť interpretáciu mapovania mozgového kortexu [25,26]. Preto je nevyhnutné presne dodržiavať odporúčaný postup striedania miesta stimulácie a používať tzv. shame stimuláciu (stimulácia bez aplikácie stimulačného podnetu), vyžadovať pri testoch rečových funkcií komplexnejšiu odpoveď (pri teste schopností pomenovať videný predmet, odpovedať celou vetou), čo klinicky pomôže upozorniť na prebiehajúci nekonvulzívny epileptický záchvat a odhalí falošne pozitívny test stimulácie [27].
Najvnímavejšia na vznik záchvatu je perirolandická oblasť mozgu [10]. Opäť treba zdôrazniť dodržiavanie metodiky stimulácie, ktorá sa môže podieľať na zvýšenom výskyte záchvatov najmä v tejto oblasti. Stimuláciou potrebujeme identifikovať kritické oblasti v mozgu, ktorých funkciu nesmieme narušiť, to platí aj pre subkortikálnu stimuláciu. V tejto oblasti je evokácia epileptických záchvatov zriedkavá, ale môže sa vyskytnúť [21]. Postup pri ich potlačení je podobný, ako keď vznikajú pri stimulácii kortexu.
Na rozdiel od niektorých údajov v literatúre [10] sme zaznamenali signifikantne vyšší výskyt evokovaných epileptických záchvatov u chorých s LGG, ktorí mali už predoperačne epilepsiu. Ide o skupinu chorých s nízkym vekovým priemerom (38 rokov), epileptické záchvaty u nich viedli k vyšetreniam, aby sa stanovila diagnóza a lézie zasahovali priamo do precentrálnej oblasti – všetko faktory, ktoré môžu uľahčiť vznik záchvatov [10]. Túto skupinu chorých považujeme za najrizikovejšiu pre evokáciu epileptického záchvatu počas mapovania mozgového kortexu. U chorých operovaných pre HGG bol intraoperačne záchvat podstatne zriedkavejší (3/34), ale aj vekový priemer chorých bol podstatne vyšší (61 rokov).
Záver
Priama elektrická stimulácia mozgu sa považuje za presnú, bezpečnú a opakovateľne reprodukovateľnú metódu pri určovaní elokventných oblastí mozgu [10,28]. Ak sa nedodržia prísne stanovené postupy pri stimulácii mozgových štruktúr, pri falošne pozitívnom výsledku stimulácie sa nedosiahne požadovaný rozsah odstránenia tumoru, pritom ponechané rezíduum tumoru neobsahuje funkčne významné nervové štruktúry. Naopak, pri falošnom negatívnom výsledku stimulačného testu môže dôjsť k odstráneniu funkčne významných nervových štruktúr so vznikom trvalého neurologického deficitu [1,10,29–31]. Intraoperačné evokovanie epileptického záchvatu pri stimulácii môže nepriaznivo ovplyvniť ďalší priebeh mapovania a monitorovania ohrozených mozgových funkcií [3,10]. Z tohto pohľadu sú podľa našich skúseností rizikoví chorí s nízkostupňovým gliómom mozgu, u ktorých sa predoperačne vyskytol epileptický záchvat. Poznanie princípov elektrofyziológie, ktoré prebiehajú pri elektrickej stimulácii mozgu a úzka tímová spolupráca neurochirurga s neuroanesteziológom, neurofyziológom, logopédom, psychológom či neurorádiológom vytvára predpoklad pre uplatnenie priamej elektrickej stimulácie mozgu pri liečení lézií vo funkčne významných oblastiach mozgu.
MUDr. Tomáš Galanda
Neurochirurgická klinika
SZU a FNsP F. D. Roosevelta
Nám. L. Svobodu 1
975 17 Banská Bystrica
e-mail: tgalanda@imafexbb.sk
Prijaté k recenzii: 1. 6. 2012
Prijaté do tlače: 25. 7. 2012
Zdroje
1. Berger MS, Hadjipanayis CG. Surgery of intrinsic cerebral tumors. Neurosurgery 2007; 61 (Suppl 1): 279–305.
2. Sartorius CJ, Wright G. Intraoperative brain mapping in a community setting-technical considerations. Surg Neurol 1997; 47(4): 380–388.
3. Stejskal L. Intraoperačni stimulačni monitorace v neurochirurgii. Praha: Grada Publishing 2006 : 104.
4. Bartoš R, Sameš M, Vachata P, Červenka M, Jech R, Vymazal J et al. Výsledky a tolerance „awake“ resekcí mozkovýchch nádorů. Cesk Slov Neurol N 2005; 68/101(1): 39–45.
5. Cee J, Sameš M, Bartoš R, Vachata P, Vaněk P, Kašperek J et al. Peroperační monitorace motorických evokovaných odpovědí za užiti transkranialní elektrické stimulace – naše první klinické zkušenosti. Cesk Slov Neurol N 2006; 69/102(5): 365–380.
6. Sarnthein J, Bozinov O, Melone AG, Bertalanffy H. Motor evoked potentials (MEP) during brainstem surgery to preserve corticospinal function. Acta Neurochir 2011; 153(9): 1753–1759
7. Duffau H, Lopes M, Arthuis F, Bitar A, Sichez JP, Van Effenterre R et al. Contribution of intraoperative electrical stimulations in surgery of low grade gliomas: a comparative study between two series without (1985–96) and with (1996–2003) functional mapping in the same institution. J Neurol Neurosurg Psychiatry 2005; 76(6): 845–851.
8. Berger MS. Lesions in functional (“eloquent”) cortex and subcortical white mater. Clin Neurosurg 1994; 41 : 444–463.
9. Ostrý S, Stejskal L. Evokované odpovědi a elektromyografie v intraoperačni monitoraci v neurochirurgii. Cesk Slov Neurol N 2010; 73/106(1): 8–19.
10. Szelenyi A, Bello L, Duffau H, Fava E, Feigl GC, Galanda M et al. Intraoperative electrical stimulation in awake craniotomy: methodological aspects of current practice. Neurosurg Focus 2010; 28(2): E7.
11. Berger MS, Ojemann GA, Lettich E. Neurophysiological monitoring during astrocytoma surgery. Neurosurg Clin N Am 1990; 1(1): 65–80.
12. Galanda M, Babicová A, Patráš F, Šulaj J, Béreš A. Peroperačná elektrická stimulácia pri operáciách v centrálnych oblastiach mozgu a v mieche. Cesk Slov Neurol N 2001; 64/67(6): 338–343.
13. Kombos T, Suess O, Ciklatekerlio O, Brock M. Monitoring of intraoperative motor evoked potentials to increase the safety of surgery in and around the motor cortex. J Neurosurg 2001; 95(4): 608–614.
14. Duffau H, Capelle L, Denvil D, Sichez N, Gatignol P, Taillandier L et al. Usefulness of intraoperative electrical subcortical mapping during surgery for low--grade gliomas located within eloquent brain regions: functional results in a consecutive series of 103 patients. J Neurosurg 2003; 98(4): 764–778.
15. Nossek E, Korn A, Shahar T, Kanner AA, Yaffe H, Marcovici D et al. Intraoperative mapping and monitoring of the corticospinal tracts with neurophysiological assessment and 3-dimensional ultrasonography-based navigation. J Neurosurg 2011; 114(4): 738–746.
16. Sartorius CJ, Berger MS. Rapid termination of intraoperative stimulation-evoked seizures with application of cold Ringer’s lactate to the cortex. Technical note. J Neurosurg 1998; 88(2): 349–351.
17. Jahangiri FR, Sherman JH, Sheehan J, Shaffrey M, Dumont AS, Vengrow M et al. Limiting the current density during localization of the primary motor cortex by using a tangential-radial cortical somatosensory evoked potentials model, direct electrical cortical stimulation, and electrocorticography. Neurosurgery 2011; 69(4): 893–898.
18. Galanda M. Intraoperačné neurofyziologické monitorovanie. In: Haruštiak S (ed). Principy chirurgie II. Bratislava: Slovak Academic Press 2010 : 26–30.
19. Yingling CD, Ojemann S, Dodson B, Harrington MJ, Berger MS. Identification of motor pathways during tumor surgery facilitated by multichannel electromyographic recording. J Neurosurg 1999; 91(6): 922–927.
20. Zentner J, Hufnagel A, Pechstein U, Wolf HK, Schramm J. Functional results after resective procedures involving the supplementary motor area. J Neurosurg 1996; 85(4): 542–549.
21. Motamedi GK, Okunola O, Kalhorn ChG, Mostofi N, Mizuno-Matsumoto Y, Yong-won Cho et al. Afterdischarges during cortical stimulation at different frequencies and intensities. Epilepsy Research 2007; 77(1): 65–69.
22. Lee HW, Webber WR, Crone N, Miglioretti DL, Lesser RP. When is electrical cortical stimulation more likely to produce afterdischarges? Clin Neurophysiol 2010; 121(1): 14–20.
23. Pouratian N, Cannestra AF, Bookheimer SY, Mar-tin NA, Toga AW. Variability of intraoperative electrocortical stimulation mapping parameters across and within individuals. J Neurosurg 2004; 101(3): 458–466.
24. Duffau H, Gatignol P, Mandonnet E, Capelle L, Taillandier L. Intraoperative subcortical stimulation mapping of language pathways in a consecutive series of 115 patients with Grade II glioma in the left dominant hemisphere. J Neurosurg 2008; 109(3): 461–471.
25. Uematsu S, Lesser R, Fisher RS, Gordon B, Hara K, Krauss GL et al. Motor and sensory cortex in humans: topography studied with chronic subdural stimulation. Neurosurgery 1992; 31(1): 59–71.
26. Sanai N, Berger MS. Intraoperative stimulation techniques for functional pathway preservation and glioma resection Neurosurg Focus 2010; 28(2): E1.
27. Ilmberger J, Eisner W, Schmid U, Reulen HJ. Performance in picture naming and word comprehension: evidence for common neuronal substrates from intraoperative language mapping. Brain Lang 2001; 76(2): 111–118.
28. Kombos T, Süss O. Neurophysiological basis of direct cortical stimulation and applied neuroanatomy of the motor cortex: a review. Neurosurg Focus 2009; 27(4): E3.
29. Gil-Robles S, Duffau H. Surgical management of World Health Organization Grade II gliomas in eloquent areas: the necessity of preserving a margin around functional structures Neurosurg Focus 2010; 28(2): E8.
30. Bartoš R, Vachata P, Hejčl A, Zolal A, Malucelli A, Radovnický T et al. Vliv funkčního mapování na výsledky operací nízkostupňových gliomů WHO grade II. Cesk Slov Neurol N 2011; 74/107(3): 292–298.
31. Šteňo A, Šteňová V, Bellan V, Hollý V, Šurkala J, Šteňo J et al. „Awake“ resekcia supratentoriálnych low-grade gliomov lokalizovaných vo vnútri alebo v priamom kontakte s elokventnými oblasťami. Cesk Slov Neurol N 2011; 74/107(5): 539–549.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 6
Nejčtenější v tomto čísle
- Epidemie roztroušené sklerózy ve světě?
- Spinální kongres
- Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
- Fázový model neurorehabilitace
