Laboratorní preparace drah z mediálního pohledu na mozkovou hemisféru
Laboratory Pathway Dissection from Medial Approach to Brain Hemisphere
In our paper we introduce the Klingler’s laboratory dissection of brain white matter tracts from the medial aspect of brain hemisphere. We continue in our previously published paper on white matter tracts dissection from the lateral aspect. Anatomical preparations are supplemented with tractographic imaging of some of the white matter tracts.
Key words:
white matter tracts – tractography – Klingler’s dissection
Autoři:
A. Hejčl 1–3; R. Bartoš 1,2; A. Zolal 1,2; A. Malucelli 1,2; M. Sameš 1,2; P. Petrovický 4
Působiště autorů:
Neurochirurgická klinika UJEP a Krajská zdravotní, a. s. – Masarykova nemocnice v Ústí nad Labem
1; Neuroanatomická laboratoř UJEP v Ústí nad Labem
2; Centrum klinického výzkumu ICRC, Brno
3; Anatomický ústav 1. LF UK v Praze
4
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(6): 707-713
Kategorie:
Původní práce
Souhrn
V naší práci představujeme laboratorní preparaci mozkových drah dle Klinglerovy metody z mediální strany hemisféry. Tím navazujeme na dříve publikovanou preparaci drah z laterální strany. Anatomické preparáty jsou doplněny traktografickým zobrazením některých mozkových drah.
Klíčová slova:
dráhy bílé hmoty – traktografie – Klinglerova metoda preparace
Úvod
Operační přístupy z mediálního aspektu mozkové hemisféry nejsou zdaleka tak časté jako ty ze strany laterální. Proto je pohled na anatomii nervových drah a dalších struktur z mediální strany mozkových hemisfér pro neurochirurga méně běžnou záležitostí. Přesto při interhemisferálních či intraventrikulárních přístupech je správná znalost anatomie struktur mediálně uložených důležitá. Rozvoj zobrazovacích metodik, zejména zobrazení DTI (Diffusion Tensor Imaging) pomocí magnetické rezonance (MR) do značné míry způsobilo renesanci zájmu o anatomii mozkových drah. V následujícím článku navazujeme na naši dříve publikovanou práci „Laboratorní preparace drah laterálního aspektu mozkové hemisféry“ [1]. Popisujeme preparaci struktur mozku z mediálního aspektu mozkové hemisféry technikou mikrodisekce. Laboratorní preparaci drah opět doplňujeme traktografickým zobrazením mozkových drah.
Materiál a metodika
Provedli jsme preparaci čtyř mozkových hemisfér zemřelých pacientů, u kterých primární příčinou smrti nebylo mozkové onemocnění. Pro preparaci drah jsme mozek připravovali dle práce profesora Josefa Klinglera (1888–1963), jehož laboratorní preparace drah bílé hmoty mozkové má i po 75 letech nezpochybnitelný význam, zvláště v době rozvoje traktografických metod [2]. Po odběru mozku byl tento zavěšen za arteria basilaris do uzavřené nádoby s 10% formalínem, fixace trvala 1–2 měsíce. Poté jsme mozek řezem v oblasti corpus callosum (CC) rozdělili na obě hemisféry a za použití laboratorního mikroskopu Wild (Wolf, Leica, Německo) odstranili arachnoideu a cévy na konvexitě obou hemisfér. Následně jsme mozek důkladně opláchli tekoucí vodou a na dva týdny zmrazili na teplotu –10 až –15 °C. Před disekcí byl mozek rozmražen vložením do vlažné vody na 24 hod a osušen. Samotná preparace byla prováděna dřevěnými lopatkami pod zvětšením laboratorního mikroskopu, ostré řezy byly prováděny skalpelem a preparace jemných svazků vláken dřevěnými lopatkami či kovovým disektorem. Postup preparace prezentujeme v následujícím oddíle článku a dokumentujeme vybranými fotografiemi.
Traktografické skeny (DTI) pro tuto anatomickou studii byly provedeny u zdravého dobrovolníka pomocí 1,5T přístroje (Avanto, Siemens, Erlangen, Německo). Použita byla spin--echo echo-planární DTI sekvence s následujícími parametry: jeden b = 0 s/mm2 obraz a 20 směrově vážených obrazů b = 1 000 s/mm2, TR/TE 8 000/94 ms, matrix 138 × 192, FOV 276 × 384 mm, izotropický voxel 2 × 2 × 2 mm, počet vrstev 55, dvě opakování. Jako anatomický podklad byla použita T1 sekvence (TR/TE 1 900/3,37; matrix 256 × 192, voxel 1 × 1 × 1 mm). Dráhy byly rekonstruovány pomocí software StealthViz (Medtronic, USA) standardním algoritmem FACT (Fiber Assignment by Continuous Tracking).
Výsledky
Mediální pohled na mozkovou hemisféru
Při pohledu na hemisféru z mediální strany interhemisferálního řezu můžeme pozorovat gyrifikaci frontálního, parietálního, okcipitálního laloku a na spodině částečně i temporálního laloku. Přes zbytky septum pellucidum uložené mezi corpus callosum a fornixem se díváme do postranní komory. Dále pak pozorujeme III. komoru, thalamus a adhesio interthalamica, frontálně průřez commissurou anterior, okcipitálně glandulou pinealis. Podrobněji jsou jednotlivé struktury označeny na obr. 1a.
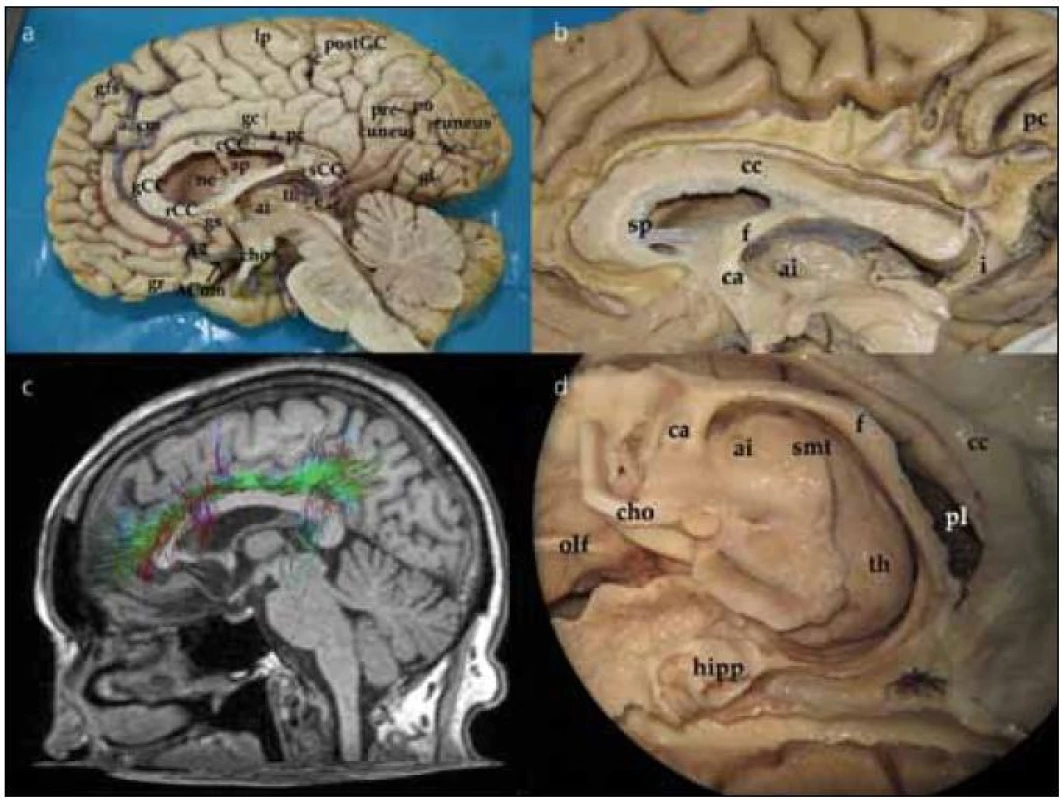
Preparace vláken cingula (fasciculus cinguli)
Preparace začíná odstraněním kortexu z přední části gyrus cinguli nad corpus callosum a pokračuje směrem dorzálním. Po odstranění kortexu pozorujeme podélná vlákna cingula, která probíhají od frontálního laloku, nad rostrem, genu a tělem corpus callosum. V dorzální části nad tělem corpus callosum se k cingulu připojují vertikálně běžící vlákna z gyrus frontalis superior, paracentrálního lobulu a precuneu a integrují se do cingula. Zvláště vlákna z precuneu významně zvětšují objem fasciculus cinguli (obr. 1b). Tuto dráhu můžeme též demonstrovat pomocí DTI metodiky magnetické rezonance (obr. 1c). Při preparaci pokračujeme dorzálně až do místa, kde vlákna cingula probíhají okolo splenia corporis callosi. Zde se cingulum zužuje a tato část se nazývá isthmus. V této části komisurální vlákna forceps posterior kříží cingulum před jeho vlákny. Pod tímto křížením cingulum probíhá poblíž nejventrálnější části optické radiace a překrývá spodní okraj přední části sulcus calcarinus. Poté se cingulum otáčí ventrálně a běží v bílé hmotě parahipokampálního gyru. Zde v preparaci pokračujeme podél sulcus corporis callosi a sulcus hippocampi, který odděluje gyrus hippocampi od gyrus dentatus (kraniálně od gyrus hippocampi). Odstraněním šedé hmoty parahipokampálního gyru ozřejmíme pokračování cingula směrem k přední parahipokampální oblasti a jeho ukončení v oblasti presubikula a entorinálním kortexu. Kompletní disekcí fasciculus cinguli odhalíme nejzevnější korovou vrstvu hipokampu. Patrný je také celý průběh fornixu (obr. 1d). Disekcí přední části cingula identifikujeme jeho část, která se stáčí dolů pod genu corporis callosi a končí v gyrus subcallosus a paraterminalis.
Preparace corpus callosum
Corpus callosum odhalíme kompletním odpreparováním fasciculus cinguli. Struktura corpus callosum je poměrně tuhá, jeho preparace je možná postupným odstraňováním vláken či jejich odstřižením nůžkami. Po preparaci corpus callosum se nám otevírá široký pohled na laterální stěnu postranní komory. Frontálně prominuje do komory caput nuclei caudati, okcipitálně zase pozorujeme větvení v. thalamostriata. Podél corpus callosum probíhají stria longitudinalis lateralis a medialis, které můžeme dobře pozorovat po odstranění kůry gyrus cinguli. Na povrchu striae longitudinales, stejně jako na povrchu corpus callosum, je šedá hmota indusium griseum. Pokračováním indusium griseum je gyrus fasciolaris (subsplenius) obklopující splenium. Po snesení vláken cingula se objeví komisurální vlákna corpus callosum. Jsou patrná vlákna z prefrontálního a premotorického kortexu, suplementární motorické kůry, z precentrálního a postcentrálního gyru, dále z temporálního a okcipitálního laloku (obr. 2a). Komisurální vlákna v oblasti genu corporis callosi se označují jako forceps major nebo anterior, komisurální vlákna splenium corporis callosi se označují jako forceps minor nebo posterior. V naší práci jsme se blíže zaměřili na motorické corpus callosum, tedy na komisurální vlákna jdoucí z precentrálního gyru. Resekovali jsme frontální lalok až k úrovni gyrus precentralis. Po částečném odstranění kortexu z precentrálního gyru jsme sledovali průběh komisurálních vláken směrem do corpus callosum. Je patrné topografické rozdělení, kdy laterálně uložená vlákna z oblasti tváře či horní končetiny vstupují do corpus callosum frontálně od vláken z mediální části gyrus precentralis (dolní končetina). Je také patrné mírné vyvýšení průběhu komisurálních vláken v průběhu nad postranní komorou těsně laterálně od vstupu do corpus callosum (obr. 2b). Průběh komisurálních vláken z primární motorické kůry můžeme opět velmi dobře demonstrovat i metodikou DTI (obr. 2c). Pokud odstraníme corpus callosum více, můžeme snadno pozorovat postranní komoru, fornix, plexus choroideus, nucleus caudatus a hippocampus. Po odstranění uncus gyri parahippocampalis se dostaneme do temporálního rohu postranní komory.
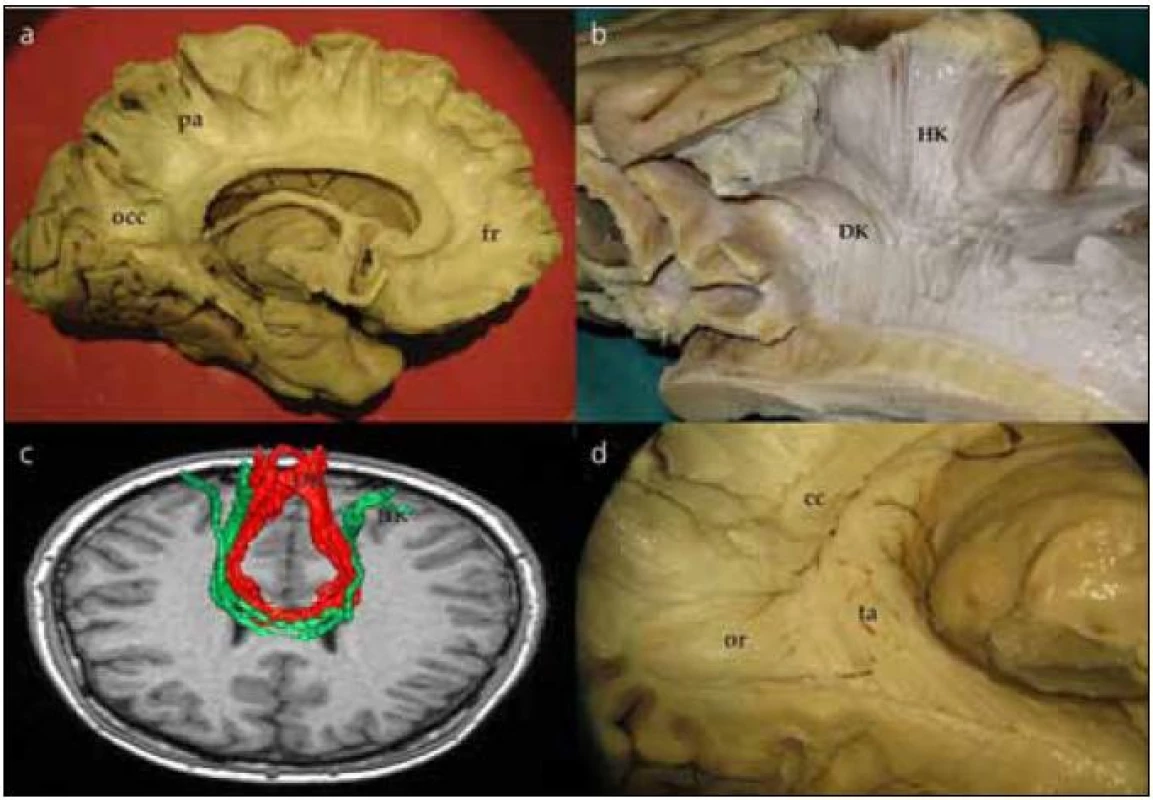
Preparace struktur laterálně od postranní komory a optické radiace
Po jemném snesení vrstvy ependymu v zadní části postranní komory můžeme identifikovat tapetum corporis callosi. Tapetum tvoří laterální stěnu atria a obtáčí se okolo temporálního rohu postranní komory. Po snesení ependymu v temporálním rohu postranní komory vidíme vlákna probíhající vějířovitě od corpus geniculatum laterale (CGL) do okcipitálního laloku. Jedná se o vlákna optické radiace, která postupně odhalujeme v okcipitálním směru (obr. 3a), což lze dokumentovat in vivo i DTI technikou (obr. 3b). V oblasti trigona jsou vlákna optické radiace schována pod vrstvou tapeta corporis callosi, které je tak nutno jemně odpreparovat. V průběhu lze identifikovat vlákna směřující přímo okcipitoparietálně (posteriorní svazek). Další skupinu vláken preparujeme nejdříve ve směru anteriorním od CGL podél temporálního rohu postranní komory a následně posteriorně až k úrovni fissura calcarina, tzv. centrální svazek. Poslední část vláken, přední svazek neboli Meyerovu kličku, preparujeme opět anteriorně až k hrotu temporálního laloku postranní komory a poté se stočí znovu směrem do okcipitálního laloku (obr. 3c). Konec vláken Meyerovy kličky pak identifikujeme pod úrovní fissura calcarina.
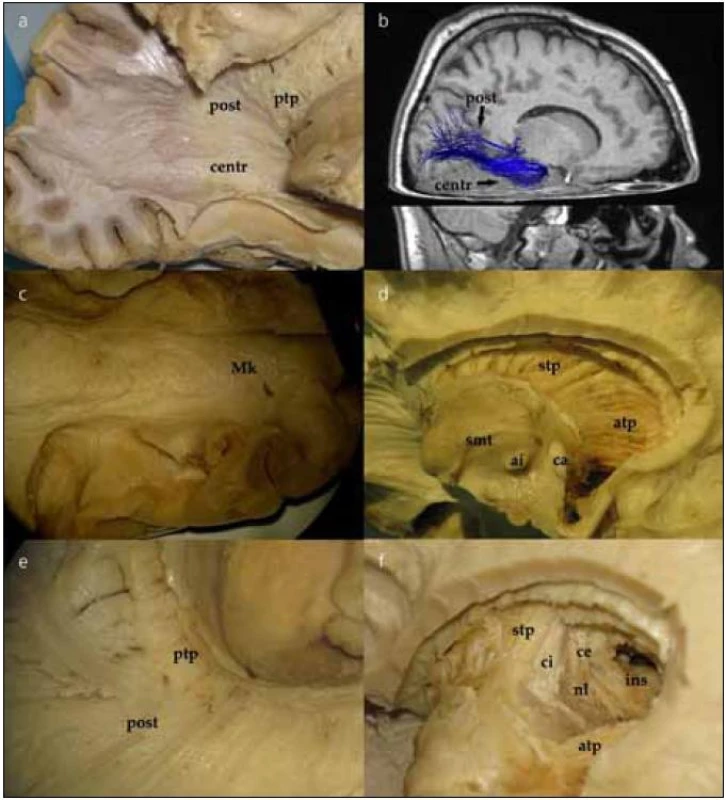
Po snesení ependymu ve frontálním rohu postranní komory se dostaneme k hlavě a tělu nucleus caudatus. Poté, co odstraníme hlavu i tělo caudata, odhalíme přední a horní thalamický pedunkulus (thalamo-kortikální dráhy, obr. 3d). Jejich průběh můžeme sledovat směrem k frontálnímu a parietálnímu kortexu, po odstranění stratum subcallosum a zbývajících vláken corpus callosum. Po odstranění posteriorní části nucleus caudatus se objeví posteriorní (zahrnující i optickou radiaci, obr. 3e) a inferiorní thalamické pedunkly. Přední a horní thalamický pedunkl tvoří anteromediální část capsula interna. Při preparaci směrem laterálně postupně ozřejmujeme nucleus lentiformis, capsula extrema až ke kortexu inzuly (obr. 3f).
Diskuze
Neurochirurgické přístupy k hlubokým či středočárovým supratentoriálním lézím mozku
Na rozdíl od zájmu např. psychiatrů či neurologů struktury mediální strany mozkových hemisfér jsou pro neurochirurgy oblastí méně probádanou, i vzhledem k tomu, že dominují přístupy z laterální strany hemisféry. Přesto i zde dochází ke zvýšení zájmu také ze strany neurochirurgické obce, což souvisí jednak s rozšiřováním využití nových metodik MR, jako je DTI, jednak s rozšířením hodnotících škál o neuropsychologický stav epileptochirurgických, cerebrovaskulárních či neurotraumatologických pacientů. Příkladem je práce zabývající se poškozením cingula a fornixu u pacientů po subarachnoidálním krvácení (SAK) při ruptuře aneuryzmatu přední komunikující arterie (ACom) [3]. Autoři našli poškození předního cingula a fornixu u více než 50 % vyšetřených pacientů, což dávají do souvislosti s poruchou paměti, a sami doporučují využití metodiky DTI cingula a fornixu u této skupiny pacientů.
Jiná skupina autorů studovala vztah mezi poruchou paměti a poraněním fornixu u pacientů s difuzním axonálním poraněním (DAP) pomocí DTI [4]. Zjistili korelaci mezi poruchou paměti a poškozením těla fornixu. Stejní autoři studovali poškození corpus callosum opět u pacientů s DAP [5]. Poškození CC detekovatelná metodikou DTI byla patrna u všech pacientů nezávisle na přítomnosti léze v CC na konvenčních obrazech MR. DTI tedy nabízí velmi senzitivní metodu studia poranění drah u pacientů s DAP.
Cingulum (fasciculus cinguli)
Fasciculus cinguli je hlavní součástí dorzálního limbického traktu; probíhá v hloubce gyrus cinguli. V části poblíž centrálního sulku se dělí na přední (pod frontálním lalokem) a zadní část (pod parietálním lalokem). Svým průběhem spojuje orbitální část frontálního laloku, entorinální a peririnální kortex, suplementární motorickou areu (SMA), dorzolaterální prefrontální kortex, lobus parietalis caudalis inferior, retrospleniální kortex, parahipokampální kortex a presubiculum. Je součástí Papezova okruhu [6,7]. Díky tomu, že propojuje hipokampus a parahipokamální gyrus (paměť) s prefrontální oblastí (chování, pracovní paměť, práce s informacemi) a rostrální inzulární gyrus (motivace a nasazení), má zásadní vliv na motivační a emoční složky chování a prostorovou paměť.
Existuje málo prací, které by se přímo systematicky zabývaly neurochirurgickými pacienty s lézí cingula [8,9]. Von Lehe a Schramm operovali 34 pacientů pro gliomy cingula. Nejčastějším projevem byly epileptické záchvaty. Dominovaly gliomy s origem v cingulu a propagací do supracingulárního frontálního či parietálního laloku. U lézí čistě cingulárních dominoval přístup interhemisferický, u pacientů s propagací do okolí tumoru pak přístup transkortikální. Nejčastější příčinou postoperační morbidity byl dočasný syndrom suplementární motorické kůry (SMA) [9]. V neurovědní problematice tak v souvislosti s fasciculus cinguli dominuje studium mikrostrukturálních změn této dráhy pomocí metodiky DTT u psychiatrických pacientů [10–12] či jedinců s psychickými poruchami např. následkem neurotraumatu [13].
Corpus callosum
Corpus callosum je jednou z dominantních struktur při pohledu na mozkovou hemisféru z mediální strany. Sestává z 200–300 miliónů axonů spojujících obě hemisféry. Jedná se tak o největší komisurální dráhu. Začíná tenkým rostrem u lamina terminalis, rozšiřuje se směrem frontálním, poté se otáčí okcipitálně (genu) a ve fronto-okcipitálním směru pokračuje pod gyrus cinguli jeho hlavní část (corpus). Ve své poslední části se ohýbá opět směrem dolů nad glandula pinealis a také zde se rozšiřuje (splenium).
Vlákna corpus callosum spojují jednotlivé části mozkových hemisfér. Ta, která spojují frontální laloky a procházejí skrze genu corporis callosi, vytvářejí strukturu forceps major či anterior, zatímco ta, jež spojují okcipitální laloky, tvoří forceps minor či posterior. Méně známou součástí je pak tzv. tapetum, popsané německým psychiatrem, anatomem a fyziologem J. C. Reilem (1759–1813), který mimo jiné popsal také inzulu. Jedná se o vlákna, která spojují oba spodní temporální laloky. Vlákna jsou zásobena dlouhými perforátory z arteria cerebri media a větvemi ze zadních mozkových tepen v okolí trigona. Vlákna probíhají kolem stěn postranních komor, tvoří postranní stěnu temporálních rohů a postranní stěnu a střechu okcipitálních rohů (obr. 2d). Degenerativní změny vláken tapeta byly nalezeny u pacientů s farmakorezistentní epilepsií, což možná souvisí s tím, že tapetum může být cestou šíření u temporálních epilepsií [14].
Existují studie topografické distribuce vláken v corpus callosum, neboť v anatomických řezech není patrné žádné dělení drah v corpus callosum. Nejznámější je Witelsonovo schéma, které corpus callosum dělí převážně na základě studia dat získaných na primátech [15]. Toto schéma dělí corpus callosum na pět vertikálních segmentů v předozadním směru: přední třetina, přední a zadní střed těla, zadní třetina a zadní pětina. Přední třetina zahrnuje rostrum, genu a přední část těla corpus callosum. Obsahuje vlákna z prefrontální a premotorického kortexu a suplementární motorické kůry. Vlákna z motorického kortexu procházejí CC skrze přední střed těla a vlákna z postcentrálního gyru a zadní parietální vlákna skrze zadní střed těla. Posteriorní třetina pak zahrnuje istmus a splenium CC a obsahuje vlákna z temporálního, parietálního a okcipitálního laloku. Nicméně ani Witelsonova klasifikace, ani jiné nekorelují se strukturou CC na buněčné úrovni [16].
Wahl et al studovali tzv. motorickou část corpus callosum, tedy vlákna spojující oba precentrální gyry; v corpus callosum se nachází v dorzální části těla [17]. Jednotlivá vlákna jsou pak uspořádána somatotopicky tak, že část vláken spojujících premotorické arey pro ústa je ventrálně, poté jsou vlákna spojující ruce a nejvíce dorzálně jsou vlákna spojující premotorické arey pro nohy. Také na našich disekčních preparátech jsme pozorovali toto somatotopické rozdělení komisurálních vláken motorické části corpus callosum (obr. 2b). Podobným způsobem jsme zrekonstruovali vlákna metodikou DTI v 3D obraze (obr. 2c).
Kalosotomie, jako operační metoda, bývá využívána v dětské epileptochirurgii u atonických či „drop-attacks“ záchvatů. V neurochirurgii dospělých pak menší kalosotomie využíváme v přístupu do lézí III. komory. Rizikem rozsáhlých kalosotomií je pak rozvoj diskonekčního syndromu. Shrnující práci zabývající se rozsahem kalosotomie a diskonekčního syndromu u dětských epileptochirurgických pacientů sepsali Jea et al [18]. Transkalózní (transforaminální či mezi oběma fornixy) přístup je také výhodný přístup k patologiím přední třetiny III. komory. Částečná roztětí corpus callosum nevede k zásadním defektům v postoperačním období, nicméně je nutné pečlivé studium snímků z magnetické rezonance pro přesné plánování, zvláště abychom se vyhnuli drenážním žílám frontálních laloků i poškození fornixu [19].
Peltier et al [20] kombinovali techniku preparace drah spolu s DTI, pomocí kterých studovali komisurální vlákna v přední části corpus callosum. V rostru a těle identifikovali vlákna spojující arey 11, 12 a 25, pro genu vlákna spojující arey 9, 10 a 32 a pro přední část těla vlákna spojující arey 6, 8 a 9. V rostru dále nově objevili vlákna spojující oba temporální laloky a nazvali je „kalozální Peltierova radiace“. Funkce těchto vláken však zatím není jasná. Autoři doufají, že další výzkum včetně neurokognitivních testů může objasnit význam takto nově objevených drah.
Zajímavostí je, že existuje již několik prací z posledních let, které studují aktivaci vláken bílé hmoty právě v corpus callosum pomocí funkční magnetické rezonance (fMR) [21–24]. Gawryluk et al dokonce zjistili aktivaci různých částí corpus callosum (ventrální a dorzální části) při použití dvou různých typů aktivačních algoritmů v závislosti na interhemisferální integraci různých funkčních oblastí mozku [25].
Fornix
Fornix je nejdůležitější drahou hipokampální formace. Jedná se o bilaterální strukturu. Fornix obsahuje asi 1 milión vláken a přináší informace z hipokampu i do něj. Vlákna vedou z hipokampu, nejvíce z oblasti subikula, a jdou směrem ke commissura anterior, kde se dělí na vlákna prekomisurální, se zakončením v area subcallosa a septu, a postkomisurální, pokračující do hypothalamu a corpus mamillare.
Fornix je v neurochirurgii významnou strukturou při operacích intraventrikulárních lézí. Jeho poškození vede k defektu krátkodobé paměti. Operace koloidní cysty III. komory je typický příklad soutěže dvou technik: mikrochirurgické (nejčastěji z transkalózního přístupu) a endoskopické [26,27]. U obou je pak právě riziko poškození této párové struktury. Dále existují práce o poruše fornixu u pacientů např. po neurotraumatu [28]. Poškození fornixu se dají opět velmi dobře studovat pomocí DTI. Hattori et al prostřednictvím DTI zjistili různý charakter změn fornixu u pacientů s idiopatickým normotenzním hydrocefalem a u pacientů s Alzheimerovou chorobou [29]. Zatímco u pacientů s iNPH došlo k mechanickému natažení fornixu na podkladě roztažení postranních komor a deformace corpus callosum, u pacientů s Alzheimerovou chorobou byla příčinou atrofie hipokampu.
Využití moderních metodik MR, jako je právě traktografie, nabízí i možnost zobrazení průběhu virtuální operace a stavu drah před operací a po ní, tedy zdali při určitém přístupu poškodíme či nepoškodíme danou dráhu. Toho využili Colnat--Coulbois et al při MR modelování selektivní amygdalohipokampektomie [30]. Zjistili, že teoreticky tento přístup poškodí část fornixu, vláken spojujících oba hipokampy a vlákna jdoucí do orbitofrontálního kortexu. Tento přístup tedy teoreticky může způsobit rozpojení frontálního a temporálního laloku.
Optická radiace
Zrakovou dráhu můžeme sledovat od nervus opticus, chiazmatu, tractus opticus otáčející se kolem mezencefala do corpus geniculatum laterale (CGL). Od corpus geniculatum laterale pak pokračuje optická radiace. Ta se nachází pod ependymem laterální stěny postranní komory. Vzhledem k tomu, že vlákna optické radiace se stávají součástí sagitálního strata, je jejich přesná identifikace obtížná. Optická radiace poté pokračuje směrem do okcipitálního laloku, superiorně a posteriorně od fissura calcarina. Lze identifikovat tři skupiny vláken optické radiace. Každá skupina obsahuje přibližně třetinu vláken. První skupina míří přímo posteriorně od CGL jako součást stratum sagittale a končí nad fissura calcarina (posteriorní svazek). Druhá skupina vláken se částečně otáčí anteriorně, ale nedosahuje k přední části temporálního rohu, neboť se stáčí posteriorně směrem k stratum sagittale a do area calcarina (centrální svazek). Třetí část vláken běží podél laterální stěny k temporálnímu hrotu postranní komory a poté se připojí k stratum sagittale a směrem posteriorním do kortexu pod fissura calcarina; vlákna tvoří přední svazek, tzv. Meyerovu kličku. Toto uspořádání optické radiace bylo popsáno mnoha autory [31,32].
Meyerova klička je složena z nejventrálnějších vláken optické radiace; přenáší vizuální impulzy z kontralaterálních horních kvadrantů obou očí. Následkem jejího přerušení je tak homonymní horní kvadrantopsie [33]. U pacientů, kteří podstoupili temporální resekci pro epilepsii, byla po operaci diagnostikována porucha zorného pole u 52–74 % z nich [34–37]. Pujari et al provedli studii vztahu optické radiace k přístupům skrze temporální lalok [35]. Zjistili, že resekce probíhající skrze strop temporálního roku postranní komory více než 3 cm za temporálním pólem či přístup skrze střední temporální gyrus více než 55–60 mm za temporálním pólem může vést k porušení zde probíhající Meyerovy kličky. Přesto však existuje kontroverze týkající se interindividuální a dokonce i intraindividulní variability (mezi oběma hemisférami jedince) průběhu Meyerovy kličky [38]. Proto se zdá, že praktický význam v predikci postoperačního deficitu zrakového pole může mít právě DTI integrované do peroperačních navigačních systémů [39].
Traktografie pomocí techniky zobrazování difuzních tenzorů
Technika traktografie pomocí zobrazování difuzních tenzorů se rozšířila jak v klinickém použití například pro zobrazení motorických a řečových drah u pacientů při operacích mozkových tumorů [40,41], tak jako metoda zkoumání anatomických vztahů drah v bílé hmotě [42,43]. V této práci představujeme použití techniky pro zobrazení drah, které zároveň demonstrujeme pomocí disekcí na kadaverózním materiálu. Důležité je na tomto místě diskutovat i o technických aspektech metody. Většina praktických doporučení a studií na téma technického provedení DTI vyšetření se shoduje na tom, že je vhodné použít pokud možno silnější magnetické pole, které zlepšuje poměr signál-šum [44]. Zároveň tyto práce popisují vhodnost měření difuze ve větším počtu směrů, což vede k lepší reprodukovatelnosti výsledků. Lepší výsledky jsou popisovány i při akvizici většího počtu směrů na úkor opakování. Vhodný přehled informací přináší například práce Mukherjee et al [45], kde je jako doporučovaný počet směrů k optimalizaci vyšetření pro traktografii u 1,5T i 3T přístrojů uváděna hodnota 30, a to bez opakování. Na tomto místě je nutné uvést, že konkrétní nastavení bude jistě záviset na časových a technických možnostech každého pracoviště. Další výhodou akvizice většího počtu difuzně vážených obrazů v různých směrech je možnost použití metod, které nejsou založeny na modelu difuzního tenzoru, a dá se tedy pomocí nich znázornit i difuze probíhající v rámci jednoho voxelu ve více směrech. Tyto metody (např. Diffusion Spectrum Imaging, DSI) vyžadují vysoké hodnoty difuzního vážení a ještě větší počet měřených směrů než 30 doporučovaných pro DTI. Příkladem vhodného použití takových metod může být například laterální část pyramidové dráhy, kde jsou v oblasti přestupu přes fasciculus longitudinalis superior vlákna obou drah uložena prakticky kolmo k sobě, a v rámci jednoho voxelu tudíž může u DTI dojít k „vynulování“ difuze a snížení frakční anizotropie. Samostatnou kapitolou jsou jednotlivé algoritmy deterministického trasování nebo probabilistické analýzy konektivity. Vzhledem k časové nenáročnosti jsou v klinické praxi používány hlavně algoritmy trasovací, probabilistické pak zůstávají doménou výzkumu.
Závěr
Pro neurochirurga je zásadní lokalizace té či oné dráhy ve vztahu k operované mozkové lézi (tumor, cévní malformace, epileptogenní ložisko apod.) a operačnímu přístupu. Většina z nás nemá zcela ideální 3D představu o všech strukturách mozku při operaci, navíc často ztíženou dislokací těchto struktur např. nádorem. Preparace jednotlivých drah bílé hmoty umožní neurochirurgovi tuto schopnost aspoň částečně získat a lépe si uvědomit prostorový vztah drah vůči povrchovým (gyrifikace, sulky) či hlubokým (bazální ganglia, komorový systém, arteriální větvení) strukturám. Disekční Klinglerova technika tak může pomoci zvláště mladším neurochirurgům při plánování operací a operačních přístupů, což nám potvrdili i účastníci letošního kurzu disekce mozkových drah pořádaného naší klinikou v červnu v Praze. Existuje mnoho dalších velmi zajímavých prací, které doporučujeme ke studiu pro zájemce o hlubší poznání problematiky preparace drah bílé hmoty [46–48].
MUDr. Aleš Hejčl, Ph.D.
Neurochirurgická klinika
UJEP a Krajská zdravotní, a.s. – Masarykova nemocnice
Sociální péče 12A
401 13 Ústí nad Labem
e-mail: ales.hejcl@kzcr.eu
Přijato k recenzi: 19. 1. 2012
Přijato do tisku: 2. 7. 2012
Zdroje
1. Bartoš R, Hejčl A, Zolal A, Malucelli A, Sameš M, Petrovický P. Laboratorní disekce drah laterálního aspektu mozkové hemisféry. Cesk Slov Neurol N 2012; 75/108(1): 30–37.
2. Agrawal A, Kapfhammer JP, Kress A, Wichers H, Deep A, Feindel W et al. Josef Klingler‘s models of white matter tracts: influences on neuroanatomy, neurosurgery, and neuroimaging. Neurosurgery 2011 69(2): 238–252.
3. Hong JH, Choi BY, Chang CH, Kim SH, Jung YJ, Byun WM et al. Injuries of cingulum and fornix following rupture of anterior communicating artery aneurysm: a diffusion tensor tractography study. Neurosurgery 2012; 70(4): 819–823.
4. Chang MC, Kim SH, Kim OL, Bai DS, Jang SH. The relation between fornix injury and memory impairment in patients with diffuse axonal injury: a diffusion tensor imaging study. NeuroRehabilitation 2010; 26(4): 347–353.
5. Chang MC, Jang SH. Corpus callosum injury in patients with diffuse axonal injury: a diffusion tensor imaging study. NeuroRehabilitation 2010; 26(4): 339–345.
6. Petrovický P. Anatomie s topografií a klinickými aplikacemi III. Martin: Osveta; 2001.
7. Petrovický P. Klinická neuroanatomie CNS. Praha//Kroměříž: Triton 2008.
8. von Lehe M, Wagner J, Wellmer J, Clusmann H, Kral T. Epilepsy surgery of the cingulate gyrus and the fronto-mesial cortex. Neurosurgery 2012; 70(4): 900–910.
9. von Lehe M, Schramm J. Gliomas of the cingulate gyrus: surgical management and functional outcome. Neurosurg Focus 2009; 27(2): E9.
10. Abdul-Rahman MF, Qiu A, Sim K. Regionally specific white matter disruptions of fornix and cingulum in schizophrenia. PLoS One 2011; 6(4): e18652.
11. O‘Dwyer L, Lamberton F, Bokde AL, Ewers M, Faluyi YO, Tanner C et al. Multiple indices of diffusion identifies white matter damage in mild cognitive impairment and Alzheimer‘s disease. PLoS One 2011; 6(6): e21745.
12. Kim JW, Lee DY, Choo IH, Seo EH, Kim SG, Park SY et al. Microstructural Alteration of the Anterior Cingulum is Associated With Apathy in Alzheimer Disease. Am J Geriatr Psychiatry 2011; 19(7): 644–653.
13. Yurgelun-Todd DA, Bueler CE, McGlade EC, Churchwell JC, Brenner LA, Lopez-Larson MP. Neuroimaging correlates of traumatic brain Injury and suicidal behavior. J Head Trauma Rehabil 2011; 26(4): 276–289.
14. Kim H, Piao Z, Liu P, Bingaman W, Diehl B. Secondary white matter degeneration of the corpus callosum in patients with intractable temporal lobe epilepsy: a diffusion tensor imaging study. Epilepsy Res 2008; 81(2–3): 136–142.
15. Witelson SF. Hand and sex differences in the isthmus and genu of the human corpus callosum. A postmortem morphological study. Brain 1989; 112 (Pt 3): 799–835.
16. Hofer S, Frahm J. Topography of the human corpus callosum revisited – comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage 2006; 32(3): 989–994.
17. Wahl M, Lauterbach-Soon B, Hattingen E, Jung P, Singer O, Volz S et al. Human motor corpus callosum: topography, somatotopy, and link between microstructure and function. J Neurosci 2007; 27(45): 12132–12138.
18. Jea A, Vachhrajani S, Widjaja E, Nilsson D, Raybaud C, Shroff M et al. Corpus callosotomy in children and the disconnection syndromes: a review. Childs Nerv Syst 2008; 24(6): 685–692.
19. Kasowski H, Piepmeier JM. Transcallosal approach for tumors of the lateral and third ventricles. Neurosurg Focus 2001; 10(6): E3.
20. Peltier J, Verclytte S, Delmaire C, Deramond H, Pruvo JP, Le Gars D et al. Microsurgical anatomy of the ventral callosal radiations: new destination, correlations with diffusion tensor imaging fiber-tracking, and clinical relevance. J Neurosurg 2010; 112(3): 512–519.
21. Mosier K, Bereznaya I. Parallel cortical networks for volitional control of swallowing in humans. Exp Brain Res 2001; 140(3): 280–289.
22. Tettamanti M, Paulesu E, Scifo P, Maravita A, Fazio F, Perani D, et al. Interhemispheric transmission of visuomotor information in humans: fMRI evidence. J Neurophysiol 2002; 88(2): 1051–1058.
23. Mazerolle EL, D‘Arcy RC, Beyea SD. Detecting functional magnetic resonance imaging activation in white matter: interhemispheric transfer across the corpus callosum. BMC Neurosci 2008; 9: 84.
24. Mazerolle EL, Beyea SD, Gawryluk JR, Brewer KD, Bowen CV, D‘Arcy RC. Confirming white matter fMRI activation in the corpus callosum: co-localization with DTI tractography. Neuroimage 2010; 50(2): 616–621.
25. Gawryluk JR, D‘Arcy RC, Mazerolle EL, Brewer KD, Beyea SD. Functional mapping in the corpus callosum: a 4T fMRI study of white matter. Neuroimage 2011; 54(1): 10–15.
26. Horn EM, Feiz-Erfan I, Bristol RE, Lekovic GP, Goslar PW, Smith KA et al. Treatment options for third ventricular colloid cysts: comparison of open microsurgical versus endoscopic resection. Neurosurgery 2008; 62 (6 Suppl 3): 1076–1083.
27. Grondin RT, Hader W, MacRae ME, Hamilton MG. Endoscopic versus microsurgical resection of third ventricle colloid cysts. Can J Neurol Sci 2007; 34(2): 197–207.
28. Hong JH, Jang SH. Degeneration of cingulum and fornix in a patient with traumatic brain injury: diffuse tensor tractography study. J Rehabil Med 2010; 42(10) 979–981.
29. Hattori T, Sato R, Aoki S, Yuasa T, Mizusawa H. Different Patterns of Fornix Damage in Idiopathic Normal Pressure Hydrocephalus and Alzheimer Disease. AJNR Am J Neuroradiol 2012; 33(2); 274–279.
30. Colnat-Coulbois S, Mok K, Klein D, Penicaud S, Tanriverdi T, Olivier A. Tractography of the amygdala and hippocampus: anatomical study and application to selective amygdalohippocampectomy. J Neurosurg 2010; 113(6): 1135–1143.
31. Sincoff EH, Tan Y, Abdulrauf SI. White matter fiber dissection of the optic radiations of the temporal lobe and implications for surgical approaches to the temporal horn. J Neurosurg 2004; 101(5): 739–746.
32. Kawashima M, Li X, Rhoton AL jr, Ulm AJ, Oka H, Fujii K. Surgical approaches to the atrium of the lateral ventricle: microsurgical anatomy. Surg Neurol 2006; 65(5): 436–445.
33. Jacobson DM. The localizing value of a quadrantanopia. Arch Neurol 1997; 54(4): 401–404.
34. Marino R jr, Rasmussen T. Visual field changes after temporal lobectomy in man. Neurology 1968; 18(9): 825–835.
35. Pujari VB, Jimbo H, Dange N, Shah A, Singh S, Goel A. Fiber dissection of the visual pathways: analysis of the relationship of optic radiations to lateral ventricle: a cadaveric study. Neurol India 2008; 56(2): 133–137.
36. Tecoma ES, Laxer KD, Barbaro NM, Plant GT. Frequency and characteristics of visual field deficits after surgery for mesial temporal sclerosis. Neurology 1993; 43(6): 1235–1238.
37. Jensen I, Seedorff HH. Temporal lobe epilepsy and neuro-ophthalmology. Ophthalmological findings in 74 temporal lobe resected patients. Acta Ophthalmol (Copenh) 1976; 54(6): 827–841.
38. Ebeling U, Reulen HJ. Neurosurgical topography of the optic radiation in the temporal lobe. Acta Neurochir (Wien) 1988; 92(1–4): 29–36.
39. Chen X, Weigel D, Ganslandt O, Buchfelder M, Nimsky C. Prediction of visual field deficits by diffusion tensor imaging in temporal lobe epilepsy surgery. Neuroimage 2009; 45(2): 286–297.
40. Kuhnt D, Bauer MH, Becker A, Merhof D, Zolal A, Richter M et al. Intraoperative visualization of fiber tracking based reconstruction of language pathways in glioma surgery. Neurosurgery 2012; 70(4): 911–919.
41. Zolal A, Hejčl A, Vachata P, Bartoš R, Humhej I, Malucelli A et al. The use of diffusion tensor images of the corticospinal tract in intrinsic brain tumor surgery – a comparison with direct subcortical stimulation. Neurosurgery 2012; 71(2): 331–340.
42. Catani M, Thiebaut de Schotten M. A diffusion tensor imaging tractography atlas for virtual in vivo dissections. Cortex 2008; 44(8): 1105–1132.
43. Zolal A, Vachata P, Hejčl A, Bartoš R, Malucelli A, Nováková M et al. Anatomy of the supraventricular portion of the pyramidal tract. Acta Neurochirurgica 2012; 154(6): 1097–1104.
44. Tijssen RH, Jansen JF, Backes WH. Assessing and minimizing the effects of noise and motion in clinical DTI at 3 T. Hum Brain Mapp 2009; 30(8): 2641–2655.
45. Mukherjee P, Chung SW, Berman JI, Hess CP, Henry RG. Diffusion tensor MR imaging and fiber tractography: technical considerations. AJNR Am J Neuroradiol 2008; 29(5): 843–852.
46. Yaşargil MG, Ture U, Yaşargil DC. Surgical anatomy of supratentorial midline lesions. Neurosurg Focus 2005; 18(6B): E1.
47. Fernández-Miranda JC, Rhoton AL jr, Alvarez-Linera J, Kakizawa Y, Choi C, de Oliveira EP. Three-dimensional microsurgical and tractographic anatomy of the white matter of the human brain. Neurosurgery 2008; 62 (6 Suppl 3): 989–1026.
48. Choi CY, Han SR, Yee GT, Lee CH. Central core of the cerebrum. J Neurosurg 2011; 114(2): 463–469.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 6
Nejčtenější v tomto čísle
- Epidemie roztroušené sklerózy ve světě?
- Spinální kongres
- Kortikální patologie u roztroušené sklerózy – morfologické, imunopatologické a klinické souvislosti
- Fázový model neurorehabilitace
