Hyperbarická oxygenační terapie závažných kraniocerebrálních poranění u dětí a adolescentů
Hyperbaric Oxygen Therapy of Severe Traumatic Brain Injury in Children and Adolescents
Aim:
Recent studies have suggested that hyperbaric oxygen therapy (HBOT) might be a relatively safe and promising treatment for children patients with severe traumatic brain injury (TBI).
Patients and methods:
From June 2006 to February 2010 we referred seven (age 2–17 years) of the 15 children (11 male) after severe TBI (GCS ≤8) treated at our PICU to HBOT. We analysed Glasgow Coma Scale (GCS) before and after acute treatment, Paediatric Risk of Mortality (PRISM) on admission to PICU, Glasgow Outcome Scale (GOS) and endocrine functions after 6 months from an injury in all admitted patients. The patients received HBOT in a multiplace chamber. Oxygen (100% O2, compression to 2 ATA) was delivered to patients over 80 min every 24 h.
Results:
HBOT was indicated in patients who suffered prolonged disturbance of consciousness after an acute treatment of the TBI. The median interval from the injury to receiving HBOT was ± 17.7 days (10–22 days). GCS after an acute treatment and PRISM score on admission of children receiving HBOT were significantly different from children without HBOT (p <0.001 and p = 0.003, respectively). The patients received between 3 and 22 courses of HBOT (mean of ±10.9 sessions per patient). Adverse events were observed in three patients. There was no statistical difference in GOS between HBOT treated and untreated patients after six months from the injury. There were no changes in endocrine function in any of the patients.
Conclusion:
HBOT appears to be beneficial as an adjunctive treatment in children and adolescents with disturbed consciousness following an acute treatment of severe TBI with no major adverse events.
Key words:
traumatic brain injury – hyperbaric oxygen therapy – neuroprotective effect – endocrine function
Autoři:
V. Smolka 1; E. Klásková 1; M. Hájek 2; M. Rohanová 1; D. Aleksijevič 1; J. Zapletalová 1; J. Wiedermann 1
Působiště autorů:
Jednotka intenzivní a resuscitační péče, Dětská klinika LF UP a FN Olomouc
1; Centrum hyperbarické medicíny, Městská nemocnice Ostrava
2
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(4): 485-489
Kategorie:
Krátké sdělení
Souhrn
Cíl:
Studie s hyperbarickou kyslíkovou terapií (HBOT) u dospělých pacientů ukázaly, že tato léčba je relativně bezpečná a mohla by být potenciální terapií pro dětské pacienty se závažným kraniocerebrálním poraněním (KCP).
Soubor a metodika:
V období od června 2006 do únoru 2010 bylo doporučeno k HBOT sedm pacientů ve věku 2–17 let z 15 dětí se závažným KCP, které byly léčeny na dětské jednotce intenzivní a resuscitační péče (JIRP). U všech přijatých pacientů bylo hodnoceno Glasgow Coma Scale (GCS) při přijetí a před propuštěním z JIRP, Paediatric Risk of Mortality Score (PRISM) při přijetí na JIRP a Glasgow Outcome Scale (GOS) a endokrinní funkce šest měsíců od úrazu. HBOT probíhala 80 minut ve vícemístné hyperbarické komoře každých 24 hodin při absolutním tlaku dvě atmosféry.
Výsledky:
K HBOT byli indikováni pacienti s prodlouženou poruchou vědomí po ukončení akutní léčby KCP. Medián doby od úrazu k zahájení HBOT byl ± 17,7 dnů (10–22 dnů). U pacientů léčených hyperbarickým kyslíkem (HBO) bylo PRISM při přijetí a GCS po akutní léčbě signifikantně rozdílné od pacientů neléčených HBO (p < 0,001; resp. p = 0,003). Proběhlých sezení HBOT bylo průměrně ± 10,9 (3–22). Vedlejší účinky léčby byly registrovány u tří pacientů. Mezi pacienty, kteří byli léčeni HBO, a skupinou neléčených nebyl statistický rozdíl v GOS po šesti měsících od úrazu. U žádného pacienta nedošlo ke změnám neuroendokrinních funkcí.
Závěr:
HBOT může být přínosná jako doplňující léčba dětí a adolescentů s přetrvávající poruchou vědomí po akutní léčbě závažného KCP bez významných vedlejších účinků.
Klíčová slova:
kraniocerebrální poranění – hyperbarická kyslíková terapie – neuroprotektivní efekt – endokrinní funkce
Úvod
Kraniocerebrální poranění (KCP) je závažný medicínský a socioekonomický problém a je nejčastější příčinou úmrtí a invalidity v dětském věku. Běžným patologickým nálezem u dětí po úrazovém i neúrazovém kraniocerebrálním poranění je difuzní axonální postižení, které zahrnuje rozsáhlé poškození axonů v mozkové bílé hmotě. Předpokládá se, že důležitou roli v rozvoji difuzního axonálního postižení sehrává hypoxicko-ischemické postižení, dysregulace toku kalcia a dalších iontů, mitochondriální a cytoskeletální dysfunkce. Na rozdíl od primárního axonálního postižení (primary axotomy), se u sekundárního traumatického axonálního postižení (TAP) jedná o opožděný proces (secondary axotomy) [1]. Hypoxie a ischemie jsou hlavní komplikace KCP, a proto není překvapením, že 80 až 90 % pacientů, kteří zemřeli po KCP, mělo při histopatologickém vyšetření mozkové tkáně ischemické změny. Na základě experimentálních prací se předpokládá, že mladší mozek je náchylnější k rozsáhlému TAP než mozek dospělý [2]. Současně se na zvířecím modelu dětského KCP ukazuje, že TAP s probíhající axonální degenerací je spojen s chronickou kognitivní dysfunkcí [3]. V současné době pokračuje intenzivní výzkum léčebných možností, jak zastavit progresi nebo zabránit rozvoji těchto patofyziologických mechanizmů.
Vědecké práce na zvířecích modelech a ojedinělé klinické studie ukazují na možný přínos hyperbarické oxygenační terapie (HBOT) v léčbě závažného KCP. HBOT je lékařské využití kyslíku při použití tlaku, který je vyšší než tlak atmosférický. Mechanizmus účinku HBOT spočívá v dramatickém zvýšení parciálního tlaku kyslíku ve tkáních, usnadnění transportu kyslíku v plazmě, zvýšení mozkového aerobního metabolizmu a ovlivnění funkce neutrofilů. Byl prokázán neuroprotektivní účinek HBOT na různých modelech mozkového postižení v důsledku zlepšení metabolizmu kyslíku, redukce apoptózy, zmenšení otoku mozku, ochrany hematoencefalické bariéry, snížení oxidativního stresu, zvýšení antioxidační aktivity, potlačení zánětlivé odpovědi a zlepšení regeneračních schopností mozku [4]. Cílem naší retrospektivní práce je upozornit na možnost využití HBOT u dětských pacientů se závažným KCP v jeho subakutní fázi a na monitorování vedlejších účinků hyperbaroxické léčby.
Soubor a metodika
Do retrospektivní observační studie byli zahrnuti pacienti, kteří byli v období od června 2006 do února 2010 přijati na jednotku intenzivní a resuscitační péče (JIRP) Dětské kliniky (DK) v Olomouci se závažným KCP. Závažné KCP bylo definováno jako Glasgow Coma Scale (GCS) ≤ 8 při vyloučení vlivu analgosedace a myorelaxace. V tomto období bylo na JIRP hospitalizováno 18 dětí a adolescentů (12 chlapců) ve věku dva roky až 17 let splňujících definici závažného KCP. Pediatric Risk of Mortality Score (PRISM) bylo stanoveno v prvních 6 hodinách od přijetí na JIRP. Pacienti byli léčeni podle Lundova schématu léčby KCP [5,6]. Tři pacienti zemřeli a jejich výsledky nejsou součástí studie. Z 15 sledovaných pacientů sedm dětí (čtyři chlapci) bylo indikováno k HBOT (skupina A) a ostatních osm pacientů (sedm chlapců) bylo propuštěno z JIRP na standardní oddělení DK (skupina B). Indikací k HBOT bylo přetrvávání poruchy vědomí po ukončení akutní léčby KCP. Pacienti skupiny A byli hemodynamicky stabilní, neměli klinické ani laboratorní známky akutní infekce. U všech dětí byla provedena preventivní paracentéza. Před překladem pacienti spontánně dýchali a nepotřebovali podpůrnou ventilaci. Rodiče dětí byli informováni o HBOT a souhlasili s navrženým postupem. Pacienti byli přeloženi do Centra hyperbarické medicíny Městské nemocnice Ostrava. HBOT probíhala ve vícemístné hyperbarické komoře 80 minut každých 24 hodin při absolutním tlaku dvě atmosféry (ATA). Hyperbarická komora byla vybavena kompletním resuscitačním zařízením s možností kompletního monitorování vitálních funkcí. Současně bylo zajištěno monitorování a přenos průběhu léčby televizním okruhem a jeho uložení na DVD záznam. Všichni pacienti byli během léčby v komoře doprovázeni a ošetřováni specializovaným personálem. Komunikace s řídícím pultem operátora a lékařem byla zajištěna hlasitým odposlechem a telefonickým spojením.
Byly sledovány vedlejší účinky HBOT. U všech 15 pacientů bylo po šesti měsících od traumatu provedeno hodnocení podle Glasgow Outcome Scale (GOS) a byly vyšetřeny standardní endokrinní testy: TSH, fT4, IGF 1, ranní kortizol, FSH, LH, testosteron u chlapců a estradiol u dívek.
Výsledky Pediatric Risk of Mortality Score (PRISM), GCS při přijetí a před propuštěním z JIRP a GOS byly porovnány u skupin pacientů léčených a neléčených hyperbaroxií (HBO) podle nepárového t-testu. Za statisticky významnou byla považována hodnota p < 0,05.
Výsledky
U pacientů ve studii byly diagnostikovány různé druhy KCP, a to buď izolované, nebo v kombinaci. Difuzní axonální poranění (DAP) se vyskytlo u šesti dětí, intracerebrální krvácení (IKK) u pěti dětí, subdurální hematom (SDH) u čtyř, epidurální hematom (EDH) u dvou a subarachnoidální krvácení (SAK) u jednoho dítěte (tab. 1).
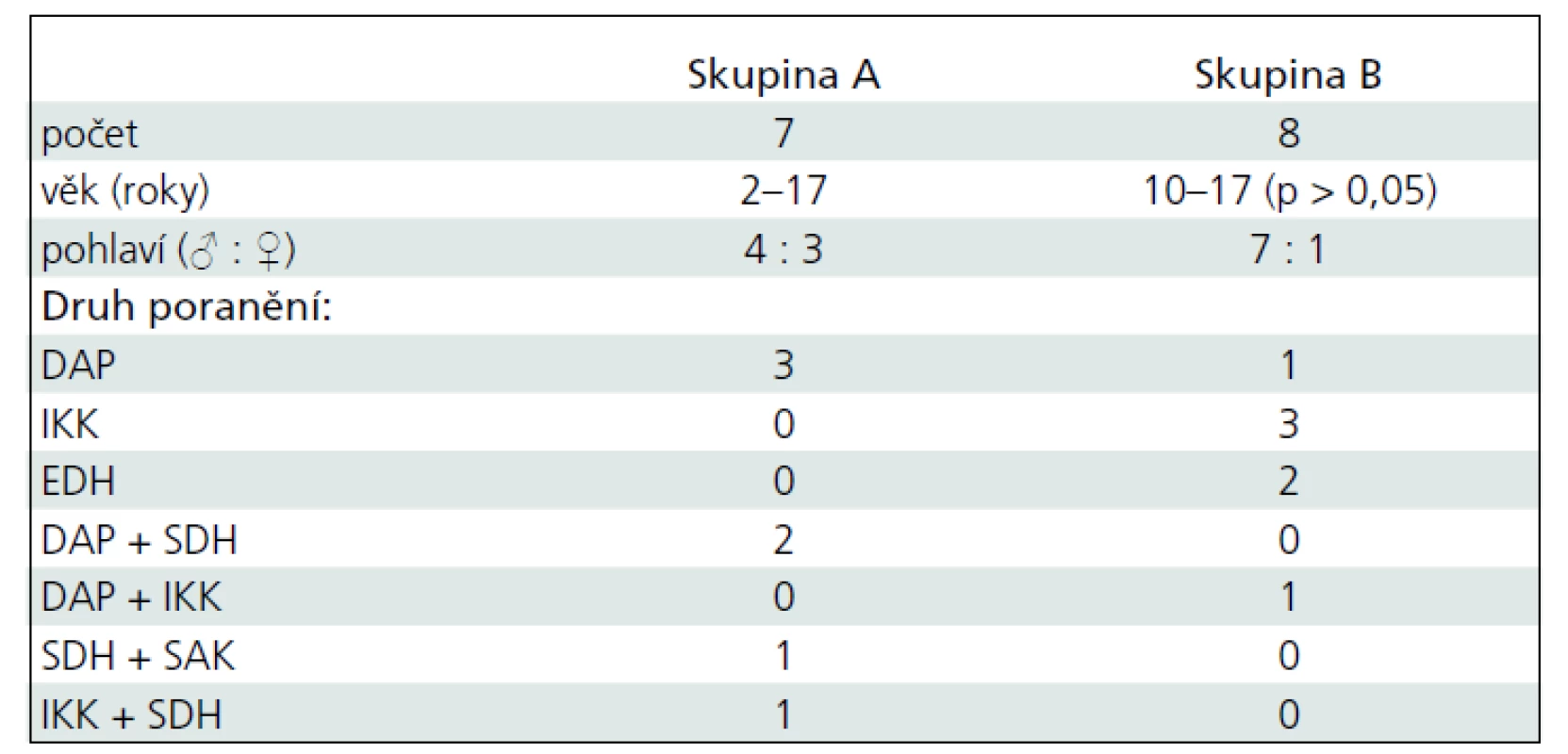
Srovnání závažnosti KCP hodnocená podle GCS do 6 hodin po úraze byla u všech dětí obou skupin bez statistické významnosti a průměrné hodnoty byly ± 6,4 (5–8) u skupiny A a ± 6,5 (4–8) u skupiny B. PRISM při přijetí bylo u pacientů skupiny A ± 25,4 (18–33) a skupiny B bylo ± 17,3 (11–25). Mezi skupinami byl signifikantní rozdíl (p = 0,003). Délka pobytu na JIRP byla 10 až 36 dnů a nebyl statistický rozdíl mezi oběma skupinami. GCS po ukončení pobytu na JIRP byl rozdílný u obou skupin (p = 0,001). Průměrná hodnota u skupiny A byla ± 10,4 (9–12) a ± 14,5 (14–15) u skupiny B. V hodnocení výsledků péče o pacienty s KCP podle GOS po šesti měsících po úrazu byl výsledek dobrý u tří dětí skupiny A a pěti dětí skupiny B. Střední porucha mozkových funkcí byla zjištěna u zbývajících sedmi dětí. Nebyl žádný statistický rozdíl ve výsledcích GOS obou skupin (tab. 2).
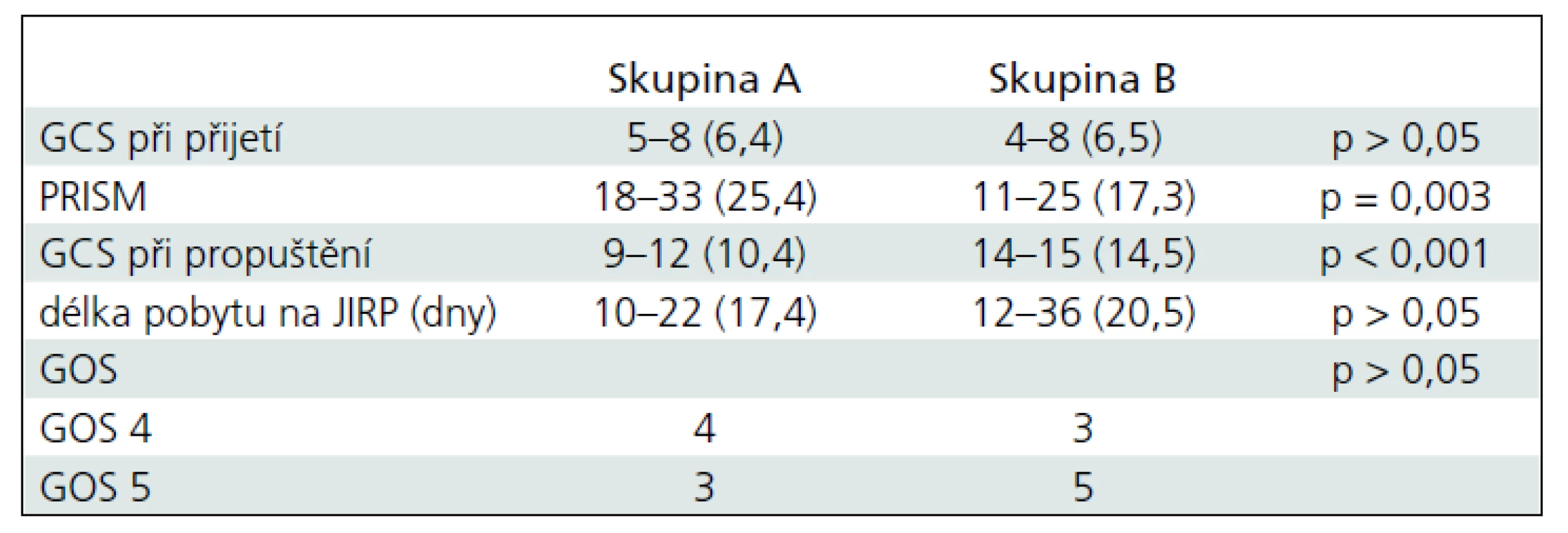
Počet sezení, kdy byla indikovaným pacientům aplikována HBOT, byl v rozmezí 3–22 dnů, průměr byl 10,9 dne. V tomto souboru nebyly u čtyř dětí žádné nežádoucí účinky. Drobné komplikace při HBOT nastaly u tří dětí. Pobyt v hyperbarické komoře byl u jednoho pacienta doprovázen motorických neklidem a intolerancí kyslíkové masky. Proto byla nutná během léčby sedace midazolamem. Další dvě děti měly problémy s ekvilibrací tlaku ve středouší. V jednom případě se jednalo o mírné potíže, které byly zvládnuty manévry a nižší rychlostí komprese. V druhém případě byly potíže již závažnější s nutností opakované paracentézy. Z důvodu trvajících bolestí uší bylo nutné u tohoto pacienta léčbu předčasně ukončit. Jiné komplikace při léčbě nebyly zaznamenány.
Vyšetření základních hormonálních parametrů neprokázalo žádné patologické hodnoty hormonů kromě jednoho pacienta, který nebyl léčen HBOT a u něhož byla prokázána nízká hladina inzulin podobného růstového faktoru (IGF 1). Avšak doplňující dynamické testy nedostatek růstového hormonu nepotvrdily.
Diskuze
Výsledkem závažného KCP může být heterogenní strukturální postižení mozku v závislosti na primárním inzultu a rozvoji sekundárních patologických procesů. Na selhání energetického metabolizmu mozkových buněk se budou podílet běžné metabolické procesy. Hypoxemie vzniklá po úraze vede ke snížení dodávky kyslíku mozku, k rozvoji anaerobního metabolizmu a k mitochondriální dysfunkci. Studie prokázaly, že HBOT zlepšuje průtok krve mozku, snižuje intrakraniální tlak a zvyšuje dostupnost kyslíku pro mozkové buňky [7]. Zvýšením difuzního gradientu kyslíku dochází k obnově mitochondriálních funkcí a zlepšení aerobního metabolizmu [7,8]. S vyšší nabídkou kyslíku se snižuje hladina laktátu v mozkomíšním moku. Klesá poměr laktát/pyruvát v mozkové tkáni Ten nejlépe odráží aktuální stav mozkového anaerobního metabolizmu [9]. U krys bylo popsáno zvýšení hladiny adenosintrifosfátu (ATP) v mozku po hyperbarické a normobarické hyperoxii, ale po HBOT došlo k obnově kognitivních funkcí a snížila se ztráta neuronálních buněk v hippokampu [10].
Pokles hladiny pO2 v mozkové tkáni jednoznačně souvisí s jejím postižením. Při nízkých hodnotách dochází k rozvoji ischemie s očekávaným nepříznivým výsledkem a nárůstem mortality po KCP u dětí [11]. Jako kritická hranice pO2 je udávána hodnota 200 mmHg, která se zdá důležitou k dosažení masivního pozitivního efektu na mozkový energetický metabolizmus [12].
Většina předcházejících studií byla zaměřena na využití HBOT co nejdříve po traumatu, to znamená v období s jednoznačnými známkami ischemie. V současné době však existují práce o léčbě dospělých pacientů HBO v subakutní nebo v chronické fázi KCP [13–15]. V této fázi se jedná již o pacienty oběhově stabilní, bez ventilačních problémů a intenzivně rehabilitované, stejně jak tomu bylo u našich pacientů. HBOT i v této časové periodě může být efektivní ve zlepšení cerebrálního metabolizmu při trvající metabolické dysfunkci [12].
V současné literatuře nejsou publikovány práce, které by se věnovaly využití HBOT u dětí se závažným KCP. I když skupina našich dětských pacientů je velmi početně omezená a rozdílná svými diagnózami, jedná se o první publikovaný soubor, kdy bylo využito HBO v postakutní fázi léčby KCP. Dětští pacienti v našem sledovaném souboru, kteří byli indikováni k HBOT, měli horší neurologický nález a na statisticky významné hladině nižší GCS při ukončení akutní léčby KPC na JIRP. Tato skupina dětí měla signifikantně vyšší PRISM a jejich prognóza při přijetí na JIRP byla méně příznivá. Ve skupině pacientů indikovaných k HBOT byl vyšší výskyt DAP. Pacienti s těžkým difuzním axonálním poraněním mnohdy přežívají ve vegetativním stavu, u méně závažných stavů jsou častým následkem poruchy kognitivních funkcí. Těžší difuzní axonální poranění vykazují vysokou mortalitu. Z těchto důvodů měla skupina pacientů léčených HBO primárně horší prognózu než skupina pacientů neléčených HBO. Avšak s odstupem šesti měsíců od úrazu byl rozdíl v GOS obou skupin statisticky nevýznamný i přes původně významně horší neurologický nález u skupiny dětí indikovaných k HBOT po ukončení akutní léčby KPC. Žádný z pacientů zařazených do studie neměl po šesti měsících od úrazu GOS ≤ 3.
Na základě získaných výsledků se nabízí předpoklad, že HBOT společně s intenzivní rehabilitací přispěla ke zlepšení neurologického nálezu u dětí a adolescentů se závažným KCP po ukončení akutní léčby. Zůstává otázkou, jaký by byl výsledek v případě, že by děti léčbu HBO nepodstoupily, a zda diagnóza DAP není nejzajímavější indikací k HBOT. Pro odpovědi chybí prospektivní studie homogennějších a větších souborů srovnatelných již se vstupními diagnózami a indikačními kritérii k HBOT.
Sekundární postižení mozku se může rozvinout po hodinách nebo dnech po KCP, ale mechanizmus opožděného mozkového poškození není jednoznačně vysvětlen. Podle výsledků studií se předpokládá, že akutní zánětlivá odpověď potencovaná především aktivitou neutrofilů je důležitou součástí tohoto procesu [16,17]. Neutrofily mohou přispívat k sekundárnímu poškození penumbra mikrovaskulárními okluzemi, uvolněním volných kyslíkových radikálů, cytolytických proteáz a prozánětlivých cytokinů. Zánětlivé cytokiny mají proapoptotické účinky a apoptóza je důležitou složkou sekundárního mozkového postižení při KCP. Při léčbě HBO ve studii na krysím modelu KCP bylo prokázáno snížení produkce metaloproteináz (MMP) a exprese MMP-9. Došlo k redukci zánětlivé reakce, poklesu počtu apoptotických buněk a zmenšení sekundárního postižení mozku [18]. Je také předpoklad, že apoptóza mozkových buněk je redukována při HBOT vyšší expresí Bcl-2 a Bcl-xl. Bcl-2 a Bcl-xl, což jsou anti-apoptotičtí členové Bcl-2 rodiny proteinů regulujících apoptózu [19]. Neuroprotektivní efekt HBOT může být důsledkem zachované mitochondriální integrity a redukcí mitochondriální dráhy apoptózy.
Mezi mechanizmy odpovědné za pozitivní efekt HBOT v léčbě sekundárního postižení mozku patří suprese adheze neutrofilů na endotel, snížení infiltrace leukocyty a omezení aktivity myeloperoxidázy [20]. K neuroprotektivnímu účinku HBOT může přispívat snížené uvolnění glutamátu a redukce volných hydroxylových radikálů [21]. Experimentálně byly prokázány protizánětlivé účinky HBOT v jiných tkáních než v mozku. HBOT snižuje adhezi neutrofilů na endotel postkapilárních venul, redukuje tkáňovou aktivitu myeloperoxidázy u experimentální kolitidy, snižuje regionální produkci oxidu dusného a potlačuje produkci prozánětlivých cytokininů, avšak neovlivňuje fagocytární aktivitu. Patofyziologie úrazu mozku a experimentální studie podporují možnost využití HBOT v postakutní fázi léčby závažného KCP.
Přes nadějné výsledky klinických studií a výzkumů na zvířatech zůstává využití HBO v léčbě závažného KCP kontroverzní. HBOT je využívána u dětských pacientů, a to především při otravách oxidem uhelnatým. Je využívána také v jiných indikacích, např. při akutní traumatické ischemii a drtivých poraněních, při nekrotizující fasciitidě a jiných nekrotizujících infekcích měkkých tkání, pozdním postradiačním poranění kostí i měkkých tkání apod. [22,23]. Komplikace léčby HBO jsou vzácné a reverzibilní. Nejčastějšími vedlejšími účinky HBOT jsou bolesti středního ucha. Nebyl prokázán toxický vliv kyslíku na mozkovou a plicní tkáň. U našich pacientů se v průběhu HBOT nevyskytly příznaky oběhové a plicní nestability, nebyly přítomny křeče ani nebyly zjištěny oční komplikace při kontrolním vyšetření. I přes provedenou paracentézu u dvou pacientů došlo k bolestem středouší a u jednoho z nich byly důvodem ukončení léčby. U dětí léčených HBO bychom doporučili zavedení „ventilačních trubiček“, což by mohlo bolestem uší předejít. U žádného pacienta včetně pacientů léčených hyperbaroxií po šesti měsících od úrazu nebyla potvrzena neuroendokrinní dysfunkce, což odpovídá nižšímu procentu endokrinopatií po KCP u dětí. Na rozdíl od dospělých pacientů, kde prevalence posttraumatické neuroendokrinní dysfunkce je mezi 23–69 %, u dětí se udává kolem 16 % po středně těžkém až těžkém úrazu mozku [24].
Závěr
Výsledek klinické studie by mohl podporovat názor, že HBOT má pozitivní vliv na léčbu závažného KCP u dětských pacientů, zlepšuje GOS a její použití je relativně bezpečné. Ovšem k potvrzení možnosti využití HBOT u KCP u dětských pacientů jsou potřebné další multicentrické klinické i experimentální studie.
MUDr. Vratislav Smolka
Jednotka intenzivní a resuscitační péče
Dětská klinika LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
e-mail: vratislavsmolka@seznam.cz
Přijato k recenzi: 1. 8. 2011
Přijato do tisku: 28. 2. 2012
Zdroje
1. Povlishock JT, Christman CW. The pathobiology of traumatically induced axonal injury in animals and humans: a review of current thoughts. J Neurotrauma 1995; 12(4): 555–564.
2. Raghupathi R, Margulies SS. Traumatic axonal injury after closed head injury in the neonatal pig.
J Neurotrauma 2002; 19(7): 843–853.
3. Huh JW, Widing AG, Raghupathi R. Midline brain injury in the immature rats induces sustained cognitive deficits, bihemispheric axonal injury and neurodegeneration. Exp Neurol 2008; 213(1): 84–92.
4. Matchett GA, Martin RD, Zhang JH. Hyperbaric oxygen therapy and cerebral ischemia: neuroprotective mechanisms. Neurol Res 2009; 31(2):
114–121.
5. Wahlström MR, Olivecrona M, Koskinen LO,
Rydenhag B, Naredi S. Severe traumatic brain injury in pediatric patients: treatment and outcome using an intracranial pressure targeted therapy – the Lund concept. Intensive Care Med 2005; 31(6): 832–839.
6. Grände PO. The “Lund Concept” for the treatment of severe head trauma – physiological principles and clinical application. Intensive Care Med 2006; 32(10): 1475–1484.
7. Rockswold SB, Rockswold GL, Vargo JM, Erickson CA,
Sutton RI, Bergman TA et al. Effects of hyperbaric oxygenation therapy on cerebral metabolism and intracranial pressure in severely brain injury patients.
J Neurosurg 2001; 94(3): 403–411.
8. Rockswold SB, Rockswold GL, Defillo A. Hyperbaric oxygen in traumatic brain injury. Neurol Res 2007; 29(2): 162–172.
9. Tolias CM, Reinert M, Seiler R, Gilman C, Scharf A, Bullock MR. Normobaric hyperoxia – induced improvement in cerebral metabolism and reduction in intracranial pressure in patients with severe head injury: a prospective historical cohort-matched study. J Neurosurg 2004; 101(3): 435–444.
10. Zhou Z, Daugherty WP, Sung D, Levasseur JE, Altememi N, Hamm RJ et al. Protection of mitochondrial function and improvement in cognitive recovery in rats treated with hyperbaric oxygen following lateral fluid percussion injury: J Neurosurg 2007; 106(4): 687–694.
11. Figaji AA, Zwane E, Thompson C, Fieggen AG, Argent AC, Le Roux PD et al. Brain tissue oxygen tension monitoring in pediatric severe traumatic brain injury Part 1: Relationship with outcome. Childs Nerv Syst 2009; 25(10): 1325–1333.
12. Rockswold SB, Rockswold GL, Zaun DA, Zhang X,
Cerra CE, Bergman TA et al. A prospective, randomized clinical trial to compare the effect of hyperbaric to normobaric hyperoxia on cerebral metabolism, intracranial pressure, and oxygen toxicity in severe traumatic brain injury. J Neurosurg 2010; 112(5):
1080–1094.
13. Nakamura T, Kuroda Y, Yamashita S, Kawakita K,
Kawai N, Tamiya T et al. Hyperbaric oxygen therapy for consciousness disturbance following head injury in subacute phase. Acta Neurochir Suppl 2008; 102: 21–24.
14. Lin JW, Tsai JT, Lee LM, Lin CM, Hung CC, Chen WY
et al. Effect of hyperbaric oxygen on patients with traumatic brain injury. Acta Neurochir Suppl 2008; 101: 145–149.
15. Golden ZL, Neubauer R, Golden CJ, Greene L, Marsh J, Mleko A. Improvement in cerebral metabolism in chronic brain injury after hyperbaric oxygen therapy. Int J Neurosci 2002; 112(2): 119–131.
16. Kubes P, Ward P. Leukocyte recruitment and the acute inflammatory response. Brain Pathol 2000; 10(1): 127–135.
17. Danton GH, Dietrich WD. Inflammatory mechanisms after ischemia and stroke. J Neuropathol Exp Neurol 2003; 62(2): 127–136.
18. Vlodavsky E, Palzur E, Soustiel JF. Hyperbaric oxygen therapy reduces neuroinflammation and expression of matrix metalloproteinase-9 in the rat model of traumatic brain injury. Neuropathol Appl Neurobiol 2006; 32(1): 40–50.
19. Vlodavsky E, Palzur E, Feinsod M, Soustiel JF. Evaluation of the apoptosis-related proteins of the BCL-2 family in the traumatic penumbra area of the rat model of cerebral contusion, treated by hyperbaric oxygen therapy: a quantitative immunohistochemical study. Acta Neuropathol (Berl) 2005; 110(2): 120–126.
20. Miljkovic-Lolic M, Silbergleit R, Fiskum G, Rosenthal RE. Neuroprotective effects of hyperbaric oxygen treatment in experimental focal cerebral ischemia are associated with reduced brain leukocyte myeloperoxidase aktivity. Brain Res 2003; 971(1):
90–94.
21. Yang Z, Xie Y, Bosco GM, Chen C, Camporesi EM. Hyperbaric oxygenation alleviates MCAO-induced brain injury and reduces hydroxyl radial formation and glutamate release. Eur J Appl Physiol 2010; 108(3): 513–522.
22. Waisman D, Shupak A, Weisz G, Melamed Y. Hyperbaric oxygen therapy in the pediatric patient: the experience of the Israel Naval Medical Institute. Pediatrics 1998; 102(5): 53–62.
23. Bouachour G, Cronier P, Gouello JP, Toulemonde JL, Talha A, Alquier P. Hyperbaric oxygen therapy in the management of crush injuries: a randomized double-blind placebo controlled clinical trial. J Trauma 1996; 41(2): 333–339.
24. Aleksijević D, Zapletalová J, Smolka V, Klásková E, Wiedermann J, Krahulík D et al. Neuroendokrinní dysfunkce u dětí a dospívajících po úrazu mozku. Cesk Slov Neurol N 2010; 73/106(4): 409–414.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 4
Nejčtenější v tomto čísle
- Mozkové arachnoidální cysty u dospělých – retrospektivní analýza výsledků chirurgické terapie
- Porucha spánku s rytmickými pohyby
- Izolovaná sfenoidální sinusitida – možná příčina bolestí hlavy a závažných komplikací
- Oswestry dotazník, verze 2.1a – výsledky u pacientů s lumbální spinální stenózou, srovnání se starší verzí dotazníku
