Nokardiové abscesy mozku – dvě kazuistiky
Brain Absceses Caused by Nocardia – Two Case Reports
The recorded incidence of human infections caused by Nocardia spp. has increased over the past 20 years, both in response to improved diagnostic techniques and to rising numbers of immunocompromised patients. Nocardial infections primarily affect the skin and lungs, but the bacteria may disseminate to any organ, including the brain. The diagnosis and treatment of patients suffering from a Nocardia infection require an interdisciplinary approach. Here we describe two case reports of patients suffering from brain abscesses caused by Nocardia that required neurosurgical treatment.
Key words:
brain abscess – Nocardia farcinica – treatment – antibiotics – brain tumour
Autoři:
S. Plíšek 1; K. Honegr 1; J. Kapla 1; J. Scharfen Jr 2,6; P. Prášil 1; P. Kosina 1; V. Hobza 3; R. Taláb 4; P. Eliáš 5; P. Ryška 5; M. Morávková 6; L. Plíšková 7; M. Bunček 8; M. Fridrichová 9
Působiště autorů:
Klinika infekčních nemocí LF UK a FN Hradec Králové
1; Národní referenční laboratoř pro patogenní aktinomycety, Oblastní nemocnice Trutnov a. s.
2; Neurochirurgická klinika LF UK a FN Hradec Králové
3; Neurologická klinika LF UK a FN Hradec Králové
4; Radiologická klinika LF UK a FN Hradec Králové
5; Ústav klinické mikrobiologieLF UK a FN Hradec Králové
6; Ústav klinické biochemie a diagnostiky LF UK a FN Hradec Králové
7; Generi Biotech s. r. o., Hradec Králové
8; Národní referenční laboratoř pro antibiotika, Státní zdravotní ústav Praha
9
Vyšlo v časopise:
Cesk Slov Neurol N 2011; 74/107(1): 78-82
Kategorie:
Kazuistika
Souhrn
V posledních 20 letech vzrůstá počet humánních nokardiových infekcí v důsledku zlepšené diagnostiky a zvyšujícího se počtu imunokompromitovaných pacientů. Klinické manifestace mohou mít formu kožní, plicní, při diseminaci může být postižen kterýkoli orgán včetně mozku. Při diagnostice a léčbě pacientů s nokardiovými infekcemi je nezbytná mezioborová spolupráce. Popisujeme dva případy nemocných s mozkovými abscesy nokardiové etiologie s neurochirurgickým zákrokem.
Klíčová slova:
mozkový absces – Nocardia farcinica – léčba – antibiotika – mozkový nádor
Úvod
Nokardie jsou nepohyblivé aerobní aktinomycety, které se barví grampozitivně nebo gramlabilně a jsou úplně nebo částečně acidorezistentní [1]. Vyskytují se ubikviterně v zevním prostředí. Patogenita nokardií je poměrně malá, jejím hlavním faktorem jsou zřejmě mykolové kyseliny v buněčné stěně, které brání fagocytóze a u fagocytovaných mikrobů inhibují fúzi fagozomů s lysozomem. Histologická struktura napadených tkání odpovídá nejčastěji granulomům a abscesům [2]. V posledních 20 letech stoupá výskyt humánních nokardiových infekcí jak vlivem zlepšené diagnostiky, tak v důsledku vzrůstajícího počtu imunokompromitovaných osob, u kterých je diagnostikováno více než 60 %nokardiových infekcí [3]. Za rizikové je považováno především dlouhodobé podávání kortikosteroidů z jakékoli indikace, HIV infekce, alkoholizmus, diabetes mellitus, některá chronická plicní onemocnění a autoimunní choroby. Zvýšené riziko je také u pacientů po orgánových transplantacích nebo s lymforetikulárními neoplazmaty [4]. Míra rizika této oportunní infekce je závislá na závažnosti imunosuprese [5]. Nokardiová infekce se klinicky manifestuje v různých formách. Po banálních poraněních může vzniknout kožní forma s málo bolestivými a pomalu progredujícími zánětlivými ložisky různé velikosti [2]. Nejčastěji dochází (asi ve 40 %) k plicnímu postižení, které může mít charakter pneumonie, abscesu, rozpadové dutiny nebo exsudativní pleuritidy, možný je i miliární rozsev [2,6,7]. Při diseminované nokardióze je ve více než 44 % [4] postižen centrální nervový systém (CNS), možné je také postižení oka, ledvin, sleziny, kloubů a srdce [8 - 10]. Z celkového počtu diagnostikovaných abscesů mozku je nokardiová etiologie prokázána ve 2 % případů [11]. Při postižení CNS jsou klinické projevy vyvolány granulomy nebo abscesy v mozku, méně častá je lokalizace ložisek v míše nebo na mozkových plenách. Onemocnění může progredovat měsíce i roky a vyvolat široké spektrum neurologických projevů. V některých případech se setkáme pouze s poruchou chování či s projevy psychiatrického onemocnění. Primární zdroj nokardiové infekce zůstává většinou neobjasněn.
Kazuistika 1
U 70letého muže s arteriální hypertenzí, hypercholesterolemií a polyartrózou bylo na jaře roku 2008 diagnostikováno chronické intersticiální plicní postižení (nespecifická intersticiální pneumonitida, NSIP), kterému předcházela tříletá anamnéza respiračních obtíží. Postižení plic bylo diagnostikováno na základě spirální počítačové tomografie (HCT) hrudníku, protože pacient bioptickou verifikaci odmítl. V červenci 2008 byla pneumologem zahájena terapie kortikoidy v úvodní dávce 60 mg prednisonu denně. Po měsíci léčby byl nemocný hospitalizován na Plicní klinice FN v Hradci Králové pro zhoršení dechových obtíží (nárůst dušnosti, suchý kašel, subfebrilie). Mikroskopicky a metodou polymerázové řetězové reakce (PCR) byla prokázána v bronchaolveolární laváži DNA Pneumocystis jiroveci (1 300 kopií/ ml), na spirálním CT plic byl popsán nález odpovídající pneumocystové pneumonii. Celkový stav byl zlepšen po 14denní léčbě trimetoprimem a sulfametoxazolem (16 ampulí cotrimoxazolu denně po 480 mg i.v). Do domácího léčení byl propuštěn s kortikoterapií a profylaktickým podáváním cotrimoxazolu (Cotrimoxazol Al forte 960 mg 3× týdně). V říjnu 2008 prodělal klebsielovou pneumonii úspěšně přeléčenou tazocinem. Od listopadu 2008 byly pro progresi plicního postižení podány tři pulzy cyklofosfamidem (11/2008–1/2009). V únoru 2009 byl nemocný přijat na neurologickou kliniku pro dva týdny progredující zhoršování paměti a orientace, agrafii, alexii, bolesti hlavy a zhoršenou obratnost pravé horní končetiny. Na CT mozku byla detekována parietálně vlevo dvě prsténčitá ložiska charakteru metastáz s expanzivním chováním (velikosti 23 mm a 10 mm) bez známého primárního zdroje, diferenciálně diagnosticky bylo uvažováno o mozkových abscesech. Na následně provedené magnetické rezonanci (MR) mozku bylo popsáno bilokulární prsténčitě se opacifikující ložisko vlevo parietookcipitálně s perifokálním vazogenním edémem (obr. 1). Bylo uvažováno spíše o primárním gliovém tumoru III.–IV.gr., metastázy se zdály méně pravděpodobné. V tomto období zánětlivé markery nesvědčily pro bakteriální infekci (CRP 0 mg/ l; leukocyty 10,03 × 109). S již normálním neurologickým nálezem byl pacient přeložen na neurochirurgickou kliniku, kde byla počátkem března 2009 provedena diagnosticky nevýtěžná navigovaná biopsie ložiska v mozku. Následně dochází k rozvoji přechodné pravostranné hemiparézy s fatickou poruchou při dobrém stavu vědomí. Na CT mozku s podáním kontrastní látky (obr. 2 vlevo) byla prokázána plynová inkluze v ložisku parietookcipitálně vlevo. Pro trvající diagnostické rozpaky a aktuálně zhoršený neurologický nález provedl neurochirurg v druhé polovině března 2009 kraniektomii okcipitálně vlevo s parciální resekcí stěny abscesu, evakuací a laváží. Peroperačně byl prokázán absces mozku, na základě kultivačního vyšetření bylo vysloveno podezření na nokardiovou etiologii. Neurochirurg pokračoval vzhledem k dobré předběžné citlivosti určeného kmene Nocardia farcinica v léčbě kombinací antibiotik Amoksiklav a Amikin i.v. v běžném dávkování. Pacient byl bez neurologického deficitu přeložen začátkem dubna 2009 zpět na neurologickou kliniku. Po obdržení definitivních výsledků citlivosti Nokardia farcinica, které prokázaly citlivost na cotrimoxazol, doporučil infektolog změnu antibiotické strategie – výměnu Amoksiklavu za útočnou dávku cotrimoxazolu 12 ampulí denně po 480 mg i.v., tj. 15 mg trimetoprimu na kg/den a 75 mg sulfametazolu na kg/den (předběžné mikrobiologické výsledky citlivost na cotrimoxazol neprokázaly). Pacient byl v celkově dobrém stavu, soběstačný a chodící přeložen koncem dubna na kliniku infekčních nemocí. Další hospitalizace byla komplikována soorem orofaryngu a herpetickou stomatitidou, a proto byly ke cotrimoxazolu přechodně přidány flukonazol a aciclovir. Na kontrolní MR mozku koncem dubna 2009 byla shledána mírná regrese velikosti komplexního ložiska vlevo parietookcipitálně (obr. 2 vpravo). Neurochirurg zvažoval drenáž abscesového ložiska, ale operační výkon byl odložen pro rozvoj respirační insuficience. Bylo indikováno provedení bronchoskopie a při vyšetření obsahu bronchů zjištěna masivní přítomnost DNA Aspergillus fumigatus (kvantitativně 165 000 kopií/ ml) a do léčby byl přidán vorikonazol. Pro progresi respirační insuficience při aspergilové pneumonii byl pacient přeložen na plicní kliniku a tam v polovině května 2009 zemřel. Celková doba podávání vysokých dávek cotrimoxazolu byla 26 dnů, amikacinu 44 dnů.
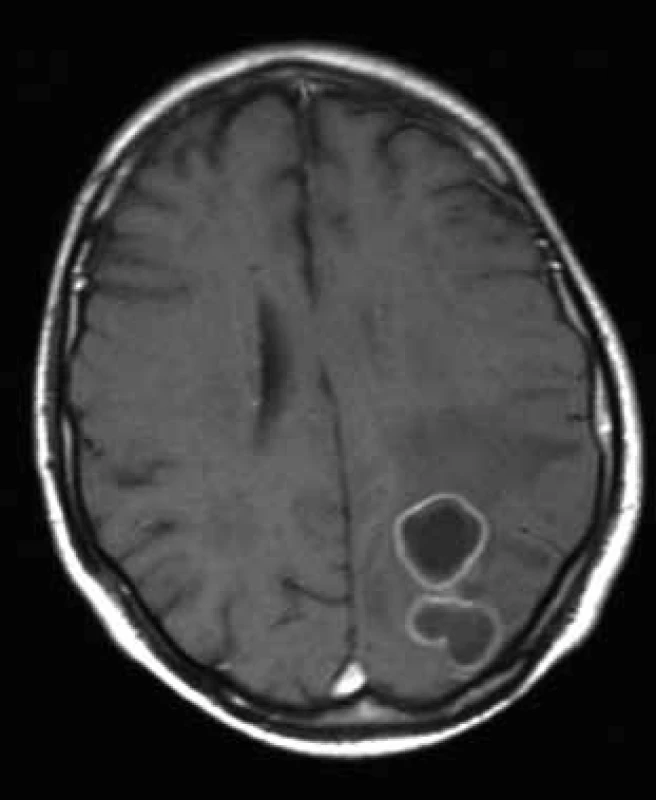
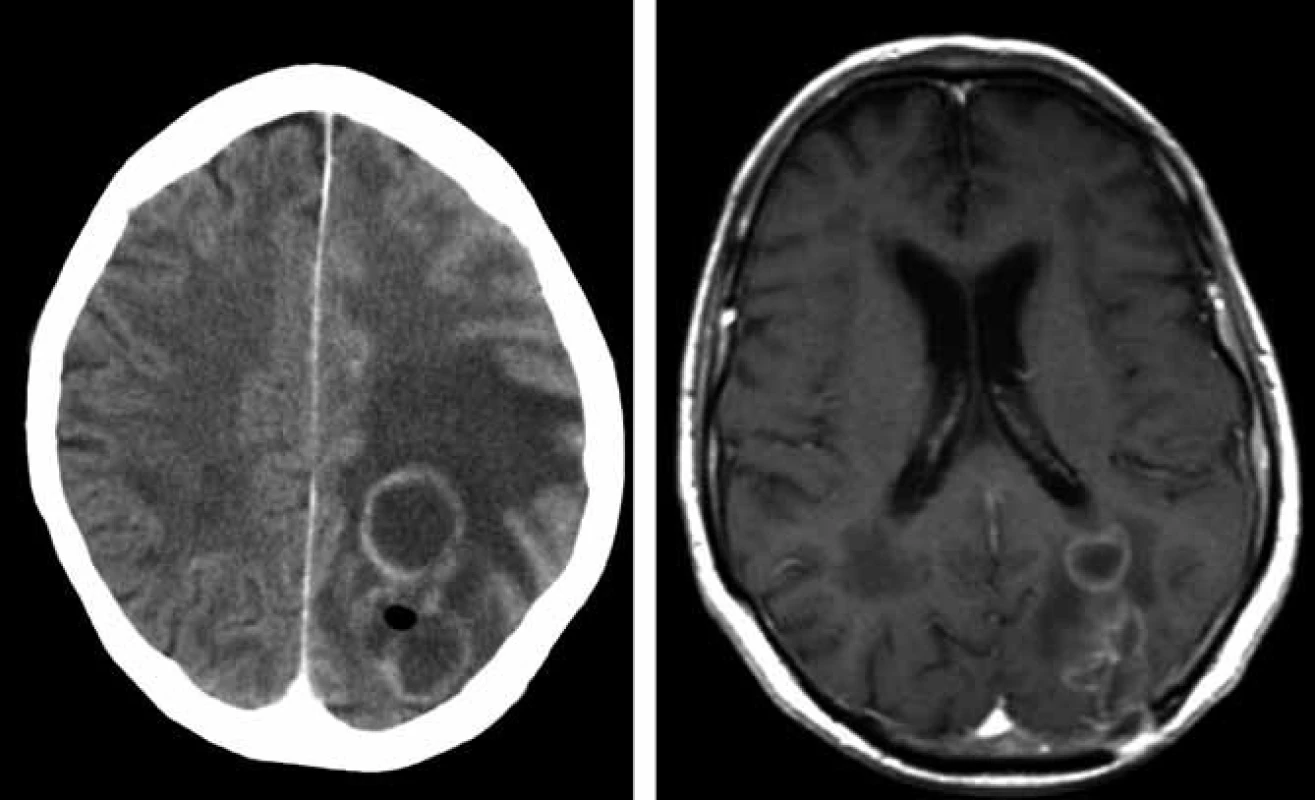
Kazuistika 2
V polovině října 2009 byl 57letý pacient s nevýznamnou osobní anamnézou přijat na Neurologickou kliniku FN v Hradci Králové pro přechodnou poruchu artikulace a hybnosti pravostranných končetin. Tyto obtíže měl údajně v posledním roce 3krát, vždy se spontánní úpravou. V neurologickém nálezu byla zjištěna pravostranná hemiparéza s akcentem na pravou dolní končetinu. Na základě patologického nálezu na CT mozku byla provedena MR (obr. 3), kde byl nález popsán jako nepravidelně prsténčitě se opacifikující ložisko s perifokálním edémem vlevo v precentrální oblasti. V diferenciální diagnostice byl zvažován především gliový tumor (anaplastický astrocytom, glioblastom). Koncem října byl nemocný přeložen na neurochirurgickou kliniku. V den překladu se objevily lumbalgie a teploty. Provedenou MR bederní páteře byl zjištěn kraniokaudálně protáhlý absces v zadním epidurálním prostoru v oblasti Th5–L5. Byla udělána revize peridurálního prostoru z hemilaminektomie L1 vlevo, z hnisu kultivačně prokázán Staphylococcus aureus. Při léčbě oxacilinem došlo k výraznému ústupu zánětlivých markerů, subjektivních obtíží a poklesu teplot. Při kontrolní MR mozku byla konstatována progrese velikosti prsténčitého ložiska vlevo s perifokálním edémem a nově patrné drobné ložisko precentrálně vpravo, a to i při léčbě oxacilinem a následně meronemem (obr. 4 horní řádek), obě antibiotika byla podávána v běžném dávkování. V polovině listopadu byla neurochirurgem provedena evakuace mozkového abscesu z punkce. Mikrobiolog překvapivě neurčil stafylokoka, ale nokardii, později klasifikovanou jako Nocardia farcinica. První testy určování citlivosti na antibiotika ukázaly problémy s citlivostí na cotrimoxazol, a proto byl přechodně podáván imipenem i.v. 4 × 500 mg v kombinaci s amikacinem i.v. 2 × 500 mg. Po definitivním určení citlivosti Nocardia farcinica infektolog indikoval návrat k podávání cotrimoxazolu v útočné dávce (12 ampulí denně po 480 mg i.v., tj. 15 mg trimetoprimu na kg/den a 75 mg sulfametazolu na kg/den), amikacin byl ponechán a pacient byl přeložen na kliniku infekčních nemocí. Celková doba podávání cotrimoxazolu byla sedm týdnů a amikacinu pět týdnů. Další MR mozku prokázalo sice ústup zánětlivého procesu v oblasti páteře, ale pouze nepatrnou regresi abscesového ložiska v mozku. Další operační intervence již nebyla neurochirurgem indikována. Imunologický deficit nebyl u pacienta prokázán, nebylo nalezeno hematologické ani nádorové onemocnění, anti-HIV protilátky byly opakovaně negativní. Od poloviny ledna 2010 byl nemocný převeden z útočné dávky cotrimoxazolu na léčbu cotrimoxazolem per os v dávce 3 × 960 mg. Pacient byl koncem ledna 2010 v celkově dobrém stavu, s normálním neurologickým nálezem a nízkými markery zánětu předán do péče ambulance kliniky infekčních nemocí. MR mozku, provedená v březnu 2010, prokázala regresi velikosti ložiska vlevo a kompletní vymizení drobného ložiska vpravo (obr. 4 dolní řádek). Uspokojivý klinický stav pacienta nadále přetrvával.
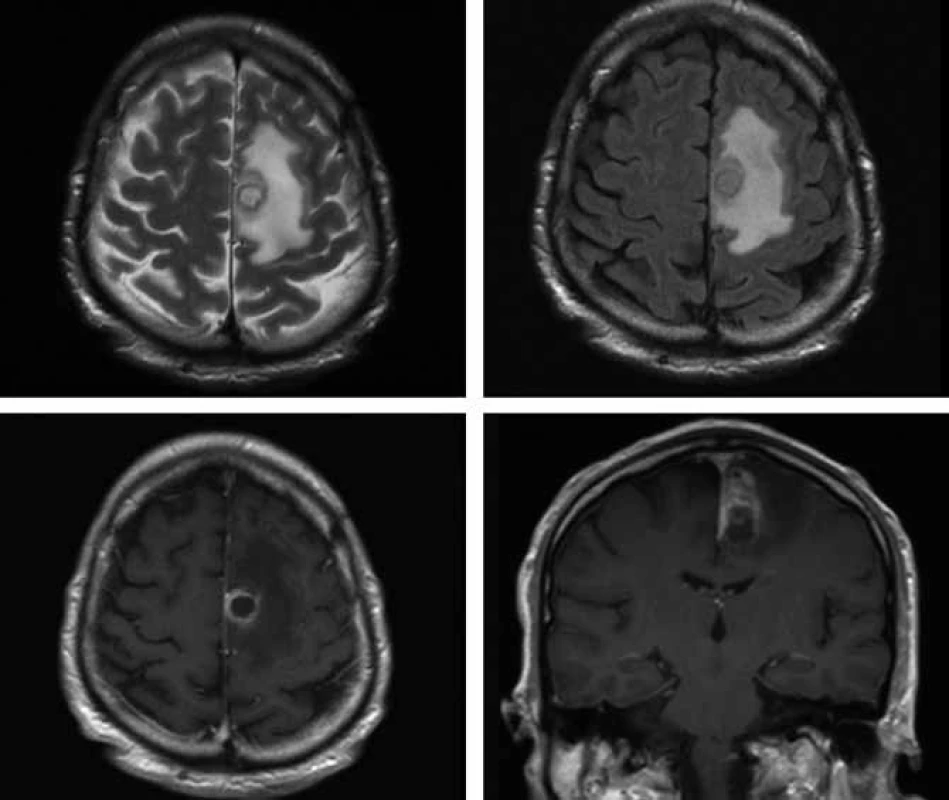
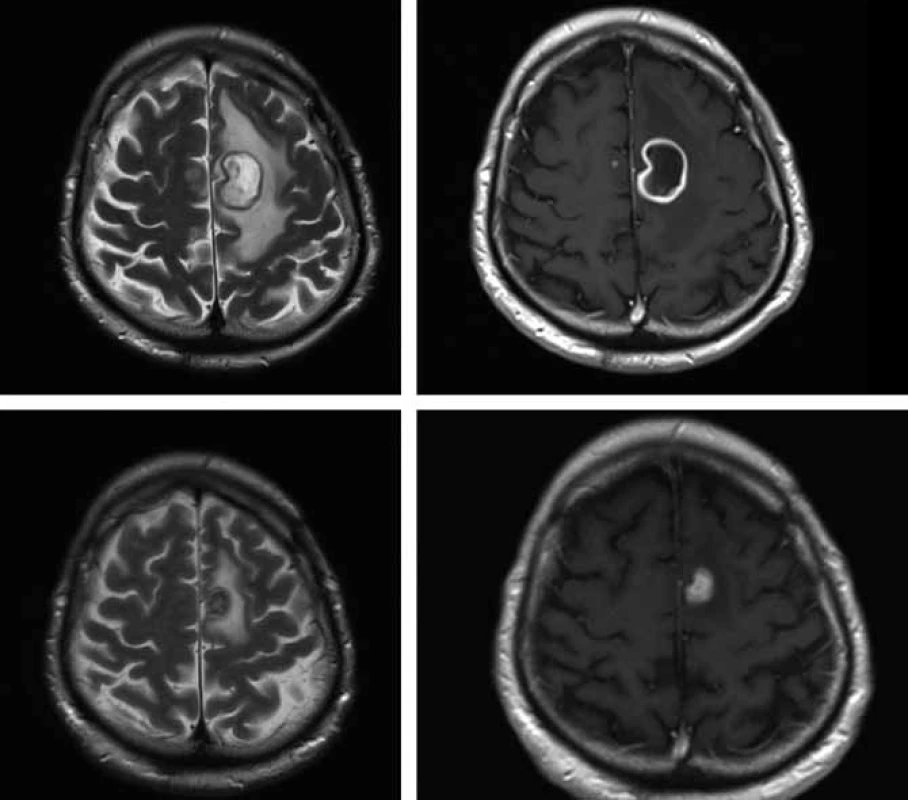
Diskuze
Uvedené kazuistiky zahrnují dva případy nokardiového postižení CNS. U prvého nemocného byly přítomny predispoziční faktory pro vznik onemocnění ve smyslu imunosuprese při léčbě kortikoidy a cyklofosfamidem, u druhého pacienta žádný rizikový faktor nalezen nebyl. Rychlost rozvoje oportunních infekcí u imunosuprimovaného jedince je neobvyklá. Vznik pneumocystové pneumonie po měsíci podávání kortikoidů a rozvoj mozkové formy nokardiózy a plicní aspergilózy v prvních osmi měsících léčby vede k podezření, že na vzniku oportunních infekcí se spolupodílel další faktor, např. maligně probíhající chronické plicní postižení. U druhého, jinak zdravého jedince, je kombinace stafylokokového epidurálního abscesu s nokardiovým abscesem mozku raritní.
Diagnostika nokardiových postižení CNS je obtížná. V počátku diferenciální diagnostiky se ukazuje jako hlavní problém správné zhodnocení výsledků CT a MR mozku. Charakter mozkového postižení kolísá od granulomatózně změněné tkáně po absces, event. tumor. Klinické obtíže mohou trvat měsíce, a přitom nemusí být přítomny laboratorní známky bakteriálního zánětu, což vede často k záměně abscesu za nádor (např. gliom) [7,8]. Také v obou uvedených kazuistikách byl po provedeném vyšetření mozku MR uváděn v diferenciální diagnostice gliový nádor na prvním místě. Ani u jednoho našeho pacienta nebyla provedena lumbální punkce pro absenci meningeálního syndromu a poruchy vědomí. Při očním vyšetření nebylo vysloveno podezření na nokardiovou infekci. Jednoznačné stanovení diagnózy je možné jen průkazem nokardií v materiálu získaném z postižené tkáně. Pokud jsou tyto výkony technicky realizovatelné, je možné získat potřebný vzorek pro vyšetření stereotaktickou punkcí nebo resekcí abscesu. Přímá mikroskopie může vést k podezření na nokardiovou etiologii, kultivační průkaz nokardií je vzácně možný i z hemokultury, ale je zdlouhavý [12]. Pozitivní výsledek umožňuje obvykle jen určit, o který komplex nokardií se jedná. Určení konkrétního druhu má však zásadní význam, protože umožňuje predikovat citlivost k antibiotikům.
V současné době se přesná identifikace nokardií provádí nejčastěji polymerázovou řetězovou reakcí (PCR) s následnou sekvenační analýzou, obvykle 16S rRNA genu [13]. Vzhledem k rozdílné citlivosti jednotlivých typů nokardií i k rozdílné citlivosti jednotlivých izolátů je třeba stanovit citlivost na používaná antibiotika. V uvedených dvou případech byla v izolátech z hnisu identifikována Nocardia farcinica [14], u které byla potvrzena citlivost na cotrimoxazol [15]. Hnis z punktátu byl vyšetřen mikroskopicky po obarvení dle Grama a po obarvení na acidorezistenci podle Kinyouna a kultivován na hotových půdách Columbia krevní agar a Brain Heart Infusion Agar fy bioMérieux. Izoláty byly předběžně identifikovány pomocí jednoduchých morfologických a biochemických metod (mikroskopie, rezistence na lysozym) a podle fenotypu rezistence na antibiotika zjištěné diskovou difuzní metodou pomocí disků fy Biorad na MH agaru firmy bioMérieux [1,6,19]. V DNA z izolátu byl osekvenován gen pro 16SrRNA v rozsahu 1,500 bazí s pomocí univerzálního eubakteriálního primeru a sekvenátoru ABI PRISM® 3100 – Avant genetic Analyzer, Applied Biosystems, USA. Identifikace byla provedena porovnáním získané sekvence s databází GenBank pomocí programu BLAST a polyfázově interpretována v souladu s výsledky fenotypových testů [6]. Citlivost na antibiotika byla vyšetřena standardní mikrodiluční metodou [3].
Testování citlivosti původce je zvláště doporučováno v případech diseminované nokardiové infekce, při selhání dosavadní léčby, při nemožnosti podat sulfonamidy a při izolaci relativně rezistentních typů, např. Nocardia farcinica. Léčba obou pacientů byla zpočátku empirická, později přizpůsobena výsledkům citlivosti. Je nutné připomenout, že optimální antibiotická léčba zatím nebyla v kontrolovaných studiích stanovena. V léčbě se nejdéle a nejčastěji používají sulfonamidy, dále kombinace amikacinu s karbapenemy. V trojkombinaci se používají sulfonamidy, amikacin s karbapenem nebo cefalosporiny třetí generace [6,8]. Nejčastěji je preferována léčba trimetoprim-sulfametoxazolem (TMP-SMX), doporučovaná dávka je 5–10 mg/ kg TMP a 25–50 mg/ kg SMX ve dvou až čtyřech dávkách v průběhu dne, a to za předpokladu normálních renálních funkcí. U jedinců s mozkovým abscesem, závažným průběhem nebo u nemocných s AIDS se úvodní dávka zvyšuje na 15 mg/ kg TMP a 75 mg/ kg SMX po dobu 3–6 týdnů a podává se intravenózně [16,17]. Citlivost Nocardia farcinica na TMP-SMX může být nejistá. V těchto případech do určení citlivosti, stejně jako při nesnášenlivosti nebo alergii na trimetoprim-sulfametoxazol, je nutné volit alternativní léčbu. Nejvíce zkušeností je s kombinací amikacin-imipenem. Současné podávání TMP-SMX a amikacinu má synergický účinek, kombinace TMP-SMX a imipenemu má účinek pouze aditivní. U mozkových forem je místo imipenemu doporučován pro lepší průnik do CNS meropenem. Cefalosporiny třetí generace jsou vhodné jen u citlivých kmenů, zatímco Nocardia farcinica, Nocardia transvalensis a Nocardia ototidiscaviarum jsou často necitlivé. Alternativu k antibiotikům podávaným per os představuje minocyklin 100–200 mg dvakrát denně [16,18] nebo amoxicilin-klavulanát, který je v Evropě někdy doporučován v kombinaci s amikacinem u onemocnění vyvolaných Nocardia farcinica místo imipenemu [19]. Z novějších antibiotik má dobrou citlivost a průnik do CNS linezolid. Dlouhodobá léčba je však limitována toxicitou léku [20]. Z dalších antibiotik, obvykle citlivých při vyšetření in vitro, přichází v úvahu makrolidy a fluorochinolony. Klinické zkušenosti jsou však malé. U našich pacientů byla zvolena nejvyšší doporučovaná dávka TMP-SMX, která byla u druhého z nich pro pochybnosti o citlivosti dočasně nahrazena kombinací imipenemu s amikacinem. Délka podávání antibiotik je závislá na lokalizaci infekce. U imunokompetentních jedinců při postižení CNS je podávání vysokých dávek TMP-SMX doporučováno 3–6 týdnů a dále per os po dobu nejméně 12 měsíců. U imunosuprimovaných pacientů trvá útočná léčba až 2krát déle. Při trvalém podávání kortikoidů nebo cytostatik může být indikováno dlouhodobé podávání nízkých dávek TMP-SMX 2–3krát týdně. U našeho prvního pacienta bylo toto dávkování použito po předchozí pneumocystové pneumonii, nezabránilo však vzniku nokardiového abscesu. Chirurgická léčba nokardiových abscesů mozku je obecně indikována tehdy, pokud při antibiotické léčbě dochází ke zhoršení stavu pacienta nebo nedochází k zmenšení abscesu po měsíci léčby, event. pokud se jedná o „velký“ absces [21]. Dekomprese lézí může být provedena stereotaktickou aspirací, často se však žádoucí efekt dostaví až po kraniotomii. Prognóza nokardiových abscesů mozku není většinou dobrá. Smrtnost je 50% [17], při současné imunosupresi až 55% [19]. Náš první pacient zemřel pro progresi plicního postižení, druhý je klinicky ve výborném stavu, ale dlouhodobá prognóza je nejistá.
V našem sdělení jsme chtěli upozornit na nutnost zahrnout možnost nokardiové etiologie do diferenciální diagnostiky mozkových abscesů, na úskalí exaktního průkazu původce, na neobvyklé dávkování a délku podávání antibiotik a v neposlední řadě na nutnost mezioborové spolupráce.
MUDr.
Stanislav Plíšek, Ph.D.
Klinika
infekčních nemocí
LF
UK a FN Hradec Králové
Sokolská
581
500
05 Hradec Králové
e-mail:
pliseks@lfhk.cuni.cz
Zdroje
1. Scharfen J jr. Nokardióza. 1st ed. Hradec Králové: Nucleus 2008.
2. Holčíková A. Nokardióza. In: Beneš J (ed). Infekční lékařství. 1st ed. Praha: Galén 2009.
3. Scharfen J jr, Plíšek S, Fridrichová M, Urbášková P, Morávková M, Hobza V et al. Nocardia farcinica z abscesu mozku u imunosuprimovaného pacienta. Zprávy EM (SZÚ, Praha) 2009; 18(5): 172–174.
4. Yamada SM, Nakai E, Toyonaga S, Nakabayashi H, Park KC, Shimizu K. A rapidly enlarging nocardial brain abscess mimicking malignant glioma. J Nippon Med Sch 2005; 72(5): 308–311.
5. Mandell D, Bennett JE. Principles and Practice of Infectious Diseases. 7th ed. Philadelphia: Churchill Livingstone 2009.
6. Brown-Elliott BA, Brown JM, Conville PS, Wallace RJ jr. Clinical and laboratory features of the Nocardia spp. based on current molecular taxonomy. Clin Microbiol Rev 2006; 19(2): 259–282.
7. Lerner PI. Nocardiosis. Clin Infect Dis 1996; 22(6): 891–905.
8. Peleg AY, Husain S, Qureshi ZA, Silveira FP, Sarumi M, Shutt KA et al. Risk factors, clinical characteristics, and outcome of Nocardia infection in organ transplant recipients: a matched case-control study. Clin Infect Dis 2007; 44(10): 1307–1314.
9. Beaman BL, Beaman L. Nocardia species: host-parasite relationships. Clin Microbiol Rev 1994; 7(2): 213–264.
10. Tamplin ML, McClung NM. Quantitative studies of the relationship between trehalose lipids and virulence of Nocardia asteroides isolates. In: Ortiz-Ortiz L, Bojalil LF, Yakeloff V (eds). Biological, biochemical and biomedical aspects of actinomycetes, Orlando: Academic Press 1984: 251–258.
11. Javaly K, Horowitz HW, Wormser GP. Nocardiosis in patients with human immunodeficiency virus infection. Report of 2 cases and review of the literature. Medicine (Baltimore) 1992; 71(3): 128–138.
12. Boiron P, Provost F, Chevrier G, Dupont B. Review of nocardial infections in France 1987 to 1990. Eur J Clin Microbiol Infect Dis 1992; 11(8): 709–714.
13. Georghiou PR, Blacklock ZM. Infection with Nocardia species in Queensland: a review of 102 clinical isolates. Med J Aust 1992; 156(10): 692–697.
14. Smego RA jr, Moeller MB, Gallis HA. Trimethoprim-sulfamethoxazole therapy for Nocardia infections. Arch Intern Med 1983; 143(4): 711–718.
15. Beaman BL, Boiron P, Beaman L, Brownell GH, Schaal K, Gombert ME. Nocardia and nocardiosis. J Med Vet Mycol 1992; 30 (Suppl 1): 317–331.
16. Bach MC, Monaco AP, Finland M. Pulmonary nocardiosis. Therapy with minocycline and with erythromycin plus ampicillin. JAMA 1973; 224(10): 1378–1381.
17. Jodlowski TZ, Melnychuk I, Conry J. Linezolid for the treatment of Nocardia spp. infections. Ann Pharmacother 2007; 41(10): 1694–1699.
18. Mamelak AN, Obana WG, Flaherty JF, Rosenblum ML. Nocardial brain abscess: treatment strategies and factors influencing outcome. Neurosurgery 1994; 35(4): 622–631.
19. Scharfen J jr, Scharfen J, Harmsen D, Bunček M. Doporučená metoda k předběžné identifikaci nokardií podle fenotypu rezistence. Zprávy CEM (SZÚ, Praha) 2007; 16(3): 131–136.
20. Viechová J, Beneš J, Kabelková M, Gabrielová A. Nokardióza. Prakt Lék 2003; 83(7): 382–385.
21. Nyč O, Lochmann O, Lomíček M, Merhaut T. Izolace Nocardia asteroides z hemokultury. Cs Epidem 1992; 41(5): 281–284.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie
2011 Číslo 1
Nejčtenější v tomto čísle
- Monitoring pacientů s těžkým poraněním mozku
- Lacosamid (Vimpat®) – nový lék pro přídatnou léčbu pacientů s fokální epilepsií
- Účinnost piracetamu, vinpocetinu a Ginkgo biloba na poruchy učení a paměti vyvolané antipsychotiky.
- Nadužívání léků pacienty s chronickou denní bolestí hlavy v České republice
