Ovlivnění plazmatické hladiny homocysteinu u pacientů s Parkinsonovou chorobou terapií L-DOPA a entacaponem
The Impact of L-DOPA and Entacapon Therapy on Plasma Level of Homocysteine in Parkinson’s Disease Patients
Introduction:
Homocysteine (HCY) is a risk factor for vascular diseases, cognitive impairment and dementia. Peripheral metabolism of L-DOPA via enzyme catechol-O-methyltransferase (COMT) is one of the possible sources of HCY. Some retrospective studies showed increased plasma HCY concentrations in patients suffering from Parkinson´s disease (PD) and long-term treated with L-DOPA. The aim of the study was to assess plasma HCY levels in L-DOPA treated PD patients and its influence by adding the inhibitor COMT (entacpone).
Methods:
Patients were divided into 3 groups: 1 – patients long-term treated with L-DOPA with added entacapone (30 patients, aged 50-82 years, mean 68,5 ± 8,5); 2 – L-DOPA naive patients, in which was start combined treatment with L-DOPA and entacapone (10 patients, aged 56-74 years, mean 67,7 ± 6,6); 3 – control group of subjects did not suffering of any neurodegenerative disease and were not treated with L-DOPA and entacapone (21 patients, aged 38-78 years, mean 51,7 ± 11,1).
Results:
In Group 1 was mean plasma HCY concentration 17,6 ± 6,6 (9,2-44,4) µmol/l and 8 weeks after adding entacapone 16,4 ± 5,5 (7,4-31,1) µmol/l. In Group 2 was found mean plasma HCY level 14,6 ± 4,7 (8,9-22,1) µmol/l and 8 weeks after combined therapy of L-DOPA and entacapone 15,1 ± 7,3 (8,1-31,1) µmol/l. In control group was found mean plasma HCY level 9,7 ± 2,8 (6,6-16,5) µmol/l.
Discussion:
Results of this study confirm, that patients long-term treated with L-DOPA have increased plasma HCY concentrations. However, do not confirm hypothesis, that combined treatment with L-DOPA and entacapone significantly decrease HCY plasma levels.
Key words:
homocysteine, Parkinson´s disease, entacapone, L-DOPA
Autoři:
M. Nevrlý 1; P. Kaňovský 1; H. Vranová 1; I. Nestrašil 1; K. Langová 2
Působiště autorů:
Neurologická klinika LF UP, FN Olomouc, 2Ústav lékařské biofyziky, UP Olomouc
1
Vyšlo v časopise:
Cesk Slov Neurol N 2008; 71/104(1): 55-60
Kategorie:
Původní práce
Souhrn
Úvod:
Homocystein (HCY) je rizikový faktor vaskulárních onemocnění, kognitivních poruch a demence. Jednou z metabolických cest vzniku HCY v organizmu je periferní metabolizmus L-DOPA přes enzym katechol-O-metyltransferázu (COMT). Některé retrospektivní studie potvrdily zvýšenou hladinu HCY v plazmě u pacientů s Parkinsonovou chorobou dlouhodobě léčených preparáty s L-DOPA. Cílem studie bylo posoudit souvislost mezi pravidelnou terapií L-DOPA a hladinou HCY v plazmě a její ovlivnění současným podáváním inhibitoru COMT (entacapone).
Metodika:
Pacienty jsme rozdělili do 3 skupin: 1. pacienti dlouhodobě v terapii L-DOPA, kterým byl přidán entacapone (30 pacientů ve věku 50-82 let, průměr 68,5 ± 8,5); 2. pacienti L-DOPA naivní, u nichž byla zahájena terapie L-DOPA v kombinaci s entacapone (10 pacientů ve věku 56-74 let, průměr 67,7 ± 6,6); 3. kontrolní skupina pacientů, kteří netrpí neurodegenerativním onemocněním a není jim podávána terapie L-DOPA ani entacapone (21 pacientů ve věku 38-78 let, průměr 51,7 ± 11,1).
Výsledky:
V 1.skupině byla průměrná hladina HCY v plazmě 17,6 ± 6,6 (9,2-44,4) µmol/l a 8 týdnů po přidání entacapone 16,4 ± 5,5 (7,4-31,1) µmol/l. Ve 2.skupině byla zjištěna hladina HCY 14,6 ± 4,7 (8,9-22,1) µmol/l a 8.týden současné terapie L-DOPA a entacapone 15,1 ± 7,3 (8,1-31,1) µmol/l. U 3. kontrolní byla průměrná hladina HCY v plazmě 9.7 ± 2,8 (6,6-16,5) µmol/l.
Diskuse:
Výsledky studie potvrzují, že pacienti dlouhodobě léčení preparáty s L-DOPA mají zvýšenou plazmatickou hladinu HCY, ale nepotvrzují hypotézu, že současné podávání terapie entacapone k L-DOPA tuto hladinu významně snižují.
Klíčová slova:
homocystein, Parkinsonova choroba, entacapone, L-DOPA
Úvod
Homocystein (HCY) je rizikový faktor vzniku vaskulárních onemocnění, kognitivních poruch a demence. Komorbidita cerebrovaskulárních choroba a kognitivní dysfunkce mají negativní vliv na prognózu Parkinsonovy nemoci (PN), a proto je nutno rizika jejich vzniku minimalizovat [1-5]. Jednou z metabolických cest vzniku HCY v organizmu je periferní metabolizmus L-DOPA přes enzym katechol-O-metyltransferázu (COMT). Některá sledování potvrdila zvýšenou hladinu HCY v plazmě u pacientů s PN dlouhodobě léčených preparáty s L-DOPA [6-12]. Další práce se zvířecími modely ukazují, že současné podávání inhibitorů COMT může tuto exogenně podávanou L-DOPA hyperhomocysteinémii (HHCY) eliminovat. Byly publikovány i retrospektivní studie, přičemž některé tento fakt potvrdily [11,13] a jiné nikoli [14].
HCY je meziproduktem v metabolizmu esenciální aminokyseliny s obsahem síry – methioninu. Odbourávání HCY je zprostředkováno především dvěma různými ději – zpětnou remetylací na methionin nebo transsulfurací na cystein [15,16]. Při prvním způsobu je klíčovým enzymem celého metabolického pochodu metylentetrahydroxyfolátreduktáza (MTHFR) a jako kofaktor se zde spolupodílí kyselina listová a vitamin B12. Při druhé cestě je kofaktorem vitamin B6. Z uvedeného vyplývá, že zvýšení hladiny HCY může být způsobeno buď zvýšeným příjmem HCY do organizmu, což je případ pacientů s PN léčených L-DOPA, nebo jeho sníženým odbouráváním, které může být způsobeno nedostatečnou aktivitou enzymů remetylace a transsulfurace anebo nedostatkem kofaktorů – folátu a vitaminů B12 a B6. Dle platných norem se za fyziologické hodnoty hladiny HCY považuje jeho plazmatická koncentrace do 15 μmol/l [17], ale některé studie prokázaly, že i nižší hladiny HCY jsou spjaty se zvýšeným rizikem vaskulárního postižení a doporučují za horní hranici normy pokládat hladinu 12 μmol/l [18-23].
Příčiny HHCY mohou být buďto vrozené nebo získané. Nejčastější genetickou abnormitou je právě postižení genu pro již zmíněný enzym MTHFR. V homozygotní formě se tato mutace vyskytuje asi u 10-12 % populace [24]. Ostatní genetické abnormity jsou spíše raritní. Získané příčiny HHCY jsou především karenční deficit kofaktorů (folátu a vitaminu B12), dále hypotyreóza, chronické selhání ledvin nebo dlouhodobý vliv některých léků [16].
Poprvé na konci 60. let McCully publikoval kazuistiku dvou dětí s HHCY a extrémně těžkým aterosklerotickým postižením [25]. Následné velké studie prokázaly příčinnou souvislost mezi HHCY a aterosklerózou cév, arteriální i žilní trombózou [18,20,21,26], ale i demencí a Alzheimerovou chorobou [4,27,28] a postižením periferních nervů [29]. Nicméně přesnou patogenezi těchto dějů dosud neznáme [30].
Poprvé pozorovali v roce 1995 Allain et al vyšší hladinu HCY u pacientů s PN ve srovnání se stejnou populací zdravých osob [31]. V tu dobu nejen on předpokládal přímou souvislost mezi HHCY a PN [32]. Až později studie Müllera et al tuto hypotézu vyvrátila, když při srovnání skupin pacientů s PN byla signifikantně vyšší hladina HCY zjištěna ve skupině dlouhodobě léčených pacientů L-DOPA oproti skupině L-DOPA-naivních pacientů [8]. To bylo následně potvrzeno i v dalších publikacích [6,9-13,33-36]. Cílem našeho sledování bylo zjistit, zda takto zvýšená hladina HCY u pacientů trpících PN může být změněna podáváním inhibitoru COMT (entacapon), a to jak u pacientů dlouhodobě léčených L-DOPA, tak i u pacientů L-DOPA-naivních.
Pacienti a metodika
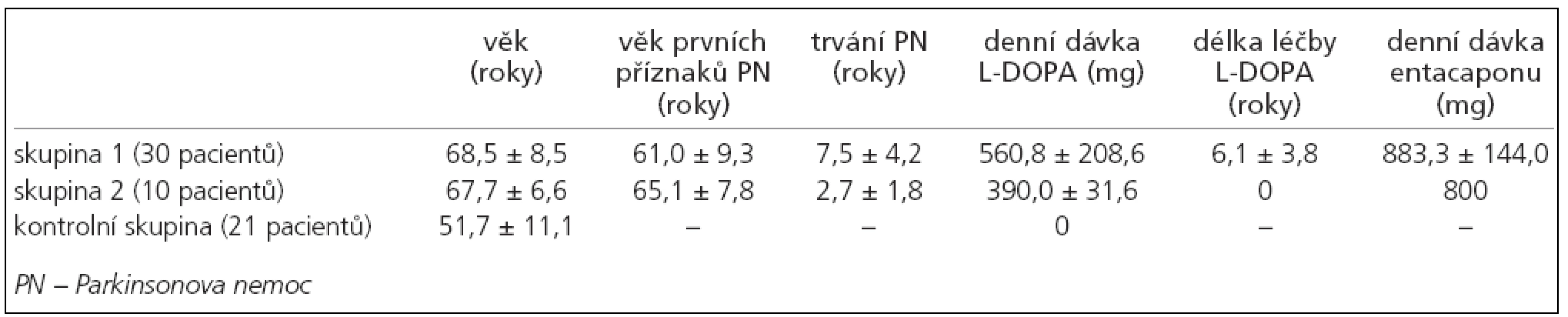
Všichni pacienti zařazení do studie splňují kritéria United Kingdom Parkinson´s Disease Society Brain Bank (UK-PDBB) pro diagnózu idiopatické PN [37] byli rozděleni do dvou skupin. Skupina 1 byla tvořena 30 pacienty (18 muži a 12 ženami) dlouhodobě léčenými L-DOPA (nejméně po dobu jednoho roku a dávkou alespoň 400mg/den), průměrný věk byl 68,5 roku (SD ± 8,5), průměrný věk výskytu prvních příznaků onemocnění byl 61, 0 roku (SD ± 9,3), průměrná doba trvání onemocnění byla 7,5 roku (SD ± 4,2), průměrná denní dávka L-DOPA byla 560,8 mg (SD ± 208,6), průměrná doba trvání léčby L-DOPA byla 6,1 roku (SD ± 3,8) a průměrná denní dávka entacapone byla 883,3 mg (SD ± 144,0). U všech pacientů byl na začátku sledování k L-DOPA přidáván entacapone, a to tak, že ke každé jednotlivé dávce L-DOPA byla přidána dávka 200 mg entacapone. Skupina 2 byla tvořena 10 pacienty (5 muži a 5 ženami), L-DOPA-naivními. Průměrný věk byl 67,7 roku (SD ± 6,6), průměrný věk výskytu prvních příznaků PN byl 65,1 roku (SD ± 7,8), průměrná doba trvání nemoci byla 2,7 roku (SD ± 1,8). Tito pacienti nebyli dosud léčeni dopaminergní terapií, 2 pacienti užívali biperiden v celkové denní dávce 4 mg, 3 pacienti užívali amantadin v denní dávce 300 mg a 2 pacienti užívali selegilin v denní dávce 5 mg. U všech pacientů byla na začátku sledování zahájena terapie pomocí L-DOPA s entacapone, přičemž L-DOPA byla titrována do celkové denní dávky dostatečné k efektivnímu ovlivnění parkinsonské symptomatologie. Nakonec byla průměrná denní dávka L-DOPA 390,0 mg (SD ± 31,6). Všichni pacienti ve skupině 2 užívali stejnou celkovou denní dávku entacapone ve výši 800 mg.
Kontrolní skupina (skupina 3) byla tvořena 21 subjekty (12 muži a 9 ženami), průměrný věk byl 51,7 roku (SD ± 11,1). Žádný ze subjektů netrpěl PN ani jiným neurodegenerativním onemocněním, žádný ze subjektů také neužíval preparáty s L-DOPA nebo entacapone (tab. 1).
Všichni pacienti byli podrobeni na začátku studie laboratornímu vyšetření plazmatické hladiny HCY, hladiny vitaminu B12 a kyseliny listové. Jako referenční hranice normy hladiny vitaminu B12 v séru jsme použili normy naší laboratoře 193-982 ng/l a hranice normy pro hladinu folátu v séru 3–17,5 µg/l. Odběr krve k vyšetření hladiny HCY v plazmě byl u všech pacientů proveden ráno nalačno v polosedě za použití antikoagulancií (EDTA), zkumavka byla ihned uložena do chladné lázně (4 °C) a zpracován centrifugací nejpozději do 4 hodin po provedení odběru [38]. U všech pacientů bylo provedeno zhodnocení pomocí Unifikované hodnotící škály Parkinsonovy choroby (UPDRS). Tato vyšetření byla dále u prvních dvou skupin pacientů prováděna v 1., 4. a 8.týdnu sledování (po přidání entacapone k L-DOPA, resp. po zahájení terapie L-DOPA a entacapone). U všech pacientů bylo dále provedeno genetické vyšetření pro polymorfizmus MTHFR 677C→T, což je nejběžnější determinantou spojenou se zvýšením plazmatické koncentrace Hcy.
Po celou dobu sledování nebyly pacientům podávány preparáty s vitaminy skupiny B ani kyselina listová, které by rovněž mohly vést k ovlivnění hladiny HCY.
Údaje získané během sledování byly zanášeny do elektronické databáze a nakonec statisticky zpracovány za pomoci systému StatSoft. Ke statistickému zhodnocení byly použity ANOVA spolu s Kruskal-Wallisovou analýzou, lineární regresní analýza a dvouvýběrový t-test.
Výsledky
Výsledky sledování jsou obsaženy v tab. 2 a v grafech 1-4. U žádného pacienta nebyl zjištěn deficit vitaminu B12 ani folátu v séru a stejně tak u žádného pacienta v našem sledování nebyla zjištěna abnormita genu pro enzym MTHFR (tedy ostatní vlivy kromě inhibice COMT, které by mohly po dobu sledování u pacientů ovlivnit plazmatickou hladinu HCY, byly eliminovány). Testy mnohonásobného porovnání byla při vstupním (baseline) vyšetření prokázána signifikantně vyšší hladina HCY u 1. skupiny pacientů dlouhodobě léčených L-DOPA při srovnání s kontrolní skupinou (p<0,0001). Signifikantně vyšší množství HCY v plazmě bylo patrno i při srovnání 2. pacientské skupiny s kontrolní skupinou (p=0,026) (graf 1). Prakticky stejné rozdíly byly zjištěny i po 4 a 8 týdnech terapie za použití L-DOPA a entacaponu (graf 2). Po 8 týdnech po zahájení léčby za použití L-DOPA a entacapone při použití linearní regresní analýzy nebyla zjištěna žádná statisticky signifikantní změna v hodnotách plazmatických hladin HCY ani u jedné ze dvou skupin pacientů s PN (graf 3 a 4). Nebyla rovněž nalezena žádná korelace mezi hodnotami UPDRS a plazmatickou hladinou HCY.

Při vzájemném statistickém porovnání všech skupin nebyly zjištěny statisticky signifikantní rozdíly ve věkovém složení skupin 1 a 2. Kontrolní skupina ale byla ve srovnání s oběma pacientskými skupinami signifikantně mladší. Při dalším porovnání skupin 1 a 2 byl zjištěn statisticky signifikantní rozdíl v délce trvání onemocnění, který je ale logicky dán již primárním rozdělením a definicí obou skupin.
Diskuse
Je známo, že HHCY způsobuje urychlení procesu aterosklerotického postižení cév, dále neurodegeneraci a demenci. Je rovněž známo, že cerebrovaskulární onemocnění a kognitivní deficit mají nepříznivý vliv na prognózu u pacientů s PN. Nicméně zatím nejsou důkazy zvýšené incidence vaskulární komorbidity u pacientů s PN [1]. Stejně tak je jednoznačné, že L-DOPA je revolučním lékem v terapii PN a její zavedení výrazně zlepšilo kvalitu a délku života pacientů s PN. Podobně jednoznačně je známo, že léčba entacapone významně zlepšuje klinický stav pacientů s prakticky minimálním rizikem nežádoucích účinků. Recentní práce rovněž diskutují možnost, že léčba entacapone snižuje hladinu HCY v plazmě [11,13,14].
Některé dřívější práce potvrdily u pacientů v dlouhodobé terapii L-DOPA zvýšenou hladinu HCY v plazmě [6-12]. Hypotéza o jejím opětovném snížení po přidání inhibitoru COMT byla v některých sledováních potvrzena [11,13], v jiných ale nikoli [14]. Výsledky našeho prospektivního sledování, podle kterých byly u všech probandů vyloučeny nejčastější genetické i nutriční abnormity vedoucí ke zkreslení výsledku, však výše zmíněné hypotézy o možném snížení L-DOPA indukované HHCY pomocí podávání entacapone nepotvrzují. Jakkoliv je entacapone velmi efektivní a bezpečný lék středně pokročilého stadia Parkinsonovy nemoci, jeho další působení (tj. kromě inhibice COMT) je přinejmenším sporné.
Nicméně výsledky plazmatických hladin HCY u 2. skupiny (pacienti L-DOPA naivní) ukazují, že při současném podávání L-DOPA s entacapone nedochází ani ke zvýšení plazmatické koncentrace HCY ani po 8 týdnech terapie. Ačkoli vezmeme v potaz, že v této skupině je pouze 10 pacientů a není ke srovnání skupina L-DOPA naivních pacientů léčených pouze L-DOPA bez entacapone, tak tento fakt nás nutí uvažovat o možné protekci kombinované terapie L-DOPA s entacapone již v počátku onemocnění před HHCY, a tím snížení rizik vzniku cerebrovaskulárního postižení a kognitivního deficitu.
Z výše uvedeného nicméně vyplývá, že monitoring plazmatické koncentrace HCY je velmi vhodný při komplexní péči o pacienta s PN. Terapeutické ovlivnění HHCY, dokonce i indukované podáváním L-DOPA, je prokazatelně možné především suplementací vitaminu B12 a kyseliny listové [39]. Podávání inhibitorů COMT je jednoznačně opodstatněné vzhledem k jejich nespornému efektu na pozdní komplikace dlouhodobé terapie L-DOPA [40]. Ovšem přímé ovlivnění hladiny HCY v plazmě podáváním inhibitoru COMT k L-DOPA nelze patrně předpovídat ani všeobecně očekávat.
MUDr. Martin Nevrlý
Neurologická klinika FN a UP
I.P. Pavlova 6
77520 Olomouc
E-mail: nevrly.martin@post.cz
Přijato k recenzi: 20. 4. 2007
Přijato do tisku: 5. 10. 2007
Zdroje
1. Jellinger KA. Prevalence of cerebrovascular lesions in Parkinson's disease. A post mortem study. Acta Neuropathol (Berl) 2003; 105: 415-419.
2. Kubová D, Rektor I. Vaskulární parkinsonský syndrom - historie a současnost. Česk Slov Neurol N 2001; 64/97: 75-81.
3. Levy G, Tang MX, Louis ED, Cote LJ, Alfaro B, Mejia H et al. The association of incident dementia with mortality in PD. Neurology 2002; 59: 1708-1713.
4. Morris MS. Homocysteine and Alzheimer's disease. Lancet Neurol 2003; 2: 425-428.
5. Rektorová I. Účinek donepezilu na demenci u Parkinsonovy nemoci a Alzheimerovy nemoci. Pilotní studie. Česk Slov Neurol N 2004; 67/100: 359-363.
6. Blandini F, Fancellu R, Martignoni E, Mangiagalli A, Pacchetti C, Samuele A et al. Plasma homocysteine and l-dopa metabolism in patients with Parkinson disease. Clin Chem 2001; 47: 1102-1104.
7. Miller JW, Selhub J, Nadeau MR, Thomas CA, Feldman RG, Wolf PA. Effect of L-dopa on plasma homocysteine in PD patients: relationship to B-vitamin status. Neurology 2003; 60: 1125-1129.
8. Müller T, Werne B, Fowler B, Kuhn W. Nigral endothelial dysfunction, homocysteine, and Parkinson's disease. Lancet 1999; 354: 126-127.
9. Ozer F, Meral H, Hanoglu L, Aydemir T, Yilsen M, Cetin S et al. Plasma homocysteine levels in patiens treated with levodopa: motor and cognitive associations. Neurological Research, 2006; 28(8): 853-858.
10. Rogers JD, Sanchez-Saffon A, Frol AB, Diaz-Arrastia R. Elevated plasma homocysteine levels in patients treated with levodopa: association with vascular disease. Arch Neurol 2003; 60: 59-64.
11. Valkovič P, Benetin J, Blažíček P, Valkovičová Ľ, Gmitterová K, Kukumberg P. Reduced plasma homocysteine levels in levodopa/entacapone treated Parkinson patients. Parkinsonism Relat Disord 2005; 11: 253-256.
12. Yasui K, Nakaso K, Kowa H, Takeshima T, Nakashima K. Levodopa-induced hyperhomocysteinaemia in Parkinson's disease. Acta Neurol Scand 2003; 108: 66-67.
13. Zoccolella S, Lamberti P, Armenise E, de Mari M, Lamberti SV, Mastronardi R et al. Plasma homocysteine levels in Parkinson's disease: role of antiparkinsonian medications. Parkinsonism Relat Disord 2005; 11: 131-3.
14. Ostrem JL, Kang GA, Subramanian I, Guarnieri M, Hubble J, Rabinowicz AL, et al. The effect of entacapone on homocysteine levels in Parkinson disease. Neurology 2005; 64(8): 1482.
15. Finkelstein JD. The metabolism of homocysteine: pathways and regulation. Eur J Pediatr 1998; 157 Suppl 2: S40-S44.
16. Selhub J. Homocysteine metabolism. Annu Rev Nutr 1999; 19: 217-46.
17. American Society of Human Genetics/American College of Medical Genetics Test and Transfer Committee Working Group. Measurement and use of total plasma homocysteine. Am J Hum Genet 1998; 63: 1541-1543.
18. Genest JJ, Jr., McNamara JR, Upson B, Salem DN, Ordovas JM, Schaefer EJ et al. Prevalence of familial hyperhomocyst(e)inemia in men with premature coronary artery disease. Arterioscler Thromb 1991; 11: 1129-1136.
19. Haynes WG. Hyperhomocysteinemia, vascular function and atherosclerosis: effects of vitamins. Cardiovasc Drugs Ther 2002; 16: 391-399.
20. Morris MS, Jacques PF, Rosenberg IH, Selhub J, Bowman BA, Gunter EW et al. Serum total homocysteine concentration is related to self-reported heart attack or stroke history among men and women in the NHANES III. J Nutr 2000; 130: 3073-3076.
21. Perry IJ, Refsum H, Morris RW, Ebrahim SB, Ueland PM, Shaper AG. Prospective study of serum total homocysteine concentration and risk of stroke in middle-aged British men. Lancet 1995; 346: 1395-1398.
22. Selhub J, Jacques PF, Bostom AG, D'Agostino RB, Wilson PW, Belanger AJ et al. Association between plasma homocysteine concentrations and extracranial carotid-artery stenosis. N Engl J Med 1995; 332: 286-291.
23. Stanger O, Herrmann W, Pietrzik K, Fowler B, Geisel J, Dierkes J et al. DACH-LIGA homocystein (german, austrian and swiss homocysteine society): consensus paper on the rational clinical use of homocysteine, folic acid and B-vitamins in cardiovascular and thrombotic diseases: guidelines and recommendations. Clin Chem Lab Med 2003; 41: 1392-1403.
24. Mattson MP, Shea TB. Folate and homocysteine metabolism in neural plasticity and neurodegenerative disorders. Trends Neurosci 2003; 26: 137-146.
25. McCully KS. Vascular pathology of homocysteinemia: implications for the pathogenesis of arteriosclerosis. Am J Pathol 1969; 56: 111-128.
26. Welch GN, Loscalzo J. Homocysteine and atherothrombosis. N Engl J Med 1998; 338: 1042-1050.
27. Clarke R, Smith AD, Jobst KA, Refsum H, Sutton L, Ueland PM. Folate, vitamin B12, and serum total homocysteine levels in confirmed Alzheimer disease. Arch Neurol 1998; 55: 1449-1455.
28. Seshadri S, Beiser A, Selhub J, Jacques PF, Rosenberg IH, D'Agostino RB et al. Plasma homocysteine as a risk factor for dementia and Alzheimer's disease. N Engl J Med 2002; 346: 476-483.
29. Muller T, Renger K, Kuhn W: Levodopa-associated increase of homocysteine levels and sural axonal neurodegeneration. Arch Neurol. 2004; 61(5): 633-634.
30. Valkovič P, Blažíček P, Benetin J, Kukumberg P, Homocysteín, levodopa a Parkinsonova choroba. Česk Slov Neurol N 2006; 69/102(3): 183-188.
31. Allain P, Le BA, Cordillet E, Le QL, Bagheri H, Montastruc JL. Sulfate and cysteine levels in the plasma of patients with Parkinson's disease. Neurotoxicology 1995; 16: 527-529.
32. Kuhn W, Roebroek R, Blom H, van Oppenraaij D, Przuntek H, Kretschmer A, et al. Elevated plasma levels of homocysteine in Parkinson's disease. Eur Neurol 1998; 40: 225-227.
33. Miller JW. Homocysteine, folate deficiency, and Parkinson's disease. Nutr Rev 2002; 60: 410-413.
34. Nakaso K, Yasui K, Kowa H, Kusumi M, Ueda K, Yoshimoto Y et al. Hypertrophy of IMC of carotid artery in Parkinson's disease is associated with L-DOPA, homocysteine, and MTHFR genotype. J Neurol Sci 2003; 207: 19-23.
35. O'Suilleabhain PE, Bottiglieri T, Dewey RB, Jr., Sharma S, Diaz-Arrastia R. Modest increase in plasma homocysteine follows levodopa initiation in Parkinson's disease. Mov Disord 2004; 19: 1403-1408.
36. Yasui K, Kowa H, Nakaso K, Takeshima T, Nakashima K. Plasma homocysteine and MTHFR C677T genotype in levodopa-treated patients with PD. Neurology 2000; 55: 437-440.
37. Daniel SE, Lees AJ. Disease Society Brain Bank, London: overview and research.
J Neural Transm Suppl 1993; 39: 165-172.
38. Refsum H, Smith AD, Ueland PM, Nexo E, Clarke R, McPartlin J et al. Facts and recommendations about total homocysteine determinations: an expert opinion. Clin Chem 2004; 50(1): 3-32.
39. Lamberti P, Zoccolella S, Armenise E, Lamberti SV, Fraddosio A, de Mari M et al. Hyperhomocysteinemia in L-dopa treated Parkinson's disease patients: effect of cobalamin and folate administration. Eur J Neurol 2005; 12: 365-368.
40. Bareš M, Kaňovský P, Rektor I. Úloha inhibitorů katechol-O-metyl-transferázy (COMT)
v léčbě pozdních komplikací Parkinsonovy nemoci - účinnost a bezpečnost entakaponu (Comtan®). Česk Slov Neurol N 2002; 65/98: 69-75.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2008 Číslo 1
Nejčtenější v tomto čísle
- Bezpečnosť MRI vyšetrenia u pacientov s kovovými implantátmi a implantovanými prístrojmi
- Difuzní gliomy mozkového kmene u dětí. Noční můra dětského onkologa.
- Myasténia gravis
- Klinické využití protilátek u roztroušené sklerózy