Variace mozkového průtoku v zobrazovacích metodách
Cerebral Blood Flow Variations in Imaging
Cerebral blood flow, blood volume, extraction of oxygen and intensity of metabolism are major factors for the prosperity of nerve functions and of the individual itself. Modern imaging methods provide on them increasingly exact data by means of perfusion CT and MRI, by MR using diffusion weighting, by means of brain cortex activations and comparing these results with histological changes in animal experiments. Of particular importance are measurements of the failing blood flow with ischaemic stroke and its accompanying issues. This text offers knowledge on the achieved results under physiological conditions, during increased or decreased cerebral tissue strains, during aging and finally in a transitory or permanent cerebral blood flow failure in the atherosclerotic vasculature.
Key words:
cerebral blood flow, perfusion CT, perfusion MRI, DWI, ischaemic stroke, cerebrovascular reserve capacity
Autoři:
P. Kalvach; J. Keller
Působiště autorů:
Neurologická klinika 3. LF Univerzity Karlovy a FNKV, Praha
Vyšlo v časopise:
Cesk Slov Neurol N 2007; 70/103(3): 236-247
Kategorie:
Minimonografie
Souhrn
Mozkový krevní průtok, krevní objem, extrakce kyslíku a intenzita metabolizmu jsou významné faktory celkové prosperity nervových funkcí i jedince samotného. Moderní zobrazovací metody o nich přinášejí stále přesnější data cestou perfuzních měření CT i MRI, dále vážením MR difuzí, sledováním aktivací mozkového kortexu a porovnáváním těchto výsledků s histologickými změnami v animálních experimentech. Zejména jsou důležitá měření průtoku selhávajícího při ischemickém iktu a jeho průvodní jevy. Tento text přináší poznatky o dosažených výsledcích v podmínkách fyziologických, při zvýšených a snížených nárocích tkáně, během stárnutí a nakonec při přechodném nebo definitivním selhání průtoku v aterosklerotickém řečišti.
Klíčová slova:
mozkový průtok, perfuzní CT, perfuzní MRI, DWI, ischemický iktus, cerebrovaskulární rezerva
Úvod
Je-li mozková krevní cirkulace určujícím faktorem pro metabolizmus a životaschopnost mozkové tkáně, jsou nepochybně naše znalosti o jejích kvalitách stěžejní. Jde o intenzitu krevního toku – v přívodných tepnách a v oblasti kapilární, o mozkový krevní objem, intenzitu kyslíkové extrakce a o metabolický obrat kyslíku a glukózy alespoň ze základních kategorií. Kromě těchto parametrů v podmínkách bazálních nás zajímá funkční kapacita systému při fyziologických i patologických zátěžích a změny této výkonnosti v průběhu života. Nakonec se pak chceme seznámit s hodnotami oběhu a metabolizmu, které jsou pro funkci a přežití tkáně kritické, abychom mohli zhodnotit naděje a efekty svých léčebných zásahů.
Výsledky, které nám rozvíjející se zobrazovací metody za posledních 25 let přinesly, jsou ve své impozantní důvtipnosti zdrojem obrovského objemu informací; jejich znalost je pro expertní ošetření mozkových iktů stále závaznější.
Pokročilé zobrazovací metody spočívají na aplikaci, detekci a počítačové analýze ultrazvuku, rentgenového záření, radioaktivity izotopů aplikovaných do oběhu, eventuálně vstupujících do metabolizmu, a na vysokofrekvenčních manipulacích rezonujících magnetických polí. Podle své provozní a finanční náročnosti se v různé míře přenášejí až do rutinní praxe při ošetření mozkových cirkulačních poruch, u nás s asi 10letým zpožděním za nejvyspělejšími neuroradiologickými pracovišti. Rozsah článku nám dovoluje pouze informativní přehled.
1. Základní parametry mozkové cirkulace
Mozkový krevní příkon se realizuje dodávkou zhruba 40 % potřebné krve každou a. carotis interna (ICA) a 10 % každou a. vertebralis (VA). Systolické a konečné diastolické rychlosti se pohybují ve středním věku v ICA kolem 65/25 cm/s a podobně ve VA kolem 65/20 cm/s; během dospělého života prodělávají pokles v ICA v rozsahu 1/3 a ve VA jen asi v rozsahu 1/6. Ve větvích Willisova okruhu se rychlost krevního toku kupodivu zvyšuje - v a. cerebri media (MCA) na hodnoty kolem 100/45 cm/s, méně pak v a. cerebri anterior a vůbec ne v a. cerebri posterior [1]. Řečiště ICA si proti společné karotidě i zevní karotidě udržuje díky své nízkoodporové povaze preferenční zásobení a podobné preference zažívá i řečiště MCA proti své mateřské ICA a jiným větvím Willisova okruhu.
Rychlosti toku krve nejen v ICA, ale také v MCA převyšují rychlosti v a. carotis communis (CCA), což se zejména projeví po 50. roce života [2,3]. Tento úkaz je zcela neobvyklý, protože v celém somatickém řečišti filiální cévy vždy s postupem k periférii své rychlosti snižují.
Zatímco úsek mezi velkými tepnami Willisova okruhu, dostupnými ultrasonograficky, a kapilární periferií se studuje obtížně, nutriční průtok kapilární je intenzivně prověřován mnoha přístupy.
Mozkový krevní průtok (CBF – cerebral blood flow)
Před érou CT se poznatky o mozkovém kapilárním průtoku čerpaly z měření diluce oxidu dusnatého, radioaktivního kryptonu a xenonu a jako smíšená hodnota šedé a bílé hmoty se uznával průtok 50–60 ml/100 g tkáně/min u dospělého člověka. Bylo známo, že u dítěte jsou hodnoty podstatně vyšší a že poměr průtokové mohutnosti mezi šedou a bílou hmotou je asi 4:1. S nástupem SPECT a CT chronogramů se hodnoty zpřesňovaly a měření v axiálních vrstvách v 90. letech při perfuzním CT a MR vážení dovolily lepší rozlišení hodnot šedé a bílé hmoty.
Nejmoderněji se dnešní MR měření provádí T2 vážením dynamické susceptibility po i.v. podání kontrastu. Podstatou metody je opět diluce kontrastu ve tkáni, tentokrát srovnáním signálu a. carotis interna a signálu šedé nebo bílé hmoty. Početné výsledky různých neuroradiologických a výzkumných pracovišť se však mohou rozcházet až o dvojnásobek. Průtok (regional Cerebral Blood Flow – rCBF) v šedé hmotě se tak může pohybovat např. mezi rCBF 37 (4) a 94 ml/100 g/min [5], v bílé hmotě pak mezi rCBF 22 [4] a 19 ml/100 g/min [5]. Vidíme, že průtok méně náročnou bílou hmotou je již fyziologicky na úrovni, kterou jsme byli zvyklí považovat za hranici nastupující penumbry. Mozkový krevní objem (Cerebral Blood Volume – CBV) činí dle stejných dvou prací 4,1 ml/100 g v šedé hmotě a 2,9 ml/100 g v bílé hmotě [4], respektive CBV 4,6 ml/100 g a CBV 1,3 ml/100 g pro šedou a bílou hmotu [5]. Jiní autoři naměřili CBV pro šedou hmotu 8,4 ml/100 g tkáně, pro bílou CBV 4,2 ml/100 g a konstatovali pokles během života o 6 % za10 let v šedé a 3 % v bílé hmotě [6].
Pro dokonalou orientaci v těchto hodnotách je ovšem zapotřebí mít na zřeteli, že nutriční průtok, procházející zaručeně kapilárami, může mít jinou mohutnost než celkový mikrovaskulární průtok, jehož část kapiláry obchází. S tím se pojí fakt, že kapilární hematokrit je nižší než celkový ve velkých cévách. Rozhodující je tedy princip použité metody a měření různými způsoby se vzájemně doplňují.
Dosud uznávanou zásadou je, že krevní objem mozku se za minutu obnoví přibližně 12krát.
Pro oxidační kapacitu řečiště je důležité, aby tranzit krevních elementů byl dostatečně rychlý. Proto také hodnota středního tranzitního času (Mean Transit Time – MTT), tedy od vstupu krvinky do lební dutiny do jejího výstupu v jugulárním bulbu, je nejsledovanější proměnnou v perfuzních studiích metodou CT i MRI. Činí přibližně v šedé hmotě 3,0 +/- 0,6 sekund a v bílé hmotě 4,3 +/- 0,7 sekund [5].
Mozkový krevní průtok v miniaturních okrscích spontánně kolísá podle změn tonu hladké svaloviny v prekapilárách. V klidových podmínkách byly prokázány cyklické aktivace a inaktivace tohoto tonu, jimiž se přizpůsobuje intenzita toku aktuální acidóze a metabolické intenzitě daného mikroprostředí [7].
Za klidových podmínek se extrahuje z protékajícího oxyhemoglobinu 40 % pro metabolické potřeby tkáně. Při zvýšení činnosti tkáně se tato extrakční frakce zvyšuje, podobně jako při snižování průtoku. Výrazná průtoková nouze, s tranzitními časy kolem 6 sekund zvyšuje extrakci kyslíku nad 80 % a při zástavě krevního proudu dosáhne extrakce posléze 100 %. Časy kolem 6 sekund jsou hraniční pro ztrátu vědomí a časy kolem 8 sekund znamenají smrt tkáně.
Požadavky na kyslíkovou dodávku diktuje obrat ATP, který v aktivizované tkáni např. při spotřebě 20 µmol/g tkáně/min vyvolá zvýšení spotřeby glukózy z 0,2 na 0,6 µmol/g tkáně/min. Tato ideálně ekonomická utilizace glukózy je však možná jen při zvýšeném přísunu kyslíku. Bez něho by tato námahová reakce vyžádala zvýšení spotřeby glukózy až na 10 µmol/g tkáně/min [8]. Limitujícím faktorem není tedy množství glukózy, ale kyslíku.
Aktivační reakce ve funkční magnetické rezonanci
Sledování bezprostředního metabolického nároku mozkové tkáně se stalo v posledních 15 letech předmětem intenzivního výzkumu metodou funkční magnetické rezonance (fMRI).
V r. 1990 popsal Seiji Ogawa s kolegy pokles signálu T2 v závislosti na hladině kyslíku v krvi. Pozorovali, že kortikální cévy se stávaly viditelnějšími při poklesu oxygenace. Pochopili, že se tak děje rozpadem homogenity magnetického pole účinkem vyšší hladiny deoxyhemoglobinu a založili metodu BOLD (Blood Oxygenation Level-Dependent). Ultra-rychlým echoplanárním zobrazováním se podařilo následně změny v oxygenaci kvantifikovat v experimentu se zvířaty, která dýchala směsi s nedostatkem kyslíku [9]. Kwong pozoroval pak změny signálu v důsledku změny kyslíkové saturace i u lidí při zadržení dechu [10]. Ze vzniku fMRI se tedy zrodila příležitost nahlédnout hlouběji do práce mozkové energetické strojovny sledováním aktivačních změn CBF, metabolického obratu kyslíku (CMRO2), extrakční frakce kyslíku (OEF) a CBV, provázených vzestupem oxyhemoglobinu a poklesem deoxyhemoglobinu. V našem časopise publikovali využití metody BOLD pro identifikaci motorických zón při neurochirurgických intervencích Klener et al [11] a Bartoš et al [12].
Při aktivaci kortikálního tkáňového okrsku se zvyšuje hlad neuronů po kyslíku a vyprovokuje zvýšení CBF. Krevní průtok je schopen vzrůst až o 30–50 %, zatímco extrakce kyslíku stoupá pouze o 5 %. Tento nepoměr způsobí přechodné snížení deoxyhemoglobinu v odvodných venulách a perivaskulární neuropil tak zažije v důsledku zvýšení homogenity precese vodíkových iontů prodloužení T2 relaxačního času. Efekt vzestupu diamagnetického oxyhemoglobinu, který je primárním akčním principem, je pro naše měření bezcenný. Pouze reciproční chování paramagnetického deoxyhemoglobinu lze detekovat. Deoxyhemoglobin, jako nositel 4 nepárových elektronů, vyvolává na rozdíl od oxyhemoglobinu mnohem větší účinek na magnetickou susceptibilitu zkrácením relaxačního času T2*. Hemodynamické změny, které jako ekvivalent zvýšené neuronální aktivity měříme, by nemusely být jen dokladem přímé metabolické aktivity, ale provázejí též vzrušení na synapsích. Excitační a inhibiční povaha synapsí by pak mohla vnášet do CBF reakcí ještě další finálně nelineární projevy [13]. Vzestup BOLD signálu následuje asi o 1 s za maximem změn CBF, CMRO2 a OEF [14]. Vzápětí prekapilární vazodilatační reakce zvýší markantně (až o 50 %) CBF a lehce i CBV, čímž saturuje tkáň přílivem krve nad potřeby nové stávající OEF. Relativní obsah deoxyhemoglobinu v odvodných žilách proto, i přes trvající aktivaci klesne a způsobuje tak po celou dobu trvání krátké stimulace zvýšený signál BOLD. Toto zvýšení MR signálu, dosahující v 1,5 T poli řádově 3 %, je na samém začátku uvedeno malým „přešvihnutím“ Hb nepoměru ještě výše (overshoot). Hyperoxická fáze BOLD signálu dosahuje plata za 5-8 s po začátku stimulace [15-17]. V prvních vteřinách po ukončení stimulace klesá signál BOLD k výchozí hladině před aktivací, avšak v prvních okamžicích opět s „přešvihnutím“ této změny, tentokrát pod hladinu (undershoot). Míra vzestupu MR signálu BOLD je závislá na podmínkách experimentu. Aplikace intenzivnějšího magnetického pole dociluje vyššího vzestupu, a to kvadratickým efektem na nárůst T2 relaxační rychlosti. Následně přetrvává ještě vazodilatační hyperemie, která se však v BOLD signálu již nijak neprojevuje (graf 1). V experimentu fMRI se tedy hladina oxyhemoglobinu, původně „spárovaná“ s metabolickým nárokem tkáně (metabolic coupling), přechodně „rozpáruje“, aby se po skončení opět spárovaly. Experimentální protokol fMRI může být pojat jako bloková studie o trvání 20-30 s (zapotřebí 6-9 s k dosažení maxima aktivační reakce a 8-20 s k návratu hladin do výchozího stavu po skončení stimulu), nebo jako studie podnětová (event related) o volitelné sekvenci stimulů.

Aktivační mapy, kterých se využívá k zobrazení okrsků právě stimulované mozkové tkáně, představují subtrakci klidových obrazů od aktivovaných (obr. 1).
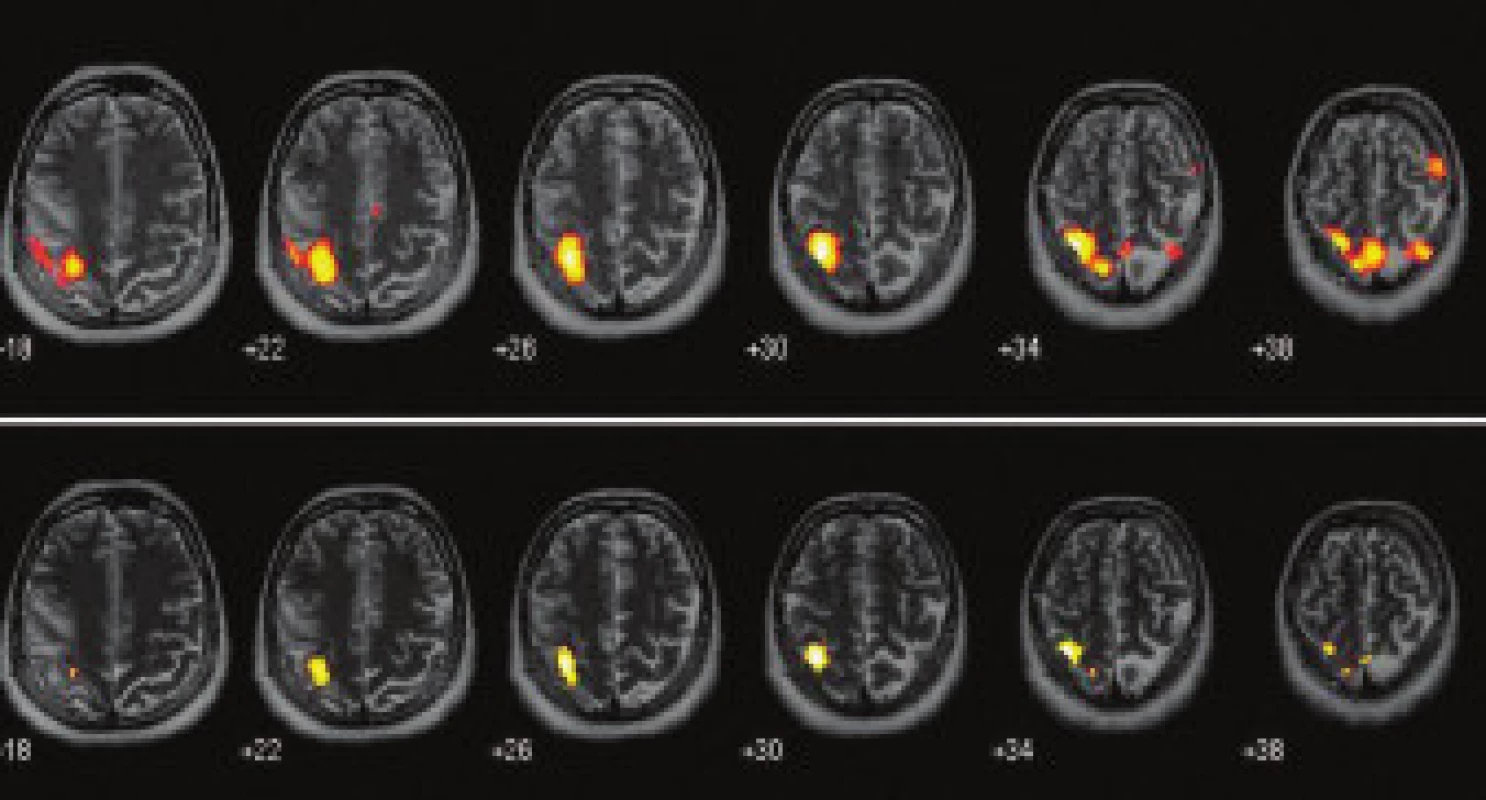
Pro získání důvěryhodných informací o vazoregulačních reakcích na zevní podněty, zejména kognitivního rázu, záleží na čistotě bazálních podmínek. Habituace, anticipace a efekty strategie mají vliv na mohutnost reakcí, více v blokovém protokolu, podstatně méně v „event-related“ protokolu.
Markerem mozkového průtoku se také mohou stát samotná vodíková jádra v perfundující krevní mase. Vtipná metoda Arterial Spin Labeling (ASL) je založena na magnetickém označení krve mimo zobrazovanou oblast (za průtoku karotidou na krku) pomocí změny spinu. Precedující jádra, vtékající do zobrazované oblasti, působí v těchto vrstvách měřitelnou změnu signálu. Protože změna je úměrná mohutnosti perfuze (změna průtoku o 1 ml/100 g tkáně/min změní signál o 1 %), je tak možno zcela neinvazivně získat hodnoty CBF [18]. ASL lze využít i při fMRI, přičemž výhodou proti BOLD technice je možnost zobrazení vlastních změn průtoku a to v jeho pomalejších variacích [19]. Vzájemnou kombinací docílil např. Obata rozlišení BOLD a hemodynamických změn v primární a suplementární motorické oblasti.
2. Rozpětí funkční přizpůsobivosti a změny s věkem
Výše uvedené standardní hodnoty podstupují výrazné změny při variacích tlakových a respiračních parametrů krevního oběhu, jakož i s postupujícím věkem.
Bazální hodnoty průtoku jsou nastavené na obvyklé hodnoty pCO2 kolem 40 mm Hg. Kromě toho zohledňují krevní tlak, viskozitu, hematokrit, acidobazickou rovnováhu a tonus vegetativního nervového systému. Snížení pCO2 usilovnou hyperventilací během 2-3 minut na polovinu (ke 20 mm Hg) způsobí tak významnou arteriolární vazokonstrikci, že střední rychlost průtoku v MCA klesne např. o více než 40 %. Po ukončení hyperventilace se systolická i diastolická rychlost vrací současně s normalizací pCO2 k normě během 5 minut [20]. Protože již před 20 lety bylo ověřeno, že průměr bazálních mozkových tepen zůstává i při hypokapnii prakticky nezměněn [21], jde při těchto změnách rychlosti o analogické snížení CBF – tedy zhruba o polovinu.
Zvyšování rychlosti toku a CBF se děje vázodilatací rezistenčních cév. Tato reakce může mít individuálně velmi různou rychlost vývoje. V akutním stavu lze takovouto reakci ilustrovat např. při zablokování toku ICA při karotické endarterektomii. Když se uzavře svorkou při operaci CCA, klesnou v následujících pulzech rychlosti v MCA na polovinu. Protože však v důsledku vazodilatace arteriol klesá následně index rezistence ze 2,5 na 1,8 a otvírá je volným kolaterálám, doplňuje se řečiště MCA z kolaterálních přítoků již v prvních vteřinách a opět zvyšuje svou střední tokovou mohutnost rychlostí 4 cm/sek směrem k normě [22]. Celý komplex mozkových tepen pracuje tedy v systému vzájemného tlakového ovlivnění. Tato přizpůsobivá vzájemnost dovoluje vznik a růst kolaterálního zásobení při překážkách v určitém individuálním řečišti. Výstavba dlouhodobých kolaterálních kompenzací probíhá u většiny osob asymptomaticky.
Pokles tonu rezistenčních tepen lze demonstrovat již pouhým zadržením dechu. Hyperventilací se naopak dociluje zvýšení tonu rezistenčních tepen a při této vazokonstrikci nastávají měřitelná zpomalení krevního toku v MCA. U zdravých lidí našel Ringelstein celkový rozsah rychlostních změn ve větvích Willisova okruhu při vazodilataci proti maximální vazokonstrikci 85 % [23]. V jiných pracích je referována mohutnost akcelerační odpovědi při hyperkapnické (5% CO2) vazodilataci ze středního bazálního stavu o 31 % a naopak retardace toku v MCA při maximální hyperventilaci 28 % [24]. Rozdíly kapacity v těchto odpovědích jsou závislé na věku vyšetřovaných osob. Obr. 2 demonstruje naše měření cerebrovaskulární reakční kapacity při zadržení dechu a při hyperventilaci.
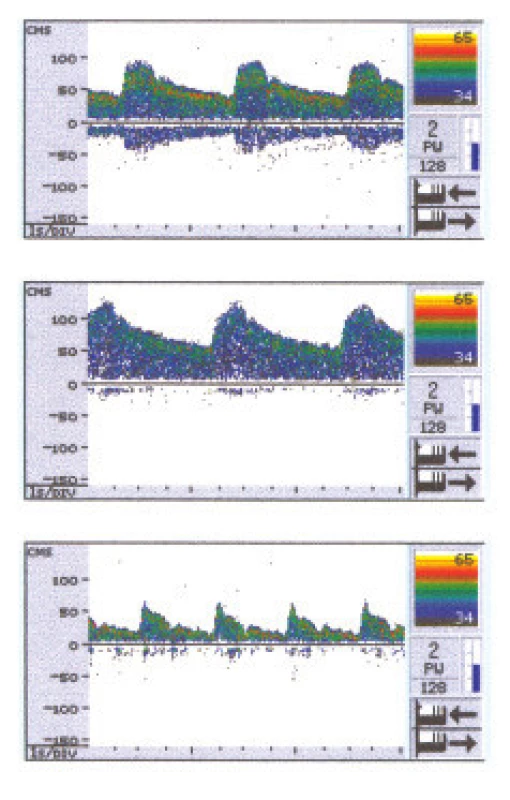
Mohutnost odpovědi na vazodilatační výzvu představuje cerebrovaskulární rezervu. Ta je nejvyšší v dětství, s rozvojem aterosklerózy a stenotických procesů na krčních a mozkových tepnách se vyčerpává. Postupné zhoršování tepenné elasticity se zhoršenou diastolickou kontrakcí, a tím více pak narůstající stenózy, jsou kompenzovány v průběhu života klesajícím tonem rezistenčních tepen v periferii. To vede k vyčerpání cerebrovaskulární rezervy, zejména v hemisféře, živené stenotickou karotidou. Po odstranění překážky karotickou endarterektomií má cerebrovaskulární rezerva opět tendenci se zotavit [3,25].
Cerebrovaskulární rezerva, opakovaně studovaná ultrasonograficky, mohla být prověřena v druhé polovině 90. let také metodami magnetické rezonance. Jde jednak o měření změn oxy/deoxy-hemoglobinu v kapilárách a venulách (tedy principu BOLD), jednak o měření průtoku změnami susceptibility. Vaskulární výzva se provádí buď testem zadrženého dechu, nebo farmakologicky (acetazolamid).
Vliv zadržení dechu na změny deoxyhemoglobinu v šedé a bílé hmotě sledovali na zdravých dobrovolnících kolegové ze Stanfordu. 30 s apnoe v exspiriu vyvolávalo zvýšení MR signálu o 2,1–3,4 % (podobně jako 40 s v inspiriu). Nádech totiž v prvních vteřinách způsobuje vzestup oxyhemoglobinu, který teprve s trváním apnoe vyústí ve vlastní vzestup deoxyhemoglobinu [26].
Medikamentózně lze vyvolat maximální vazodilataci podáním inhibitoru karboanhydrázy, acetazolamidu. Ten snižuje tonus hladké svaloviny arterií a arteriol, a tím snižuje prekapilární rezistenci. Následně se zvyšuje tok kapilárním řečištěm. Měří se tak opět periferní vazodilatační rezerva, která ilustruje míru vyčerpání „mladistvého“ arteriálního tonu v důsledku aterosklerotických změn. Dilatací po acetazolamidu se zvětšuje krevní objem ve tkáni. Když byl na 30 zdravých dobrovolnících od 23 do 82 let proveden tento test i.v. podáním 15 mg/kg, s následným měřením dynamické susceptibility kontrastním MRI za 50-60 min klidového odstupu, došlo ke zvýšení rCBV kolem 20 % v bílé a mezi 30 a 40 % v šedé hmotě. S věkem se tato reakce krevního objemu zvětšovala [27].
K věku vázaný vzestup rCBV odpovědi na acetazolamid je opakem ke studiím, měřícím CBF. Vazodilatační efekt CO2 u opic Maccacus rhesus zvyšuje jak CBF, tak CBV v úzké korelaci, ale vztah není lineární [28]. Nábor nových kapilár vyústí ve zvýšení CBV. Mají-li staří lidé větší kapacitu v náboru kapilár na jednotku objemu, mají na druhé straně v důsledku Poiseuilleova zákona relativně menší vzestup CBF než mladí. Tím lze vysvětlit reciproční odpověď na acetazolamid co se týče CBV a CBF.
Nesmí se zaměňovat vazodilatační kapacita, měřená změnou rCBV, se skutečnou cerebrovaskulární rezervou. Druhá je schopností udržet normální průtok při poklesu systémového tlaku. Navrhovalo se, aby se klidový CBV, nebo poměr CBF/CBV užíval jako index mozkové hemodynamické rezervy pro stanovení rizika iktu, nebo jako indikátor pro chirurgický zákrok u osob s karotickou stenózou/okluzí. To bylo založeno na studiích u pacientů, kteří měli zvýšený CBV, snížený poměr CBF/CBV a zvýšenou extrakční frakci kyslíku v oblasti „misery perfusion“. Takoví pacienti mají sníženou CBF odpověď k vazodilatační výzvě, ale variabilní CBV odpověď.
Tyto nálezy podporují přesvědčení, že architektura kapilárního řečiště zůstává ve stáří zachována vzdor ztrátám neuronální i gliální komponenty.
U cerebrovaskulárních poruch z okluzních lézí lze acetazolamidovým testem rozlišit pomocí MRI zvýšení CBF ve zdravé hemisféře – např. 47 %, od mnohem menšího v regionálně deficitních oblastech v hemisféře postižené [29]. Kombinace PET s pozitronovou vodou (H2O15) a inhalace O15 ověřila, že účinkem acetazolamidu se zvyšuje poměr arteriálního krevního objemu (dilatace rezistenčních arteriol) proti kapilárnímu a že se tak v hemisférách se stenotickým karotickým řečištěm může krevní objem zvýšit (v arteriolách), a přitom krevní nutriční průtok (v kapilárách) zůstává stejný, nebo dokonce klesne [27,28].
3. Selhání mozkové perfuze s následnou deteriorací tkáně
Míra poškození tkáně mozku ischémií má gradient prostorový a gradient časový. V průběhu minut a hodin od nástupu průtokové nouze propadá tkáň nejdříve polostínu, pak reverzibilnímu nebo ireverzibilnímu cytotoxickému edému, lipolýze membrán a zástavě proteosyntézy. Nejprve vždy jádro ischemického okrsku, později i okolí. Pacienta tedy dostáváme k ošetření v různě pokročilých stadiích tohoto procesu v centru a periferii infarktového ložiska. Poznat rozsah a topiku těchto stádií co nejrychleji je cílem metodik perfuzních měření CT a MR a difuzního vážení magnetickou rezonancí.
Definice penumbry od Astrupa, Siesjo a Symona pochází již z r. 1981 [30]. Jde o ischemickou tkáň, v níž je metabolizmus dosud zachován, membránový potenciál nezbytný pro funkci neuronů však je již vyhaslý. Některé práce připouštějí trvání penumbry až do 48 hodin – podle intenzity energetické deplece [31,32]. Podle našeho přesvědčení může být ještě delší.
Pro výběr pacientů, vhodných k urgentní trombolýze, je žádoucí znát rozsah ztraceného infarktového jádra proti kurabilní zóně okolní penumbry. Přestože ve svých schématech rozlišujeme tyto 2 oblasti jakoby každá byla jednotná, ukáže nám detailnější pohled, že jde o gradient průtokového selhání, které má značně odlišné zóny poškození podle právě sledovaného jevu. V oblasti funkčního ticha se skrývají zóny zvýšené acidózy, odlišné od oblastí deplece ATP a ty jsou zase odlišné od oblastí patologických hladin glutamátu, nebo od jinak rozsáhlých areálů prodlouženého tranzitního času či alterovaného tkáňového objemu intravaskulární krve. Společným osudovým viníkem pro tyto změny je intenzita a trvání průtokového selhání. Je proto naším naléhavým cílem rozlišit, které hodnoty průtoku vedou k jednotlivým konkrétním hladinám sledovaných veličin.
Klasické zobrazování počítačovou tomografií a T2 váženými (T2WI) MRI snímky je pro klinická rozhodnutí při příjmu pacienta dnes již nedostatečně instruktivní. Jejich zobrazovací princip dává informaci teprve po dalších hodinách nezbytné maturace ložiska, tedy v době, kdy pro léčebná rozhodnutí je již pozdě.
Perfuzní měření selhávajícího mozkového průtoku (PWI)
Intravenózní aplikace jódové kontrastní látky s následným CT, nebo aplikace gadolinia (GdDTPA, či jiného chelátu gadolinia) s následným MRI dovoluje zobrazit v axiálních vrstvách distribuci kontrastu a stanovit intenzitu prvního průtoku tohoto kontrastního bolu šedou a bílou hmotou mozkovou. Při CT vyšetření se aplikuje 40 ml kontrastní látky, tj. 16 mg jodu, během 10 sekund s následným obdobným množstvím fyziologického roztoku. V následných 45 sekundách se provádí podle typu přístroje např. přes 300 skenů s rotací gantry za 0,5 sekundy. Analýzy narůstající a posléze „vyplavované“ denzity dovolují porovnat patologické zóny CBF s kontralaterální zdravou stranou a dynamické analýzy přinesou reference o rychlosti a intenzitě pasáže bolu v podobě „time to peak“ (TTP) a „mean transit time“ (MTT). Princip sledování bolu Gadolinia při MRI je obdobný, neměříme však jeho přítomnost, nýbrž jeho účinek.
Perfuzní studie dovolují rozlišit v hodnotách průtoku a tranzitního času jednak oblast nezadržitelně nekrotizujícího jádra, jednak oblasti penumbry směřující buď k propadu cestou apoptózy do gliózy, či přímo do nekrózy, nebo naopak směřující k pozdější normalizaci. Ve studii Rohlové [33] se porovnávaly oblasti infarktového jádra s oblastmi penumbry, rozdělené na centrální část, která bude podle finálního T2WI 30. dne po iktu zjevná jako definitivní léze, a na část penumbry kurabilní, kterou představuje rozdíl perfuzního defektu z akutní fáze proti budoucí T2WI lézi při kontrole 30. dne. Ischemické jádro mělo CBF proti zrcadlovému okrsku v kontralaterální hemisféře snížen na 26 % (jde o oblast určenou patologickou difuzí); v oblasti polostínu mířící do infarktu byl CBF snížen na 42 % a v oblasti polostínu, který se zhojí (benigní oligemie), na 62 %. Rozhodující hodnota průtoku, oddělující obě dvě zóny penumbry protichůdného osudu byla stanovena na 59 %; toto rozlišení umožňovalo predikci se senzitivitou 0,91 a specificitou 0,73. Rozlišení dle CBF se ukázalo jako nejspolehlivější. Hodnoty rCBF v této práci se podobají hodnotám dle Schlauga, který nalezl v jádru 0,11 ml/100 g/min a v penumbře předurčené k infarktu 0,37 ml/100 g/min(34), podobně jako Hoehn-Berlage [35], který nalezl 2 hodiny po iktu v modelu u krys v jádru 0,18 ml/100 g tkáně/min, zatímco v polostínu 31 ml/100 g/min. Hodnoty z práce Rohlové zde korespondují při předpokladu smíšeného fyziologického průtoku šedé/bílé hmoty 50 ml s hodnotami v jádru 13 ml a v penumbře progredující do infarktu 21 ml/100 g/min. rCBF je lepší separátor ztracené a perspektivní tkáně než MTT a samozřejmě mnohem lepší než CBV.
Nedávná metaanalýza průtokových prahů pro infarktové jádro a pro penumbru u dospělých lidí zahrnovala 237 publikovaných studií za posledních 59 let (1945 publikováno Ketty a Schmidtem první měření mozkového průtoku u člověka). Pouze 7 z těchto studií (PET, DW-PW MRI) splňovalo kritéria přesného rozlišení jádra a penumbry ve vztahu k finálnímu CT nebo MRI. Fatální hodnoty CBF, určující infarktové jádro, se pohybovaly mezi 4,8 a 8,4 ml/100 g/min. Hodnoty, odlišující penumbru od benigní oligemie, se pohybovaly mezi 14,1 a 35,0 ml/100 g/min [36]. Proti hodnotám, tradovaným z výzkumů na zvířatech (10, respektive 17 ml/100g/min) se tedy tato data mírně liší. Nejdůležitější je zde pochopitelně metoda, jíž byla měření provedena.
Tranzitní čas MTT má inverzní vztah k perfuznímu tlaku. Sunshine dokázal s úspěchem třídit pacienty na základě času „time to peak“, porovnaného s mapou alterované difuze, na kandidáty i.v. a i.a. trombolýzy [37]. Také Rohlová s Ostergaardem predikují, že pacienti benefitující z trombolýzy budou ti, nebo ty jejich tkáně, jejichž MTT nedosahuje prodloužení na 1,63 (proti kontralaterální zdravé pasáži). Členění zón dle protrahovaného MTT se ukazuje v perfuzních měřeních jako druhé nejpřesnější. Mezní hodnotou diference mezi částí penumbry odsouzené k zániku a penumbrou, jdoucí vstříc uzdravení, je tedy právě charakteristické prodloužení na 1,63 kontralaterálního tranzitního času [33]. Vycházíme-li tedy z fyziologického tranzitního času mezi 3,2 a 3,5 s, jednalo se o hodnoty, blížící se 5 sekundám.
Měření CBV jako indikátoru osudu penumbry se ukazuje málo výmluvným. CBV prodělává v ischemické tkáni bimodální změny. Blokádou krevního příkonu nejdříve klesá, reaktivní vazodilatací vzápětí stoupá, účinkem intracelulárního edému se opět komprimuje a konečným selháním veškeré hnací síly klesá definitivně. V tomto variabilním procesu záleží na tom, kdy CBV měříme a v jaké patogenetické fázi se právě tkáň nachází. Celkem lze říci, že není zcela jasné, zda zvýšený CBV má protektivní nebo destruktivní efekt a predikci pro penumbru, avšak objem redukovaný pod 70 % zrcadlového ROI (region of interest) předpovídá již ireverzibilní škodu.
Magnetická rezonance vážená difuzí (DWI)
Dopad kriticky snížené perfuze na mozkovou tkáň lze studovat měřením difuze. Dusící se mozkový parenchym prodělává časné změny nejprve v šedé hmotě a následně i v bílé. Měřený fyzikální jev je Brownův molekulární pohyb, v našem případě pohyb vodíkových protonů. Jde o kmitavé nahodilé pohyby, provokované teplotou těla. Intenzita se vyjadřuje v mm2/s a pro čistou vodu činí při 37 ºC. C přibližně 3,2 x 10-3 mm2/s. V mozkomíšním moku, jehož viskozita je o něco vyšší, má difuzní koeficient hodnotu 2,8 x 10-3 mm2/s [38]. Využitelnost difuze pro měření změn vadné nervové tkáně popsal již před 20 lety Le Bihan [39].
Faktorem difuzivity, neboli stupně difuze, difuzního koeficientu, jsou hlavně viskozita prostředí a ve tkáni rozměr volného prostoru mezi jednotlivými membránami. Velikost buněk a velikost intercelulárních prostorů jsou tedy hlavní proměnnou při změnách difuzivity. Odlišná situace od neuropilu je ve svazcích axonů, kde navíc přistupuje difuzní aniozotropie. Způsobují ji formace cytoskeletu a tkáňové trajektorie axonálního transportu. Podle jejich směru převažuje longitudinální difuzivita v určitém vektoru ortogonálního systému x,y,z. Tento fenomén dovoluje analýzy tzv. tenzorů. O izo- či anizotropii tkáně tedy rozhoduje anatomické uspořádání mozkových drah.
MRI studie difuze se provádějí aplikací párových gradientových pulzů mezi standardními radiofrekvenčními pulzy běžného T2 váženého vyšetření. Jejich účinkem prodělává atom, spinující v echo synchronizaci zpoždění, tzv. defázování a následným opačným gradientem se opět refázuje. Pokud atom při vysoké difuzi unikne mezi těmito pulzy z pole, není jeho signál již registrován. Tímto účinkem se např. likvor původně probíhajícího T2 vážení propadne v tmavý signál. Tkáň, která nemá tak vysoký obsah volně pohyblivé vody, a tím více pak tkáň, která snížila difuzivitu v důsledku patologického procesu, zůstávají tímto MRI postupem méně zasaženy a echo signál setrvá relativně vysoko (defázováním nabouráváme efekt T2 relaxace).
Míru difuzního vážení ovlivňuje tzv. b-faktor. Ten závisí na 3 proměnných, ovlivňujících účinnost difuzního vážení proti výchozím konvenčním pulzům. Těmito proměnnými jsou čas δ, po nějž trvá defázující potenciál, síla aplikovaného pole G a čas ∆, oddělující de- a refázující impulz. Separujeme-li např.de- a refázující impulz delší mezerou, stává se únik difundujících molekul významnějším. V praxi se obvykle používá impulzů s faktorem b nula a 1000, ale vlastnosti tkání je možno - zejména experimentálně - ověřovat i jinými hodnotami tohoto faktoru.
Aplikací různých gradientových pulzů lze docílit srovnání kódovací síly defázujících pulzů a spočítat pro každý pixel vlastní mohutnost difuze. Tento rozměr, tzv. apparent diffusion coefficient – ADC je skutečnou hledanou hodnotou. Na rozdíl od obrazu váženého difuzí (DWI) není ovlivněn „prosvítáním“ T2 váženého skenu. Využívá se k tvorbě parametrických map ADC [40]. Zobrazování metodou difuzního vážení je možné pouze z výchozí aplikace T2 vážení. Proto se účinek T2 relaxace do obrazu vždy v určité míře prosazuje. Pouze oblasti s vysokou difuzí dokáží T2 signál plně překonat (např. likvor). Pronikání T2 relaxace do DWI obrazu se nazývá „T2 prosvítání“ (T2 shine through).
Čím vyšší je hodnota difuze – ADC – a tím též světlejší oblast na parametrických mapách, tím je tmavší oblast na exponenciálních DWI obrazech (dokázala překonat efekt T2 relaxace). Naopak, nejtmavší místa ADC map, zobrazující relativně nízkou difuzi, jsou na DWI zónou vysokého signálu. Úměra tohoto vztahu však v praxi není jednoduchá, protože s vývojem patologického procesu se mění echo charakteristiky tkáně. Kombinovaný efekt T2 a difuze, prosazující se do DWI obrazu, se tedy pak neřídí pravidlem pouhé difuze, jak je tomu v ADC mapě. V DWI jde vždy o ochotu magnetické rotace a vzájemné synchronie spinujících jader na jedné straně a pohyb z místa na místo v rámci difuze na druhé straně.
Proti hodnotám difuze ve vodě nebo likvoru (viz výše) jsou hodnoty ADC ve zdravé dospělé šedé a bílé hmotě více než 4x nižší: 0,76, resp 0,77 x 10-3 mm2/s. Děti mají ADC vyšší, zejména v bílé hmotě (novorozenci šedá hmota 1,02; bílá 1,13 x 10-3 mm2/s). To je důsledkem zejména vyššího obsahu vody a nezralé myelinizace v dětství [41]. Postupem života difuze v mozkové tkáni zřejmě (minimálně) stejnoměrně stoupá. Periventrikulární bílá hmota se u starých lidí jeví v DWI světlejší, což je však také účinek prosvítání vyššího signálu z T2WI.
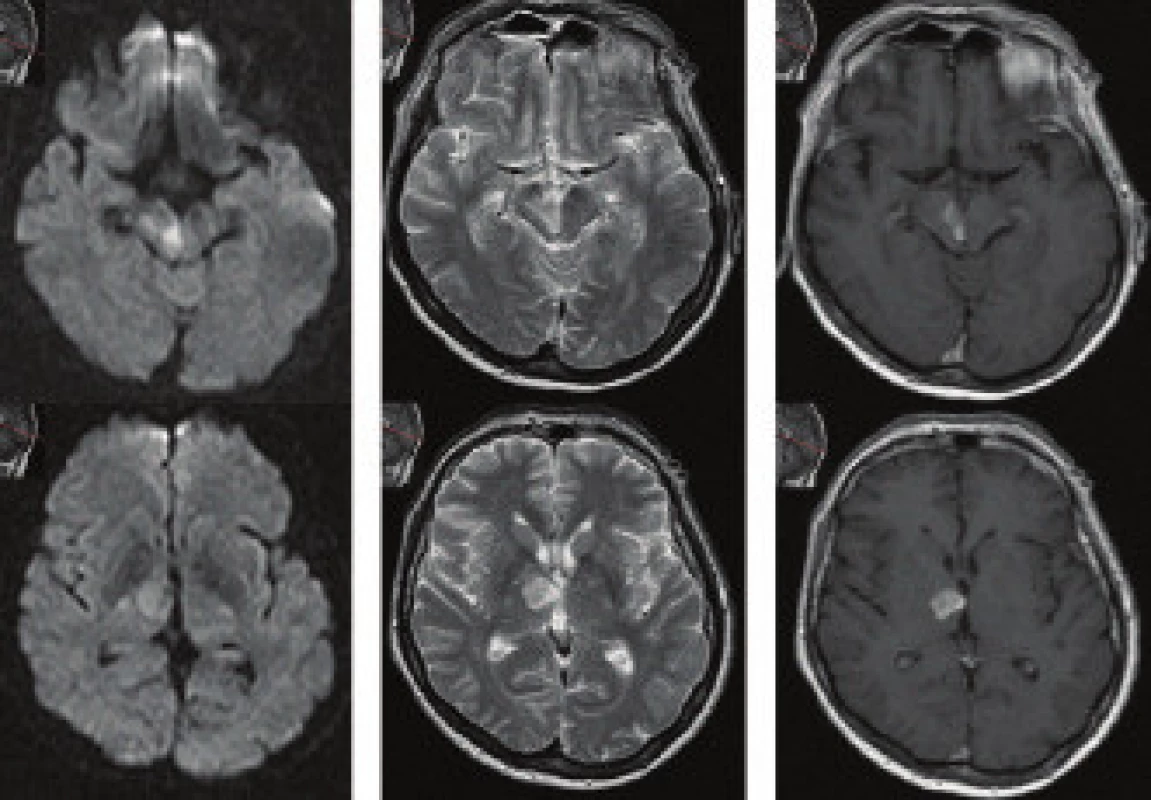
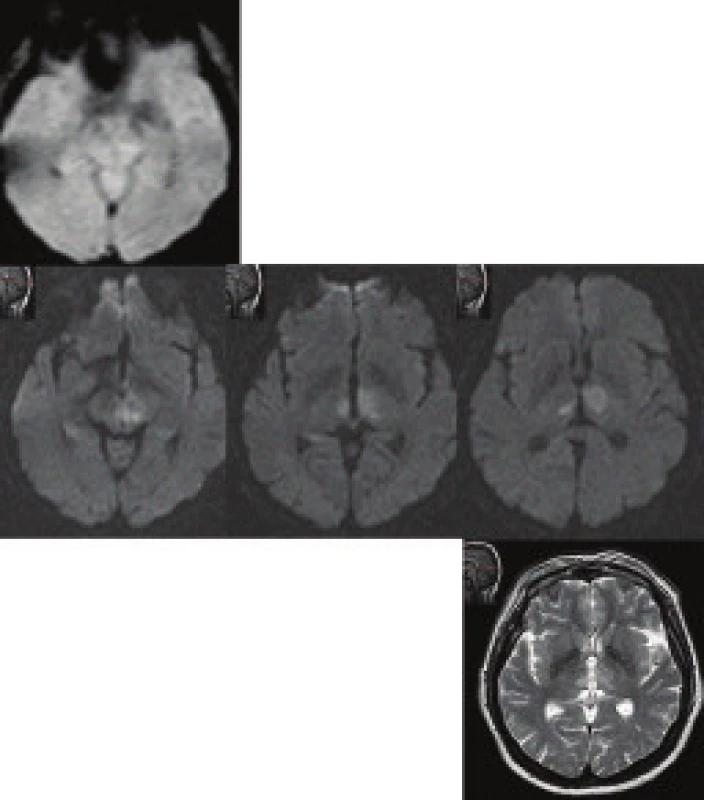
DWI je v praxi nejcitlivější technikou ke stanovení časného infarktového ložiska (obr. 3 a 4). I když příčiny a nástup mohou být detekovány perfuzním vážením a cestou PET (CBF, CMRO2, OEF), vlastní lézi definuje DWI. Vyšetření může být provedeno během 2 minut. Pokles ADC se zvýšeným signálem DWI jsou důsledkem intracelulárního edému. Znalost ADC nám zvyšuje spolehlivost nálezu, protože DWI ložisko by mohlo imponovat vysokým signálem i na základě prosvítání T2 u subakutních nebo starých iktů.
Intracelulární edém vyvolává snížení ADC, dosahující až 40 %. Důvodem je zmenšení extracelulárního prostoru a změny jeho „tortuozity“, které brání volnému pohybu molekul [42,43]. Tvoří-li extracelulární voda standardně 20 % objemu neuropilu, nestačilo by však ani veškeré její přelití do buněk na tak výrazné snížení ADC. Předpokládá se proto také zvýšení viskozity cytoplazmatu. Dovolujeme si předpovídat, že další složkou, která „difuzivitu“ oslabí, je ustrnutí životního koloběhu v buňce a na jejích membránách. Představujeme si, že hnací síly energetického ATP agregátu přispívají za zdravých okolností k pohyblivosti difundujících molekul a zastavením tohoto života klesá těkavost molekul současně s jejich organizovaným biologickým transportem.
Difuze klesá nejen v ložiscích infarktů, ale také v oblasti koagulační nekrózy (hyperviskozita), v hemoragiích (erytrocytární masa), některých tumorech (zvýšená buněčná denzita), abscesech a dokonce i v některých stadiích degenerativních procesů. Intramyelinový edém provází akutní stadia roztroušené sklerózy, osmotickou myelinolýzu i toxické a metabolické leukoencefalopatie.
Intracelulární edém není spolehlivým ukazatelem ireverzibilního poškození. Dovede se jednoznačně vzpamatovat - např. po status epilepticus. Zvláště pokud postihne pouze reaktivní astrocyty, může se upravit ad integrum. Je tomu tak např. při těžších TIA.
Vazogenní edém je v mikrotkáňovém prostředí subakutního iktu v určitém směru opakem intracelulárního. Nadbytkem vody v intersticiu zvětšuje tento prostor a usnadňuje difuzivitu. S odstupem od vzniku iktu se navíc prosazuje do obrazu také zvyšující se T2 relaxace a tento fenomén „prosvítání“ může efekt zvýšené difuzivity neutralizovat. Oba tyto procesy vedou k pseudonormalizaci DWI kolem 10.–12. dne [44]. S rozpadem buněčných membrán a organel se nakonec svoboda prostoru pro difuzi zvyšuje až na 2,5násobek fyziologických hodnot (obr. 5).
Reverzibilita pokleslého ADC z důvodů sanace ložiska je možná u lehkých poklesů. Takovými lézemi jsou např. některé TIA, vyšetřené do 4 hodin, tranzitorní globální amnézie, hemiplegické migrény a některé lehčí venózní infarkty.
U podezření na trombózu sinů je DWI velmi namístě. Dokáže odhalit již iniciální stadia připraveného infarktu.
Protože jsou v oblasti penumbry jen lehké poklesy ADC, lze usuzovat na rozsah tkáně, kterou bude možno včasnou léčbou zachránit. Tento úsudek nabývá na hodnotě zvláště zapojením perfuzního obrazu, který nejlépe definuje rozsah oblasti pokleslého průtoku. Poměr tkáně ireverzibilně ztracené (definované DWI) a tkáně penumbry v pouhé hypoperfuzi (definované PWI) je podstatou intenzivně studovaného jevu „odlišnosti“ těchto zón (mismatch). Čím větší je rozdíl v těchto 2 oblastech při přijetí pacienta, tím větší jsou naděje na blahodárný efekt trombolýzy a ostatní naší léčby. Ložiska výrazně alterovaného ADC jsou také více vystavena nebezpečí hemoragické transformace.
Jaké jsou prahy metabolického selhání, které vedou k patognostickému snížení difuze? ADC změny nastávají již krátce před nástupem anoxické depolarizace buněčných membrán. Poklesy ADC o 10 % korespondují s acidózou tkáně a poklesy o 23 % s vyčerpáním ATP [35]. V krysím modelu s okluzí MCA byla vazba hodnot ADC na ATP depleci a tkáňovou acidózu prověřena nejen v průběhu ischémie, ale i během následné reperfuze. Také zde se i při vývoji rozsahu ložiska v čase vázala hodnota 77 % ADC proti zdravé straně na plné vyčerpání ATP a hodnota 86 % zdravé strany na tkáňovou acidózu [45].
Velké množství prací usiluje o stanovení infarktového jádra na základě patologické zóny ADC s cílem poznat, které poklesy ADC definují ireverzibilitu ztracené vitality. Retrospektivní analýza 48 pacientů s iktem, kteří nebyli ošetřeni trombolýzou, dovolila srovnání ADC hodnot v zónách, které propadly definitivní nekróze (konečný rozsah infarktu ve FLAIR sekvencích); dále v zóně růstu infarktu z iniciální penumbry (perfuzně difuzní mismatch) a v zóně, která se ze své oligemie zotaví (PWI porucha, posléze uzdravená). Autoři shledali, že hraniční hodnota, odlišující s 95% specificitou tkáň budoucího infarktu od tkáně, která se uzdraví, je ADC 0,74 x 10-3 mm2/s na rozdíl od hodnot v kontralaterální zdravé tkáni s ADC 0,82 x 10-3 mm2/s. Jádro časného infarktu se pohybovalo v ADC 0,66 x 10-3 mm2/s. Tyto hodnoty difuze byly pro diskriminaci budoucího definitivního infarktu spolehlivější, než hodnoty CBF i MTT a CBV [46].
Gradient ADC hodnot, předurčujících osud hypoperfundované oblasti nalezla Rohlová v následujících indexech: ztracené jádro průměrně 0,62 kontralaterální zdravé strany, penumbra mířící do záhuby 0,89 a penumbra mířící k zotavení 0,92. Za hodnotu spolehlivě definující tkáň, která se zhroutí definitivně, lze pokládat 0,75 poměru proti fyziologické difuzi [33]. Liu [47] nalezl v jádru 0,53, v ireverzibilní penumbře 0,98 a v reverzibilní 1,00. Schlaug [34] shledal v jádru 0,56 a v ireverzibilní penumbře 0,91. Rozlišit obě protichůdné meze poškození v penumbře se tedy ukazuje na základě ADC jako mírně nespolehlivé.
Zahajovací poklesy difuze se mohou při reperfuzi (např. po hodině ischemie) opět zrestaurovat, avšak tato normalizace v období kolem 24 hodin nemusí být dokladem uzdravení. Sekundární ischemické změny rozpoutávají po první zdánlivé úpravě řetěz sekundárních škod, které v dalších dnech povedou k druhé vlně ADC poklesu [48].
Využití MRI technik v úvodním vyšetření pacienta stojí cenné minuty, které některé teamy vedou k tomu, že aplikují trombolýzu raději dříve, jen na základě perfuzního CT. Nicméně opakovaným používáním všech těchto metod se praxe propracovává ke stále účelnější rutině. Docílení detailních znalostí o aktuálním stavu ischemického ložiska v okamžiku přijetí pacienta do nemocnice je vynikající oporou pro léčebná rozhodnutí.
Rozvoj neuroradiologie v posledních 4 desetiletích dává obrovské možnosti ve sledování detailů mozkové cirkulace. Poznatky se i u nás stávají intenzivně součástí fondu praktických vědomostí [49] a nejpokrokovější teamy vyvinuly kvalitní neuroradiologickou spolupráci k zasvěcené péči o akutní cévní příhody mozkové [50].
Práce vznikla za podpory VZ MSM 0021620816
Přijato k recenzi: 30. 12. 2006
Přijato do tisku: 5. 4. 2007
Recenzenti: doc. MUDr. Jan Mareš, CSc., Ústav normální, patologické a klinické fyziologie 3. LF UK , Praha
doc. MUDr. Zbyněk Kalita, CSc., Neurologické oddělení, Baťova nemocnice, Zlín
doc. MUDr. Josef Vymazal, DrSc., Radiodiagnostické oddělení, Nemocnice Na Homolce, Praha 5
Korespondující autor:
prof. MUDr. Pavel Kalvach, CSc.
Neurologická klinika 3.LF UK a FNKV, Praha
e-mail: kalvach@fnkv.cz
Prof. MUDr. Pavel Kalvach, CSc.
Prof. MUDr. Pavel Kalvach, CSc. promoval na Lékařské fakultě Karlovy University v Praze v r. 1967. V následných 3 letech pracoval ve Fyziologickém ústavu ČSAV a krátce v okresní nemocnici v Šumperku. Od r. 1971 pak po dobu 17 let jako sekundář a asistent Neurologické kliniky 1. LF v Praze. Atestace I. v r. 1972, II. v r. 1975, 1983 obhájena kandidátská disertační práce na téma Sledování mozkového mikrovaskulárního průtoku, 1988 jmenován docentem a 2003 profesorem. V letech 1988-1992 byl přednostou Neurologické kliniky IPVZ a v letech 1996-2006 přednostou Neurologické kliniky 3. lékařské fakulty UK. Předsedou Československé a poté České neurologické společnosti byl v letech 1990-1995. Byl vedoucím kolektivu autorů monografie Mozkové ischemie a hemoragie, vyznamenané cenou Literárního fondu a cenou České lékařské společnosti J.E. Turkyně v roce 1985. Pracovní pobyty na Yale University absolvoval 4krát, studium mozkového metabolizmu metodou PET ve Švýcarsku v roce 1996. V r. 2003 obdržel výroční Evropskou cenu LINF za přínos pro vzdělávání v oboru neurologie a psychiatrie. V Evropské federaci neurologických společností zastával funkci generálního sekretáře 1999-2003 a viceprezidenta 2003-2007. Je členem redakční rady Čes a Slov Neurol N a Journal of Neurological Sciences.
Vědomostní test
1. Rychlost krevního toku je nejvyšší v:
- a) a. carotis communis
- b) a. carotis interna
- c) a. cerebri media
- d) a. cerebri anterior
2. Regionální průtok krve mozkovou tkání
- a) je vyšší v šedé hmotě
- b) je vyšší v bílé hmotě
- c) je přibližně stejný v obou tkáních
- d) měření nedává spolehlivé výsledky
3. Extrakce kyslíku z protékajícího oxyhemoglobinu se zvyšuje
- a) při snížení činnosti tkáně
- b) při zvýšení činnosti tkáně
- c) při snižování průtoku
- d) ihned při zástavě krevního proudu
4. Při aktivaci korového tkáňového okrsku
- a) se krevní průtok nemění
- b) krevní průtok vzroste až o 30-50 %
- c) extrakce kyslíku stoupá pouze o 5 %
- d) obsah deoxyhemoglobinu v odvodných žilách se přechodně sníží
5. Objem krve protékající u zdravého jedince karotidami
- a) odpovídá zhruba průtoku aa. vertebrales
- b) představuje asi dvojnásobek průtoku aa. vertebrales
- c) je zhruba čtyřnásobkem průtoku aa. vertebrales
- d) je oproti průtoku aa. vertebrales osminásobný
6. Metoda BOLD detekuje přímo změny
- a) oxyhemoglobinu
- b) deoxyhemoglobinu
- c) extrakční frakce kyslíku
- d) detekuje jiné změny
7. Intenzivní hyperventilace způsobuje
- a) arteriolární vazokonstrikci a. cerebri media
- b) zpomalení krevního toku v a. cerebri media
- c) vazodilataci bazálních mozkových tepen
- d) snížení pCO2
8. Při zadržení dechu na 30 sekund vzniká
- a) hyperkapnická vazodilatace
- b) zvýšení průtokové rychlosti v a. cerebri media
- c) snížení průtokové rychlosti v a. cerebri media
- d) mohutnost odpovědi se mění s věkem
9. Perfuzní studie dovolují rozlišit v hodnotách průtoku a tranzitního času
- a) oblast nezadržitelně nekrotizujícího jádra
- b) oblast penumbry směřující k propadu do gliózy resp. nekrózy
- c) všechny možnosti
- d) oblast penumbry nadějné k plné restituci
10. Kriticky snížená perfuze mozkové tkáně vede k časným změnám
- a) nejprve v šedé hmotě
- b) nejprve v bílé hmotě
- c) změny vznikají současně
- d) postižení jednotlivých struktur záleží na rychlosti vzniku
11. Faktorem stupně difuze jsou hlavně
- a) viskozita prostředí
- b) rozměr volného prostoru mezi jednotlivými buněčnými membránami
- c) obojí
- d) množství podané kontrastní látky
12. Při měření cerebrovaskulární rezervy se používá:
- a) test zadrženého dechu
- b) podání acetazolamidu
- c) hyperventilace
- d) sklopný stůl s měřením TK
13. Prospěch pacienta s ischemickou CMP z trombolýzy bude nejpravděpodobnější při
- a) prodloužení MTT na postižené straně zhruba na trojnásobek hodnot na zdravé straně
- b) prodloužení MTT na postižené straně zhruba o polovinu oproti zdravé straně
- c) CBV zvýšeném o polovinu oproti zdravé straně
- d) CBV sníženém o polovinu oproti zdravé straně
14. Cytotoxický edém má na ADC následující vliv:
- a) anuluje jeho hodnotu v oblasti penumbry
- b) snižuje jeho hodnoty až o 40 % v jádru infarktu
- c) zvyšuje jeho hodnoty asi o 20 %
- d) zvyšuje jeho hodnoty až na dvojnásobek
15. Vazogenní edém má na MR obraz následující vliv:
- a) zvyšuje T2 signál
- b) snižuje T2 signál
- c) nemá vliv na T2 relaxaci
- d) může pseudonormalizovat DWI
16. Penumbra (polostín)
- a) je ischemická tkáň se zachovaným metabolismem pod úrovní akčního potenciálu
- b) je tkáň s trvale fungujícími neurony na periferii infarktu
- c) odlišitelná (proti infarktovému jádru) perfuzními studiemi podle hodnot průtoku
- d) tkáň s prodlouženým tranzitním časem predikujícím efekt trombolýzy
17. Magnetická rezonance vážená difuzí (DWI)
- a) je v praxi nejcitlivější ke stanovení časného infarktového ložiska
- b) nachází pokles ADC i v koagulační nekróze, hemoragiích a některých tumorech
- c) slouží k potvrzení hemoragické transformace ložiska
- d) Je nejspolehlivější v diskriminaci ireverzibilně ztracené tkáně
18. ADC je schopno referovat o následujících stavech ischemické tkáně
- a) acidóza tkáně
- b) vyčerpání zásob ATP
- c) zástava řízených dějů na membráně
- d) nadcházející nekróza
19. Nejspolehlivější metodou pro diskriminaci budoucího definitivního infarktu v prvních 6 hodinách je
- a) SPECT
- b) Digitální subtrakční angiografie
- c) Stanovení mozkového krevního objemu perfuzním CT
- d) Difuzí vážená MR s určením ADC
20. O nepříznivém osudu oblasti mozku je rozhodnuto při hodnotě ADC
- a) méně než 50 % zdravé tkáně
- b) méně než 62 % zdravé tkáně
- c) méně než 75 % zdravé tkáně
- d) méně než 95 % zdravé tkáně
Správné odpovědi: 1 C, 2A, 3 BCD, 4 BCD, 5C, 6B, 7 ABD, 8 ABD, 9 ABCD, 10 A, 11 ABC, 12 AB,13 B, 14 B, 15 AD, 16 ACD, 17 ABD, 18 ABCD, 19 D, 20 ABC
Zdroje
1. Školoudík D, Škoda O, Bar M, Brozman M, Václavík D. Neurosonologie. Praha: Galén 2003.
2. Gregová D, Termerová J, Korsa J, Benedikt P, Peisker T, Procházka B et al. Věková závislost průtokových rychlostí v karotických tepnách. Česk Slov Neurol N 2004; 67/100 (6): 409-14.
3. Kalvach P, Gregová D, Škoda O, Peisker T, Tůmová R, Termerová J et al. Cerebral blood supply with aging: Normal, stenotic and recanalized. J Neurol Sci 2007: in print.
4. Koshimoto Y, Yamada H, Kimura H, Maeda M, Tsuchida C, Kawamura Y et al. Quantitative analysis of cerebrovascular hemodynamics with T2-weighted dynamic MR imaging. J Magn Reson Imaging 1999; 9(3): 462-7.
5. Helenius J, Perkio J, Soinne L, Ostergaard L, Carano RA, Salonen O et al. Cerebral hemodynamics in a healthy population measured by dynamic susceptibility contrast MR imaging. Acta Radiol 2003, 44(5): 538-46.
6. Wenz F, Rempp K, Brix G, Knopp MV, Guckel F, Hess T et al. Age dependency of the regional cerebral blood volume (rCBV) measured with dynamic susceptibility contrast MR imaging (DSC). J Magn Reson Imaging 1996, 14(2): 157-62.
7. Ruetzler CA, Furuya K, Takeda H, Hallenbeck JM. Brain vessels normally undergo cyclic activation and inactivation: Evidence from tumor necrosis factor-alfa, Heme-oxygenase-1, and Manganese Superoxide dismutase immunostaining of vessels and perivascular brain cells. J Cerebr Blood Flow Metabol 2001; 21: 244-52.
8. Hoge RD, Atkinson J, Gill B, Crelier GL, Marrett S, Pike GB. Investigation of BOLD signal dependence on cerebral blood flow and oxygen consumption: the deoxyhemoglobin dilution model. Magnetic resonance in medicine 1999; 42(5): 849-63.
9. Turner R. How much cortex can a vein drain? Downstream dilution of activation-related cerebral blood oxygenation changes. Neuroimage 2002; 16: 1062-7.
10. Kwong KK, Belliveau JW, Chesler DA, Goldberg IE, Weisskoff RM, Poncelet BP et al. Dynamic magnetic resonance imaging of human brain activity during primary sensory stimulation. Proc Natl Acad Sci 1992; 89: 5675-9.
11. Klener J, Urgošík D, Tiňtěra J. Využití funkční magnetické rezonance v neurochirurgii centrální krajiny. Česk Slov Neurol N 2003; 66/99: 329-34.
12. Bartoš R, Jech R, Vymazal J, Cihlář F, Hejčl A, Sameš M. Spolehlivost lokalizace primární motorické oblasti pomocí funkční magnetické rezonance. Česk Slov Neurol N 2006; 69/102: 189-94.
13. Frisoni GB, Filippini N. Quantitative and functional magnetic resonance imaging techiques. In Herholz K, Perani D, Morris Ch (eds). The Dementias. Early diagnosis and evaluation. New York: Taylor and Francis Group 2006: 157-96.
14. Feng CM, Liu HL, Fox PT, Gao JH. Dynamic changes in the cerebral metabolic rate of O2 and oxygen extraction ratio in event-related functional MRI. Neuroimage 2003; 18: 257-62.
15. Liu HL, Pu Y, Nickerson LD, Liu Y, Fox PT, Gao JH. Comparison of the temporal response in perfusion and BOLD-based event-related functional MRI. Magnetic resonance in medicine 2000; 43(5): 768-72.
16. Menon RS, Ogawa S, Hu X, Strupp JP, Anderson P, Ugurbil K. BOLD based functional MRI at 4 Tesla includes a capillary bed contribution: echo-planar imaging correlates with previous optical imaging using intrinsic signals. Magnetic resonance in medicine 1995; 33(3): 453-9.
17. Hu X, Le TH, Ugurbil K. Evaluation of the early response in fMRI in individual subjects using short stimulus duration. Magnetic resonance in medicine 1997; 37(6): 877-84.
18. Williams DS, Detre JA, Leigh JS, Koretsky AP. Magnetic resonance imaging of perfusion using spin inversion of arterial water. Proc Nat Acad Sci USA 1992; 89(1): 212-6.
19. Wang JJ, Aguirre GK, Kimberg DY, Roc AC, Li L, Detre JA. Arterial spin labeling perfusion AM with very low task frequency. Magnetic resonance in medicine 2003; 45(9): 796-802.
20. Malatino LS, Bellofiore S, Costa MP, Lo Manto G, Finocchiaro F, Di Maria GU. Cerebral blood flow velocity after hyperventilation-induced vasoconstriction in hypertensive patients. Stroke 1992; 23:1728-32.
21. Bishop CCR, Powell S, Rutt D, Browse NL. Transcranial Doppler measurement of middle cerebral artery blood flow velocity: a validation study. Stroke 1986; 17: 913-5.
22. Spencer MP, Thomas GI, Moehring MA. Relation between middle cerebral artery blood flow velocity and stump pressure during carotid endarterectomy. Stroke 1992; 23: 1439-45.
23. Ringelstein EB, Sievers C, Ecker S, Schneider PA, Otis SM. Noninvasive assessment of CO2 induced cerebral vasomotor response in normal individuals and patients with internal carotid artery occlusions. Stroke 1988; 19: 963-9.
24. Eicke BM, Buss E, Baehr RR, Hajak G, Paulus W. Influence of Acetazolamide and CO2 on extracranial flow volume and intracranial blood flow velocity. Stroke 1999; 30: 76-80.
25. Silvestrini M, Troisi E, Matteis M, Cupini LM, Caltagirone C. Transcranial Doppler assessment of cerebrovascular reactivity in symptomatic and asymptomatic severe carotid stenosis. Stroke 1996; 27: 1970-3.
26. Kastrup A, Li T-Q, Takahashi A, Glover GH, Moseley ME. Functional magnetic resonance imaging of regional cerebral blood oxygenation changes during breath holding. Stroke 1998; 29: 2641-5.
27. Okazawa H, Yamauchi H, Sugimoto K, Toyoda H, Kishibe Y, Takahashi M. Effects of acetazolamide on cerebral blood flow, blood volume and oxygen metabolism: a positron emission tomography study with healthy volunteers. J Cereb Blood Flow Metab 2001; 21: 1472-9.
28. Okazawa H, Yamauchi H, Sugimoto K, Takahashi M. Differences in vasodilatory capacity and changes in cerebral blood flow induced by acetazolamide in patients with cerebrovascular disease. J Nucl Med 2003; 44: 1371-8.
29. Guckel FJ, Brix G, Schmiedek P, Piepgras Z, Becker G, Kopke J et al. Cerebrovascular reserve capacity in patients with occlusive cerebrovascular disease: assessment with dynamic susceptibility contrast-enhanced MR imaging and the acetazolamide stimulation test. Radiology 1996; 201: 405-12.
30. Astrup J, Siesjo BK, Symon L. Thresholds in cerebral ischemia: the ischemic penumbra. Stroke 1981; 12: 723-5.
31. Furlan M, Marchal G, Viader F, Derlon JM, Baron JC. Spontaneous neurological recovery after stroke and the fate of the ischemic penumbra. Ann Neurol 1996; 40: 216-26.
32. Marchal G, Beaudouin V, Rioux P, de la Sayette V, Le Doze F, Viader F et al. Prolonged persistence of substantial volumes of potentially viable brain tissue after stroke: a correlative PET-CT study with voxel-based data analysis. Stroke 1996; 27: 599-606.
33. Rohl L, Ostergaard L, Simonsen CZ, Vestergaard-Poulsen P, Andersen G, Sakoh M et al. Viability thresholds of ischemic penumbra of hyperacute stroke defined by perfusion-weighted MRI and apparent diffusion coefficient. Stroke 2001; 32: 1140-8.
34. Schlaug G, Benfield A, Baird AE, Siewert B, Lovblad KO, Parker RA et al. The ischemic penumbra: operationally defined by diffusion and perfusion MRI. Neurology 1999; 53: 1528-37.
35. Hoehn-Berlage M, Norris DG, Kohno K, Mies G, Leibfritz D, Hossmann K-A. Evolution of regional changes in apparent diffusion coefficient during focal ischemia of rat brain – the relationship of quantitative diffusion NMR imaging to reduction in cerebral blood flow and metabolic disturbances. J Cereb Blood Flow Metab 1995; 15: 1002-11.
36. Bandera E, Botteri M, Minelli C, Sutton A, Abrams KR, Latronico L. Cerebral blood flow threshold of ischemic penumbra and infarct core in acute ischemic stroke. A systematic review. Stroke 2006; 37: 1334-9.
37. Sunshine JL, Tarr RW, Lanzieri CF, Landis DM, Selman WR, Lewin JS. Hyperacute stroke: ultrafast MR imaging to triage patients prior to therapy. Radiology 1999; 212: 325-32.
38. Helenius J, Soinne L, Salonen O, Kaste M, Tatlisumak T. Leukoaraiosis, ischemic stroke, and normal white matter on diffusion-weighted MRI. Stroke 2002; 33: 45-50.
39. Le Bihan D, Breton E, Lallemand D, Grenier P, Cabanis E, Laval-Jeantet M. MR imaging of intravoxel incoherent motions: application to diffusion and perfusion in neurologic disorders. Radiology 1986; 161: 401-7.
40. Moritani T, Ekholm S, Westesson PL. Diffusion-weighted MR Imaging of the Brain. Berlin, Heidelberg, New York: Springer 2005.
41. Forbes KP, Pipe JG, Bird CR. Changes in brain water diffusion during the first year of life. Radiology 2002; 222: 405-9.
42. Syková E, Mazel T, Šimonová Z. Diffusion constraints and neuron-glia interaction during aging. Exp Gerontology 1998; 33: 837-51.
43. Syková E. Glial diffusion barriers during aging and pathological states. In Lopez BC and Nieto-Sampedro (Eds). Progress in Brain Research. Elsevier Science BV 2001: 339-63.
44. Fiebach JB, Jansen O, Schellinger PD, Heiland S, Hacke W, Sartor K et al. Serial analysis of the apparent diffusion coefficient time course in human stroke. Neuroradiology 2002; 44: 294-8.
45. Olah L, Wecker S, Hoehn M. Relation of apparent diffusion coefficient changes and metabolic disturbances after 1 hour of focal cerebral ischemia and at different reperfusion phases in rats. J Cereb Blood Flow Metab 2001; 4: 430-9.
46. Oppenheim C, Grandin C, Samson Y, Smith A, Duprez T, Marsault C et al. Is there an apparent diffusion coefficient threshold in predicting tissue viability in hyperacute stroke? Stroke 2001; 32: 2486-91.
47. Liu Y, Karonen JO, Vanninen RL, Ostergaard L, Roivainen R, Nuutinen J et al. Cerebral hemodynamics in human acute ischemic stroke: a study with diffusion- and perfusion-weighted magnetic resonance imaging and SPECT. J Cereb Blood Flow Metab 2000; 20: 910-20.
48. Neumann-Haefelin T, Kastrup A, de Crespigny A, Yenari MA, Ringer T, Sun, GH et al. Serial MRI after transient focal cerebral ischemia in rats. Stroke 2000; 31: 1965-73.
49. Nosál V, Šaňák D, Herzig R, Zeleňák K, Kurča E, Kaňovský P. Náhla cievna mozgová príhoda ischemická – súčasné zobrazovacie možnosti. Cesk Slov Neurol N 2006; 69/102: 272-9.
50. Šaňák D, Nosál V, Horák D, Bártková A, Zeleňák K, Herzig R et al. Impact of initial cerebral infarction volume measured in diffusion-weighted MRI on clinical outcome in acute stroke patients with middle cerebral artery occlusion treated by thrombolysis. Neuroradiology 2007: in print.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2007 Číslo 3
Nejčtenější v tomto čísle
- Chiariho malformace – vlastní zkušenosti
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Osteoplastická dekompresivní kraniotomie

