Korelace ptiO2 a apoptózy u fokální mozkové ischemie a vliv systémové hypertenze
Correlation between ptiO2 and Apoptosis in Focal Brain ischaemia and the Influence of Systemic Hypertension
Introduction:
Current neurosurgery and intensive medicine often deal with patients threatened by focal brain ischemia. Temporary ischemia has been used purposefully in some neurosurgical interventions. In the centre of ischemia, the tissue is menaced with necrosis but in the surrounding tissue (penumbra) the cells become extinct via apoptosis. Systemic hypertension can delay the extinction of cells by apoptosis in the tissue in the penumbra region probably by means of involving leptomeningeal collaterals.
Material and Methods:
We have used a thread model of focal brain ischemia in a sewer-rat which enables to perform controlled focal ischemia for the selected interval with long-term reperfusion. The effects of systemic hypertension on partial O2 pressure in the penumbral tissue and the number of cells disappearing via apoptosis were studied by means of TUNEL test. The total of 70 sewer-rats were operated on, which had been divided into groups of normotensive and hypertensive animals and then into groups with 15 or 30 minutes of focal ischemia. Reperfusion lasted for 48 hours.
Results:
Significant difference (p < 0.001) was demonstrated between normotensive and hypertensive groups with 15-minutes´ ischemia both in the values of ptiO2 and decrease of the number of TUNEL+ cells, namely in favour of hypertensive rats. The comparison of 15-minutes´ normotensive and 30-minutes´ hypertensive ischemias showed an interesting significant difference in the initial and terminal values of ptiO2 (p < 0.001) in favour of hypertension but the decrease of ptiO2 is not significantly different (p = 0.141). TUNEL+ neurons of the cortex were fewer in number in the hypertensive group (p = 0.005).
Conclusion:
Systemic hypertension delays the extinction of cells via apoptotis in the tissue in the penumbra region. The number of TUNEL+ cells depends rather on the absolute value of ptiO2 than on the size of decrease in values during ischemia. Monitoring ptiO2 in clinical practice can also serve as an indicator of threatening the brain tissue with apoptosis.
Key words:
Brain focal ischemia, reperfusion, tissue oxymetry, apoptosis, sewer-rat, hypertension
Autoři:
F. Otevřel 1; M. Smrčka 2; Š. Kuchtíčková 1; J. Mužík 3
Působiště autorů:
Ústav normální a patologické fyziologie LFMU Brno
1; Neurochirurgická klinika FN Brno, pracoviště Bohunice
2; Centrum biostatistiky a analýz LFMU Brno
3
Vyšlo v časopise:
Cesk Slov Neurol N 2007; 70/103(2): 168-173
Kategorie:
Původní práce
Souhrn
Úvod:
Současná neurochirurgie a intenzivní medicína se často setkává s pacienty ohroženými fokální ischemií mozku. Dočasná ischemie se používá záměrně při některých neurochirurgických výkonech. V centru ischemie je tkáň ohrožena nekrózou, ale v okolní tkáni (penumbra) buňky zanikají cestou apoptózy. Systémová hypertenze může oddálit zánik buněk apoptózou ve tkáni v oblasti penumbry pravděpodobně zapojením leptomeningeálních kolaterál.
Materiál a metodika:
Použili jsme niťový model fokální ischemie mozku u potkana, který umožňuje provést kontrolovanou fokální ischemii po zvolenou dobu s dlouhodobou reperfuzí. Zkoumali jsme vliv systémové hypertenze na parciální tlak O2 v penumbrální tkáni a množství buněk zanikajících cestou apoptózy pomocí TUNEL testu. Celkem jsme operovali 70 potkanů, kteří byli rozděleni na skupiny normotenzních a hypertenzních potkanů a tyto skupiny dále na skupiny s 15 nebo 30 minutami fokální ischemie. Reperfuze trvala 48 hodin.
Výsledky:
Prokázali jsme signifikantní rozdíl (p<0,001) mezi normotenzní a hypertenzní skupinou u 15minutové ischemie jak v hodnotách ptiO2, tak v poklesu množství TUNEL+ buněk, a to ve prospěch hypertenzních potkanů. Ve srovnání 15minutové normotenzní ischemie a 30minutové hypertenzní ischemie je zajímavý signifikantní rozdíl v počátečních a koncových hodnotách ptiO2 (p<0.001) ve prospěch hypertenze, ale pokles ptiO2 není signifikantně rozdílný (p=0,141). TUNEL+ neuronů kortexu bylo méně v hypertenzní skupině (p=0,005).
Závěr:
Systémová hypertenze oddálí zánik buněk cestou apoptózy ve tkáni v oblasti penumbry. Počet TUNEL+ buněk je závislý spíše na absolutní hodnotě ptiO2 než na velikosti poklesu hodnot během ischemie. Monitoring ptiO2 v klinické praxi může proto sloužit i jako indikátor ohrožení mozkové tkáně apoptózou.
Klíčová slova:
Mozková fokální ischemie, reperfuze, tkáňová oxymetrie, apoptóza, potkan, hypertenze
Úvod
Pacienti s uzávěry mozkových tepen, pacienti po poranění mozku, ale také pacienti operovaní pro mozkové cévní patologie mohou být ohroženi následky fokální mozkové ischemie. Dočasné svorkování přívodných cév se často uplatňuje například v chirurgii mozkových aneuryzmat. Tato řízená fokální ischemie nesmí trvat příliš dlouho, protože hrozí riziko ireverzibilního ischemického poškození mozku, ale musí umožnit vlastní chirurgický výkon. Proto je nutné vědět, za jakých okolností k ireverzibilním změnám tkáně dochází, a pracovat na rozvoji neuroprotektivních metod, které by dokázaly prodloužit interval fokální mozkové ischemie bez zvýšeného rizika trvalého poškození. Jako jedna z variant se v současné době uplatňuje systémová hypertenze [1-3], kdy zvýšený krevní tlak může zmírnit škodlivý efekt fokální mozkové ischemie. Podstatou je, že prostřednictvím zvýšeného krevního tlaku se zvýší kolaterální krevní průtok (cerebral blood flow - CBF) do ohrožené oblasti. Bezprostředně po akutním uzávěru mozkové tepny dochází k významnému poklesu perfuzního tlaku v oblasti mozku zásobovaného touto tepnou. V sousedství ischemického ložiska je průtok krve zachován na normálních hodnotách. Tento děj vede ke změně v cirkulaci krve okolním mozkem a stává se podnětem pro otevření nevyužitých cévních anastomóz, které mohou vytvořit podmínky pro kolaterální zásobení ischemického ložiska krví. Díky kolaterálám potom dochází k retrográdnímu plnění krevního řečiště ischemické oblasti ze sousedních oblastí mozku, tedy ve směru nového tlakového gradientu. Nejdříve se plní ty části ischemické zóny, které jsou v bezprostředním sousedství s oblastmi dobrého průtoku (oblast ischemického polostínu - tzv. penumbra), zatímco oblasti mozku v centru ischemie jsou nejvíce ohroženy. Je pravděpodobné, že čím distálněji na mozkové cévě leží místo uzávěru, tím je ischemická oblast menší, a tím kolaterální perfúze snadněji dosáhne až k centru ischemie [4].
Léčebně aplikovaná systémová hypertenze by měla ještě zvýšit perfuzní tlak v oblastech normálního průtoku a facilitovat anastomózy, aby se krev dostala kolaterálami co nejblíže k centru ischemie. Výsledná perfuze by tak měla v rizikové oblasti zajistit takový průtok krve mozkovou tkání, který by neznamenal vývoj infarktu. Existuje množství prací, které pozitivní efekt systémové hypertenze na ložisko fokální mozkové ischemie podporují [4-8]. Zmíněná forma terapeutické intervence však není bez rizika. Bylo též prokázáno, že hypertenze může zvýšit vazogenní edém [9], umožnit makromolekulám penetraci hematoencefalickou barierou a zvýšit riziko krvácení v ischemické mozkové tkáni [10]. Všechny tyto vedlejší účinky mohou vést k redukci tlakových gradientů v mikrocirkulaci a způsobit postischemickou hypoperfuzi [11]. Výše uvedené procesy vedou ke zhoršení ischemického poškození, které se ještě prohloubí následnou reperfuzí krve po uvolnění uzávěru cévy (reperfusion injury). Rozsah nevratných škod, které nakonec vzniknou, pravděpodobně záleží nejen na intenzitě a trvání samotné ischemie, ale také na míře poškození tkáně v ischemickém ložisku na začátku reperfuze.
Zatímco v centru ischemie může docházet k nekróze tkáně, v penumbrální oblasti způsobuje porucha průtoku nastartování apoptotické kaskády. Pokud existuje korelace mezi hladinou ptiO2 a intenzitou apoptózy ve tkáni, mohl by mít monitoring ptiO2 nový klinický význam. Měření ptiO2 je dnes již zavedená klinická metoda, zatímco stanovení apoptózy v klinické praxi není dosud reálné (vyžaduje biopsii tkáně). K ověření této hypotézy jsme proto použili model fokální mozkové ischemie u potkana, který umožňuje dlouhodobou reperfuzi. Biochemickým znakem apoptózy je fragmentace genomické DNA, jde o ireverzibilní proces, jehož následkem buňky umírají. Jedná se o prelytickou fragmentaci, jenž se objevuje dříve než dochází ke změnám permeability plazmatické membrány. Apoptotická fragmentace DNA se liší od fragmentací, které provázejí jiné způsoby buněčné smrti tím, že vždy předchází změny morfologické [12]. Tato DNA fragmentace je výsledkem aktivace endogenní Ca2+ a Mg2+ - dependentní nukleární endonukleázy, která selektivně štěpí DNA v místech mezi nukleosomálními jednotkami (linker DNA) a vytváří tak mono - a oligonukleozomální fragmenty DNA [13].
Cílem této experimentální práce bylo ověření hypotézy, že existuje závislost mezi výskytem pozdních apoptotických markerů u neuronů v různých částech penumbrální tkáně a hladinou parciálního tlaku kyslíku (ptiO2) v ischemickém okrsku mozku. Zároveň jsme testovali, zda a jaký vliv má na tuto závislost přítomnost systémové arteriální hypertenze.
Materiál a metodika
Potkan rodu Wistar (250 – 400 g) přes noc lačný byl anestezován směsí Narkamonu a Rometaru 0,5 ml/100 g t.h. i.p. Operační pole byla oholena. Na hlavě byl proveden řez kůží a bylo lokalizováno místo trepanace do fronto-parietální oblasti na starně budoucího uzávěru a.cerebri media (ACM). Raspatoriem byl odstraněna galea a obnažena kost. Sterilní jehlou G14, krouživými pohyby byla opatrně provedena trepanace lebky přes obě vrstvy kosti. Luminem troakaru zavedným pod kůži v oblasti šíje bylo provlečeno čidlo pro monitoring tkáňové mozkové oxymetrie (Licox). Obnažená kost byla odmaštěna éterem a do otvoru v lebce bylo zavedeno čidlo až do kontaktu se spodinou lebeční kolmo na povrch kosti. Vytékající mozkomíšní mok byl odsát tampónem a otvor s čidlem zakápnut parafínem (obr. 1a, b).

Dále byla provedena fokální mozková ischemie umožňující dlouhodobou reperfuzi. Předpokladem je zavedení 4-0 monofilního vlákna do zaklínění v ACM [14].
Celkem bylo operováno 60 zvířat, která byla rozdělena do následujících skupin:
Normotenzní skupina (n = 30), rozdělená na 2 skupiny s délkou ischemického intervalu 15 (n = 15) a 30 (n = 15) minut.
Hypertenzní skupina (n = 30), rozdělená na dvě skupiny s délkou ischemického intervalu 15 (n = 15) a 30 (n = 15) minut.
Po skončení ischemické fáze byla nit vytažena a zvíře bylo dále observováno po dobu 48 hodin s volným přístupem k potravě a vodě. Poté bylo zvíře utraceno, mozek vyňat, ochlazen, nařezán a fixován. Systémové hypertenze bylo dosaženo u zvířat hypertenzní skupiny koarktací abdominální aorty. Tímto manévrem docilujeme u vybraných zvířat zvýšení systémové vaskulární rezistence (SVR) a jejím důsledkem je pak zvýšení středního arteriálního tlaku (MABP) o 30 - 40 torrů [15].
U všech zvířat byla udržována Sp02 90-100 %.
Pro stanovení apoptózy byly zvoleny střednědobé až pozdní známky apoptózy (TUNEL test). Tento test je dostatečně senzitivní pro stanovení exekuční fáze apoptózy. Tato metoda je založená na značení jaderných DNA fragmentů pomocí terminální deoxynukleotidyl-transferázy (TUNEL – TdT-mediated dUTP-biotin Nick End Labeling). Metoda je založena na specifické vazbě terminální deoxynukleotidyl-transferázy (TdT k 3´-OH konci DNA a následné syntéze polydeoxynukleotidu).
DNA v tkáňovém vzorku byla nejprve vystavena působení proteolytického enzymu k odstranění maskujících nukleoproteinů, pak pomocí TdT byl do míst zlomů DNA inkorporován biotinylovaný deoxyuridin, který byl vizualizován pomocí avidin-peroxidázového značícího systému.
Řezy o síle 5 µm byly odparafínovány, rehydratovány a přeneseny do destilované vody. Odstranění nukleoproteinů bylo provedeno inkubací řezů v proteináze-K (20ug-ml PBS) při pokojové teplotě na 15 minut. Aktivita endogenní peroxidázy byla zrušena 3% roztokem peroxidu vodíku při pokojové teplotě a řezy byly přeneseny do destilované vody. Značení 3´-OH konců (TDTpufr, TdT 0,3 e.u.-µl, biotinylovaný dUTP) bylo provedeno ve vlhké komůrce při 37*C na 60 minut. Aplikací avidin-peroxydázy a vyvoláním aktivity peroxidázy za pomocí DAB (diaminobenzidinu v peroxidázovém pufru) byla vizualizována pozitivní jádra. Následovalo dobarvení negativních jader. Jako „kontrabarva“ byl použit hematoxylin. Dále byly preparáty zpracovávány obligátním histochemickým způsobem (odvodnění, projasnění a montování).
TUNEL + neurony byly počítány vždy z 200 náhodně selektovaných buněk v dané a vyjádřeny v procentech.
Statistická metodika
Statistická analýza dat byla provedena pomocí software STATISTICA (data analysis software system), verze 7.1. StatSoft, Inc. (2005). www.statsoft.com. Shoda zjištěných hodnot ptiO2 a počtu TUNEL pozitivních buněk v kortexu a subkortexu mezi jednotlivými skupinami zvířat byla testována pomocí neparametrického Mannova-Whitneyova testu, hladina významnosti prokázaného rozdílu byla 0,05.
Výsledky
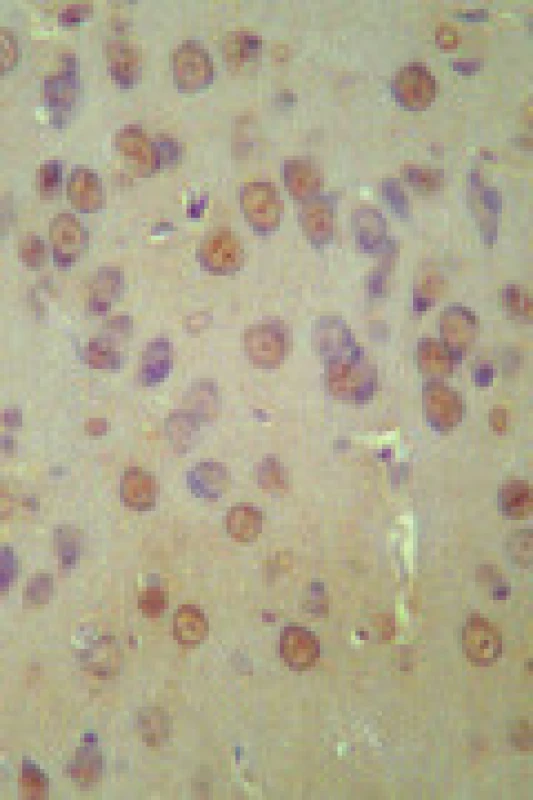
TUNEL test byl dostatečně specifický i senzitivní i pro krátkodobé ischemizace. V normotenzní skupině v 15minutovém intervalu ischemizace následované reperfuzí byla nalezena fragmentace DNA. Postiženy byly neurony kortikální i subkortikální. Fotografie TUNEL pozitivity v různých oblastech mozku ukazuje obr. 3. 30minutovou ischemii bez protektivního vlivu systémové hypertenze zvířata přežívala jen ojediněle a nebylo možno vytvořit konzistentní skupinu. Ze skupiny 30minutové ischemizace bez hypertenze přežilo pokus jenom 5 zvířat a reperfuzní fázi pouze 2. Vytvořit konzistentní skupinu nebylo možné. V hypertenzní skupině přežívala zvířata dobře i 30minutový ischemický interval.
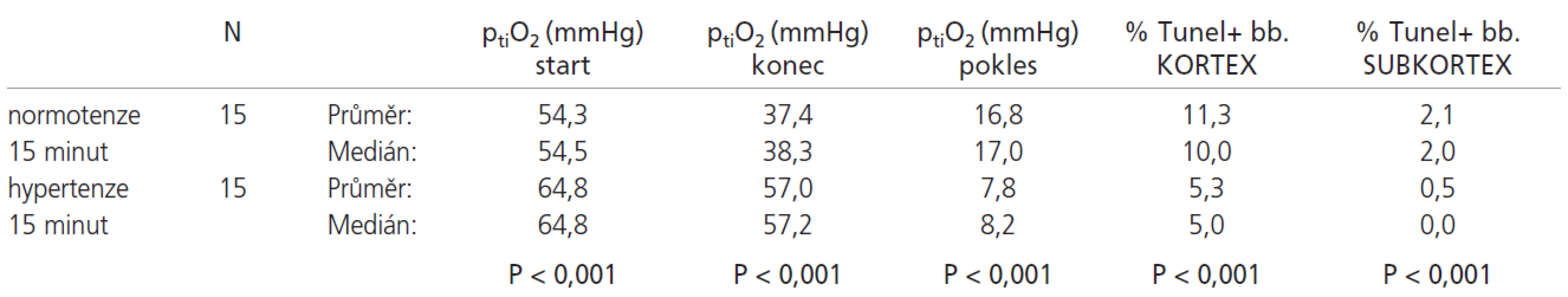
Srovnání výsledků normotenzních a hypertenzních skupin s 15minutovou ischemií uvádí tab. 1:
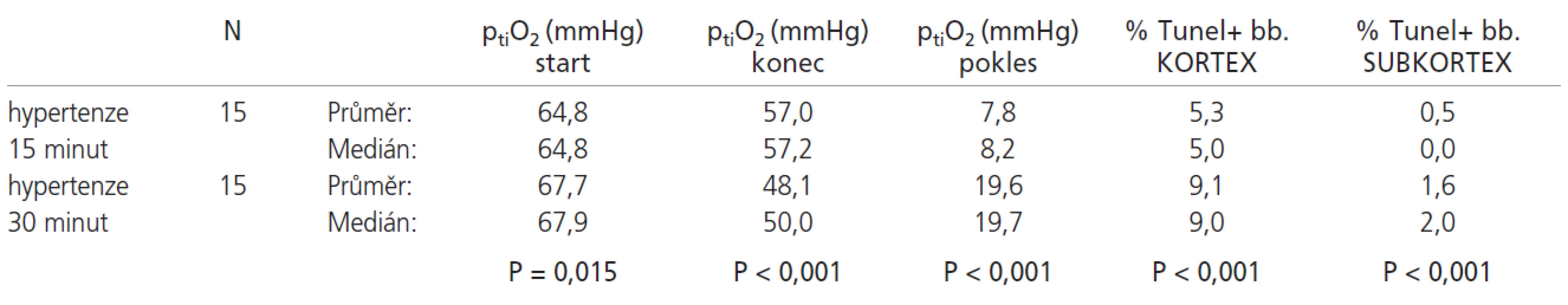
Srovnání výsledků hypertenzních skupin s 15 - a 30minutovou ischemií uvádí tab.2.
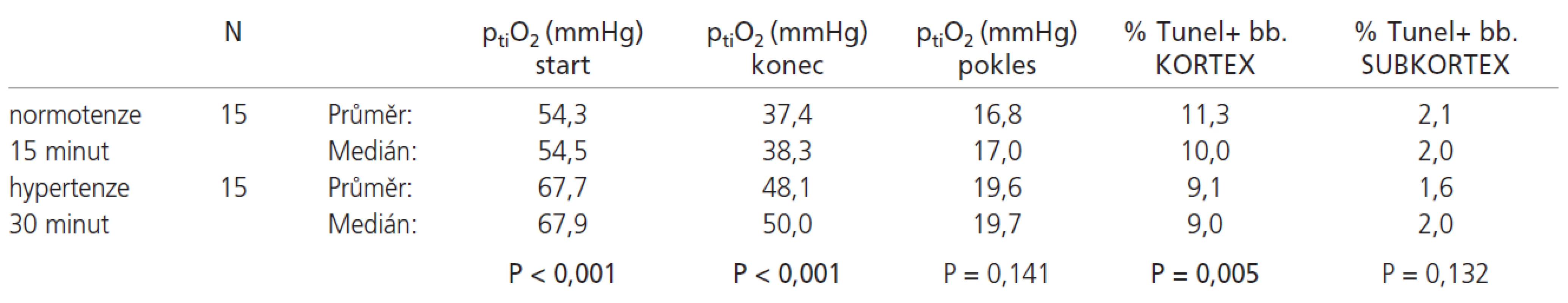
Srovnání výsledků normotenzní skupiny s 15 minutovou ischemií a hypertenzní skupiny s 30 minutovou ischemií uvádí tab. 3.
Přehledné srovnání předchozích výsledků umožňují grafy 1 a 2.


Diskuse
Nedostatkem řady experimentálních studií dočasné fokální mozkové ischemie je velmi krátce trvající doba reperfuze. Experimentální modely vyžadující extenzivní chirurgickou fázi zahrnující kraniektomii a enukleaci bulbu, jsou často mutilující a po ukončení experimentu je nutno zvíře časně utratit. Reperfuzní fáze je potom krátká (maximálně několik hodin) a výsledné poškození vykazuje jinou charakteristiku, než jakou by mělo při dostatečně dlouhé reperfuzi, kterou lze předpokládat v klinické praxi. Současný trend se orientuje na šetrné zvířecí modely, kdy po proběhlém chirurgickém zákroku dochází bez zbytečného utrpení zvířete k dlouhodobému přežití, a tak se dociluje dostatečně dlouhé reperfuzní fáze.
Ve shodě s očekáváním u 15minutové ischemizace došlo u hypertenzní skupiny ve srovnání s normotenzní ke zmenšení procenta TUNEL pozitivních jader (kortex/subkortex) z 11,33 % resp. 2,09 % na 5,26 % resp. 0,46 %. PtiO2 klesá o průměrně 16,84 mmHg u normotenzních potkanů oproti poklesu o 7,84 mmHg u navozené hypertenze (p<0,001 u všech sledovaných veličin). Potkani 30minutový ischemický interval s hypertenzí dobře přežívají, zatímco v normotenzní skupině přežila reperfuzní interval jen 2 zvířata. I tento fakt hovoří pro projektivní vliv systémové hypertenze. Zajímavé je ovšem srovnání 15minutové normotenzní ischemie s 30minutovou hypertenzní ischemií. U 30minutové hypertenzní skupiny sice dochází k nevýznamně (p=0,141) většímu poklesu ptiO2 (19,64 mmHg vs 16,84 mmHg), ale procento TUNEL pozitivních jader je v kortexu významně (p=0,005) vyšší u 15minutové ischemie bez hypertenze. V subkortikální oblasti je tento rozdíl pouze nevýznamný (p=0,132). Tato skutečnost je pravděpodobně dána vyššími absolutními hodnotami ptiO2 u hypertenze (p<0,001). Doba ischemie však byla dvojnásobná. Zajímavým vedlejším zjištěním bylo, že po vytažení nitě z MCA po 30minutové ischemii dochází nadále k poklesu ptiO2 (viz graf 2). Tento jev je možné pravděpodobně přičíst vazospazmu v oblasti střední mozkové tepny způsobeným mechanickým podrážděním cévy.
Vyšší mozkový krevní průtok (CBF) před zavedením okluze tedy zmírňuje dopad ischemie, přestože hladina ptiO2 poklesne nevýznamně více.
TUNEL test se ukázal být dostatečně senzitivní i pro krátkodobé ischemické intervaly. Procento TUNEL + buněk se mírně zvětšilo ve srovnání s naší předchozí prací [8], což přičítáme inzerci čidla do stanovované oblasti tkáně. U kontrolní neischemizované skupiny se zavedeným tkáňovým čidlem z přípravné fáze experimentu (n = 10) byla nalezena jen ojedinělá TUNEL pozitivní jádra. Další nárůst pozitivity je tedy možné přičíst ischemizaci. Zpočátku bylo překážkou validního měření hodnot tkáňové oxymetrie konstrukce čidla Licox. Měřící zóna čidla má cca 7 mm a k ní je ještě nutno připočíst cca 3 - 4 mm zaváděcího konce. Z výše uvedeného vyplývá, že čidlo je třeba zavést minimálně 11 mm hluboko do tkáně s vyloučením vlivu okolní atmosféry. Laboratorní potkan (podle tělesné hmotnosti) má v místě měření průměr mozku srovnatelný nebo dokonce menší. Tuto technickou potíž jsme řešili zkrácením zaváděcí části čidla (což nemělo vliv na samotná měření) a zakápnutí odmaštěné lebky v místě trepanace parafínem.
Stanovení TUNEL pozitivity jader (ireverzibilní fáze apoptózy) a současné měřením tenze tkáňového kyslíku je zatím možné pouze v experimentu. I přes metodologické výhrady, které nám brání automaticky extrapolovat naše závěry z experimentu s potkanem na člověka, je možné se přiblížit k porozumění dějů na úrovni buněk v lidském mozku, ke kterým zatím u pacientů nemáme přístup. Tyto poznatky mohou být využitelné u pacientů v neurointenzivní péči (poranění mozku, subarachnoidální krvácení, mozková ischemie) nebo při neurochirugických výkonech (použití dočasného klipu v chirurgii aneuryzmat, u bypassů). Nitrolební tlak a mozkový perfuzní tlak jsou globální parametry, které nemusí odrážet skutečnou situaci metabolizmu zvláště v nejvíce ohrožených („penumbrálních“) regionech mozku. Monitorace ptiO2 v postižené oblasti nám podává přesnější informace o regionálním metabolizmu. Naše experimentální práce prokazuje, že mozková ischemie s poklesem tkáňového kyslíku, která nemusí nutně vést k nekróze tkáně, může vést k rozvoji apoptózy neuronů. Zjišťujeme, že hodnota ptiO2 je významný faktor určující, zda neurony nastupují ireverzibilní fázi apoptózy a monitoring tkáňové oxymetrie tak dostává novou dimenzi. Další práce jsou potřebné ke zjištění, zda existuje konkrétní hladina tkáňového kyslíku u člověka, kdy dochází k iniciaci apoptózy, eventuálně jak dlouhý časový interval při určité hodnotě ptiO2 vede k nástupu apoptózy v mozkové tkáni.
Závěrem je možno konstatovat, že jsme prokázali na zavedené metodice modelu fokální mozkové ischemie u potkana významnou korelaci mezi hladinou ptiO2, a přítomností apoptotických neuronů a dále protektivní vliv systémové hypertenze. S jistou dávkou aproximace lze říci, že hladina tkáňového kyslíku je jeden z významných ukazatelů napovídajících, že neurony v oblasti penumbry již nastoupily cestu zániku apoptózou. Tento děj lze významně ovlivnit navozením systémové hypertenze.
Tato práce byla podporována grantem č. 8000-3 Interní Grantové Agentury Ministerstva zdravotnictví ČR.
MUDr. Filip Otevřel
KARIM FN Brno
Jihlavská 20
625 00 Brno
E-mail: filip.otevrel@otesound.cz
Přijato k recenzi: 28. 7. 2009
Přijato do tisku: 14. 9. 2007
Zdroje
1. Darby JM, Yonas H, Marks EC, Durham S, Snyder RW, Nemoto EM. Acute cerebral blood flow response to dopamine-induced hypertension after subarachniod hemorrhage. J Neurosurg 1994; 80 : 857-64.
2. Brown FD, Hanlon K, Mullan S. Treatment of aneurismal hemiplegia with dopamine and manitol. J Neurosurg 1978; 49 : 525-9.
3. Wise G, Sutter R, Burkholder J. The treatment of brain ischemia with vasopressor drugs. Stroke 1972; 3 : 135-40.
4. Drummond JC, Oh YS, Cole DJ, Shapiro HM. Phenylephrine-induced hypertension reduced ischemia following middle cerebral artery occlusion in rats. Stroke 1989; 20 : 1538-44.
5. Cole DJ, Drummond JC, Matsamura JS, Marcantonio S, Chi-Lum BI. Hypervolemic-hemodilution and hypertension during temporary middle cerebral artery occlusion in rats: effect on blood-brain barrier permeability. Can J Neurol Sci 1990; 17 : 372-7.
6. Cole DJ, Drummond JC, Ruta TS, Peckham NH. Hemodilution and hypertension affects on cerebral hemorrhage in cerebral ischemia in rats. Stroke 1990; 21 : 1333-9.
7. Ogilvy CS, Carter B, Kaplan S, Rich C, Crowell RM. Temporary vessel occlusion for aneurysm surgery: risk factors for stroke in patients protected by induced hypothermia and hypertension and intravenous manitol administration. J Neurosurg 1996; 84(5): 785-91.
8. Smrčka M, Horký M, Otevřel F, Kuchtičková Š, Kotala V, Mužík J. The Onset of Apoptosis of Neurons Induced by Ischemia-Reperfusion Injury Is Delayed by Transient Period of Hypertension in Rats. Phys Res 2003; 52 : 117-22.
9. Katzo I. Brain edema following brain ischemia and the influence of the therapy. Br J Anesth 1985; 57 : 18-22.
10. Cole DJ, Drummond JC, Osborne TN, Matsamura J. Hypertension and hemodilution during cerebral ischemia reduce brain injury and edema. Am J Physiology 1990; 259: H211-7.
11. Schurer L, Grogaard B, Arfors KE, Gerdin B. Is postischemic hypoperfusion related to brain edema? Adv Neurol 1990; 52 : 155-64.
12. Kolář Z. Úvod do molekulární patologie a onkologie. Olomouc: Vydavatelství Palackého univerzity 1997 : 48.
13. Rosypal S. Úvod do molekulární biologie. Díl 2. Molekulární biologie eukaryot. 3. ed. Brno: Stanislav Rosypal 1999 : 600 s.
14. Smrčka M, Otevřel F, Kuchtíčková Š, Horký M, Juráň V, Duba M et al. Experimental Model of Reversible Focal Ischemia in The Rats. Scripta medica 2001; ročník: 391-8.
15. Horký M, Horský P, Kolář F. Different onset of nucleolar activation in endocardial endothelial cells and cardiomyocytes following presure oveload in rat heart. J Mol Cell Cardiol 1997; 29 : 2475-81.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2007 Číslo 2
Nejčtenější v tomto čísle
- Epilepsie a cyklus spánku a bdění
- Súčasný pohľad na diagnostiku a terapiu afázie
- Komplikace operací z předního přístupu pro degenerativní onemocnění krční páteře
- Zhoršování epileptických záchvatů a epilepsií antiepileptiky - je to možné?



