Doporučení pro strukturální zobrazení MR mozku v diagnostice epilepsie
Recommendations for structural brain MRI in the diagnosis of epilepsy
Epilepsy affects about 0.5-1.5% of the population, of which approximately 30% of patients are drug-resistant. The importance of MRI in diagnosis lies mainly in the detection of structural etiology of the disease, assessing the patient‘s prognosis and, to a limited extent, planning appropriate treatment. Despite technological advances and technical equipment in medical centers, there is a considerable inconsistency in the MRI protocols used for structural brain imaging in patients with epilepsy. We aim to recommend a standardized MR structural brain imaging protocol for patients with epilepsy based on current international recommendations. Its widespread implementation will enable the establishment of a unified neuroimaging platform in the Czech Republic for these indications.
Keywords:
Epilepsy – magnetic resonance imaging – structural brain imaging
Authors:
M. Kynčl 1*; Z. Holubová 1*; Jaroslav Tintěra 2; N. Profantová 1; J. Šanda 1; D. Kala 3; Y. Prysiazhniuk 4; M. Kudr 5; P. Kršek 5; A. Kalina 6; J. Zárubová 6; V. Komárek 5; J. Otáhal 7; P. Marusič 6
Authors‘ workplace:
Oba autoři přispěli rovným dílem.
*; Klinika zobrazovacích metod 2. LF UK a FN Motol, Praha
1; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha
2; Fyziologický ústav AV ČR
3; Ústav fyziologie, 2. LF UK, Praha
4; Klinika dětské neurologie 2. LF UK a FN Motol, Praha
5; Neurologická klinika 2. LF UK a FN Motol, Praha
6; Ústav patologické fyziologie, 2. LF UK, Praha
7
Published in:
Cesk Slov Neurol N 2023; 86(1): 18-24
Category:
Review Article
doi:
https://doi.org/10.48095/cccsnn202318
Overview
Epilepsie postihuje asi 0,5–1,5 % populace, z čehož přibližně 30 % pacientů vykazuje farmakorezistenci. Význam MR v diagnostice spočívá zejména v odhalení strukturální etiologie onemocnění, zhodnocení prognózy pacienta a limitovaně i v plánování odpovídající léčby. Navzdory technologickému pokroku v přístrojovém a technickém vybavení zdravotnických pracovišť panuje velká nejednotnost v oblasti protokolů MR využívaných ke strukturálnímu zobrazení mozku u pacientů s epilepsií. Cílem našeho sdělení je doporučení standardizovaného MR protokolu strukturálního zobrazení mozku u pacientů s epilepsií, které vychází ze současných mezinárodních doporučení. Jeho široká implementace umožní v České republice nastavit jednotnou platformu neurozobrazení v těchto indikacích.
Klíčová slova:
epilepsie – magnetická rezonance – strukturální zobrazení mozku
Úvod
Magnetická rezonance představuje nepostradatelnou diagnostickou modalitu pro neinvazivní anatomické zobrazení mozku u pacientů s epilepsií i u pacientů po ojedinělém epileptickém záchvatu nebo epileptickém statu. Význam zobrazení MR spočívá zejména ve zjištění lokalizace a rozsahu potenciálně epileptogenních strukturálních změn mozku, zhodnocení prognózy pacienta a v některých případech i plánování odpovídající léčby.
Epilepsie postihuje asi 0,5–1,5 % populace, přičemž zhruba 30 % pacientů vykazuje farmakorezistenci [1–3]. Farmakorezistentní epilepsie zatěžuje pacienty svým mnohdy fatálním průběhem, léčba je velmi nákladná a ovlivňuje citelně i ekonomiku zdravotních systémů [4]. Pacienti s fokální farmakorezistentní epilepsií přitom mohou po resekčním epileptochirurgickém výkonu dosáhnout dlouhodobého stavu bez záchvatů, a tím i významného zlepšení kvality života [4,5]. Nezávislými faktory určujícími úspěšnost takových zákroků jsou abnormální histopatologický nález v resekátu, mladší věk při operaci, epileptochirurgie provedená v temporálních oblastech a krátká doba trvání onemocnění před operací [6]. Mezi časté indikace k operačnímu řešení náleží meziotemporální epilepsie (MTLE) spojená s hipokampální sklerózou (HS) a epilepsie na podkladě různých malformací kortikálního vývoje, nejčastěji fokální kortikální dysplazie (FCD) [2]. Vyšší pravděpodobnost dosažení stavu bez záchvatů mají po epileptochirurgickém výkonu pacienti s benigními mozkovými nádory sdruženými s epilepsií (long-term epilepsy associated tumors; LEAT) a pacienti s HS, horší pooperační prognózu mají naopak pacienti s FCD typu I [6]. MR má tedy důležitou roli v selekci pacientů, kteří budou z epileptochirurgického zákroku profitovat.
Strukturální MR při zařazení základních sekvencí T1, T2 a T2/FLAIR přináší makroskopickou anatomickou informaci o struktuře, uspořádání a signálu mozkové tkáně. Oproti tomu techniky pokročilého MR zobrazení mohou detekovat subtilnější změny bílé a šedé hmoty a zaměřují se detailně na sledování funkce a propojení jednotlivých oblastí mozku. Mezi pokročilé MR techniky řadíme zatím převážně výzkumně využívané sekvence zobrazení tenzoru a kurtózy difuze (DTI/DKI), kvantitativní T1 sekvence (qT1) a sekvence zobrazující perfuzi mozkové tkáně nebo poruchu hematoencefalické bariéry, jako jsou dynamické kontrastní sycení (dynamic contrast-enhanced; DCE), dynamický susceptibilní kontrast (DSC) a arterial spin labeling (ASL) [7–11]. Mezi pokročilé techniky MR patří také funkční MR (fMR) [12].
Při strukturálním zobrazování MR mozku v rámci diagnostiky epileptogenních lézí je kladen důraz zejména na volbu vhodného vyšetřovacího protokolu [13–15].
Pokud není MR provedena v adekvátním protokolu a MR nález není zhodnocen správně, dojde k významnému ovlivnění následného diagnostického i léčebného postupu. U farmakorezistentních pacientů s přetrvávajícím podezřením na fokální epilepsii je vhodné strukturální MR zobrazení mozku zopakovat [16]. Ruku v ruce s co nejpřesnějším zobrazením jde také expertní hodnocení MR nálezů zkušeným neuroradiologem [17,18]. Sekvence MR by měly být hodnoceny neuroradiologem, který se specializuje na epileptologii, nejlépe s možností ještě dalšího čtení nálezu společně s epileptologem [12]. Velmi užitečné pro neuroradiologické zhodnocení obrazů MR je podrobně se seznámit s anamnézou pacienta, mít k dispozici výsledky předchozích vyšetření, zejména elektroklinické diagnózy, a znát podezření epileptologa na pravděpodobnou lokalizaci léze. Toto vše umožňuje přesnější zhodnocení nálezu na mozku a zvyšuje výtěžnost MR při detekci epileptogenní léze.
Specifickou problematiku v epileptologii představuje zobrazení mozku v dětském věku. Při hodnocení typů FCD lézí v MR obraze u dětí např. nelze spoléhat na přesné měření šíře kortexu [19]. Šíře kortexu je v tomto období velmi variabilní, mění se s věkem, s postupem myelinizace bílé hmoty, podle oblastí mozku i s podílem získaných lézí nebo stavem po proběhlém epileptickém záchvatu. U dětí s předpokládanou fokální epilepsií a pokračující myelinizací mozkové tkáně je v případě iniciálně normálního neurozobrazení nezbytné vyšetření MR s časovým odstupem zopakovat.
Z výše uvedeného vyplývá potřeba standardizovat a zavést dedikovaný strukturální MR protokol u pacientů s epilepsií, který umožní detailní zobrazení mozku zaměřené zejména na signálově, strukturálně a věkem ovlivněné nálezy.
Při formulování parametrů pro MR zobrazení mozku a pro následné neuroradiologické zhodnocení nálezu je vhodné znát tato východiska:
- jaké je minimum potřebné pro provedení strukturálního zobrazení MR mozku, co se týče technického vybavení, rozsahu zobrazení a počtu sekvencí;
- jak zvýšit pravděpodobnost detekce epileptogenní léze;
- jak vzniklé strukturální obrazy MR hodnotit.
Vývoj protokolů MR v čase
Základem pro jakýkoli standardní protokol zobrazení MR mozku je využití všech základních rovin zobrazení (axiální, koronální a sagitální rovina) a základních typů sekvencí (T1, T2 a T2/FLAIR), nejlépe s možností následné multiplanární analýzy zrekonstruovaných dat [20]. První protokoly určené pro zobrazení v epileptologii vznikaly a byly využity na přístrojích o síle 1,5T. V doporučeních Mezinárodní ligy proti epilepsii (International League Against Epilepsy; ILAE) z roku 1997 [21] již bylo zobrazení MR uvedeno jako základní strukturální vyšetření mozku u pacientů s epilepsií. Zdůrazňovalo se zakomponování sekvencí T1 i T2 s pokrytím celého objemu mozku a rovněž potřeba provedení vyšetření v nejméně dvou na sebe kolmých rovinách. V ideálním případě bylo vhodné použít objemové (3D) akvizice dat s šíří řezu menší nebo rovnou 1,5 mm.
V roce 2013 autoři Wellmer et al [14] publikovali návrh vycházející z výsledků rozsáhlého výzkumu zaměřeného na zobrazení pacientů před epileptochirurgickým výkonem a popsali výtěžnost jednotlivých sekvencí MR pro detekci epileptogenní léze.
Recentní doporučení ILAE z roku 2019 [15] přináší souhrn protokolu s obsahem sekvencí 3D v takzvaném harmonizovaném neurozobrazení epileptických strukturálních sekvencí (HARNESS-MR). Poprvé jsou uvedena i doporučení typů hlavových cívek pro vyšetření mozku. Jedná se o vícekanálové segmentové phased-array cívky s počtem 8, 12 nebo 32 kanálů a s možností paralelního zobrazení [15].
Technické parametry sekvencí MR
Základem většiny běžných vyšetření mozku jsou 2D sekvence. U těchto sekvencí je každá vrstva excitována selektivním radiofrekvenčním (RF) pulzem, nejmenší dosažitelná tloušťka vrstvy je kolem 2 mm. Praktickým omezením jsou limitovaná délka a amplituda pulzu formující reálný profil vrstvy, které řez nevymezí dokonale ostře. Větší tloušťka vrstvy spolu s neideálním profilem vede k efektu částečného objemu (partial volume effect). Silná anizotropie prostorového rozlišení daná větší tloušťkou vrstvy, než jsou rozměry obrazového pixelu, neumožňuje z takových dat provádět následné multiplanární prostorové rekonstrukce (MPR).
Alternativním přístupem je využití 3D sekvencí, kdy je celý vyšetřovaný objem tkáně excitován jedním RF pulzem a vrstvy jsou získány prostorovým kódováním signálu. To umožní získat vrstvy se submilimetrovou tloušťkou, optimálním profilem a možností zobrazení ostré hrany vrstvy. Profil vrstvy se pozitivně projeví na zvýšení kontrastu obrazu. Získaná data také umožňují prostorové rekonstrukce v libovolném směru, kdy orientace a směr originálně naměřených vrstev nehrají zásadní roli. Prostorové kódování vrstev je však časově náročné, akviziční doba roste lineárně s počtem vrstev. Čím mají zvolené vrstvy menší šířku, tím je potřeba většího množství vrstev k pokrytí objemu mozku. Oproti 2D sekvencím je u 3D zobrazení a náběru dat nutné počítat s delší dobou měření, někdy dvoj - až trojnásobnou.
Vyšetření MR kombinuje obrazy, jejichž kontrast je založen na rozdílech v T1 nebo v T2 vážení. Pro T1 kontrast jsou nejčastěji používány 3D sekvence gradientního echa (MP-RAGE). Pro T2 jsou to rychlé varianty 3D spinového echa (SPACE, CUBE, VISTA – podle výrobce přístroje). Praktická realizace takových sekvencí byla umožněna s nástupem vyspělého hardware přístrojů MR, kterými jsou vysoké magnetické pole a multielementové vícekanálové phased-array přijímací RF cívky. Nesporný význam při zobrazování v epileptologii má rovněž T2 3D sekvence s potlačením signálu mozkomíšního moku – sekvence FLAIR. 3D FLAIR (SPACE, CUBE, VISTA – podle výrobce přístroje MR) poskytuje vysokou detekční schopnost pro tkáňové změny typu gliózy v bílé hmotě mozku a umožní zobrazit detailní alterace signálu u drobných lézí typu FCD.
Další sekvence využitelné v epileptologii
Kromě sekvencí, které jsou v uživatelských verzích dostupné u většiny přístrojů MR, dochází k vývoji nových, zatím ne vždy validovaných sekvencí, které však mohou přinést cenné dodatečné diagnostické informace.
Double inversion recovery (DIR) je pulzní sekvence, která je modifikací sekvence FLAIR rozšířením o další inverzní RF pulz. Sekvence tak pomocí dvou inverzních RF pulzů a dvou různě dlouhých inverzních časů TI (TI1 ~ 3 400 ms, TI2 ~ 325 ms) potlačuje jak signál bílé hmoty, tak i signál mozkomíšního moku. Sekvence poskytuje dobrý tkáňový kontrast s vysokou schopností detekovat léze v bílé hmotě [22].
MP2RAGE je modifikací sekvence MP-RAGE, i zde se jedná o rozšíření o další inverzní RF pulz a další interval TI. V tomto případě jsou však měřeny dvě sady obrazů s odlišným TI. Právě volbou TI (TI1 ~ 700 ms, TI2 ~ 2 500 ms) lze dosáhnout velmi odlišného kontrastu v obrazech, což také umožňuje další kvantifikaci parametrů tkání pomocí postprocessingu.
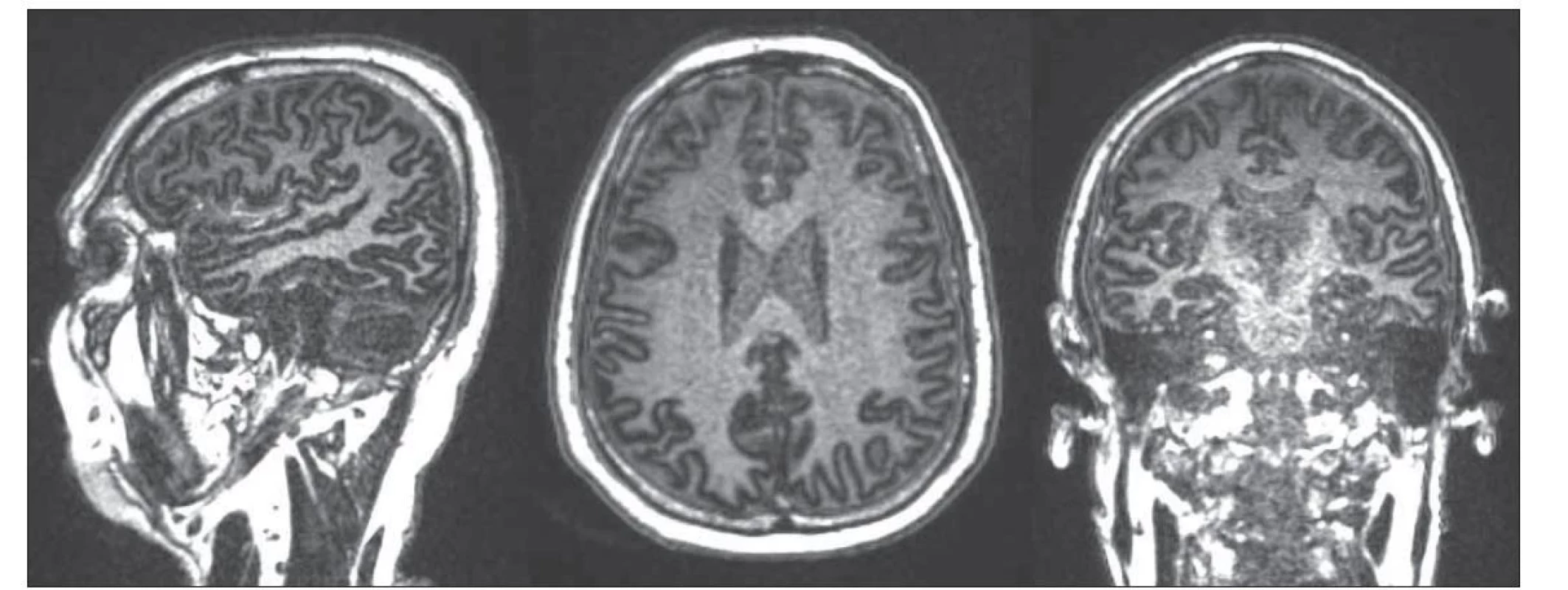
3D Edge-Enhancing Gradient Echo (3D-EDGE) sekvence je v principu MP-RAGE s přesně zvoleným TI, a to tak, aby šedá a bílá hmota dávaly stejný signál, avšak opačné fáze (je to trochu analogické s in-phase a opposed-phase zobrazením tuku a vody) (obr. 1). Díky rozdílné fázi se signál v hraničních voxelech mezi bílou a šedou hmotou odečte, protože obsahují oba typy tkání. V normálním rozhraní tak vznikne úzká hyposignální linka mezi šedou a bílou hmotou, čímž sekvence detailněji zobrazí jejich hranici. Sekvence 3D-EDGE byla použita i v rámci MP2RAGE jako jeden za dvou data setů s TI = 700 ms [23]. V této studii právě sekvence 3D-EDGE ukázala lepší výsledky ve srovnání s používanými sekvencemi MPRAGE, FLAIR a DIR především v detekci méně nápadných FCD [23].
Sekvence pořízená v sagitální rovině s následnou multiplanární rekonstrukcí do axiální a koronální roviny.
Fig. 1. Example of a 3D Edge-Enhancing Gradient Echo sequence (3D-EDGE). More detailed visualization of gray-white matter border.
Sequence acquired in the sagittal plane followed by multiplanar reconstruction in the transverse and coronal planes.
Principu MP2RAGE využívá i sekvence fluid and white matter supression (FLAWS), tedy specificky volené dva TI (TI1 ~ 400 ms, TI2 ~ 1 100 ms). Vzniknou dva sety 3D zobrazení ve dvou odlišných inverzních časech s tím, že dojde k potlačení signálu bílé hmoty a signálu mozkomíšního moku [24]. Synteticky vypočtený FLAWS obraz obsahuje prakticky pouze šedou hmotu. Obrazy této sekvence jsou specifické citlivostí k signálu kortexu.
Doporučení pro strukturální zobrazení MR
Naše doporučení pro vyšetření pacientů s epilepsií je konsenzuální s doporučením ILAE, které bylo publikováno v roce 2019 [15].
Níže uvedené protokoly se sekvencemi strukturálního zobrazení MR mozku pro pacienty s epilepsií je možné využít jak u pacientů v péči ambulantních neurologů, tak i v centrech pro epilepsie. Doporučujeme provádět vyšetření na strojích s vyšším magnetickým polem 3T. Sekvence je možné využít pro jakýkoli věk, vč. vyšetření dětí vyžadujících celkovou anestezii.
Naše doporučení pro strukturální MR protokol zahrnuje následující sekvence (tab. 1):
- 3D T1 (MP-RAGE)
- 3D T2 (SPACE, CUBE, VISTA)
- 3D FLAIR (SPACE, CUBE, VISTA)
- 2D T2 turbo spin echo (TSE) 2mm koronální sekvence s rovinou kolmou na dlouhou osu hipokampu
- 2D DWI
- 3D/2D SWI.
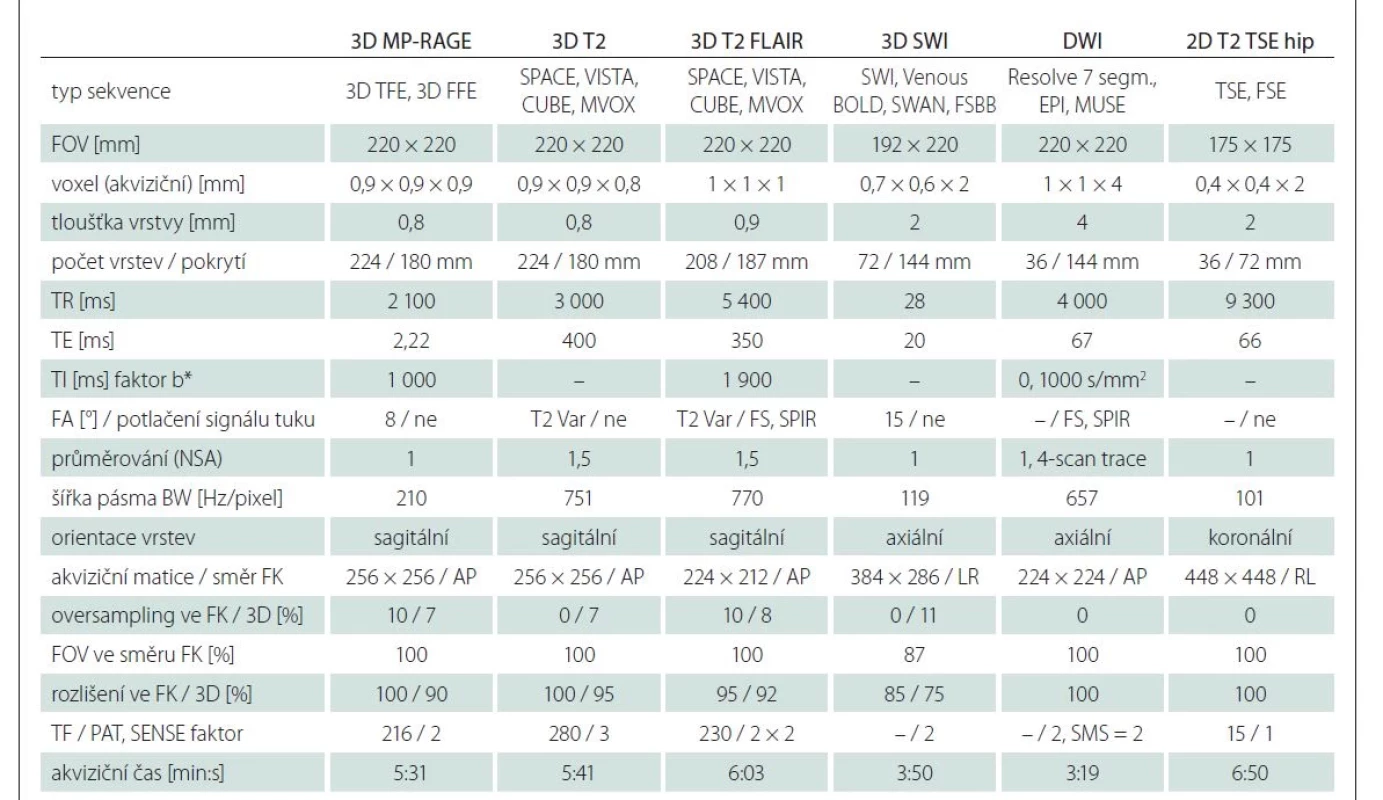
směr AP – směr anterior-posterior; BW – bandwidth; DWI – difuzně vážené obrazy; FA – flip angle; směr FK – směr fázového kódování; FOV – field-of-view; FS – technika potlačení signálu tuku Fat Sat; NSA – number of averages; PAT, SENSE – paralelní akviziční techniky; směr RL – směr pravo-levý; SMS – simultánní náběr více vrstev; SPIR – spectral presaturation with inversion recovery; TE – time to echo; TF – Turbo faktor (ETL); TI – inverzní
čas; TR – repetition time
Prostorové rozlišení 3D sekvencí je mezi 0,7 × 0,7 × 0,7 mm a 1 × 1 × 1 mm, v kontinuálním zobrazení. Kombinuje informace různých typů kontrastu obrazu a vysokého prostorového rozlišení. Rozlišení 3D sekvencí nižší než 1 × 1 × 1 mm zřetelně snižuje možnosti vzájemného porovnání snímků a výrazně omezuje uplatnění sofistikovaných postprocessingových metod.
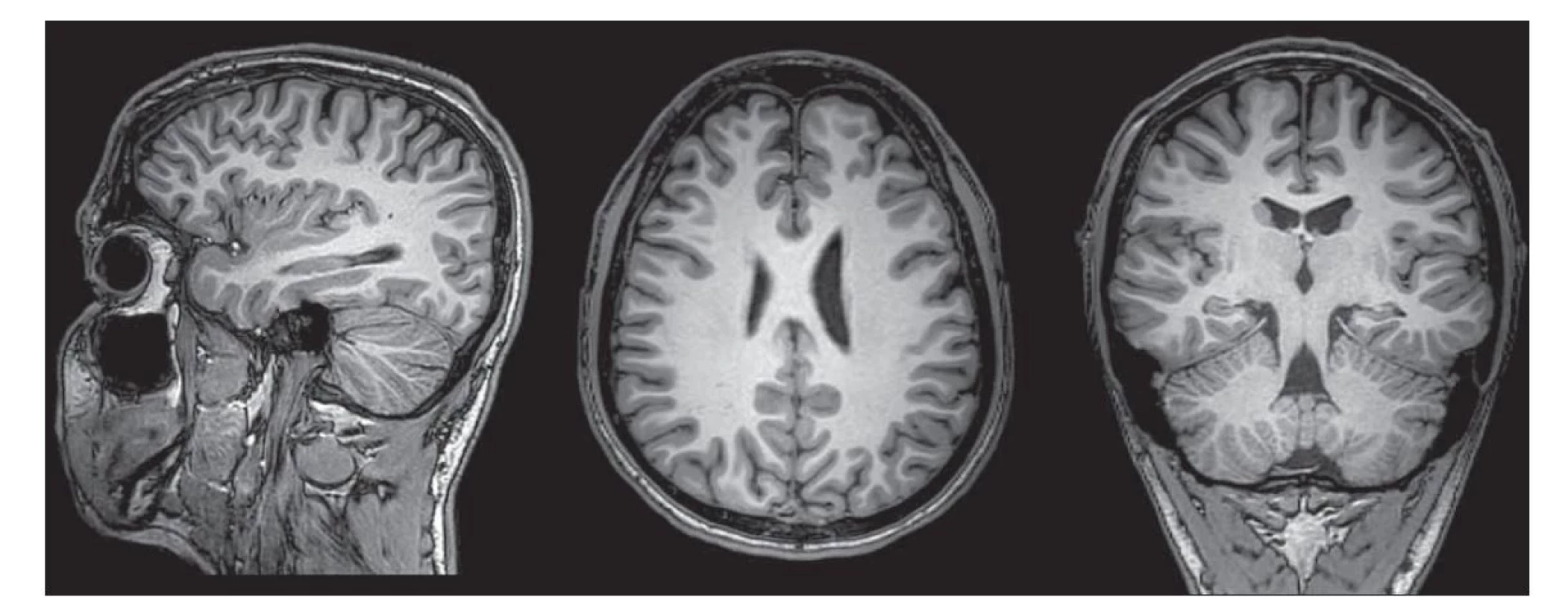
Sekvence T1 3D vykreslují detailně anatomii mozku, uspořádání, charakter a plynulost gyrifikace, jsou citlivé ke změně signálu kortexu zejména u lézí FCD typu II (obr. 2).
Fig. 2. 3T MRI, 30-channel head coil. 3D T1 MPRAGE sequence acquired in the sagittal plane followed by multiplanar reconstruction in
the transverse and coronal planes.
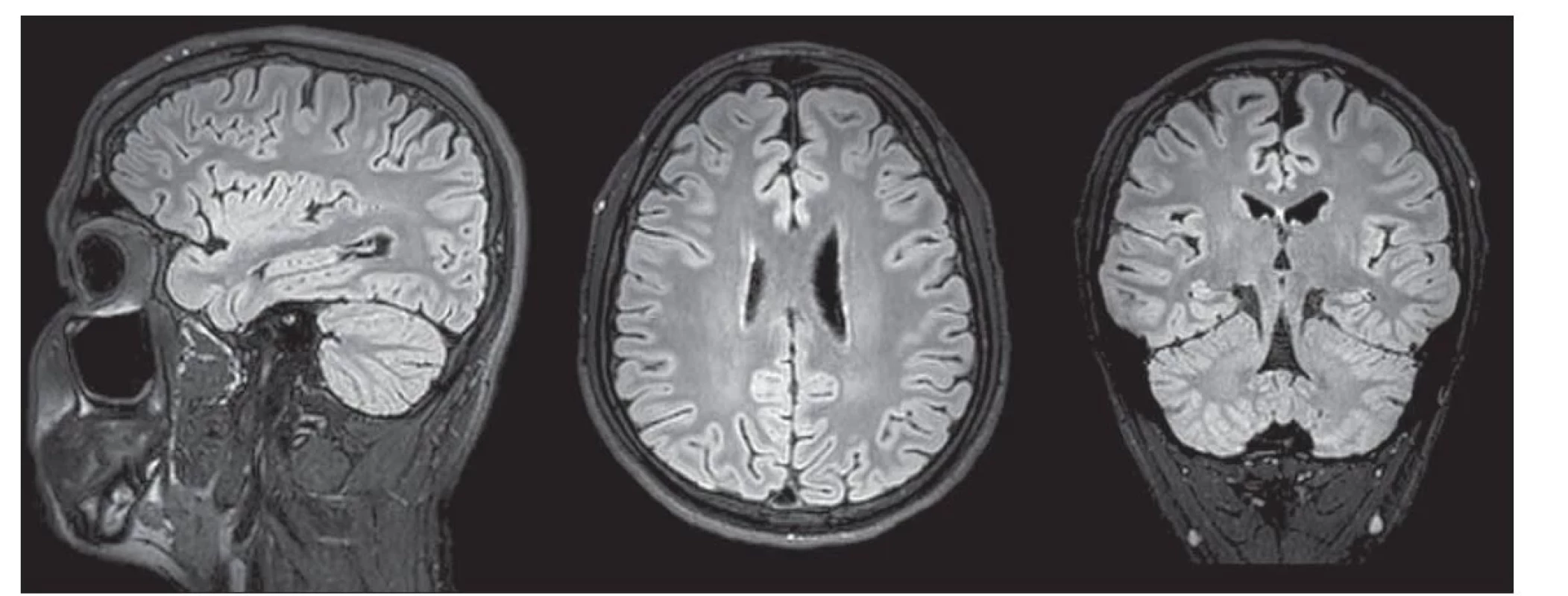
Zobrazení FLAIR 3D umožňuje zhodnocení změny signálu kortexu, bílé hmoty a jejich rozhraní, lépe než ostatní sekvence odhalí možnou pruhovitou extenzi změn signálu kortexu do periventrikulární oblasti – obraz transmantle změn (obr. 3). Díky potlačení signálu mozkomíšního moku jsou tyto sekvence vhodné ke zvýšení viditelnosti hyperintenzních periferních kortikálních lézí [15]. Sekvence FLAIR sice mohou mít svá omezení v detekci lézí a změn signálu u dětí do 24 měsíců věku z důvodu nedokončené myelinizace bílé hmoty [19], přesto je pro jejich komplexnost a poskytovanou informaci doporučujeme zařadit do protokolu dedikovaného strukturálního zobrazení.
Fig. 3. 3T MRI, 30-channel head coil. 3D FLAIR VISTA sequence acquired in the sagittal plane followed by multiplanar reconstruction in
the transverse and coronal planes.
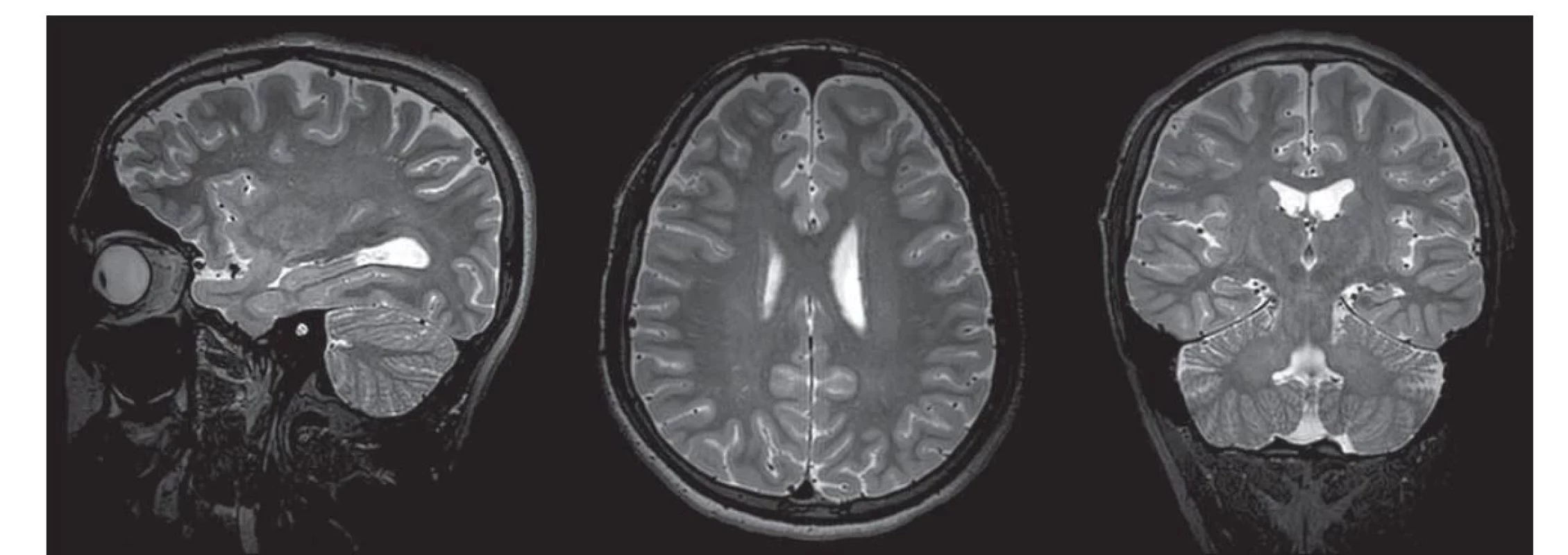
T2 sekvence v 3D zobrazení výrazně snižují možnost vzniku partial volume efektu, poskytují informaci jak o morfologii v rámci anatomického uspořádání struktur, tak i o signálových varietách (obr. 4). 3D T2 sekvence v sagitální MPR rekonstrukci jsou citlivé k detekci drobných temporálních encefalokél, jejichž časná detekce může pomoci při rozvaze o uskutečnění epileptochirurgického výkonu [25]. 3D T2 sekvence jsou hlavní technikou zobrazení struktury mozku u dětí.
Fig. 4. 3T MRI, 30-channel head coil. 3D T2 VISTA sequence acquired in the sagittal plane followed by multiplanar reconstruction in the
transverse and coronal planes.
3D sekvence jsou doplněny sekvencemi susceptibilně váženými (SWI, SWAN, VenBold – název podle jednotlivých výrobců přístrojů MR), které jsou senzitivní k potenciálním ložiskům depozit hemosiderinu nebo kalcia, a klasickou difuzně váženou sekvencí (DWI) s šířkou řezu jednotlivých vrstev 3–4 mm. SWI sekvence je formou sekvence gradientního echa (GRE), která je citlivá ke změnám susceptibility tkání způsobených nehomogenitami v magnetickém poli. Díky vzniku magnitudového i fázového zobrazení můžeme od sebe signálově odlišit kalcifikaci a hemosiderin. Sekvence je vhodná i pro detekci komplexních nebo komplikovaných cévních a vývojových žilních anomálií [26].
Přínosem echoplanární (EPI) sekvence DWI je především informace o změnách difuze postižených oblastí mozku po proběhlém epileptickém záchvatu nebo epileptickém statu [27], odhalení charakteristik svědčících pro potenciálně maligní formy expanzivního procesu a podobně.
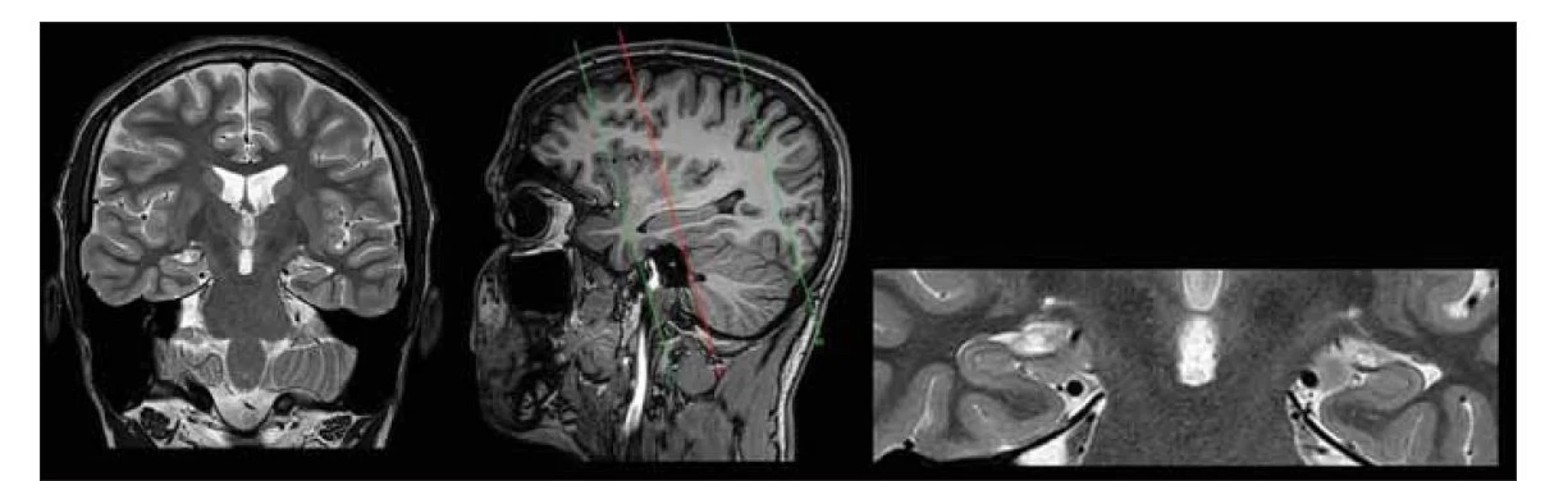
Sekvencemi pro detailní zhodnocení struktur hipokampu jsou 2D TSE koronální sekvence umístěné kolmo na dlouhou osu hipokampu s vysokým rozlišením a submilimetrovou rezolucí voxelu 0,4 × 0,4 × 2,0 mm, v kontinuálním zobrazení, bez ponechaného prostoru mezi jednotlivými řezy (obr. 5). Rozsah pokrytí celého hipokampu je ventrodorzálně v délce 72 mm.
Fig. 5. 3T MRI, 30-channel head coil, T2 2D TSE, coronal plane perpendicular to the long axis of the hippocampus; anisotropic image
measuring 0.4 × 0.4 × 2.0 mm.
Vizuální hodnocení nálezů v epileptologii
Při diagnostice v epileptologii je stěžejní souběžné hodnocení morfologie mozku a jeho signálu, který v daných sekvencích poukazuje na změny ve složení tkáně, odchylky myelinizace bílé hmoty nebo podíly kalcifikací. Při strukturálním zobrazení MR za použití 3D sekvencí vzniká velké množství výsledných obrazů (řezů), které je potřebné zhodnotit. V rovině náběru dat vznikne při pokrytí celého objemu mozku/hlavy přibližně 170 řezů. Rekonstrukční intervaly nedoporučujeme provádět širší než 1 mm. Výhodou zobrazení v 3D je možnost vzájemného současného porovnání zkoumané oblasti v koronální, axiální i sagitální rovině. Taková komparace je užitečná především v oblastech se složitou topoanatomií kortexu, při překryvu sulků a kontury kortexu a podobně.
S rostoucím významem diagnostiky pomocí MR v epileptologii je potřeba neuroradiology v této problematice cíleně vzdělávat. Zásadní úlohu v takové edukaci by měla mít Centra vysoce specializované péče pro pacienty s farmakorezistentní epilepsií, pracoviště s vysokou koncentrací pacientů s epilepsií a kvalitou dedikovaných zobrazení, univerzity i lékařské společnosti.
Možnosti zpracování morfologických dat pro zvýšení pravděpodobnosti detekce epileptogenní léze –postprocessing
Navzdory neustálému technickému pokroku může mnoho lézí při rutinním vizuálním hodnocení uniknout záchytu. Bylo prokázáno, že až 60 % případů MR negativní farmakorezistentní fokální epilepsie je způsobeno FCD [28]. Je tedy třeba usilovat o optimalizaci a zdokonalení technik, které data matematicky zpracovávají a objektivně hodnotí vybrané parametry nasnímaných strukturálních dat MR (postprocessing). Vhodnou extenzí anatomického strukturálního protokolu může být postprocessing obrazových dat, především T1 a T2 vážených 3D sekvencí. U sekvence T1 je využit vysoký kontrast mezi šedou a bílou hmotou pro segmentaci obrazu na tři základní typy tkání (bílá hmota, šedá hmota a mozkomíšní mok) a hlubší analýzu kortexu. Hodnocena je především šířka kortexu pomocí nástrojů, jako je Freesurfer [29], který provede surface-based analýzu. Segmentovaných T1 vážených obrazů se užívá také pro voxel-based analýzu nestandardního přechodu signálu mezi bílou a šedou hmotou mozku, kde je pomocí detekčních algoritmů hodnocen „blurring“ [30]. T2 3D strukturální data jsou používána pro koregistraci s dalšími zobrazovacími modalitami, jako jsou metody nukleární medicíny: pozitronová emisní tomografie deoxyglukózou značenou radioaktivním fluorem (FDG PET) nebo jednofotonová emisní CT (SPECT). Velkým přínosem u vyšetření SPECT je vyhodnocení pomocí metody SISCOM (Subtraction of ictal and interictal SPECT coregistered to MRI), kdy je možná subtrakce iktálních a interiktálních dat [31]. Data nasnímaná ve 2D T2 TSE sekvenci pro detailní hodnocení hipokampu v koronální rovině je možné využít pro automatické měření objemu (volumometrii) a segmentaci meziálních temporálních oblastí [32].
Nevhodným nastavením algoritmů však může dojít ke vzniku falešně pozitivních nebo negativních výsledků.
Metody takového zpracování dat jsou systematicky vyvíjeny v Epileptologickém výzkumném centru v Praze (Epilepsy Research Centre Prague; EpiReC) i na výzkumných pracovištích v Brně (CEITEC, MUNI). Vhodně zpracovaná data vzniklá v dedikovaném protokolu mohou vést nejen k úspoře času a financí jinak potřebných k novým a opakovaným vyšetřením MR, ale nepochybně mají rovněž potenciál ke zvýšení úspěšnosti záchytu drobnějších strukturálních epileptogenních lézí v rámci takto cíleně navigovaného vizuálního hodnocení.
Závěr
Představená doporučení pro strukturální zobrazení MR mozku u pacientů s epilepsií respektují rovnováhu mezi využitím moderních technologií zobrazení a technikami, které jsou prakticky využitelné ve většině nemocničních i ambulantních pracovišť. Uvedená doporučení pro dedikovaná strukturální zobrazení MR by mohla na pracovištích, která se zobrazením u pacientů s epilepsií zabývají nebo v budoucnu chtějí zabývat, přinést základní platformu pro standardizovaná vyšetření MR v těchto indikacích a vést následně ke zpřesnění a urychlení diagnostiky.
Finanční podpora
Podpořeno Institucionální podporou MZ ČR – RVO (FN Motol, 00064203). Podpořeno projektem č. LX22NPO 5107 (MŠMT): Financováno EU – Next Generation EU. Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. NU21-08-00228 a NV19-04-00369. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
MUDr. Martin Kynčl, Ph.D.
Klinika zobrazovacích metod
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: martin.kyncl@fnmotol.cz
Přijato k recenzi: 16. 9. 2022
Přijato do tisku: 18. 1. 2023
Sources
1. Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med 2000; 342 (5): 314–319. doi: 10.1056/NEJM200002033420503.
2. Tavakol S, Royer J, Lowe AJ et al. Neuroimaging and connectomics of drug-resistant epilepsy at multiple scales: from focal lesions to macroscale networks. Epilepsia 2019; 60 (4): 593–604. doi: 10.1111/epi.14688.
3. Marusič P. Resekční chirurgická léčba epilepsie. Neurol Praxi 2018; 19 (1): 16–21. doi: 10.36290/neu.2018.004.
4. Engel J, McDermott MP, Wiebe S et al. Early surgical therapy for drug-resistant temporal lobe epilepsy: a randomized trial. JAMA 2012; 307 (9): 922–930. doi: 10.1001/jama.2012.220.
5. Dwivedi R, Ramanujam B, Chandra PS et al. Surgery for drug-resistant epilepsy in children. N Engl J Med 2017; 377 (17): 1639–1647. doi: 10.1056/NEJMoa1615 335.
6. Lamberink HJ, Otte WM, Blümcke I et al. Seizure outcome and use of antiepileptic drugs after epilepsy surgery according to histopathological diagnosis: a retrospective multicentre cohort study. Lancet Neurol 2020; 19 (9): 748–757. doi: 10.1016/S1474-4422 (20) 30220-9.
7. Bonilha L, Lee CY, Jensen JH et al. Altered microstructure in temporal lobe epilepsy: a diffusional kurtosis imaging study. AJNR Am J Neuroradiol 2015; 36 (4): 719–724. doi: 10.3174/ajnr.A4185.
8. Glenn GR, Jensen JH, Helpern JA et al. Epilepsy-related cytoarchitectonic abnormalities along white matter pathways. J Neurol Neurosurg Psychiatry 2016; 87 (9): 930–936. doi: 10.1136/jnnp-2015-312980.
9. Hogan RE. Quantitative measurement of longitudinal relaxation time (qT1) mapping in TLE: a marker for intracortical microstructure? Epilepsy Curr 2017; 17 (6): 358–360. doi: 10.5698/1535-7597.17.6.358.
10. Jbabdi S, Johansen-Berg H. Tractography: where do we go from here? Brain Connect 2011; 1 (3): 169–183. doi: 10.1089/brain.2011.0033.
11. Kini LG, Gee JC, Litt B. Computational analysis in epilepsy neuroimaging: a survey of features and methods. Neuroimage Clin 2016; 11 : 515–529. doi: 10.1016/ j.nicl.2016.02.013.
12. Zijlmans M, Zweiphenning W, van Klink N. Changing concepts in presurgical assessment for epilepsy surgery. Nat Rev Neurol 2019; 15 (10): 594–606. doi: 10.1038/s41582-019-0224-y.
13. Gaillard WD, Cross JH, Duncan JS et al. Epilepsy imaging study guideline criteria: commentary on diagnostic testing study guidelines and practice parameters. Epilepsia 2011; 52 (9): 1750–1756. doi: 10.1111/j.15 28-1167.2011.03155.x.
14. Wellmer J, Quesada CM, Rothe L et al. Proposal for a magnetic resonance imaging protocol for the detection of epileptogenic lesions at early outpatient stages. Epilepsia 2013; 54 (11): 1977–1987. doi: 10.1111/epi.12 375.
15. Bernasconi A, Cendes F, Theodore WH et al. Recommendations for the use of structural magnetic resonance imaging in the care of patients with epilepsy: a consensus report from the International League Against Epilepsy Neuroimaging Task Force. Epilepsia 2019; 60 (6): 1054–1068. doi: 10.1111/epi.15612.
16. Winston GP, Micallef C, Kendell BE et al. The value of repeat neuroimaging for epilepsy at a tertiary referral centre: 16 years of experience. Epilepsy Res 2013; 105 (3): 349–355. doi: 10.1016/j.eplepsyres.2013.02.022.
17. Von Oertzen J, Urbach H, Jungbluth S et al. Standard magnetic resonance imaging is inadequate for patients with refractory focal epilepsy. J Neurol Neurosurg Psychiatry 2002; 73 (6): 643–647. doi: 10.1136/jnnp.73.6.643.
18. Kreilkamp BAK, Das K, Wieshmann UC et al. Neuroradiological findings in patients with “non-lesional” focal epilepsy revealed by research protocol. Clin Radiol 2019; 74 (1): 78.e1–78.e11. doi: 10.1016/j.crad.2018.08.013.
19. Severino M, Geraldo AF, Utz N et al. Definitions and classification of malformations of cortical development: practical guidelines. Brain 2020; 143 (10): 2874–2894. doi: 10.1093/brain/awaa174.
20. Cendes F, Theodore WH, Brinkmann BH et al. Neuroimaging of epilepsy. Handb Clin Neurol 2016; 136 : 985–1014. doi: 10.1016/B978-0-444-53486-6.00051-X.
21. Recommendations for neuroimaging of patients with epilepsy. Commission on Neuroimaging of the International League Against Epilepsy. Epilepsia 1997; 38 (11): 1255–1256. doi: 10.1111/j.1528-1157.1997.tb01226.x.
22. Wong-Kisiel LC, Britton JW, Witte RJ et al. Double inversion recovery magnetic resonance imaging in identifying focal cortical dysplasia. Pediatr Neurol 2016; 61 : 87–93. doi: 10.1016/j.pediatrneurol.2016.04.013.
23. Middlebrooks EH, Lin C, Westerhold E et al. Improved detection of focal cortical dysplasia using a novel 3D imaging sequence: Edge-Enhancing Gradient Echo (3D-EDGE) MRI. Neuroimage Clin 2020; 28 : 102449. doi: 10.1016/j.nicl.2020.102449.
24. Chen X, Qian T, Kober T et al. Gray-matter-specific MR imaging improves the detection of epileptogenic zones in focal cortical dysplasia: a new sequence called fluid and white matter suppression (FLAWS). Neuroimage Clin 2018; 20 : 388–397. doi: 10.1016/j.nicl.2018. 08.010.
25. Toledano R, Jiménez-Huete A, Campo P et al. Small temporal pole encephalocele: a hidden cause of “normal” MRI temporal lobe epilepsy. Epilepsia 2016; 57 (5): 841–851. doi: 10.1111/epi.13371.
26. Dussaule C, Masnou P, Nasser G et al. Can developmental venous anomalies cause seizures? J Neurol 2017; 264 (12): 2495–2505. doi: 10.1007/s00415-017-8456-5.
27. Mendes A, Sampaio L. Brain magnetic resonance in status epilepticus: a focused review. Seizure 2016; 38 : 63–67. doi: 10.1016/j.seizure.2016.04.007.
28. So EL, Lee RW. Epilepsy surgery in MRI-negative epilepsies. Curr Opin Neurol 2014; 27 (2): 206–212. doi: 10.1097/WCO.0000000000000078.
29. FreeSurfer. [online]. Available from URL: https: //surfer.nmr.mgh.harvard.edu.
30. Huppertz HJ, Grimm C, Fauser S et al. Enhanced visualization of blurred gray-white matter junctions in focal cortical dysplasia by voxel-based 3D MRI analysis. Epilepsy Res 2005; 67 (1–2): 35–50. doi: 10.1016/j.eplepsyres.2005.07.009.
31. Kudr M, Krsek P, Marusic P et al. SISCOM and FDG--PET in patients with non-lesional extratemporal epilepsy: correlation with intracranial EEG, histology, and seizure outcome. Epileptic Disord 2013; 15 (1): 3–13. doi: 10.1684/epd.2013.0560.
32. Sone D, Sato N, Maikusa N et al. Automated subfield volumetric analysis of hippocampus in temporal lobe epilepsy using high-resolution T2-weighed MR imaging. Neuroimage Clin 2016; 12 : 57–64. doi: 10.1016/j.nicl.2016.06.008.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2023 Issue 1
Most read in this issue
- Progressive multiple sclerosis in the light of the latest findings
- Recommendations for structural brain MRI in the diagnosis of epilepsy
- Dietary approaches specific to patients with multiple sclerosis
- The role of dynamic MRI of the cervical spine and dynamic evoked potentials in the diagnosis of degenerative cervical myelopathy
