Klinicko-radiologický paradox u roztroušené sklerózy – význam vyšetření míchy
Clinical-radiological paradox in multiple sclerosis – the role of the spinal cord examination
Aim: Insufficient correlation between the findings on conventional MRI and physical disability, the so-called clinical-radiological paradox, complicates the estimation of individual prognosis and therapeutic decisions in patients with MS. The primary goal of our work was to elucidate the role of spinal cord atrophy in the situation of the clinical-radiological paradox. A secondary objective was to identify predictors of spinal cord volume in healthy individuals. Patients and methods: A total of 2,009 patients with relapsing-remitting and secondary progressive MS and 102 healthy volunteers underwent a 3T MRI examination of the brain and spinal cord with automatic volumetry. Patients with Expanded Disability Status Scale (EDSS) ≤ 1.5 were matched with patients with EDSS ≥ 3.5 of the same age, with the same disease duration and identical intracranial lesion volume. Moreover, we identified patients with an unusually high respectively low lesion volume and disproportionally low respectively severe physical disability. In these groups representing the clinical-radiological paradox, we compared global and regional spinal cord and brain volumes by using parametric and nonparametric tests. We also evaluated the proportion of patients with brain and/or spinal cord atrophy identified by 2 standard deviations from normative values. Results: 245 patients with EDSS ≤ 1.5 differed from 245 matched patients with and EDSS ≥ 3.5 only in the normalized spinal cord volume (P = 0.002) and normalized cerebral white matter volume (P = 0.028). Cerebral white matter was one of the predictors of spinal cord volume in healthy individuals. Patients with unusually high lesion load and minimal physical disability had lower global and regional brain volumes, however, their normalized spinal cord volumes did not differ from those of non-paradox patients and from patients with a low lesion load and severe disability. The lowest non-normalized (absolute) spinal cord volumes were observed in patients with a low lesion load and severe disability. Conclusion: Spinal cord volume may explain the discrepancy between intracranial lesion load and physical disability.
Keywords:
Brain – Multiple sclerosis – Atrophy – Spinal cord – magnetic resonance imaging – white matter
Authors:
M. Andělová 1; K. Vodehnalová 1; J. Krásenský 2; T. Uher 1; D. Šťastná 1; I. Menkyová 1,3; D. Horáková 1
; M. Vaněčková 2
Authors‘ workplace:
Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
1; Radiodiagnostická klinika, 1. LF UK a VFN v Praze
2; II. neurologická klinika LF UK a UNB, Bratislava, Slovensko
3
Published in:
Cesk Slov Neurol N 2021; 84(6): 547-554
Category:
Original Paper
doi:
https://doi.org/10.48095/cccsnn2021547
Overview
Cíl: Nedostatečná korelace mezi nálezem na konvenční MR a klinickým stavem, označovaná jako klinicko-radiologický paradox, znesnadňuje odhad individuální prognózy a výběr terapie u pacientů s RS. Hlavním cílem práce bylo osvětlit roli atrofie míchy v situaci klinicko-radiologického paradoxu. Sekundárním cílem bylo identifikovat prediktory objemu míchy u zdravých jedinců. Soubor a metodika: Vyšetření 3T MR mozku a míchy s automatickou volumetrií podstoupilo 2 009 pacientů s relaps-remitentní a sekundárně progresivní RS a 102 zdravých dobrovolníků. Pacienty s hodnotou Expanded Disability Status Scale (EDSS) ≤ 1,5 jsme spárovali s pacienty s EDSS ≥ 3,5 stejného věku se stejně dlouhým trváním choroby a s identickým objemem intrakraniálních ložisek. Dále jsme identifikovali pacienty s neobvykle velkým, resp. malým objemem ložisek a neúměrně lehkým, resp. závažným fyzickým postižením. U těchto skupin reprezentujících klinicko-radiologický paradox jsme pomocí parametrických a neparametrických testů srovnávali globální a regionální objemy míchy a mozku. Dále jsme vyhodnocovali podíl pacientů s atrofií mozku a/nebo míchy identifikovaných 2 směrodatnými odchylkami od normativních hodnot. Výsledky: Celkem 245 pacientů s EDSS ≤ 1,5 se od 245 spárovaných pacientů s totožným objemem ložisek a s EDSS ≥ 3,5 lišilo pouze normalizovaným objemem míchy (p = 0,002) a bílé hmoty mozku (p = 0,028). Bílá hmota mozku byla jedním z prediktorů objemu míchy u zdravých jedinců. Pacienti s velkým objemem ložisek a minimálním fyzickým postižením měli sice menší globální a regionální objemy mozku, v normalizovaném objemu míchy se však nelišili od neparadoxních pacientů a od pacientů s malým objemem ložisek a závažným fyzickým postižením. Nenormalizované (absolutní) objemy míchy byly nejnižší ve skupině pacientů s malým objemem ložisek a závažným fyzickým postižením. Závěr: Objem míchy může vysvětlit diskrepanci mezi intrakraniálním ložiskovým nálezem a stupněm postižení
Klíčová slova:
roztroušená skleróza – magnetická rezonance – bílá hmota – mícha – atrofie – mozek
Úvod
Roztroušená skleróza je zánětlivé, demyelinizační a degenerativní onemocnění mozku a míchy. Charakteristickým rysem onemocnění a zároveň faktorem komplikujícím predikci individuální prognózy a odpovědi na léčbu je heterogenita klinického průběhu i nálezů na MR. Projevem této heterogenity je i nedostatečná korelace mezi nálezem na konvenční MR a klinickým stavem pacienta. Na MR je v klinické praxi většinou hodnocen počet ložisek (eventuálně i jejich objem), počet aktivních (nových či zvětšených) ložisek reflektujících zánětlivou aktivitu RS a stále častěji také objem mozku jako ukazatel neurodegenerativní komponenty RS částečně nezávislé na zánětlivé aktivitě. Pro hodnocení klinického postižení se nejčastěji používá škála Expanded Disability Status Scale (EDSS). U většiny pacientů s malým klinickým postižením (nízkým EDSS) jsou ložiskový nález a atrofie mozku menší než u pacientů se závažnějším klinickým postižením (vysokým EDSS). Tento vztah však neplatí absolutně a existuje skupina pacientů, u kterých je klinické postižení minimální i přes rozsáhlý nález na MR mozku. U části pacientů je naopak klinické postižení závažné i přes nevelký či průměrný ložiskový nález na MR mozku. Tato disociace mezi klinickým stavem a nálezy na MR se označuje jako „klinicko-radiologický paradox“ [1]. Existuje více možných vysvětlení disociace mezi ložiskovým nálezem a klinickým stavem pacienta. Za prvé si lze představit, že strategicky uložená ložiska (např. v infratentoriální oblasti) mohou vést k vyššímu stupni postižení. Tuto zjednodušenou představu v poslední době nahrazuje nahlížení na patologii nejen regionální, ale také ve smyslu sítí a tzv. konektomu [2]. Za druhé nám konvenční MR neumožňuje diferencovat histopatologický charakter, aktivitu a úroveň remyelinizace ložisek v bílé hmotě [3] a zhodnotit rozsah ložisek v šedé hmotě. Za třetí se v poslední době ukazuje význam mikrostrukturálního poškození normálně vypadající šedé a bílé hmoty [4], vliv genetických a metabolických vlivů, komorbidit a tzv. mozkové rezervy na průběh onemocnění [5]. Tyto mechanizmy by se mohly nepřímo odrazit na objemu mozku, respektive na jeho atrofii, která je považována za ukazatel neurodegenerace. Měření objemu mozku se u pacientů s RS používá stále více a bylo prokázáno, že rychlost atrofie je spojena s vyšší aktivitou onemocnění [6]. Zatím však neexistuje jednotné doporučení ohledně techniky měření atrofie mozku [7]. Dalším aspektem, který komplikuje interpretaci atrofie mozku, je, že atrofie nepostihuje všechny struktury rovnoměrně. Struktury mozku atrofují různě rychle v závislosti na trvání onemocnění [8] a ukazují se i vzorce globální a regionální atrofie, které neodpovídají klasickému rozlišení podtypů RS a korelují s klinickým postižením [9]. V neposlední řadě se často opomíjí ložiskový proces a atrofie míchy. Přestože se termín „klinicko-radiologický paradox“ objevuje velice často, jednotná definice tohoto fenoménu ani data o jeho prevalenci ne - existují. Systematicky se disociací mezi ložiskovým postižením v bílé hmotě mozku a klinickým stavem věnovala práce Healyho et al, ve které bylo popsáno 13,5 % pacientů s disociací mezi ložiskovým nálezem a klinickým postižením (4,1 % pacientů s malým objemem ložisek a nepoměrně těžkým klinickým postižením a 9,4 % pacientů s velkým objemem ložisek a lehkým klinickým postižením) [10]. Tento přístup ke klinicko-radiologickému paradoxu je zacílený zejména na pacienty s extrémně malým, resp. velkým ložiskovým nálezem, a nereflektuje většinu pacientů s „průměrným“ ložiskovým nálezem. V naší práci jsme proto kromě definice Healyho et al, použili jiný přístup, který podle nás lépe odráží klinicko-radiologický paradox u větší části pacientů. Z velké kohorty pacientů s RS sledované v Centru pro demyelinizační onemocnění jsme přesně spárovali pacienty s minimálním postižením (EDSS ≤ 1,5) a pacienty se středním až závažným postižením (EDSS ≥ 3,5) na objem ložisek, pohlaví, věk a trvání RS a srovnávali jsme u nich globální a regionální objemy mozku a objemy míchy. Naší hypotézou bylo, že objemy mozku a zejména míchy budou alespoň u části pacientů vysvětlovat rozdíl v postižení mezi pacienty se stejným objemem ložisek.
Soubor a metodika
Pacienti a zdraví dobrovolníci
Soubor tvořili pacienti v různých fázích RS, kteří jsou sledováni a léčeni v Centru pro demyelinizační onemocnění při univerzitní nemocnici.
Celkem 2 379 pacientů s demyelinizačním onemocněním či podezřením na demyelinizační onemocnění bylo vyšetřeno pomocí protokolu kvantitativní MR (QMRI) mezi 1. 2. 2018 a 30. 5. 2019. Z analýzy byli vyřazeni pacienti s neuromyelitis optica (n = 11), primárně progresivní RS (n = 24), dále pacienti, u kterých se onemocnění nepotvrdilo (n = 55), a pacienti s první atakou onemocnění či relapsem, u kterých by EDSS mohlo být ovlivněno akutní neurologickou symptomatikou (n = 167). Dále byli vyřazeni pacienti, u nichž nebylo provedeno nebo selhalo měření míchy (n = 113). Výsledný hodnocený soubor tvořilo 2 009 pacientů. Celkem 102 zdravých dobrovolníků ve věku 18–60 let podstoupilo vyšetření MR v březnu až září 2018 na stejném přístroji s využitím stejného protokolu, jaký byl použit u pacientů s RS.
Magnetická rezonance
Protokol
Všechna vyšetření pacientů i dobrovolníků proběhla na stejném přístroji (3T Skyra, Siemens Healthcare, Erlangen, Německo). Detaily protokolu jsou uvedeny v tab. 1.
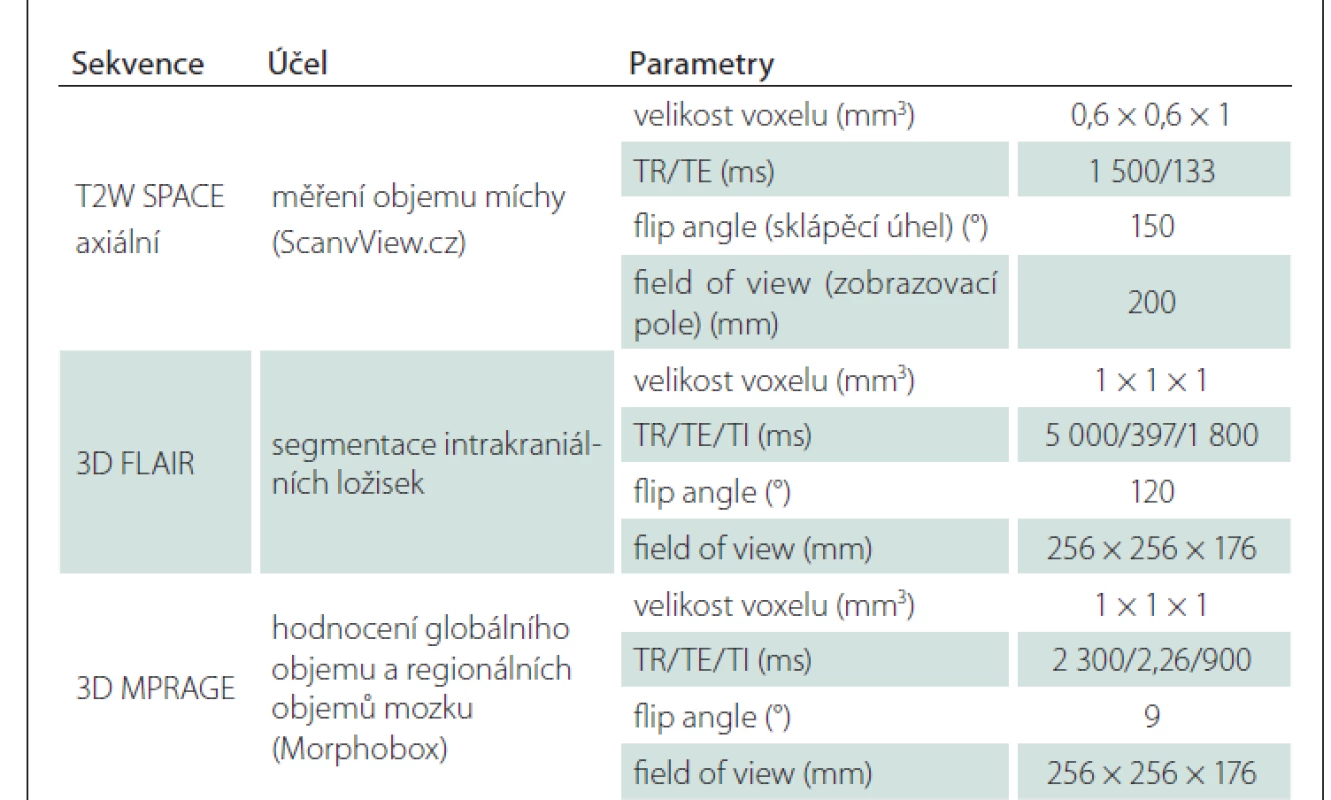
Měření objemu mozku, míchy a ložisek
Celkový objem mozku, jeho regionální objemy a objemy ložisek byly měřeny v T1 sekvenci pomocí softwaru MorphoBox Prototype, jehož použití testujeme v klinické praxi. Segmentace anatomických struktur probíhá ve dvou krocích:
1. rozdělení všech voxelů / totálního intrakraniálního objemu (označovaného MorphoBoxem jako TIV) na jednotlivé tkáně – mozkomíšní mok, šedá hmota) a bílá hmota. Tento krok je podobný segmentaci v SPM (Statistical Parametric Mapping), ale nevyužívá v této fázi atlas;
2. vlastní segmentace mozkových struktur kombinací tkáňových map získaných v prvním kroku a anatomických masek získaných z šablony pomocí nerigidní registrace.
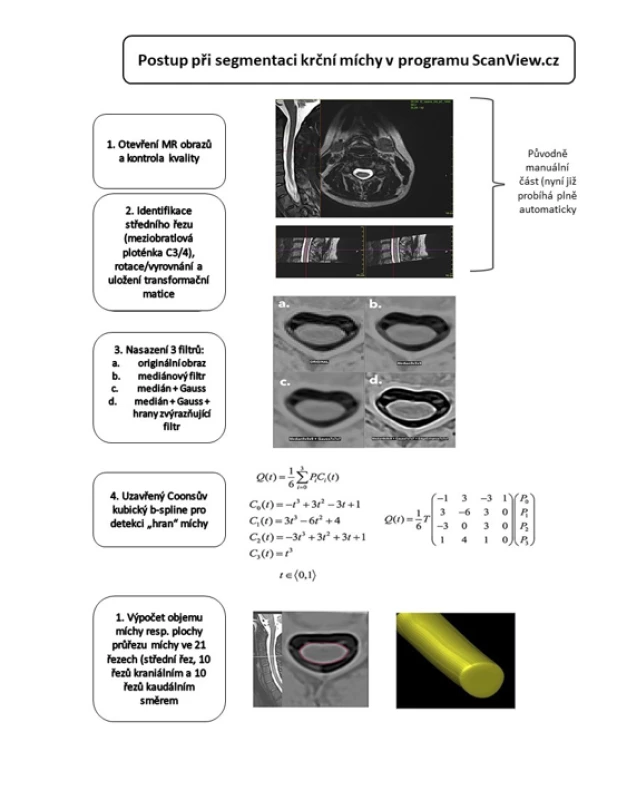
Anatomická šablona byla vytvořena na podkladě MR mozku 64leté ženy bez závažných komorbidit. Detaily algoritmu popisuje práce Schmittera et al [11]. Metoda byla nejprve validována v kontextu Alzheimerovy choroby. V současnosti se používá u širokého spektra neurologických onemocnění vč. pacientů s RS, epilepsií [12] či Parkinsonovou chorobou [13]. Globální i regionální objemy mozku byly normalizovány pomocí totálního intrakraniálního objemu. Parciální objem, respektive plocha 21 řezů v úseku horní krční míchy pacientů s RS, byl měřen pomocí semiautomatické metody v T2-váženém obraze 3D v rozsahu obratlových těl C3 a C4. Jedná se o metodu vyvinutou na oddělení MR Radiodiagnostické kliniky VFN, která je implementována v softwaru ScanView.CZ (vytvořeném Dr. Krásenským) [14,15]. V prvním kroku (presegmentace) je manuálně zafixován takzvaný „střední řez“ na úrovni meziobratlové ploténky C3/4 (ve středu ploténky), po němž následuje manuální „straightening“, tedy vyrovnání míchy paralelně se zadní stranou obratlového těla C3 a uložení transformační matice pro následující automatické zpracování. Vlastní plně automatická segmentace míchy je založená na uzavřeném Coonsově kubickém B-splinu, pomocí něhož je vytvořena křivka představující obvod míchy na „středním řezu“ C3/4 a na 10 řezech kraniálním a 10 řezech kaudálním směrem od tohoto středního řezu. Nakonec je vypočtena celková plocha všech 21 řezů a poté oblast MUCCA (mean upper cervical cord area) vydělením celkové plochy počtem řezů. V této práci používáme pro zjednodušení v metodách, výsledcích i diskuzi opakovaně termín „objem míchy“, přestože správně bychom měli užívat termín průměrná hodnota plochy průřezu v oblasti horní krční míchy (MUCCA).
Determinanty MUCCA
Protože jedním z cílů bylo porozumění role objemu míchy v klinicko-radiologickém paradoxu, analyzovali jsme u dobrovolníků fyziologické vlivy na objem míchy, konkrétně věk a pohlaví, parametry spojené s tělesnou stavbou (výška a totální intrakraniální objem) a mozkové volumetrické parametry (objem mozku, mozkomíšního moku, šedé a bílé hmoty).
Klinické vyšetření
U pacientů byly použity klinické nálezy získané v rámci pravidelných kontrol (frekvence kontrol 1–4× ročně) pomocí škály EDSS [16]. Hodnocení EDSS je založeno na standardizovaném vyšetření sedmi „funkčních systémů“, které hodnotí vizuální, kmenový, pyramidový, mozečkový, senzorický, sfinkterový a „cerebrální“ systém. Dále se hodnotí schopnost samostatné chůze a potřeba opory či pomůcky při chůzi. EDSS je ordinální škála, která se pohybuje mezi hodnotou 0 (odpovídá normálnímu neurologickému nálezu) a 10 (smrt v důsledku RS). Údaje pro statistické zpracování byly získány ze systému iMED.
Identifikace pacientů s klinickou a MR disociací
Pomocí SPSS (IBM, Armonk, NY, USA) funkce case-control matching jsme ze skupiny 2 009 pacientů vybrali 490 pacientů – 245 pacientů s EDSS 0–1,5 a 245 pacientů s EDSS ≥ 3,5 co nejpřesněji spárovaných na pohlaví, věk (tolerance 3 roky), trvání RS (tolerance 1 rok) a objem T2-hyperintenzních lézí (T2-hyperintense lesion volume; T2LV) (tolerance 1 cm3) – a srovnávali u nich globální a regionální objemy mozku a míchy.
Druhý přístup jsme převzali z práce Healyho et al. Celou skupinu pacientů (n = 2 009) jsme rozdělili do 3 skupin na podkladě úrovně fyzického postižení a objemu T2LV v bílé hmotě mozku. Disociace mezi objemem lézí a postižením jsme definovali na podkladě prvního a posledního kvartilu z našich dat (pro srovnání stejně jako Healy et al, který použil medián [10]) následovně:
- T2LV < 1,4 cm3 (< 2 cm3) a EDSS ≥ 4,0 (≥ 3,0) = malý objem lézí a vysoké postižení (MLVP);
- T2LV > 4,5 cm3 (6 cm3) a EDSS ≤ 1,5 = velký objem lézí a malé postižení (VLMP);
- zbylí pacienti = „neparadoxní“.
Ve třetím přístupu jsme identifikovali pacienty bez atrofie mozku a/nebo míchy a s atrofií mozku a/nebo míchy. Objemy mozku a míchy normalizované na TIV a adjustované na věk jsme srovnali s objemy zdravých dobrovolníků vyšetřených na stejném MR přístroji ve stejném protokolu MR. Vzhledem k věku zdravých dobrovolníků jsme vyřadili pacienty ve věku nad 62 let a analyzovali pouze podskupinu 1 920 pacientů. Významná atrofie mozku, resp. míchy, byla definována jako z-skóre menší než (–2). Z-skóre pro normalizovaný objem mozku a míchy bylo vypočteno následovně: (individuální normalizovaný objem mozku či míchy pacienta – průměrný normalizovaný objem mozku či míchy zdravých kontrol) / směrodatná odchylka (SD) zdravých kontrol
Vznikly čtyři skupiny pacientů:
- pacienti bez atrofie mozku a míchy (z-skóre pro mozek i míchu > –2);
- pacienti s atrofií mozku bez atrofie míchy (z-skóre pro mozek < –2, pro míchu > –2);
- pacienti s atrofií míchy bez atrofie mozku (z-skóre pro mozek > –2, pro míchu < –2);
- pacienti s atrofií mozku i míchy (z-skóre pro mozek i míchu < –2).
U pacientů s rozdílným EDSS a u spárovaných pacientů s rozdílným EDSS jsme porovnávali zastoupení jednotlivých skupin vytvořených na základě atrofie mozku a míchy.
Determinanty MUCCA u zdravých osob
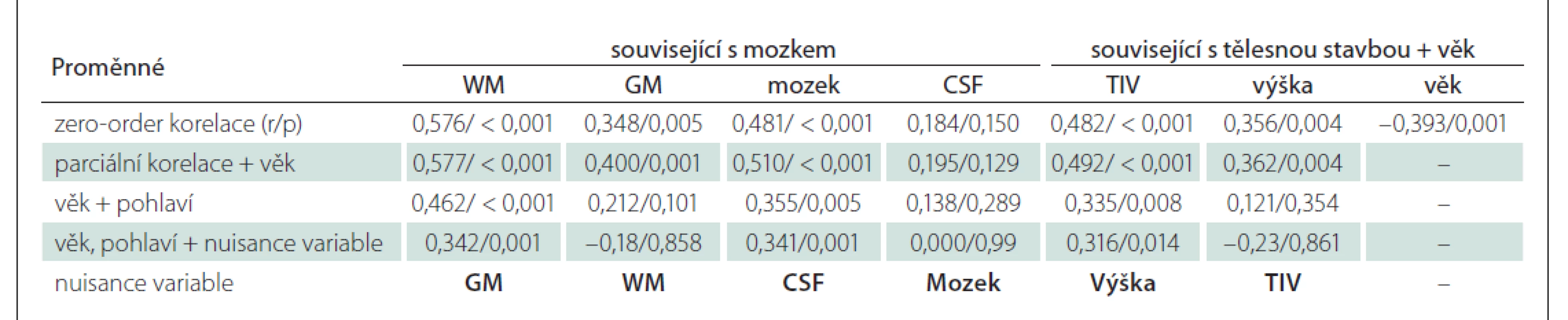
Jednotlivé proměnné, které jsme analyzovali jako determinanty MUCCA (věk, pohlaví, výška, totální intrakraniální objem, objem bílé a šedé hmoty, objem mozku a mozkomíšního moku), nejsou zcela nezávislé. Se zvyšujícím se věkem klesá objem mozku, dále existuje komplexní vztah mezi pohlavím, tělesnou výškou a totálním intrakraniálním objemem. Abychom zachovali statistickou sílu, nevytvořili jsme proto jeden regresní model s MUCCA jako závislou proměnnou a všemi výše uvedenými faktory jako závislými proměnnými, ale použili jsme parciální korelaci, ve které byl věk zahrnut do všech parciálních korelací. Ve druhém kroku byl věk zkombinován s pohlavím a ve třetím kroku byl navíc vždy zahrnut jeden další „přebytečný parametr“ (nuisance variable).
Klinicko-radiologický paradox
Pro srovnání volumetrických parametrů u spárovaných pacientů se stejným objemem ložisek a rozdílným stupněm postižení, u pacientů s diskrepancí mezi intrakraniálními ložisky a klinickým postižením a pacientů „nediskrepantních“ jsme použili studentův t-test či analýzu rozptylu u proměnných s normálním rozdělením, resp. Mann-Whitneyho U test či Kruskal-Wallisův test u proměnných, u kterých bylo nutné použít neparametrické testy.
Rozdíly v distribuci pacientů s jednotlivými stupni klinického postižení (dle EDSS) a diskrepantních pacientů ve čtyřech skupinách dle atrofie mozku a míchy (1. pacienti bez atrofie mozku a míchy; 2. pacienti s atrofií mozku bez atrofie míchy; 3. pacienti s atrofií míchy bez atrofie mozku; 4. pacienti s atrofií mozku i míchy) byly hodnoceny pomocí chí kvadrát testu.
Pro hodnocení vztahu mezi ložisky v bílé hmotě a objemy mozku a míchy byl použit Spearmanův koeficient pořadové korelace.
Výsledky
Determinanty MUCCA u zdravých osob
Věk, tělesná výška, intrakraniální objem, objem mozku, šedé i bílé hmoty mozku korelují u zdravých jedinců s MUCCA (tab. 2). Po korekci na věk a pohlaví si zachovala významnost pouze korelace MUCCA a TIV (r = 0,316; p = 0,014), celkového objemu mozku (r = 0,342; p = 0,001) a bílé hmoty mozku (r = 0,342; p = 0,001).
Klinicko-radiologický paradox
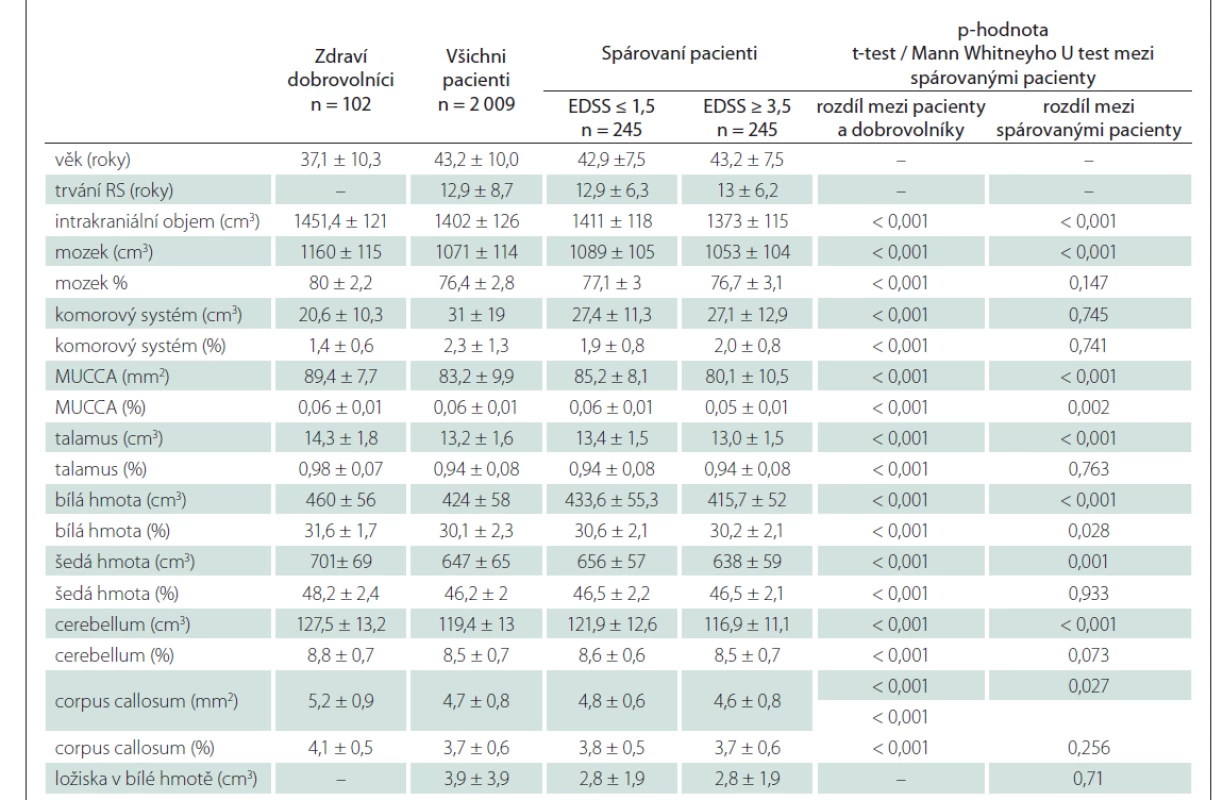
Pacienti se stejným objemem ložisek a rozdílným postižením
Pomocí case-control párování bylo vybráno 490 pacientů (245 pacientů s EDSS ≤ 1,5 a 245 pacientů s EDSS ≥ 3) stejného pohlaví, věku, se stejnou délkou onemocnění a stejným objemem ložisek v bílé hmotě. Tab. 3 ukazuje rozdíly mezi skupinami. Pacienti s EDSS ≤ 1,5 měli větší totální intrakraniální objem a větší absolutní objemy všech vyšetřovaných struktur (celkový objem mozku, bílá a šedá hmota mozku, talamus, corpus callosum, mozeček) kromě objemů komor, které se nelišily. Po normalizaci na totální intrakraniální objem se však lišily pouze objemy míchy (p = 0,002) a bílé hmoty (p = 0,028), které byly vyšší u pacientů s EDSS ≤ 1,5.
Pacienti s výraznou diskrepancí mezi ložiskovým nálezem a klinickým postižením
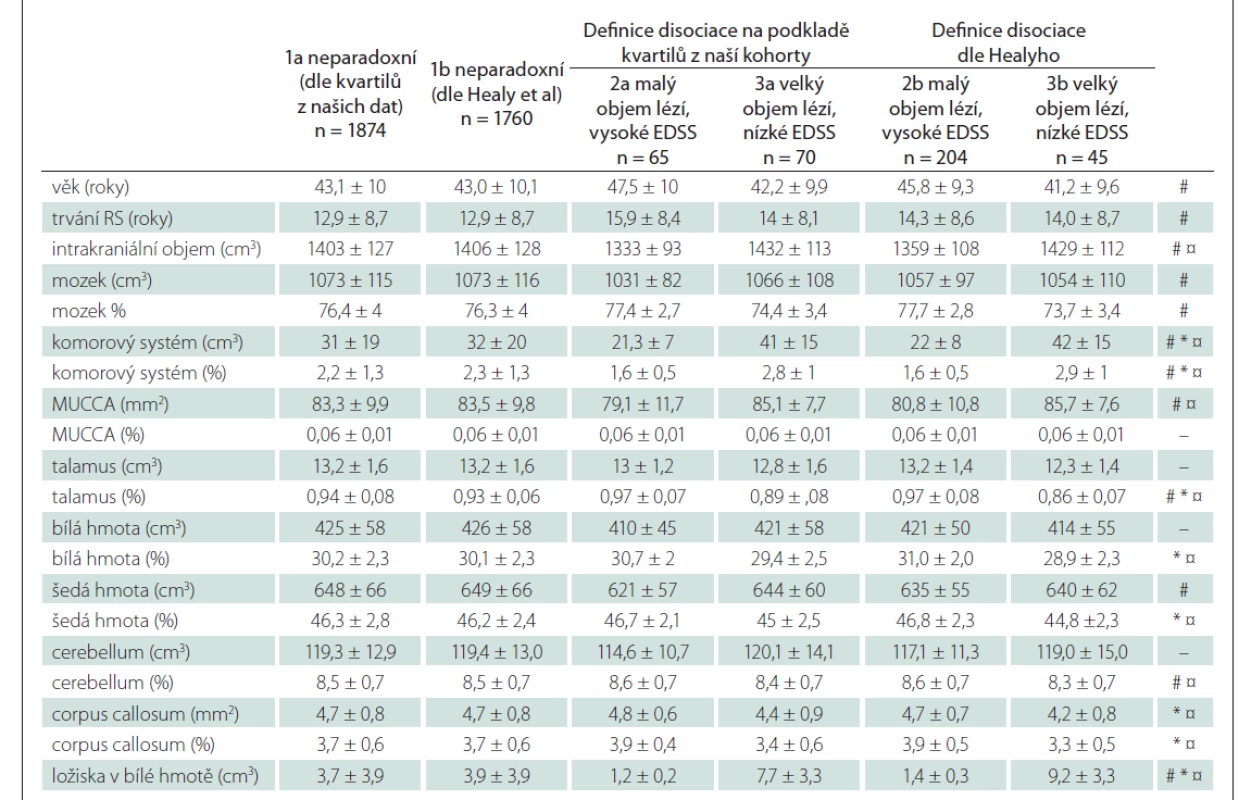
Disociaci postižení ve smyslu velmi malého ložiskového postižení a relativně vyššího stupně klinického postižení (MLVP) jsme nalezli pouze u 65 (3,2 %) pacientů. Malé klinické postižení i přes velký ložiskový nález mělo 70 (3,5 %) pacientů. Při použití definice dle Healyho et al bylo malé ložiskové postižení a vyšší klinické postižení patrné u 204 pacientů (10,1 %), zatímco pacientů s velkým ložiskovým nálezem a nepoměrně malým stupněm postižení (VLMP) bylo pouze 45 (2,2 %).
U pacientů s MLVP byl normalizovaný objem mozku a jeho jednotlivých struktur (bílá a šedá hmota, talamus, corpus callosum a mozeček) vyšší a objem komor nižší než u skupiny s VLMP. Normalizovaný ani absolutní objem míchy se však mezi skupinami nelišily (tab. 4).
EDSS – Expanded Disability Status Scale; MUCCA – mean upper cervical cord area (průměrná hodnota plochy průřezu v oblasti horní krční
míchy); n – počet; SD – standard deviation (směrodatná odchylka)
Vztah atrofie mozku a míchy a klinicko-radiologického paradoxu
U pacientů se stejným objemem ložisek, ale rozdílným postižením bylo ve skupině s malým postižením 74,9 % pacientů bez výrazné atrofie mozku a míchy, izolovanou atrofii mozku mělo 21,7 %, izolovanou atrofii míchy 1,7 % a atrofii mozku i míchy dalších 1,7 %. Ve skupině pacientů odpovídajícího pohlaví a věku, se stejným objemem ložisek a vyšším postižením bylo 55,6 % pacientů bez atrofie mozku a míchy, 27,5 % s izolovanou atrofií mozku, 11,1 % s izolovanou atrofií míchy a 6 % s atrofií mozku i míchy. Atrofii míchy mělo tedy 3,4 % pacientů s malým postižením a 17,1 % pacientů se středním až těžkým postižením. Rozdíl byl statisticky významný (Pearsonův chí kvadrát 30,1; p < 0,001) (tab. 5).
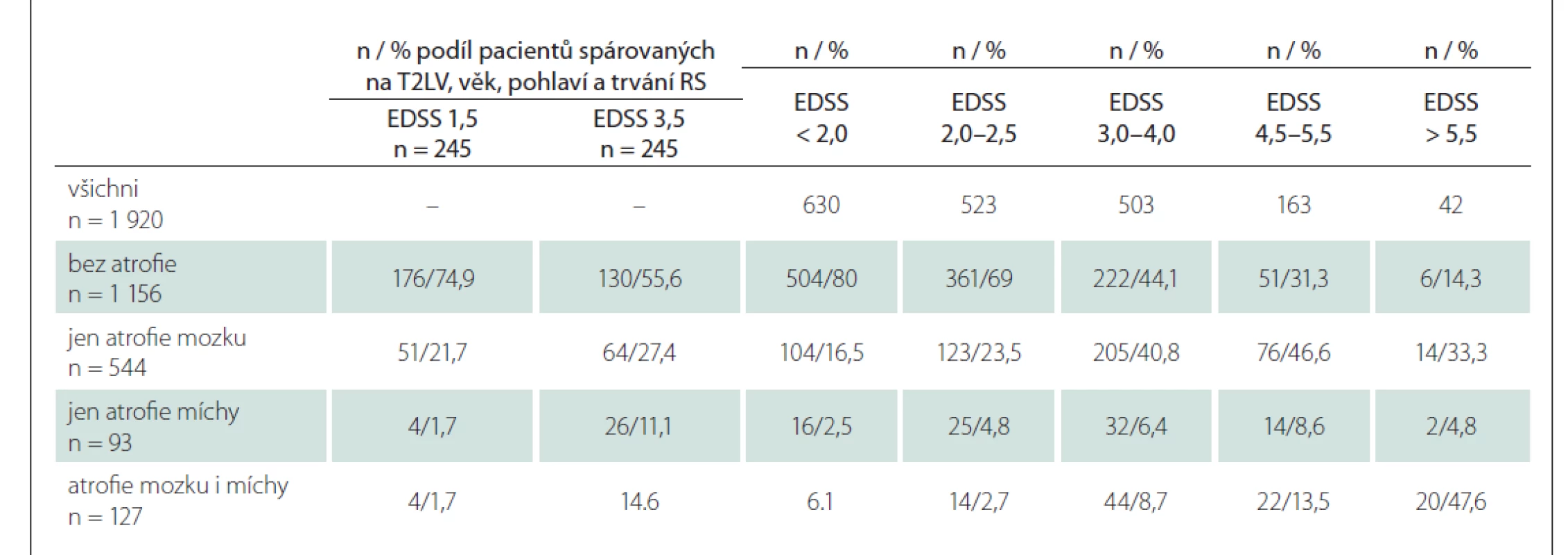
Pro srovnání – u „nediskrepantních“ pacientů bylo 59,4 % bez závažné atrofie mozku či míchy, 29,1 % mělo izolovanou atrofii mozku, 4,4 % izolovanou atrofii míchy a 7,1 % atrofii mozku i míchy. Tab. 5 dále ukazuje podíl pacientů s různým stupněm postižení ve skupinách dle atrofie mozku a míchy. Je patrné, že izolovaná atrofie míchy je u pacientů s RS vzácná, nicméně atrofie míchy provázející atrofii mozku významně narůstá u pacientů s EDSS > 5,5.
Vztah objemu ložisek, mozku a míchy u zdravých dobrovolníků a pacientů ukazuje tab. 6.
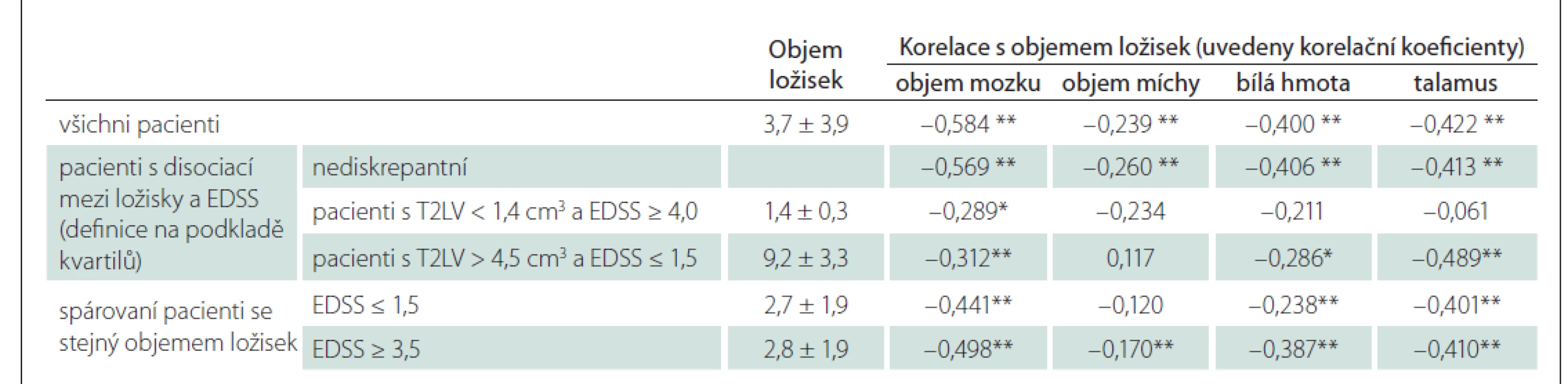
EDSS – Expanded Disability Status Scale; T2LV – objem T2 hyperintenzních ložisek
Diskuze
Naše výsledky ukazují, že objem míchy může vysvětlit část klinicko-radiologického paradoxu jak u pacientů s průměrným ložiskovým nálezem, tak u pacientů s disociací mezi malým, respektive velkým ložiskovým nálezem a klinickým postižením. U spárovaných pacientů s identickým objemem ložisek v mozku, ale rozdílným stupněm postižení jsme ukázali, že pacienti s vyšším postižením mají relativně nižší objem míchy, přičemž globální objem mozku se mezi skupinami neliší. Skupina s vyšším stupněm postižení má nižší také objem bílé hmoty mozku, což je zajímavé, protože bílá hmota byla u zdravých kontrol jedním z prediktorů objemu míchy jak v naší, tak v předchozí studii. V té Engl et al prokázali, že objem mozku a objem cerebrospinálních drah v bílé hmotě u zdravých osob determinují objem horní krční míchy [17]. Nalezli jsme menší podíl pacientů s disociací mezi ložiskovým nálezem a klinickým postižením (celkem 6,7 %) než v práci Healyho et al z roku 2017 (13,5 %) [10]. Při použití Healyho definice byl podíl pacientů s disociací srovnatelný (12,3 %), v naší kohortě však bylo vyšší procento pacientů s malým objemem ložisek a nepoměrně vyšším klinickým postižením (10,1 vs. 4,1 %) a naopak menší skupina pacientů s velkým objemem ložisek a malým stupněm klinického postižení (2,2 vs. 9,4 %). Rozdíly mohou být vysvětleny odlišnými demografickými parametry v kohortách pacientů i technikou měření objemu ložisek. U našich pacientů s výraznou disociací mezi ložisky a klinickým postižením bylo patrné, že velké ložiskové postižení vedlo k atrofii mozku, která ale nebyla doprovázena odpovídající atrofií míchy a objem míchy by mohl pacienty s malým postižením navzdory velkému ložiskovému nálezu chránit před motorickou disabilitou. Uvádíme několik možných mechanizmů, které by mohly vést ke klinicko-radiologickému paradoxu s ohledem na postižení míchy.
Vliv topografie a heterogenity intrakraniálních ložisek na míšní postižení
Hypoteticky je možné, že strategicky uložená ložiska (např. v cerebrospinálních drahách) mohou vést k vyššímu stupni postižení a dále i k Wallerově degeneraci a úbytku objemu vzdálených struktur [18]. Tuto hypotézu by mohla podpořit nedávno popsaná nová klinická jednotka, tzv. progresivní solitární skleróza, u které izolované ložisko demyelinizace v CNS (v 90 % v míše) vede k progresivnímu horšení funkce horních motoneuronů [19]. V naší práci jsme případné rozdíly v lokalizaci ložisek nehodnotili. Kromě lokalizace ložisek může hrát roli i jejich heterogenita [3,20]. Trapp et al v nedávné post mortem studii identifikovali podskupinu pacientů (12 ze 100 pacientů), jejichž T2-hyperintenzní ložiska v bílé hmotě překvapivě neměla patologický korelát demyelinizace [21]. Demyelinizace je u této skupiny patrná pouze v míše a v kortexu. Autoři tuto skupinu pacientů proto označují jako „myelokortikální RS“. Proti výrazné heterogenitě ložisek u našich pacientů však svědčí podobná korelace jejich objemu s objemem mozku v obou skupinách.
Disociace mezi atrofií mozku a míchy
Izolovaná atrofie míchy byla v naší kohortě přítomna pouze u 4,9 % pacientů, byla ale dvojnásobně častější u pacientů se závažnějším postižením (11,1 %) a vzácná u pacientů s minimálním postižením (1,7 %). Několik recentních studií ukázalo disociaci mezi rychlostí progrese atrofie mezi různými částmi CNS [8]. Tsagkas et al identifikovali skupinu s výraznou izolovanou progresí atrofie míchy a talamu, která byla spojena s vyšším stupněm postižení a s vyšší hladinou neurofilament [9]. V jiné studii byla současná přítomnost atrofie mozku a míchy nejdůležitějším rizikovým faktorem progrese postižení v čase. Překvapivé ale bylo, že izolovaná atrofie míchy zvyšovala riziko progrese podobně jako kombinovaná atrofie mozku a míchy, zatímco izolovaná atrofie mozku s vyšším rizikem progrese postižení spojena nebyla [22]. Průměrný roční úbytek objemu míchy byl na rozdíl od objemu mozku a objemu ložisek významným prediktorem zhoršení EDSS v čase jak u pacientů s relaps-remitentní RS, tak u pacientů se sekundárně progresivní RS a zrychlení průměrného ročního úbytku objemu míchy o 1 % bylo u obou typů RS spojeno s 28% zvýšením rizika progrese onemocnění v následujícím roce [23]. Extrémním případem izolovaného postižení míchy je další nově popsaná klinická jednotka, tzv. čistě míšní RS („pure spinal MS“), u které dochází k relabujícím myelitidám bez postižení mozku a bez retrobulbární neuritidy [24].
Vztah míšních ložisek, míšní atrofie a disability
Ve studiích hodnotících míchu na 1,5T přístrojích nebyla fokální míšní ložiska jasně spojena s míšní atrofií [25] a jejich počet koreloval s klinickým postižením jen slabě [26,27]. S klinickým postižením i atrofií míchy korelovaly lépe difuzní míšní změny, tedy oblasti splývajícího abnormálního lehce zvýšeného signálu bez ostrého ohraničení viditelné nejlépe v sekvenci PD (proton density) na sagitálních řezech [26]. Na druhou stranu se v novější práci ukázalo, že T1-hypointenzní ložiska, která byla v minulosti v míše popisována zřídka, jsou přítomna až u 87 % pacientů a oblasti míchy s T1-hypointenzními ložisky částečně odpovídají oblastem s lokální atrofií a korelují s klinickým stavem pacientů [28]. Korelace mezi počtem míšních ložisek, objemem míchy a klinickým postižením by mohla být zlepšena také díky informaci o lokalizaci míšních ložisek. Ložiska v postranních provazcích a v šedé hmotě míšní mají relativně vyšší klinický význam ve smyslu korelace s EDSS než míšní ložiska v jiných lokalizacích [29,30]. Bonacchi et al použili místo počtu míšních ložisek jejich normalizovaný objem (procento míšní tkáně postižené ložisky) a ukázali, že ložiska a objem šedé hmoty míšní vysvětlí větší podíl klinického postižení než globální a regionální objemy mozku. Jak objem ložisek v šedé hmotě krční míchy, tak objem šedé hmoty míšní byly nezávislými prediktory typu RS (cut-off pro plochu průřezu šedé hmoty 11,1 mm2 měl 90% senzitivitu a 91% specificitu pro odlišení mezi relaps-remitentní RS a progresivní RS).
Mozková a míšní rezerva
Jak u spárovaných skupin, tak u pacientů s disociací mezi ložisky a postižením se ukázalo, že pacienti s menším postižením mají signifikantně vyšší totální intrakraniální objem. Toto pozorování odpovídá teorii o tzv. mozkové rezervě („brain reserve“), podle které jsou pacienti s větším intrakraniálními objemy (a tedy i s původně větším absolutními objemy mozku) odolnější vůči poškození mozku patologickým procesem, potažmo vůči rozvoji klinických projevů, resp. neurologickému zhoršení [5,31]. Je možné, že pacientům s menším intrakraniálním objemem hrozí závažnější neurologické postižení než pacientům s identickým objemem ložisek s větším intrakraniálním objemem (větší rezervou). Protože je u zdravých dobrovolníků intrakraniální objem i objem mozku významným determinantem objemu krční míchy, lze si představit i jakousi „míšní rezervu“.
Kromě mozkové a míšní rezervy připadají v úvahu i další faktory, které umožňují kompenzovat ložiskové postižení viditelné na strukturální konvenční MR, např. lepší remyelinizace, menší množství kortikálních ložisek, menší zánětlivé postižení mening, menší postižení normálně vypadající bílé hmoty či neuroplastické a kompenzační mechanizmy. Tyto faktory bude nutné zkoumat pomocí nonkonvenčních kvantitativních technik a případně funkční MR. Bude také nutné pečlivě zohledňovat komorbidity.
Limitace
Hlavní limitací této práce je to, že jsme systematicky nehodnotili počet a objem míšních fokálních ložisek a difuzní míšní změny. Ve výše zmíněné práci týkající se disociace ložiskového a klinického nálezu se u pacientů s malým objemem ložisek a vysokým stupněm postižení ukázal vyšší počet ložisek v krční míše, nicméně objem míchy a distribuce intrakraniálních ložisek nebyly hodnoceny [10]. Průřezový charakter této práce nám neumožnil posoudit, zda u pacientů s velkým ložiskovým nálezem a malým postižením nedojde časem k progresi disability nebo atrofii některých struktur mozku. Nezohledňovali jsme také další, klinicky důležitý aspekt klinicko-radiologického paradoxu ve smyslu disociace počtu a tíže atak a nálezu na MR. Přístup založený na disociaci mezi relapsy a aktivitou na MR nedávno použili van Faals et al, kteří zkoumali prevalenci disociace mezi nálezem na MR a klinickou aktivitou a jeho význam ve smyslu dlouhodobé progrese klinického postižení [32]. Autoři nalezli podobně malé podíly pacientů s klinicky vysoce aktivním onemocněním i přes stabilní nález na MR (6,4 %) a klinicky stabilních pacientů s aktivitou na MR (5,1 %). Riziko progrese onemocnění po 6 a 11 letech se nelišilo od pacientů bez disociace.
Závěr
Naše práce ukázala, že objem míchy může u části pacientů vysvětlit diskrepanci mezi intrakraniálním ložiskovým nálezem a stupněm postižení. Výsledky jednoznačně podporují rozšíření monitorace MR o měření atrofie míchy. Poznatky získané naší studií jsou ve shodě s recentními pracemi, které ukazují, že vyšetření míchy (zejména její atrofie v čase) by mohlo v predikci klinického postižení hrát větší roli, než se původně předpokládalo, a možná i větší roli než ložiska a objem mozku [22,23,30,33]. Porozumění faktorům, které vedou k rozdílnému postižení pacientů, jejichž nález se na MR jeví podobně, a identifikace pacientů s dominantně míšním postižením, by mohly přispět k lepší klasifikaci fenotypů pacientů s RS a ke správnému výběru imunomodulační a neuroprotektivní léčby [34].
Etické aspekty
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Vyšetření MR proběhla v rámci pravidelného každoročního klinického sledování. Všichni pacienti souhlasili se sběrem a zpracováním klinických a imunologických dat a dat z MR v rámci mezinárodního online registru (MSBase) a v rámci Českého národního registru pacientů s RS (ReMuS) a podepsali informovaný souhlas. Vzhledem k retrospektivnímu sběru dat a neintervenčnímu přístupu nebylo vyžadováno schválení studie etickou komisí. Projekt zdravých dobrovolníků by schválen 20. 9. 2017 Etickou komisí Všeobecné Fakultní Nemocnice v Praze (KHL 182/2017; NCT03706118; Principal Investigator doc. MUDr. Dana Horáková, Ph.D.) a všichni účastníci podepsali informovaný souhlas.
Grantová podpora
Tato práce byla podpořena grantem AZV NV18-04-00168. Projekt zdravých dobrovolníků (Physiologic Volume and Atrophy of Brain and Spinal Cord Measured by Magnetic Resonance Imaging NCT03706118) byl podpořen firmou Roche. Práce byla dále podpořena projektem Progres Q27/LF1.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Michaela Andělová
Neurologická klinika
1. LF UK a VFN v Praze
Kateřinská 30
128 00 Praha
e-mail: michaela.andelova@vfn.cz
Přijato k recenzi: 20. 8. 2021
Přijato do tisku: 4. 11. 2021
Příloha (obr.1, část 1-5):
Fig. 1. Schematic representation of the proposed pipeline for spinal cord segmentation.
Sources
1. Barkhof F. The clinico-radiological paradox in multiple sclerosis revisited. Curr Opin Neurol 2002; 15 (3) 239–245. doi: 10.1097/00019052-200206000-00003.
2. Chard D, Trip SA. Resolving the clinico-radiological paradox in multiple sclerosis. F1000Res 2017; 6 : 1828. doi: 10.12688/f1000research.11932.1.
3. Lucchinetti C, Brück W, Parisi J et al. Heterogeneity of multiple sclerosis lesions: implications for the pathogenesis of demyelination. Ann Neurol 2000; 47 (6): 707–717. doi: 10.1002/1531-8249 (200006) 47 : 6<707:: aid-ana3>3.0.co; 2-q.
4. Granziera C, Wuerfel J, Barkhof F et al. Quantitative magnetic resonance imaging towards clinical application in multiple sclerosis. Brain 2021; 144 (5): 1296–1311. doi: 10.1093/brain/awab029.
5. Sumowski JF, Rocca MA, Leavitt VM et al. Brain reserve against physical disability progression over 5 years in multiple sclerosis. Neurology 2016; 86 (21): 2006–2009. doi: 10.1212/WNL.0000000000002702.
6. Uher T, Krasensky J, Malpas C et al. Evolution of brain volume loss rates in early stages of multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2021; 8 (3): e979. doi: 10.1212/NXI.0000000000000979.
7. Sastre-Garriga J, Pareto D, Rovira A. Brain atrophy in multiple sclerosis: clinical relevance and technical aspects. Neuroimaging Clin N Am 2017; 27 (2): 289–300. doi: 10.1016/j.nic.2017.01.002.
8. Eshaghi A, Marinescu RV, Young AL et al. Progression of regional grey matter atrophy in multiple sclerosis. Brain 2018; 141 (6): 1665–1677. doi: 10.1093/brain/awy088.
9. Tsagkas C, Parmar K, Pezold S et al. Classification of multiple sclerosis based on patterns of CNS regional atrophy covariance. Hum Brain Mapp 2021; 42 (8): 2399–2415. doi: 10.1002/hbm.25375.
10. Healy BC, Buckle GJ, Ali EN et al. Characterizing clinical and MRI dissociation in patients with multiple sclerosis. J Neuroimaging 2017; 27 (5): 481–485. doi: 10.1111/jon.12433.
11. Schmitter D, Roche A, Maréchal B et al. An evaluation of volume-based morphometry for prediction of mild cognitive impairment and Alzheimer’s dinase. Neuroimage Clin 2014; 7 : 7–17. doi: 10.1016/j.nicl.2014.11.001.
12. Chen X, Qian T, Maréchal B et al. Quantitative volume-based morphometry in focal cortical dysplasia: a pilot study for lesion localization at the individual level. Eur J Radiol 2018; 105 : 240–245. doi: 10.1016/j.ejrad.2018.06.019.
13. Fang E, Ann CN, Maréchal B et al. Differentiating Parkinson’s disease motor subtypes using automated volume-based morphometry incorporating white matter and deep gray nuclear lesion load. J Magn Reson Imaging 2020; 51 (3): 748–756. doi: 10.1002/jmri.26887.
14. Uher T, Krasensky J, Vaneckova M et al. A novel semiautomated pipeline to measure brain atrophy and lesion burden in multiple sclerosis: a long-term comparative study. J Neuroimaging 2017; 27 (6): 620–629. doi: 10.1111/jon.12445.
15. Andelova M, Uher T, Krasensky J et al. Additive effect of spinal cord volume, diffuse and focal cord pathology on disability in multiple sclerosis. Front Neurol 2019; 10 : 820. doi: 10.3389/fneur.2019.00820.
16. Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurology 1983; 33 (11): 1444–1452. doi: 10.1212/ wnl.33.11.1444.
17. Engl C, Schmidt P, Arsic M et al. Brain size and white matter content of cerebrospinal tracts determine the upper cervical cord area: evidence from structural brain MRI. Neuroradiology 2013; 55 (8): 963–970. doi: 10.1007/s00234-013-1204-3.
18. Droby A, Fleischer A, Carnini M et al. The impact of isolated lesions on white-matter fiber tracts in multiple sclerosis patients. Neuroimage Clin 2015; 8 : 110–116. doi: 10.1016/j.nicl.2015.03.003.
19. Keegan BM, Kaufmann TJ, Weinshenker BG et al. Progressive solitary sclerosis: gradual motor impairment from a single CNS demyelinating lesion. Neurology 2016; 87 (16): 1713–1719. doi: 10.1212/WNL.0000000000003235.
20. Burgetová A, Seidl Z, Vaněčková M et al. Magnetická rezonanční relaxometrie u roztroušené sklerózy – mě - ření T2 relaxačního času v centrální šedé hmotě. Cesk Slov Neurol N 2010; 73/106 (1): 26–31.
21. Trapp BD, Vignos M, Dudman J et al. Cortical neuronal densities and cerebral white matter demyelination in multiple sclerosis: a retrospective study. Lancet Neurol 2018; 17 (10): 870–884. doi: 10.1016/S1474-4422 (18) 30245-X.
22. Ruggieri S, Petracca M, De Giglio L et al. A matter of atrophy: differential impact of brain and spine damage on disability worsening in multiple sclerosis. J Neurol 2021; 268 (12): 4698–4706. doi: 10.1007/s00415-021-10576-9.
23. Tsagkas C, Magon S, Gaetano L et al. Spinal cord volume loss: a marker of disease progression in multiple sclerosis. Neurology 2018; 91 (4): e349–e358. doi: 10.1212/WNL.0000000000005853.
24. Schee JP, Viswanathan S. Pure spinal multiple sclerosis: a possible novel entity within the multiple sclerosis disease spektrum. Mult Scler 2019; 25 (8): 1189–1195. doi: 10.1177/1352458518775912.
25. Evangelou N, DeLuca GC, Owens T et al. Pathological study of spinal cord atrophy in multiple sclerosis suggests limited role of local lesions. Brain 2005; 128 (1): 29–34. doi: 10.1093/brain/awh323.
26. Lukas C, Sombekke MH, Bellenberg B et al. Relevance of spinal cord abnormalities to clinical disability in multiple sclerosis: MR imaging findings in a large cohort of patients. Radiology 2013; 269 (2): 542–552. doi: 10.1148/radiology.13122566.
27. Stankiewicz JM, Neema M, Alsop DC et al. Spinal cord lesions and clinical status in multiple sclerosis: a 1.5 T and 3 T MRI study. J Neurol Sci 2009; 279 (1–2): 99–105. doi: 10.1016/j.jns.2008.11.009.
28. Valsasina P, Aboulwafa M, Preziosa P et al. Cervical cord T1-weighted hypointense lesions at MR imaging in multiple sclerosis: relationship to cord atrophy and disability. Radiology 2018; 288 (1): 234–244. doi: 10.1148/radiol.2018172311.
29. Eden D, Gros C, Badji A et al. Spatial distribution of multiple sclerosis lesions in the cervical spinal cord. Brain 2019; 142 (3): 633–646. doi: 10.1093/brain/awy352.
30. Bonacchi R, Pagani E, Meani A et al. Clinical relevance of multiparametric MRI assessment of cervical cord damage in multiple sclerosis. Radiology 2020; 296 (3): 605–615. doi: 10.1148/radiol.2020200430.
31. Sandroff BM, Schwartz CE, DeLuca J. Measurement and maintenance of reserve in multiple sclerosis. J Neurol 2016; 263 (11): 2158–2169. doi: 10.1007/s00415-016-8104-5.
32. van Faals NL, Dekker I, Balk LJ et al. Clinico-radiological dissociation of disease activity in MS patients: frequency and clinical relevance. J Neurol 2020; 267 (11): 3287–3291. doi: 10.1007/s00415-020-09991-1.
33. Agosta F, Absinta M, Sormani MP et al. In vivo assessment of cervical cord damage in MS patients: a longitudinal diffusion tensor MRI study. Brain 2007; 130 (8): 2211–2219. doi: 10.1093/brain/awm110.
34. Coetzee T, Thompson AJ. Unified understanding of MS course is required for drug development. Nat Rev Neurol 2018; 14 (4): 191–192. doi: 10.1038/nrneurol.2017.184.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2021 Issue 6
Most read in this issue
- Stiff -person syndrom
- Normotenzní hydrocefalus
- Synukleinopatie a jejich laboratorní biomarkery
- Perorální kladribin v léčbě roztroušené sklerózy – data z celostátního registru ReMuS®





