Charakteristika aterosklerotického plátu a riziko mozkové ischemie při stentování vnitřní karotidy
Atherosclerotic plaque characteristics and the risk of brain ischemia during internal carotid artery stenting
Aim: The aim of a prospective multicenter study was to determine whether the risk of developing a new ischemic brain lesion on control MRI is dependent on some of the characteristics of atherosclerotic plaque detected by duplex sonography, MRI and CTA.
Materials and methods: Patients with internal carotid artery stenosis (70– 95%) indicated for carotid angioplasty and stenting (CAS) were consecutively included in the prospective observational study. All enrolled patients underwent neurological and physical examinations, duplex sonographic examination of the carotid arteries with evaluation of the structure of atherosclerotic plaque in the ultrasound B-mode, CTA of the cervical and cerebral arteries and MRI of the neck and brain. The univariate and multivariate logistic regression analyses were performed to identify factors affecting the risk of the onset of brain ischemia following CAS.
Results: A total of 121 patients (93 males, age 70.5 ± 7.6 years) were enrolled in the study. Within 30 days of the CAS, 4 patients suffered from stroke, 1 patient suffered from a transient ischemic attack and 1 patient died. A new ischemic lesion on control brain MRI was detected in 34 (28.1%) patients. Using univariate and multivariate logistic regression analysis, no predictor (atherosclerotic plaque characteristics, history data, CAS data) was found to influence the risk of the onset of new brain ischemia.
Conclusion: Characteristics of atherosclerotic plaque in the area of the internal carotid artery stenosis does not affect the risk of developing brain ischemia detected by brain MRI following CAS.
Keywords:
Atherosclerosis – ultrasound – stent – internal carotid artery – Stenosis – magnetic resonance imaging
Authors:
F. Charvát 1; J. Vrána 1; D. Netuka 2; F. Cihlář 3; A. Krajina 4; V. Chovanec 4; R. Herzig 5; V. Procházka 6
; M. Roubec 7; P. Kešnerová 8; D. Školoudík 7; Pro Antique Trial Group 9
Authors‘ workplace:
D. Hořínek, M. Sameš, J. Neumann, M. Orlický, D. Součková, D. Ospalík, S. Vachtlová, T. Moravec, Z. Šustrová, A. Malucelli (Krajská zdravotní a. s., Ústí nad Labem)
; M. Bar, J. Havelka, T. Jonszta, T. Fadrná (FN Ostrava)
; M. Lojík, J. Raupach, Z. Bělobrádek, J. Jandura, D. Krajíčková, M. Rek, Z. Horčičiková (FN Hradec Králové)
; Radiologická klinika, Komplexní cerebrovaskulární centrum, ÚVN – VFN Praha
1; Neurochirurgická klinika, Komplexní cerebrovaskulární centrum, ÚVN – VFN Praha
2; Radiologická klinika, Komplexní cerebrovaskulární centrum, Masarykova nemocnice o. z., Krajská zdravotní a. s., FZS Univerzity J. E. Purkyně, Ústí nad Labem
3; Radiologická klinika, Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové
4; Neurologická klinika, Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové
5; Ústav radiodiagnostický, Komplexní cerebrovaskulární centrum, FN Ostrava
6; Neurologická klinika, Komplexní cerebrovaskulární centrum, FN Ostrava
7; Neurologická klinika, Komplexní cerebrovaskulární centrum, 2. LF UK a FN Motol, Praha
8; ANTIQUE Trial Group:T. Belšan, L. Coufalová, J. Meluzín, K. Broulíková, O. Krahula (ÚVN - VFN Praha)
9
Published in:
Cesk Slov Neurol N 2020; 83(1): 84-94
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn202084
Overview
Cíl: Cílem prospektivní multicentrické studie bylo zjistit, zda riziko vzniku nové ischemické léze mozku na kontrolní MR je závislé na některé z charakteristik aterosklerotického plátu detekované pomocí duplexní sonografie, MR a CTA.
Materiál a metodika: Do prospektivní, observační studie byli konsekutivně zařazeni pacienti se stenózou vnitřní karotidy 70– 95 % indikovaní ke karotické angioplastice se zavedením stentu (carotid angioplasty and stenting; CAS). U všech zařazených pacientů byla provedena neurologická a fyzikální vyšetření, duplexní sonografické vyšetření krčních tepen se zaměřením na vyhodnocení struktury aterosklerotického plátu v UZ B-obraze, CTA krčních a mozkových tepen a MR krku a mozku. Byla provedena univariantní a multivariantní logistická regresní analýza pro nalezení faktorů ovlivňujících riziko vzniku ischemie mozku po CAS.
Výsledky: Do studie bylo zařazeno celkem 121 pacientů (93 mužů, věk 70,5 ± 7,6 let). Během 30 dní od CAS prodělali 4 pacienti CMP, 1 pacient tranzitorní ischemickou ataku, 1 pacient zemřel. Nová ischemická léze na kontrolní MR mozku byla detekována u 34 (28,1 %) pacientů. Pomocí univariantní a multivariantní logistické regresní analýzy nebyl nalezen žádný prediktor (charakteristika aterosklerotického plátu, anamnestické údaje, data z CAS) signifikantně ovlivňující riziko vzniku nové ischemie mozku.
Závěr: Charakteristika aterosklerotického plátu v oblasti stenózy vnitřní karotidy neovlivňuje riziko rozvoje ischemie mozku detekované pomocí MR mozku po CAS.
Klíčová slova:
vnitřní karotida – stenóza – ultrazvuk – magnetická rezonance – stent – ateroskleróza
Úvod
V posledním desetiletí se karotická angioplastika se zavedením stentu (carotid angioplasty and stenting; CAS) stala alternativní metodou léčby ke karotické endarterektomii u pacientů se stenózou vnitřní karotidy (arteria carotis interna; ACI) díky menší invazivitě – není zde problém s řeznou ránou, jejím hojením a následnou jizvou, není zde nebezpečí poškození hlavových nervů a není potřeba celkové anestezie [1– 7]. Ačkoli recentní studie ukázaly, že je možno při CAS dosáhnout obdobné postoperační mortality a rizika iktu jako u karotické endarterektomie, riziko vzniku klinicky asymptomatických (němých) mozkových infarktů detekovaných pomocí MR je u CAS výrazně vyšší [8– 12].
Optimální selekcí pacientů a optimalizací intervenčního výkonu by mohlo být dosaženo snížení rizika nejen CMP a tranzitorní ischemické ataky (TIA), ale také němých mozkových infarktů a následného poklesu kognitivních funkcí u pacientů podstupujících CAS.
Výsledky několika prospektivních studií potvrdily zvýšené riziko CMP se zvyšujícím se procentem karotické stenózy až k 95% stenóze. Riziko iktu je také vyšší u symptomatické než u asymptomatické stenózy, ale toto riziko se snižuje s časem od proběhlého iktu. Po 6 měsících od iktu již neexistuje žádný významný rozdíl v riziku CMP mezi symptomatickými a asymptomatickými stenózami karotid [13,14]. Kromě těchto dvou faktorů bylo studováno mnoho dalších faktorů ovlivňujících pooperační riziko CMP, TIA a němých mozkových infarktů [11,15– 19]. Jedním z potenciálních faktorů, které mohou ovlivnit riziko perioperačních a pooperačních komplikací, je charakter aterosklerotického plátu v oblasti karotické stenózy, tzv. nestabilní nebo vulnerabilní plát [16– 19].
Cílem prospektivní multicentrické studie bylo zjistit, zda je riziko vzniku nové ischemické léze mozku na kontrolní MR závislé na některé z charakteristik aterosklerotického plátu detekované pomocí duplexní sonografie, MR a CTA.
Materiál a metodika
Pacienti
V průběhu 3 let (květen 2016 až duben 2019) byli do prospektivní observační studie konsekutivně zařazeni ve 4 komplexních cerebrovaskulárních centrech (ÚVN – VFN Praha, FN Hradec Králové, FN Ostrava a Masarykova nemocnice Ústí nad Labem) pacienti se stenózou ACI 70– 95 % indikovaní k CAS v rámci studie Atherosclerotic Plaque Characteristics Associated with a Progression Rate of the Plaque in Carotids and a Risk of Stroke (ANTIQUE).
Vstupními kritérii pro zařazení pacienta do studie byly:
- věk 25– 80 let;
- detekovaná stenóza ACI 70– 99 % dle CTA;
- indikace CAS dle kritérií European StrokeOrganisation/ European Society of Cardio-logy [20] a American Heart Association/ American Stroke Association [21];
- podpis informovaného souhlasu.
Vylučujícími kritérii byly:
- okluze kontralaterální vnitřní karotidy;
- implantovaný kardiostimulátor nebo klaustrofobie jako kontraindikace provedení MR krku a mozku;
- nekontrolovatelné pohyby hlavy a krku nebo nespolupráce pacienta.
U všech zařazených pacientů byla provedena neurologické a fyzikální vyšetření, duplexní sonografické vyšetření krčních tepen se zaměřením na vyhodnocení struktury aterosklerotického plátu v UZ B-obraze, CTA krčních a mozkových tepen a MR krku a mozku (s maximálním odstupem 14 dní mezi vyšetřeními).
Duplexní sonografie karotických tepen
Všichni pacienti podstoupili duplexní sonografické vyšetření krčních a intrakraniálních tepen. Byly použity následující ultrazvukové přístroje – ESAOTE MyLab Twice (Esaote, Janov, Itálie), Toshiba Aplio (Toshiba, Kjóto, Japonsko), Samsung HS70A (Samsung, Seongnam-si, Jižní Korea). U všech pacientů byly změřeny úhlově korigovaná maximální systolická rychlost (peak systolic velocity; PSV), konečná diastolická rychlost (end-diastolic velocity; EDV) a průměrná průtoková rychlost (mean flow velocity; Vmean) v oblasti stenózy, velikost (šířka) aterosklerotického plátu, reziduální průměr tepny v místě stenózy, průměry tepny jak v oblasti stenózy, tak distálně za stenózou.
Vyhodnocení složení aterosklerotického plátu v karotické tepně bylo provedeno v B-obraze. Byly hodnoceny echogenita (nízce echogenní – echogenita blízká echogenitě lumina tepny; středně echogenní – echogenita jasně vyšší než echogenita lumina tepny, ale nedosahující echogenity adventicie; hyperechogenní – echogenita blízká echogenitě adventicie; kalcifikovaný plát – plát s vyšší echogenitou následovaný anechogenním stínem), homogenita (homogenní – ≥ 50 % obsahu plátu je shodné echogenity; heterogenní – < 50 % obsahu plátu je shodné echogenity) a povrch plátu (hladký – bez zobrazitelných nerovností na povrchu; nepravidelný – nepravidelnosti povrchu hloubky ≤ 1 mm; ulcerovaný – nepravidelnosti povrchu hloubky > 1 mm). Echolucentní (anechogenní) část aterosklerotického plátu > 8 mm2 byla posuzována jako krvácení do plátu (intralaque hemorrhage; IPH). Pomocí digitální analýzy obrazu byly programem CEREB B-Mode Assist (TESCOSW, Olomouc, ČR) zhodnoceny echogenní složení plátu (echogenní index) a homogenita (MaxDif). Procenta stenózy byla stanovena dle publikovaných kritérií odpovídajících hodnocení dle studie North American Symptomatic Carotid Endarterectomy Trial (NASCET – stenóza nad 70 %: PSV > 230 cm/ s, EDV > 100 cm/ s, poměr PSV v ACI a a. carotis communis > 4, PSV za stenózou ≥ 50 cm/ s, odpovídající nález v B-obraze) [22].
Výpočetně tomografická angiografie
U všech pacientů byla před CAS provedena standardní helikální multidetektorová CTA na přístrojích Philips Briliance iCT128 a Philips Ingenuity 64 (Philips, Eindhoven, Nizozemí), Siemens Definition AS+ (Siemens, Erlangen, Německo) a Siemens Somatom AS+ (Siemens Healthineers, Forchheim, Německo) s aplikací jodované kontrastní látky intravenózně: 50– 100 ml Iomeron 400 (Bracco Imaging, Milán, Itálie), (dávka podle hmotnosti pacienta, rychlost podání 3– 4 ml/ min) automatickým injektorem přes alespoň 20G kanylu zavedenou v periferní žíle. Skenování bylo spuštěno sledováním bolusu ve vzestupné aortě. CT skeny pokrývaly oblast od aortálního oblouku až nad Willisův okruh. Nezpracovaná data byla uložena a 1mm multiplanární rekonstrukce a rekonstrukce projekce maximální intenzity projekce (MIP) byly následně posouzeny zkušeným radiologem.
Na CTA bylo hodnoceno procento stenózy krčních a intrakraniálních tepen vč. ACI indikované k CAS podle metodiky studie NASCET pomocí dedikovaného software CT přístroje [23]. Následně byly evaluovány charakteristiky aterosklerotického plátu a pláty byly zhodnoceny dle denzity jako tukové (< 50 HU), smíšení a kalcifikované (> 120 HU). Dále byla stanovena také přítomnost aterosklerotického plátu v aortálním oblouku.
Magnetická rezonance
Vyšetření MR bylo provedeno na přístrojích Siemens 1.5 T Avanto a 3T Skyra (Siemens, Erlangen, Německo), GE 3T Discovery 750w (General Electric Medical Systems, Milwaukee, WI, USA) a Philips Ingenia 3T (Philips, Eindhoven, Nizozemí). U všech pacientů byly provedeny MR karotických tepen a MR mozku 24 ± 5 h před CAS. Kontrolní vyšetření mozku bylo realizováno 24 ± 5 h po provedení CAS.
Protokol MR vyšetření karotických tepen se skládal ze 4 sekvencí:
- T1-vážené_TSE_FatSat sekvence, axiální řezy (čas echa [echo time, TE] 19 ms, repetiční čas [repetition time, TR] 600 ms; šířka vrstvy [slice thickness, ST] 3 mm; velikost matrix [matrix size] 230 × 256; distanční faktor [gap] 0,3 mm; zobrazovaná oblast [field of view; FOV] 256 mm; fáze FOV [FOV phase] 100 %; Turbo factor [TF] 2; počet excitací [number of excitations, NEX] 2; délka sekvence 3:50 min).
- 3D_T1_MPRAGE sekvence, axiální řezy, IPH senzitivní (TE 4 ms; TR 670 ms; inverzní čas [inversion time, TI] 370 ms, ST 1 mm; matrix size 192 × 256; gap 0 mm; FOV 180 mm; FOV phase 75; Q3 NEX 3; délka sekvence 5:49 min).
- T2-vážené TSE sekvence, axiální řezy (TE 72 ms; TR 4 580 ms; ST 4 mm; matrix size 294 × 384; gap 0,4 mm; FOV 230 mm; FOV phase 100, TF 14; Q3 NEX 2; délka sekvence 3:18 min).
- 3D_TOF sekvence, axiální řezy (TE 7 ms; TR 24 ms; ST 1 mm; matrix size, 198 × 384; gap 0 mm; FOV 200 mm; FOV phase 75%; Q3 NEX 1; délka sekvence 2:43 min).
Protokol MR vyšetření mozku se skládal také ze 4 sekvencí:
- T2-vážené spin echo sekvence (TE 100 ms; TR 4310 ms; ST 5,0 mm; matrix size 192 × 256; gap 0,5 mm; FOV 250 mm; FOV phase 75 %; echo train length [ETL] 9; Q3 NEX 1).
- difuzí vážené (diffusion weighted imaging; DWI) sekvence (TE 130 ms; TR 4 500 ms; b faktor DWI sekvencí 0 a 1 000 s/ mm2; ST 5,0 mm; gap 1 mm, koeficient 0,2, následně bylo počítáno s efektivní tloušťkou vrstvy; matrix size 192 × 192; FOV 255 mm; FOV phase 100 %; NEX 4; šířka pole [bandwidth] 1 240 Hz/ pixel) s mapou zdánlivých difúznich koeficientů (apparent diffusion coefficient, ADC) 9.
- T2*-vážené gradient-recalled echo sekvence (TE 20 ms; TR 820 ms; ST 4 mm; gap 0,5 mm; matrix size 192 × 256; FOV 250 mm; FOV phase 75 %; NEX 1) na detekci krvácení, vč. mikrokrvácení.
- Fluid-attenuated inversion recovery (FLAIR) sekvence (TE 109 ms; TR 8 000 ms; TI 2 500 ms; ST 5,0 mm; matrix size, 256 × 151; gap 0.5 mm; FOV 250 mm; FOV phase 77,0 %; NEX 1; ETL 5).
Hyperintenzity na 3D_T1_MPRAGE krčních MR obrazech byly hodnoceny jako IPH. Dále byly posuzovány enhancement v oblasti karotického plátu, lipidové jádro, fibrózní čepička, ruptura plátu a procento stenózy.
Na MR mozku byla hodnocena přítomnost mozkové ischemie nebo jiných patologií před provedením CAS. Na kontrolní MR mozku byla zjišťována přítomnost nových ischemických změn a známek krvácení. Hyperintenzní ložiska na MR-DWI obrazech mozku (hypointenzní na vypočtené mapě ADC) byla hodnocena jako čerstvá ischemie.
Digitální subtrakční angiografie a karotická angioplastika se zavedením stentu
Pacienti indikovaní k CAS podstoupili diagnostický a intervenční výkon s využitím DSA. Výkon byl proveden zkušeným intervenčním radiologem s minimálně 5letou praxí a minimálně 25 CAS ročně z femorálního přístupu. Nejprve byla provedena standardní diagnostická angiografie na přístrojích GE Innova Biplane (General Electric Medical Systems, Milwaukee, WI, USA), GE Innova IGS 630 (GE Healthcare, Chicago, IL, USA), Philips Allura Xper FD 20 a Allura Clarity Xper 20/ 20 (Philips Medical System, Best, Nizozemsko) se stanovením procenta stenózy v intervenované ACI dle metodiky studie NASCET [23]. Pokud to bylo možné, byla použita distální protekce v průběhu výkonu. Po zavedení filtru/ vodiče přes oblast intervenované stenózy byla dle potřeby provedena předdilatace stenózy pomocí balónku a zavedení stentu Carotid Wallstent (Boston Scientific Corp, Natick, MA, USA). Poté dle nálezu uskutečněna ještě dodilatace reziduální stenózy ve stentu pomocí balónku a bylo vytaženo protekční zařízení. Po zákroku byla realizována kontrolní angiografie se zhodnocením výsledného nálezu.
Klinická vyšetření a demografická data
Všichni pacienti byli vyšetřeni neurologem se zhodnocením neurologického deficitu pomocí škály National Institutes of Health Stroke Scale (NIHSS) před CAS, 24 h a 30 dní po CAS. Soběstačnost byla posuzována pomocí modifikované Rankinovy škály (mRS). Test rezistence na protidestičkovou léčbu nebyl standardně prováděn. Byla byla zaznamenána následující anamnestická data: věk, pohlaví, strana stenózy ACI, procento stenózy ACI dle všech 4 vyšetřovacích metod (duplexní sonografie, CTA, MR a DSA), proběhlá a přítomná onemocnění – arteriální hypertenze, diabetes mellitus, hyperlipidemie, ischemická choroba srdeční, fibrilace síní, infarkt myokardu, ischemická CMP, TIA, amaurosis fugax a retinální infarkt v anamnéze. Dále byly zaznamenány údaje o užívání protidestičkové terapie, antikoagulancií, perorálních antidiabetik, inzulínu a statinu vč. dávky statinu, anamnéza kouření a množství denní konzumace alkoholu (1 jednotka = 0,5 l 12° piva nebo 1,5 dl vína nebo 0,5 dl destilátu) [24].
Statistika
Výpočet velikosti vzorku vycházel z předpokládaného relativního rozdílu 50 % a absolutního rozdílu 20 % v riziku nové mozkové ischemie detekované na kontrolní MR mozku 24 h po CAS mezi přítomnými a nepřítomnými jednotlivými testovanými charakteristikami aterosklerotického plátu. Výpočty ukázaly, že k dosažení významného rozdílu s hladinou významnosti alfa (pravděpodobnosti výskytu chyby typu I) = 0,05 a síle testu beta = 0,8 je potřeba do studie zařadit minimálně 120 pacientů.
Normalita rozložení dat byla testována Shapir-Wilkovým testem. Data s normálním rozložením jsou prezentována formou průměru a směrodatné odchylky, ostatní data formou mediánu, průměru a směrodatné odchylky. Kategorické proměnné byly porovnávány pomocí Fisherova přesného testu, kontinuální proměnné pomocí Mann-Whitneyho U testu. Následující proměnné byly použity v univariantní a multivariantní logistické regresní analýze pro nalezení faktorů ovlivňujících riziko vzniku ischemie mozku po CAS (metoda Enter): věk, pohlaví, strana stenózy, procento stenózy, arteriální hypertenze, diabetes mellitus, hyperlipidemie, ischemická choroba srdeční, infarkt myokardu, fibrilace síní, ischemická CMP, TIA, amaurosis fugax, retinální infarkt v anamnéze, kouření, denní dávka alkoholu, užívání protidestičkových léků, antikoagulancií, antihypertenziv vč. jejich počtu, perorálních antidiabetik, inzulínu a statinu vč. dávky statinu.
Statistická signifikance byla definována hodnotou p < 0,05 s následnou korekcí dle Bonferroniho. Data byla analyzována pomocí software SPSS v.22.0 software (IBM, Armonk, NY, USA).
Výsledky
Do studie bylo zařazeno celkem 121 pacientů (93 mužů, průměrný věk 70,5 ± 7,6 let) se stenózou ACI, u kterých byla následně provedena CAS. U 54 pacientů se jednalo o symptomatickou stenózu, v jejímž povodí proběhla ischemická CMP, TIA, amaurosis fugax nebo retinální infarkt v posledních 6 měsících, u zbývajících 67 pacientů se jednalo o asymptomatickou stenózu. Demografické údaje zařazených pacientů jsou uvedeny v tab. 1.
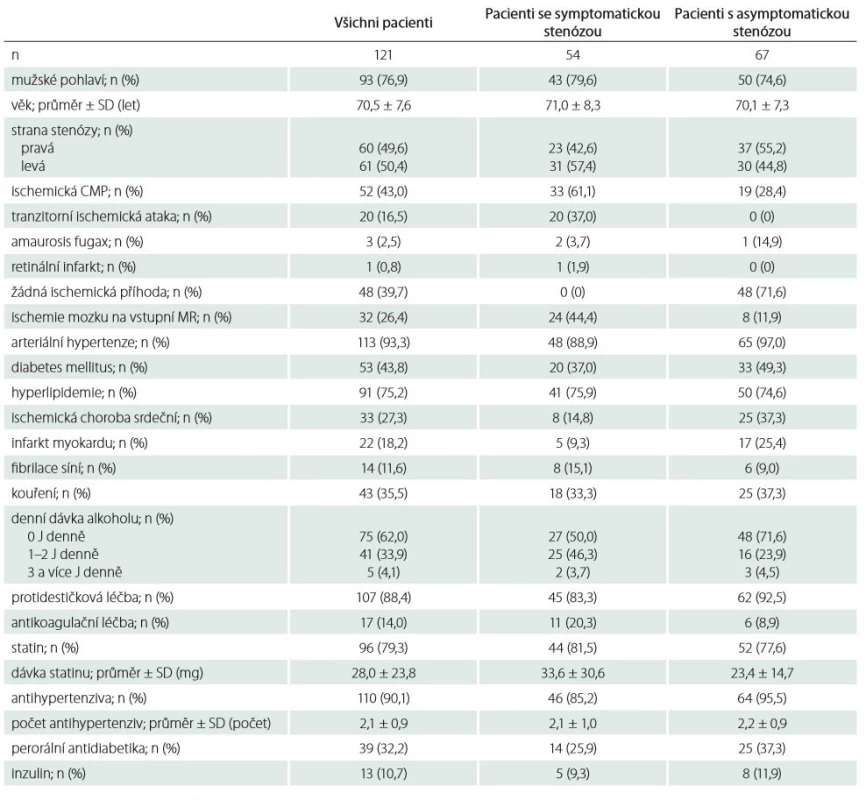
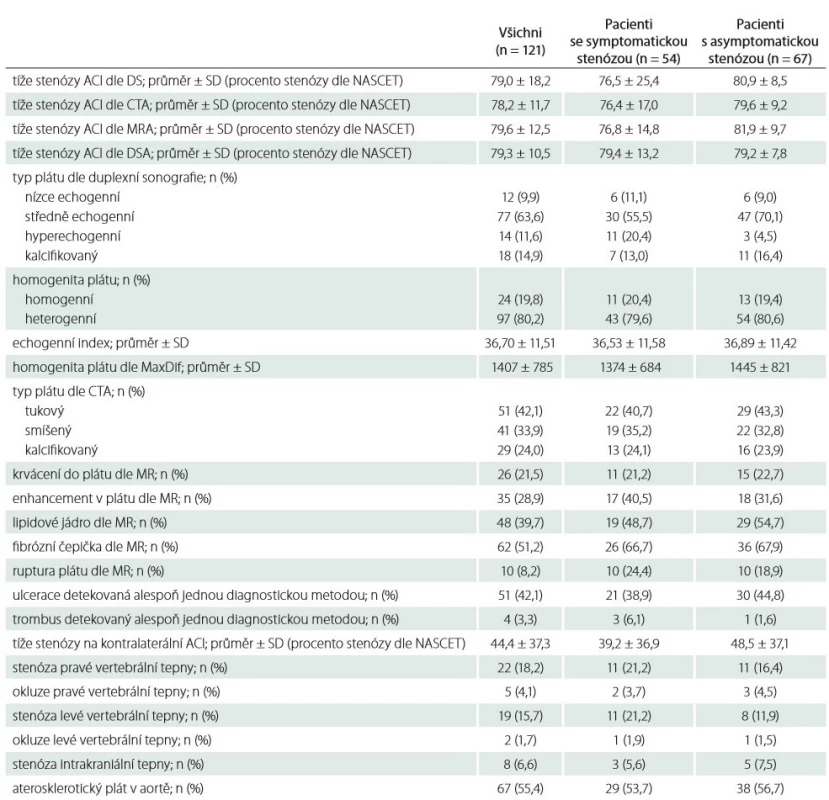
Charakteristika aterosklerotických plátů je uvedena v tab. 2. Typ a složení aterosklerotického plátu u pacientů se symptomatickou a asymptomatickou stenózou se signifikantně nelišily (p > 0,05 ve všech případech). Průměrný čas provedení CAS byl 35,3 ± 12,1 min, u 4 pacientů byl výkon proveden v celkové anestezii (na vlastní žádost pro anxietu), u zbývajících 117 pacientů byl výkon proveden v lokální anestezii (tab. 3).
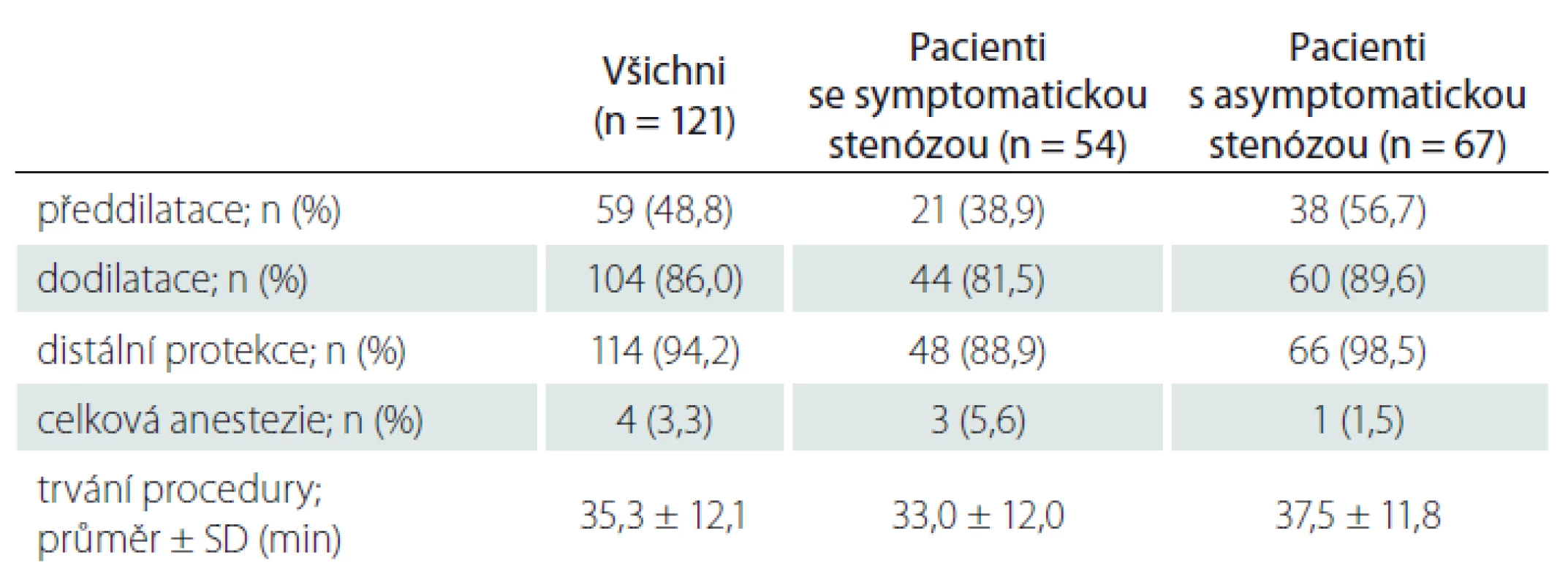
Během 30 dní od CAS prodělali CMP 4 (3,3 %) pacienti, z toho 3 měli výkon na symptomatické a 1 na asymptomatické stenóze. Tři z těchto 4 pacientů měli již asymptomatickou novou ischemickou lézi na kontrolní MR mozku 24 h po CAS. Jeden pacient (0,8 %) během 30 dní od výkonu prodělal TIA a 1 (0,8 %) pacient zemřel (plicní embolie) (tab. 4).
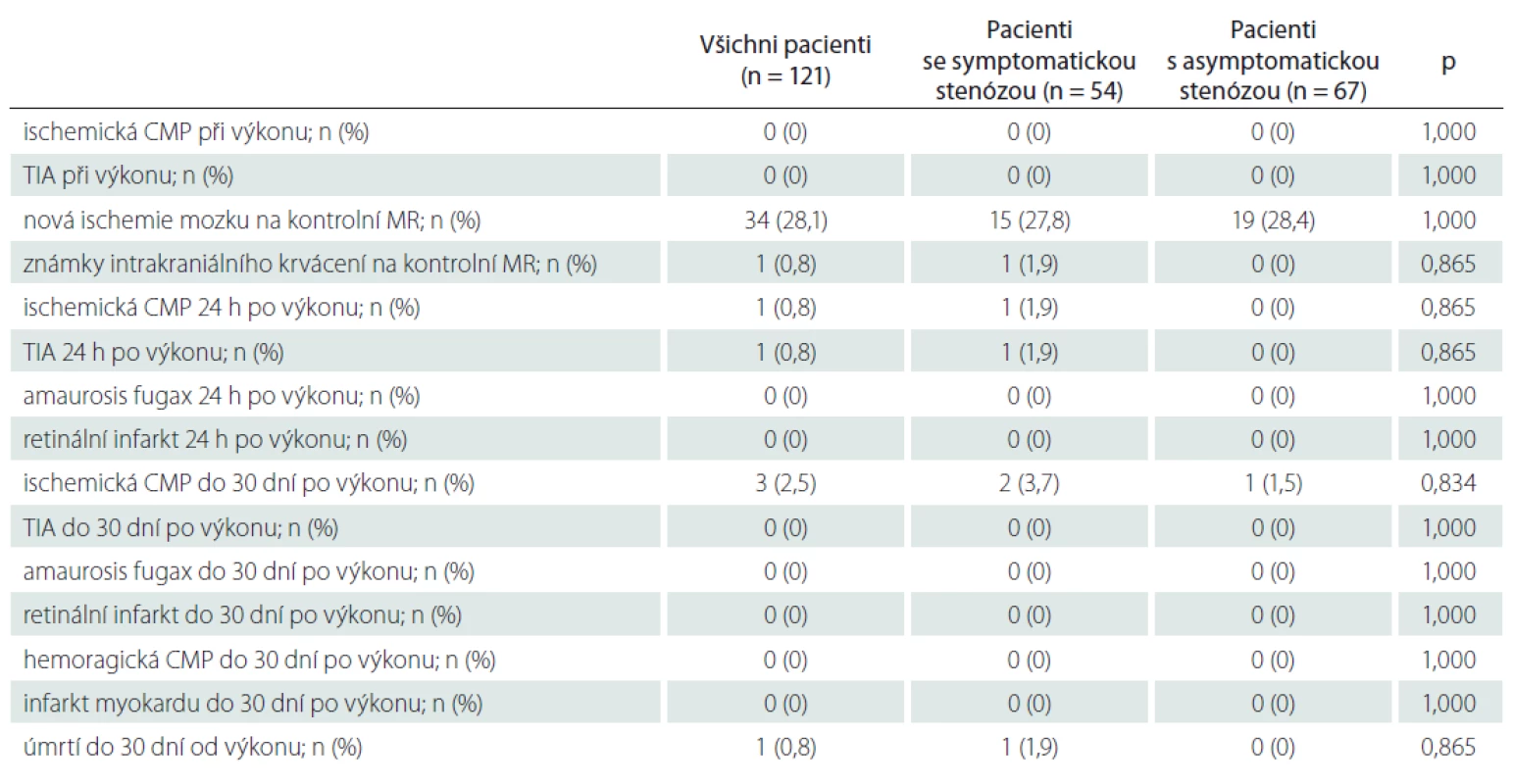
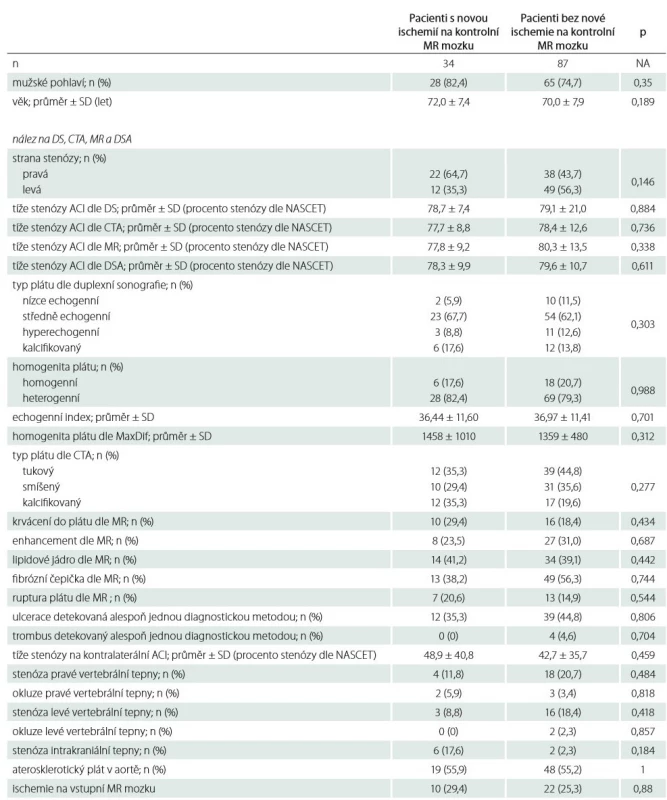
Nová ischemická léze na kontrolní MR mozku byla detekována u 34 (28,1 %) pacientů (tab. 4). U 24 pacientů (19,8 %) byly ischemie jen v povodí intervenované tepny, u ostatních 97 pacientů (80,2 %) byly ischemie zjištěny i v povodí dalších krčních tepen. U 1 pacienta bylo detekováno drobné asymptomatické intracerebrální krvácení (zdroj nenalezen). Porovnání charakteristik aterosklerotického plátu mezi pacienty s novou ischemií mozku na kontrolní MR ve srovnání s pacienty bez nové ischemie je uvedeno v tab 5. Nebyl nalezen signifikantní rozdíl v typu a složení aterosklerotického plátu, procentu stenózy, nálezu na ostatních tepnách, anamnestických údajích ani v charakteristikách provedeného výkonu mezi oběma skupinami pacientů. Pomocí multivariantní logistické regresní analýzy nebyl mezi sledovanými faktory nalezen žádný prediktor, který by signifikantně ovlivňoval riziko vzniku nové ischemie mozku na kontrolní MR.

Diskuze
V prezentované studii byla u pacientů podstupujících CAS pro stenózu ACI 30denní morbidita (CMP nebo infarkt myokardu) a mortalita 3,3 %, přičemž u pacientů se symptomatickou stenózou byla 5,6 % u pacientů s asymptomatickou stenózou 1,5 %, což je ve shodě s dosud publikovanými studiemi [2– 5,7,12,15]. V posledních dekádách proběhlo několik studií srovnávajících bezpečnost a účinnost CAS s karotickou endarterektomií (např. SAPPHIRE [Stenting and Angioplasty With Protection in Patients at High Risk for Endarterectomy], SPACE [Stent-Protected Angioplasty versus Carotid Endarterectomy], TECAS-C [Trial of Endarterectomy versus Stenting for the Treatment of Carotid Atherosclerotic Stenosis in China], BACASS [Basel Carotid Artery Stenting Study], EVA-3S [Endarterectomy Versus Angioplasty in Patients with Symptomatic Severe Carotid Stenosis], CAVATAS [Carotid and Vertebral Artery Transluminal Angioplasty Study], ICSS [The International Carotid Stenting Study], CREST [The Carotid Revascularization Endarterectomy versus Stenting Trial]), které prokázaly vyšší nebo shodnou morbiditu a mortalitu CAS ve srovnání s karotickou endarterektomií [2– 5,7]. Identifikace a následná eliminace faktorů zvyšujících periprocedurální a postprocedurální riziko distální embolizace a následného vzniku němých nebo symptomatických mozkových infarktů by mohla vést ke snížení tohoto rizika na úroveň karotické endarterektomie nebo dokonce pod tuto úroveň.
Jelikož počet vaskulárních příhod v průběhu intervenčních výkonů na karotidách a v následných 30 dnech je relativně nízký a pohybuje se okolo 6 %, je do studií srovnávajících klinické vaskulární příhody potřeba zařadit velmi vysoký počet pacientů. Oproti tomu pomocí MR mozku je možno detekovat němé mozkové ischemie u výrazně vyššího počtu pacientů (okolo 40 %) časně po CAS, díky čemuž se MR mozku stává stále častějším zástupným markerem klinické CMP [25,26]. Navíc recentní studie ukazují, že u pacientů s němými mozkovými ischemiemi dochází následně k výraznějšímu poklesu kognitivních funkcí s vyšším rizikem vzniku demence [12,27,28].
Prevalence nové mozkové ischemie na kontrolní MR 24 h po výkonu byla v prezentované studii 28,1 %, přičemž se nelišila mezi pacienty se stenózou symptomatickou (27,8 %) a asymptomatickou (28,4 %). U všech pacientů se jednalo o klinicky asymptomatickou lézi, kdy v průběhu CAS ani v prvních 24 h od výkonu nedošlo k vaskulární příhodě (CMP, TIA, infarktu myokardu či vaskulárnímu úmrtí) u žádného ze sledovaných pacientů. Riziko vzniku nové němé ischemie po CAS bylo nižší ve srovnání s proběhlými studiemi, kde dle recentní metaanalýzy dosahovalo průměrně 37,4 % (95% CI: 32,6– 42,1 %), nicméně i přesto je toto riziko stále vyšší než u karotické endarterektomie, kde dosahovalo dle této metaanalýzy průměrně 13,0 % (95% CI: 9,1– 16,8 %) [29]. Podobné výsledky byly zjištěny i v metaanalýze 6 velkých studií srovnávající CAS s karotickou endarterektomií. Ta prokázala shodnou prevalenci nových ischemických lézí detekovaných na MR-DWI u pacientů po CAS 37 vs. 10 % u karotické endarterektomie s odds ratio 6,1 [11].
V předchozí studii jsme neprokázali vliv laboratorních markerů hemokoagulace ani klasických rizikových faktorů na riziko vzniku mozkové ischemie po CAS na kontrolní MR mozku [15]. V prezentované studii jsme neprokázali vliv nejen klasických rizikových faktorů (arteriální hypertenze, diabetes mellitus, hyperlipidemie, kouření, alkohol, prodělaná vaskulární příhoda, fibrilace síní), ale ani charakteristiky (složení) aterosklerotického plátu v oblasti stenózy, tíže a lokalizace stenózy či periprocedurálních dat. Především tzv. nestabilní (vulnerabilní) aterosklerotický plát je považován za faktor potenciálně zvyšující riziko distální embolizace v průběhu CAS. Asi nejvíce prostudovaným markerem je zde IPH. Ačkoli recentní studie i metaanalýza prokázaly zvýšení rizika detekce mozkového infarktu na kontrolní MR po CAS u stenóz s IPH asi o 50 % oproti stenózám bez detekovatelného krvácení, v našem souboru byl zaznamenám pouze statisticky nevýznamný trend zvýšení tohoto rizika (také cca o 50 %) [30,31]. Ani přítomnost dalších markerů nestability plátu, jako jsou ulcerace, trombóza na plátu, či anechogenní plát na duplexní sonografii se nelišila mezi pacienty s novou ischemií mozku a pacienty bez nově detekované mozkové ischemie.
Nižší riziko nové klinicky němé ischemie mozku v naší studii oproti dříve publikovaným studiím může souviset s vývojem a zlepšením instrumentárií používaných při CAS či zvyšující se zkušeností intervenčních radiologů [11,32– 34]. Ačkoli dle jednotlivých publikovaných studií zůstávala dlouhou dobu prevalence němých mozkových ischemií po CAS na stejné úrovni [10,11], recentní studie prokazují pokles této prevalence, který je pravděpodobně spojen s používáním cerebrální protekce, především proximální, používáním zavřených stentů (closed-cell stents) a optimalizací antitrombotické léčby [11,29,32– 35].
Na rozdíl od karotické endarterektomie lze po CAS detekovat ischemická ložiska nejen v povodí intervenované tepny, ale také v povodí kontralaterální karotidy nebo ve vertebrobazilárním řečišti. Ta se v našem souboru vyskytovala téměř u 20 % pacientů, což je v souladu s dříve publikovanými studiemi [8– 12,36]. Příčin zvýšeného rizika embolizace do mozku při CAS oproti karotické endarterektomii se zvýšením rizika vzniku klinicky němých i symptomatických mozkových infarktů, a to i v oblastech mimo řečiště intervenované tepny je více. Za nejčastější příčinu je považována embolizace částí ateromové masy z oblasti stenózy či proximálněji lokalizovaných aterosklerotických plátů vč. oblasti aortálního oblouku a lokální trombóza s distální embolizací způsobená mechanickým poškozením endotelu a odhalení prokoagulačních složek aterosklerotického plátu [37]. Tvorba drobných trombů na katétrech a vodicích drátech používaných při CAS by mohla být další příčinou lokální trombózy s distální embolizací [38]. Endogenní hypofibrinolytické stavy způsobené vysokými hladinami inhibitoru aktivátoru plazminogenu-1 (PAI-1) se také mohou podílet na vzniku němých mozkových infarktů po CAS [39]. K dalším potenciálním příčinám vzniku němých mozkových infarktů může patřit také embolizace vzduchových bublin, především v průběhu aplikace kontrastní látky [40].
Základní antitrombotickou léčbou snižující prevalenci klinicky němých i symptomatických mozkových infarktů je duální protidestičková terapie (klopidogrel + acetylsalicylová kyselina) [41]. Otázkou však zůstává optimální antitrombotická léčba u pacientů na dlouhodobé antikoagulační léčbě. Také optimalizace antitrombotické léčby u pacientů s rezistencí na acetylsalicylovou kyselinu anebo klopidogrel není objasněna, přičemž prevalence rezistence se odhaduje 6– 27 % na acetylsalicylovou kyselinu a 15– 30 % na klopidogrel [15,42– 44]. Výsledky studie ARMYDA-9 CAROTID (Clopidogrel and Atorvastatin Treatment During Carotid Artery Stenting) prokázaly, že vysoká úvodní dávka klopidogrelu (600 mg) s vysokou dávkou atorvastatinu (80 mg 12 h před výkonem + 40 mg 2 h před výkonem) je spojena se sníženým rizikem ischemických cerebrálních lézí po CAS a se sníženým rizikem CMP nebo TIA během dalších 30 dní [34]. Další studie však tento benefit vysoké dávky klopidogrelu (600 mg) ve srovnání se standardní dávkou (300 mg) neprokázala [45]. Ani v naší prezentované studii jsme neprokázali vliv antitrombotické léčby ani užívání statinu (vč. jeho dávky) na vznik klinicky němého mozkového infarktu.
Závěrem je třeba uvést také limitace studie. Vzhledem k multicentrickému charakteru studie bylo použito více diagnostických přístrojů různých firem, což mohlo vést k drobným rozdílům při hodnocení jednotlivých patologií. Pro omezení této chyby byla provedena kalibrace přístrojů na 5 aterosklerotických plátech in vitro. Počet zařazených pacientů byl vypočten k detekci vlivu jednotlivých charakteristik aterosklerotického plátu na vznik nové mozkové ischemie po CAS, nicméně tento počet nemusí být dostatečný pro identifikaci ostatních faktorů a také faktorů, které nezvýšily nebo nesnížily riziko nové ischemie alespoň o 50 %. Je také potřeba uvést, že do studie nebyli zařazováni všichni pacienti, kteří byli indikováni k CAS na daných pracovištích, ale jen pacienti zařazení do studie ANTIQUE, kteří splnili vstupní a vylučující kritéria. Další limitací je fakt, že test rezistence na protidestičkovou léčbu nebyl standardně prováděn u všech pacientů. Nicméně v naší předcházející studii nebylo u pacientů s rezistencí na acetylsalicylovou kyselinu nebo klopidogrel zvýšené riziko vzniku nových ischemických ložisek v mozku [15]. Další obecnou limitací detekce nových ischemických ložisek pomocí MR mozku je použitá šířka vrstvy řezu, která v naší studii byla 1 mm, takže ischemická ložiska o průměru menším než 1 mm nemusela být zobrazena. Jako silnou stránku lze naopak uvést prospektivní charakter studie a použití pouze jednoho typu stentu. Analýza objemu a lokalizace nových ischemických ložisek nebyla cílem této studie a tato analýza bude publikována v následující práci.
Závěr
Studie neprokázala vliv sledovaných charakteristik aterosklerotického plátu na riziko vzniku mozkového infarktu detekovaného pomocí MR po provedené CAS, stejně jako jednotlivých rizikových faktorů CMP, prodělaných onemocnění, typu dlouhodobé léčby vč. antitrombotické léčby či délky intervenční procedury a typu anestezie. Třicetidenní morbidita a mortalita v prezentovaném souboru dosáhla 3,3 % (5,6 % u pacientů se symptomatickou a 1,5 % s asymptomatickou stenózou). Prevalence nové mozkové ischemie na kontrolní MR 24 h po výkonu činila 28,1 %, přičemž se nelišila mezi pacienty se symptomatickou a asymptomatickou stenózou.
Etické aspekty
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008) a byla schválena lokálními etickými komisemi všech 4 zúčastněných nemocnic – ÚVN – VFN Praha (108/ 8-53/ 2015, 15.6.2015), FN Hradec Králové (201507S14P, 30.6.2015), FN Ostrava (474/ 2015, 4.6.2015) a Masarykovy nemocnice Ústí nad Labem (227/ 98, 24.6.2015). Všichni pacienti podepsali informovaný souhlas s účastí ve studii. Studie byla registrována před zařazením prvního pacienta na www.clinicaltrials.gov (Identifier: NCT02360137).
Grantová podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-30965A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 18. 12. 2019
Přijato do tisku: 9. 1. 2020
prof. MUDr. David Školoudík, Ph.D., FESO, FEAN
Neurologická klinika
Komplexní cerebrovaskulární centrum
FN Ostrava
17. listopadu 1790/5
708 52 Ostrava
e-mail: skoloudik@email.cz
Sources
1. Ferguson GG, Eliasziw M, Barr HW et al. The North American Symptomatic Carotid Endarterectomy Trial: surgical results in 1 415 patients. Stroke 1999; 30(9): 1751– 1758. doi: 10.1161/ 01.str.30.9.1751.
2. Yavin D, Roberts DJ, Tso M et al. Carotid endarterectomy versus stenting: a meta-analysis of randomized trials. Can J Neurol Sci 2011; 38(2): 230– 235. doi: 10.1017/ s0317167100011380.
3. Economopoulos KP, Sergentanis TN, Tsivgoulis G et al. Carotid artery stenting versus carotid endarterectomy: a comprehensive meta-analysis of short-term and long-term outcomes. Stroke 2011; 42(3): 687– 692. doi: 10.1161/ STROKEAHA.110.606079.
4. Murad MH, Shahrour A, Shah ND et al. A systematic review and meta-analysis of randomized trials of carotid endarterectomy vs stenting. J Vasc Surg 2011; 53(3): 792– 797. doi: 10.1016/ j.jvs.2010.10.101.
5. Eckstein HH, Ringleb P, Allenberg JR et al. Results of the Stent-Protected Angioplasty versus Carotid Endarterectomy (SPACE) study to treat symptomatic stenoses at 2 years: a multinational, prospective, randomised trial. Lancet Neurol 2008; 7(10): 893– 902. doi: 10.1016/ S1474-4422(08)70196-0.
6. Škoda O, Herzig R, Mikulík R et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016; 79/ 112(3): 351– 363. doi: 10.14735/ amcsnn2016351.
7. Brott TG, Hobson RW 2nd, Howard G et al. Stenting versus endarterectomy for treatment of carotid-artery stenosis. N Engl J Med 2010; 363(1): 11– 23. doi: 10.1056/ NEJMoa0912321.
8. Flach HZ, Ouhlous M, Hendriks JM et al. Cerebral ischemia after carotid intervention. J Endovasc Ther 2004; 11(3): 251– 257. doi: 10.1583/ 03-1128.1.
9. Lacroix V, Hammer F, Astarci P et al. Ischemic cerebral lesions after carotid surgery and carotid stenting. Eur J Vasc Endovasc Surg 2007; 33(4): 430– 435. doi: 10.1016/ j.ejvs.2006.11.012.
10. Bonati LH, Jongen LM, Haller S et al. New ischaemic brain lesions on MRI after stenting or endarterectomy for symptomatic carotid stenosis: a substudy of the International Carotid Stenting Study (ICSS). Lancet Neurol 2010; 9(4): 353– 362. doi: 10.1016/ S1474-4422(10)70057-0.
11. Schnaudigel S, Gröschel K, Pilgram SM et al. New brain lesions after carotid stenting versus carotid endarterectomy: a systematic review of the literature. Stroke 2008; 39(6): 1911– 1919. doi: 10.1161/ STROKEAHA.107.500603.
12. Kuliha M, Roubec M, Procházka V et al. Randomized clinical trial comparing neurological outcomes after carotid endarterectomy or stenting. Br J Surg 2015; 102(3): 194– 201. doi: 10.1002/ bjs.9677.
13. Školoudík D, Škoda O, Bar M et al (eds). Neurosonologie. Praha: Galén 2003: 1– 389.
14. Rothwell PM, Eliasziw M, Gutnikov SA et al. Endarterectomy for symptomatic carotid stenosis in relation to clinical subgroups and timing of surgery. Lancet 2004; 363(9413): 915– 924. doi: 10.1016/ S0140-6736(04)15785-1.
15. Kuliha M, Roubec M, Goldírová A et al. Laboratory-based markers as predictors of brain infarction during carotid stenting: a prospective study. J Atheroscler Thromb 2016; 23(7): 839– 847. doi: 10.5551/ jat.31799.
16. Naghavi M, Falk E, Hecht HS et al. From vulnerable plaque to vulnerable patient – part III: executive summary of the Screening for Heart Attack Prevention and Education (SHAPE) task force report. Am J Cardiol 2006; 98(2A): 2H– 15H. doi: 10.1016/ j.amjcard.2006.03.002.
17. Naim C, Douziech M, Therasse E et al. Vulnerable atherosclerotic carotid plaque evaluation by ultrasound, computed tomography angiography, and magnetic resonance imaging. Can Assoc Radiol J 2014; 65(3): 275– 286. doi: 10.1016/ j.carj.2013.05.003.
18. ten Kate GL, Sijbrands EJ, Staub D et al. Noninvasive imaging of the vulnerable atherosclerotic plaque. Curr Probl Cardiol 2010; 35(11): 556– 591. doi: 10.1016/ j.cpcardiol.2010.09.002.
19. Fleg JL, Stone GW, Fayad ZA et al. Detection of high-risk atherosclerotic plaque: report of the NHLBI Working Group on current status and future directions. JACC Cardiovasc Imaging 2012; 5(9): 941– 955. doi: 10.1016/ j.jcmg.2012.07.007.
20. Tendera M, Aboyans V, Bartelink ML et al. ESC Guidelines on the diagnosis and treatment of peripheral artery diseases: document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteries: the task force on the diagnosis and treatment of peripheral artery diseases of the European Society of Cardiology (ESC). Eur Heart J 2011; 32(22): 2851– 2906. doi: 10.1093/ eurheartj/ ehr211.
21. Brott TG, Halperin JL, Abbara S et al. 2011 ASA/ ACCF/ AHA/ AANN/ AANS/ ACR/ ASNR/ CNS/ SAIP/ SCAI/ SIR/ SNIS/ SVM/ SVS guideline on the management of patients with extracranial carotid and vertebral artery disease: executive summary. Stroke 2011; 42(8): e420– e463. doi: 10.1161/ STR.0b013e3182112d08.
22. von Reutern GM, Goertler MW, Bornstein NM et al. Grading carotid stenosis using ultrasonic methods. Stroke 2012; 43(3): 916– 921. doi: 10.1161/ STROKEAHA.111.636084.
23. North American Symptomatic Carotid Endarterectomy Trial. Methods, patient characteristics, and progress. Stroke 1991; 22(6): 711– 720. doi: 10.1161/ 01.str.22.6.711.
24. Herzig R, Urbánek K, Vlachová I et al. The role of chronic alcohol intake in patients with spontaneous intracranial hemorrhage: a carbohydrate-deficient transferrin study. Cerebrovasc Dis 2003; 15(1– 2): 22– 28. doi: 10.1159/ 000067118.
25. Bendszus M, Stoll G. Silent cerebral ischaemia: hidden fingerprints of invasive medical procedures. Lancet Neurol 2006; 5(4): 364– 372. doi: 10.1016/ S1474-4422(06)70412-4.
26. Ringleb PA, Allenberg J, Brückmann H et al. 30 day results from the SPACE trial of stent-protected angioplasty versus carotid endarterectomy in symptomatic patients: a randomised non-inferiority trial. Lancet 2006; 368(9543): 1239– 1247. doi: 10.1016/ S0140-6736(06)69122-8.
27. Gossetti B, Gattuso R, Irace L et al. Embolism to the brain during carotid stenting and surgery. Acta Chir Belg 2007; 107(2): 151– 154.
28. Crawley F, Stygall J, Lunn S et al. Comparison of microembolism detected by transcranial Doppler and neuropsychological sequelae of carotid surgery and percutaneous transluminal angioplasty. Stroke 2000; 31(6): 1329– 1334. doi: 10.1161/ 01.str.31.6.1329.
29. Cho SM, Deshpande A, Pasupuleti V et al. Radiographic and symptomatic brain ischemia in CEA and CAS: a systematic review and meta-analysis. Neurology 2017; 89(19): 1977– 1984. doi: 10.1212/ WNL.0000000000004626.
30. Ji A, Lv P, Dai Y et al. Associations between carotid intraplaque hemorrhage and new ipsilateral ischemic lesions after carotid artery stenting: a quantitative study with conventional multi-contrast MRI. Int J Cardiovasc Imaging 2019; 35(6): 1047– 1054. doi: 10.1007/ s10554-018-01521-5.
31. Brinjikji W, Lehman VT, Huston J 3rd et al. The association between carotid intraplaque hemorrhage and outcomes of carotid stenting: a systematic review and meta-analysis. J Neurointerv Surg 2017; 9(9): 837– 842. doi: 10.1136/ neurintsurg-2016-012593.
32. Bijuklic K, Wandler A, Hazizi F et al. The PROFI study (Prevention of Cerebral Embolization by Proximal Balloon Occlusion Compared to Filter Protection During Carotid Artery Stenting): a prospective randomized trial. J Am Coll Cardiol 2012; 59(15): 1383– 1389. doi: 10.1016/ j.jacc.2011.11.035.
33. Montorsi P, Caputi L, Galli S et al. Microembolization during carotid artery stenting in patients with high-risk, lipid-rich plaque. A randomized trial of proximal versus distal cerebral protection. J Am Coll Cardiol 2011; 58(16): 1656– 1663. doi: 10.1016/ j.jacc.2011.07.015.
34. Patti G, Tomai F, Melfi R et al. Strategies of clopidogrel load and atorvastatin reload to prevent ischemic cerebral events in patients undergoing protected carotid stenting. Results of the randomized ARMYDA-9 CAROTID (Clopidogrel and Atorvastatin Treatment During Carotid Artery Stenting) study. J Am Coll Cardiol 2013; 61(13): 1379– 1387. doi: 10.1016/ j.jacc.2013.01.015.
35. Pavlík O, Václavík D, Kučera D et al. Bezpečnost karotického stentingu – srovnání protekčních systémů. Cesk Slov Neurol N 2016; 79/ 112(5): 560– 565.
36. Zeleňák K, Kurča E, Zeleňáková J et al. MR vyšetrenie mozgu pred a po CAS – výskyt embolických komplikácií a ich klinické prejavy. Cesk Slov Neurol N 2008; 71/ 104 (Suppl 1): S57– S58.
37. Pasternak RC, Baughman KL, Fallon JT et al. Scanning electron microscopy after coronary transluminal angioplasty of normal canine coronary arteries. Am J Cardiol 1980; 45(3): 591– 598. doi: 10.1016/ s0002-9149(80)80009-9.
38. Grunwald IQ, Reith W, Kühn AL et al. Proximal protection with the Gore PAES can reduce DWI lesion size in high-grade stenosis during carotid stenting. EuroIntervention 2014; 10(2): 271– 276. doi: 10.4244/ EIJV10I2A45.
39. Vucković BA, Djerić MJ, Ilić TA et al. Fibrinolytic parameters, lipid status and lipoprotein(a) in ischemic stroke patients. Srp Arh Celok Lek 2010; 138 (Suppl 1): 12– 17. doi: 10.2298/ sarh10s1012v.
40. Gupta R, Vora N, Thomas A et al. Symptomatic cerebral air embolism during neuro-angiographic procedures: incidence and problem avoidance. Neurocrit Care 2007; 7(3): 241– 246. doi: 10.1007/ s12028-007-0041-9.
41. Enomoto Y, Yoshimura S. Antiplatelet therapy for carotid artery stenting. Interv Neurol 2013; 1(3– 4): 151– 163. doi: 10.1159/ 000351686.
42. Hovens MM, Snoep JD, Eikenboom JC et al. Prevalence of persistent platelet reactivity despite use of aspirin: a systematic review. Am Heart J 2007; 153(2): 175– 181. doi: 10.1016/ j.ahj.2006.10.040.
43. Mansour K, Taher AT, Musallam KM et al. Aspirin resistance. Adv Hematol 2009; 2009: 937352. doi: 10.1155/ 2009/ 937352.
44. Feher G, Feher A, Pusch G et al. Clinical importance of aspirin and clopidogrel resistance. World J Cardiol 2010; 2(7): 171– 186. doi: 10.4330/ wjc.v2.i7.171.
45. Van Der Heyden J, Van Werkum J, Hackeng CM et al. High versus standard clopidogrel loading in patients undergoing carotid artery stenting prior to cardiac surgery to assess the number of microemboli detected with transcranial Doppler: results of the randomized IMPACT trial. J Cardiovasc Surg (Torino) 2013; 54(3): 337– 347.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2020 Issue 1
Most read in this issue
- Novorozenecké záchvaty – současný pohled na problematiku
- Možnosti prevence Alzheimerovy choroby
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
