Konsenzus a návrh k algoritmu léčby – mechanická trombektomie u akutního mozkového infarktu
Výsledky intervenčních studií MR CLEAN, ESCAPE, SWIFT PRIME, EXTEND-IA, REVASCAT
For the first time in cerebrovascular neurology there is an indisputable evidence of clinical effectiveness of mechanical recanalization in acute cerebral artery occlusion. Five randomized trials published in 2015 documented an unprecedented benefit and safety of endovascular thrombectomy. The particular trials were: MR CLEAN, ESCAPE, SWIFT PRIME, EXTEND-IA and REVASCAT. It has been proven that endovascular treatment reduces morbidity and mortality of patients significantly. The number needed to treat to result in one patient with good functional outcome was staggeringly low – only 3–7 patients. Age and deficit severity do not constitute exclusionary criteria (MR CLEAN, ESCAPE and EXTEND-IA without age restrictions; SWIFT PRIME between 18–80 years and REVASCAT between 18–85 years of age). The principal imaging methods were predominantly native CT and CT angiography. Perfusion methods were used in EXTEND-IA and SWIFT PRIME. The objective of endovascular treatment was to achieve reperfusion within 60 min after groin puncture. An essential part of the trials was a performance evaluation system. We provide information on the results of thrombectomy trials, summarize management during thrombectomy (correction of blood pressure, use of anesthesia, concomitant medication) and propose indication criteria.
Key words:
stroke – endovascular thrombectomy – neurointerventions – imaging – acute care management – quality monitoring
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
O. Volný 1,2; A. Krajina 3; M. Bar 4; R. Herzig 5; D. Šaňák 6; A. Tomek 7; D. Školoudík 8; F. Charvát 9; D. Václavík 10; J. Neumann 11,12; O. Škoda 13,14; R. Mikulík 1,2
Authors‘ workplace:
ICRC – Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
1; I. neurologická klinika LF MU a FN u sv. Anny v Brně
2; Komplexní cerebrovaskulární centrum, Radiologická klinika LF UK a FN Hradec Králové
3; Neurologická klinika LF OU a FN Ostrava
4; Komplexní cerebrovaskulární centrum, Neurologická klinika LF UK a FN Hradec Králové
5; Komplexní cerebrovaskulární centrum, Neurologická klinika LF UP a FN Olomouc
6; Neurologická klinika 2. LF UK a FN v Motole, Praha
7; Ústav ošetřovatelství, FZV, UP v Olomouci
8; Radiodiagnostické oddělení, ÚVN – VFN Praha
9; Vzdělávací a výzkumný institut Agel, Neurologické oddělení, Vítkovická nemocnice, a. s., Ostrava
10; Iktové centrum, Neurologické oddělení, Krajská zdravotní, a. s., Nemocnice Chomutov
11; Neurologická klinika LF UK a FN Plzeň
12; Iktové centrum, Neurologické oddělení, Nemocnice Jihlava
13; Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha
14
Published in:
Cesk Slov Neurol N 2016; 79/112(1): 100-110
Category:
Guidelines
doi:
https://doi.org/10.14735/amcsnn2016100
Overview
V cerebrovaskulární neurologii vůbec poprvé existují nezpochybnitelné důkazy o klinické efektivitě mechanické rekanalizace u akutního uzávěru mozkové tepny. Pět randomizovaných studií publikovaných v roce 2015 dokumentovalo nebývalý prospěch a bezpečnost mechanické rekanalizace. Jednalo se o studie: MR CLEAN, ESCAPE, SWIFT PRIME, EXTEND-IA a REVASCAT. Bylo prokázáno, že endovaskulární léčba výrazně snižuje morbiditu a mortalitu pacientů. Počet pacientů, kteří musí být léčeni, aby jeden pacient byl kompletně vyléčen, je ohromující – jen 3– 7 pacientů. Věk a tíže deficitu nepředstavují vylučující kritérium (MR CLEAN, ESCAPE a EXTEND-IA bez věkového omezení; SWIFT PRIME od 18 do 80 let a REVASCAT od 18 do 85 let). Základním zobrazením byly dominantně nativní výpočetní tomografie (CT) a CT angiografie. Perfuzní metody byly využity pouze v EXTEND-IA a SWIFT PRIME. Cílem výkonů bylo dosažení reperfuze do 60 min od vpichu do třísla. Nezbytnou součástí studií byl systém hodnocení kvality výkonů. V tomto článku přinášíme výsledky uvedených studií, shrnujeme management během endovaskulární léčby (korekce krevního tlaku, použití anestézie, konkomitantní medikace) a navrhujeme možná indikační kritéria.
Klíčová slova:
akutní mozkový infarkt – mechanická rekanalizace – neurointervenční výkony – protokol zobrazení – logistika péče – indikátory kvality
Úvod
Do roku 2014 představovala jedinou evidence-based terapii akutního mozkového infarktu systémová trombolýza. Nicméně samotnou intravenózní trombolýzou je dosaženo kompletní rekanalizace pouze u jedné čtvrtiny takto léčených pacientů. Důležitými faktory ovlivňujícími rekanalizaci tepny po podání trombolýzy jsou (kromě času od vzniku příznaků do podání léčby) také délka, lokalizace a permeabilita trombu, do kterého musí trombolytikum proniknout. Úspěšnost rekanalizace pomocí systémové trombolýzy se u proximálních anebo delších trombů (nad 8 mm) pohybuje mezi 0 a 25 % [1,2]. Nedostatečná účinnost trombolýzy na delší a objemnější tromby může být překonána intra-arteriální terapií pomocí mechanické trombektomie (tzv. endovaskulární léčba). Do roku 2015 však chyběly randomizované důkazy o prospěchu mechanické rekanalizace. Jinými slovy, zda intervenční léčba nejenom „otevírá mozkové tepny“, ale má i klinický benefit pro pacienta.
Intra-arteriální terapie akutního mozkového infarktu není koncepčně nová. Na základě empirického předpokladu, že dosažení reperfuze/ rekanalizace zlepšuje prognózu pacienta, bylo v posledních řádově 10 letech mnoho pacientů léčeno intra-arteriální terapií, a to ve světě i v České republice (ČR). Prospěch pro pacienty, kteří byli léčeni intra-arteriálně, byl testován ve třech randomizovaných studiích, jejichž výsledky byly publikovány v roce 2013:
- IMS III (Interventional Management of Stroke III) [3],
- SYNTHESIS (Intra-arterial versus Systemic Thrombolysis for Acute Ischemic Stroke) [4],
- MR RESCUE (Magnetic Resonance and Recanalization of Stroke Clots Using Embolectomy) [5].
Všechny zmíněné studie přinesly negativní výsledky a otřásly přesvědčením, že neurointervenční léčba je prospěšná. Bylo evidentní, že podobně jako v kardiologii před mnoha lety je potřeba analyzovat důvody iniciálního neúspěchu a pokusit se tyto nedostatky eliminovat v následujících randomizovaných studiích a poté poznatky aplikovat do klinické praxe.
K „neúspěchu“ studií IMS III a MR RESCUE vedly následující limitace:
- nebyli vyloučeni pacienti, kteří měli rozsáhlejší ischemické změny;
- v rámci protokolu zobrazovacích metod nemusela být provedena CT angiografie (CTA) umožňující detekci uzávěru velké tepny a přinášející další důležité informace o arteriálním přístupu;
- stent-retrievery byly použity pouze u 1,5 % pacientů ve studii IMS III a u 11 % pacientů ve studii SYNTHESIS;
- více než polovina pacientů ve studii SYNTHESIS a téměř polovina pacientů ve studii IMS III nebyla léčena mechanickou rekanalizací (coil retrievery nebo stent retrievery), ale pouze intra-arteriální (lokální) trombolýzou;
- nebyla použita plná dávka tkáňového aktivátoru plazminogenu (tPA);
- nebyl aplikován důsledný systém kontroly kvality výkonů zajištující dodržení co nejkratších časů k dosažení kompletní reperfuze.
Nedostatky a poučení ze studií SYNTHESIS a hlavně IMS III vedly k designu nových studií, které na základě vylepšených zobrazovacích, intervenčních a logistických protokolů eliminovaly neperspektivní pacienty, zrychlily logistiku péče a používaly moderní mechanická instrumentária s lepším terapeutickým a risk-benefit profilem (dominantě systém SolitaireTM, Covidien-Medtronic, USA). Jako vůbec první byla publikována studie MR CLEAN, která jako jediná byla dokončena dle původního plánu (po dosažení plánovaného počtu pacientů). Všechny ostatní studie byly po zveřejnění výsledků MR CLEAN předčasně ukončeny, jelikož se pokládalo za neetické zařazovat do kontrolní skupiny, tedy do skupiny neléčené mechanickou rekanalizací, další pacienty. Přestože probíhající studie nedosáhly původně plánovaného počtu pacientů v intervenční a kontrolní skupině, byly všechny jednoznačně pozitivní (což znamená, že efekt léčby byl mnohem vyšší, než se původně předpokládalo, a statisticky signifikantního výsledku bylo dosaženo i při menším počtu zařazených pacientů).
Následující odstavce jsou věnovány:
- charakteristice protokolů zobrazovacích metod v jednotlivých studiích,
- srovnání výsledků a bezpečnosti jednotlivých studií,
- managementu během endovaskulárního výkonu,
- indikátorům kvality neurointervenčních výkonů.
Pozitivní endovaskulární studie
MR CLEAN, ESCAPE, SWIFT PRIME, EXTEND-IA, REVASCAT
V roce 2015 bylo publikováno pět prospektivních randomizovaných multicentrických studií:
- MR CLEAN (Multicentre Randomized Clinical trial of Endovascular treatment for Acute ischemic stroke in the Netherlands) [6];
- ESCAPE (Endovascular treatment for Small Core and Anterior circulation Proximal occlusion with Emphasis in minimizing computed tomography to recanalization times) [7];
- SWIFT PRIME (Solitaire With the Intention For Thrombectomy as PRIMary Endovascular treatment) [8];
- EXTEND-IA (Extending the time to Thrombolysis in Emergency Neurological Deficits-Intra-Arterial) [9];
- REVASCAT (Revascularization with SOLITAIRE FR device vs. best medical therapy in the treatment of acute stroke due to anterior circulation large vessel occlusion presenting within eight-hours of symptom onset) [10].
Všechny tyto studie testovaly endovaskulární terapii akutního mozkového infarktu dominantně pomocí systému Solitaire™, popř. jiného mechanického extraktoru (s podáním systémové trombolýzy nebo bez ní) u pacientů s proximálním uzávěrem v přední mozkové cirkulaci a s průkazem viabilní mozkové tkáně dle vstupních zobrazovacích metod. Indikační kritéria jednotlivých studií jsou shrnuta v tab. 1.
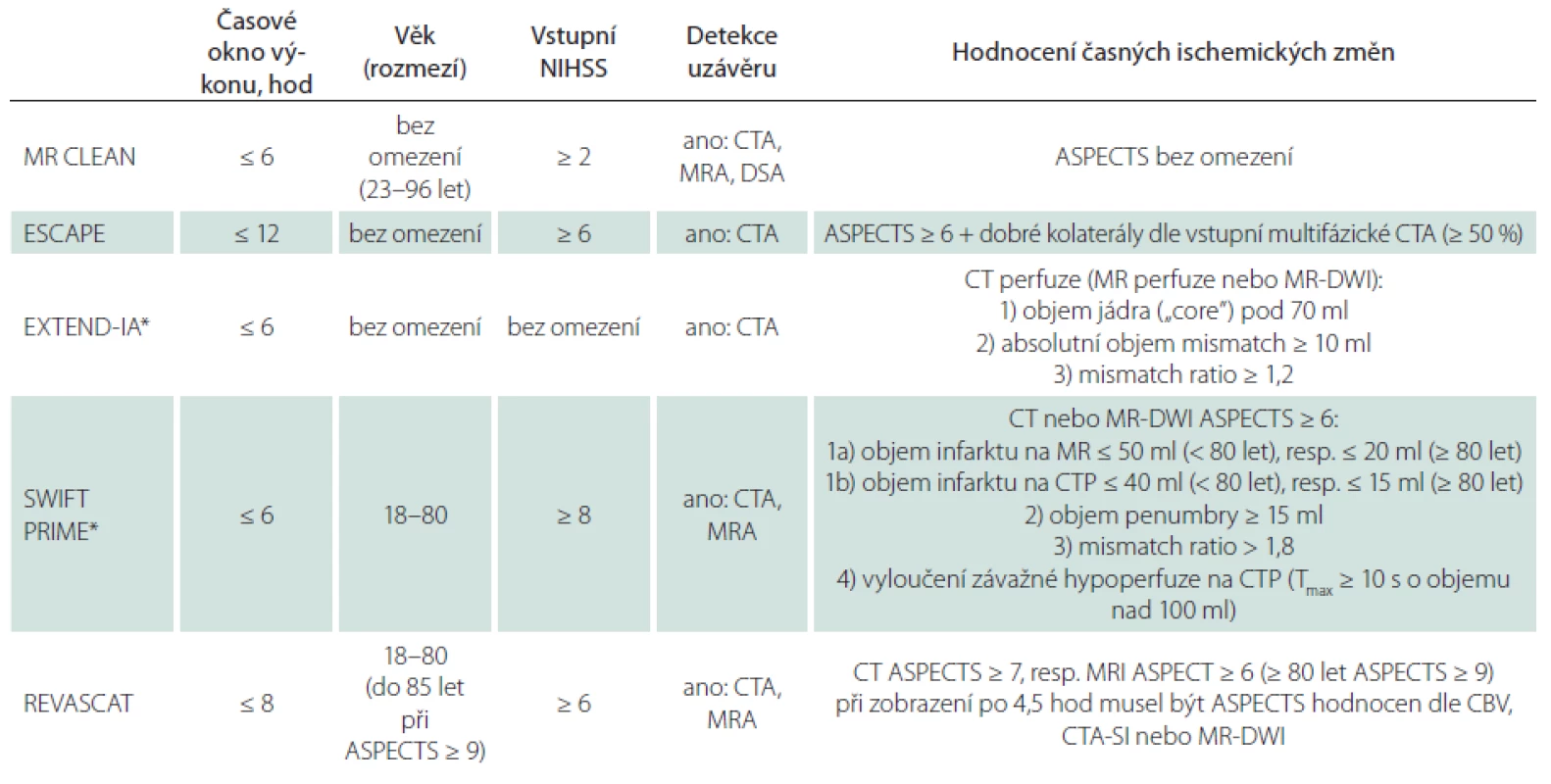
Zásadní rozdíl mezi uvedenými pozitivními intervenčními studiemi a těmi „negativními“, resp. neutrálními studiemi publikovanými před rokem 2015 bylo využití vstupní CTA zobrazující cévní zásobení od oblouku aorty intrakraniálně až po vertex pro selekci a randomizaci pacientů s proximálním intrakraniálním uzávěrem.
Následující odstavce jsou věnovány základním charakteristikám a designu jednotlivých studií, použitým protokolům zobrazovacích metod (detekce časných ischemických změn s využitím nativního CT, CT perfuze či magnetické rezonance (MR)) a specifikům jednotlivých studií (např. hodnocení kolaterální mozkové cirkulace ve studii ESCAPE, přístupu k extra- a intrakraniálním uzávěrům a. carotis interna (ACI) – vč. přístupu k akutnímu zavedení stentu do extrakraniálního úseku).
Charakteristika protokolů zobrazovacích metod
Studie byly srovnatelné v rámci věku zařazených pacientů, vstupního neurologického deficitu hodnoceného dle National Institute of Health Stroke Scale (NIHSS), rozsahu ischemických změn hodnoceného výhradně dle Alberta Stroke Program Early CT skóre (ASPECTS) (výjimkou byla studie EXTEND-IA využívající pouze perfuzní CT), lokalizace uzávěru tepny (většina pacientů s uzávěrem intrakraniálního úseku ACI anebo segmentu M1 a. cerebri media (ACM)) i v procentu podání systémové trombolýzy u většiny pacientů v intervenční skupině (68– 100 %).
Hodnocení časných ischemických změn na vstupním zobrazení mozku
Studie ESCAPE (vstupní NIHSS bez omezení), EXTEND-IA (vstupní NIHSS bez omezení) a SWIFT PRIME (vstupní NIHSS ≥ 8) zařazovaly pacienty s malým jádrem ischemie (tzv. core) patrným na vstupním zobrazení mozku. Ve studiích ESCAPE a REVASCAT bylo použito skóre ASPECTS (bližší informace k hodnocení časných ischemických změn viz http:/ / www.aspectsinstroke.com) hodnocené na vstupním nativním CT nebo na difuzí vážených sekvencí (Diffusion Weighted Imaging; DWI) magnetické rezonance (MR-DWI).
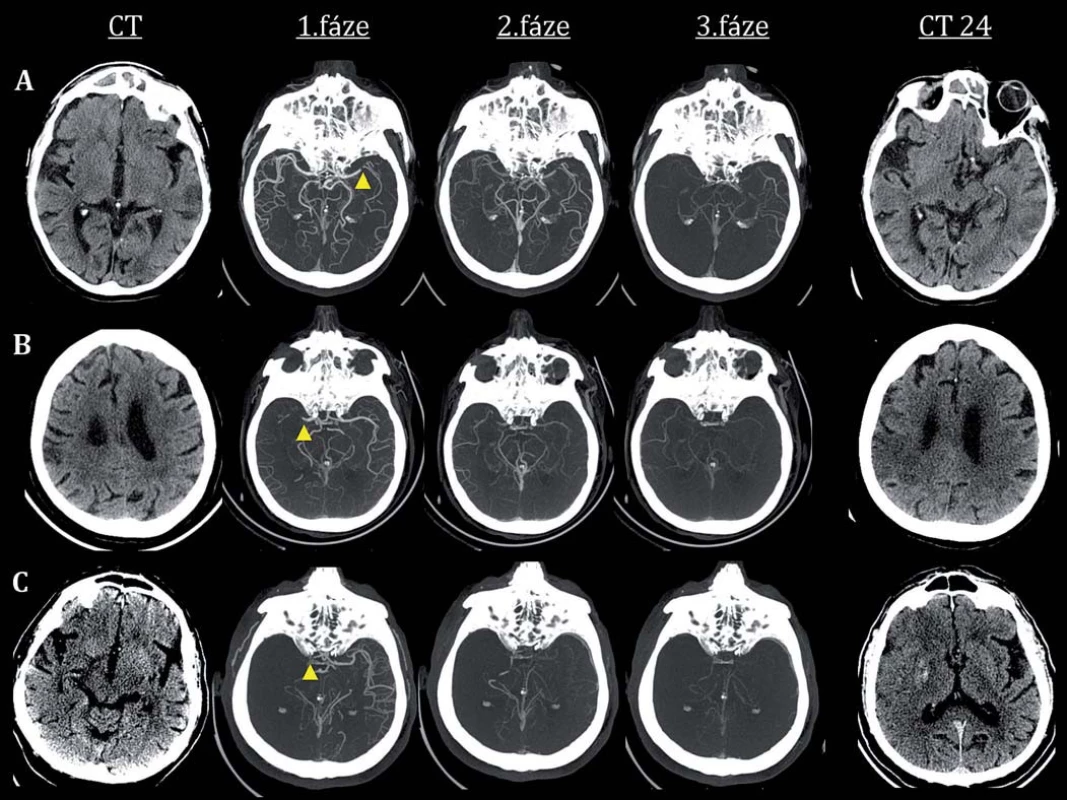
Hranicí dle ASPECTS pro selekci pacienta k intervenci ve studii ESCAPE bylo skóre ≥ 6. Ve studii REVASCAT se jednalo o CT-ASPECTS ≥ 7, resp. MR-ASPECTS ≥ 6 (v této studii byl protokol po zařazení 180 pacientů modifikován, mj. byla posunuta i věková hranice na 85 let, avšak pouze pro pacienty s malým rozsahem časných ischemických změn, tedy ASPECTS ≥ 9). Pokud bylo překročeno časové okno 4,5 hod, bylo skóre ASPECTS hodnoceno pomocí map mozkového krevního průtoku dle CT perfuze (Cerebral Blood Flow; CBF), CTA Source Imaging (CTA-SI) nebo MR-DWI. U pacientů léčených endovaskulárně mezi 6. a 8. hod musela být hodnota ASPECTS minimálně 7 (REVASCAT) a u pacientů mezi 8. a 12. hod (ESCAPE) musela být hodnota ASPECTS ≥ 6 a navíc dle CTA muselo být přítomno dobré kolaterální řečiště na úrovni leptomeningeálních kolaterál, tj. nad 50 % (preferován byl protokol tzv. multifázické CTA, ukázka zobrazení mozkové cirkulace viz obr. 1).
Ve studii ESCAPE bylo mj. 49 pacientů randomizováno po více než 6 hod. Analýza výsledného klinického stavu hodnoceného pomocí modifikované Rankinovy škály (mRS) za tři měsíce prokázala pozitivní trend pro endovaskulární terapii (Rate Ratio; RR: 1,7; 95% konfidenční interval (CI) 0,7– 4,0). Ve studii MR CLEAN byli mj. randomizováni i pacienti s ASPECTS 0– 5 a dle podskupinové analýzy se efekt endovaskulární léčby u těchto pacientů s rozsáhlejšími časnými ischemickými změnami jevil jako neutrální. Tato analýza však má z důvodu malého počtu pacientů limitovanou statistickou výpovědní hodnotu, a proto nelze vyloučit benefit i pro pacienty s nízkým ASPECTS.
CT perfuzní analýza
CT perfuze byla použita ve studiích EXTEND-IAa SWIFT PRIME. Ireverzibilní ischemické změny (tzv. core) byly definovány hodnotou relativního mozkového průtoku oproti kontralaterální (nepostižené) straně, rCBF < 30 %. Reverzibilní změny (tzv. penumbra) byly charakterizovány hodnotou time to maximum (Tmax) ≥ 6 s. Objem jádra a penumbry, tzv. difuzně-perfuzní mismatch, byl hodnocen pomocí plně automatizované vstupní analýzy výše uvedených perfuzních parametrů softwarem RAPID (Stanford University). Vstupní CT perfuze byla provedena u 100 % pacientů ve studii EXTEND-IA a u 85 % pacientů ve studii SWIFT PRIME (u 15 % MR perfuzní analýza).
Přínos hodnocení leptomeningeálních kolaterál
Leptomeningeální mozková cirkulace byla v rámci protokolu hodnocena pouze ve studii ESCAPE. Opakovaně bylo prokázáno, že dobré kolaterální řečiště hodnocené pomocí vstupní CT angiografie nepřímo svědčí o efektivním zapojení cirkulace cestou leptomeningeálních kolaterál. Pacienti s dobrými kolaterálami na vstupní CTA mají větší pravděpodobnost dosažení lepšího výsledného klinického stavu, pokud jsou efektivně léčeni. Zatímco pacienti s chudým kolaterálním řečištěm a s časnými ischemickými změnami na vstupním zobrazení z endovaskulární léčby neprofitují, dokonce touto terapií mohou být poškozeni [11]. Morfologie leptomeningeální mozkové cirkulace byla u většiny pacientů ve studii ESCAPE hodnocena pomocí tzv. multifázické CTA. Tato modalita zobrazení cév umožňuje dynamické zobrazení mozkové cirkulace a stavu leptomeningeálních kolaterál (detailní informace na obr. 1, hodnocení kolaterální cirkulace v tab. 2). Tato zobrazovací metoda je ve FN u sv. Anny v Brně rutinně používána a hodnocení stavu kolaterální cirkulace je součástí radiologických popisů. Její výhodou je zobrazení mozkové cirkulace ve třech fázích, které výrazně snižuje pravděpodobnost podhodnocení stavu leptomeningeální cirkulace, jak tomu může být u tzv. standardních/ jednofázových CTA protokolů [12].

Dalším přínosem vstupní CTA provedené od oblouku aorty po vertex je přínos v odhalení uzávěru v extrakraniálním karotickém řečišti, atypií aortálního oblouku, odstupů a průběhu extrakraniálních úseků ACI. Z výše uvedených důvodů by CTA měla být standardem vstupního zobrazení u pacientů, jež jsou potenciálními kandidáty endovaskulárního výkonu.
Extrakraniální uzávěr ACI byl běžným nálezem ve všech pozitivních intervenčních studiích (např. 12,7 % ESCAPE, 18,6 % REVASCAT, 32,2 % MR CLEAN). Efekt endovaskulární terapie byl u pacientů s tímto nálezem rovněž pozitivní. Tudíž přítomnost extrakraniálního uzávěru by neměla být kritériem k vyloučení pacienta jako kandidáta k endovaskulární terapii. V případě uzávěru extrakraniálního úseku vnitřní karotidy není ve většině případů nutná implantace stentu. Primárním cílem endovaskulárního výkonu by mělo být odstranění intrakraniálního uzávěru a event. vyřešení extrakraniálního uzávěru až ve druhém kroku. V případě zavedení stentu do extrakraniální části ACI (REVASCAT 8,7 %, EXTEND-IA 9 % pacientů léčených mechanickou rekanalizací) byli pacienti předléčeni duální antiagregací kyselinou acetylsalicylovou a klopidogrelem (600 mg) a poté bylo pokračováno v duální antiagregaci, což může zvyšovat riziko krvácení.
Intrakraniální uzávěr ACI představoval rovněž běžný nález.
Srovnání efektu endovaskulární terapie na výsledný klinický stav pacientů hodnocený hodnotou mRS po třech měsících byl: ESCAPE – odds ratio (OR) 2,6; 95% CI 1,2– 5,9; SWIFT PRIME: OR 2,04; 95% CI 0,6– 6,21; REVASCAT: rozdíl mRS po třech měsících mezi intervenční a kontrolní skupinou nebyl signifikantní, 23,1 vs. 7,7 %; p = 0,60).
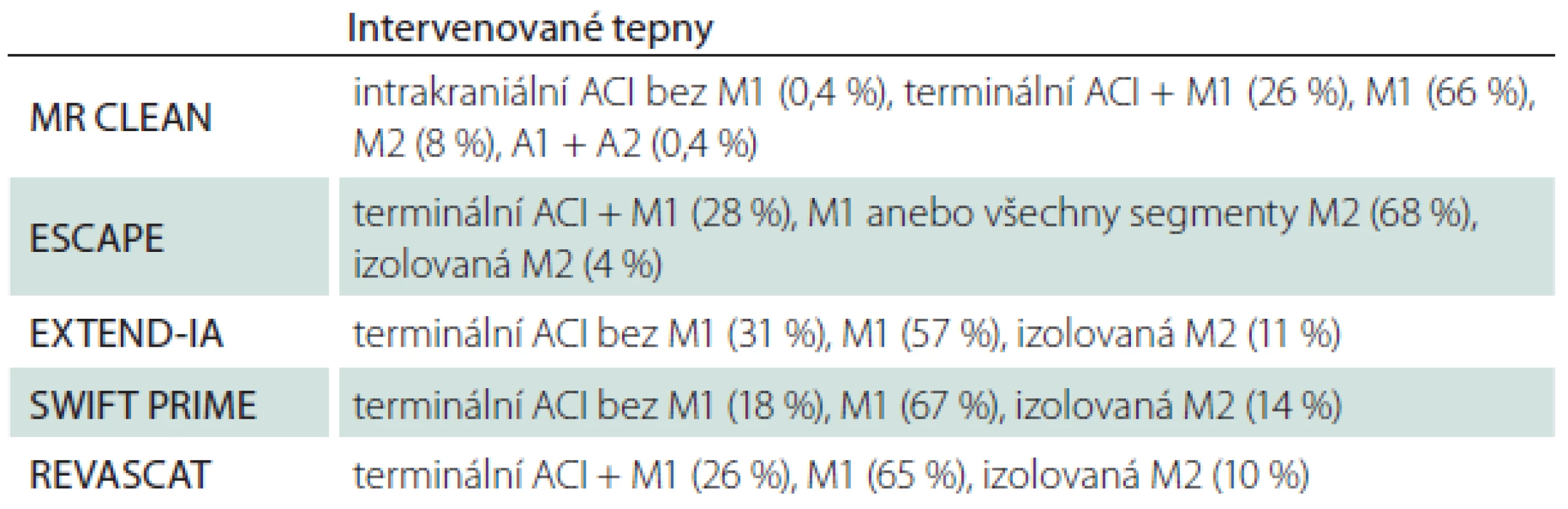
I po odstranění velkého tepenného uzávěru může u části pacientů přetrvávat okluze distální větve nebo distálních větví, např. reziduální uzávěr segmentů M2– M3 nebo A2– A3. Snaha o odstranění distálního trombu/ distálních trombů nemusí být vždy nezbytná pro dosažení dobrého výsledného klinického stavu pacienta, proto je v rámci pokračování endovaskulárního výkonu nutné zvážit individuální poměr rizika možných komplikací vyplývajících z pokračování v intervenčním výkonu. Popis intervenovaných tepen v jednotlivých studiích je uveden v tab. 3.

Srovnání výsledků a bezpečnosti studií
Procentuální zastoupení výkonů na jednotlivých tepnách uvádí tab. 4. Úspěšnost reperfuze byla ve všech studiích hodnocena pomocí skóre Thrombolysis in Cerebral Infarction (TICI; tab. 5). Za úspěšnou byla považována hodnota TICI 2b/ 3. Dalším klinicky používaným skóre je tzv. modifikované TICI skóre (mTICI), které se od TICI liší navíc kategorií TICI 2c (tab. 6) [13].


Studie MR CLEAN byla první a zároveň největší pozitivní intervenční studie (celkem zařazeno 500 pacientů, 233 do intervenované skupiny) s časovým oknem ukončení mechanické rekanalizace do 6 hod od vzniku příznaků. Specifikem studie byla delší doba k rozhodnutí o randomizaci pacienta (více než 2 hod od podání systémové trombolýzy), čímž byli k výkonu vyselektováni pacienti bez jasné klinické odpovědi na systémovou trombolýzu (tj. s perzistujícím závažným neurologickým deficitem). Dalším specifikem studie byla nízká míra restrikce pacientů na základě vstupních demografických, klinických a radiologických parametrů. Reperfuze 2b/ 3 bylo dosaženo u 59 % pacientů a dobrý výsledný klinický stav hodnocený jako mRS 0– 2 dosáhlo 33 % pacientů v intervenční skupině, ve srovnání s 19 % ve skupině kontrolní. Mortalita se mezi skupinami nelišila, což mohlo být způsobeno zpožděním zahájení samotného výkonu (dlouhý čas k randomizaci pacienta) i nižším procentem úspěšných rekanalizací (navíc do studie bylo mj. zahrnuto řádově více pacientů s extrakraniálním uzávěrem ACI než v ostatních studiích).
ESCAPE představuje studii, která byla předčasně ukončena po zveřejnění výsledků MR CLEAN (celkem zařazeno 316 pacientů, 165 do intervenční skupiny). Specifikem studie bylo hodnocení stavu leptomeningeální mozkové cirkulace, delší časové okno intervence (do 12 hod od rozvoje iktu) umožňující i zařazování pacientů s tzv. wake-up stroke (tedy iktem se symptomy zjištěnými po probuzení) a v rámci logistiky výkonu tendence k co nejrychlejšímu zahájení intervence (čas „zobrazení-punkce třísla“ pod 1 hod). Reperfuze TICI 2b/ 3 bylo dosaženo v 72 %, mRS 0– 2 dosáhlo 53 % pacientů v intervenční skupině ve srovnání s pouze 29 % ve skupině kontrolní a rovněž byla prokázána signifikantní redukce mortality (10 % v intervenční vs. 19 % v kontrolní skupině).
EXTEND-IA a SWIFT PRIME byly jediné studie, u kterých byla systémová trombolýza podána všem pacientům. EXTEND-IA představuje pozitivní studii s nejnižším počtem zařazených pacientů (celkem 70), která v rámci selekce pacientů pro endovaskulární výkon využívala pouze CT perfuzní analýzu. Terapeutické okno ukončení výkonu bylo do 8 hod od vzniku příznaků. Reperfuze TICI 2b/ 3 bylo dosaženo v 86 %, mRS 0– 2 dosáhlo 71 % v intervenované skupině ve srovnání s 40 % ve skupině léčené pouze systémovou trombolýzou.
Studie SWIFT PRIME (celkem 196 pacientů) v rámci selekce využívala jak CT perfuzní analýzu (u první třetiny pacientů), tak skóre ASPECTS dle vstupního nativního CT. Na rozdíl od ostatních studií byli ze studie vyřazeni všichni pacienti s extrakraniálními uzávěry. Terapeutické okno ukončení výkonu bylo do 6 hod. V této studii bylo dosaženo nejvyššího procenta reperfuze TICI 2b/ 3 v 88 %, mRS 0– 2 dosáhlo 60 % v intervenované skupině ve srovnání s 36 % ve skupině léčené systémovou trombolýzou.
Studie REVASCAT (celkem 206 pacientů) představuje katalánskou studii s terapeutickým oknem do 8 hod, která stejně jako EXTEND-IA a SWIFT PRIME u všech intervenovaných pacientů užívala systém Solitaire™. Reperfuze TICI 2b/ 3 bylo dosaženo v 66 %, mRS 0– 2 dosáhlo 44 % v intervenované skupině ve srovnání s 28 % ve skupině léčené pouze systémovou trombolýzou.
Symptomatické intracerebrální krvácení se vyskytlo v malém procentu případů ve studiích MR CLEAN (parenchymový hematom PH2 odpovídající > 30 % ischemického teritoria v 6 %), ESCAPE (symptomatické intracerebrální krvácení v 3,6 %) a REVASCAT (dle SITS-MOST kritérií 1,9 %, resp. dle kritérií ECASS II 4,9 %). Ve studii EXTEND-IA se pak nevyskytl žádný parenchymový hematom PH2 a ve studii SWIFT PRIME žádné symptomatické intrakraniální krvácení hodnocené po 24 hod. Tím se intervenční výkony řadí k nejen k vysoce účinným, ale rovněž vysoce bezpečným výkonům.
Srovnání výsledného klinického stavu a celkové mortality jsou v tab. 7. Efekt mechanické rekanalizace v jednotlivých studiích nezávisel na definovaném časovém okně. Vysvětlení je, že efekt byl spíše úměrný selekci vhodných kandidátů k endovaskulární léčbě. Právě proto je mechanická rekanalizace vysoce účinná i v delším časovém okně, a to až do 12 hod (po 6. hod byl léčen poměrně malý počet pacientů: 49/ 315 ve studii ESCAPE a 20/ 206 ve studii REVASCAT). Na druhé straně i studie bez restriktivních kritérií (MR CLEAN) prokázala jasný efekt do 6 hod.
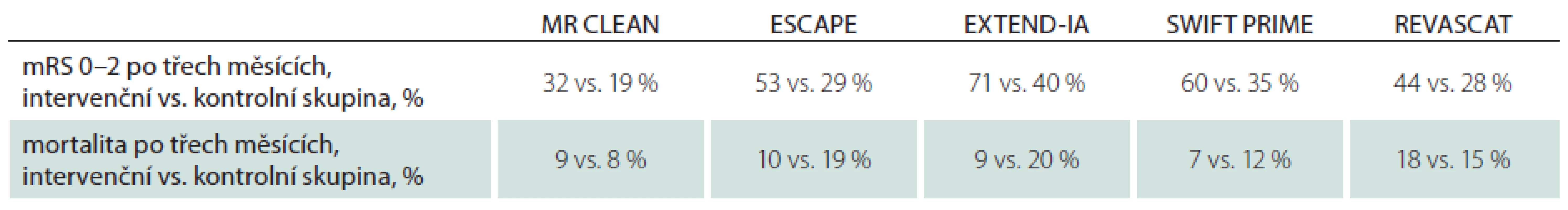
Interpretace autorů tohoto konsenzu je, že v časovém okně do 6 hod je zbytečné provádět selekci kandidátů pro mechanickou rekanalizaci jinak než pomocí CT a CTA. Cílem by mělo být co nejrychlejší otevření tepny bez dalších časových ztrát. Avšak po 6. hod od vzniku příznaků mozkového infarktu je potřeba vyloučit pomocí multimodálních neurozobrazovacích protokolů (CT perfuze a MR) pacienty, kteří nebudou mít prospěch z mechanické rekanalizace.
Management během endovaskulárního výkonu a časně po něm
Výběr pacientů k celkové anestezii nebo analgosedaci
Retrospektivní post hoc analýza výsledků studie MR CLEAN prokázala signifikantně horší výsledný klinický stav u pacientů, kteří podstoupili výkon v celkové anestezii (International Stroke Conference 2015, Nashville, USA). Tyto výsledky jsou ve shodě s několika předchozími kohortovými studiemi, které ukázaly, že použití celkové anestezie je spojeno s horší prognózou. Celková anestezie byla použita u 37,8 % pacientů ve studii MR CLEAN, u 9,1 % pacientů ve studii ESCAPE, u 36 % ve studii EXTEND-IA, u 37 % ve studii SWIFT PRIME a 6,7 % pacientů ve studii REVASCAT.
Doporučení na úrovni současných avšak limitovaných znalostí jsou, že celková anestezie by měla být použita pouze u vysoce selektovaných pacientů. Především se jedná o pacienty s rizikem respirační insuficience, agitované a nespolupracující (např. s percepční či globální fatickou poruchou). Preferována by měla být analgosedace. Nezbytná je monitorace saturace krve kyslíkem, krevního tlaku (TK) a tepové frekvence. V současné době probíhá několik randomizovaných studií srovnávajících vliv celkové anestezie vs. analgosedace na výsledný klinický stav.
Korekce krevního tlaku v průběhu výkonu a po něm
Doporučené hodnoty jsou méně než 185/ 110 mm Hg. V případě dosažení úspěšné reperfuze je doporučeno TK udržovat pod 140/ 90 mm Hg. Ve studii ESCAPE nebylo doporučení redukovat TK, pokud hodnoty nepřekračovaly 220/ 120 mm Hg a pacient nebyl léčen intravenózní trombolýzou. Z toho vyplývá, že hodnoty 185/ 110–220/ 120 mm Hg by měly být kompenzovány, ale snaha o kompenzaci by neměla být důvodem časového zdržení mechanické rekanalizace.
Antikoagulační léčba během výkonu
V současnosti neexistuje shoda, zda použít antikoagulační léčbu během intervenčního výkonu. Při výkonu může být podáno 2 000 jednotek heparinu bolusově s následnou infuzí 450 jednotek za hodinu po dobu výkonu (SWIFT PRIME). Ve studii REVASCAT nebylo podání systémové antikoagulace použito, byl prováděn pouze proplach katétru heparinizovaným fyziologickým roztokem.
Ponechání zavaděče (sheath) v třísle
Postup byl popsán pouze u studie REVASCAT. Zavaděč byl ponechán 12– 24 hod in situ a byl proplachován 30 ml/ hod fyziologického roztoku (FR) nebo 1 000 jednotek heparinu + 1 000 ml FR. Extrahován byl po dokumentování normální koagulace krve. Z vlastních zkušeností doporučujeme zavaděč odstranit dříve, a to zejména u neklidných pacientů, u kterých hrozí vytažení pacientem s rizikem závažného krvácení (zejména noční časová perioda může být riziková) nebo vznikem pseudoaneuryzmatu arteria femoralis. Po odstranění instrumentaria lze ošetřit místo vpichu některým typem z dostupných zařízení (StarClose, Perclose, AngioSeal, FemoSeal a další), které pacientovi přinášejí lepší komfort v rámci polohování.
Indikátory kvality neurointervenčních výkonů
Jedním z hlavních důvodů pozitivních výsledků uvedených studií byla kromě použití nové generace mechanických extraktorů a způsobu selekce pacientů dle vstupníhozobrazení také detailní kontrola kvality. Jejich monitorace a pravidelná evaluace jsou v souladu se současnými doporučeními American Heart Association/ American Stroke Association (AHA/ ASA) [14]. Tudíž by údaje všech pacientů léčených mechanickou trombektomií měly být vkládány do registru (preferenčně SITS-TBY), který poskytne centrům zpětnou vazbu o jejich výsledcích, umožní srovnání s ostatními centry v rámci ČR a také srovnání ČR s ostatními zeměmi. Již při zavádění systémové intravenózní trombolýzy se ukázalo, že zařazovaní a evaluace pacientů v registru SITS výrazně napomáhá v nastavovaní systému péče o pacienty s cévní mozkovou příhodou.
Publikované výsledky randomizovaných studií přinesly řadu časových a technických parametrů, jejichž shrnutí a využití v klinické praxi jsou věnovány následující odstavce. Naším cílem je vytvoření systematického a standardizovaného doporučení k hodnocení kvality center poskytujících neurointervenční výkony v rámci ČR.
V případě, že je pacient přivezen do iktového centra (IC) musí být jako standard zobrazení provedeny CT a CT angiografie (před plánovanou konzultací doporučujeme vložení snímků do systému PACS), poté následuje kontaktování komplexního cerebrovaskulárního centra (KCC). Za minimum požadovaných informací považujeme následující údaje: věk, pohlaví, čas od vzniku příznaků, aktuální NIHSS (event. premorbidní mRS), lokalizace uzávěru dle CTA, ASPECTS, event. orientační zhodnocení kolaterální cirkulace.
Cílem by měla být minimalizace časových ztrát, proto navrhujeme následující časové parametry:
- čas od provedení CT/ CTA do aktivace neurointervenčního týmu KCC do 15 min,
- celkový čas od příjezdu do IC po transport do KCC (tedy doba strávená v IC) do 45 min.
Po transportu pacienta do KCC by mělo následovat vyšetření pacienta neurologem, za vhodné považujeme i přítomnost intervenčního radiologa při neurologickém vyšetření a škálování NIHSS, zhodnocení snímků vložených do systému PACS a zahájení intervenčního výkonu.
Následující odstavce jsou věnovány indikátorům kvality neurointervenčních výkonů.
Indikátory kvality mohou být rozděleny na časové (zahrnující mj. týmovou organizaci péče o pacienta směřovaného k intervenčnímu výkonu) a technické (zahrnující výběr vhodného instrumentária, provedení samotného výkonu a komplikace spojené s výkonem a po výkonu).
1. Časové indikátory– nejdůležitějšími faktory a zároveň významnými parametry kvality centra jsou: příjezd do nemocnice– vpich do třísla (door-to-puncture) a celkový čas od příjezdu do nemocnice k dosažení reperfuze (tzv. door-to-reperfusion); dalšími časovými parametry umožňujícími monitorování a pravidelnou evaluaci centra mohou být: příjezd do nemocnice– provedení zobrazení (door-to-picture), zobrazení– vpich do třísla (picture-to-puncture), vpich do třísla– první rozvinutí stentu (puncture-to-first pass) a vpich do třísla– dosažení reperfuze TICI2b/ 3 (puncture-to-reperfusion).
Dostupné časové údaje k jednotlivým studiím shrnuje tab. 8.

Za nezbytné považujeme monitorovat:
- a) příjezd do nemocnice– vpich do třísla (door-to-puncture): cílový čas do 60 min;
- b) celkový čas–door-to-reperfusion: cílový čas pod 90 min;
- c) celkový čas od příjezdu do IC po transport do KCC (tedy doba strávená v IC): cílový čas průměrně 45 min.
Za vhodné považujeme monitorovat:
- a) vpich do třísla– první rozvinutí stentu (puncture-to-first pass): ve studiích nebylo blíže specifikováno (cílový čas ideálně pod 30 min);
- b) vpich do třísla– dosažení reperfuze TICI2b/ 3 (puncture-to-reperfusion): cílový čas do 60 min (ESCAPE 30 min, EXTEND-IA 43 min, REVASCAT 59 min, uvedena hodnota = medián).
2. Technické indikátory
- a) typ použitého instrumentária: doporučeny stent retrievery (nutno použít pracovní katétr s balónkem k zástavě krevního toku při stahování – evidence třídy IIa);
- b) procento celkových anestezií na dané centrum s uvedením indikace/ indikací k celkové anestezii;
- c) monitorace vitálních funkcí vč. kompenzace TK (vedená anesteziologem);
- d) počet zavedení stentů („stent deployment“) do dosažení rekanalizace: doporučeno 3× (maximálně 6× – s narůstajícím počtem neúspěšného zavedení stentu se snižuje pravděpodobnost úspěšné reperfuze);
- e) dosažení reperfuze: minimálně dosažení TICI 2b/ 3;
- f) zhodnocení bezpečnosti výkonu – např. výskyt symptomatického intracerebrálního krvácení, komplikace periprocedurální a postprocedurální.
3. Ukončení endovaskulárního výkonu – výkon je ukončen, pokud:
- a) je dosaženo TICI 2b/ 3,
- b) okluze je refrakterní na mechanickou extrakci,
- c) dojde k deterioraci neurologického stavu s podezřením na intracerebrální krvácení či jiné příčiny
4. Popis intervenčního výkonu (radiologem)
- a) čas začátku výkonu (příjezd na angiosál– vpich do třísla);
- b) čas ukončení výkonu;
- c) lokalizace a charakteristika uzávěru/ ů;
- d) TICI nebo mTICI na začátku a na konci výkonu;
- e) typ použitého extraktoru/ ů, celkový počet zavedení;
- f) komplikace při výkonu;
- g) další nálezy (nálezy na jiných tepnách, náhodné nálezy apod.);
- h) doporučení pro export snímků do systému PACS po ukončení výkonu:
- nástřik před zahájením intervence přes guiding katétr: k posouzení místa okluze, rozsahu/ délky trombu, postižení teritoria, konkomitantních nálezů a kolaterálního toku;
- nástřik po průchodu trombem k posouzení distální cirkulace, event. sekundárních trombů;
- nástřiky po každém stažení stentu k posouzení stavu okluze;
- nástřik po skončení výkonu k posouzení výsledku výkonu;
- zařazení pacienta do národního anebo mezinárodního registru.
Návrh indikací a kontraindikací mechanické trombektomie
Níže prezentovaný návrh indikací k mechanické trombektomii primárně vychází z výsledků klinických studií, a to pro přední mozkovou cirkulaci. Pro mechanickou trombektomii v zadní mozkové cirkulaci nejsou k dispozici randomizovaná data o prospěchu této léčby. Na základě současných poznatků se předpokládá, že prospěch z mechanické rekanalizace v zadní cirkulaci bude nejméně takový jako v přední mozkové cirkulaci.
Z výsledků studií vyplývá, že prospěch z mechanické trombektomie do 6 hod od vzniku příznaků mají pacienti na základě zhodnocení skóre ASPECTS, tedy bez nutnosti provedení perfuzního vyšetření. Počet pacientů zařazených pouze na základě ASPECTS tvoří většinu pacientů v uvedených klinických studiích (počet pacientů zařazených do studií na základě hodnocení penumbry byl relativně nízký). Limitacemi použití CT perfuzního vyšetření je zejména skutečnost, že:
a) pro každého výrobce CT přístrojů je potřeba speciální nastavení a výsledky nejsou zcela srovnatelné;
b) některé z přístrojů a jejich software nejsou schopny poskytnout hodnotu Tmax, která byla použita jako definice penumbry v randomizovaných studiích;
c) vyšetření je časově náročnější a vyžaduje post-processing;
d) je nezbytná zkušenost pro interpretaci, což brání všeobecnému zavedení do rutinní klinické praxe.
Proto do 6 hod navrhujeme jako standardní vyšetření nativní CT a CTA se zhodnocením ASPECTS a stavu kolaterální cirkulace. V časovém okně do 6 hod se jeví použití CT perfuzního vyšetření jako racionální pouze v centrech, kde existuje zkušenost s interpretací a současně jsou pochybnosti o indikaci pacienta (např. hraniční skóre ASPECTS).
Indikovaní pacienti
A) Přední mozková cirkulace
Do 6 hod od vzniku:
- Pacienti bez věkového omezení s NIHSS ≥ 2s uzávěrem velké intrakraniální tepny (vč. dominantní M2).
- Pacienti s NIHSS < 2, avšak s prokázaným uzávěrem mozkové tepny mohou být indikováni po zvážení poměru prospěchu a rizika výkonu. Prospěch mohou mít zejména pacienti, kteří mají uzávěr velké tepny a kolísající neurologický deficit anebo deficit omezující kvalitu života, a to i přes nízké NIHSS (např. přítomnost akrální plegie horní končetiny) a/ nebo uzávěr velké tepny při nízkém neurologickém deficitu.
- Pacienti s:
- a) ASPECTS ≥ 6 dle CT nebo CTA-SI nebo,
- b) ASPECTS ≥ 5 dle MR-DWI.
Mezi 6. a 12. hod od vzniku jsou důkazy o prospěchu limitované, a proto navrhujeme, že mohou být léčeni pacienti s:
- NIHSS ≥ 2 + ASPECTS ≥ 6 (ASPECTS ≥ 5 dle MR-DWI) + kolaterály ≥ 50 % teritoria ACM nebo
- NIHSS ≥ 2 + ASPECTS ≥ 6 (ASPECTS ≥ 5 dle MR-DWI) + přítomnost penumbry dle CT perfuze.
Více než 12 hod od vzniku:
Pro provedení mechanické rekanalizace v době po 12 hod neexistují důkazy. Avšak na základě výsledků studií lze předpokládat, že pacienti s příznivým radiologickým nálezem (ASPECTS ≥ 6 + dobré kolaterály ≥ 50 % teritoria ACM nebo ASPECTS ≥ 6 + přítomnost penumbry dle CT perfuze) mohou mít prospěch z provedení mechanické rekanalizace.
B) Zadní mozková cirkulace
Pro zadní mozkovou cirkulaci nelze uplatnit standardně používanou škálu neurologického deficitu NIHSS ani standardní skóre ASPECTS. Pro hodnocení ischemických změn ve vertebrobazilárním povodí bylo navrženo skóre posterior circulation ASPECTS (pc ASPECTS použitelné při vyšetření MR-Susceptibility Weighted Imaging; MR-SWI). Rozhodování o intervenci záleží na časovém okně, klinické závažnosti neurologického deficitu (např. pacient s poruchou polykání bude mít těžký deficit, ale NIHSS 0) a případně výsledku MR-DWI se zhodnocením rozsahu ischemických změn v zadní mozkové cirkulaci.
Indikováni by měli být pacienti do 24 hod od vzniku příznaků s uzávěrem distální vertebrální tepny anebo s prokázaným uzávěrem bazilární tepny a s příznivým nálezem na zobrazení mozku a CT angiografickém vyšetření.
Kontraindikovaní pacienti
Kontraindikace se mírně lišily dle jednotlivých studií a pouze některé kontraindikace jsou striktně absolutní (A):
- Intrakraniální krvácení dle vstupního zobrazení (A).
- TK > 220/ 120 mm Hg (A). TK > 185/ 110 mm Hg je kontraindikací podání intravenózní trombolýzy, nikoliv provedení mechanické rekanalizace. V případě přetrvávajícího uzávěru je možné tolerovat vyšší TK, v případě dosažení reperfuze snaha o dosažení normotenze nebo lehce vyššího TK (v případě, že k tomu nedojde spontánně). Snaha o kompenzaci TK by neměla zdržovat endovaskulární výkon.
- Subakutní mozkový infarkt v povodí intervenované tepny (stáří < 6 týdnů).
- Invalidita před vznikem akutního mozkového infarktu (mRS ≥ 3).
- Závažná alergie na jodovou kontrastní látku (A), nikl nebo titan.
- Klinicky signifikantní hypoglykemie (< 2,7 mmol/ l).
- Cerebrální vaskulitida.
Doporučení a závěr
Dosud publikované klinické studie jednoznačně prokázaly, že endovaskulární terapie pomocí stent retrieverů (zejména Solitaire™) představuje vysoce účinnou a navíc bezpečnou léčbu (výskytem symptomatických intracerebrálních krvácení srovnatelnou se systémovou trombolýzou). Před plánovaným neurointervenčním výkonem musí být vždy podána systémová trombolýza, pokud není kontraindikována (např. před transportem do KCC). Zároveň nesmí být mechanická trombektomie zpožděna z důvodu čekání na případný klinicky nebo radiologický efekt trombolýzy. Mechanická trombektomie by měla být indikována již v době samotného provádění, resp. hodnocení zobrazení mozku. Pokud pacient splňuje indikační kritéria, pak je nezbytné neprodleně aktivovat intervenční tým v KCC. Standardem zobrazení musí být vstupní CT či MR zahrnující popis přítomnosti časných ischemických změn (ASPECTS) a CTA od aortálního oblouku po vertex umožňující detailní zobrazení mozkových tepen (event. MRA). Doporučujeme i hodnocení leptomeningeálních kolaterál a charakteristiky uzávěru/ ů.
Způsob, jakým budou interpretovány výsledky pěti diskutovaných studií různými autory nebo odbornými společnostmi, nemusí být jednotný. Důvodem je, že se indikační kritéria a protokoly zobrazovacích metod v rámci jednotlivých studií liší. Jedním z důležitých dokumentů, který je publikován paralelně s tímto sdělením, je „Mechanical thrombectomy in acute ischemic stroke: Consensus statement by ESO-Karolinska Stroke Update 2014/ 2015“ [15] podpořený následujícími odbornými společnostmi: European Stroke Organisation (ESO), European Society of Minimally Invasive Neurological Therapy (ESMINT), European Society of Neuroradiology (ESNR) a European Academy of Neurology (EAN). Náš i tento zahraniční dokument se shodují v zásadních otázkách, např. použití časového okna do 6 hod pro širokou skupinu pacientů bez věkového omezení. Výše uvedený konsenzus i doporučení Cerebrovaskulární sekce ČNS uvádí, že i pacienti s nízkým skóre ASPECTS (5 a méně) mohou mít prospěch z mechanické rekanalizace. Prospěch z mechanické trombektomie mohou mít i vhodně selektovaní pacienti po 6 hod od vzniku klinických příznaků, pokud nejsou přítomny rozsáhlé časné ischemické změny, zobrazení tepen prokáže uzávěr velké mozkové tepny a dle CTA jsou přítomny dobré leptomeningeální kolaterály. Tento názor se opírá o výsledky studií REVASCAT a ESCAPE [16], ve kterých byli pacienti léčení do 8 hod, resp. 12 hod od vzniku příznaků (nicméně takto léčených pacientů bylo relativně málo). Doporučení AHA/ ASA se s našimi shodují v indikacích výkonu (věk ≥ 18 let – v indikovaných případech je možné intervenovat i pacienty mladší, premorbidní mRS 0– 1, prokázaný uzávěr ACI anebo M1, NIHSS ≥ 6, ASPECTS ≥ 6). Pokud pacient splňuje tato kritéria, je možné přistoupit k intervenčnímu výkonu do 6 hod (vznik příznaků– punkce třísla). Tato doporučení rovněž podporují zahájení výkonu do 6 hod v případě, že je prokázán symptomatický uzávěr segmentů M2 i M3 ACM, a. cerebri anterior, vertebrální tepny, bazilární tepny i a. cerebri posterior. Pro zahájení výkonu po 6 hod není dle těchto doporučení dostatek údajů a jsou nutné randomizované studie. Jako standard zobrazení je doporučeno provedení vyšetření CT/ CTA nebo MR/ MR angiografie. Pokročilé metody zobrazení, jako např. CT/ MR perfuze, jsou doporučeny ke zhodnocení ischemických změn u pacientů v terapeutickém okně do 6 hod s ASPECTS pod 6, resp. u pacientů po 6 hod od vzniku příznaků s prokázaným uzávěrem velké tepny.
Za nezbytnou součást zvyšování kvality prováděných výkonů považujeme systematický trénink specialistů provádějících neurointervenční výkony a také systematickou a standardizovanou monitoraci a evaluaci časových a technických parametrů (námi navrhované doporučení viz oddíl Indikátory kvality neurointervenčních výkonů). Monitorace a pravidelná evaluace jsou nezbytné i dle současných doporučení AHA/ ASA [14].
Stran logistiky není v současné době jasné, zda by pacienti měli být transportováni do KCC primárně anebo zda je vhodný transport do nejbližšího IC a teprve po provedení zobrazení a zahájení intravenózní trombolýzy by měl následovat transport do intervenčního centra. Data z randomizovaných studií nejsou jednoznačná. Například ve studii SWIFT PRIME nebyl nalezen významný rozdíl ve výsledném stavu pacientů léčených přímo ve vyšším centru ve srovnání s těmi odeslanými z centra nižšího, i když čas od vzniku do punkce třísla byl kratší u pacientů ve vyšším centru. Současný systém triáže pacientů v ČR v zásadě umožňuje oba postupy, protože každý kandidát by měl být konzultován posádkou zdravotnické záchranné služby v centru provádějícím neurointervenční výkony, a je tak na rozhodnutí centra, který způsob zvolí. Ačkoli by se zdálo, že současný model je ideální, má určité limitace:
- rozhodování lékařů KCC o primárním transportu může být ovlivněno lůžkovou kapacitou, a ne úvahou, který způsob je pro pacienta výhodnější;
- záchranná služba reportuje stav pacientů nejednotně a nestrukturovaně především z hlediska skutečného neurologického stavu (tíže deficitu).
Proto je potřeba zavést jednotný a validizovaný způsob, a to ve formě zjednodušené neurologické škály, která bude schopna validně identifikovat pacienty s pravděpodobnou přítomností okluze velké mozkové tepny. Do budoucna by tedy první selekce vhodných kandidátů pro primární transport do intervenčních center měla probíhat již na úrovni prvního kontaktu zdravotnické záchranné služby s pacientem, kdy by pacienti na základě přítomnosti určitého stupně závažnosti neurologického deficitu měli být automaticky transportováni do neurointervenčního centra. Druhá selekce by měla probíhat na úrovni IC, kde jsou pacienti transportováni k provedení CT a CTA. Cílem musí být minimalizovat čas od vzniku iktu do dosažení reperfuze/ rekanalizace. Nalezení vhodného řešení závisí jednak na existenci důkazů a jednak na systematické a pravidelné multioborové diskuzi.
Závěr
Jednoznačná pozitivita zmíněných studií zařadila mechanickou rekanalizaci do rutinní klinické praxe. To vyžaduje zejména změny organizace péče o pacienty s akutní cévní mozkovou příhodou s cílem zefektivnit logistiku péče, nastavit a standardizovat zobrazovací protokoly a zavést systematické vzdělávání v oblasti diagnostiky a terapie mozkovým infarktů, a to vč. nastavení pravidel vzdělávání a dalších požadavků na trénink specialistů v neurointervenčních výkonech.
V rámci managementu péče o pacienty po příjezdu do KCC by měla být snaha o minimalizaci časových ztrát do zahájení výkonu. Důraz by měl být kladen na týmovou spolupráci zahrnující kooperaci posádky sanitního vozu, neurologa, radiologa, intervenčního radiologa, anesteziologa a v neposlední řadě i týmu sester s cílem redukovat časové prodlevy. Je absolutní prioritou, aby všechny procesy směřovaly k nejkratšímu možnému času od přijetí do dosažení reperfuze. Indikace mechanické rekanalizace by měla být provedena již v čase, kdy jsou známy indikace výkonu, což je typicky během, resp. po provedení zobrazení mozku a mozkových tepen.
Grantová podpora: projekt FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
Autoři děkují MUDr. Petře Cimflové (Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně) za zpracování obrazové dokumentace k multifázické CT angiografii.
Přijato do tisku: 13. 12. 2015
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Robert Mikulík, Ph.D.
1. neurologická klinika
FN u sv. Anny v Brně
Pekařská 53, 656 91 Brno
e-mail: mikulik@hotmail.com
Sources
1. Mishra SM, Dykeman J, Sajobi TT, Trivedi A, Almekhlafi M, Sohn SI et al. Early reperfusion rates with IV tPA are determined by CTA clot characteristics. AJNR Am J Neuroradiol 2014; 35(12): 2265– 2272. doi: 10.3174/ ajnr.A4048.
2. Riedel CH, Zimmermann P, Jensen-Kondering U, Stingele R, Deuschl G, Jansen O. The importance of size: successful recanalization by intravenous thrombolysis in acute anterior stroke depends on thrombus length. Stroke 2011; 42(6): 1775– 1777. doi: 10.1161/ STROKEAHA.110.609693.
3. Broderick JP, Palesch YY, Demchuk AM, Yeatts SD, Khatri P, Hill MD et al. Endovascular therapy after intravenous t-PA versus t-PA alone for stroke. N Engl J Med 2013; 368(13): 893– 903. doi: 10.1056/ NEJMoa1214300.
4. Ciccone A, Valvassori L, Nichelatti M, Sgoifo A, Ponzio M, Sterzi R et al. Endovascular treatment for acute ischemic stroke. N Engl J Med 2013; 368: 904– 913. doi: 10.1056/ NEJMoa1213701.
5. Kidwell CS, Jahan R, Gornbein J, Alger JR, Nenov V, Ajani Z et al. A trial of imaging selection and endovascular treatment for ischemic stroke. N Engl J Med 2013; 368(10): 914– 923. doi: 10.1056/ NEJMoa1212793.
6. Berkhemer OA, Fransen PS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ et al. A randomized trial of intraarterial treatmentfor acute ischemic stroke. N Engl J Med 2015; 372(1): 11– 20. doi: 10.1056/ NEJMoa1411587.
7. Goyal M, Demchuk AM, Menon BK, Eesa M, Rempel JL, Thornton et al.Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372(11): 1019– 1030. doi: 10.1056/ NEJMoa1414905.
8. Saver JL, Goyal M, Bonafe A, Diener HCh, Levy EI, Pereira VM et al. Stent-retriever thrombectomy after intravenous t-PA vs. t-PA alone in stroke. N Engl J Med 2015; 372(24): 2285– 2295. doi: 10.1056/ NEJMoa1415061.
9. Campbell BC, Mitchell PJ, Kleinig TJ, Dewey HM, Churilov L, Yassi N et al. Endovascular therapy for ischemic stroke with perfusion-imaging selection. N Engl J Med 2015; 372(11): 1009– 1018. doi: 10.1056/ NEJMoa1414792.
10. Jovin TG, Chamorro A, Cobo E, Miquel AM, Molina CA, Rovira A et al. Thrombectomy within 8 hours after symptom onset in ischemic stroke. N Engl J Med 2015; 372: 2296– 2306. doi: 10.1056/ NEJMoa1503780.
11. Nambiar V, Sohn SI, Almekhlafi MA, Chang HW, Mishra S, Qazi E et al. CTA collateral status and response to recanalization in patients with acute ischemic stroke. AJNR Am J Neuroradiol 2014; 35(5): 884– 890. doi: 10.3174/ ajnr.A3817.
12. Menon BK, Campbell BC, Levi C, Goyal M. Role of imaging in current acute ischemic stroke workflow for endovascular therapy. Stroke 2015; 46(6): 1453– 1461. doi: 10.1161/ STROKEAHA.115.009160.
13. Almekhlafi MA, Mishra S, Desai JA, Nambiar V, Volny O, Goel A et al. Not all „successful“ angiographic reperfusion patients are an equal validation of a modified TICI scoring system. Interv Neuroradiol 2014; 20(1): 21– 27.
14. Powers WJ, Derdeyn CP, Biller J, Coffey CS, Hoh BL,Jauch EC et al. American Heart Association StrokeCouncil. 2015 AHA/ ASA Focused Update of the 2013 Guidelines for the Early Management of Patients With Acute Ischemic Stroke Regarding Endovascular Treatment: a Guideline for Healthcare Professionals From the American Heart Association/ American Stroke Association. Stroke 2015; 46(10): 3020– 3035. doi: 10.1161/ STR.0000000000000074.
15. Wahlgren N, Moreira T, Michel P, Steiner T, Jansen O, Cognard Ch et al. Mechanical thrombectomy in acute ischemic stroke: consensus statement by ESO-Karolinska Stroke Update 2014/ 2015, supported by ESO, ESMINT, ESNR and EAN 2015. Available from URL: http:/ / www.eso-stroke.org/ eso-stroke/ strokeinformation/ thrombectomy-consensus-eso-karolinska-esmint-esnr.html.
16. Casaubon LK, Boulanger JM, Blacquiere D, Bou-cher S, Brown K, Goddard T et al. Canadian Stroke BestPractice Recommendations: Hyperacute Stroke Care Guidelines, Update 2015. Int J Stroke 2015; 10(6): 924– 940. doi: 10.1111/ ijs.12551.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2016 Issue 1
Most read in this issue
- Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
- Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
- Komplikace kranioplastik po dekompresivní kraniektomii
- Indikace dekompresivní kraniektomie
