Kardioembolizace je nejčastější příčinou akutní ischemické cévní mozkové příhody u pacientů přijatých do Komplexního cerebrovaskulárního centra do 12 hodin od začátku příznaků – výsledky studie HISTORY
Cardioembolism is the Most Frequent Etiology of an Acute Ischemic Stroke in Patients Admitted within 12 Hours from Symptom Onset – Results of the HISTORY Study
Aim:
The aims of the study were to compare stroke classifications TOAST and ASCOD in acute ischemic stroke (AIS) patients, age, gender, day-time of stroke symptoms onset, time to hospital admission, usage or recanalization methods and prognosis of patients admitted to the hospital within 12 hours after stroke onset with different AIS subtypes.
Materials and methods:
In total, 519 AIS patients admitted to a hospital within 12 hours after stroke onset were consecutively enrolled to the study. Demographic, epidemiologic, anamnestic data, neurological, physical examinations, brain imaging, laboratory tests, vascular and cardiac examinations were performed in all patients. Etiology of AIS was evaluated using the TOAST and ASCOD criteria.
Results:
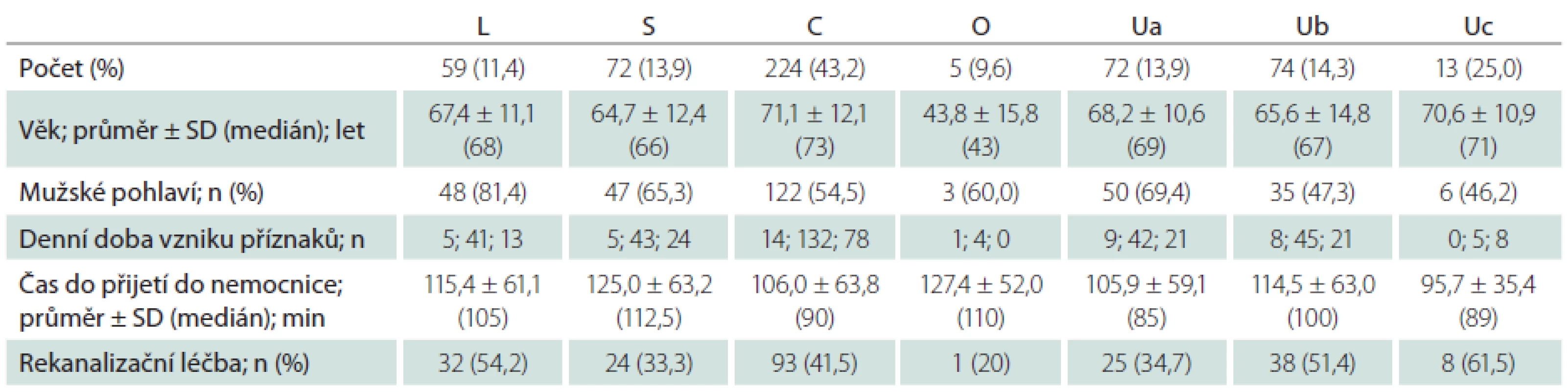
Agreement in stroke classification between the TOAST and ASCOD systems was 78.2%. The most frequent etiology of AIS was cardioembolism, detected in 43.2% patients using the TOAST. Using the ASCOD, 46.1% patients had cardioembolism as potential, 9.2% patients as uncertain and 16.2% as unlikely cause of AIS. Patients with cardioembolic stroke according to the TOAST were significantly older than patients with large-artery atherosclerosis (p = 0.003), lacunar stroke (p < 0.001), other determined (p = 0.026) or undetermined AIS etiology (p < 0.001). Patients with lacunar stroke or other determined AIS etiology had significantly better prognosis of survival than patients with cardioembolic stroke or large-artery atherosclerosis (p < 0.05).
Conclusions:
Cardioembolism is the most frequent etiology of AIS in patients admitted to a Comprehensive Stroke Center within 12 hours after onset. These patients were significantly older and had significantly worse prognosis than patients with lacunar stroke or other determined AIS etiology.
Key words:
ischemic stroke – etiology – classification – cardioembolism – ASCOD – TOAST
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
M. Král 1; D. Šaňák 1; D. Školoudík 2; History Study Group *
Authors‘ workplace:
HISTORY Study Group: T. Veverka, A. Bárt-ková, A. Kunčarová, T. Dorňák, P. Kaňovský (Neurologická klinika LF UP a FN Olomouc), M. Hutyra, D. Vindiš, M. Táborský (Kardiologická klinika LF UP a FN Olomouc), E. Čecháková, Z. Tüdös, M. Černá, M. Köcher (Radio
*; Komplexní cerebrovaskulární centrum, Neurologická klinika LF UP a FN Olomouc
1; Ústav ošetřovatelství, FZV UP v Olomouci
2
Published in:
Cesk Slov Neurol N 2016; 79/112(1): 61-67
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn201661
* HISTORY Study Group: T. Veverka, A. Bártková, A. Kunčarová, T. Dorňák, P. Kaňovský (Neurologická klinika LF UP a FN Olomouc), M. Hutyra, D. Vindiš, M. Táborský (Kardiologická klinika LF UP a FN Olomouc), E. Čecháková, Z. Tüdös, M. Černá, M. Köcher (Radiologická klinika LF UP a FN Olomouc), L. Roubalová, D. Novotný, T. Adam (Oddělení klinické biochemie, FN Olomouc), J. Úlehlová, L. Slavík (Hemato-onkologická klinika LF UP a FN Olomouc), R. Herzig (Neurologická klinika LF UP a FN Hradec Králové), K. Langová (Katedra biofyziky, LF UP v Olomouci)
Overview
Cíl:
Cílem studie bylo srovnat klasifikace etiologie akutní ischemické cévní mozkové příhody (iCMP) pomocí systému TOAST a ASCOD, porovnat věk, pohlaví, denní dobu vzniku příznaků, čas od vzniku příznaků do přijetí, použití rekanalizačních metod a prognózu přežití u pacientů s různými podtypy iCMP, přijatých do Komplexního cerebrovaskulárního centra během 12 hod od vzniku příznaků.
Soubor a metodika:
Do studie bylo konsekutivně zařazeno 519 pacientů přijatých do Komplexního cerebrovaskulárního centra během 12 hod od vzniku iCMP. U všech pacientů byly zaznamenány demografické, epidemiologické a anamnestické údaje, provedena neurologická a fyzikální vyšetření, zobrazení mozku, laboratorní vyšetření a vyšetření srdce a cév. Následně byla vyhodnocena etiologie iCMP podle TOAST a ASCOD kritérií.
Výsledky:
Shoda mezi klasifikací iCMP podle TOAST a ASCOD byla v 78,2 % případů. Nejčastější příčinou iCMP byla podle obou klasifikačních systému kardioembolická etiologie. V klasifikaci TOAST byla kardiální příčina detekována jako etiologie iktu u 43,2 % pacientů. V klasifikaci ASCOD byla srdeční patologie potenciální příčinou u 46,1 %, nejistou příčinou u 9,2 % a málo pravděpodobnou příčinou u dalších 16,2 % pacientů. Pacienti s kardioembolickou etiologií iCMP dle TOAST byli signifikantně starší než pacienti s aterosklerotickým postižením velkých tepen (p = 0,003), lakunárním iktem (p < 0,001), jinou etiologií (p = 0,026) i nejasnou etiologií iCMP (p < 0,001). Pacienti s lakunární nebo jinou určenou etiologií iCMP měli signifikantně vyšší pravděpodobnost přežití než pacienti s kardioembolickou iCMP nebo aterosklerózou velkých tepen (p < 0,05).
Závěry:
Kardioembolizace je nejčastější příčinou iCMP u akutně přijatých pacientů v Komplexním cerebrovaskulárním centru. Pacienti s touto příčinou iktu byli signifikantně starší a měli signifikantně horší prognózu dlouhodobého přežití než pacienti s lakunární nebo jinou určenou etiologií ischemického iktu.
Klíčová slova:
ischemická cévní mozková příhoda – etiologie – klasifikace – kardioembolizace – ASCOD – TOAST
Úvod
Intravenózní trombolýza a následně mechanické trombektomie dramaticky změnily organizaci péče, léčebný algoritmus a prognózu pacientů s akutní ischemickou cévní mozkovou příhodou (iCMP) [1– 3]. Po publikaci výsledků studie ECASS 3 došlo k prodloužení časového okna pro léčbu systémovou trombolýzou na 4,5 hod. Recentní studie demonstrovaly účinnost a bezpečnost mechanické trombektomie do šesti, resp. 12 hod od vzniku iCMP [4– 6]. Technická úspěšnost a především dobrý klinický výsledek rekanalizační terapie však jsou závislé nejen na typu rekanalizační léčby a době do zahájení léčby a rekanalizace tepny, ale také na věku pacienta, místě okluze tepny, tíži příznaků (NIHSS), délce trombu (> 14 mm) a stavu kolaterálního řečiště, délce endovaskulárního výkonu [7], přítomnosti diabetu mellitu [8], ale též na etiologii iktu [9,10].
V posledních desetiletích se stal nejpoužívanějším klasifikačním systémem pro hodnocení etiologie iCMP systém TOAST (Trial of ORG 10172 in Acute Stroke Treatment) [11,12]. Avšak i modifikovaná klasifikace TOAST ignoruje koexistující příčiny a je založena pouze na „nejpravděpodobnější příčině iCMP“ („the most likely cause(s) of stroke“). Kromě toho pacienti s více než jednou příčinou iCMP jsou klasifikováni jako „etiologicky neurčeno” („undetermined etiology“) [12,13]. Díky tomu významná část pacientů spadá do kategorie „etiologicky neurčených“, třebaže potenciální příčiny iCMP jsou identifikovatelné.
V novější klasifikaci ASCOD (A – atherosclerosis, S – small vessel disease, C – cardiac source, O – other cause, D – dissection) Phenotypic System [14], která představuje aktualizovaný klasifikační systém ASCO [15], je charakterizován individuální etiologický profil každého pacienta se současným vyjádřením spolehlivosti (síly) diagnostických důkazů. Každý z pěti fenotypů (A, S, C, O, D) je odstupňován jako 1, 2 nebo 3 v závislosti na úrovni diagnostické jistoty. Pokud i po důkladné diagnostice chybí průkaz etiologie, je fenotyp klasifikován jako 0, popřípadě jako 9, pokud nebyl proveden dostatečný diagnostický proces ke stanovení etiologie. Lze tedy předpokládat, že použití klasifikace ASCOD by mohlo vést ke snížení podílu etiologicky neurčených pacientů ve srovnání s klasifikací TOAST. Je známa poměrně vysoká míra shody mezi klasifikací ASCO a modifikovaným schématem TOAST ve všech etiologických podtypech iCMP kromě „neurčené“ etiologie. Předchozí studie srovnávající ASCO a TOAST zjistily, že ASCO stupeň 1 však nesnižuje poměr pacientů s „neurčenou“ příčinou iCMP [16,17].
Cílem studie bylo srovnat rozdíly mezi klasifikacemi ASCOD a TOAST při stanovení etiologie akutní iCMP u pacientů přijatých do Komplexního cerebrovaskulárního centra během 12hod časového okna pro potenciální rekanalizační léčbu a porovnat věk, pohlaví, denní dobu vzniku příznaků, čas od vzniku příznaků do přijetí, použití jednotlivých rekanalizačních metod (intravenózní trombolýzy, intraarteriální trombolýzy a mechanické trombektomie) a prognózu přežití u pacientů s různými podtypy iCMP.
Soubor a metodika
Do studie HISTORY byli konsekutivně zařazeni všichni pacienti přijatí do Komplexního cerebrovaskulárního centra FN Olomouc během 12 hod od vzniku iCMP během 50měsíčního období (listopad 2010– prosinec 2014). Studie byla registrována na http:/ / www.clinicaltrials.gov (No. NCT01541163). Podrobný studijní protokol byl zveřejněn dříve [18]. Celá studie byla provedena v souladu s Helsinskou deklarací z roku 1975 (ve znění z roku 2004 a 2008). Studie byla schválena místní etickou komisí FN Olomouc (kód návrhu MZ10-FNOL-KralMichal). Před zařazením do studie všichni pacienti podepsali formulář informovaného souhlasu.
Provedená diagnostika
Při přijetí byly u všech pacientů zjištěny demografické a epidemiologické údaje – výskyt arteriální hypertenze, diabetes mellitus, hyperlipidemie, ischemické choroby srdeční a infarktu myokardu v anamnéze, městnavého srdečního selhání (definováno jako ejekční frakce levé komory ≤ 40 %) [19], selhání ledvin (definováno jako glomerulární filtrace < 15 %) nebo renální insuficience (definována jako glomerulární filtrace 15– 89 %) [20], anamnéza CMP, fibrilace síní, nadužívání alkoholu [21], kouření (> 5 cigaret za den), trombofilie, užívání hormonální antikoncepce, anamnéza antikoagulační nebo antiagregační terapie. Dále byla provedena následující vyšetření:
- A. neurologické vyšetření se stanovením tíže příznaků pomocí National Institutes of Health Stroke Scale (NIHSS);
- B. fyzikální vyšetření;
- C. zobrazení mozku při přijetí a po 24 hod pomocí magnetické rezonance (MR), vč. MR angiografie, nebo pomocí počítačové tomografie (CT), vč. CT angiografie;
- D. laboratorní vyšetření při přijetí a po 4 hod;
- E. elektrokardiografie (EKG) při přijetí a po 4 hod;
- F. duplexní sonografie krčních tepen a transkraniální barevně kódovaná duplexní sonografie do 72 hod od přijetí;
- G. transtorakální nebo transezofageální echokardiografie;
- H. Holter EKG (24hod monitoring standardně, v případě indikace rozšířený Holter EKG monitoring 48hod, 7denní, 3týdenní);
- I. kardiologické vyšetření během dvou týdnů od přijetí. Následně bylo provedeno vyhodnocení etiologie iCMP podle TOAST kritérií [18] a ASCOD Phenotypic System [14].
Klasifikace CMP
Dle klasifikačního systému TOAST byli na základě etiologie iktu pacienti zařazeni do jedné z následujících kategorií:
- ateroskleróza velkých tepen (L);
- kardioembolizmus (C);
- okluze malé tepny – lakunární (S);
- ostatní příčiny (O);
- neurčená etiologie – se dvěma nebo více potenciálními příčinami vzniku iCMP znemožňujícími stanovit konečnou diagnózu (Ua), bez zjištěné pravděpodobné etiologie i přes extenzivní došetření (Ub) nebo s nedostatečným došetřením (Uc) [11].
Dle klasifikace ASCOD byla etiologie iktu u každého pacienta hodnocena v pěti předdefinovaných fenotypech: aterosklerotický (A); onemocnění malých tepen (S); srdeční patologie (C); jiné příčiny (O) a disekce tepny (D). V rámci každé kategorie byly hodnoceny stupně síly příčinné souvislosti s proběhlou iCMP (tab. 1). Pokud nebyla po provedení standardního diagnostického procesu zjištěna potenciální příčina, byl stupeň hodnocen jako 0. V případě neúplného diagnostického procesu, nevylučujícího danou příčinu iCMP, byl stupeň hodnocen jako 9 [14].Hodnocení etiologie iktu pomocí klasifikace TOAST a ASCOD bylo provedeno dvěma nezávislými odborníky (TOAST hodnocení – D.S., ASCOD hodnocení – M.K.)
![Klasifikace ASCOD – stupně síly příčinné souvislosti s proběhlou iCMP [14].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/d5dca6891cab30ebeb68dcf624cf06a2.png)
Sledování pacientů
Všichni pacienti zařazení do studie byli sledováni v ročních intervalech, a to ambulantně, pokud byli ve spádové oblasti, nebo telefonicky. V případě, že se pacient nedostavil na kontrolu anebo nebylo se s ním možno spojit telefonicky, byla kontaktována příslušná zdravotní pojišťovna, zda nedošlo k úmrtí pacienta.
Statistická analýza
Shoda mezi klasifikací iCMP dle TOAST a ASCOD byla provedena pomocí kappa koeficientu. Pro následnou statistickou analýzu byly použity tyto proměnné: věk, pohlaví, doba vzniku iCMP (byly stanoveny tři kategorie: vznik mezi 22:00 a 06:00, 6:00 a 14:00 a 14:00 a 22:00 hod), čas od vzniku iCMP do přijetí do nemocnice a použití rekanalizační terapie. Normální rozdělení dat bylo ověřeno Shapirovým-Wilkovým testem. Data s normálním rozložením jsou uváděna jako průměr ± standardní odchylka (SD). Všechny parametry nesplňující normalitu rozdělení jsou uvedeny jako medián a mezikvartilové rozpětí (IQR). Pro srovnání spojitých proměnných s normálním rozložením mezi jednotlivými etiologickými podtypy byl použit Mannův-Whitneyův U test, u ostatních proměnných (věk, čas od vzniku iCMP do přijetí) byl použit Kruskalův-Wallisův test. V případě p < 0,05 byl použit post hoc Mannův-Whitneyův U test s Bonnferoniho korekcí. Pro vyhodnocení kvalitativních parametrů (pohlaví, použití rekanalizační léčby, denní doba vzniku iCMP) byl použit chí kvadrát test. K určení pravděpodobnosti přežití byl použit Kaplanův-Meierův odhad. Srovnání pravděpodobnosti přežití v jednotlivých etiologických podskupinách bylo provedeno pomocí log rank testu. Všechna data byla analyzována za použití IBM SPSS Statistics v22.0 (SPSS, Chicago, IL, USA). Všechny testy byly provedeny na úrovni alfa statistické významnosti p < 0,05.
Výsledky
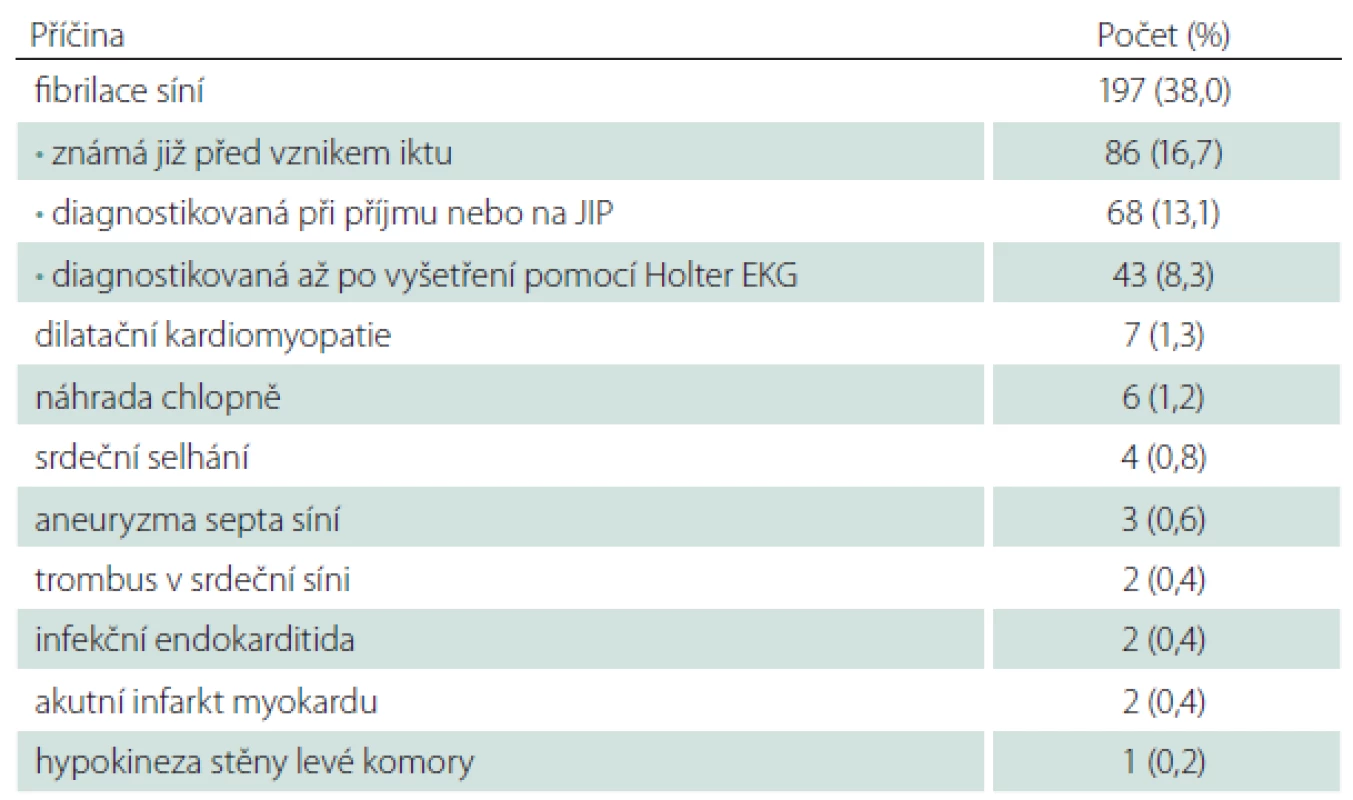
Do studie HISTORY bylo během 50 měsíců zařazeno celkem 519 pacientů z 2 589 pacientů hospitalizovaných v Komplexním cerebrovaskulárním centru pro CMP. Demografická data zařazených pacientů jsou v tab. 2. Klasifikace etiologie iCMP dle klasifikačních systémů TOAST a ASCOD jsou uvedeny v tab. 3 a 4. Shoda mezi klasifikací iCMP podle TOAST a ASCOD byla v 78,2 % případů, kappa koeficient = 0,711 (95% CI: 0,669– 0,756). Nejčastější příčinou iCMP byla podle obou klasifikačních systémů kardioembolická etiologie. V klasifikaci TOAST byla kardiální příčina detekována jako etiologie iktu u 43,2 % pacientů. V klasifikaci ASCOD byla srdeční patologie potenciální příčinou u 46,1 %, nejistou příčinou u 9,2 % a málo pravděpodobnou příčinou u dalších 16,2 % pacientů. Jen u 11,8 % pacientů byla kardioembolická etiologie iktu vyloučena. Výskyt jednotlivých kardioembolických příčin je v tab. 5.
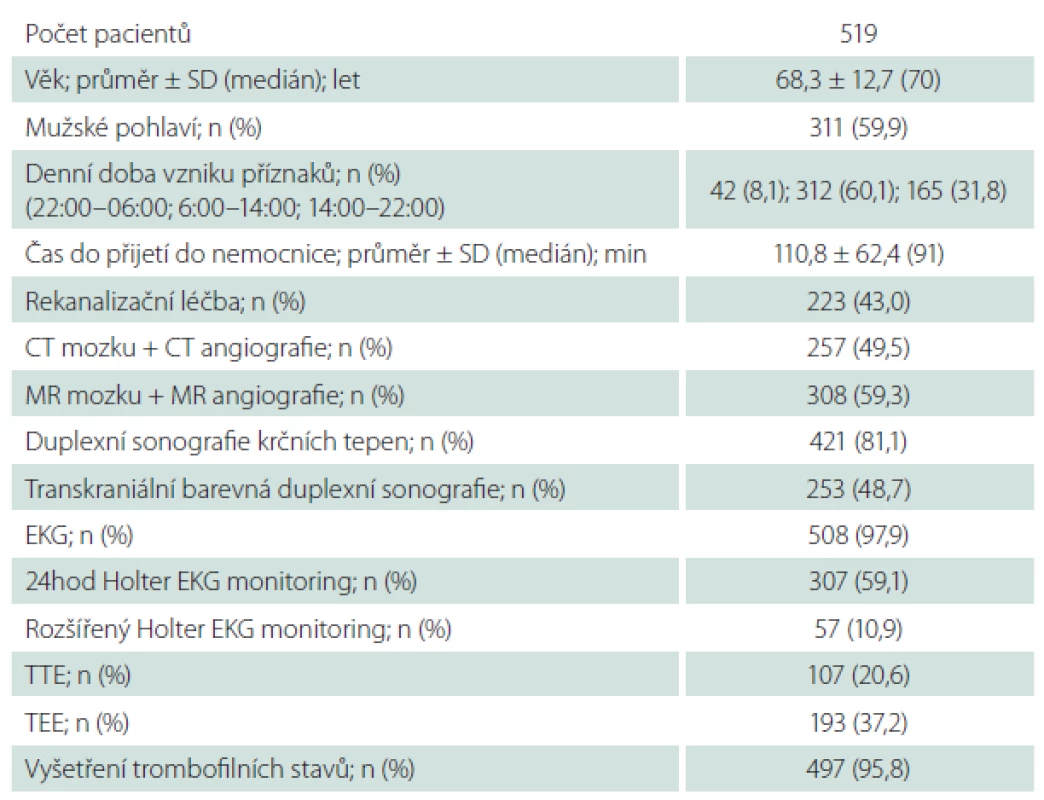
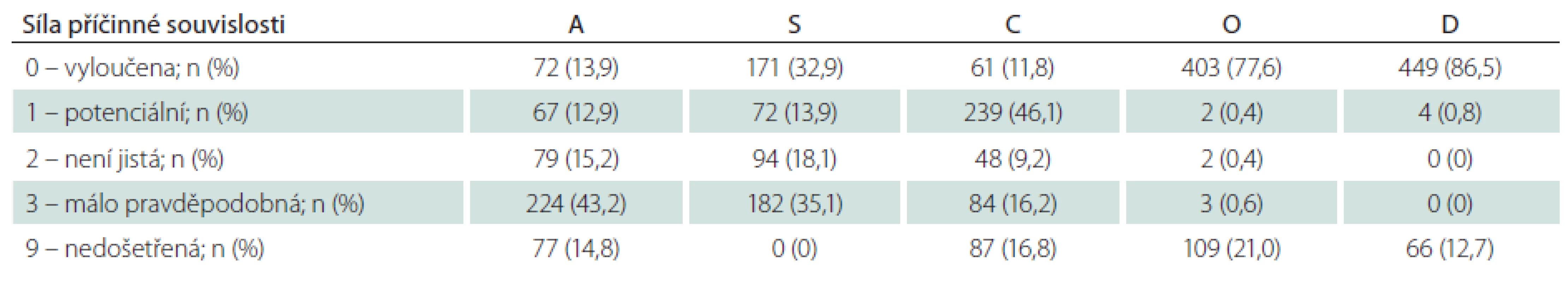
Při klasifikaci etiologie iktu pomocí TOAST nebylo možno určit etiologii iktu u 159 (30,6 %) pacientů, přičemž u 74 z nich nebyla zjištěna pravděpodobná etiologie i přes extenzivní došetření (Ub), u 72 bylo zjištěno více potenciálních příčin znemožňujících stanovit konečnou diagnózu a 13 pacientů nebylo dovyšetřeno dle kritérií TOAST klasifikace. Při klasifikaci etiologie iktu pomocí ASCOD klasifikace nebylo možno určit potenciální etiologii iktu (stupeň síly příčinné souvislosti 1) u 220 (42,4 %) pacientů, přičemž u 170 z nich nebyla zjištěna potenciální etiologie i přes extenzivní došetření (Ub), u 39 bylo zjištěno více potenciálních příčin a 11 pacientů nebylo dovyšetřeno dle kritérií ASCOD klasifikace. V případě, že byl jako dostatečný stupeň síly příčinné souvislosti 2, tedy potenciální nebo nejistá příčinná souvislost, nebylo možno určit potenciální etiologii iktu u 150 (28,9 %) pacientů (73 pacientů bez zjištěné příčiny, 66 s více zjištěnými příčinami a 11 nedošetřených pacientů).
Pacienti s kardioembolickou etiologií iCMP dle TOAST byli signifikantně starší než pacienti s aterosklerotickým postižením velkých tepen (p = 0,003), lakunárním iktem (p < 0,001), jinou etiologií (p = 0,026) i nejasnou etiologií iCMP (p < 0,001). Pacienti s jinou etiologií iktu byli naopak signifikantně mladší než pacienti s aterosklerotickým postižením velkých tepen (p = 0,027), lakunárním iktem (p = 0,038), kardioembolickou (p = 0,027) i nejasnou etiologií iCMP (p = 0,046).
Mezi pacienty s aterosklerotickým postižením velkých tepen byli signifikantně častěji muži oproti pacientům s kardioembolickou (p = 0,001) nebo nejasnou etiologií iCMP (p = 0,001). Statisticky nebyly zjištěny signifikantní rozdíly v denní době vzniku iktu, době od vzniku příznaků do přijetí do nemocnice či použití rekanalizační léčby mezi jednotlivými etiologiemi iCMP dle TOAST ani ASCOD klasifikace (p > 0,05 ve všech případech). Křivky pravděpodobnosti přežití jsou v grafech 1 a 2. Pacienti s lakunární nebo jinou určenou etiologií ischemického iktu měli signifikantně vyšší pravděpodobnost přežití než pacienti s kardioembolickou iCMP (p < 0,001 a p < 0,001) nebo aterosklerózou velkých tepen (p = 0,002 a p < 0,001).


Diskuze
Správné a včasné určení příčiny iCMP je důležité nejen pro optimální sekundární prevenci, ale také pro prognózu pacientů s akutním iktem [9,10,22]. Základní předpoklad pro určení správné příčiny iktu je přesná etiologická klasifikace. V současnosti jsou nejpoužívanější klasifikační systémy TOAST a ASCO, resp. ASCOD [11,12,14,15].
Výsledky prezentované studie ukázaly dobrou shodu mezi oběma klasifikačními systémy. Dle obou klasifikací byla nejčastější etiologií akutní iCMP u pacientů přijatých do 12 hod od začátku příznaků kardioembolizace. Ta byla potenciální příčinou téměř 50 % ischemických iktů, což je výrazně více než v dosud publikovaných studiích, v nichž se pohybovala v rozmezí 10– 30 % [23– 26]. V post hoc analýze studie AMISTAD [25], která zařazovala pacienty do 10 dní od začátku příznaků iktu, pak byla kardioembolizace dokonce plně vyloučena u 48 % pacientů, zatímco v naší studii jen v 12 % případů.
Ateroskleróza velkých tepen a okluze malé tepny (tj. lakunární infarkt) byly v prezentované studii příčinou iCMP u 11, resp. 14 % pacientů, což je ve shodě s publikovanými studiemi, ve kterých byla u kavkazské populace ateroskleróza velkých tepen příčinou 6– 16 % a okluze malé tepny 11– 26 % ischemických iktů [23– 25]. Vyšší výskyt byl referován jen u Asiatů, kde ateroskleróza velkých tepen byla příčinou 10– 54 % a lakunární infarkt 20– 42 % iCMP [26].
Možných vysvětlení vyššího výskytu kardioembolických iktů v prezentované studii je více. Prvním je komplexní vyšetření pacientů, a to především poruch srdečního rytmu. Díky tomu bylo detekováno o 8,3 % více pacientů s fibrilací síní oproti běžnému vyšetření pouze EKG při příjmu, event. monitorováním srdečního rytmu na JIP. Druhým může být „podléčenost“ pacientů se známým rizikem kardioembolizmu ve zkoumané populaci [27]. Nedostatečná léčba kardioembolických rizik však byla publikována i z jiných světových regionů [28,29]. V neposlední řadě se jednotlivé studie významně liší selekcí pacientů; do naší studie byli zařazeni pouze pacienti přijatí k hospitalizaci do Komplexního cerebrovaskulárního centra do 12 hod od začátku příznaků.
Výsledky prezentované studie prokázaly velmi důležitý fakt. Pacienti s různou etiologií iCMP hospitalizovaní do 12 hod od vzniku příznaků se neliší v čase od začátku příznaků do přijetí do nemocnice a zároveň v šanci být léčeni rekanalizační léčbou – intravenózní nebo intraarteriální trombolýzou či mechanickou trombektomií. Lze tedy předpokládat, že iCMP na podkladě všech etiologických podskupin má pravděpodobně podobně „dramatické“ či „typické“ příznaky. Tedy příznaky se stejnou motivací k vyhledání akutní lékařské péče.
Dalším výsledkem studie je, že pacienti s různou etiologií iCMP se neliší v denní době vzniku příznaků. Nejčastěji byl vznik mezi 6. hod ranní a 2. hod odpoledne, tedy v pracovní době, kdy vznikly příznaky u 60 % pacientů. Naopak nejméně často vznikly příznaky v noci mezi 10. hod večerní a 6. hod ranní. Tento fakt je však pravděpodobně zkreslen tím, že pokud vzniknou příznaky během spánku, dotyčný je zjistí až po probuzení.
Nejlepší prognózu dlouhodobého přežití měli pacienti s lakunární nebo jinou určenou etiologií iCMP. Pacient s aterosklerózou velkých tepen a především pacienti s kardioembolickou iCMP měli signifikantně nižší pravděpodobnost přežití, což je ve shodě s publikovanou německou studií [24].
Důvodem horší prognózy pacientů s kardioembolickou iCMP je až pětinásobně vyšší riziko recidivy iCMP a vyšší tříměsíční mortalita díky strukturálním změnám myokardu [30,31]. Fibrilace síní sama o sobě i u pacientů bez iCMP zvyšuje riziko úmrtí o 30 % [32]. Nižší pravděpodobnost přežití je tedy významně determinována kardiálními příčinami: strukturálními změnami myokardu, ischemickou chorobou srdeční a poruchami srdečního rytmu. Jako důvod horší prognózy přežití u pacientů s kardioembolickou iCMP je popisován také těžší průběh iktu s těžšími příznaky [30,31]. V naší studii nestanovil tíži vstupního deficitu u jednotlivých pacientů vždy specialistou iktového týmu. Proto tento údaj nebyl hodnocen. Dalším důvodem horší prognózy přežití je také vyšší věk pacientů s kardioembolickým iktem.
Závěr
Nejčastější etiologií iCMP u pacientů přijatých do Komplexního cerebrovaskulárního centra do 12 hod od začátku příznaků byla kardioembolizace. Pacienti s touto příčinou iktu byli signifikantně starší a méně často muži než v případě jiné etiologie iCMP a měli signifikantně horší prognózu dlouhodobého přežití než pacienti s lakunární nebo jinou určenou etiologií ischemického iktu.
Podpořeno grantovým projektem Interní grantové agentury Ministerstva zdravotnictví České republiky č. NT/11046-6/2010.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 1. 10. 2015
Přijato do tisku: 14. 12. 2015
prof. MUDr. David Školoudík, Ph.D., FESO
Ústav ošetřovatelství
FZV UP v Olomouci
Tř. Svobody 8, 771 11 Olomouc
e-mail: david.skoloudik@upol.cz
Sources
1. Powers WJ, Derdeyn CP, Biller J, Coffey CS, Hoh BL, Jauch EC et al. American Heart Association Stroke Council 2015 AHA/ ASA Focused Update of the 2013 Guidelines for the Early Management of Patients With Acute Ischemic Stroke Regarding Endovascular Treatment: a Guideline for Healthcare Professionals From the American Heart Association/ American Stroke Association. Stroke 2015; in press.
2. Jauch EC, Saver JL, Adams HP jr, Bruno A, Connors JJ, Demaerschalk BM et al. American Heart Association Stroke Council; Council on Cardiovascular Nursing; Council on Peripheral Vascular Disease; Council on Clinical Cardiology. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2013; 44(3): 870– 947. doi: 10.1161/ STR.0b013e318284056a.
3. Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke 2007; 38(3): 967– 973.
4. Hacke W, Kaste M, Bluhmki E, Brozman M, Dávalos A, Guidetti D et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359(13): 1317– 1329. doi: 10.1056/ NEJMoa0804656.
5. Berkhemer OA, Fransen PS, Beumer D, van den Berg LA, Lingsma HF, Yoo AJ et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015; 372(1): 11– 20. doi: 10.1056/ NEJMoa1411587.
6. Goyal M, Demchuk AM, Menon BK, Eesa M, Rempel JL, Thornton J et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372(11): 1019– 1030. doi: 10.1056/ NEJMoa1414905.
7. Soize S, Barbe C, Kadziolka K, Estrade L, Serre I, Pierot L. Predictive factors of outcome and hemorrhage after acute ischemic stroke treated by mechanical thrombectomy with a stent-retriever. Neuroradiology 2013; 55(8): 977– 987. doi: 10.1007/ s00234-013-1191-4.
8. Linfante I, Starosciak AK, Walker GR, Dabus G, Castonguay AC, Gupta R et al. Predictors of poor outcome despite recanalization: a multiple regression analysis of the NASA registry. J Neurointerv Surg 2015; pii: neurintsurg-2014-011525. doi: 10.1136/ neurintsurg-2014-011525.
9. Chung CP, Yong CS, Chang FC, Sheng WY, Huang HC, Tsai JY et al. Stroke etiology is associated with outcome in posterior circulation stroke. Ann Clin Transl Neurol 2015; 2(5): 510– 517. doi: 10.1002/ acn3.188.
10. Ueda T, Sakaki S, Kumon Y, Ohta S. Multivariable analysis of predictive factors related to outcome at 6 months after intra-arterial thrombolysis for acute ischemic stroke. Stroke 1999; 30(11): 2360– 2365.
11. Adams HP, Bendixen BH, Kappelle LJ, Biller J, Love BB, Gordon DL et al. Classification of subtype of acute ischemic stroke definitions for use in a multicenter clinical trial. Stroke 1993; 24(1): 35– 41.
12. Han SW, Kim SH, Lee JY, Chu CK, Yang JH, Shin HY et al. A new subtype classification of ischemic stroke based on treatment and etiologic. Eur Neurol 2007; 57(2): 96– 102.
13. Scullen TA, Monlezun DJ, Siegler JE, George AJ, Schwickrath M, El Khoury R et al. Cryptogenic stroke: clinical consideration of a heterogeneous ischemic subtype. J Stroke Cerebrovasc Dis 2015; 24(5): 993– 999. doi: 10.1016/ j.jstrokecerebrovasdis.2014.12.024.
14. Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Wolf ME, Hennerici MG. The ASCOD Phenotyping of Ischemic Stroke (Updated ASCO Phenotyping). Cerebrovasc Dis 2013; 36(1): 1– 5. doi: 10.1159/ 000352050.
15. Amarenco P, Bogousslavsky J, Caplan LR, Donnan GA, Hennerici MG. New approach to stroke subtyping: the A-S-C-O (phenotypic) classification of stroke. Cerebrovasc Dis 2009; 27(5): 502– 508. doi: 10.1159/ 000210433.
16. Marnane M, Duggan CA, Sheehan OC, Merwick A, Hannon N, Curtin D et al. Stroke subtype classification to mechanism-specific and undetermined categories by TOAST, A-S-C-O, and causative classification system. Stroke 2010; 41(8): 1579– 1586. doi: 10.1161/ STROKEAHA.109.575373.
17. Shang Wy, Liu Jy. Stroke subtype classification: a comparative study of ASCO and modified TOAST. J Neurol Sci 2012; 314(1– 2): 66– 70. doi: 10.1016/ j.jns.2011.10.029.
18. Kral M, Skoloudik D, Sanak D, Veverka T, Bartkova A, Dornak T et al. Assessment of relationship between acute ischemic stroke and heart disease – protocol of a prospective observational trial. Biomed Pap 2012; 156(6): 284– 289. doi: 10.5507/ bp.2012.094.
19. Yancy CW, Jessup M, Bozkurt B, Butler J, Casey DE jr, Drazner MH; American College of Cardiology Foundation; American Heart Association Task Force on Practice Guidelines. 2013 ACCF/ AHA guideline for the management of heart failure: executive summary: a report of the American College of Cardiology Foundation/ American Heart Association Task Force on practice guidelines. Circulation 2013; 128(16): 1810– 1852. doi: 10.1161/ CIR.0b013e31829e8807.
20. National Kidney Foundation. K/ DOQI, clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis 2002; 39 (Suppl 1): S1– S266.
21. Herzig R, Urbánek K, Vlachová I, Krupka B, Gabrys M, Mares J et al. The role of chronic alcohol intake in patients with spontaneous intracranial hemorrhage: a carbohydrate-deficient transferrin study. Cerebrovasc Dis 2003; 15(1– 2): 22– 28.
22. Kernan WN, Ovbiagele B, Black HR, Bravata DM,Chimowitz MI, Ezekowitz MD et al; American HeartAssociation Stroke Council, Council on Cardiovascular and Stroke Nursing, Council on Clinical Cardiology, and Council on Peripheral Vascular Disease. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2014; 45(7): 2160– 2236. doi: 10.1161/ STR.0000000000000024.
23. Cotter PE, Belham M, Martin PJ. Towards understanding the cause of stroke in young adults utilising a new stroke classification system (A-S-C-O). Cerebrovasc Dis 2012; 33(2): 123– 127. doi: 10.1159/ 000334183.
24. Kolominsky-Rabas PL, Weber M, Gefeller O, Neundoerfer B, Heuschmann PU. Epidemiology of ischemic stroke subtypes according to TOAST criteria: incidence, recurrence, and long-term survival in ischemic stroke subtypes: a population-based study. Stroke 2001; 32(12): 2735– 2740.
25. Sirimarco G, Lavallée PC, Labreuche J, Meseguer E, Cabrejo L, Guidoux C et al. Overlap of diseases underlying ischemic stroke: the ASCOD phenotyping. Stroke 2013; 44(9): 2427– 2433. doi: 10.1161/ STROKEAHA.113.001363.
26. Tsai CF, Thomas B, Sudlow CL. Epidemiology of stroke and its subtypes in Chinese vs white populations: a systematic review. Neurology 2013; 81(3): 264– 272. doi: 10.1212/ WNL.0b013e31829bfde3.
27. Král M, Herzig R, Šaňák D, Školoudík D, Bártková A, Veverka T et al. Underuse of oral anticoagulation in primary prevention of cardioembolic stroke. Cesk Slov Neurol N 2014; 77/ 110(1): 59– 63.
28. Wong CX, Lee SW, Gan SW, Mahajan R, Rangnekar G, Pathak RK et al. Underuse and overuse of anticoagulation for atrial fibrillation: a study in indigenous and non-indigenous Australians. Int J Cardiol 2015; 191: 20– 24. doi: 10.1016/ j.ijcard.2015.03.064.
29. Bahri O, Roca F, Lechani T, Druesne L, Jouanny P, Serot JM et al. Underuse of oral anticoagulation for individuals with atrial fibrillation in a nursing home setting in France: comparisons of resident characteristics and physician attitude. J Am Geriatr Soc 2015; 63(1): 71– 76. doi: 10.1111/ jgs.13200.
30. Arboix A, Alió J. Acute cardioembolic stroke: an update. Expert Rev Cardiovasc Ther 2011; 9(3): 367– 379. doi: 10.1586/ erc.10.192.
31. Wolf PA, Abbott RD, Kannel WB. Atrial fibrillation as an independent risk factor for stroke: the framingham study. Stroke 1991; 22(8): 983– 988.
32. Chao TF, Liu CJ, Tuan TC, Chen SJ, Wang KL, Lin YJ et al. Rate-Control Treatment and Mortality in Atrial Fibrillation. Circulation 2015; 132(17): 1604– 1612. doi: 10.1161/ CIRCULATIONAHA.114.013709.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2016 Issue 1
Most read in this issue
- Pozorovanie hrúbky vrstvy nervových vlákien sietnice u pacientov so sklerózou multiplex pomocou optickej koherentnej tomografie
- Sympatická kožní odpověď v diagnostice neuropatie tenkých vláken
- Komplikace kranioplastik po dekompresivní kraniektomii
- Indikace dekompresivní kraniektomie
