Chirurgicky obtížně řešitelné meningeomy
Surgically Difficult‑ to‑ Treat Meningiomas
Surgical treatment is still considered as the method of choice for the treatment of meningiomas. The goal of treatment is to completely surgically remove the tumor; complete excision often results in a permanent cure of the patient. The patient prognosis is mainly determined by the completeness of the resection but anatomical location and histological type of the tumor according to the WHO classification also play an important role. Some meningiomas, especially the skull base meningiomas, often involving large vessels and cranial nerves, as well as WHO grade III meningiomas are very difficult to treat. Patient general health status and internal comorbidities represent another very important factor. The authors describe the most common types of surgically difficult-to-treat meningiomas and describe their experience with surgical removal and additional treatment and surveillance of patients with these tumors.
Key words:
meningioma – surgery – resection
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
M. Duba; A. Mrlian; E. Neuman; J. Musil; M. Smrčka
Authors‘ workplace:
Neurochirurgická klinika LF MU a FN Brno
Published in:
Cesk Slov Neurol N 2015; 78/111(1): 88-92
Category:
Short Communication
Overview
V terapii meningeomů na prvním místě přetrvává chirurgická léčba. Cílem chirurgické léčby je úplné odstranění nádoru, které často znamená úplné vyléčení pacienta. Prognózu pacienta určuje především radikalita resekce, dále také anatomické umístění a histologický typ nádoru dle WHO klasifikace. Některé meningeomy, zejm. meningeomy baze lební, které často utiskují nebo obrůstají velké cévy a hlavové nervy, a dále potom meningeomy, které histologicky odpovídají WHO st. III, jsou velmi obtížně léčitelné. Nezanedbatelným faktorem je i celkový stav a interní komorbidity. Autoři uvádějí nejčastější typy obtížně chirurgicky řešitelných meningeomů a popisují zkušenosti svého pracoviště s chirurgickým odstraněním, další léčbou a sledováním pacientů s těmito nádory.
Klíčová slova:
meningeom – chirurgická léčba – resekce
Úvod
Meningeomy jsou zpravidla dobře ohraničené, pomalu rostoucí nádory vycházející z arachnoideálních buněk, jež dále prorůstají tvrdou plenu. Tvoří až okolo 20 % všech primárních intrakraniálních nádorů (13– 26 %) s maximem výskytu kolem 45 let věku a častějším výskytem u žen (2 : 1). Někteří autoři popisují ovšem vyšší incidenci malignějších variant meningeomů u mužů [1– 3]. Bylo zjištěno, že mezi nádorem a přilehlou mozkovou tkání bývá tenká vrstva vřetenovitých buněk, která tvoří pouzdro, jež dobře odděluje mozkovou tkáň od nádoru. Takovéto meningeomy byly označeny jako neinvazivní [3,4]. Existují však i formy, jež působí nejen kompresivně, ale dokonce i infiltrativně na okolní kost i měkké tkáně. U těchto invazivních meningeomů se pouzdro z vřetenovitých buněk částečně ztrácí, nádorové buňky jím prorůstají, dokonce jsou při okraji promíchány s buňkami okolní zdravé mozkové tkáně [5– 7]. Navíc buňky některých meningeomů vytvářejí tzv. arachnoideální hnízda, která mohou být vzdálena až 2 cm od origa a mohou být limitujícím faktorem radikality resekce i možným zdrojem časných recidiv nádorového procesu [8]. Sekrece růstových faktorů, zvláště VEGF z mikroskopického rezidua, i po jinak radikální resekci podporuje neovaskularizaci, která postupně vede k recidivě nádoru [9,10].
Úspěšnost chirurgické léčby je spojena s radikalitou resekce. Od roku 1957 byla zavedena klasifikace radikality chirurgického zákroku podle Simpsona na pět stupňů [11,12]. Recidiva je tím pravděpodobnější, čím menší stupeň radikality byl dosažen. Některá anatomická umístění (např. oblast klivu a hrotu pyramidy) jsou velmi obtížně chirurgicky přístupná. Všechny tyto faktory hrají významnou roli v dosažitelné radikalitě resekce [11– 14].
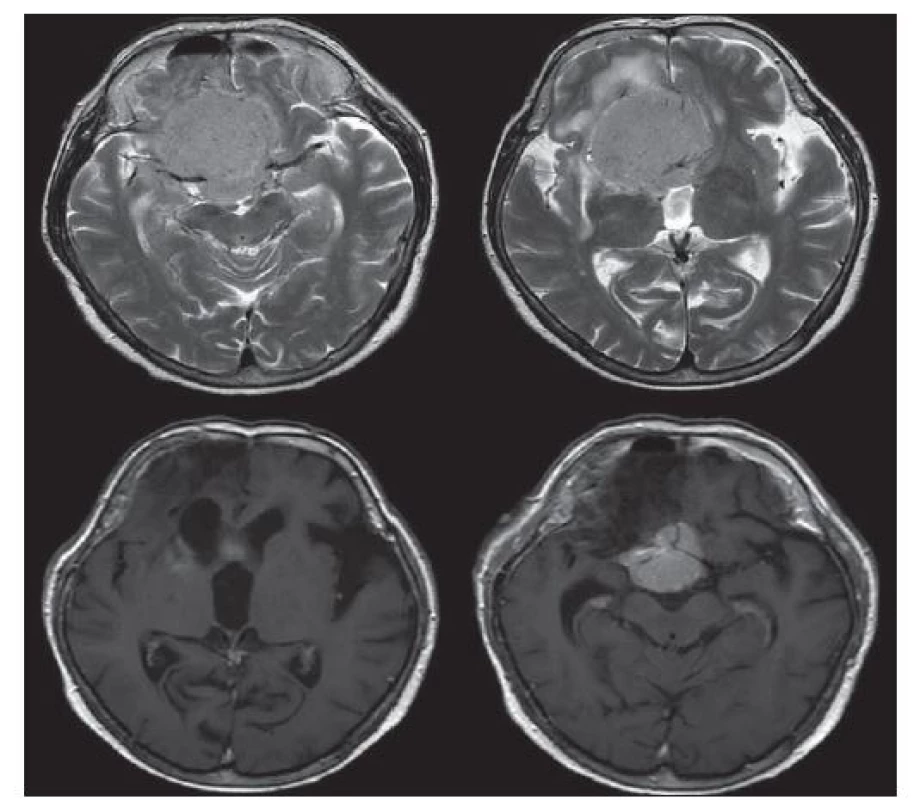
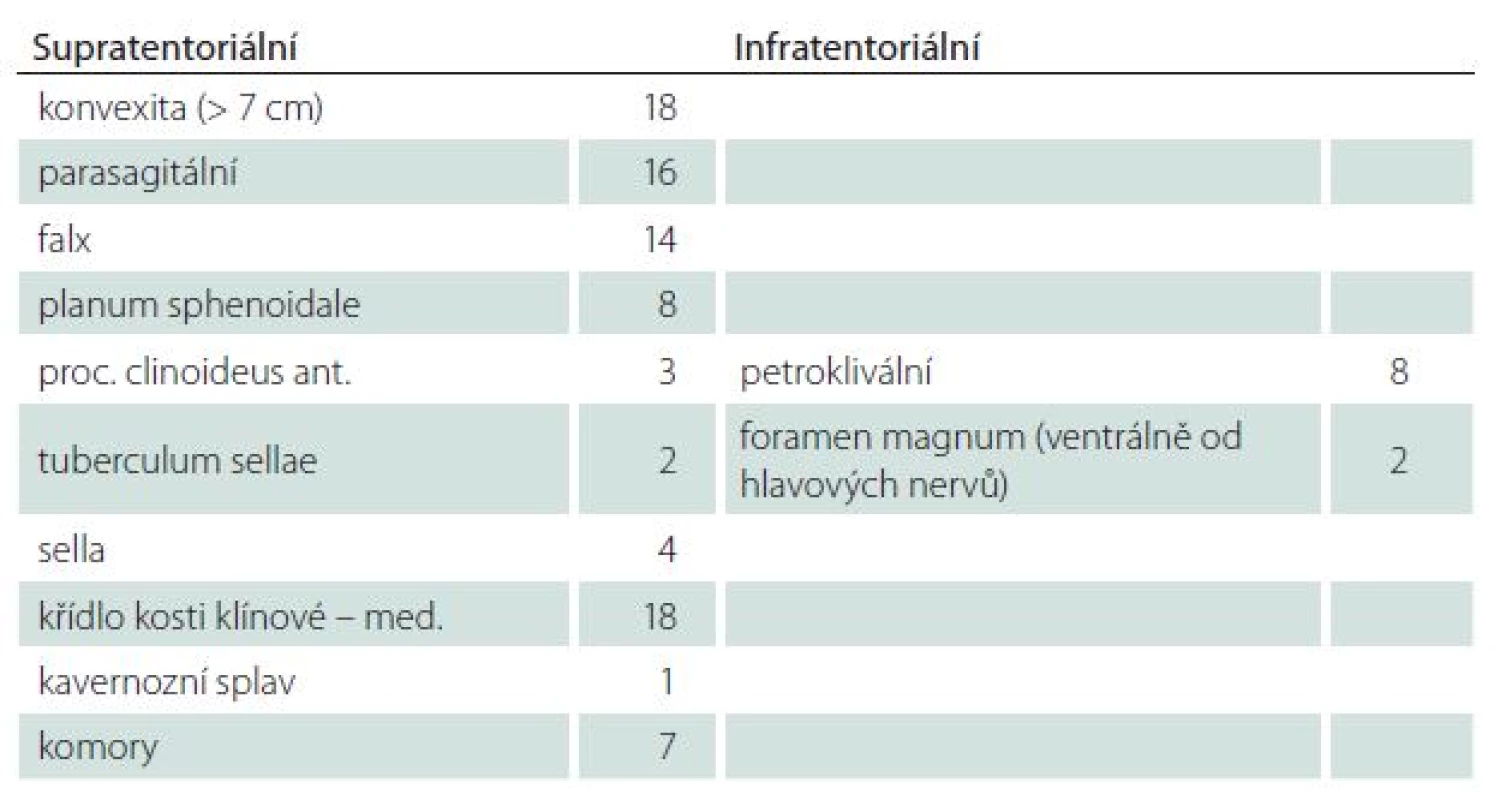
Za obtížně chirurgicky řešitelné meningeomy lze považovat především meningeomy baze lební [15]. Jsou to jednak ty, které mají delikátní anatomické umístění, např. meningeomy klivu a petroklivální (obr. 1). Zde je často nutné naplánování dvou samostatných operací, z přístupu supratentoriálního a přístupu infratentoriálního. Dále jsou to meningeomy planum sphenoidale, tuberculum sellae, procesus clinoideus anterior, mediální varianta kosti klínové, (obr. 2) [16,17]. Dotčenými strukturami bývají n. opticus, chiasma optimum, a. carotis int. (ACI), a. cerebri ant. (ACA), a. cerebri media (ACM). Potom jsou to meningeomy kavernózního splavu a sfenokavernózní meningeomy (vnitřní varianta křídla s prorůstáním do sinus cavernosus), které infiltrují kavernózní splav.
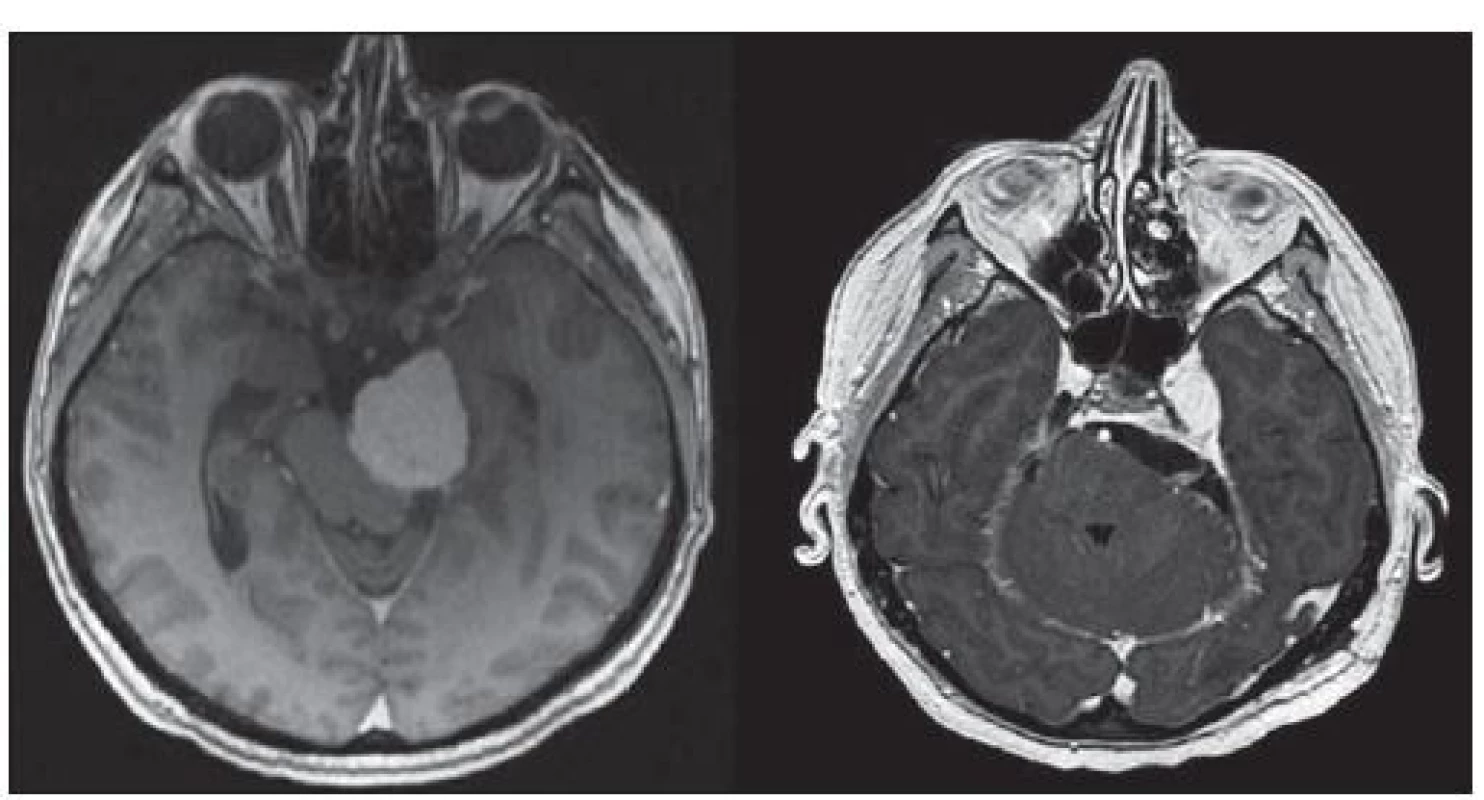
Ze supratentoriálních meningeomů jsou obtížně chirurgicky řešitelné především parasagitální meningeomy [18,19], které prorůstají do splavů, jež ale nejsou často zcela uzavřeny. Zde je možná pouze totální exstirpace s následnou rekonstrukcí splavu nebo ponechání rezidua tumoru. Chirurgické riziko velikých meningeomů falxu spočívá v možné přítomnosti silných drénujících žil do splavu (obr. 3). Tyto žíly často zmenšují přístupový koridor a celá resekce se stává delší a obtížnější [20].
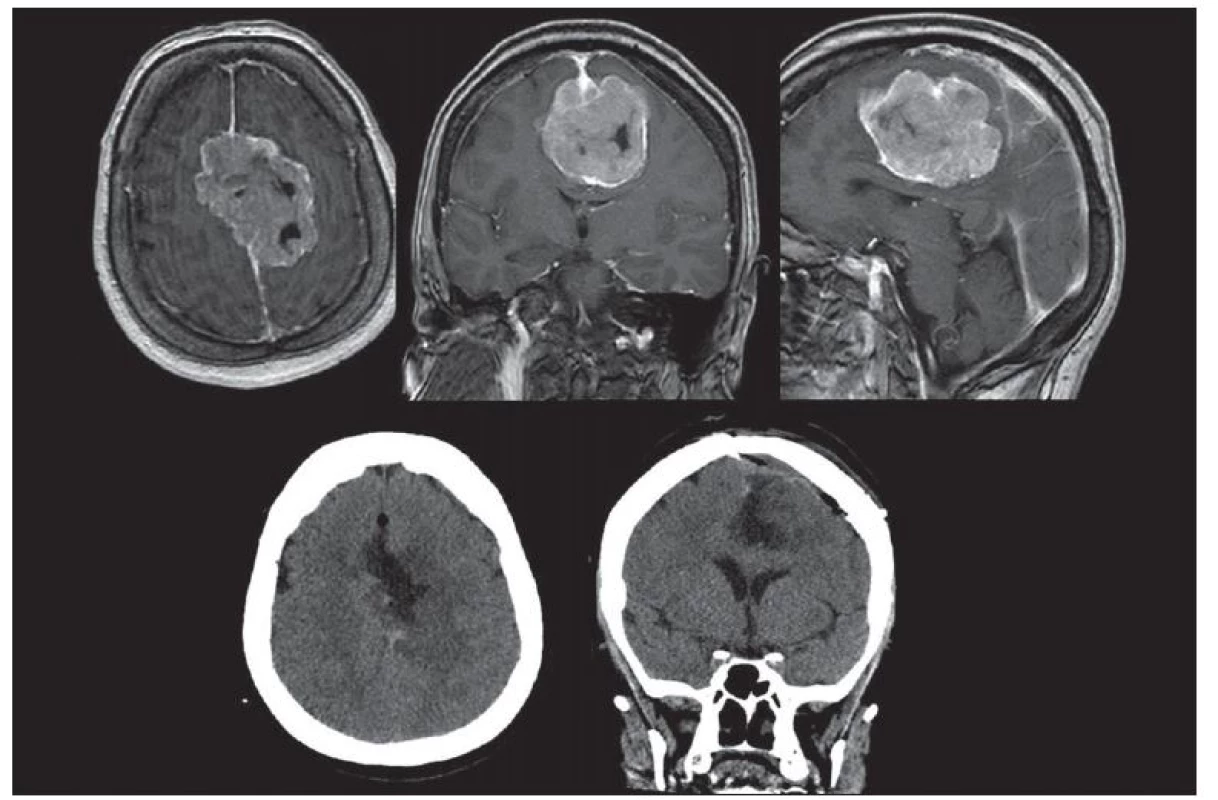
Za chirurgicky obtížné lze považovat i meningeomy očnice. Z důvodu mnohdy výrazného roztlačení nervových struktur dochází k jejich významné anatomické dislokaci a tím i náročné identifikaci v průběhu operačního výkonu.
Další skupinou obtížně chirurgicky řešitelných meningeomů jsou meningeomy WHO st. III s histologickými rysy malignity a vysokým proliferačním indexem. Tyto meningeomy často výrazně infiltrují přilehlou kost a nedají se totálně extirpovat. Mnohdy se musíme spokojit pouze se subtotální nebo parciální resekcí (Simpson III) [21– 23]. I totální resekce tumoru neznamená dlouhodobou remisi, na operaci je potřebné navázat adjuvantní radioterapií.
Samostatnou skupinou potom zůstávají gigantické konvexitární meningeomy. Někdy díky své velikosti mohou zasahovat až do elokventních zón, např. motorické a suplementární motorické arei. I když je tento meningeom velmi snadno přístupný a jeho odstranění ve většině případů nečiní téměř žádné obtíže, nastávají někdy časné komplikace po operaci. Nejčastěji je to zhoršený neurologický deficit a zakrvácení do lůžka po odstraněném tumoru. Ke vzniku těchto komplikací významně přispívá redistribuce mozkové tkáně do takto náhle vzniklého prostoru po odstranění meningeomu, dále edém okolní mozkové tkáně a samozřejmě porušená hematoencefalická bariéra, jež se v prvních pooperačních dnech podstatně podílí na nárůstu edému mozku [22,23].
Vlastní soubor a výsledky
V letech 2005– 2012 jsme na našem pracovišti ošetřili celkem 381 extraaxiálních tumorů. V rámci komplexního přístupu byla standardně během operací využívána bezrámová navigace a neurofyziologie. Navigace sloužila k přesnějšímu cílení kraniotomie a určení vztahu meningeomů k přilehlým důležitým strukturám, jako jsou žilní splavy a nervové a cévní struktury na bazi lební. V rámci neurofyziologie jsme využívali přesné určení primární motorické oblasti (zvrat fáze).
V našem souboru bylo možné podle výše rozebíraných kritérií označit 101 meningeomů jako chirurgicky obtížně řešitelné. Jejich lokalizaci detailně vysvětluje tab. 1. Bylo lokalizováno 91 meningeomů supratentoriálně a 10 bylo lokalizováno infratentoriálně. Poměr muži : ženy byl 1 : 1,7 a věkový průměr byl 61,6 let. Na základě výsledků histologického vyšetření byl u 95 pacientů diagnostikován meningeom grade I + II, u šesti pacientů se potvrdila diagnóza grade III, ve třech případech se jednalo o rhabdoidní a u třech pacientů o anaplastický meningeom. V rámci hodnocení stupně radikality dle Simpsona bylo ve 22 případech dosaženo stupně 1, 25 pacientů bylo ve skupině S2, stupně S3 bylo dosaženo ve 31 případech a u 33 pacientů byl odstraněn tumor parciálně, případně byla provedena biopsie (S4 + S5) (graf 1). Třicetidenní morbidita byla na úrovni 20 % (graf 2). Nejčastěji jsme se setkávali s pooperačním edémem, hematomem v lůžku, likvoreou a zánětem. U třech pacientů se nově rozvinuly epileptické záchvaty, které byly charakteru parciálních simplexních záchvatů. V jednom případě došlo k rozvoji do komplexního záchvatu. Pacientům byla nasazena antikonvulzivní medikace a záchvaty se již neopakovaly. Nový trvalý neurologický deficit se vyskytoval u 10 pacientů, jeden pacient zemřel v rámci prvních 30 dnů po operaci. Šest měsíců od operace jsme zhodnotili výsledek léčby dle GOS (graf 3). Do skupiny GOS 5 (dobrý výsledek) bylo zařazeno 32 pacientů, 28 pacientů mělo lehké postižení (GOS 4), 12 pacientů bylo postiženo těžce (GOS 3), osm pacientů zůstávalo ve vegetativním stavu (GOS 2) a pět pacientů zemřelo (GOS 1). Ve čtyřech případech úmrtí byla nalezena zhoubná varianta meningeomu, progresi primárního onemocnění a následnému úmrtí nezabránila ani radikální resekce (S1 + S2) a časná adjuvantní radioterapie.



Diskuze
I u obtížně řešitelných meningeomů by mělo být cílem chirurgické léčby co nejradikálnější odstranění nádoru bez prohloubení neurologického deficitu a nárůstu morbidity. U konvexitárně lokalizovaných meningeomů je cílem odstranit i přilehlou část dury (Simpson I), mnohdy i postiženou část kalvy až do zdravé kosti. Defekt dury se uzavře plastikou alotransplanátem, nejčastěji z periostu či fascie temporálního svalu, velmi rozšířeny jsou syntetické náhrady tvrdé plény. Vzniklý defekt v kosti je na našem pracovišti nejčastěji nahrazen ploténkou z kostního cementu. Na bazi lební se i po totální resekci origo pouze zkoaguluje (Simpson II) [24].
Na některých místech je totální odstranění nádorů velmi riskantní. Například meningeom procesus clinoideus anterior často výrazně infiltruje adventícii vnitřní karotidy. Velmi lehce může nastat její poranění s katastrofálními následky. Také při odstraňování meningeomu v oblasti kavernózního splavu se často doporučuje část meningeomu ponechat (Simpson III) a reziduum ošetřit radiochirurgicky. Kontrola růstu tumoru v dlouhodobém horizontu může dosáhnout 94,7 %, s nízkou dočasnou i trvalou morbiditou (13,8 resp. 6,4 %) [25– 27]. Paraselární meningeomy lze úspěšně odoperovat i endoskopicky asistovanou, transnazální transsfenoidální cestou. Na našem pracovišti je tato metoda standardně využívána v operativě selárních a paraselárních extraaxiálních expanzí.
Rovněž a. cerebri ant. často výrazně naléhá na meningeomy tuberculum sellae a a. cerebri med. na meningeomy mediální varianty křídla. S využitím mikrochirurgické techniky se často podaří nádor odstranit radikálně, ale někdy je přece jen bezpečnější drobné reziduum ponechat [28,29].
Některé meningeomy křídla kosti klínové způsobují její výrazné ztluštění s postupnou resorpcí kostní tkáně a nevytvářejí typický nádorový uzel (meningeoma en plaque). Klinicky se projevují především protruzí očního bulbu. Cílem chirurgické resekce je nejen dekomprese očnice s resekcí stropu, ale i odstranění co největší části postižené kosti. Operace by měla být následována radiochirurgií, někdy i radioterapií. Navzdory komplexnosti terapie je kontrola růstu v těchto případech neúspěšná [30,31].
Při parasagitálních meningeomech je obvyklé provést kraniotomii přes střední linii, aby se lépe ošetřilo případné porušení splavu [32].
Snad nejnáročnější je chirurgické odstranění meningeomů v oblasti klivu. Nádor roste částečně supratentoriálně a částečně infratentoriálně. Většinou utlačuje mozkový kmen, přilehlé hlavové nervy a někdy přímo naléhá na a. basilaris a další větve zadního povodí Willisova okruhu. Resekce nádoru vyžaduje složité kombinované chirurgické přístupy, často jsou nezbytné dva samostatné operační výkony. Důležitá je řádná předoperační rozvaha, správně zvolená strategie a velké zkušenosti neurochirurga. I přesto je někdy bezpečnější drobné reziduum ponechat a využít radiochirurgii jako doplňkovou pooperační léčbu [32– 34]. Možnou komplikací této metody je vznik kolaterálního mozkového edému a zhoršení, resp. výskyt neurologického deficitu.
Radiochirurgie se jako metoda volby využívá u pacientů, kteří pro celkový nepříznivý zdravotní stav nejsou schopni podstoupit náročný operační výkon. V posledních letech nachází radiochirurgie svoje místo i jako alternativní terapie k léčbě obtížně chirurgicky řešitelných meningeomů, zejm. v oblasti kavernózního splavu [35,36].
V neposlední řadě je mezi léčebnými metodami potřebné zmínit i observaci [37]. Existuje skupina pacientů, u nichž se meningeom objevil náhodně, v rámci diferenciálně diagnostického provedení zobrazovacích vyšetření [38,39]. U asymptomatických pacientů, zvláště ve vyšším věku, s výskytem interních komorbidit je jakákoliv chirurgická léčba spojena se signifikantně vyšším rizikem než přirozený průběh onemocnění [40]. Delikátní uložení meningeomů v blízkosti mozkového kmene či v jiné elokventní zóně nedovoluje ani použití radiochirurgie [41]. U těchto pacientů je observace metodou zcela legitimní, vysoce riziková operace je rezervována pouze u neurologicky symptomatických pacientů v jinak biologicky dobrém stavu. Při výběru vhodné léčebné modality nám mohou pomoci četné skórovací systémy, z nichž CLASS scale se zdá být velmi užitečná v rozvaze, zda pacienta operovat či nikoliv [42]. Ve sledované skupině jsme brali v potaz jednotlivé komponenty uvedené škály, nicméně skórovací systém jako takový jsme rutinně nevyužívali.
Závěr
Přestože i chirurgicky obtížně řešitelné meningeomy mají většinou benigní povahu, jsou tyto nádory kvůli postupnému útlaku, resp. prorůstání důležitých cévních (a nervových struktur) spojeny s vysokým rizikem závažného neurologického postižení. Chirurgická léčba dává možnosti tuto situaci řešit. Avšak míru radikality výkonu je třeba zvážit s riziky, která přináší. Předpokladem úspěšného zvládnutí operace je důkladná příprava operačního týmu i pacienta, využití všech dostupných technologií naplánování přístupů, načasování operačních fází, protože se často jedná o dvou a někdy i vícedobé operační výkony. Velký důraz je třeba klást i na komplexní pooperační neurointenzivní péči, která výrazně přispívá ke snížení časné pooperační morbidity a mortality a tím vede k podstatnému zlepšení další pooperační prognózy a rychlejšímu uzdravení pacienta.
MUDr. Andrej Mrlian, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
email: andrejmrlian@hotmail.com
Přijato k recenzi: 28. 4. 2014
Přijato do tisku: 6. 10. 2014
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Sources
1. Kane AJ, Sughrue ME, Rutkowski MJ, Shangari G, Fang S, McDermott MW et al. Anatomic location is a risk factor for atypical and malignant meningiomas. Cancer 2011; 117(6): 1272– 1278. doi: 10.1002/ cncr.25591.
2. Larjavaara S, Haapasalo H, Sankila R, Helén P, Auvinen A. Is the incidence of meningiomas underestimated? A regional survey. Br J Cancer 2008; 99(1): 182– 184.
3. Wiemels J, Wrensch M, Claus EB. Epidemiology and etiology of meningioma. J Neurooncol 2010; 99(3): 307– 314. doi: 10.1007/ s11060‑ 010‑ 0386‑ 3.
4. Perrot‑ Applanat M, Groyer‑ Picard MT, Kujas M. Immunocytochemical study of progesterone receptor in human meningioma. Acta Neurochir 1992; 115(1– 2): 20– 30.
5. Sughrue ME, Kane AJ, Shangari G, Rutkowski MJ, McDermott MW, Berger MS et al. The relevance of Simpson Grade I and II resection in modern neurosurgical treatment of World Health Organization Grade I meningiomas. J Neurosurg 2010; 113(5): 1029– 1035. doi: 10.3171/ 2010.3.JNS091971.
6. Palma L, Celli P, Franco C, Cervoni L, Cantore G. Long‑term prognosis for atypical and malignant meningiomas: a study of 71 surgical cases. Neurosurg Focus 1997; 2(4): 122– 126.
7. Pannullo SC, Fraser JF, Moliterno J, Cobb W, Stieg PE. Stereotactic radiosurgery: a meta‑analysis of current therapeutic applications in neuro‑oncologic disease. J Neurooncol 2011; 103(1): 1– 17. doi: 10.1007/ s11060‑ 010‑ 0360‑ 0.
8. Pollock BE, Stafford SL, Utter A, Giannini C, Schreiner SA. Stereotactic radiosurgery provides equivalent tumor control to Simpson Grade 1 resection for patients with small‑ to medium‑ size meningiomas. Int J Radiat Oncol Biol Phys 2003; 55(4): 1000– 1005.
9. Náhlovský J et al. Neurochirurgie. 1. vyd. Praha: Galén 2006.
10. Kozler P et al. Intrakraniální nádory. 1. vyd. Praha: Galén 2007.
11. Simpson D. The recurrence of intracranial meningiomas after surgical treatment. J Neurol Neurosurg Psychiatry 1957; 20(1): 22– 39.
12. Stafford S L, Perry A, Suman VJ, Meyer FB, Scheithauer BW, Lohse CM et al. Primarily resected meningiomas: outcome and prognostic factors in 581 Mayo clinic patients, 1978 through 1988. Mayo Clin Proc 1998; 73(10): 936– 942.
13. Schul DB, Wolf S, Krammer MJ, Landscheidt JF, Tomasino A, Lumenta CB. Meningioma surgery in the elderly: outcome and validation of 2 proposed grading scores systems. Neurosurgery 2012; 70(3): 555– 565. doi: 10.1227/ NEU.0b013e318233a99a.
14. Mirimanoff RO, Dosoretz DE, Linggood RM, Ojemann RG, Martuza RL. Meningioma: analysis of recurrence and progression following neurosurgical resection. J Neurosurg 1985; 62(1): 18– 24.
15. Jung HW, Yoo H, Paek SH, Choi KS. Long‑term outcome and growth rate of subtotally resected petroclival meningiomas: experience with 38 cases. Neurosurgery 2000; 46(3): 567– 574.
16. Kleihues P, Burger PD, Scheithauer BW. Histological typing of tumors of the central nervous system. World Health Organisation international histological classification of tumors. 1st ed. Berlin: Springer 1993: 33– 37.
17. Rohringer M, Sutherland GR, Louw DF, Sima AA. Incidence and clinicopathological features of meningioma. J Neurosurg 1989; 71(5): 665– 672.
18. Mahmood A, Caccamo DV, Tomecek FJ, Malik GM. Atypical and malignant meningiomas: a clinicopathological review. Neurosurgery 1993; 33(6): 955– 963.
19. Maier H, Ofner D, Hittmair A, Kitz K, Budka H. Classic, atypical, and anaplastic meningioma: three histopathological subtypes of clinical relevance. J Neurosurg 1997; 77(4): 616– 623.
20. Palma L, Celli P, Franco C, Cervoni L, Cantore G. Long‑term prognosis for atypical and malignant meningiomas: a study of 71 surgical cases. J Neurosurg 1997; 86(5): 793– 800.
21. Milosevic MF, Frost PJ, Laperriere NJ, Wong CS, Simpson WJ. Radiotherapy for atypical or malignant intracranial meningioma. Int J Radiat Oncol Biol Phys 1996; 34(4): 817– 822.
22. Dziuk TW, Woo S, Butler EB, Thornby J, Grossman R, Dennis WS et al. Malignant meningioma: an indication for initial aggressive surgery and adjuvant radiotherapy. J Neurooncol 1998; 37(2): 177– 188.
23. Goyal LK, Suh JH, Mohan DS, Prayson RA, Lee J, Barnett GH. Local control and overall survival in atypical meningioma: a retrospective study. Int J Radiat Oncol Biol Phys 2000; 46(1): 657– 661.
24. Jääskeläinen J, Haltia M, Servo A. Atypical and anaplastic meningiomas: radiology, surgery, radiotherapy and outcome. Surg Neurol 1986; 25(3): 233– 242.
25. McCarthy BJ, Davis FG, Freels S, Surawicz TS, Damek DM, Grutsch J et al. Factors associated with survival in patients with meningioma. J Neurosurg 1998; 88(5): 831– 839.
26. Perry A, Scheithauer BW, Stafford SL, Lohse CM, Wollan PC. “Malignancy” in meningiomas: a clinicopathologic study of 116 patients, with grading implications. Cancer 1999; 85(9): 2046– 2056.
27. Hsu DW, Pardo FS, Efird JT, Linggood RM, Hedley‑ Whyte ET. Prognostic significance of proliferative indices in meningiomas. J Neuropathol Exp Neurol 1994; 53(3): 247– 255.
28. Mesic JB, Hanks GE, Doggett RL. The value of radiation therapy as an adjuvant to surgery in intracranial meningiomas. Am J Clin Oncol 1986; 9(4): 337– 340.
29. Hakim R, Alexander E, Loeffler JS, Shrieve DC, Wen P, Fallon MP et al. Results of linear accelerator‑based radiosurgery for intracranial meningiomas. Neurosurgery 1998; 42(3): 446– 453.
30. Kondziolka D, Niranjan A, Lunsford LD, Flickinger JC. Stereotactic radiosurgery for meningiomas. Neurosurg Clin North Am 1999; 10(4): 317– 325.
31. Nutting C, Brada M, Brazil L, Sibtain A, Saran F, Westbury C et al. Radiotherapy in the treatment of benign meningioma of the skull base. J Neurosurg 1999; 90(5): 823– 827.
32. Debus J, Wuendrich M, Pirzkall A, Hoess A, Schlegel W, Zuna I et al. High efficacy of fractionated stereotactic radiotherapy of large base‑ of‑ skull meningiomas: long‑term results. J Clin Oncol 2001; 19(15): 547– 553.
33. Stafford SL, Pollock BE, Foote RL, Link MJ, Gorman DA, Schomberg PJ et al. Meningioma radiosurgery: tumor control, outcomes and complications among 190 consecutive patients. Neurosurgery 2001; 49(5): 1029– 1037.
34. Santacroce A, Walier M, Régis J, Liščák R, Motti E, Lindquist C et al. Long‑term tumor control of benign intracranial meningiomas after radiosurgery in a series of 4,565 patients. Neurosurgery 2012; 70(1): 32– 39. doi: 10.1227/ NEU.0b013e31822d408a.
35. Kollová A, Liščák R, Šemnícká J, Simonová G, Vladyka V, Urgosík D et al. Dlhodobé výsledky liečby meningeómov Leksellovým gama nožom. Cesk Slov Neurol N 2010; 73/ 106(4): 415– 421.
36. Kollová A, Liscák R, Novotný J jr, Vladyka V, Simonová G, Janouskova L. Gamma knife surgery for benign meningioma. J Neurosurg 2007; 107(2): 325– 336.
37. Firsching RP, Fischer A, Peters R, Thun F, Klug N. Growth rate of incidental meningiomas. J Neurosurg 1990; 73(4): 545– 547.
38. Olivero WC, Lister JR, Elwood PW. The natural history and growth rate of asymptomatic meningiomas: a review of 60 patients. J Neurosurg 1995; 83(2): 222– 224.
39. Niiro M, Yatsushiro K, Nakamura K, Kawahara Y, Kuratsu J. Natural history of elderly patients with asymptomatic meningiomas. J Neurol Neurosurg Psychiatry 2000; 68(1) 25– 28.
40. Nakamura M, Roser F, Michel J, Jacobs C, Samii M. The natural history of incidental meningiomas. Neurosurgery 2003; 53(1): 62– 70.
41. Jääskeläinen J, Haltia M, Laasonen E, Wahlström T, Valtonen S. The growth rate of intracranial meningiomas and its relation to histology. An analysis of 43 patients. Surg Neurol 1985; 24(2): 165– 172.
42. Lee JH. Meningiomas: Diagnosis, Treatment, and Outcome. 1st ed. London (UK): Springer Science & Business Media 2009.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2015 Issue 1
Most read in this issue
- Protokol diagnostiky a léčby hyponatremie a hypernatremie v neurointenzivní péči
- Mini‑Mental State Examination – česká normativní studie
- Autoimunitní encefalitidy
- Asymptomatická spondylogenní komprese krční míchy
