Asymptomatická spondylogenní komprese krční míchy
Asymptomatic Spondylotic Cervical Cord Compression
Cervical spinal stenosis may lead to cervical cord compression and represents the most important mechanical factor in pathophysiology of cervical spondylotic myelopathy. Medullar tissue is, however, rather resistant to compression and development of symptomatic myelopathy occurs only when higher degree stenosis is present and in combination with other pathophysiological factors, mainly dynamic compression and trauma. Asymptomatic spondylotic cervical cord compression (ASCCC) is a quite frequent finding in older population above the age of fifty. However, reliability of the methods used to verify and quantify cervical stenosis and cervical cord compression is low and clear predictors of development of symptomatic myelopathy and related indication of potential preventive surgical decompression in ASCCC have not been determined yet. The overview discusses the most frequently used methods to establish cervical spinal stenosis and cervical cord compression using imaging methods. Radiogram and especially computed tomography are important for verification of cervical spinal stenosis, while magnetic resonance imaging (MRI) is a preferable method to detect cervical cord compression. The cross‑ sectional spinal cord area and T2 MRI spinal cord hyperintensity are among the parameters considered to be the most closely correlated with clinical manifestation of spinal cord compression. Among newly introduced imaging modalities, MRI diffusion tensor imaging seems to be the most promising one. The presence of symptomatic radiculopathy and abnormality of motor and somatosensory evoked potentials are among generally accepted predictors of symptomatic myelopathy. The importance of imaging methods as predictors of symptomatic myelopathy development as well as benefits of preventive surgical decompression in ASCCC individuals with high risk of developing symptomatic myelopathy is to be established in future studies.
Key words:
cervical spinal stenosis – cervical spondylotic myelopathy – asymptomatic spondylotic cervical cord compression – magnetic resonance imaging – diffusion tensor imaging –computed tomography
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
I. Kovalová 1; J. Bednařík 1,2; M. Keřkovský 2,3; B. Adamová 1,2; Z. Kadaňka 1
Authors‘ workplace:
Neurologická klinika LF MU a FN Brno
1; CEITEC – Středoevropský technologický institut MU, Brno
2; Radiologická klinika LF MU a FN Brno
3
Published in:
Cesk Slov Neurol N 2015; 78/111(1): 24-33
Category:
Review Article
doi:
https://doi.org/10.14735/amcsnn201524
Overview
Stenóza cervikálního kanálu může vést ke kompresi krční míchy a představuje nejvýznamnější mechanický faktor v patofyziologii cervikální spondylogenní myelopatie. Míšní tkáň je však vůči kompresi poměrně odolná a k rozvoji manifestní myelopatie dochází až při vyšším stupni komprese a v kombinaci s dalšími patofyziologickými faktory, zejm. dynamickým faktorem a zevním traumatem. Asymptomatická spondylogenní komprese krční míchy (ASCCC) je velmi častým nálezem zvláště v populaci vyššího věku nad 50 let. Objektivizace a kvantifikace cervikální stenózy a komprese krční míchy jsou však nejednotné a nejsou jasně stanoveny prediktory progrese do manifestní myelopatie a s tím související indikace případné preventivní chirurgické dekomprese. Přehled obsahuje nejčastěji používané metody stanovení cervikální stenózy a cervikální míšní komprese pomocí zobrazovacích metod. Nativní radiogram a výpočetní tomografie mají význam v objektivizaci cervikální stenózy, zatímco dominantní metodou objektivizace míšní komprese je magnetická rezonance (MR). Z parametrů, které nejvíce korelují s klinickou manifestací komprese, jsou uváděny příčná plocha míchy v místě komprese a přítomnost intenzitních změn míšního signálu. Z novějších zobrazovacích modalit je nejcitlivější MR zobrazení tenzorů difúze. Z prognostických faktorů rozvoje manifestní myelopatie u ASCCC jsou obecně akceptovány přítomnost manifestní radikulopatie a abnormita motorických a senzomotorických evokovaných potenciálů. Význam zobrazovacích metod v predikci rozvoje manifestní myelopatie a benefit provedení preventivní dekomprese ve skupině nemocných s asymptomatickou kompresí a vyšším rizikem rozvoje manifestní myelopatie bude nutné ověřit dalšími studiemi.
Klíčová slova:
cervikální stenóza – cervikální spondylogenní myelopatie – asymptomatická komprese krční míchy – magnetická rezonance –zobrazení tenzorů difúze – výpočetní tomografie
Úvod
Cílem přehledu je poukázat na existenci asymptomatické netraumatické spondylogenní komprese krční míchy a možnosti zobrazovacích metod při její detekci a predikci dalšího vývoje a prognózy.
Prevalence degenerativního onemocnění páteře narůstá s věkem, postihuje predilekčně krční a bederní páteř a ve vyšším věku je výskyt degenerativních změn prakticky ubikvitární [1]. Degenerativní změny postihují meziobratlové disky, intervertebrální klouby, kostní a vazivové struktury páteře a mohou vést ke zúžení spinálního kanálu a kořenových kanálů a tím i k potenciální kompresi nervových struktur.
Nativní RTG zobrazí pouze změny obratlů, nepřímé známky degenerace meziobratlového disku (obr. 1) a umožní kvantifikovat některé rozměry spinálního kanálu, zejm. anteroposteriorní průměr.
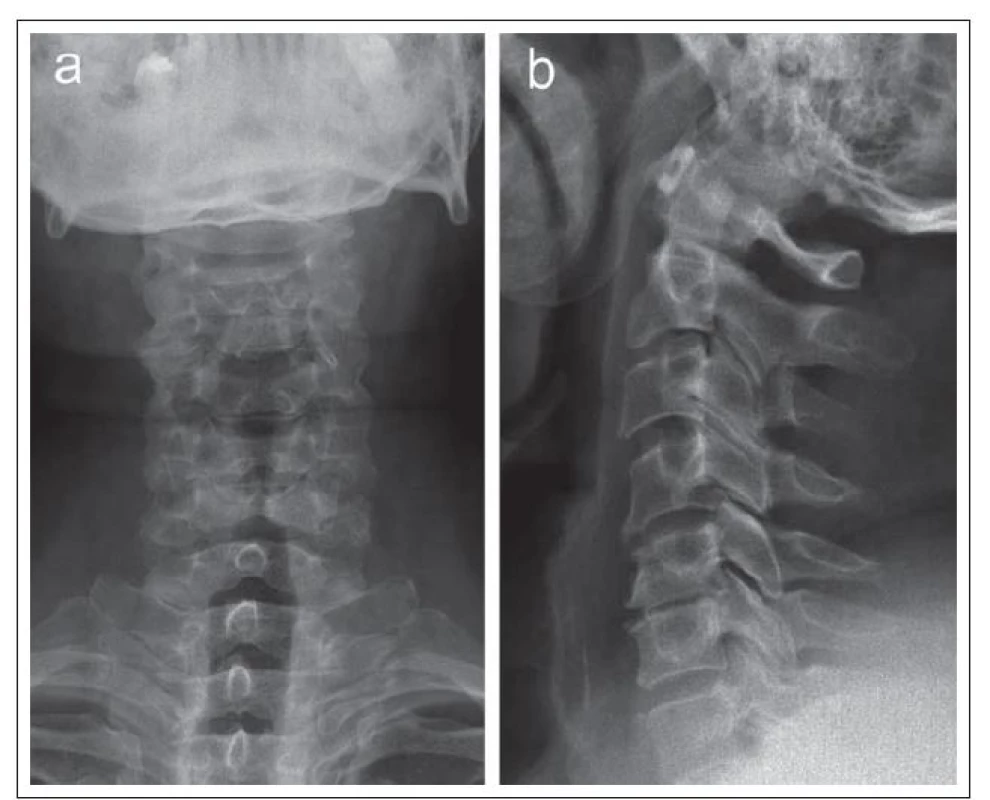
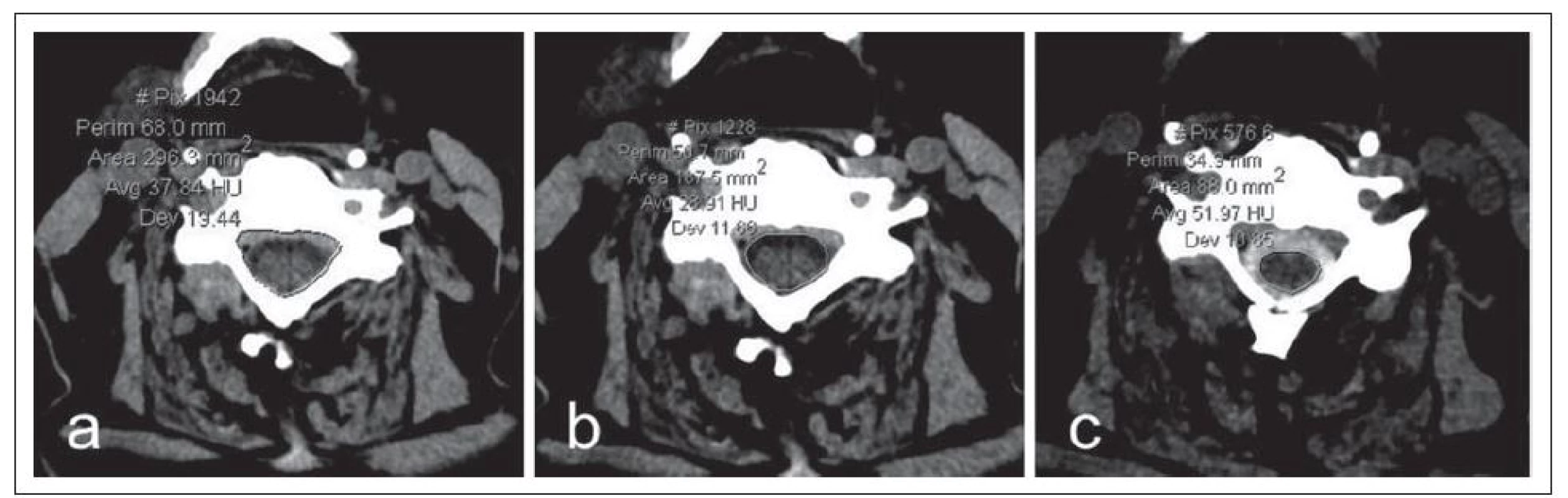
Výpočetní tomografie (CT) dokáže zobrazit detailně tvar a rozměry kostěného spinálního i kořenového kanálu, durální vak a orientačně i míchu, avšak pomocí CT nelze spolehlivě objektivizovat míšní či kořenovou kompresi i změny struktury míchy (obr. 2).
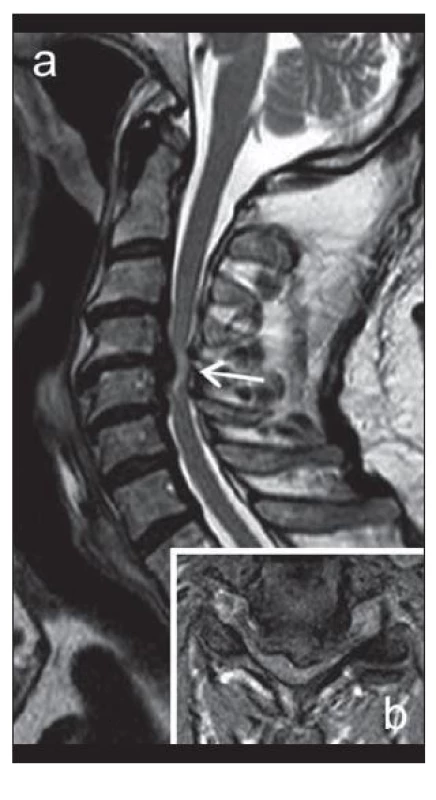
Magnetická rezonance (MR) dokáže zobrazit i vazivové struktury (ligamenta longitudinalia, ligamenta flava, meningy), míchu a kořeny, umožní objektivizovat míšní kompresi i změnu struktury míšní tkáně. Současná diagnostika klinicky manifestní cervikální spondylogenní myelopatie (CSM) jako nejzávažnějšího následku krční spondylózy je založena na klinické detekci subjektivních a především objektivních příznaků míšní léze v krčním úseku a MR známkách míšní komprese (obr. 3).
CSM byla popsána Stookeym již v roce 1928 [2], ale její patofyziologie není detailně známa. Zahrnuje statické faktory (cervikální spinální stenózu) a faktory dynamické vedoucí k opakovanému míšnímu poranění. Tyto mechanické faktory sekundárně indukují ischemii, zánět a apoptózu. Histologicky se nacházejí cystické kavitace a glióza v centrální šedi míšní a demyelinizace v mediálních částech dlouhých míšních drah. Wallerova degenerace postihuje zadní provazce a posterolaterální ascendentní dráhy kraniální od místa komprese, a přední provazce a kortikospinální trakty v místě komprese a kaudálně [3].
Z experimentálních prací je známo, že míšní tkáň je poměrně odolná vůči kompresi a neurologický deficit se může manifestovat s významným zpožděním po vzniku komprese [4– 6]. Vzniká tak klinicko‑radiologická disociace („mismatch“), kdy radiologické známky komprese nejsou do určitého stupně provázeny klinickými projevy myelopatie – tzv. presymptomatická spondylogenní komprese krční míchy (PSCCC) [7,8]. Protože termín „presymptomatická komprese“ implikuje, že musí dojít ke klinické manifestaci komprese, což naše nálezy nepotvrzují, je v těchto případech přesnějším termínem asymptomatická komprese (Asymptomatic Spondylotic Cervical Cord Compression or Encroachment; ASCCC, ASCCE) [1,8–10].
Následující přehled shrnuje současné možnosti diagnostiky cervikální stenózy a cervikální míšní komprese, poznatky o korelaci mezi zobrazovacími a klinickými nálezy a prediktory rozvoje cervikální míšní komprese a symptomatické cervikální myelopatie.
Diagnostika cervikální stenózy
Zúžení spinálního kanálu v krčním úseku páteře je označováno jako cervikální spinální stenóza (CS). Může vést nejprve k obliteraci subarachnoidálního prostoru a teprve později ke kompresi nervových struktur – kořenů a krční míchy. Toto zúžení může být buď vrozené (primární stenóza) nebo získané (sekundární stenóza).
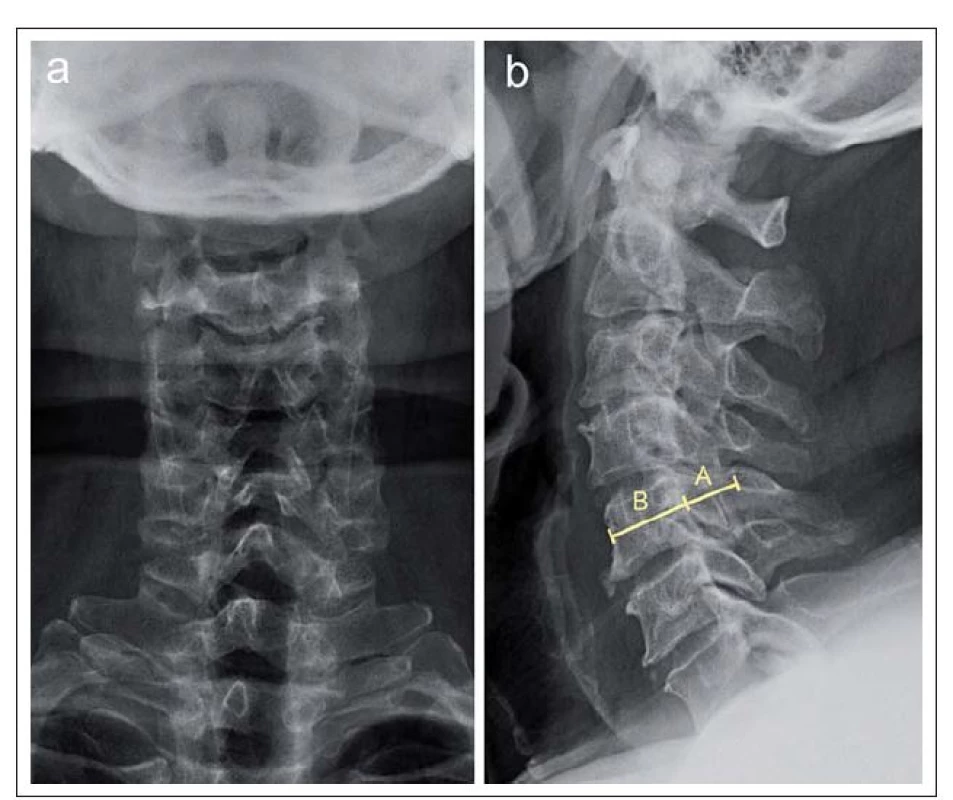
Normální uváděné hodnoty nejdelšího anteroposteriorního průměru kostěného spinálního kanálu, hodnoceného vzhledem k projekčnímu zkreslení při nativním RTG optimálně ze sagitálního či axiálního CT skenu v místě středu obratlového těla (Canal Diameter Midvertebral; CDmitvertebral) [11], vyjádřené v absolutních hodnotách, jsou kolem 17– 18 mm (ve výši obratlů C3– C6) [12]. Za stenózu jsou považovány hodnoty < 10 mm, hodnoty 10– 13 mm jsou považovány za hraniční [13]. Podle jiných autorů signalizují stenózu již hodnoty < 12 mm [14]. Dalším parametrem je průměr kanálu v úrovni disku (CDdisc) [11]. Daleko častěji je ke kvantifikaci anteroposteriorního průměru spinálního kanálu používán Index Pavlovové (nebo také Index Torga‑ Pavlovové; TPR [15]), protože jde o relativní poměr, který eliminuje zkreslení dané zvětšením či zmenšením radiologického obrazu nebo mohutnosti kostěných struktur páteře. Jde o poměr anteroposteriorního průměru kanálu a obratlového těla měřený původně ve výši středu obratlového těla C5 z nativního bočního RTG snímku, nověji však i ze sagitálního CT či MR skenu (obr. 4) [11,16]. Za normální byly označeny hodnoty > 1,0 a jako stenóza hodnoty TPR < 0,82 [15]. Absolutní či relativní zúžení nejdelšího anteroposteriorního průměru v centrální oblasti kanálu (tzv. centrální typ stenózy) je indikátorem stenózy dominantně vrozeného (vývojového), nikoliv získaného, zejm. degenerativního původu. TPR byl v řadě prací použit jako možný prediktor rozvoje míšní komprese i její tíže a prognózy, včetně efektu operační dekomprese, a to s nejednoznačnými výsledky – viz dále. Lindberg et al [17] zjistili u pacientů s CSM korelaci mezi TPR a parametry zobrazení tenzorů difúze (DTI) v MR obraze.
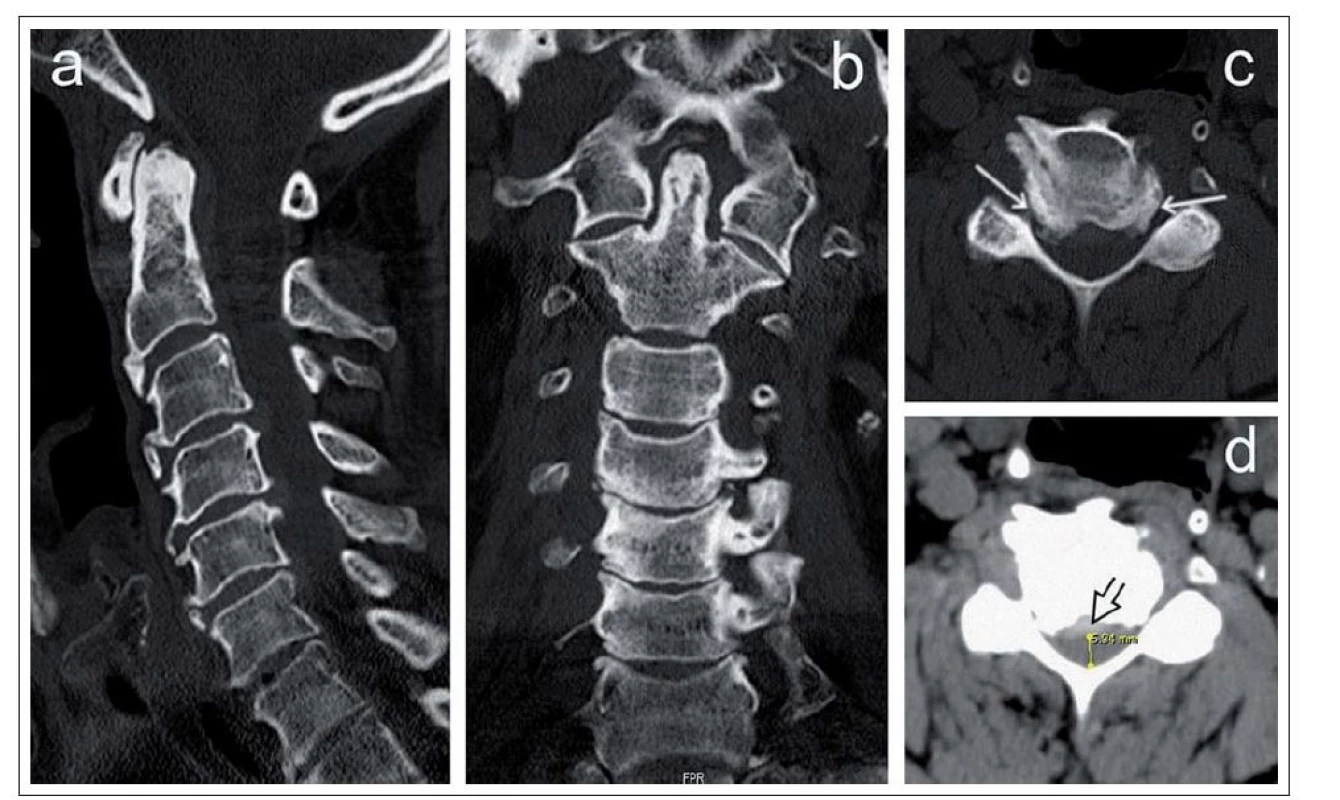
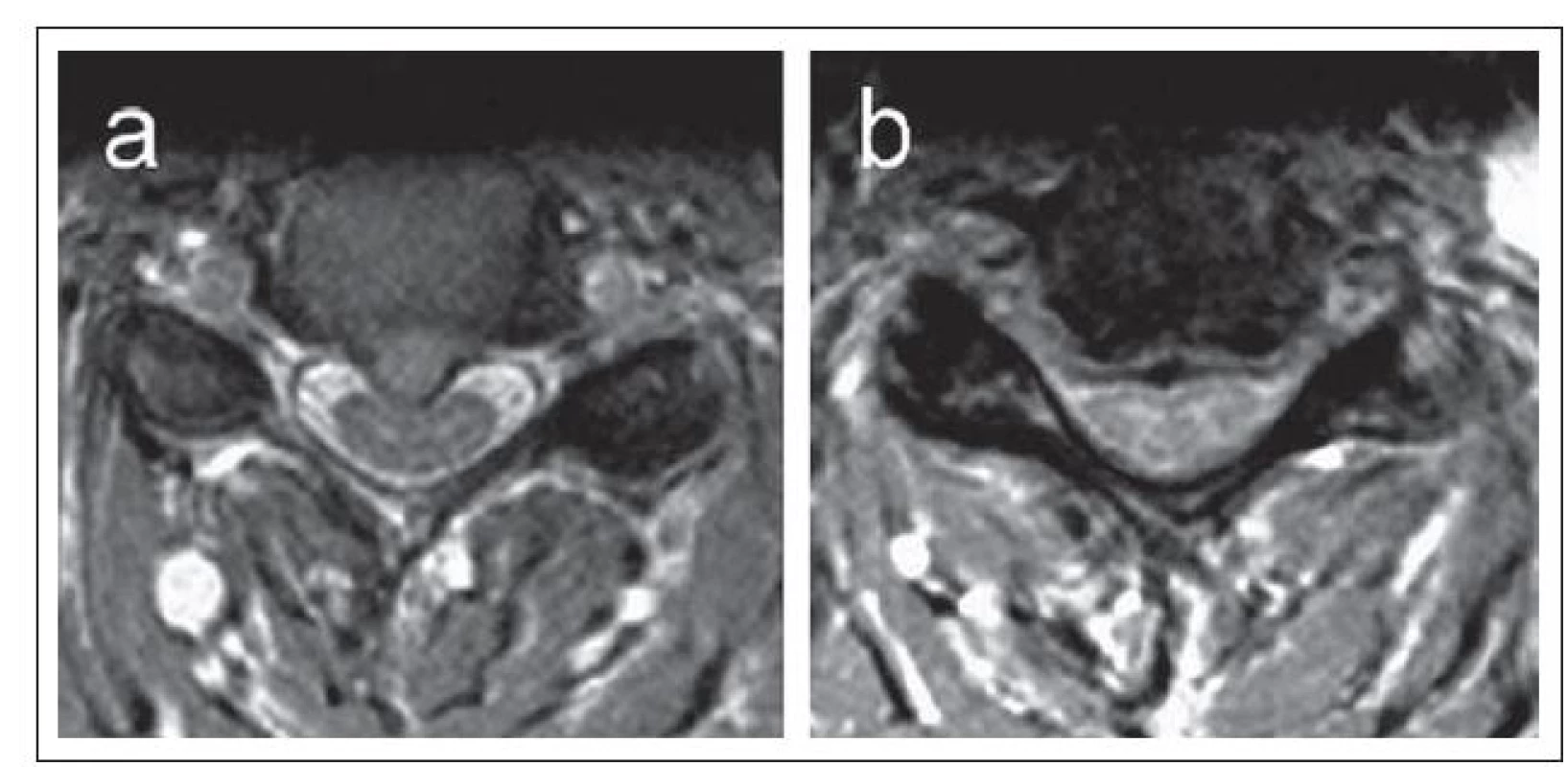
Degenerativní cervikální stenóza je nejčastější příčinou získané CS. Na rozdíl od vývojové stenózy, která je typicky centrálního typu, vede degenerativní cervikální stenóza k hypertrofii unkovertebrálních kloubů a zúžení laterálních recesů (laterální stenóza) a proximální části kořenového kanálu. Degenerace však vede i k protruzi disků a jejich komplexů s osteofyty, dorzálně dochází k osifikaci zadního longitudinálního ligamenta a ligamenta flava a tím i k zúžení v centrální části spinálního kanálu. Cervikální spinální kanál ztrácí při výrazné laterální stenóze na průřezu typický oválný tvar včetně konvexity ventrálního okraje a v pokročilejším stadiu nabývá tvaru třírohého klobouku nebo trojlístku („trefoil“). (obr. 5a,b).
Ke kvantifikaci rozměrů cervikálního kanálu se používá kromě anteroposteriorního průměru kanálu i transverzální průměr a zejm. transverzální plocha kostěného kanálu (Osseous Spinal Canal Area; OSCA) a transverzální plocha durálního vaku (Dural Sac Area; DSA) (obr. 6a– c) [14].
Zvláštním subtypem degenerativní stenózy je osifikace zadního podélného ligamenta (OPLL), která se vyskytuje převážně u Asiatů. Porovnáním CT/ myelografie a MR Naganawa et al [18] zjistili, že rozměry durálního vaku jsou při měření CT myelografií lehce větší v porovnání s fast spin echo T2 MR obrazem, zatímco rozměry míchy zjištěné pomocí MR jsou naopak větší. Lze předpokládat, že při použití MR T2* gradientního echa by tento rozdíl mezi MR a CT myelografií byl ještě větší. Další studie prokázala vyšší validitu CT/ myelografie v detekci foraminální stenózy a rozlišení kostěných a měkkotkáňových struktur, zatímco MR lépe detekuje přímou kompresi kořene [19] a zvláště míchy.
Dalšími parametry navrženými ke kvantifikaci cervikální stenózy jsou rozměry měřené ze sagitálního MR skenu:
- prostor dostupný pro míchu – Space Available for Cord (SAC) vypočítaný jako AP průměr cervikálního kanálu (CDdisc) minus AP průměr míchy ve výši disku;
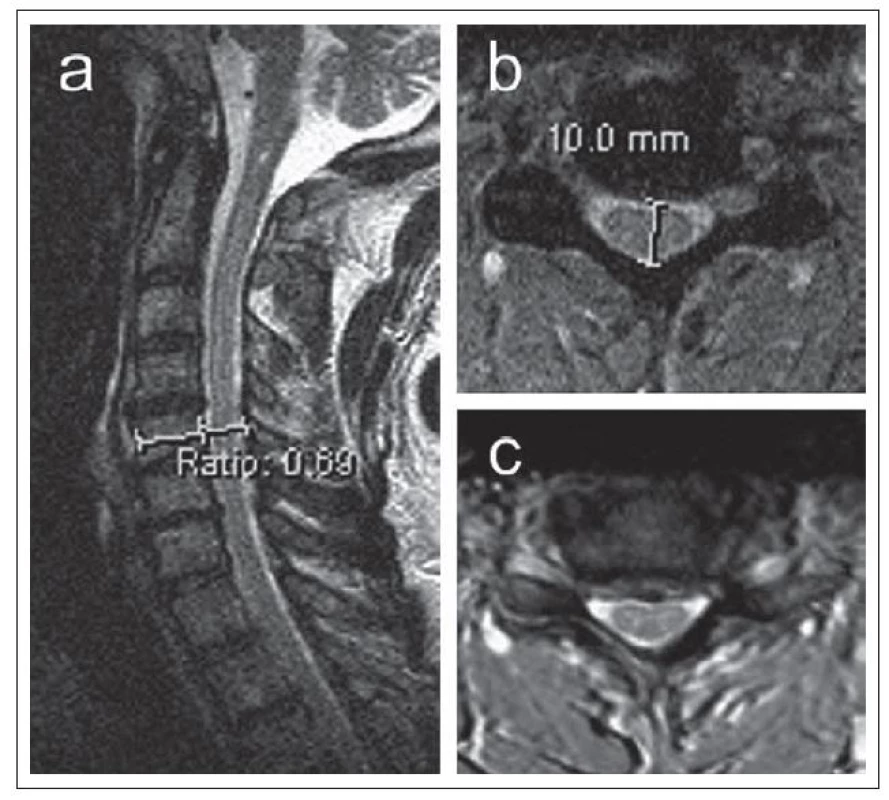
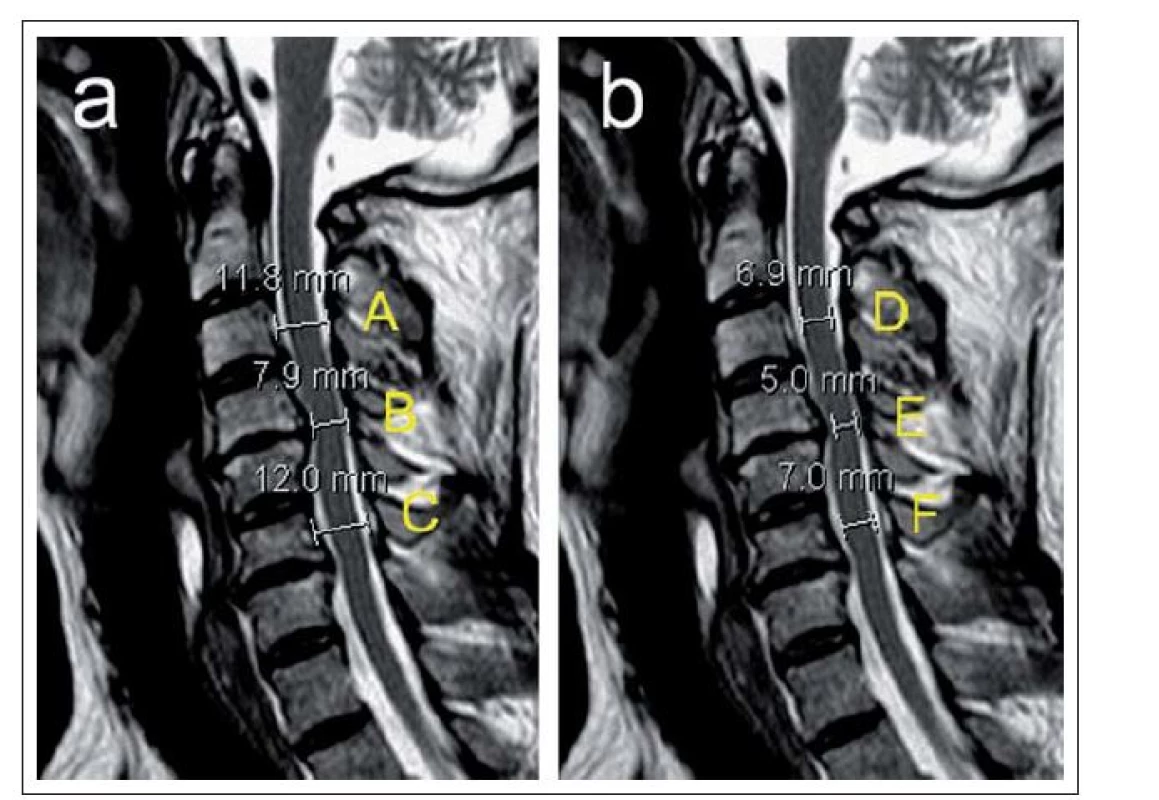
- podíl AP průměru kanálu k AP průměru míchy – Canal to Cord Ratio (CCR) = (CDdisc) / AP průměr míchy ve výši disku (obr. 7a,b) [11].
Definice a diagnostika míšní komprese
Spolehlivá detekce míšní komprese je možná pouze pomocí MR. Hodnocení komprese provádí většina autorů v T2 vážených obrazech, které poskytují výborný kontrast mezi míchou, mozkomíšním mokem a strukturami ohraničujícími páteřní kanál, a to z transverzálních (axiálních) řezů nebo ze sagitálního řezu ve střední čáře. Sagitální řez umožní rychlé orientační zhodnocení ve všech etážích, axiální řezy mají výhodu detailnějšího posouzení tíže a směru komprese.
Byla navržena řada způsobů a algoritmů, jakým způsobem definovat a kvantifikovat míšní kompresi.
Anteroposteriorní průměr míchy (obr. 7b) hodnocený jak ze sagitálního, tak transverzálního T2 MR skenu je u dospělých jedinců poměrně konstantní a ve výši obratlů C3– C7 se pohybuje kolem 8 mm [12].
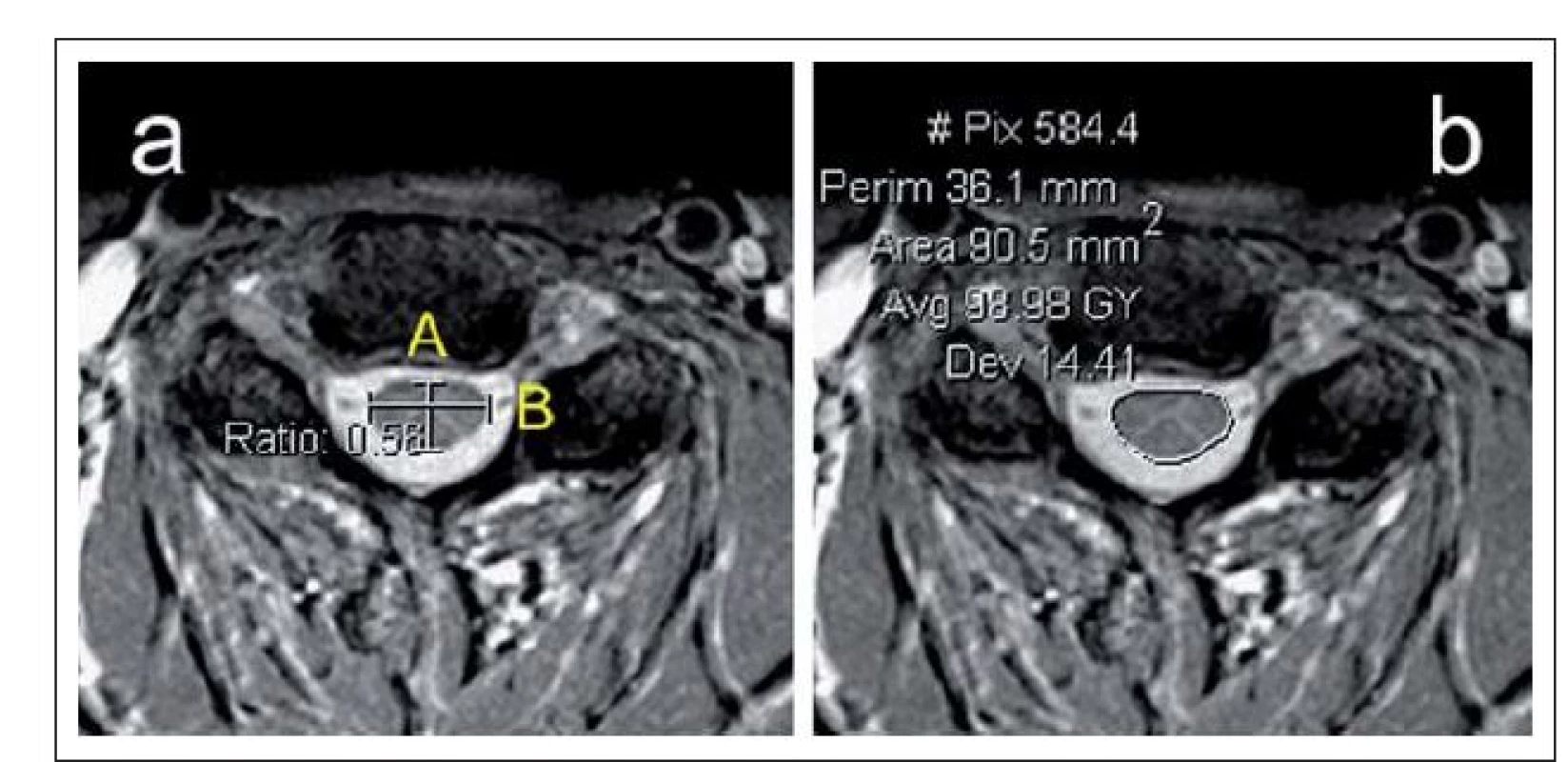
Plocha míchy na příčném řezu (Cross‑ Sectional Area; CSA; nebo Spinal Cord Area) asi nejlépe odráží případnou atrofii míchy. Z téhož řezu lze hodnotit kompresivní poměr (Compression Ratio; CR) jako poměr předozadního a laterolaterálního průměru míchy (obr. 8a,b).
Fehlings et al [20] navrhli hodnocení cervikální stenózy a komprese krční míchy ze sagitálních CT a MR skenů pomocí indexů „Maximum Canal Compromise“ (MCC) a „Maximum Spinal Cord Compression“ (MSCC), které se hodnotily podle následujícího vzorce:
kde di je anteroposteriorní průměr míchy v místě maximální komprese, da a db průměr míchy ve výši nejbližšího kraniálního a kaudálního segmentu bez komprese (měřeno ze sagitální T2 MR skenů). V případě výpočtu MCC se do vzorce dosadí anteroposteriorní průměry kostěného spinálního kanálu měřené ze sagitální CT nebo T1 MR skenů (obr. 7a,b). Karpová et al [21] zjistili vysokou intra‑ a interobserver reliabilitu CR, CSA, MCC a MSCC.
Teresi et al [9] rozlišili „impingement“ jako konkávní defekt v míšním signálu související s protruzí disku a/ nebo osteofytem bez obliterace subarachnoidálního prostoru a míšní kompresi jako konkávní defekt s obliterací subarachnoidálního prostoru. Současně kvantifikovali tíži komprese vyjádřenou pomocí CSA jako relativní podíl hodnoty CSA v úrovni maximální komprese na hodnotě zjištěné z nejbližší normální etáže nad kompresí.
Shimomura et al [22] rozlišovali typ „P“ („Partial“) s kompresí míchy ventrálně protrudovaným diskem a/ nebo osteofytem a zachovaným zadním subarachnoidálním prostorem; a typem „C“ („Circumferential“) s cirkulární kompresí diskem, osteofyty a ligamentum flavum a zašlým subarachnoidálním prostorem. Kameyama et al [23] označili typ „P“ jako „boomerang“ a typ C jako triangulární (obr. 9a,b).
Byly však navrženy i komplexnější způsoby kvantifikace stupně cervikální stenózy a komprese durálního vaku a míchy [16]:
Index komprese krční míchy (Cervical Cord compression Index; CCI):
Skóruje se tíže přední a zadní komprese:
Přední komprese (body):
- 0 bez komprese
- 1 protruze disku, ale zachovaný subarachnoidální prostor (intaktní signál mozkomíšního moku; CSF)
- 2 zašlý subarachnoidální prostor bez signálu CSF, ale bez míšní komprese
- 3 míšní komprese
Zadní komprese (body):
- 0 bez komprese
- 1 mírná komprese žlutým vazem, ale zachovaný subarachnoidální prostor
- 2 zašlý subarachnoidální prostor bez signálu CSF, ale není míšní komprese
- 3 míšní komprese
CCI = součet bodů přední a zadní komprese
- Stupeň 0: 0 bodů
- Stupeň 1: 1– 2 body
- Stupeň 2*: 3– 4 body
- Stupeň 3: 5– 6 bodů
Signifikantní kompresi představuje stupeň 3, tj. musí být přítomna komprese míšní alespoň zepředu nebo zezadu, případně obojí.
Dynamická komprese krční míchy
Dynamická MR u pacientů s CSM zjistila, že CSA byla největší v neutrální poloze, zmenšila se ve flexi a ještě více v extenzi. Impingement krční míchy byl poněkud v rozporu s CSA zaznamenán jen u 12 % nemocných ve flexi, avšak u 34 % v neutrální pozici a u 74 % v extenzi [24]. Muhle et al [25] zjistili progresi cervikální stenózy při změně z neutrální pozice do extenze o 48 % a progresi míšní komprese o 20 %, zatímco stejný pohyb do flexe vedl k progresi CS o 24 % a míšní komprese o 11 %. Kromě mechanické komprese a distenze míchy může přispívat k lézi míchy i ischemie, především při ventrální kompresi.
Korelace mezi zobrazovacími nálezy a klinickou manifestací míšní komprese
U cervikální stenózy byla popsána určitá, i když nevýrazná a nekonstantně prokazovaná korelace s klinicky manifestní míšní kompresí. Edwards a LaRocca [13] zjistili nepřímou úměru mezi anteroposteriorním průměrem cervikálního kanálu a rozvojem myelopatie. Aebli et al [26] zjistili, že pacienti s vývojovou (vrozenou) cervikální stenózou, vyjádřenou TPR < 0,7, mají vyšší riziko míšního poranění po lehkém traumatu krční páteře. Iizuka et al [27] u pacientů s LSS a současnou CSM (8,86 %) nalezli nižší TRP ve srovnání s jedinci bez CSM (cut‑off hodnota 0,78). Existuje však nepříliš těsná korelace mezi hodnotou TPR a prostorem pro míchu v cervikálním kanále [28].
Významnější korelace s klinickou manifestací míšní komprese byla ilustrována u CSA míchy a intenzitních změn míšní tkáně v MR obraze. Okada et al zjistili korelaci mezi absolutní hodnotou CSA i mezi podílem mezi transverzální plochou cervikálního kanálu a míchy a klinickou manifestací [29]. Kadaňka et al srovnávali dvě skupiny nemocných s míšní kompresí – s manifestní myelopatií a bez klinických známek myelopatie. Kritickou hodnotou CSA v místě komprese bylo 50– 60 mm2, avšak pouze při současné přítomnost MR T2 hyperintenzity, zatímco u nemocných bez intenzitních změn nebylo možno nalézt spolehlivou korelaci mezi CSA a klinickou manifestací komprese [30].
Intenzitní změny míšního signálu v MR obraze jako předpokládané známky myelopatie mohou mít různý patologicko‑anatomický korelát, zejm. v závislosti na stadiu komprese (obr. 3). Izolovaná T2 hyperintenzita může být podmíněna edémem v akutním stadiu myelomalcie [31], zvláště pokud je hyperintenzita nevýrazná a přechodná, nebo odpovídá glióze či cystické nekróze, především pokud je dobře ohraničená a permanentní. Kombinace T2 hyperintenzity s T1 hypointenzitou odráží přechod myelomalacie do ireverzibilního stadia cystické nekrózy a tvorbu dutin [12,32].
Enhancement gadolinia byl přítomen u pacientů s CSM vždy v oblasti T2 hyperintenzity, vymizel u většiny nemocných do jednoho roku po chirurgické dekompresi a predikoval horší pooperační průběh [33]. PET studie prokázala u části pacientů s CSM zvýšené vychytávání 18fluorodeoxyglukózy v místě komprese, které korelovalo s kratším trváním symptomů, rychlejším poklesem funkce před operací a predikovalo zlepšení po operaci ve srovnání s pacienty bez zvýšeného vychytávání [34].
Existuje řada studií, které potvrzují, že zobrazení tenzorů difúze (Diffusion Tensor Imaging; DTI), konkrétně parametry frakční anizotropie (FA), jež vyjadřuje míru směrové závislosti difúze, a „Apparent Diffusion Coefficient“ (ADC) nebo také „Mean Diffusivity“ (MD) vyjadřující celkovou difuzivitu vody v tkáni bez ohledu na směrovou predilekci, by mohly odlišit pacienty se symptomatickou a asymptomatickou kompresí krční míchy lépe než MR intenzitní změny [12,35]. Kara et al [36] prokázali u skupiny 16 nemocných s CSM, avšak bez intenzitních MR změn v míše snížení FA a zvýšení ADC v místě komprese oproti kontrolám. Snížení FA v úrovni komprese u pacientů s CSM ve srovnání s kontrolami prokázali i Budzik et al [37]. Hodnoty FA korelovaly s funkčním stavem pacienta, nikoli však s přítomností T2 hyperintenzity. U pacientů s T1 hypointenzitou byly přítomny velmi nízké hodnoty FA. Podobné snížení hodnot FA, ale také zvýšení hodnot ADC bylo nalezeno u pacientů s CSM v místě maximální komprese [38] a parametry DTI ukázaly vyšší diskriminační schopnost v odlišení od skupiny nemocných s ASCCC než standardní radiologické parametry – CSA a přítomnost intenzitních změn v míše (obr. 10).
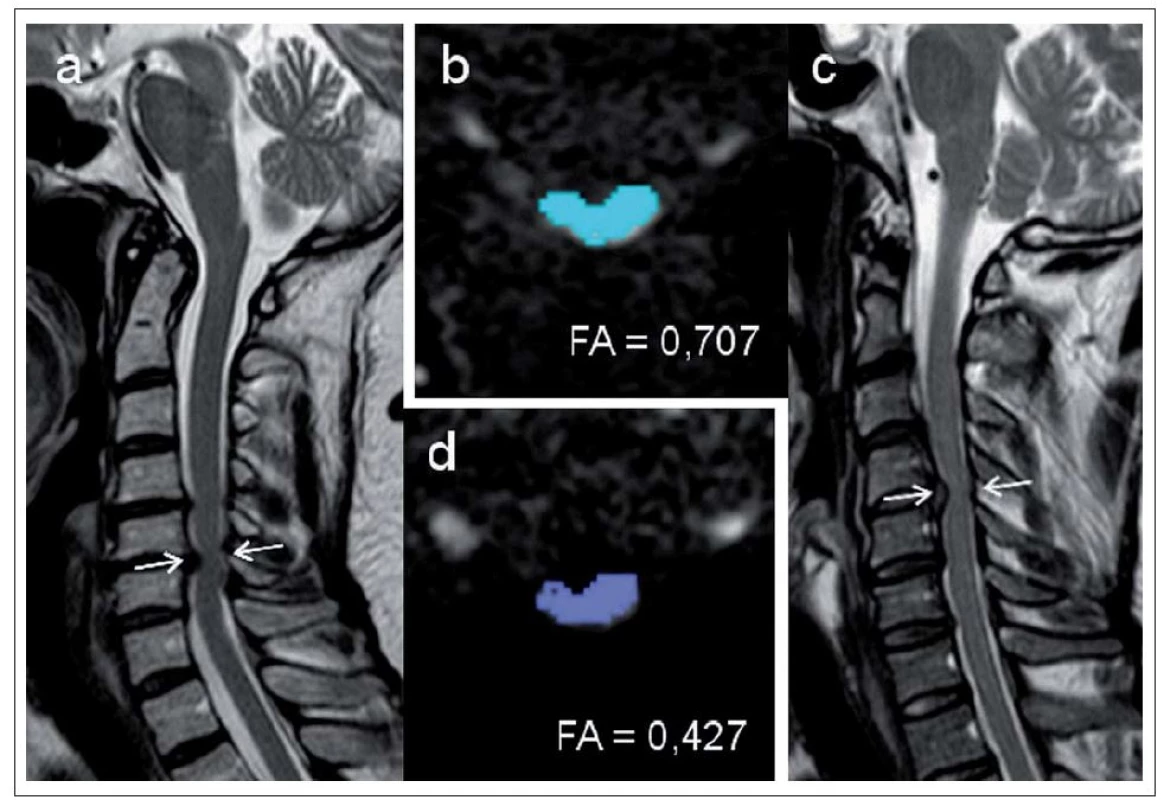
DTI tak představuje slibný parametr pro identifikaci pacientů s kompresí míchy v riziku klinické manifestace a je citlivějším parametrem míšního postižení lépe korelujícím s klinickou symptomatikou. Může přispět k výběru vhodných pacientů pro chirurgickou dekompresi.
Epidemiologie ASCCC a CSM
Přibližně 14 % populace udává chronické bolesti v krční páteři trvající déle než šest měsíců, avšak prevalence asymptomatické či symptomatické míšní komprese (SCM) není přesně známa, resp. údaje v literatuře se značně liší [39].
Symptomatická CSM je nejčastější příčinou míšní dysfunkce u jedinců starších 55 let [3].
Lee et al [40] udávají přítomnost cervikální stenózy u 4,9 % zdravé populace a u 9 % populace ve věku > 70 let. Hayashi et al [41] nalezli asymptomatické zúžení cervikálního kanálu s anteroposteriorním průměrem < 13 mm u 10 % populace nad 60 let věku.
Teresi et al [9] nacházejí ve skupině jedinců vyšetřených pomocí MR pro jinou diagnózu známky protruze disku u 57 % jedinců a impingement míchy bez obliterace subarachnoidálního prostoru u 27 % jedinců nad 64 let. Míšní komprese s obliterací subarachnoidálního prostoru byla nalezena u 7 % souboru ve věku 45– 82 let, nelze však zjistit, jaká byla prevalence tohoto typu komprese ve vyšší věkové skupině. Procentuální redukce CSA ve výši komprese byla v průměru 7 % a nikdy nepřesáhla 16 %.
Matsumoto et al [1] zjistili ve skupině 497 asymptomatických jedinců degeneraci krčních meziobratlových disků v rozsahu C2/ 3– C6/ 7 u 17 % disků u mužů a 12 % disků u žen ve věku do 30 let a u 86 % disků u mužů a 89 % disků u žen nad 60 let věku. Kompresi míchy protruzí disku nalezli u 7,6 % jedinců studovaného souboru, většinou ve věku nad 40 let, bez bližší definice metodiky hodnocení či věkového složení jedinců s míšní kompresí.
Naše předběžné výsledky [42] ukazují, že ve věku nad 40 let je prevalence cervikální míšní komprese vyšší, než bylo původně referováno a přesahují 50 %, i když jde o asymptomatické komprese lehkého stupně, charakteru impingementu nebo ploché komprese bez obliterace subarachnoidálního prostoru a bez klinické manifestace.
Predikce rozvoje CSM u ASCCC
Existuje řada prací popisující prognostické faktory ovlivňující výběr pacientů s CSM k chirurgické dekompresi i prognózu po operaci. Souhrnně míšní T2 hyperintenzita zhoršuje prognózu, a to více dobře definovaná a ohraničená hyperintenzita, víceúrovňová hyperintenzita a zvětšení rozsahu hyperintenzity po operaci, zatímco vymizení hyperintenzity po dekompresi je příznivým prognostickým faktorem [12]. Míšní T1 hypointenzita nebo její objevení po dekompresi výrazně zhoršuje prognózu pacientů s CSM. Enhancement gadolinia zhoršuje prognózu, kdežto zvýšené vychytávání fluorodeoxyglukózy je příznivým faktorem. Přetrvávající známky komprese po dekompresi a chybění zvětšení CSA jsou negativními prognostickými faktory [11].
Predikce rozvoje CSM u ASCCC však není dosud známa [43] a byla studována opakovaně naší skupinou [7,8,44] a její výsledky bude třeba potvrdit. Nicméně v r. 2013 publikovala v časopise Spine expertní skupina severoamerických spondylochirurgů za podpory AO Spine North America přehled problematiky asymptomatické netraumatické spondylogenní komprese krční míchy na terénu cervikální spinální stenózy a/ nebo osifikace zadního longitudinálního ligamenta (OPLL) se zaměřením na otázku indikace operačního řešení, a výsledky naší skupiny jsou hodnoceny jako významné [45]. Autoři přehledu si položili tři základní otázky, které současně řešíme v našem článku:
- Jaká je u ASCCC prevalence a časový rámec rozvoje klinické manifestace (tj. manifestní myelopatie)?
- Jaké jsou u ASCCC klinické, zobrazovací a elektrofyziologické prediktory klinické manifestace?
- Jaké klinické a zobrazovací parametry ovlivňují rozhodnutí o léčbě ASCCC? (Odpověď na tuto otázku hledali pomocí dotazníku rozeslaného 19 750 členům AO Spine International, která reprezentuje mezinárodní komunitu profesionálů zabývajících se onemocněním páteře včetně spondylochirurgů).
Z původně identifikovaných 388 prací blíže analyzovali pět prací, které splňovaly vstupní kritéria, a výsledky byly z hlediska síly průkazu hodnoceny čtyřmi stupni (I– IV – I. stupeň představoval nejvyšší sílu průkazu) na základě doporučení AHRQ a pracovní skupiny Grade [46,47]. Tři japonské práce se věnovaly problematice OPLL a jediné dvě hodnocené práce zabývající se problematikou ASCCC u cervikální stenózy byly naše vlastní práce, jež byly z hlediska síly průkazu hodnoceny stupněm II [8], resp. III [10]. Jako odpověď na první dvě otázky autoři přejímají výsledky naší práce [8], která zjistila rozvoj symptomatické CSM do jednoho roku u 8 % nemocných s ASCCC a průměrná doba, do níž dojde u 25 % jedinců s ASCCC k rozvoji CMS, je 48,4 měsíců. Významnými prediktory časného rozvoje symptomatické CSM (do jednoho roku) byla klinicky manifestní radikulopatie, abnormální somatosenzitivní a motorické evokované potenciály a chybění míšní MR hyperintenzity.
Zajímavé výsledky přinesla i přes nízkou návratnost (3,9 %, avšak 774 respondentů) dotazníková akce. V případě chybění manifestní radikulopatie se mírně nadpoloviční většina (53,9 %) respondentů domnívala, že ASCCC zůstane stabilní, zatímco v případě klinicky manifestní radikulopatie předpokládala stabilní vývoj bez rozvoje manifestní myelopatie významně nižší část respondentů (27,3 %). Na základě hodnocení modelových případů by operační řešení indikovalo u jedince s ASCCC, míšní hyperintenzitou v MR obraze a bez manifestní radikulopatie 67,8 % respondentů, u obdobného případu s manifestní radikulopatií již 85,9 % respondentů a u jedince se známkami míšní komprese v MR obraze bez hyperintenzity a s klinickými známkami lehké myelopatie pouze 65,1 % respondentů. Na základě zhodnocení dostupných vědeckých důkazů a převažujícího klinického názoru autoři doporučují, že jedinci se známkami ASCCC v důsledku cervikální spinální stenózy, kteří vykazují známky manifestní radikulopatie a abnormální vedení somatosenzitivní a motorickou dráhou prokázanou pomocí SEP a MEP, mají vyšší riziko rozvoje manifestní CSM a je nutné u nich zvážit operační řešení. Sílu průkazu tohoto tvrzení hodnotí jako středně silnou a sílu doporučení jako silnou [45].
Nedávno publikované výsledky studií s použitím DTI [36,38,48] ukazují, že parametry DTI v MR obraze korelují s klinickými známkami manifestní myelopatie těsněji než tradiční zobrazovací a elektrofyziologické prediktory rozvoje CSM a bude nezbytné doplnit posouzení rizika rozvoje manifestní myelopatie u ASCCC za použití těchto parametrů.
Predikce rozvoje CSM u ASCCC po lehkém traumatu
Řada autorů popisuje vznik cervikální myelopatie akutně po lehkém úrazu krční páteře [49– 51]. Aebli et al prokázali, že u pacientů s akutně vzniklou lézí krční páteře po traumatu ve srovnání s těmi, kteří prodělali úraz bez následků, je významně nižší hodnota řady parametrů odrážejících rozměry cervikálního kanálu, nejvyšší predikční hodnotu měla CDdisc < 8 mm [11] a TPR < 0,7 [26]. Tato asociace je považována některými autory za důkaz, že pacienti s cervikální stenózou a zejm. ASCCC mají vyšší riziko vzniku akutní myelopatie po často lehkém poranění páteře [52,53], což vedlo u řady spondylochirurgů k provádění preventivní dekompresní operace s cílem zabránit rozvoji myelopatie [54,55]. Tato otázka se stala jedním z kontroverzních spondylochirurgických témat v posledních letech [10,43]. Přehledná práce z roku 2009 našla dvě práce, které prokazují toto zvýšené riziko, avšak šlo o práce retrospektivní [51,56], a proto autoři uzavírají, že neexistuje dostatek důkazů k provádění dekompresní operace u pacientů s ASCCC [43].
V naší práci z roku 2011 [10] jsme retrospektivně analyzovali epizody traumatu krční míchy u naší kohorty 199 jedinců s ASCCC jak během téměř čtyřletého prospektivního sledování (medián 44 měsíců), tak retrográdně před sledováním analýzou dokumentace a pomocí dotazníku. Identifikovali jsme 14 relevantních traumatických epizod během sledování a nenašli jsme korelaci s rozvojem manifestní CSM, kterou jsme zaznamenali u 45 jedinců (RR: 0,95; p > 0,05). Validitu této studie snižuje její retrospektivní charakter, pro nějž ji Wilson et al hodnotí stupněm III dle AHRQ a Grade [46,47], avšak současně ji identifikovali jako jedinou relevantní studii řešící tento problém [45]. Výsledky mohly být ovlivněny faktem, že kohorta našich pacientů s ASCCC byla poučena o nutnosti minimalizovat rizikové aktivity, u kterých hrozilo riziko poranění krční páteře.
Závěr
Degenerativní onemocnění krční páteře vede zejm. ve vyšším věku k časté cervikální stenóze a následné kompresi nervových struktur – míšních kořenů a míchy. Komprese může zůstat asymptomatická, ale vést i k závažnému neurologickému deficitu. Vzhledem k vysoké prevalenci ASCCC ve vyšším věku, variabilnímu klinickému průběhu cervikální spondylózy a nepříliš uspokojivému efektu dekompresivních operací prováděných u nemocných se signifikantním neurologickým deficitem je zásadní potřeba najít biomarkery časných stadií zvláště míšního postižení a zvýšeného rizika přechodu do klinicky významného symptomatického stadia. U těchto rizikových jedinců pak bude nutné ověřit provádění dekompresí v časném presymptomatickém stadiu stenózujícího degenerativního onemocnění krční páteře.
Podporováno grantem IGA MZČR NT/13449-4 a projektem specifického výzkumu č. MUNI/A/0935/2013 z programu podpory studentských projektů na Masarykově univerzitě.
prof. MUDr. Josef Bednařík, CSc., FCMA
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
Přijato k recenzi: 27. 11. 2014
Přijato do tisku: 23. 12. 2014
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Sources
1. Matsumoto M, Fujimura Y, Suzuki N, Nishy Y, Nakamura M, Zabe Y et al. MRI and cervical intervertebral discs in asymptomatic subjects. J Bone Joint Surg Br 1998; 80(1): 19– 24.
2. Stookey B. Compression of the spinal cord due to ventral extradural cervical chondromas. Arch Neurol Psychiatry 1928; 20: 275– 291.
3. Baptiste DC, Fehlings MG. Pathophysiology of cervical myelopathy. Spine J 2006; 6 (Suppl 6): 190S– 197S.
4. al‑ Mefty O, Harkey HL, Marawi I, Haines DE, Peeler DF, Wilner HI et al. Experimental chronic compressive cervical myelopathy. J Neurosurg 1993; 79(4): 550– 561.
5. Harkey HL, al‑ Mefty O, Marawi I, Peeler DF, Haines DE, Alexander LF. Experimental chronic compressive cervical myelopathy: effects of decompression. J Neurosurg 1995; 83(2): 336– 341.
6. Kim P, Haisa T, Kawamoto T, Kirino T, Wakai S. Delayed myelopathy induced by chronic compression in the rat spinal cord. Ann Neurol 2004; 55(4): 503– 511.
7. Bednarik J, Kadanka Z, Dusek L, Novotny O, Surelova D, Urbanek I et al. Presymptomatic spondylotic cervical cord compression. Spine (Phila Pa 1976) 2004; 29(20): 2260– 2269.
8. Bednarik J, Kadanka Z, Dusek L, Kerkovsky M, Vohanka S, Novotny O et al. Presymptomatic spondylotic cervical myelopathy: an updated predictive model. Eur Spine J 2008; 17(3): 421– 431. doi: 10.1007/ s00586‑ 008‑ 0585‑ 1.
9. Teresi LM, Lufkin RB, Reicher MA, Moffit BJ, Vinuela FV, Wilson GM et al. Asymptomatic degenerative disc disease and spondylosis of the cervical spine: MR imaging. Radiology 1987; 164(1): 83– 88.
10. Bednařík J, Sládková D, Kadaňka Z, Dušek L, Keřkovský M, Voháňka S et al. Are subjects with spondylotic cervical cord encroachment at increased risk of cervical spinal cord injury after minor trauma? J Neurol Neurosurg Psychiatry 2011; 82(7): 779– 781. doi: 10.1136/ jnnp.2009.198945.
11. Aebli N, Tabea B, Rüegg TB, Wicki AG, Petrou N, Krebs J. Predicting the risk and severity of acute spinal cord injury after a minor trauma to the cervical spine. Spine J 2013; 13(6): 597– 604. doi: 10.1016/ j.spinee.2013.02.006.
12. Maus TP. Imaging of spinal stenosis: neurogenic intermittent claudication and cervical spondylotic myelopathy. Radiol Clin North Am 2012; 50(4): 651– 679. doi: 10.1016/ j.rcl.2012.04.007.
13. Edwards WC, LaRocca H. The developmental segmental sagittal diameter of the cervical spinal patients with cervical spondylosis. Spine (Phila Pa 1976) 1983; 8(1): 20– 27.
14. Miyazaki M1, Takita C, Yoshiiwa T, Itonaga I, Tsumura H. Morphological analysis of the cervical pedicles, lateral masses, and laminae in developmental canal stenosis. Spine (Phila Pa 1976) 2010; 35(24): E1381– 1385. doi: 10.1097/ BRS.0b013e3181e8958f.
15. Pavlov H, Torg J, Robie B, Jahre C. Cervical spinal stenosis: determination with vertebral body ratio method. Radiology 1987; 164(3): 771– 775.
16. Lee S H, Kim K T, Suk K S, Lee J H, Shin J H, So D H et al. Asymptomatic cervical cord compression in lumbar spinal stenosis patiens: a whole spine magnetic resonance imaging study. Spine (Phila Pa 1976) 2010; 35(23): 2057– 2063. doi: 10.1097/ BRS.0b013e3181f4588a.
17. Lindberg PG, Feydy A, Sanchez K, Rannou F, Maier MA. Measures of spinal canal stenosis and relationship to spinal cord structure in patients with cervical spondylosis. J Neuroradiol 2012; 39(4): 236– 242. doi: 10.1016/ j.neurad.2011.09.004.
18. Naganawa T, Miyamoto K, Ogura H, Suzuki N, Shimizu K. Comparison of magnetic resonance imaging and computed tomogram‑ myelography for evaluation of cross sections of cervical spinal morphology. Spine (Phila Pa 1976) 2011; 36(1): 50– 56. doi: 10.1097/ BRS.0b013e3181cb469c.
19. Song KJ, Choi BW, Kim GH, Kim JR. Clinical usefulness of CT‑ myelogram comparing with the MRI in degenerative cervical spinal disorders: is CTM still useful for primary diagnostic tool? J Spinal Disord Tech 2009; 22(5): 353– 357. doi: 10.1097/ BSD.0b013e31817df78e.
20. Fehlings MG, Furlan JC, Massicotte EM, Arnold P, Aarabi B, Harrop J et al. Interobserver and intraobserver reliability of maximum canal compromise and spinal cord compression for evaluation of acute traumatic cervical spinal cord injury. Spine (Phila Pa 1976) 2006; 31(15): 1719– 1725.
21. Karpova A, Arun R, Davis AM, Kulkarni AV, Mikulis DJ, Sooyong C et al. Reliability of quantitative magnetic resonance imaging methods in the assessment of spinal canal stenosis and cord compression in cervical myelopathy. Spine (Phila Pa 1976) 2013; 38(3): 245– 252. doi: 10.1097/ BRS.0b013e3182672307.
22. Shimomura T, Sumi M, Nishida K, Maeno K, Tadokoro K, Miyamoto H et al. Prognostic factors for deterioration of patients with cervical spondylotic myelopathy after nonsurgical treatment. Spine 2007; 32(22): 2474– 2479.
23. Kameyama T, Hashizume Y, Ando T, Takahashi A, Yanagi T, Mizuno J. Spinal cord morphology and pathology in ossification of the posterior longitudinal ligament. Brain 1995; 118(1): 263– 278.
24. Zhang L, Zeitoun D, Rangel A, Lazennec JY, Catonné Y, Pascal‑ Moussellard H. Preoperative evaluation of the cervical spondylotic myelopathy with flexion‑ extension magnetic resonance imaging: about a prospective study of fifty patients. Spine (Phila Pa 1976) 2011; 36(17): E1134– E1139. doi: 10.1097/ BRS.0b013e3181f822c7.
25. Muhle C, Weinert D, Falliner A, Wiskirchen J, Metzner J, Baumer M et al. Dynamic changes of the spinal canal in patients with cervical spondylosis at flexion and extension using magnetic resonance imaging. Invest Radiol 1998; 33(8): 444– 449.
26. Aebli N, Wicki AG, Rüegg TB, Petrou N, Eisenlohr H, Krebs J. The Torg‑ Pavlov ratio for the prediction of acute spinal cord injury after a minor trauma to the cervical spine. Spine J 2013; 13(6): 605– 612. doi: 10.1016/ j.spinee.2012.10.039.
27. Iizuka H, Takahashi K, Tanaka S, Kawamura K, Okano Y, Oda H. Predictive factors of cervical spondylotic myelopathy in patients with lumbar spinal stenosis. Arch Orthop Trauma Surg 2012; 132(5): 607– 611. doi: 10.1007/ s00402‑ 012‑ 1465‑ z.
28. Prasad SS, O’Malley M, Caplan M, Shackleford IM, Pydisetty RK. MRI measurements of the cervical spine and their correlation to Pavlov’s ratio. Spine (Phila Pa 1976) 2003; 28(12): 1263– 1268.
29. Okada Y, Ikata T, Katoh S, Yamada H. Morphologic analysis of the cervical spinal cord, dural tube, and spinal canal by magnetic resonance imaging in normal adults and patients with cervical spondylotic myelopathy. Spine (Phila Pa 1976) 1994; 19(20): 2331– 2335.
30. Kadanka Z, Kerkovský M, Bednarik J, Jarkovský J. Cross‑ sectional transverse area and hyperintensities on MRI in relation to the clinical picture in cervical spondylotic myelopathy. Spine (Phila Pa 1976) 2007; 32(23): 2573– 2577.
31. Takahashi M, Yamashita Y, Sakamoto Y, Kojima R. Chronic cervical cord compression: clinical significance of increased signal intensity on MR images. Radiology 1989; 173(1): 219– 224.
32. Ramanauskas WL, Wilner HI, Metes JJ, Lazo A, Kelly JK. MR imaging of compressive myelomalacia. J Comput Assist Tomogr 1989; 13(3): 399– 404.
33. Ozawa H, Sato T, Hyodo H, Ishii Y, Morozumi N, Koizumi Y et al. Clinical significance of intramedullary Gd‑ DTPA enhancement in cervical myelopathy. Spinal Cord 2010; 48(5): 415– 422. doi: 10.1038/ sc.2009.152.
34. Floeth FW, Stoffels G, Herdmann J, Eicker S, Galldiks N, Rhee S et al. Prognostic value of 18F‑ FDG PET in monosegmental stenosis and myelopathy of the cervical spinal cord. J Nucl Med 2011; 52(9): 1385– 1391. doi: 10.2967/ jnumed.111.091801.
35. Facon D, Ozanne A, Fillard P, Lepeintre JF, Tournoux‑ Facon C, Ducreux D. MR diffusion tensor imaging and fiber tracking in spinal cord compression. AJNR Am J Neuroradiol 2005; 26(6): 1587– 1594.
36. Kara B, Celik A, Karadereler S, Ulusoy L, Ganiyusufoglu K, Onat L et al. The role of DTI in early detection of cervical spondylotic myelopathy: a preliminary study with 3– T MRI. Neuroradiology 2011; 53(8): 609– 616. doi: 10.1007/ s00234‑ 011‑ 0844‑ 4.
37. Budzik JF, Balbi V, Le Thuc V, Duhamel A, Assaker R, Cotten A. Diffusion tensor imaging and fibre tracking in cervical spondylotic myelopathy. Eur Radiol 2011; 21(2): 426– 433. doi: 10.1007/ s00330‑ 010‑ 1927‑ z.
38. Kerkovsky M, Bednarik J, Dusek L, Sprlákova‑ Pukova, Urbanek I, Mechl M et al. Magnetic resonance diffusion tensor imaging in patients with cervical spondylotic spinal cord compression: correlations between clinical and electrophysiological findings. Spine (Phila Pa 1976) 2012; 37(1): 48– 56. doi: 10.1097/ BRS.0b013e31820e6c35.
39. Dvorak J, Sutter M, Hermann J. Cervical myelopathy: clinical and neurophysiological evaluation. Eur Spine J 2003; 12 (Suppl 2): S181– S187.
40. Lee MJ, Cassinelli EH, Riew KD. Prevalence of cervical spine stenosis. Anatomic study in cadavers. J Bone Joint Surg Am 2007; 89(2): 376– 380.
41. Hayashi H, Okada K, Hamada M, Tada K, Ueno R. Etiologic factors of myelopathy. A radiographic evaluation of the aging changes in the cervical spine. Clin Orthop Relat Res 1987; 214: 200– 209.
42. Bednarik J, Kerkovsky M, Kadanka Z, Kadanka Z jr, Nemec M, Kovalova I et al. Prevalence and imaging characteristics of asymptomatic and symptomatic spondylotic cervical spinal cord compression. Eur J Neurol 2014; 21 (Suppl 1): 243.
43. Murphy DR, Coulis CHM, Gerrard JK. Cervical spondylosis with spinal cord encroachment: should preventive surgery be recommended? Chiropr Osteopat 2009; 17: 8. doi: 10.1186/ 1746‑ 1340‑ 17‑ 8.
44. Bednařík J, Kadaňka Z, Voháňka S, Novotný O, Surelová D, Filipovicová D et al. The value of somatosensory and motor evoked potentials in pre‑clinical spondylotic cervical cord compression. Eur Spine J 1998; 7(6): 493– 500.
45. Wilson JR, Barry S, Fischer DJ, Skelly AC, Arnold PM, Riew KD et al. Frequency, timing, and predictors of neurological dysfunction in the nonmyelopathic patient with cervical spinal cord compression, canal stenosis, and/ or ossification of the posterior longitudinal ligament. Spine (Phila Pa 1976) 2013; 38 (Suppl 1): S37– S54.
46. Atkins D, Best D, Briss PA, Eccles M, Falck‑ Ytter Y, Flottorp S et al. Grading quality of evidence and strength of recommendations. BMJ 2004; 328(7454): 1490.
47. Norvell DC, Dettori JR, Skelly AC, Riew KD, Chapman JR, Anderson PA. Methodology for the systematic reviews on an adjacent segment pathology. Spine (Phila Pa 1976) 2012; 37 (Suppl 22): S10– S17. doi: 10.1097/ BRS.0b013e31826cd9c8.
48. Song T, Chen WJ, Yang B, Zhao HP, Huang JW, Cai MJ et al. Diffusion tensor imaging in the cervical spinal cord. Eur Spine J 2011; 20(3): 422– 428. doi: 10.1007/ s00586‑ 010‑ 1587‑ 3.
49. Foo D. Spinal cord injury in forty‑ four patients with cervical spondylosis. Paraplegia 1986; 24(5): 301– 306.
50. Hughes JT, Brownell B. Spinal‑ cord damage from hyperextension injury in cervical spondylosis. Lancet 1963; 1(7283): 687– 690.
51. Regenbogen VS, Rogers LF, Atlas SW, Kim KS. Cervical spinal cord injuries in patients with cervical spondylosis. AJR Am J Roentgenol 1986; 146(2): 277– 284.
52. Emery SE. Cervical spondylotic myelopathy: diagnosis and treatment. J Am Acad Orthop Surg 2001; 9(6): 376– 388.
53. Shedid D, Benzel EC. Cervical spondylosis anatomy: pathophysiology and biomechanics. Neurosurgery 2007; 60 (Suppl 1): S7– S13.
54. Epstein NE. Laminectomy for cervical myelopathy. Spinal Cord 2003; 41(6): 317– 327.
55. Lauryssen C, Riew KD, Wang JC. Severe cervical stenosis: operative treatment of continued conservative care? Spine Line 2006; 8: 21– 25.
56. Katoh S, Ikata T, Hirai N, Okada Y, Nakauchi K. Influence of minor trauma to the neck on the neurological outcome in patients with ossification of the posterior longitudinal ligament (OPLL) of the cervical spine. Paraplegia 1995; 33(6): 330– 333.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2015 Issue 1
Most read in this issue
- Protokol diagnostiky a léčby hyponatremie a hypernatremie v neurointenzivní péči
- Mini‑Mental State Examination – česká normativní studie
- Autoimunitní encefalitidy
- Asymptomatická spondylogenní komprese krční míchy

