Postižení kognitivních funkcí v časných fázích roztroušené sklerózy
Cognitive Impairment in Early Stages of Multiple Sclerosis
Multiple sclerosis (MS) is a chronic disease affecting brain and spinal cord and leading primarily to motor disability. Cognitive deficit in patients with MS are often neglected in routine clinical practise despite its significant impact on patients’ quality of life. Recent studies have suggested that cognitive impairment is present in almost 65% of patients with MS even at the earliest stages of the disease – in patients with clinically isolated syndrome (CIS). The goal of this review was to summarize results of previous studies focused on cognitive deficit in patients with MS. We put particular emphasis on early stages of the disease including patients after the first clinical manifestation of the disease (CIS), who are likely to develop clinically definite multiple sclerosis (CDMS). We further describe the relationship between cognitive functions and structural changes on magnetic resonance imaging (MRI). We also mention the most commonly used neuropsychological batteries and pharmacological and non-pharmacological treatments of cognitive deficits in patients with MS. The final part of the review focuses on fatigue, depression and quality of life.
Key words:
multiple sclerosis – clinically isolated syndrome – cognitive deficit – neuropsychological tests – magnetic resonance imaging
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
E. Hynčicová 1; E. Meluzínová 1; M. Vyhnálek 1,3; J. Libertínová 1; I. Kovářová 2; T. Nikolai 1,2; J. Hort 1,3; J. Laczó 1,3
Authors‘ workplace:
Neurologická klinika 2. LF UK a FN v Motole, Praha
1; Neurologická klinika 1. LF UK a VFN v Praze
2; ICRC, FN u sv. Anny v Brně
3
Published in:
Cesk Slov Neurol N 2013; 76/109(6): 690-694
Category:
Review Article
Overview
Roztroušená skleróza (RS) je chronické onemocnění, jež postihuje mozek a míchu, a projevuje se převážně motorickým postižením. Ačkoli nedávné studie naznačují, že postižení kognitivních funkcí je přítomno až u 65 % pacientů s RS, a to dokonce již ve stadiu klinicky izolovaného syndromu (CIS). Zhoršuje jejich kvalitu života, přesto je problematika kognitivního deficitu u těchto pacientů v běžné klinické praxi často opomíjena. Cílem tohoto přehledného článku je shrnout dosavadní výsledky studií, jež se zabývají problematikou kognitivního deficitu u pacientů s RS, především zaměřené na časná stadia onemocnění včetně pacientů po prvním příznaku (CIS), kteří jsou ve velkém riziku rozvoje klinicky jisté RS (CDMS). Je zde zdůrazněn vztah kognitivních funkcí k jejich strukturálním korelátům. Dále se zmiňujeme o nejčastěji používaných bateriích neuropsychologických testů a o farmakologických a nefarmakologických přístupech v léčbě kognitivních poruch u pacientů s RS. Závěr je věnován problematice únavy, deprese a kvality života.
Klíčová slova:
roztroušená skleróza – klinicky izolovaný syndrom – kognitivní deficit – neuropsychologické testy – magnetická rezonance
Grant IGA NT/ 12385- 5, grant IGA NR/ 9445- 3, GAČR 309/ 05/ 0693, projekt FNUSA‑ ICRC (no. CZ.1.05/ 1.1.00/ 02.0123) z Evropského fondu regionálního rozvoje.
Úvod
Roztroušená skleróza (RS) je chronické onemocnění centrálního nervového systému s prevalencí 80– 170/ 100 000 a incidencí mezi 6 a 11/ 100 000 v ČR.Dochází při něm kombinací autoimunitně navozeného zánětu a neurodegenerativního procesu k destrukci myelinu a zániku axonů. Typický nález na magnetické rezonanci (MR) mozku je přítomnost lézí, které nejčastěji nacházíme v oblasti bílé hmoty v blízkosti komor, mozečku, mozkového kmene, bazálních ganglií a míchy. V zánětlivém ložisku dochází nejen k destrukci myelinu, ale současně k axonální lézi, a to již v časné fázi choroby. Ztráta myelinu a zejména nevratné poškození axonů vede k atrofii CNS, jejíž klinickým korelátem je postupující invalidizace pacienta. Vzhledem k tomu, že RS je primárně onemocnění motorické, nebyla dříve věnována velká pozornost hodnocení kognitivního postižení. Původní studie popisovaly kognitivní deficit jen u 3 % pacientů s RS [1], ale se zvyšujícím se zájmem o kognitivní problematiku a s častějším používáním nových senzitivních testů se ukazuje, že prevalence kognitivního deficitu je výrazně vyšší. Nedávné studie udávají prevalenci 43– 72 % [2]. Kognitivní postižení bylo prokázáno u všech forem klinicky jisté RS (CDMS) – u relaps‑ remitentní (RR‑ RS), primárně (PP‑ RS) a sekundárně (SP‑ RS) progresivních forem. Nedávné výzkumy dále prokazují kognitivní deficit již u pacientů po prvním klinickém příznaku (CIS). Ti mají vysokou pravděpodobnost dalšího rozvoje CDMS.
Cílem tohoto přehledného článku je shrnutí dosavadních poznatků o kognitivním postižení u pacientů s RS. Speciálně se zde zaměřujeme na problematiku kognitivního postižení u pacientů s CIS a na strukturální koreláty kognitivního deficitu.
Kognitivní postižení
Nedávné studie prokázaly, že u pacientů s RS je postiženo více kognitivních domén, než se doposud předpokládalo [3]. Ukazuje se, že jsou v různé míře postiženy všechny kognitivní funkce, které zahrnují paměť, pozornost, exekutivní funkce, vizuospaciální funkce a funkce řečové [3,4]. Trendem posledních let je stanovení přítomnosti kognitivního deficitu již u pacientů s CIS [5] a v raných stadiích RS. Navíc se ukazuje, že existuje vztah mezi kognitivním deficitem a rychlostí konverze do (CDMS) [60]. V následujících odstavcích se budeme podrobněji věnovat jednotlivým kognitivním funkcím.
Pozornost, pracovní paměť a „rychlost zpracování informací“
Poruchy v oblasti pozornosti, rychlosti zpracování informací a krátkodobé paměti (též paměť pracovní) spolu úzce souvisejí a patří mezi nejčastěji postižené u pacientů s RS [6], a to již v nejčasnějších stadiích onemocnění [7]. Nedávné studie dokonce naznačují, že testy zaměřené na tuto doménu mohou být používány k predikci dlouhodobého kognitivního vývoje u pacientů s RS [2]. Poruchy pozornosti jsou pozorovány u 12– 25 % pacientů s RS a bývají více vyjádřeny u pacientů se sekundárně progredientní formou RS [8]. Rychlost zpracování informací je také zpomalena u pacientů s RS ve srovnání s kontrolami [9] a dle některých autorů [10– 13] se jedná o nejběžnější a nejvíce vyjádřený kognitivní deficit. U pacientů s RS dále nacházíme i deficit v oblasti pracovní paměti [14]. U pacientů s CIS dominuje postižení pozornosti a rychlosti zpracování informací [15].
Exekutivní funkce
S pozorností, pracovní pamětí a rychlostí zpracování informací úzce souvisejí exekutivní funkce [2], které vyjadřují schopnost a dovednost plánovat, rozhodovat se a řešit problémy. Jejich postižení je přítomno asi u 17 % pacientů [16] s RS, a jejich výskyt je tudíž ve srovnání s poškozením paměti [2] a zpracováním informací [17] méně častý. Bylo prokázáno, že pacienti s RS v testech zaměřených na exekutivní funkce dosahují horších výsledků než kontrolní skupina, i když vyloučíme vliv jejich motorického postižení. U pacientů s CIS jsou exekutivní funkce na rozdíl od pacientů s RR‑ RS relativně ušetřeny [18]. Výsledky testů exekutivních funkcí mohou být také do značné míry ovlivněny depresí [19– 21], což by mělo být vždy bráno v úvahu při hodnocení výsledků testů.
Paměť
Mírné poškození paměti [14] se často vyskytuje již v časných stadiích [22] nemoci, u pacientů s CIS však zatím prokázáno nebylo [15]. U pacientů s RS se jedná o jeden z nejčastěji pacienty subjektivně zmiňovaných kognitivních deficitů s frekvencí udávanou mezi 40 a 60 % [23]. Přesto ale podle některých prací nemusí paměť patřit mezi nejvíce postižené domény [24]. Zatímco paměť pro úkony a motorické dovednosti (paměť procedurální) zůstává u pacientů s RS dlouho ušetřena [25], paměť pro události a fakta (deklarativní paměť) je postižena již v časnějších stadiích [26], především v oblasti učení [26] a oddáleného volného vybavení a rozpoznávání slov [15]. U pacientů s RS je zraková paměť (neverbální) postižena více [1] než paměť na slova (verbální), která je výrazněji poškozena u pacientů s delším trváním nemoci a vyšším motorickým postižením na škále Expanded Disability Status Scale (EDSS).
Zrakově‑prostorové funkce
Zrakově‑prostorové schopnosti byly doposud spíše na okraji zájmu a nebyly považovány za příliš časté [17]. Nedávné studie však naznačují, že až 19 % pacientů s RS má horší výsledky v testech zaměřených na zrakově‑prostorové funkce ve srovnání s kontrolami. Nicméně závěry studií však nejsou zcela konzistentní [27], jelikož některé studie naznačují, že zrakově‑prostorové funkce nemusí být u pacientů s RS postiženy [28,29]. Nicméně se ukazuje, že tíže zrakově‑prostorového postižení se zhoršuje s délkou trvání nemoci [30] a výší EDSS [1]. U pacientů s CIS nebyly zrakově‑prostorové funkce dosud příliš podrobně zkoumány, ojedinělé studie však jejich možné postižení u této skupiny pacientů neprokazují [31].
Fatické funkce
Vzhledem k tomu, že expresivní afázie je u pacientů s RS vzácná, je výskyt poškození plynulosti řeči (verbální fluence) spíše důsledkem postižení exekutivních funkcí. Bylo prokázáno, že pacienti s RS mohou mít v porovnání se zdravými kontrolami značné rozdíly jak ve schopnosti užívat správné tvary slov (fonemická fluence), tak ve schopnosti nalézt slova správného významu (sémantická fluence) [32]. Pacienti s PP‑ RS a SP‑ RS formou onemocnění s vyšším skóre v EDSS (ve srovnání s RR‑ RS) mají větší deficit v testech sémantické fluence [33]. U pacientů s CIS je dokonce sémantická verbální fluence považována za jednu z nejčastěji postižených domén [15].
Testové baterie pro hodnocení kognitivních funkcí a jejich specifika
Ke zhodnocení kognitivního deficitu se u pacientů s RS a CIS se používá několik testových baterií. Nejznámějšími z nich jsou Minimal Assessment of Cognitive Function in Multiple Sclerosis (MACFIMS) a Brief International Cognitive Assessment for Multiple Sclerosis (BICAMS), dalším příkladem používané testové baterie může být Brief Repeatable Battery of Neuropsychological Tests (BRB‑ N). MACFIMS se skládá ze sedmi testů, které vyšetřují všechny kognitivní domény (tab. 1). Jeho administrace přísluší neuropsychologovi a vyšetření tímto testem trvá přibližně 90 min. BICAMS je zkrácená verze MACFIMS a zahrnuje tři testy (tab. 2). Provedení trvá zhruba jen 15 min, může ho zadávat i vyškolený personál, a je proto v každodenní praxi zatím nejvhodnější sadou testů, která se používá častěji v menších centrech, k rychlému zhodnocení kognitivního postižení u pacientů s RS. Na základě doporučení konsorcia center pro roztroušenou sklerózu je vhodné zavedení BICAMS do rutinní praxe a tato baterie je také validizována k použití v českém jazyce [34].
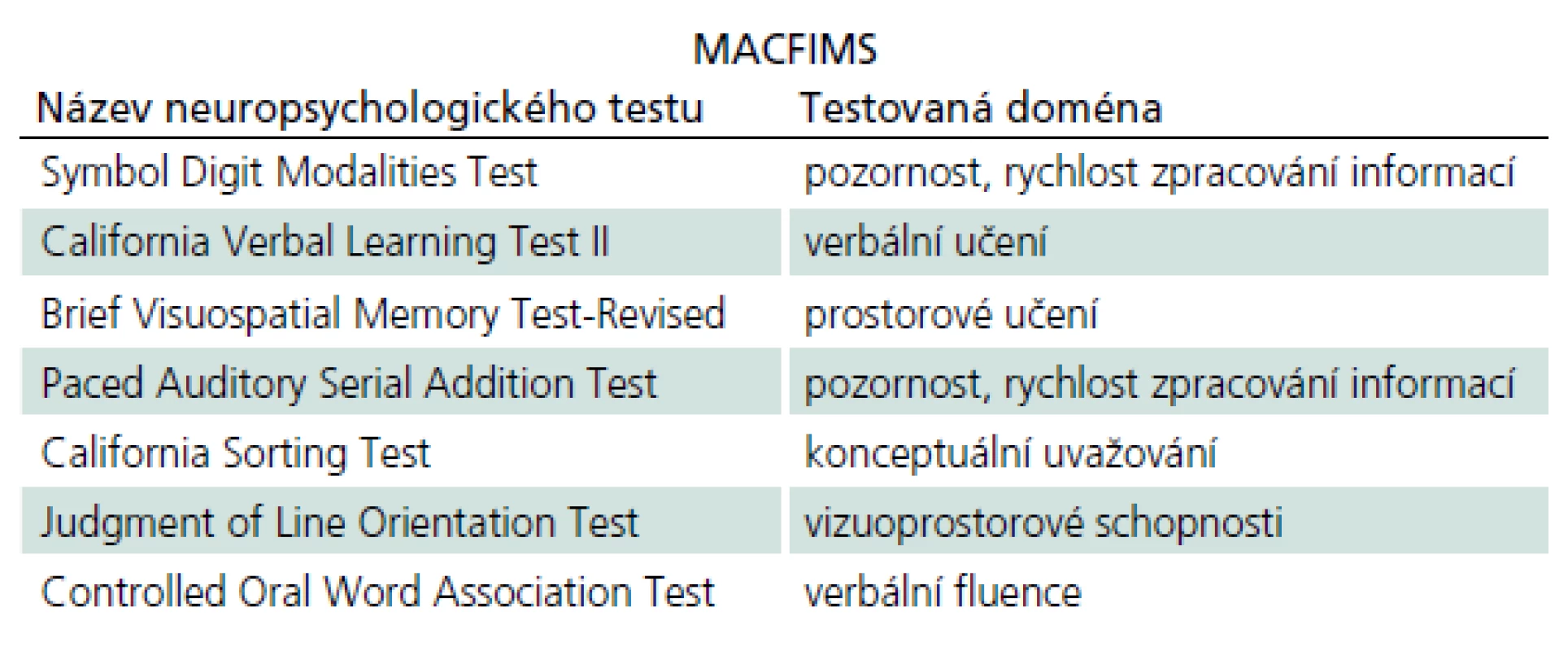

Vzhledem k častému motorickému poškození se u pacientů s RS používají takové neuropsychologické testy, které se provádí v ústní verzi. Dalším faktorem, jež je nutné zohlednit, je nízký věk některých pacientů. Musí se proto používat takové testy, které budou dostatečně senzitivní.
V neurologické ordinaci je nejrozšířenější skríningový test na kognitivní poruchy Mini Mental State Examination (MMSE) [35] test, který je však pro skríning kognice u pacientů s RS nevhodný. Nevyšetřuje totiž exekutivní funkce a obsahuje příliš jednoduchý test na paměť [36]. Vhodnější skríningovou metodou by mohly být testy Montreal Cognitive Assessment (MoCA) [37] nebo do češtiny přeložený Adenbrookský kognitivní test (Adenbrooke’s Cognitive Examination – ACE) [38].
Strukturální koreláty
Porucha kognitivních funkcí souvisí s přítomností a množstvím demyelinizačních lézí a postižení jednotlivých domén odpovídají léze konkrétních mozkových struktur. K poškození paměti mají vztah zejména demyelinizační léze v oblasti frontálního a mediálního temporálního laloku [39,40]. Verbální učení souvisí s lézemi v Brocově oblasti, v pravém frontálním laloku a ve spleniu [41]. Nebyly nalezeny léze konkrétních mozkových struktur odpovídajících postižení pozornosti. Vztah postižení frontálního laloku a poškození exekutivních funkcí nebyl dosud zobrazovacími studiemi u pacientů s RS prokázán.
Další nezávislý faktor, který vypovídá o kognitivních schopnostech ještě lépe než výskyt demyelinizačních lézí, je mozková atrofie (jak šedé, tak i bílé hmoty) [42– 44]. Mnoho studií prokázalo těsný vztah mezi poškozením šedé hmoty a kognitivním postižením u RS [40,45]. Ukazuje se, že korová atrofie, zejména ve frontální a temporální oblasti, souvisí s poškozením verbální [40,46], vizuální a pracovní paměti [38], verbální fluence [45], pozornosti [45] a rychlostí zpracování informací [40]. Také atrofie subkortikální šedé hmoty, především atrofie thalamu, je spojena s deteriorací kognitivních funkcí [47]. Velmi recentní studie naznačují, že jednou z nejčasněji postižených struktur je corpus callosum [48], jehož atrofie je spjata zvláště s postižením neverbální (vizuospaciální) paměti [49]. Ukazuje se že právě atrofie corpus callosum [50,51] dokáže u pacientů s CIS předpovědět rychlost progrese onemocnění a reflektovat účinnost léčby.
Deprese
U 50– 60 % pacientů s RS se vyskytují emoční změny a změny nálady [52,53], především pak deprese. Je proto vhodné v rámci vyšetření kognitivních funkcí vyšetřovat také depresi pomocí cílených dotazníků (např. Zungova a Beckova sebeposuzovací stupnice deprese). Deprese totiž může mít značný vliv na kognitivní funkce, a to zejména na exekutivní funkce, kapacitu kognitivních procesů a pracovní paměť [26]. Ukazuje se, že deprese se vyskytuje ve zvýšené míře již u pacientů s CIS [54]. Deprese je u pacientů s RS častější než v porovnání s běžnou populací a riziko sebevraždy u pacientů s RS je třikrát až sedmkrát vyšší. Potíže spojené s nespavostí, poruchou paměti a koncentrace mohou být v souvislosti buď s depresí, nebo se základním onemocněním [52]. Je pravděpodobné, že má vztah k efektu léčby i k únavě. K její akcentaci může přispívat i medikace – často interferon beta (IFNb), ale také kortikoterapie.
Deprese je častější u pacientů s velkým počtem lézí temporálně [2] a dále u pacientů s těžkou atrofií v bílé hmotě parietálního a frontálního laloku vzhledem k poškození limbických funkcí.
Únava
Únava je jednou z nejčastějších obtíží u pacientů s RS [55]. Je pravděpodobné, že existuje vztah mezi únavou, kterou pacient udává, a objektivním výkonem v testech, což bylo podpořeno nedávnými studiemi. Ty ukazují, že únava souvisí s kognitivním deficitem [14]. Dále se předpokládá, že existuje i obrácený vztah, kdy kognitivní deficit může způsobovat zvýšenou únavu vycházející z potřeby více se snažit (což může pacienta vyčerpávat). Doporučuje se, aby časově náročné neuropsychologické testy a dále testy, u kterých se hodnotí čas, nebyly používány příliš často.
Kvalita života
Kognitivní postižení u pacientů s RS má také přímý vliv na kvalitu života. Pacienti s RS a kognitivním postižením mají vyšší riziko ztráty zaměstnání [56]. Horší výkon v neuropsychologických testech rovněž přímo souvisí se schopností řídit motorová vozidla a např. postižení v testech vizuospaciální paměti dokáže předpovědět zvýšené riziko automobilové nehody [57]. Kombinace motorického deficitu a lehkého kognitivního deficitu může ovlivnit celkové schopnosti pacientů více než postižení pouze v jedné z těchto oblastí.
Léčba poruchy kognitivních funkcí u RS
V principu je třeba stanovit co nejrychleji správnou diagnózu a včasnou účinnou terapií léky první nebo druhé volby zamezit axonální ztrátě a rozvoji atrofie, a tím předejít i vzniku kognitivního deficitu. O symptomatické terapii není příliš mnoho dat. Byl prokázán efekt i.v. fyzostigminu a lecitinu na paměť [58], což však nemá praktické využití. Ginkgo biloba nemělo efekt na zlepšení kognitivních funkcí, mělo jen mírný efekt na zmírnění únavy [59].
Shrnutí
Kognitivní postižení je u pacientů s RS velmi časté. Prokázaná porucha kognice může predikovat další průběh onemocnění např. u pacientů s CIS. Jelikož progrese kognitivního deficitu souvisí s rychlostí progrese onemocnění, je velmi důležité diagnostikovat kognitivní deficit v co nejčasnějším stadiu. Mezi nejvíce používané baterie pro hodnocení kognitivního postižení u pacientů s RS patří neuropsychologická baterie MACFIMS, jehož administrace trvá přibližně 90 min. Vzhledem ke své časové náročnosti se začíná stále více používat baterie BICAMS, jejíž administrace nepřesahuje 15 min, a proto je vhodnější pro rutinní klinické vyšetření. Kognitivní deficit se vyskytuje až u 26– 53 % pacientů s CIS a u 65 % pacientů s RS. V různé míře jsou postiženy všechny kognitivní domény, především pozornost, dlouhodobá a pracovní paměť a rychlost zpracování informací. Ke kognitivnímu postižení dochází nejen v důsledku přítomnosti demyelinizačních lézí, ale také pro atrofii bílé a šedé hmoty mozkové a především atrofii corpus callosum, která může predikovat přechod pacientů s CIS do CDMS. Kromě kognitivního deficitu jsou častými příznaky u pacientů s RS únava a deprese, které přispívají ke zhoršení kvality života. Specifická léčba kognitivního deficitu u pacientů s RS a CIS zatím neexistuje.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Eva Meluzínová
Neurologická klinika
2. LF UK a FN v Motole
V Úvalu 84
150 06 Praha 5
e-mail: eva.meluzinova@fnmotol.cz
Přijato k recenzi: 29. 4. 2013
Přijato do tisku: 9. 8. 2013
Sources
1. Schulz D, Kopp B, Kunkel A, Faiss JH. Cognition in the early stage of multiple sclerosis. J Neurol 2006; 253(8): 1002– 1010.
2. Chiaravalloti ND, DeLuca J. Cognitive impairment in multiple sclerosis. Lancet Neurol 2008; 7(12): 1139– 1151.
3.Vleugels L, Lafosse C, van Nunen A, Nachtergaele S, Ketelaer P, Charlier M et al. Visuoperceptual impairment in multiple sclerosis patients diagnosed with neuropsychological tasks. Mult Scler 2000; 6(4): 241– 254.
4. Laatu S, Hämäläinen P, Revonsuo A, Portin R, Ruutiainen J. Semantic memory deficit in multiple sclerosis; impaired understanding of conceptual meanings. J Neurol Sci 1999; 162(2): 152– 161.
5. Štecková T, Hluštík P, Sládková V, Doláková J, Zapletalová J, Kaňovský P. Kognitivní dysfunkce u pacientů s klinickým izolovaným syndromem a roztroušenou sklerózou. Cesk Slov Neurol N 2011; 74/ 107(5): 551– 555.
6. Rao SM, Leo GJ, Bernardin L, Unverzagt F. Cognitive dysfunction in multiple sclerosis: I. Frequency, patterns, and prediction. Neurology 1991; 41(5): 685– 691.
7.Audoin B, Au Duong MV, Ranjeva JP, Ibarrola D, Malikova I, Confort‑ Gouny S et al. Magnetic resonance study of the influence of tissue damage and cortical reorganization on PASAT performance at the earliest stage of multiple sclerosis. Hum Brain Mapp 2005; 24(3): 216– 228.
8. Huijbregts SC, Kalkers NF, de Sonneville LM, de Groot V, Reuling IE, Polman CH. Differences in cognitive impairment of relapsing remitting, secondary, and primary progressive MS. Neurology 2004; 63(2): 335– 339.
9. Denney DR, Gallagher KS, Lynch SG. Deficits in processing speed in patients with multiple sclerosis: evidence from explicit and covert measures. Arch Clin Neuropsychol 2011; 26(2): 110– 119.
10. Denney DR, Lynch SG, Parmenter BA. A 3‑year longitudinal study of cognitive impairment in patients with primary progressive multiple sclerosis: speed matters. J Neurol Sci 2008; 267(1– 2): 129– 136.
11. DeLuca J, Chelune GJ, Tulsky DS, Lengenfelder J, Chiaravalloti ND. Is speed of processing or working memory the primary information processing deficit in multiple sclerosis? J Clin Exp Neuropsychol 2004; 26(4): 550– 562.
12. Janculjak D, Mubrin A, Brinar V, Spilich G. Changes of attention and memory in a group of patients with multiple sclerosis. Clin Neurol Neurosurg 2002; 104(3): 221– 227.
13. Bergendal G, Fredrikson S, Almkvist O. Selective decline in information processing in subgroups of multiple sclerosis: an 8 year old longitudinal study. Eur Neurol 2007; 57(4): 193– 202.
14. Winkelmann A, Engel C, Apel. Cognitive impairment in multiple sclerosis. J Neurol 2008; 255 (Suppl 2): 309– 310.
15. Potagas C, Giogkaraki E, Koutsis G, Mandellos D,Tsirempolou E, Sfagos C et al. Cognitive impairment in different MS subtypes and clinically isolated syndromes. J Neurol Sci 2008; 267(1– 2): 100– 106.
16. Drew M, Tippett LJ, Starkey NJ, Isler RB. Executive dysfunction and cognitive impairment in a large community‑based sample with multiple sclerosis form New Zealand: a descriptive study. Arch Clin Neuropsychol 2008; 23(1): 1– 19.
17. Bagert B, Camplair P, Bourdette D. Cognitive dysfunction in multiple sclerosis: natural history, pathophysiology and management. CNS Drugs 2002; 16(7): 445– 455.
18. Simioni S, Ruffieux C, Bruggimann L, Annoni JM, Schluep M. Cognition, mood and fatigue in patients in the early stage of multiple sclerosis. Swiss Med Wkly 2007; 137(35– 36): 496– 501.
19. Parmenter BA, Zivadinov R, Kerenyi L, Gavett R, Weinstock‑ Guttman B, Dwyer MG et al. Validity of the Wisconsin Card Sorting and Delis‑ Kaplan Executive Function System (DKEFS) Sorting Tests in multiple sclerosis. J Clin Exp Neuropsychol 2007; 29(2): 215– 223.
20. Arnett PA, Higginson CI, Randolph JJ. Depression in multiple sclerosis: relationship to planning ability. J Int Neuropsychol Soc 2001; 7(6): 665– 674.
21. Denney DR, Lynch SG, Parmenter BA, Horne N. Cognitive impairment in relapsing and primary progressive multiple sclerosis: mostly a matter of speed. J Int Neuropsychol Soc 2004; 10(7): 948– 956.
22. Grant I, McDonald WI, Trimble MR, Smith E, Reed R.Deficient learning and memory in early and middle phases of multiple sclerosis. J Neurol Neurosurg Psychiatry 1984; 47(3): 250– 255.
23. Grafman J, Rao S, Bernardin L, Leo GJ. Automatic memory processes in patients with multiple sclerosis. Arch Neurol 1991; 48(10): 1072– 1075.
24. Jønsson A, Andresen J, Storr L, Tscherning T, Soelberg Sørensen P, Ravnborg M. Cognitive impairment in newly diagnosed multiple sclerosis patients: a 4‑year follow‑up study. J Neurol Sci 2006; 245(1– 2): 77– 85.
25. Rao SM. Neuropsychology of multiple sclerosis: a critical review. J Clin Exp Neuropsychol 1986; 8(5): 503– 542.
26. Thornton AE, Raz N. Memory impairment in multiple sclerosis: a quantitative review. Neuropsychology 1997; 11(3): 357– 366.
27. Haase C, Tinnefeld M, Lienemann M, Ganz RE, Faustmann PM. Depression and cognitive impairment in disability‑free early multiple sclerosis. Behav Neurol 2003; 14(1– 2): 39– 45.
28. Camp SJ, Stevenson VL, Thompson AJ, Miller DH, Borras C, Auriacombe S et al. Cognitive function in primary progressive and transitional progressive multiple sclerosis: a controlled study with MRI correlates. Brain 1999; 122(7): 1341– 1348.
29. De Sonneville LM, Boringa JB, Reuling IE, Lazeron RH, Adèr HJ, Polman CH. Information processing characteristics in subtypes of multiple sclerosis. Neuropsychologia 2002; 40(11): 1751– 1755.
30. Bruce JM, Bruce AS, Arnett PA. Mild visual acuity disturbances are associated with performance on tests of complex visual attention in MS. J Int Neuropsychol Soc 2007; 13(3): 544– 548.
31. Achiron A, Barak Y. Cognitive impairment in probable multiple sclerosis. J Neurol Neurosurg Psychiatry 2003; 74(4): 443– 446.
32. Henry JD, Beatty WW. Verbal fluency deficits in multiple sclerosis. Neuropsychologia 2006; 44(7): 1166– 1174.
33. Amato MP, Portaccio E, Goretti B, Zipoli V, Battaglini M, Bartolozzi ML et al. Association of neocortical volume changes with cognitive deterioration in relapsing‑ remitting multiple sclerosis. Arch Neurol 2007; 64(8): 1157– 1161.
34. Dusankova JB, Kalincik T, Havrdova E, Benedict RH. Cross cultural validation of the Minimal Assessment of Cognitive Function in Multiple Sclerosis (MACFIMS) and the Brief International Cognitive Assessment for Multiple Sclerosis (BICAMS). Clin Neuropsychol 2012; 26(7): 1186– 1200 .
35. Folstein MF, Folstein SE, McHugh PR. “Mini‑mental state”. A practical method for grading the cognitive state of patients for the clinician. J Psychiatr Res 1975; 12(3): 189– 198.
36. Mathuranath PS, Cherian JP, Mathew R, George A,Alexander A, Sarma SP. Mini mental state examination and the Addenbrooke‘s cognitive examination: effect of education and norms for a multicultural population. Neurol India 2007; 55(2): 106– 110.
37. Nasreddine ZS, Phillips NA, Bédirian V, Charbonneau S, Whitehead V, Collin I et al. The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. J Am Geriatr Soc 2005; 53(4): 695– 699.
38. Hummelová‑ Fanfrdlová Z, Rektorová I, Sheardová K,Bartoš A, Línek V, Ressner P et al. Česká adaptace Addenbrookského kognitivního testu (Addenbrooke’s Cognitive Examination). Československá psychologie 2009; 53(4): 376– 388.
39. Sánchez MP, Nieto A, Barroso J, Martín V, Hernández MA. Brain atrophy as a marker of cognitive impairment in mildly disabling relapsing‑ remitting multiple sclerosis. Eur J Neurol 2008; 15(10): 1091– 1099.
40. Tekok‑ Kilic A, Benedict RH, Weinstock‑ Guttman B,Dwyer MG, Carone D, Srinivasaraghavan B et al. Independent contributions of cortical gray matter atrophy and ventricle enlargement for predicting neuropsychological impairment in multiple sclerosis. Neuroimage 2007; 36(4): 1294– 1300.
41. Reuter F, Zaaraoui W, Crespy L, Faivre A, Rico A, Malikova I et al. Cognitive impairment at the onset of multiple sclerosis: relationship to lesion location. Mult Scler 2011; 17(6): 755– 758.
42. Calabrese M, Rocca MA, Atzori M, Mattisi I, Favaretto A, Perini P et al. A 3‑year magnetic resonance imaging study of cortical lesions in relapse‑ onset multiple sclerosis. Ann Neurol 2010; 67(3): 376– 383.
43. Calabrese M, Agosta F, Rinaldi F, Mattisi I, Grossi P,Favaretto A et al. Cortical lesions and atrophy associated with cognitive impairment in relapsing‑ remitting multiple sclerosis. Arch Neurol 2009; 66(9): 1144– 1150.
44. Obhlídalová I, Keřkovský M, Štourač P, Bednařík P,Vlčková E. Diagnostické možnosti zobrazovacích metod v hodnocení morfologického korelátu kognitivních změn u pacientů s roztroušenou sklerózou. Cesk Slov Neurol N 2012; 75/ 108(2): 170– 178.
45. Amato MP, Bartolozzi ML, Zipoli V, Portaccio E, Mortilla M, Guidi L et al. Neocortical volume decrease in relapsing‑ remitting MS patients with mild cognitive impairment. Neurology 2004; 63(1): 89– 93.
46. Benedict RH, Zivadinov R, Carone DA, Weinstock‑ Guttman B, Gaines J, Maggiore C et al. Regional lobar atrophy predicts memory impairment in multiple sclerosis. AJNR Am J Neuroradiol. 2005; 26(7): 1824– 1831.
47. Houtchens MK, Benedict RH, Killiany R, Sharma J,Jaisani Z, Singh B et al. Thalamic atrophy and cognition in multiple sclerosis. Neurology 2007; 69(12): 1213– 1223.
48. Lin F, Yu C, Liu Y, Li K, Lei H. Diffusion tensor group tractography of the corpus callosum in clinically isolated syndrome. AJNR Am J Neuroradiol 2011; 32(1): 92– 98.
49. Rimkus Cde M, Junqueira Tde F, Lyra KP, Jackowski MP, Machado MA, Miotto EC et al. Corpus callosum microstructural changes correlate with cognitive dysfunction in early stages of relapsing‑ remitting multiple sclerosis: axial and radial diffusivities approach. Mult Scler Int 2011; 2011: 304875.
50. Kalincik T, Vaneckova M, Tyblova M, Krasensky J, Seidl Z, Havrdova E et al. Volumetric MRI markers and predictors of disease activity in early multiple sclerosis: a longitudinal cohort study. PLoS One 2012; 7(11): e50101.
51. Vaneckova M, Kalincik T, Krasensky J, Horakova D, Havrdova E, Hrebikova T et al. Corpus callosum atrophy – a simple predictor of multiple sclerosis progression: a longitudinal 9‑year study. Eur Neurol 2012; 68(1): 23– 27.
52. Feinstein A. Mood disorders in multiple sclerosis and the effects on cognition. J Neurol Sci 2006; 245(1– 2): 63– 66.
53. Haase CG, Tinnefeld M, Lienemann M, Ganz RE, Faustmann PM. Depression and cognitive impairment in disability‑free early multiple sclerosis. Behav Neurol 2003; 14(1– 2): 39– 45.
54. Anhoque CF, Domingues SC, Carvalho T, Teixeira AL, Domingues RB. Anxiety and depressive symptoms in clinically isolated syndrome and multiple sclerosis. Arq Neuropsiquiatr 2011; 69(6): 882– 886.
55. Zajicek JP, Ingram WM, Vickery J, Creanor S, Wright DE, Hobart JC. Patient‑ orientated longitudinal study of multiple sclerosis in south west England (The South West Impact of Multiple Sclerosis Project, SWIMS). 1: Protocol and baseline characteristics of cohort. BMC Neurol 2010; 10: 88.
56. Honarmand K, Akbar N, Kou N, Feinstein A. Predicting employment status in multiple sclerosis patients: the utility of the MS functional composite. J Neurol 2011; 258 (2): 244– 249.
57. Schultheis MT, Weisser V, Ang J, Elovic E, Nead R,Sestito N. Examining the relationship between cognition and driving performance in multiple sclerosis. Arch Phys Med Rehabil 2010; 91(3): 465– 473.
58. Leo GJ, Rao SM. Effects of intravenous physostigmine and lecithin on memory loss in multiple sclerosis: Report of a pilot study. J Neurol Rehabil 1988; 2: 123– 129.
59. Johnson SK, Diamond BJ, Rausch S, Kaufman M, Shiflett SC, Graves L. The effect of Gingko biloba on functional measures in multiple sclerosis: a pilot randomized controlled trial. Explore 2006; 2(1): 19– 24.
60. Zakzanis KK. Distinct neurocognitive profiles in multiple sclerosis subtypes. Arch Clin Neuropsychol 2000; 15(2): 115–136.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 6
Most read in this issue
- Frontotemporálna lobárna degenerácia z pohľadu nových klinicko‑patologických korelácií
- Tuberózní skleróza u dětí sledovaných od novorozeneckého věku pro prenatální nález rhabdomyomů srdce – dvě kazuistiky
- Expanze pineální krajiny
- Zlomeniny kondylu okciputu
