Mozkové arachnoidální cysty u dospělých – retrospektivní analýza výsledků chirurgické terapie
Cerebral Arachnoid Cysts in Adults – Retrospective Analysis of the Results of Surgical Treatment
Cerebral arachnoid cysts represent about 1% of all intracranial expansive processes. The authors of the article present a group of 64 patients treated surgically during a 20-year period. Patients with symptomatic arachnoid cysts were treated surgically. The most common clinical manifestation was headache, epileptic seizures, vertigo, nausea, cerebellar symptoms, visual disturbances, etc. The patients were treated by endoscopy technique (16 pts, i.e. 25.0%), cystoperitoneal shunt implantation (22 pts, i.e. 34.4%), open craniotomy and marsupialization (21 pts, i.e. 32.8%) and puncture of arachnoid cysts (5 pts, i.e. 7.8%). According to the authors, endoscopic techniques are a preferred method for their minimal invasiveness, low complication rate, and independence from the implant, such as with cystoperitoneal shunts. Their implantation is simple and universal but they are a subject to risk of possible revisions due to failure. Craniotomy with a resection of the cyst wall and establishment of communication with the surrounding tissues is another alternative. The method provides a good view of and orientation in the surgical field, an opportunity to treat associated lesions and solution of eventual intraoperative complications. Even though there is no dependence on the implant, this method is more invasive than the other. The puncture of arachnoid cysts is used least frequently. This is a simple, minimally invasive but the least effective method. It is reserved primarily for older polymorbid patients.
Key words:
cerebral arachnoid cysts – cystoperitoneal shunt – endoscopy – craniotomy – marsupialization – puncture
:
V. Vybíhal 1
; V. Smrčka 1; M. Smrčka 1; M. Keřkovský 2
:
LF MU a FN Brno
Neurochirurgická klinika
1; LF MU a FN Brno
Radiologická klinika
2
:
Cesk Slov Neurol N 2012; 75/108(4): 480-484
:
Short Communication
Mozkové arachnoidální cysty tvoří přibližně 1 % všech intrakraniálních expanzivních procesů. Autoři v článku prezentují soubor 64 dospělých pacientů léčených chirurgicky v průběhu 20letého období. K operační léčbě byli indikováni pacienti se symptomatickými arachnoidálními cystami. Jejich nejčastějším klinickým projevem byly bolesti hlavy, epileptické záchvaty, vertigo, nauzea, cerebelární symptomatologie, poruchy vizu aj. Pacienti byli ošetřeni endoskopicky (16, tj. 25,0 %), implantací cystoperitoneálního shuntu (22, tj. 34,4 %), otevřenou operací z kraniotomie (21, tj. 32,8 %) a také punkcí cysty (5, tj. 7,8 %). Za preferovanou metodu autoři považují endoskopické ošetření pro její minimální invazivitu, malé procento komplikací a nezávislost na implantátu, jako je tomu u cystoperitoneálních shuntů. Jejich implantace je sice jednoduchá a mají univerzální použití, ale jsou zatíženy rizikem revizí pro jejich případnou nefunkčnost. Další alternativou je ošetření pomocí kraniotomie s resekcí části stěny cysty a vytvoření komunikace s okolím. Metoda umožňuje dobrý přehled a orientaci v operačním poli, možnost ošetřit přidruženou lézi a eventuální peroperační komplikace. Není zde závislost na implantátu, ale je to metoda invazivnější než ostatní. Nejméně často byla použita punkce mozkové arachnoidální cysty, která je jednoduchá a minimálně invazivní, ale nejméně efektivní. Vyhrazena byla především pro starší polymorbidní pacienty.
Klíčová slova:
mozkové arachnoidální cysty – cystoperitoneální shunt – endoskopie – kraniotomie – marsupializace – punkce
Úvod
Mozkové arachnoidální cysty (MAC) jsou nahromaděním tekutiny podobné mozkomíšnímu moku (CSF) ohraničené arachnoideou. Poprvé byly popsány Brightem v roce 1831 jako serózní cysty ve spojení s arachnoideou [1]. MAC představují přibližně 1 % všech intrakraniálních expanzivních lézí [2]. V převážné většině se jedná o vývojové anomálie (primární či kongenitální MAC), ale mohou vzniknout i sekundárně, např. po traumatu, zánětu aj. [3]. Postihují častěji muže než ženy. Větší část MAC se manifestuje během prvních dvou dekád života. Supratentoriálně bývá lokalizováno přibližně 70 % MAC. Nejčastěji se vyskytují v temporální oblasti.
Většina MAC je asymptomatických. Bývají zjištěny náhodně v rámci vyšetřování pacientů z jiných důvodů a nejsou předmětem naší studie. Symptomatické MAC se nejčastěji projevují různými nespecifickými příznaky (bolesti hlavy aj.) nebo příznaky fokálními, korespondujícími s lokalizací MAC. Mohou být také doprovázeny hydrocefalem, zejména v případě MAC zadní jámy lební.
Materiál a metodika
Od roku 1992 do roku 2011 bylo na naší klinice ošetřeno 64 pacientů. V souboru nemocných bylo 34 žen a 30 mužů. Věk nemocných byl v rozmezí od 18 let do 78 let s průměrem 46,0 roku (medián 45,0 let).
Operační léčba byla indikována pouze u pacientů se symptomatickými MAC. V roce 2000 jsme rozšířili možnosti chirurgické terapie o endoskopii. Do té doby bylo ošetřeno celkem 27 pacientů – 16 nemocných pomocí implantace CPS, devět pacientů otevřeně z kraniotomie a dva nemocní punkční technikou (graf 1). Od zavedení endoskopie je tímto způsobem ošetřena necelá polovina pacientů (43,2 %).

Klinické příznaky, kterými se MAC manifestovaly, byly nejčastěji bolesti hlavy u 42 pacientů (65,6 %), epileptické projevy jsme zaznamenali u 10 nemocných (15,6 %), vertigo a nauzea se vyskytovaly u osmi pacientů (12,5 %), cerebelární symptomatologie stejně jako poruchy vizu u sedmi nemocných (10,9 %) a další již méně časté obtíže.
Nejvíce MAC bylo lokalizováno supratentoriálně v temporální oblasti – Sylviova rýha (tab. 1). U čtyř (6,3 %) pacientů byla MAC lokalizována supraselárně a u dvou (3,1 %) pacientů intraventrikulárně.
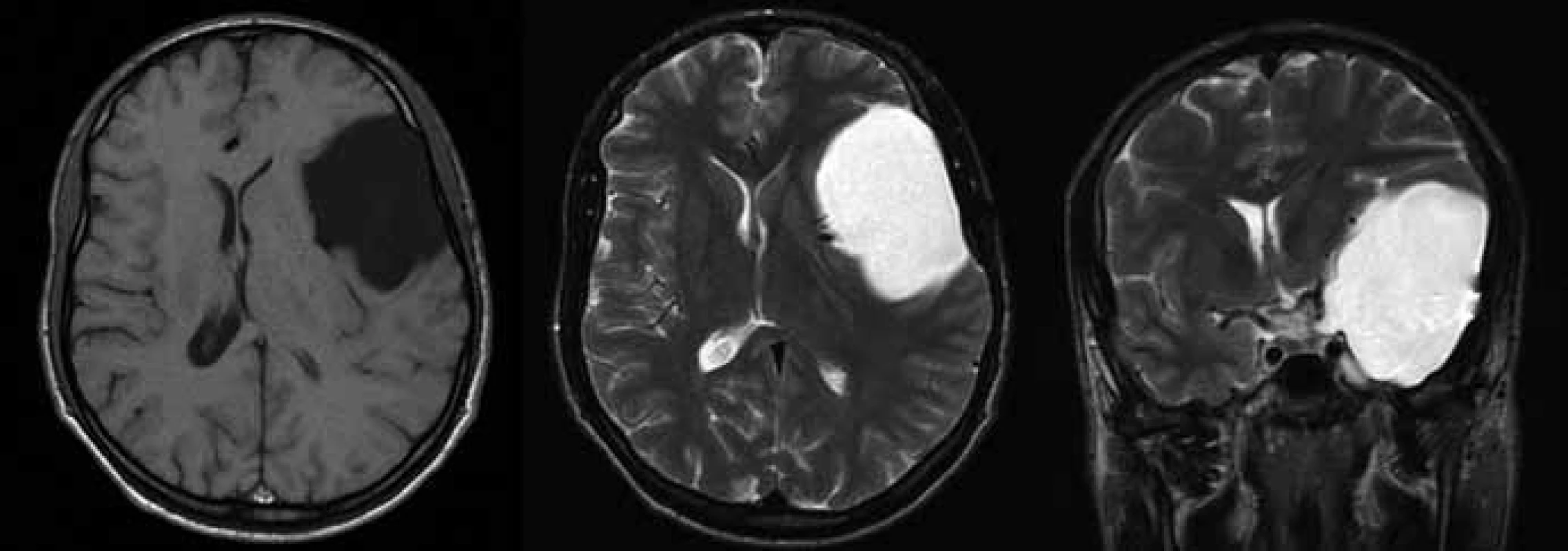
Všichni pacienti byli vyšetřeni pomocí zobrazovacích metod. Jako primární vyšetření podstoupili většinou výpočetní tomografii (CT), která byla následně doplňována magnetickou rezonancí (MR) (obr. 1). Objem MAC se pohyboval v rozmezí od 4,0 ml do 132,5 ml s průměrným objemem 59,9 ml (medián 40,0). Výpočet byl proveden na základě všeobecně používaného vzorce:
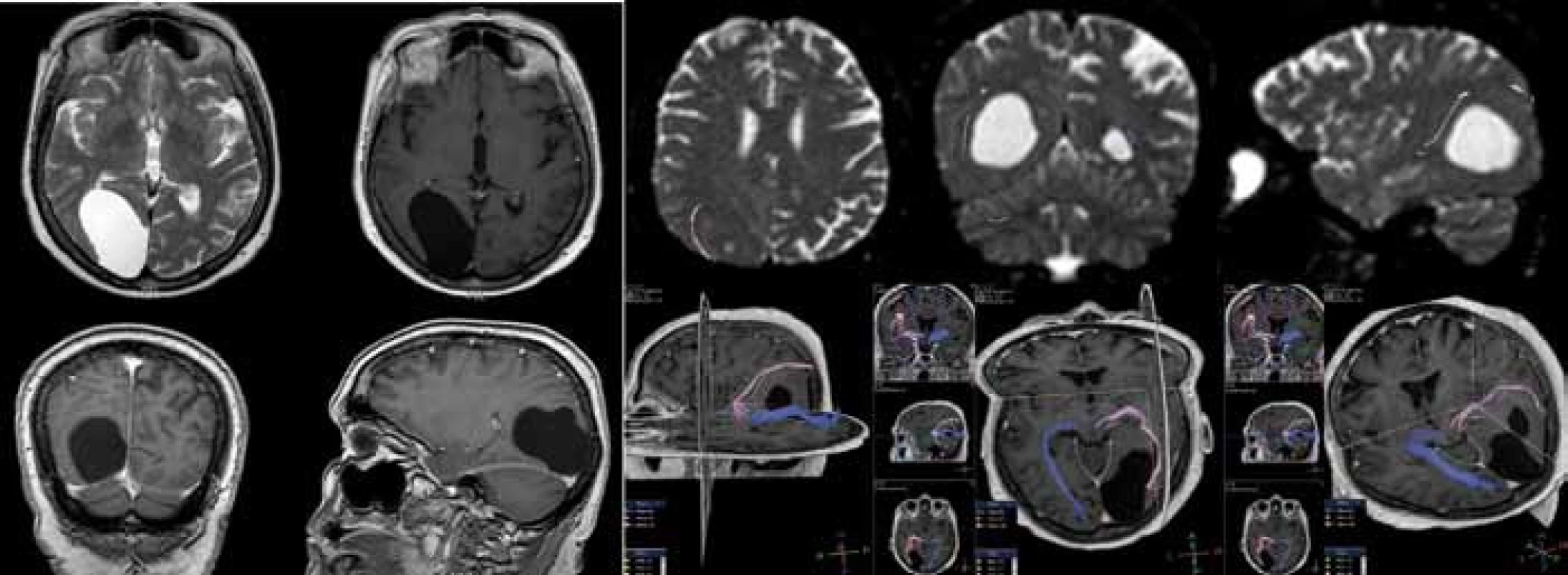
Endoskopicky bylo ošetřeno 16 (25,0 %) pacientů. Operace spočívá ve vytvoření komunikace buď s bazálními cisternami (cystocisternostomie), nebo s komorovým systémem (cystoventrikulostomie). Při vyšším riziku uzavření stomie jsme použili stent. Za nezbytnou považujeme rozvahu o taktice provedení výkonu včetně případného doplnění speciálních MR technik (obr. 2). Dalších 21 (32,8 %) pacientů bylo ošetřeno otevřeně z kraniotomie, při které byla provedena parciální resekce stěny cysty (tzv. marsupializace) s vytvořením komunikace do subarachnoidálních prostor (SAS). Implantace cystoperitoneálního shuntu (CPS) byla provedena u 22 (34,4 %) nemocných (obr. 3) a punkce, popřípadě stereopunkce u pěti (7,8 %) pacientů. V pěti (7,8 %) případech byly provedeny dva různé výkony nutné k definitivnímu ošetření MAC.
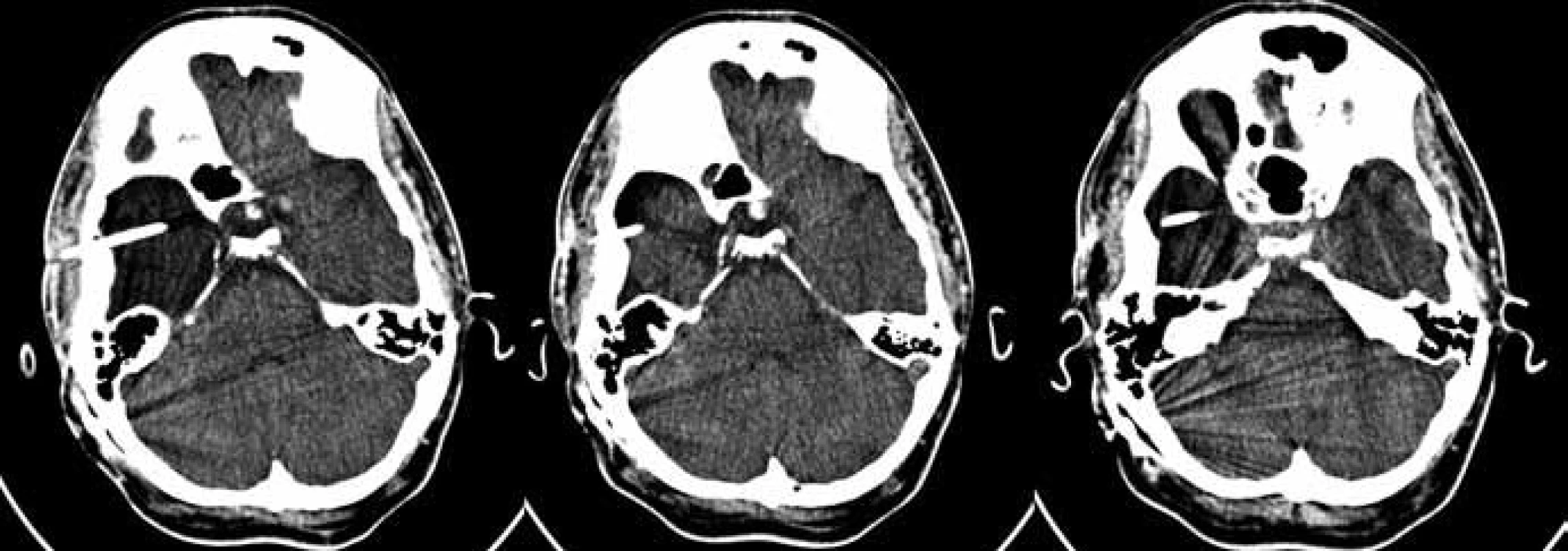
V retrospektivně analyzovaném souboru byli pacienti sledováni v rozmezí od 3 do 224 měsíců s průměrnou délkou 117,0 měsíce (medián 113,9).
Výsledky
56,3 % (9/16) pacientů, kteří podstoupili endoskopický výkon, udávalo, že jsou bez potíží či mají pouze minimální potíže. 25,0 % (4/16) nemocných mělo částečné zlepšení původních potíží, z nichž dva (12,5 %) pacienti udali zlepšení předoperační symptomatologie o méně než 50 %. U tří (18,8 %) pacientů, kteří byli operováni endoskopicky, bylo nutno pro nedostatečný efekt operace implantovat CPS. U jednoho pacienta (6,3 %) bylo nutno provést operační revizi a korigovat polohu stentu a u dalšího pacienta byla ještě revize pro prosakování CSF, celkem tedy bylo nutno revidovat 12,5 % pacientů. U jedné pacientky byla přechodně lehká paréza nervus oculomotorius, která se spontánně upravila.
Pacienti, kteří byli operováni otevřeně z kraniotomie, udávali výrazné zlepšení či pouze minimální potíže ve 42,9 % (9/21). Částečné zlepšení bylo zaznamenáno u 19,0 % (4/21) nemocných. Minimální zlepšení či přetrvávání jiných potíží udávalo 19,0 % (4/21). Jednomu pacientovi (4,8 %) operovanému otevřeně z kraniotomie byl následně implantován CPS. Dva (9,5 %) pacienti byli revidování pro krvácivou komplikaci, u jednoho (4,8 %) nemocného byla ještě rozšířena resekce stěny MAC a další nemocný byl reoperován pro výrazný pnemocefalus.
V případě pacientů ošetřených implantací CPS nebylo nutno použít žádnou další modalitu k definitivnímu ošetření. Nicméně u 27,3 % (6/22) nemocných bylo nutno provést revizi CPS pro jeho malfunkci. Výrazné zlepšení či minimální potíže udávalo 54,5 % (12/22) operovaných, částečné zlepšení pět (22,7 %) pacientů a minimální či žádné zlepšení pět (22,7 %) nemocných.
Provedení punkce jsme indikovali u pěti pacientů, většinou v případě starších polymorbidních nemocných. U jednoho (20,0 %) pacienta jsme následně implantovali CPS. Jedna pacientka (20,0 %) udávala výrazné zlepšení stavu. Částečné zlepšení stavu bylo zaznamenáno u dvou (40,0 %) nemocných a u stejného procenta pacientů nebyl stav podstatněji operací ovlivněn.
Intracystický tlak byl měřen jednorázově během operace a pohyboval se v rozmezí od 60 do 210 mm vodního sloupce, s průměrnou hodnotou 157,5 mm vodního sloupce. Byl ale změřen pouze u 65,6 % nemocných – rozhodnutí záleželo na každém operatérovi.
Mortalita operovaných pacientů byla 0 %. Šest (9,4 %) nemocných v průběhu sledování zemřelo bez souvislosti s operačním výkonem a v důsledku jiných diagnóz.
V celém souboru operovaných došlo pouze k jednomu zhoršení celkového stavu u pacienta s MAC lokalizovanou temporálně vpravo III. typu dle Galassiho klasifikace. Pacient byl nejprve operován endoskopicky a následně byl implantován CPS. Původní potíže, především bolesti hlavy, zůstaly beze změn a navíc se přidal tremor pravostranných končetin s akcentací na pravé dolní končetině, který se zvýrazňoval při stresových situacích. Na zobrazovacích metodách došlo k postupné výrazné regresi MAC.
Komplikovaný pooperační průběh s přechodným zhoršením neurologického stavu jsme zaznamenali u objemných MAC temporální oblasti (dva pacienti operovaní otevřeně z kraniotomie a jeden nemocný endoskopicky). Za příčinu považujeme náhlou a prudkou dekompresi s posunem mozkových struktur.
Vzhledem k tomu, že nebylo možné u větší části sledovaných pacientů získat pooperační kontroly zobrazovacími metodami s delším časovým odstupem, nebylo provedeno celkové objemové srovnání redukce MAC po operaci. U těch pacientů, u kterých jsme mohli srovnat velikost cysty před operací a po ní, se nám jeví, že míra redukce MAC neodpovídá stupni klinického zlepšení a naopak.
Diskuze
Jednou z nejvíce akceptovaných hypotéz vzniku MAC je jejich embryonální původ, kdy vznikají dysgenezí během embryonálního vývoje SAS, které se formují ve 4. měsíci [4]. Vznikají tzv. hydraulickou disekcí, kdy po perforaci stropu 4. komory začíná CSF proudit z primitivního komorového systému do cisterna magna a oddělí od sebe arachnoideu a piu mater. Arachnoidální membrána, která je normálně tvořena dvěma pevně spojenými vrstvami, není ještě v tomto období plně diferencována, a může tak dojít k vniknutí CSF mezi vrstvy arachnoidey. Tímto mechanizmem pak vznikají MAC. Další hypotézy předpokládají, že ke vzniku MAC dochází na podkladě sekrece substancí do SAS z venózního systému [4]. Robinson se domnívá, že MAC vznikají sekundárně při fokální mozkové hypoplazii [5]. Mohou vzniknout ale i sekundárně, například po traumatu, zánětu aj. [3].
Mechanizmus, proč cysty začínají expandovat a stávají se symptomatickými, není dosud zcela jasný. Jednou z možností je v případě komunikujících MAC mechanizmus jednocestné chlopně, kdy se tekutina dostává dovnitř cysty prostřednictvím arteriálních pulzací [6]. Další zvažovanou možností je přímá sekrece tekutiny z výstelky cysty na základě vyšetření elektronovou mikroskopií s nálezem mikroklků buněk vnitřní výstelky cysty [7]. Za méně pravděpodobný se pak považuje osmotický gradient indukovaný díky akumulované intracystické tekutině [8].
Ze zobrazovacích metod je u MAC nejčastěji využívána CT a MR. MR má oproti CT řadu výhod – pomáhá v diferenciální diagnostice, např. ve vyloučení cystického tumoru, dovoluje přesné zhodnocení anatomických poměrů a naplánování místa vytvoření stomie.
MAC temporální oblasti jsou klasifikovány podle Galassiho na základě CT obrazu do tří typů [9]. I. typ je malá bikonvexní MAC lokalizovaná temporobazálně, nechová se většinou expanzivně a na CT cisternogramu bývá prokázána komunikace se SAS. V případě II. typu MAC zaujímá proximální a střední část Sylviovy rýhy, částečně komunikuje se SAS. III. typ pak vyplňuje celou Sylviovu rýhu, působí přetlak středočárových struktur, vyklenování šupiny temporální kosti a minimálně komunikuje se SAS. MAC zadní jámy lební jsou podle Araie a Sata [10] rozděleny na retrocerebelární (středočárové či hemisférické) a na lokalizované v oblasti mostomozečkového koutu.
Di Rocco [4] popisuje zvýšený ICP u pacientů s většími MAC u dětí a normální ICP u menších MAC. Naopak Helland a Wester [11] nalezli normální ICP u všech pacientů. Naměřený ICP neměl vliv na stupeň redukce objemu MAC a na výsledný klinický stav. Autoři si myslí, že tlak uvnitř MAC může být vyšší než v okolí a symptomy mohou být způsobeny tlakovým gradientem, nebo se jedná o změnu poddajnosti (kompliance) mozku, která pak alteruje dynamiku ICP. V našem souboru byli pacienti jak s normálním ICP, tak s elevovaným, a to zejména u větších MAC s mass efektem.
MAC se projevují celým spektrem klinických příznaků, ať už nespecifických (např. bolesti hlavy) či specifických (fokálních). Tyto příznaky bývají způsobeny kompresí či iritací přilehlých struktur, mass efektem či poruchou cirkulace mozkomíšního moku [1]. MAC mohou způsobit podle některých autorů i kognitivní [12] či metabolický deficit [13], ovlivnit mozkovou perfuzi [14]. Velice specifickou, ale vzácnou klinickou manifestací je u dětí tzv. syndrom kývavé panenky, kterým se projevují supraselární MAC. Kromě toho se mohou manifestovat poruchami funkce hypofýzy nebo příznaky z komprese zrakových nervů. MAC lokalizované v zadní jámě lební jsou často doprovázeny hydrocefalem kvůli obstrukci cirkulace CSF. Pro temporální MAC je charakteristické, že se mohou projevit intracystickým krvácením s případným vznikem subdurálního hematomu, často po lehkém traumatu [15]. Příčinou je přítomnost probíhajících cév v MAC, které jsou náchylné k ruptuře. Spontánní ruptury MAC mohou být pak doprovázeny vznikem subdurálních hygromů [16]. V literatuře jsou i zmínky o spontánní regresi MAC, často asociované s traumatem mozku [17]. Jako mechanizmus je pak předpokládáno vytvoření komunikace se subdurálním prostorem nebo SAS, kde dochází ke vstřebávání. Jako méně pravděpodobný je zvažován také přímý transport přes stěnu cysty.
MAC, které se projevují symptomy zvýšeného intrakraniálního tlaku či fokálními příznaky, jsou indikovány k chirurgické léčbě. Zvažovány k intervenci bývají i asymptomatické MAC s progredující velikostí na vyšetřeních zobrazovacími metodami z důvodu možné komprese okolních struktur a rizika vzniku intracystického či subdurálního krvácení. Nicméně názory na léčbu progredujících asymptomatických MAC se různí.
Není ani zcela jednotný názor na způsob chirurgického ošetření MAC. V úvahu přichází punkce, otevřená operace s částečnou resekcí její stěny, endoskopický výkon nebo zavedení CPS, popřípadě cystosubdurálního shuntu [18]. Punkce cysty je minimálně invazivní výkon, ale je zatížena vyšším procentem selhání. V současné době bývá preferovanou metodou endoskopická fenestrace cysty [19]. Její výhodou je minimální invazivita, poměrně vysoká úspěšnost, ale nelze ji použít u zcela všech MAC. Výhodou implantace CPS je její bezpečnost, jednoduchost a univerzální použití, ale nevýhodou jsou možné revize pro selhání systému, nemožnost ošetřit multilokulární cysty a přidružené léze. Vyšší procento revizí bylo zaznamenáno v případě použití ventilů neprogramovatelných [20]. Výhodou otevřené operace je možnost jejího širokého použití, dobrá orientace v operačním poli, ošetření případné přidružené léze. Nevýhodou však větší invazivita a riziko možných komplikací spojených s extenzivním výkonem. V případě MAC temporální oblasti někteří autoři preferují tuto techniku, protože se v blízkosti nacházejí důležité struktury – především cévy a nervy a bývá zde větší riziko recidivy pro výraznější tloušťku arachnoidální membrány a její zvýšenou vaskularitu, které mohou urychlit časný uzávěr stomie [21]. Použitá metoda by měla být vhodně indikována se snahou o použití minimálně invazivních technik. Možná je i kombinace jednotlivých technik, např. otevřená mikrochirurgická operace s endoskopickou asistencí. Mottolese et al [20] kombinují endoskopickou techniku s implantací CPS (u dětí). Důvodem je dosažení kolapsu MAC. Po jeho dosažení postupně zvyšují přepouštěcí tlak ventilu na maximum a snaží se následně shunt extrahovat. To se jim podařilo u 60 % pacientů. V případě supraselárních cyst Wang et al doporučují duální endoskopickou fenestraci – provedení cystocisternostomie společně s cystoventrikulostomií [22]. U multilokulárních cyst bývá endoskopická terapie nejméně úspěšná a je prospěšná především jako nástroj ke zjednodušení anatomické situace. Většinou je pak následována implantací CPS.
Vzhledem k tomu, že se jedná o benigní léze, je nutné připomenout, že je nezbytné se snažit snížit množství komplikací na minimum. K tomu je třeba využít všech nástrojů, které jsou vhodné pro bezpečnost a efektivitu procedury. Jedním z nich je navigace, užitečná zejména u endoskopických výkonů. Dovoluje naplánovat vhodnou trajektorii a šetřit důležité struktury. Výhodná je především u multilokulárních intraparenchymových cyst. Je ale nutné mít na mysli, že neposkytuje on-line informace a může dojít k posunu struktur, zejména při odpuštění většího množství CSF. Další možností je použití peroperačních zobrazovacích metod (MR, CT, sonografie), z nichž nejdostupnější je samozřejmě použití ultrazvuku.
Podle Mottolese et al je korelace mezi zlepšením klinických obtíží a nálezu regrese velikosti MAC na zobrazovacích metodách [20], ale podle jiných nemusí regrese velikosti MAC na zobrazovacích metodách znamenat ústup klinických obtíží a naopak [23,24]. V případě současného výskytu hydrocefalu pak bývají lepší výsledky u pacientů bez hydrocefalu než u pacientů s asociovaným hydrocefalem [25].
Závěr
Chirurgická léčba MAC je poměrně efektivní metoda, která vede ke zlepšení klinických potíží pacientů. Za preferovanou léčbu považujeme endoskopickou techniku pro její minimální invazivitu, malé procento komplikací a také proto, že zde není závislost na implantátu jako u drenážních operací. Nicméně není ji možné použít ve všech případech, limitací mohou být především anatomické poměry. Implantace CPS je jednoduchý výkon a má univerzální použití, ale je zatížena rizikem jeho případných revizí. Zvažována by měla být, pokud nelze ošetřit MAC endoskopicky, popřípadě při jejím selhání. Další alternativou je kraniotomie s marsupializací, jejíž výhodou je dobrý přehled a snadnější orientace v operačním poli, možnost ošetření přidružených lézí a případných komplikací. Zbavuje pacienta závislosti na CPS, ale je invazivnější než ostatní metody a má větší riziko komplikací. Punkce je nejméně efektivní metoda, kterou lze využít především u starších polymorbidních pacientů. Nutný je individuální přístup, komplexní zhodnocení situace včetně anatomických poměrů a následné zvolení optimální metody a léčebné strategie.
Zkratky
MAC mozkové arachnoidální cysty
CT výpočetní tomografie
MR magnetická rezonance
ICP intrakraniální tlak (IntraCranial Pressure)
CSF mozkomíšní mok (CerebroSpinal Fluid)
CPS cystoperitoneální shunt
SAS subarachnoidální prostory (SubArachnoid Spaces)
MUDr. Václav Vybíhal
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: vvybihal@fnbrno.cz
Přijato k recenzi: 2. 12. 2011
Přijato do tisku: 30. 1. 2012
Sources
1. Vega-Sosa A, de Obieta-Cruz E, Hernández-Rojas MA. Intracranial arachnoid cyst. Cir Cir 2010; 78(6): 551–556.
2. Rengachary SS, Kennedy JD. Intracranial arachnoid cysts and ependymal cysts. In: Wilkins RH, Rengachary SS (eds). Neurosurgery. 2nd ed. New York: McGraw-
-Hill 1996: 3709–3728.
3. Choi JU, Kim DS. Pathogenesis of arachnoid cyst: congenital or traumatic? Pediatr Neurosurg 1998; 29(5): 260–266.
4. Di Rocco C. Arachnoid cysts. In: Youmans JR (ed). Youmans Neurological Surgery. 4th ed. Philadelphia: WB Saunders 1997: 967–994.
5. Robinson RG. The temporal lobe agenesis syndrome. Brain 1964; 87: 87–106.
6. Santamarta D, Aguas J, Ferrer E. The natural history of arachnoid cyst: endoscopic and cine-mode MRI evidence of a slit-valve mechanism. Minim Invasive Neurosurg 1995; 38(4): 133–137.
7. Go KG, Houthoff HF, Blaauw EH, Havinga P, Hartsuiker J. Arachnoid cysts of the sylvian fissure. Evidence of fluid secretion. J Neurosurg 1984; 60(4): 803–813.
8. Sandberg DI, McComb JE, Krieger MD. Chemical analysis of fluid obtained from intracranial arachnoid cysts in pediatric patients. J Neurosurg 2005;
103 (Suppl 5): 427–432.
9. Galassi E, Tognetti F, Gaist G, Fagioli L, Frank F, Frank G. CT scan and metrizamide CT cisternography in arachnoid cysts of the middle cranial fossa: classification and pathophysiological aspects. Surg Neurol 1982; 17(5): 363–369.
10. Arai H, Sato K. Posterior fossa cysts: clinical,
neuroradiological and surgical features. Childs Nerv Syst 1991; 7(3): 156–164.
11. Helland CA, Wester K. Intracystic pressure in patients with temporal arachnoid cysts: a prospective study of preoperative complaints and postoperative outcome. J Neurol Neurosurg Psychiatry 2007; 78(6): 620–623.
12. Raeder MB, Helland CA, Hugdahl K, Wester K. Arachnoid cysts cause cognitive deficits that improve after surgery. Neurology 2005; 64(1): 160–162.
13. Lang W, Lang M, Kornhuber A, Gallwitz A, Kriebel J. Neuropsychological and neuroendocrinological disturbances associated with extracerebral cysts of the anterior and middle cranial fossa. Eur Arch Psychiatry Neurol Sci 1985; 235(1): 38–41.
14. Sgouros S, Chapman S. Congenital middle fossa arachnoid cysts may cause global brain ischaemia: a study with 99Tc-hexamethylpropyleneamineoxime single photon emission computerized tomography scans. Pediatr Neurosurg 2001; 35(4): 188–194.
15. Mori K, Yamamoto T, Horinaka N, Maeda M. Arachnoid cyst is a risk factor for chronic subdural hematoma in juveniles: twelve cases of chronic subdural hematoma associated with arachnoid cyst. J Neurotrauma 2002; 19(9): 1017–1027.
16. Poirrier AL, Ngosso-Tetanye I, Mouchamps M, Misson JP. Spontaneous arachnoid cyst rupture in a previously asymptomatic child: a case report. Eur J
Paediatr Neurol 2004; 8(5): 247–251.
17. Beltramello A, Mazza C. Spontaneuous disappearance of a large middle cranial fossa arachnoid cyst. Surg Neurol 1985; 24(2): 181–183.
18. Wester K. Arachnoid cysts in adults: experience with internal shunts to the subdural compartment. Surg Neurol 1996; 45(1): 15–24.
19. Karabatsou K, Hayhurst C, Buxton N, O’Brien DF, Mallucci CL. Endoscopic management of arachnoid cysts: an advancing technique. J Neurosurg 2007; 106 (Suppl 6): 455–462.
20. Mottolese C, Szathmari A, Simon E, Ginguene C,
Ricci-Franchi AC, Hermier M. The parallel use of endoscopic fenestration and a cystoperitoneal shunt with programmable valve to treat arachnoid cysts: experience and hypothesis. J Neurosurg Pediatrics 2010; 5(4): 408–414.
21. Levy ML, Wang M, Arayan HE, Yoo K, Meltzer H.
Microsurgical keyhole approach for middle fossa arachnoid cyst fenestration. Neurosurgery 2003; 53(5): 1138–1145.
22. Wang JC, Heier L, Souweidane MM. Advances in the endoscopic management of suprasellar cysts in children. J Neurosurg 2004; 100 (Suppl 5): 418–426.
23. Helland CA, Wester K. A population based study of intracranial arachnoid cysts: clinical and neuroimaging outcomes following surgical cyst decompression in adults. J Neurol Neurosurg Psychiatry 2007; 78(10): 1129–1135.
24. Häckel M, Homolková H. Mozkové arachnoidální cysty. Výsledky chirurgické léčby 9 nemocných v letech 2000–2003. Cesk Slov Neurol N 2005; 68/101(5): 316–322.
25. Fewel ME, Levy ML, McComb JG. Surgical treatment of 95 children with 102 intracranial arachnoid cysts. Pediatr Neurosurg 1996; 25(4): 165–173.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 4
Most read in this issue
- Cerebral Arachnoid Cysts in Adults – Retrospective Analysis of the Results of Surgical Treatment
- Rhythmic Movement Disorder
- Isolated Sphenoid Sinusitis – Possible Cause of Headache and Severe Complications
- The Oswestry Questionnaire, Version 2.1a – Results in Patients with Lumbar Spinal Stenosis, Comparison with the Previous Version of the Questionnaire

