Léčba neurogenního hyperaktivního detruzoru po spinálním poranění aplikací botulinumtoxinu A. Porovnání endoskopické subslizniční a intramuskulární aplikace
Treatment of Neurogenic Detrusor Overactivity after Spinal Cord Injury Using Botulinum A Toxin. Comparison of Endoscopic Submucosal and Intramuscular Route of Application
Treatment of neurogenic detrusor overactivity using botulinum A toxin is currently the approach of choice in patients refractory to antimuscarinic drugs. This study compares the changes of urodynamic parameters with different routes of botulinum A toxin administration – submucosal and intramuscular. The study monitors changes in selected urodynamic parameters and the number of incontinence episodes as well as an improvement in the quality of life.
Material and methods:
Fifteen patients with neurogenic detrusor overactivity after spinal cord injury aged 25 to 46 year were randomized into two groups to receive 300 U of botulinumtoxin (Botox®) by cystoscopic approach. In group A, the drug submucosaly and it was administered into detrusor in group B. Urodynamic parameters and the quality of life were evaluated before and 12 weeks after the treatment.
Results:
The authors present results obtained from 15 patients. The number of incontinence episodes decreased after the treatment in about 77% of patients in both groups. Maximum cystometric capacity increased from 236.6 ±76.1 ml to 456 ±73.8 ml in the group with submucosal application (p <0.05) and from 242.7 ±96.8 ml to 432.8 ±79.1 ml in the group with the application into detrusor (p <0.05). Maximum detrusor pressure during involuntary contraction decreased (p <0.05).
Conclusion:
Administration of botulinum A toxin within 3 months after treatment increased the maximum cystometric capacity, decreased maximum detrusor pressure during involuntary detrusor contraction and reduced the number of incontinence episodes. These preliminary results suggest that both methods of administration are comparable.
Key words:
botulinum toxin – detrusor overactivity – incontinence – submucosal application
Authors:
V. Šámal 1; J. Mečl 1; J. Šrám 2
Authors‘ workplace:
Krajská nemocnice Liberec, a. s.
Urologické oddělení
1; Krajská nemocnice Liberec, a. s.
Traumatologicko-ortopedické centrum, Spinální jednotka
2
Published in:
Cesk Slov Neurol N 2012; 75/108(2): 197-202
Category:
Original Paper
Overview
Léčba neurogenního hyperaktivního detruzoru aplikací botulinumtoxinu A je dnes metodou volby pro pacienty refrakterní na standardní terapii anticholinergiky. Práce porovnává efekt rozdílných způsobů aplikace léku. Sleduje změnu vybraných urodynamických parametrů, změnu počtu epizod inkontinence a vliv na kvalitu života.
Soubor a metodika:
Soubor 15 pacientů s neurogenní hyperaktivitou detruzoru po spinálním poranění byl tvořen muži ve věku 25–46 let randomizovanými do dvou skupin, v prospektivní otevřené studii. Léčba byla provedena cystoskopickou aplikací 300 U botulinumtoxinu (Botox®). Ve skupině A byla provedena aplikace léku subslizničně, ve skupině B aplikace léku do detruzoru. Vyhodnocení sledovaných urodynamických parametrů a dotazníků kvality života se uskutečnilo 12 týdnů po léčbě.
Výsledky:
Autoři prezentují výsledky urodynamických parametrů po třech měsících sledování u 15 pacientů. U obou skupin pacientů došlo po léčbě ke snížení počtu epizod inkontinence o 77 %. V obou skupinách nastalo významné zvýšení cystometrické kapacity z 236,6 ± 76,1 ml na 456 ± 73,8 ml (p < 0,05) u skupiny se subslizniční aplikací, resp. z 242,7 ± 96,8 ml na 432,8 ± 79,1 ml (p < 0,05) u skupiny s aplikací léku do detruzoru. Došlo také k významnému poklesu maximálního detruzorového tlaku (p < 0,05).
Závěr:
Aplikace botulinumtoxinu vedla ve sledovaném období k významnému zvýšení cystometrické kapacity, poklesu maximálního detruzorového tlaku a významnému snížení epizod inkontinence. Z předběžných výsledků jsme neprokázali rozdíl mezi oběma formami aplikace.
Klíčová slova:
botulinumtoxin – hyperaktivní detruzor – inkontinence – subslizniční aplikace
Úvod
Botulinumtoxin (BTA) patří mezi nejúčinnější neurotoxiny. První významný klinický objev provedl v roce 1953 Vernon Brooks. Aplikoval experimentálně injekčně BTA do hyperaktivních, spastických svalů a popsal blokádu uvolňování acetylcholinu, která způsobuje reverzibilní chemickou paralýzu v okolí, kam byl toxin aplikován. Americký oftalmolog Alan Scott poprvé použil v klinické praxi BTA v roce 1981 k léčbě strabizmu, několik let předtím již ale testoval použití toxinu na břišních svalech u opic.
V příčně pruhovaném svalu BTA způsobuje blokádu presynaptického uvolnění acetylcholinu (ACH) na neuromuskulární ploténce, která vede v intervalu 24–48 hod k paralýze svalu. Efekt toxinu je reverzibilní, v horizontu několika měsíců (6 až 9) dochází k jevu zvanému „nerve sprouting“, kdy vedle nervového zakončení blokovaného toxinem nastane pučení nového zakončení. Toxin nepůsobí na postganglionární přenos [1].
Vliv BTA na detruzor močového měchýře byl v posledních letech intenzivně studován. Původní práce předpokládaly stejný efekt jako u příčně pruhovaného svalu. Při zkoumání efektu BTA na detruzor močového měchýře bylo prokázáno, že nezpůsobuje pouze presynaptickou blokádu uvolňování ACH, ale také snižuje uvolňování neuropeptidů (substance P, calcitonine gene-related peptid) [2]. Svoji roli zde hraje zejména urotel a subslizniční pojivová tkáň s hustou sítí senzitivních aferentních nervových vláken. Nižší úroveň uvolňování ATP snižuje excitabilitu P2X3 receptorů senzitivních vláken urotelu a vaniloidních TRPV1 receptorů [3]. Je také prokázáno, že aplikace BTA zmenšuje koncentraci „nerve growth factor“ v tkáni detruzoru, což vede ke snížení přenosu přes aferentní vlákna, zejména demyelinizovaná C-vlákna, která mají zásadní význam v patogenezi hyperaktivity detruzoru [4]. Mechanizmus účinku BTA na detruzor močového měchýře se tak ve světle dnešních poznatků jeví jako složitější a komplexní jev, kdy jsou patrně ovlivněny i aferentní nervové dráhy. Histologické studie detruzoru močového měchýře neprokázaly změny v denzitě svaloviny, svalovou atrofii či jiné degenerativní změny ani po opakovaných aplikacích BTA. Oproti nálezu na příčně pruhovaném svalu neprokázaly ovšem ani „nerve sprouting“ po aplikaci BTA, což potvrzuje jiný mechanizmus účinku u hladké svaloviny [5]. Při variabilní síle detruzoru může při podání léku do detruzoru dojít k náhodnému systémovému podání s projevem nežádoucích účinků léku. Kromě standardní cesty aplikace do detruzoru močového měchýře jsou proto nyní intenzivně zkoumány i jiné formy aplikace, zejména subslizniční podání nebo instilace roztoku léku.
Soubor a metodika
Soubor tvořili pacienti s neurogenní detruzorovou hyperaktivitou v důsledku spinálního poranění. Jednalo se o muže ve věku od 25 do 46 let po spinálním poranění. Průměrná délka od spinálního poranění byla 50 měsíců (13–154 měsíců). Osm pacientů bylo po poranění krční míchy a sedm pacientů po poranění hrudní míchy, dle klasifikace American Spinal Injury Association (ASIA) bylo 13 pacientů kategorie ASIA A, jeden pacient kategorie ASIA B a jeden pacient kategorie ASIA C. Do studie byli zařazeni pacienti, u kterých přetrvávala inkontinence moči při zavedené anticholinergní terapii a zvládali techniku intermitentní autokatetrizace. Podmínkou byl stabilní neurologický stav s minimálním odstupem od spinálního poranění 12 měsíců, schopnost provádět intermitentní autokatetrizaci a vstupní počet epizod inkontinence více než pět za sledované pětidenní období. Vylučujícím kritériem pak riziko myasthenie gravis, přítomnost cystolitiázy v posledních šesti měsících před aplikací léku, nádorová onemocnění orgánů malé pánve, stavy po radikálních operacích v malé pánvi v posledním roce a stavy po operacích, které mohou ovlivnit hyperaktivitu detruzoru (např. operace cystokély, operace pro inkontinenci, transuretrální resekce prostaty). Neurogenní hyperaktivita detruzoru byla před zařazením do studie potvrzena urodynamickým vyšetřením. Délka základní části studie je 12 týdnů, po které navazuje dlouhodobé sledování pacientů. Při zahájení studie a ve 12. týdnu bylo provedeno urodynamické vyšetření – plnící cystometrie. Vyšetření bylo prováděno vleže, přístrojem Uromic 6 (Medkonsult s.r.o), použili jsme 8FR uretrální a rektální katétr. K plnění jsme použili fyziologický roztok a rychlost plnění byla 50 ml/min. Mezi sledované urodynamické parametry jsme zařadili cystometrickou kapacitu (CC), objem močového měchýře při první netlumené kontrakci detruzoru (BCIDC), maximální detruzorový tlak při netlumené kontrakci (Pdetmax) a compliance močového měchýře. Urodynamické vyšetření a jeho vyhodnocení jsme prováděli v souladu s doporučením International Continence Society [6].
Mikční deník byl vyplňován pět dní před každou návštěvou. Podle mikčního deníku je vyhodnocován počet epizod inkontinence, počet mikcí/katetrizací za sledované období a mikční objem.
Anticholinergní terapie byla vysazena minimálně týden před vstupním urodynamickým vyšetřením a po celou dobu studie. K léčbě byl použit preparát Botox® v dávce 300 U, BTA byl aplikován do 30 míst (10 U/ml) močového měchýře mimo trigona. Pacienti byli randomizováni do dvou skupin metodou otevření zaslepené obálky. Ve skupině A byl u devíti pacientů BTA aplikován subslizničně a ve skupině B u šesti pacientů do detruzoru močového měchýře. Výkon byl prováděn v krátké celkové anestezii rigidním 21FR cystoskopem s použitím flexibilní endoskopické 23G jehly. Všichni pacienti po spinálním poranění s neurogenní detruzorovou hyperaktivitou v našem souboru používali před léčbou anticholinergní terapii a techniku čisté intermitentní autokatetrizace, přesto nebylo dosaženo dobré kontinence. Permanentní močový katétr jsme nechali po výkonu zavedený po dobu 24 hod a po jeho odstranění se pacienti vraceli k technice intermitentní autokatetrizace. Vliv léčby na kvalitu života jsme posuzovali podle standardizovaného dotazníku Incontinence Quality of Life Questionnaire (I-QOL). Efektivitu léčby měříme změnou sledovaných urodynamických parametrů a poklesem počtu epizod inkontinence za sledované období. Stav kontinence pacienta byl definován jako stav ve 12. týdnu léčby, kdy pacient přestal nosit inkontinenční pomůcky (pleny, kondomové urinály).
Pro analýzu skupiny jsme použili párový t test. K sledování změn mezi jednotlivými skupinami studie jsme použili Mann-Whitney test. Jako hladinu významnosti stanovujeme p < 0,05. K analýze byl použit statistický software NCSS [7]. Výsledky jsou prezentovány jako průměr ± ± směrodatná odchylka výběru.
Studie byla schválena Multicentrickou etickou komisí při Krajské nemocnici Liberec, a.s., a Státním úřadem pro kontrolu léčiv.
Výsledky
Při aplikaci jsme nezaznamenali žádné komplikace. U jednoho pacienta jsme po aplikaci BTA do detruzoru pozorovali celkovou únavu a slabost, která do 24 hod odezněla. Výsledky shrnuje tab. 1. Průměrný počet epizod inkontinence ve sledovaném období (5 dní) před zahájením léčby byl 13,3 ± 4,7. Ve skupině pacientů se subslizniční aplikací BTA došlo ke zlepšení z průměrných 13,4 ± 5,3 epizod inkontinence na 3,1 ± 1,7 epizody inkontinence za sledované období, tj. o 77 % (p < 0,05). Ve skupině pacientů s aplikací léku do detruzoru došlo ke zlepšení kontinence z průměrných 13,2 ± 4,6 epizod na 3 ± 1,9 epizody inkontinence za sledované období, tj. o 77 % (p < 0,05). Významně poklesl počet mikcí/katetrizací po léčbě. Ve skupině léčené subslizniční aplikací z 38,6 ± 4,8 na 29 ± 4,1 (p < 0,05) a z 41,8 ±11,2 na 32,2 ± 8,5 ve skupině léčené aplikací BTA do detruzoru (p < 0,05).
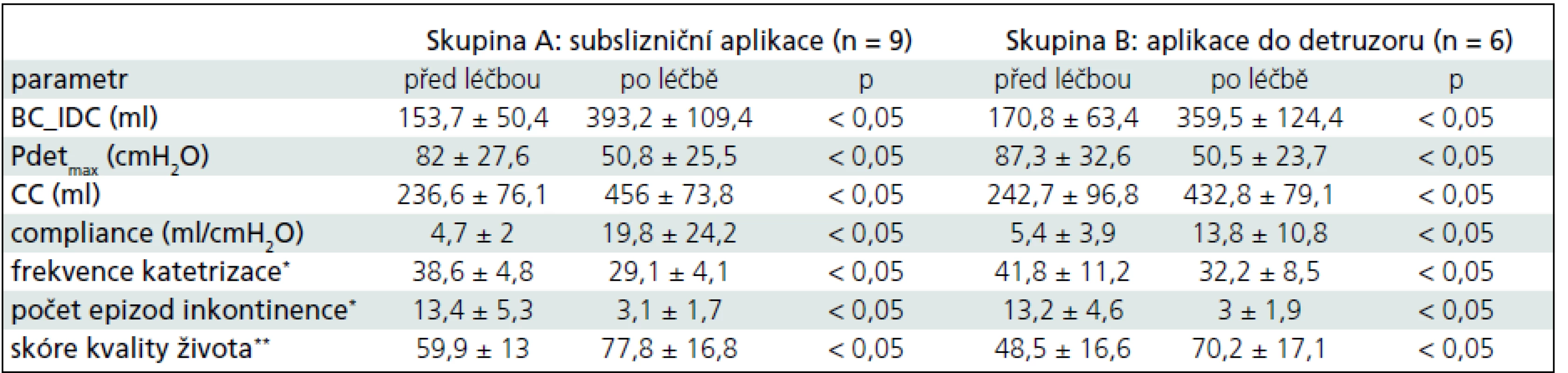
V obou skupinách bylo pozorováno významné zlepšení sledovaných urodynamických parametrů. Došlo ke zvětšení cystometrické kapacity z 236,6 ± 76,1 ml na 456 ± 73,8 ml (p < 0,05) u skupiny se subslizniční aplikací, resp. z 242,7 ± 96,8 ml na 432,8 ± 79,1 ml (p < 0,05) u skupiny s aplikací léku do detruzoru. Dále bylo pozorováno zvýšení objemu močového měchýře v době první netlumené kontrakce z 153,7 ± 50,4 ml na 393,2 ± 109,4 ml (p < 0,05), resp. z 170,8 ± 63,4 ml na 359,5 ± 124,4 ml (p < 0,05). Detruzorový tlak v době netlumené kontrakce se u obou skupin pacientů významně snížil z 82 ± 27,6 cmH2O na 50,8 ± 25,5 cmH2O (p < 0,05) u skupiny se subslizniční aplikací léku, resp. z 87,3 ± 32,6 cmH2O na 50,5 ± 23,7 cmH2O (p < 0,05) u druhé skupiny pacientů.
Dvanáct týdnů po léčbě je kontinentních 8 z 9 pacientů, tj. 88 % pacientů ve skupině A, a 5 ze 6 pacientů, tj. 83 % pacientů ve skupině B.
V délce trvání efektu léčby jsme mezi oběma skupinami neprokázali rozdíl (7,5 ± 2,2 vs 6 ± 1,3 měsíce, p = 0,15).
Léčba byla u obou skupin pacientů provázena zlepšením kvality života pacientů, které monitorujeme dotazníky I-QOL. Průměrné skóre ve skupině se subslizniční aplikací vzrostlo z 59,9 ± 13 na 77,8 ± ± 16,8 (p < 0,05) a ve skupině s aplikací léku do detruzoru vzrostlo z 48,5 ± 16,6 na 70,2 ± 17,1 (p < 0,05).
Porovnáním obou forem aplikace jsme neprokázali rozdíl mezi subslizniční aplikací a podáním léku do detruzoru (tab. 2).
Diskuze
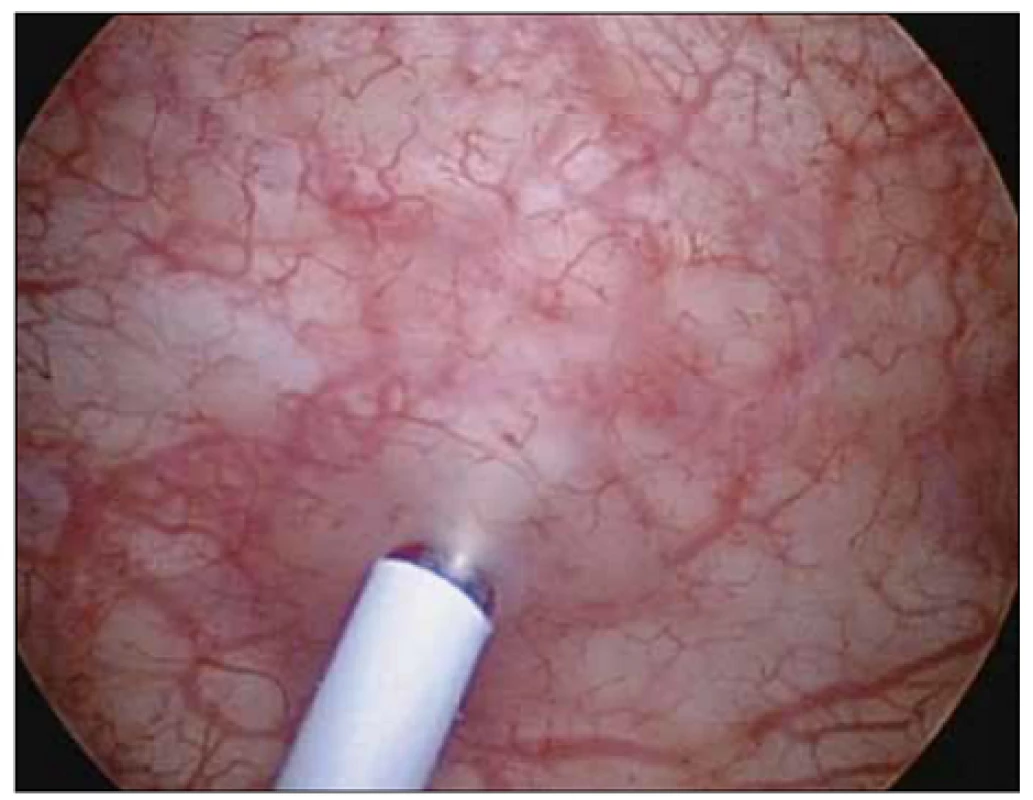
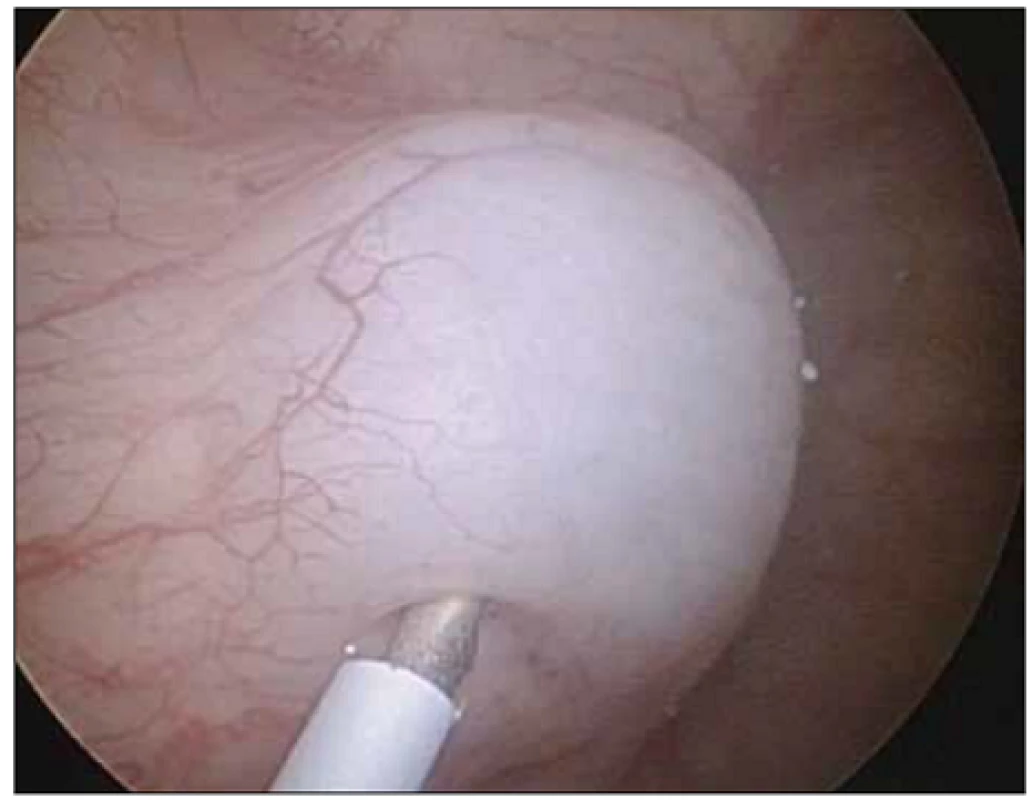
Podle našich znalostí jde o první práci v České republice porovnávající efekt léčby BTA při odlišných způsobech aplikace. Standardní metodou aplikace BTA je podání formou intramuskulární aplikace (obr. 1). Naprostá většina autorů referuje své zkušenosti a výsledky s aplikací BTA do detruzoru močového měchýře [8]. Aplikace do detruzoru močového měchýře při jeho variabilní síle s sebou přináší riziko podání BTA mimo detruzor močového měchýře v případě tenkých detruzorů nebo riziko systémového podání v případě aplikace do cévy ve svalovině (významně zvyšuje možný systémový nežádoucí účinek léku). Variabilita síly detruzoru je závislá především na pohlaví, věku, náplni měchýře a přítomnosti neurogenní léze či obstrukce. Podání do subslizničního prostoru lze endoskopicky vizuálně dobře kontrolovat (obr. 2).
Morfologickým zhodnocením distribuce BTA v detruzoru se zabývali Mehnert et al, kteří ve své pilotní práci hodnotili u šesti pacientů distribuci BTA v detruzoru. K léčbě použili standardně cystoskopicky aplikovaný BTA s přidáním magnetické kontrastní látky gadopentátu. Ihned po aplikaci provedli magnetickou resonanci. Prokázali, že jen 82,4 % podané látky je v detruzoru. Zbylých 17,6 % bylo v perivezikální tukové tkáni [9]. V jiné práci Boy et al prokázali, že dokonce až 33 % roztoku BTA je po aplikaci mimo místo distribuce, tedy stěnu detruzoru [10]. Proti tomu při subslizniční aplikaci množství látky, které se při aplikaci dostává mimo distribuční prostor, je téměř nulové.
Výsledky naší studie na limitovaném počtu pacientů prokázaly významné zlepšení sledovaných urodynamických parametrů v jednotlivých skupinách a neprokázali jsme rozdíl mezi subslizničním podáním a aplikací do detruzoru. Ačkoliv současná doporučení International Continence Society [6] nestanovují pro fázickou nebo terminální detruzorovou kontrakci žádnou mezní hranici (amplitudy nižší než 5 cmH2O nelze v praxi většinou detekovat), byla minimální amplituda detruzorového tlaku při netlumené kontrakci v našem souboru 46 cmH2O.
Literárně již byly publikovány práce s aplikací BTA subslizničně nebo ve formě roztoku k instilační léčbě. Nejobsáhlejší práci publikoval Kuo, který referoval výsledky léčby souboru 45 pacientů s idiopatickou detruzorovou hyperaktivitou refrakterních na klasickou anticholinergní medikaci. Soubor rozdělil na třetiny a BTA aplikoval v dávce 100 U do detruzoru močového měchýře, subslizničně a ve formě roztoku k instilační léčbě. Úspěšnost hodnotil dle dotazníku, poklesu počtu inkontinencí a efekt dosáhl u 93 %, 80 %, resp. 67 % pacientů. Efekt léčby klesl po šesti měsících u 67 %, 47 %, resp. u 13 % pacientů. Výsledky aplikace léku do detruzoru a subslizničně se v této práci jeví při limitovaném počtu pacientů jako srovnatelné, efektivita léčby formou instilace léku je nižší a časem rychle klesá [11].
Aktuálně jednu z největších srovnávacích studií s podáním BTA do detruzoru publikovali Karsenty et al, kteří shrnuli výsledky 15 randomizovaných studií na více než 600 pacientech s neurogenní poruchou mikce. Použití BTA významně snížilo počet inkontinencí až o 60–80 % v porovnání se vstupním stavem pacientů. Mezi intervaly katetrizace je kompletně kontinentních 47–80 % pacientů. Počet denních mikcí se zredukoval o 40–60 % a 28–58 % pacientů je schopno snížit nebo vysadit anticholinergika. Podobně se zlepšila i většina sledovaných urodynamických parametrů. Došlo k poklesu maximálního detruzorového tlaku během netlumené kontrakce až u 40–60 % pacientů a ke zvýšení cystometrické kapacity od 40 % do 233 % [12]. V české literatuře publikovali nejobsáhlejší práci Krhut et al [13], kteří v souboru 42 pacientů s neurogenní dysfunkcí dolních močových cest po spinálním poranění, s roztroušenou sklerózou a při kongenitálních míšních dysrafizmech aplikovali dávku 1 000 U Dysportu®. Prokázali zlepšení kontinence u 58 % pacientů po spinálním poranění, 100 % pacientů s RS, resp. 25 % pacientů se spinálními dysrafizmy. U všech skupin pacientů došlo k významnému zlepšení kvality života a zvýšení cystometrické kapacity.
Alternativou invazivnímu způsobu podání je instilace roztoku BTA do močového měchýře. Při intravezikálním podání působí BTA na nervová zakončení v urotelu a ovlivňuje aferentní nervový přenos. V limitovaném množství pak dochází k jeho přestupu přes urotel a interakci se subslizniční nervovou sítí a vlákny svaloviny detruzoru. Krhut et al publikovali soubor 16 pacientek s idiopatickou detruzorovou hyperaktivitou, které byly léčeny instilací 200 U Botoxu® v 50 ml fyziologického roztoku. Při urodynamickém vyšetření prokázali zvýšení kapacity měchýře, při které dochází k první netlumené kontrakci. Prokázali také snížení počtu epizod inkontinence. Efekt léčby trval průměrně 6,8 týdne [14]. Právě pro krátký efekt léčby zatím není tento způsob podání příliš rozšířen a tato forma aplikace je používána spíše pro idiopatickou detruzorovou hyperaktivitu.
V délce trvání efektu terapie jsme neprokázali mezi oběma skupinami rozdíl. V našem souboru pacienti po celou dobu studie neužívali anticholinergika, tím je možné zdůvodnit relativně kratší dobu trvání léčby v porovnání s dostupnými údaji. Klinický a urodynamický efekt terapie BTA kulminuje mezi 1.–4. týdnem po aplikaci a udržuje se po dobu 24–36 týdnů [12]. Délka účinku terapie je modifikována v závislosti na současném používání anticholinergik. Právě v nesourodosti protokolů, jak jsou během aplikace BTA podávána anticholinergika, je slabina některých z citovaných prací. Po vymizení efektu je aplikaci BTA možno opakovat. Doposud nebylo prokázáno, že by opakovaná aplikace BTA měla negativní vliv na dolní močové cesty. Giannantoni et al [15] referovali malý soubor pacientů po spinálním poranění s neurogenním hyperaktivním detruzorem, kteří měli aplikován BTA průměrně 7,2krát. Studie potvrdila i při opakovaných aplikacích stejnou efektivitu BTA při intradetruzorové aplikaci. Průměrná doba efektu jednotlivých aplikací se výrazně neměnila a zůstávala i při opakovaných aplikacích prakticky stejná.
Léčba neurogenní hyperaktivity detruzoru je provázena významným zlepšením kvality života.
Zlepšení kvality života je v přímé korelaci s poklesem počtu mikcí a poklesem počtu inkontinencí. Naděje na zlepšení kvality života je pro pacienty jedním z nejdůležitějších parametrů při rozhodování, zda podstoupit novou léčbu. K hodnocení kvality života jsme v souladu s Druhou mezinárodní konzultací o inkontinenci použili dotazník Incontinence Quality of Life Questionnaire (I-QOL) [16]. Dotazník I-QOL je v posuzování urgentní inkontinence moči často používán, existuje ve 20 jazykových provedeních včetně českého a jeho validita je potvrzena prospektivními randomizovanými studiemi [17]. Studii 48 pacientů, kteří byli léčeni Botoxem® v dávce 200 U nebo 300 U s akcentem na sledování změny kvality života, publikovali Kalsi et al [18]. V 16. týdnu po aplikaci Botoxu® prokázali dle standardizovaných dotazníků zlepšení kvality života o 67,5 ± 4,5 % ve skupině pacientů s neurogenní hyperaktivitou detruzoru, resp. 70,3 ± 7,7 % ve skupině s idiopatickou hyperaktivitou detruzoru. Změna kvality života korelovala s poklesem frekvencí močení, urgencí a inkontinencí. Nekorelovala s vzestupem cystometrické kapacity a poklesem maximálního detruzorového tlaku Pdetmax. Schurch et al publikovali randomizovanou, placebem kontrolovanou studii 59 pacientů léčených 200 U nebo 300 U BTA pro neurogenní hyperaktivitu detruzoru. Pacienti vyplňovali před léčbou a dále ve 2., 6., 12. a 24. týdnu po léčbě dotazník I-QOL. Celkové I-QOL skóre se ve skupině pacientů léčených BTA významně zvýšilo proti skupině léčené placebem (p < 0,05). V absolutní hodnotě skóre došlo k navýšení (hodnoty mediánu) z 48,9 na 84,1 ve skupině léčené 200 U, z 44,3 na 72,7 ve skupině léčené 300 U a ze 42,6 na 45,5 u skupiny léčené placebem [19].
Anticholinergní léčba, často používaná k léčbě hyperaktivity detruzoru, je mnohdy špatně tolerována pro vysokou incidenci vedlejších účinků terapie, jako jsou sucho v ústech, rozmazané vidění, zácpa. Doposud neexistuje srovnání mezi kvalitou života při léčbě neurogenní hyperaktivity detruzoru BTA nebo léčbou anticholinergiky.
K léčbě jsme použili dávku 300 U Botoxu®. Dávka BTA není dosud jednoznačně určena, studie s dávkou 100 U vs 300 U Botoxu®, kterou publikovali Truzzi et al [20], ukázala lepší efekt vyšší dávky. Studie s dávkou 100 U vs 150 U, kterou publikovali Gausse et al [21], prokázala stejnou efektivitu obou dávek. V současnosti většina probíhajících studií testuje dávku 200 U vs 300 U Botoxu®, resp. odpovídající dávku Dysportu®. V porovnání obou preparátů Schurch et al [22] prokázali lehce vyšší efekt Dysportu® proti Botoxu®, ale mohlo to být interpretováno jako výsledek nekomparativní dávky. Nicméně přestože jsou oba preparáty sérotypu A, mají jiné vlastnosti, což je způsobeno tím, že jsou syntetizovány jinými bakteriálními klony a k výrobě jsou použity jiné výrobní procesy. Také vedlejší příznaky obou preparátů se trochu liší [23].
Výkon lze u pacientů s kompletní míšní lézí provést bez anestezie, přesto se nám pro lepší komfort pacienta osvědčilo jeho uskutečnění v krátké celkové anestezii. Zvláště u pacientů s malou kapacitou měchýře je výkon bez anestezie provázen nepříjemnými vegetativními příznaky a zvýšenou spasticitou dolních končetin. Větší pozornost je třeba věnovat pacientům s anamnézou syndromu autonomní dysreflexie. K aplikaci BTA postačí zcela standardní endoskopické vybavení (obr. 3).
Pro přesnější zhodnocení obou forem aplikace je nezbytný další výzkum a posouzení na větším souboru pacientů.
Závěr
Léčba neurogenní hyperaktivity detruzoru u pacientů po spinálním poranění aplikací BTA je metodou první volby u onemocnění refrakterních na standardní terapii anticholinergiky či v případech výrazných nežádoucích účinků této léčby. Aplikace BTA vede ke zlepšení sledovaných urodynamických parametrů. Tři měsíce po léčbě došlo k významnému zlepšení sledovaných urodynamických parametrů a významnému zlepšení kvality života. Zlepšení urodynamických parametrů má také zásadní význam v ochraně horních močových cest. Úprava kontinence je často jedním ze zásadních předpokladů pro resocializace a reintegraci pacienta do společnosti po těžkém spinálním traumatu a důležitý předpoklad pro spokojený partnerský život. Srovnatelné výsledky a tolerance subslizniční a intramuskulární aplikace nabízí pacientům novou cestu aplikace bez rizika systémového podání, čímž se minimalizuje riziko nežádoucích účinků léku. Současně pak srovnatelné výsledky subslizničního podání a podání do detruzoru podporují teorii o odlišném mechanizmu účinku BTA v hladké svalovině detruzoru.
Práce vznikla s podporou Vědecké rady Krajské nemocnice Liberec, a.s.
Přijato k recenzi: 20. 6. 2011
Přijato do tisku: 4. 10. 2011
MUDr. Vladimír Šámal
Urologické oddělení
Krajská nemocnice Liberec, a.s.
Husova 10
460 63 Liberec
e-mail: vladimir.samal@nemlib.cz
Sources
1. Leippold T, Reitz A, Schurch B. Botulinum toxin as a new therapy option for voiding disorders: current state of the art. Eur Urol 2003; 44(2): 165–174.
2. Dong M, Yeh F, Tepp WH, Johnson EA, Janz R, Chapman ER. SV2 is the protein receptor for botulinum neurotoxin A. Science 2006; 312(5773): 592–596.
3. Apostolidis A, Popat R, Yiangou Y, Cockayne D, Ford A, Davis J et al. Decreased sensory receptors P2X3 and TRPV1 in suburothelial nerve fibres following intradetrusor injections of botulinum toxin for human detrusor overactivity. J Urol 2005; 174(3): 977–983.
4. Giannantoni A, Di Stasi SM, Nadricchi V, Zuchi A, Machcioni L, Bini V et al. Botulinum-A toxin injections into the detrusor muscle decrease nerve growth factor bladder tissue levels in patients with neurogenic detrusor overactivity. J Urol 2006; 175(6): 2341–2344.
5. Haferkapm A, Schurch B, Reitz A, Krengel U, Grosse J, Kramer G et al. Lack of ultrastructural detrusor changes following endoscopic injection of botulinum toxin type A in overactive neuorogenic bladder. Eur Urol 2004; 46(6): 784–791.
6. Abrams P, Cardozo L, Fall M, Griffiths D, Rosier P, Ulmsten U et al. Standardisation Sub-Committee of the International Continence Society. The standardisation of terminology in lower urinary tract function: report from the standardisation sub-committee of the International Continence Society. Urology 2003; 61(1): 37–49.
7. Hintze J. NCSS and PASS, Number Crundur Statistical Systems, Kaysville, Utah, US, 2001. Available from: http://www.NCSS.com.
8. Patel AK, Patterson JM, Chapple CR. Botulinum Toxin injections for neurogenic and idiopathic detrusor overactivity: A critical analysis of results. Eur Urol 2006; 50(4): 684–710.
9. Mehnert U, Boy S, Schmid M, Reitz A, von Hessling A, Hodler J et al. A morphological evaluation of botulinum neurotoxin A injections into detrusor muscle using magnetic resonance imaging. World J Urol 2009; 27(3): 397–409.
10. Boy S, Schmid M, Reitz A, Von Hessling A, Hodler J, Schurch B. Botulinum toxin injections into the bladder wall – a morphological evaluation of the injections technique using magnetic resonance imaging. Eur Urol 2006; 2 (Suppl 5): 299.
11. Kuo HC. Comparison of effectiveness of detrusor, suburothelial and bladder base injection of botulinum toxin A for idiopathic detrusor overactivity. J Urol 2007; 178(4): 1359–1363.
12. Karsenty G, Denys P, Amarenco G, De Seze M, Gamé X, Haab F et al. Botulinum toxin A (Botox®) intradetrusor injections in adults with neurogenic detrusor overactivity /neurogenic overactive bladder: a systematic literature review. Eur Urol 2008; 53(2): 275–287.
13. Krhut J, Kopecký J, Hradílek P, Zapletalová O, Tvrdík J. Využití léčby neurogenních dysfunkcí dolních cest močových aplikací botulinumtoxinu do detruzoru. Ces Urol 2007; 11(3): 154–158.
14. Krhut J, Zvara P. Intravesical instillation of butulinum toxin A: an in vivo murine study and pilot clinical trial. Int Urol Nephrol 2011; 43(2): 337–343.
15. Giannantoni A, Mearini E, Del Zengrano M, Perena M. Six year follow-up of botulinum toxin A intradetrusorial injection in patient with refractory neurogenic detrusor overactivity: clinical and urodynamic results. Eur Urol 2009; 55(3): 705–711.
16. Highlights from the World Health Organization 2nd International Consultation on Incontinence 2001, July 1–4, Paris, France. Available from: http://www.icsoffice.org/Publications/ICI_2/MENUS/MAIN.PDF.
17. Bushnell DM, Martin ML, Summers KH, Svihra J, Lionis C, Patrick DL. Quality of life of women with urinary incontinence: cross-cultural performance of 15 language versions of the I-QOL. Qual Life Res 2005; 14(8): 1901–1913.
18. Kalsi V, Apostolidis A, Popat R, Gonzales G, Fowler CJ, Daskygypta P et al. Quality of life changes in patient with neurogenic versus idopatic detrusor overactivity after intradetrusor injections of botulinum neurotoxin type A and corelations with lower urinary tract symptoms and urodynamic changes. Eur Urol 2006; 49(3): 528–535.
19. Schurch B, Denys P, Kozma CM, Reese PR, Slaton T, Barron RL. Botulinum toxin A improves the quality of life of patients with neurogenic urinary inkontinence. Eur Urol 2007; 52(3): 850–859.
20. Truzzi JC, Bruschini H, Simonetti R, Miguel S. What is the best dose for intravesical botulinum A toxin injection in overactive bladder treatment? A prospective randomised preliminary study. Join Meeting of the International Continence Society (ICS) and the International Uro-Gynecological association (IUGA); 2004 Aug 25–27; Paris, France (abstract 254).
21. Gausse A, Tunuguntla HS, Rodroiguez G, Velzazquez D. Dose finding prospective randomized study to evaluate the efficacy and safety of botulinum A toxin for refractory idiopathic overactive bladder. International Continence Society Annual Meeting; 2005 Aug 28–Sep 02; Montreal, Canada (abstract 254).
22. Schurch B, Stöhrer M, Kramer G. Botulinum toxin A to treat detrusor hyperreflexia in spinal cord injured patient. Neurourol Urodyn 2001; 20: 521–522.
23. Wenzel R, Jones D, Borrego JA, Comparing two botulinum toxin type A formulations using manufacturers´ product summaries. J Clin Pharm Ther 2007; 32(4): 387–402.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 2
Most read in this issue
- Využití perkutánní endoskopické gastrostomie – přehled indikací, popis techniky a současné trendy v neurologii
- Posturálna instabilita, poruchy chôdze a pády pri Parkinsonovej chorobe
- Algoritmus vyšetření likvoru v návaznosti na doporučení Sekce neuroimunologie a likvorologie České neurologické společnosti JEP
- Obstrukční spánková apnoe a CPAP – má význam řešit nosní průchodnost?
