Diabetická neuropatia u detí a adolescentov – prospektívna 5-ročná štúdia
Diabetic Neuropathy in Children and Adolescents – a Prospective 5‑year Study
Introduction:
Diabetic neuropathy is the most commonly occurring chronic complication of diabetes, the onset of which depends largely on the duration of the disease. The prevalence of diabetic neuropathy in adult diabetics is estimated at more than 30%; however, the symptomatic forms of neuropathy in children and adolescents with DM are considered rare.
Aim:
To determine the occurrence of diabetic neuropathy in a definite sample of patients and to investigate whether children and adolescents with type 1 DM still develop peripheral nerve dysfunction despite using modern multiple insulin injection therapy. Methods: 72 young diabetics with type 1 DM were progressively entered into a 5-year prospective study in the years 2001–2003. All patients were treated with modern multiple insulin injection therapy. A total of 66 patients finished the study (92%). Average age was 14.2 years at study entrance; average duration of diabetes at the beginning was 5.4 years. All patients were given a detailed clinical neurological examination, including tactile perception, vibratory perception and electromyographia.
Results:
Despite multiple insulin injection therapy, there was an increase of the occurrence of diabetic neuropathy from 24.2 to 42.4% during the 5-year follow-up period. The proportion of patients with asymptomatic (subclinical) neuropathy increased from 13.6 to 25.7% and that of patients with symptomatic (clinical) neuropathy increased from 10.6 to 16.7%. Among the electrophysiological investigations, the highest sensitivity was found in the conduction velocity of the tibial nerve (abnormal in 35% of patients), followed by the conduction velocity of the peroneal and sural nerves.
Conclusion:
Young diabetics develop mainly subclinical forms of neuropathy, an unusually important finding in the light of prevention. This study is one of the few that are concerned with the longitudinal follow-up of neuropathy in young diabetics.
Key words:
diabetes mellitus, type 1 – diabetic neuropathy – early diagnosis – electromyography
Authors:
G. Hajaš 1; J. Jakubička 2
Authors‘ workplace:
FSVaZ UKF a FN Nitra
Neurologická klinika
1; FSVaZ UKF a FN Nitra
Pediatrická klinika
2
Published in:
Cesk Slov Neurol N 2010; 73/106(1): 51-56
Category:
Original Paper
Overview
Úvod:
Diabetická neuropatia je najčastejšou chronickou komplikáciou diabetu, ktorej výskyt závisí na dĺžke trvania ochorenia. Kým medzi dospelými diabetikmi sa prevalencia diabetickej neuropatie odhaduje na viac ako 30 %, u detí a dospievajúcich s DM sa symptomatické formy neuropatie považujú za zriedkavé.
Cieľ:
Zistiť, aký je výskyt diabetickej neuropatie na definovanej vzorke pacientov, a overiť, či sa u detí a adolescentov s 1. typom diabetu napriek intenzifikovanej inzulínovej liečbe rozvíja dysfunkcia periférnych nervov.
Metódy:
V rokoch 2001–2003 vstúpilo postupne do prospektívnej štúdie 72 mladých diabetikov s 1. typom DM. Všetci pacienti boli liečení intenzifikovaným inzulínovým režimom. Štúdiu ukončilo celkove 66 pacientov (92 %). Priemerný vek pacientov pri vstupe do štúdie bol 14,2 roka; priemerné trvanie DM bolo 5,4 roka. Všetci pacienti boli podrobne neurologicky vyšetrení, vrátane taktilnej citlivosti, vibračnej citlivosti a elektromyografie. Výsledky: Napriek intenzifikovanému inzulínovému režimu došlo počas 5-ročného sledovania k nárastu výskytu diabetickej neuropatie z 24,2 na 42,4 %. Podiel pacientov s asymptomatickou (subklinickou) neuropatiou stúpol z 13,6 na 25,7 % a podiel pacientov so symptomatickou neuropatiou stúpol z 10,6 na 16,7 %. Z elektrofyziologických metodík bolo najsenzitívnejšie meranie rýchlostí vedenia (CV) n. tibialis (abnormálne hodnoty u 35 % pacientov), ďalej nasledovalo meranie CV n. fibularis a CV n. suralis.
Záver:
Naša práca potvrdila, že u mladých diabetikov sa vyskytujú najmä subklinické formy neuropatií, ktoré sú neobyčajne dôležité z preventívneho hľadiska. Táto štúdia je jednou z mála, ktoré sa venujú sledovaniu neuropatie u mladých diabetikov z longitudinálneho hľadiska.
Kľúčové slová:
diabetes mellitus 1. typu – diabetická neuropatia – včasná diagnostika – elektromyografia
Úvod
Diabetes mellitus (DM) predstavuje jedno z najzávažnejších a najčastejších chronických ochorení detského veku, drvivú väčšinu pacientov tvoria deti s diabetom 1. typu. Takmer v polovici prípadov sa DM 1. typu zistí pred 21. rokom života, s vrcholom incidencie okolo puberty. Diabetická neuropatia (DN) nebýva častým problémom počas detstva, túto diagnózu však treba zvažovať u adolescentov s dlhším trvaním diabetu [1,2]. U dospelých diabetikov sa prevalencia DN odhaduje na viac ako 30 %.
Diabetická neuropatia je pre samotného pacienta nepríjemná najmä pre subjektívne symptómy (neuropatická bolesť), okrem toho je DN nebezpečná svojim plazivým priebehom a často oneskoreným poznaním. Závažné sú najmä pokročilejšie štádia neuropatie, ktoré sa môžu podieľať na vzniku tzv. diabetickej nohy a spôsobujú tým výrazné zneschopnenie pacienta. Aby sa predišlo oneskorenému poznaniu DN, je nevyhnutná včasná detekcia neuropatie. Práve u mladých diabetikov (deti, adolescenti, mladí dospelí) máme možnosť stretnúť sa predovšetkým so včasnými formami neuropatie.
Problematike DN u detí a adolescentov nebola doteraz vo svete ani u nás venovaná dostatočná pozornosť. V údajoch o incidencii a prevalencii DN v detskej vekovej skupine vládne významná neistota spôsobená chýbaním veľkých epidemiologických štúdií. Z tohto dôvodu neexistujú ani jednotné doporučenia týkajúce sa diagnostiky DN v detskom veku. V štúdiách zahrňujúcich dospelých aj detských diabetikov sa percento periférnej neuropatie pohybuje v rozmedzí 7–57 % [3,4]. V Pittsburskej štúdii (1992) bola zistená prevalencia symptomatickej diabetickej polyneuropatie (DPN) u mladých ľudí (18–29-roční) s 1. typom DM na úrovni 18 %. V posledných rokoch sa uskutočnili viaceré menšie štúdie hodnotiace výskyt subklinickej formy diabetickej neuropatie u detí a adolescentov. Výsledky týchto štúdií výrazne kolíšu, s udávanou prevalenciou od 10 do 72 % [5,6]. Ešte väčšia nejednotnosť vládne v problematike výskytu diabetickej autonómnej neuropatie (DAN) v tejto vekovej skupine, s udávanou prevalenciou 0–40 %.
Za potvrdené rizikové faktory sa v súčasnosti považujú dĺžka trvania DM a úroveň dlhodobej metabolickej kompenzácie, za pravdepodobné potom vek, fajčenie, telesná výška a súčasná prítomnosť diabetickej retinopatie [7].
Cieľom našej práce bolo longitudinálne sledovanie výskytu DN a jej jednotlivých štádií v našom súbore mladých diabetikov. Akcent bol dávaný na včasnú diagnostiku DN s využitím elektromyografie. Následne sme korelovali naše výsledky s prácami iných autorov.
Materiál a metodika
Súbor pacientov
V rokoch 2001–2003 postupne vstúpilo do našej štúdie 72 pacientov. Išlo o deti, adolescentov a mladých dospelých s 1. typom DM (všetci liečení intenzifikovaným inzulínovým režimom), ktorých vek nepresiahol 30 rokov a nebola prítomná iná známa príčina neuropatie. Päťročné sledovanie dokončilo celkove 66 pacientov. Všetci pacienti boli podrobne vyšetrení na začiatku štúdie a potom po piatich rokoch. Samotná návšteva pozostávala z odobratia anamnézy, zisťovania demografických údajov a laboratórnych výsledkov. Nasledovalo neurologické vyšetrenie a vyšetrením jednotlivých modalít citlivosti a šľachových reflexov. Všetci pacienti absolvovali elektromyografické vyšetrenie (EMG).
Povrchovú tlakovú citlivosť sme vyšetrovali nylónovým 10 g monofilamentom a závažnosť hodnotili stupňom 0–3. Vibračný percepčný prah sme zisťovali kalibrovanou 128-Hz ladičkou v oblasti I. metatarzo‑falangeálneho kĺbu a takisto hodnotili stupňom od 0–3 (hodnoty 7–8 = stupeň 0; hodnoty 5–6 = 1; 3–4 = 2; 1–2 = 3). Šľachové reflexy sme vyšetrovali neurologickým kladivkom vrátane použitia zosilňovacích manévrov (normoreflexia = stupeň 0; mierna hyporeflexia = 1; výrazná hyporeflexia = 2; areflexia = 3).
Zo 66 pacientov základného súboru bolo 34 mužského pohlavia a 32 ženského pohlavia. Vek pacientov varíroval od 3 do 28 (mean ± SD = 14,19 ± 5,94). Trvanie diabetu bolo v rozpätí od 0 do 22 rokov (mean ± SD = 5,39 ± 5,16). Vek v čase diagnózy diabetu bol od 1 do 27 rokov (mean ± SD = 8,62 ± 5,48). Výška pacientov kolísala od 85 do 189 cm (mean ± SD = 151,4 ± 23,9) a hmotnosť varírovala od 15 do 95 kg (mean ± SD = 49,5 ± 17,6). Pre potreby stanovenia elektrofyziologických noriem slúžil kontrolný súbor 55 zdravých nediabetických detí a adolescentov s priemerným vekom 15,3 ± 7,6 roka. Najmladší pacient mal 2 roky, najstarší 31 rokov. Chlapcov bolo 29, dievčat 26 (tab. 1).
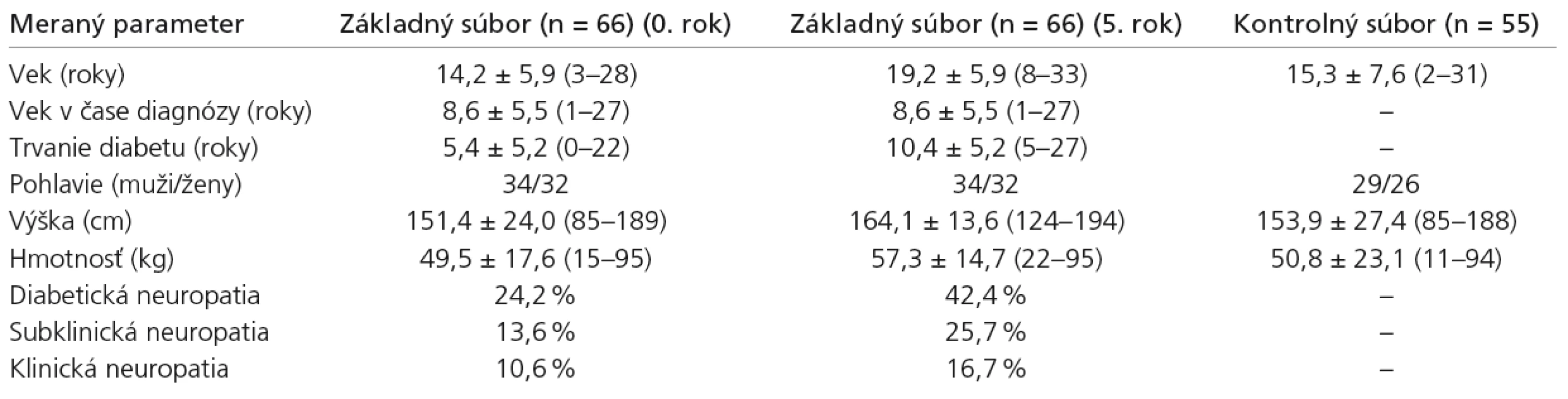
Elektromyografia
Elektrofyziologické vyšetrenie bolo robené v miestnosti s teplotami od 22–24 ºC, realizované elektromyografom značky Viking‑select. V prípade teploty vyšetrovanej končatiny pod 32,0 ºC sme hodnoty rýchlosti vedenia nervov upravovali s použitím korekčných koeficientov podľa Shin J. Oha. Výsledky hodnotil vždy jeden a ten istý vyšetrujúci lekár. Hodnotené parametre boli: amplitúda sumačného akčného potenciálu (CMAP) n. fibularis; rýchlosť vedenia (CV) n. fibularis; amplitúda CMAP n. tibialis; CV n. tibialis; amplitúda senzitívneho akčného nervového potenciálu (SNAP) n. suralis (antidrómne zapojenie); CV n. suralis; kožný sympatikový reflex (SSR) n. medianus (prítomnosť alebo neprítomnosť). Namerané elektrofyziologické hodnoty u diabetických pacientov boli považované za abnormné v prípade, že prekračovali priemernú hodnotu (mean) ± 2 SD zistenú u kontrolného zdravého súboru.
Diagnostika
Pri diagnostike diabetickej neuropatie smevychádzali z medzinárodne uznávanej metodiky podľa Dycka et al, ktorú sme čiastočne upravili [17]. Táto diagnostika je založená na splnení nasledujúcich kritérií:
1. prítomnosť jedného alebo viacerých subjektívnych príznakov („symptoms“) – tŕpnutie, mravčenie na končatinách, krče, únavnosť, slabosť končatín
2. prítomnosť objektívnych príznakov („signs“):
- a) prítomnosť, zníženie alebo absencia reflexu Achillovej šľachy
- b) vibračný percepčný prah meraný kalibrovanou 128-Hz ladičkou
- c) povrchová tlaková citlivosť sa hodnotila 10-g nylónovým monofilamentom
3. kvantitatívne hodnotenie autonómnych funkcií – kožný sympatikový reflex (SSR)
4. elektromyografické vyšetrenie
Na základe týchto štyroch kritérií sme klasifikovali diabetickú neuropatiu do nasledujúcich štádií:
- 0: bez neuropatie. Nie sú splnené požiadavky pre 1a.
- 1a: asymptomatická neuropatia (elektrofyziologické štádium). Prítomné sú aspoň dve vodivostné alebo amplitúdové abnormality vyšetrovaných nervov (n. fibularis, n. tibialis, n. suralis) vrátane nevýbavnosti SSR.
- 1b: asymptomatická neuropatia (objektívna). Splnené 1a kritériá + aspoň dve abnormality pri neurologickom vyšetrení (RŠA, vibračná citlivosť, taktilná citlivosť, motorické príznaky). Subjektívne príznaky nie sú prítomné.
- 2a: mierna symptomatická neuropatia. Splnené 1b kritériá + prítomné subjektívne ťažkosti (senzitívne, autonómne alebo motorické) spôsobené diabetickou neuropatiou. Stupeň svalovej sily dorziflexie členka podľa MRC škály: 4–5.
- 2b: ťažká symptomatická neuropatia. Splnené 2a kritériá + stupeň svalovej sily dorziflexie členka podľa MRC škály < 4.
- 3: ťažká zneschopňujúca neuropatia. Prítomné subjektívne aj objektívne príznaky výrazne obmedzujúce pacienta.
Výsledky
Súbor v 0. roku sledovania
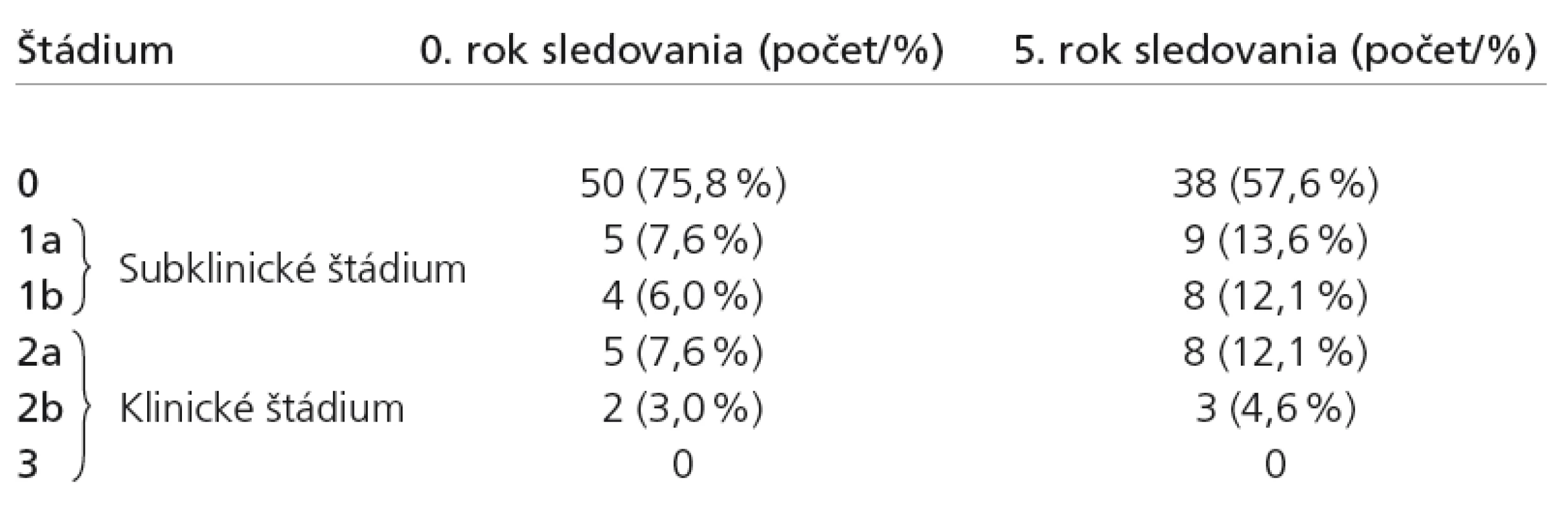
Na začiatku sledovania sme z celkového počtu 66 pacientov diagnostikovali diabetickú neuropatiu 16 pacientom, čo predstavuje 24,2 %. Z toho malo asymptomatickú (subklinickú) neuropatiu 9 pacientov (13,6 %) a symptomatickú (klinickú) neuropatiu 7 pacientov (10,6 %). V incipientom štádiu neuropatie 1a (elektrofyziologicky definovaná neuropatia) bolo 5 pacientov (7,6 %). Presnejšie rozdelenie podľa jednotlivých štádií neuropatie je v tab. 2 a grafe 1.

Z klinických príznakov diabetickej neuropatie sa ako najčastejšie preukázali abnormality reflexu Achillovej šľachy (RŠA), ktoré sme verifikovali u 27 pacientov (40,9 %), poruchy taktilnej citlivosti malo 10 pacientov (15,2 %) poruchu vibračnej citlivosti 8 pacientov (12,1 %), subjektívne ťažkosti (symptoms) udávali 7 pacienti (10,6 %) – graf 2.

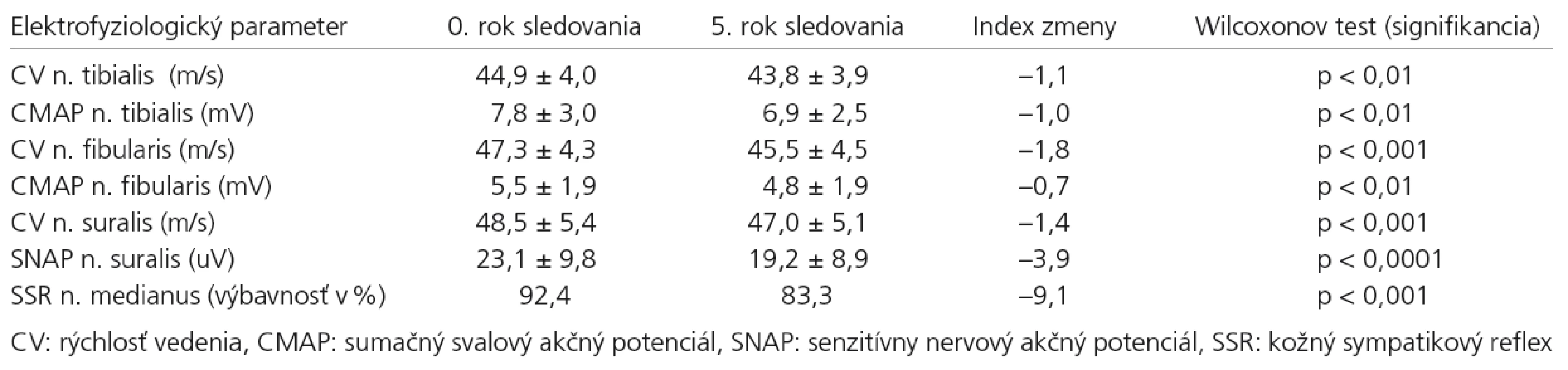
Čo sa týka výskytu elektrofyziologických abnormalít, ako najcitlivejší abnormný parameter sa ukázalo meranie CV n. tibialis, abnormálne hodnoty boli zistené u 27,3 % pacientov. Nasledovalo meranie CV n. fibularis a CV n. suralis (zhodne 16,7 %). Meranie amplitúd evokovaných motorických a senzitívnych odpovedí (CMAP, SNAP) bolo menej senzitívnym parametrom (tab. 3).

Súbor v 5. roku sledovania (longitudinálne výsledky)
Po piatich rokoch boli pacienti nášho súboru (n = 66) znova kompletne neurologicky a elektrofyziologicky vyšetrení, jednotlivé demografické údaje a ich zmenu za päť rokov vidíme v tab. 1.
V priebehu piatich rokov došlo k nárastu výskytu diabetickej neuropatie v našom súbore z 24,2 na 42,4 %, čo predstavuje nárast o 18,2 %. Došlo ku signifikantnému nárastu subklinickej (štádia 1a + 1b), menej aj klinickej formy neuropatie (2a + 2b) – graf 3.

Zastúpenie jednotlivých štádií DN vidíme v tab. 2 a názornejšie aj na grafe 4.

Z klinických príznakov diabetickej neuropatie malo subjektívne ťažkosti 11 pacientov (16,7 %), poruchu taktilnej citlivosti 15 pacientov (22,7 %), vibračnej citlivosti 19 pacientov (28,8 %). Najčastejším klinickým príznakom bolo opäť zníženie alebo neprítomnosť RŠA u 38 pacientov (57,5 %). V longitudinálnom sledovaní za päť rokov najviac stúplo percento porúch RŠA (+ 17 %) a vibračnej citlivosti (+ 16 %) – graf 2.
Čo sa týka výskytu elektrofyziologických abnormalít v 5. roku sledovania, ako najcitlivejší parameter sa opäť preukázalo meranie CV n. tibialis, abnormálne hodnoty boli zistené u 34,8 % pacientov. Ďalej nasledovalo meranie CV n. fibularis (28,8 %) a CV n. suralis (25,8 %). Amplitúdy CMAP a SNAP sa ukázali ako menej senzitívny ukazovateľ. Pri porovnávaní za päť rokov však najvýraznejšie stúpli abnormality CV n. fibularis (nárast o 12 %) – tab. 3.
Ďalej sme sledovali longitudinálne zmeny amplitúd CMAP, SNAP a rýchlosti vedenia (CV) senzitívnych a motorických v ich absolútnych číslach. Vypočítali sme priemernú hodnotu v našom súbore pre každý sledovaný parameter, a to v 0. roku a v 5. roku sledovania. Pomocou Wilcoxonovho jednovýberového (párového) testu sme zistili, že došlo k štatisticky významnému poklesu meraných amplitúd, ako aj rýchlostí vedenia všetkých vyšetrovaných nervov. Ako vidíme v tab. 4, v priebehu 5-ročného sledovania dochádza k najvýraznejšiemu poklesu u amplitúdy SNAPn. suralis (–3,9 uV), na druhom mieste potom k poklesu CV n. fibularis (–1,8 m/s)– tab. 4.
Diskusia
Poškodenie periférneho nervového systému je u dlhotrvajúceho diabetu časté. Najčastejšie ide o distálnu symetrickú senzorimotorickú polyneuropatiu. Symptomatická (klinická) neuropatia je u mladých diabetikov zriedkavým ochorením [8]. Viacerí autori však zistili, že skoré abnormality nervovej funkcie hodnotené na základe percepčného vibračného prahu (VPT) alebo rýchlosti vedenia nervov, sú často detegované už v detstve alebo adolescencii [7,9,10]. Vo všeobecnosti sa uznáva, že dobrá dlhodobá metabolická kontrola redukuje celkové riziko komplikácií u 1. typu DM u dospelých [4] i adolescentov [11].
Všetci naši pacienti boli počas 5-ročného obdobia liečení intenzifikovaným inzulínovým režimom (4–5 injekcií inzulínu denne, resp. inzulínová pumpa). Napriek tomu počas tohto obdobia došlo k nárastu výskytu neuropatie v našom súbore o 18,2 %; konkrétne stúpol najmä počet subklinických neuropatií (štádia 1a, 1b), na druhom mieste potom počet ľahkých symptomatických foriem (2a) – tab. 2. Týmto sme odpovedali na základnú otázku našej práce: napriek intenzifikovanej inzulinoterapii sa v skupine detí a adolescentov s 1. typom diabetu vyvíja periférna nervová dysfunkcia. K podobnému výsledku dospeli aj švédski autori pod vedením Hyllienmarka, ktorí na vzorke 75 diabetických detí a dospievajúcich verifikovali DN u 57 % z nich (základom hodnotenia bola EMG) [9]. Pri vysvetlení tohto javu musíme pripomenúť, že priemerná úroveň metabolickej kompenzácie v našom súbore meraná hodnotou HbA1c (metodika DCCT) bola 8,86; je to výsledok minimálne neuspokojivý.
Medzi detskými a dospievajúcimi diabetikmi jednoznačne dominuje subklinická forma DN, čo potvrdzujú viaceré štúdie [6,7,12]. Napr. v prospektívnej švédskej štúdii 144 diabetických detí bola zistená subklinická diabetická neuropatia u 25 % z nich, pričom išlo o novozistených diabetikov. V priebehu štúdie dochádzalo ku progresívnemu nárastu výskytu neuropatie [7]. V našej štúdii malo subklinickú DN na začiatku sledovania 13,6 % a po piatich rokoch sledovania už 25,7 % našich pacientov. Odhalenie diabetickej neuropatie v jej včasnom štádiu má preventívny význam, keďže nám neurológom poskytuje možnosť zasiahnuť do rozvíjajúceho sa ochorenia ešte v jeho ranom, pravdepodobne reverzibilnom štádiu.
Včasná diagnostika DN sa nezaobíde bez dôkladného hodnotenia senzitívnych funkcií a elektromyografie. V práci Olsena et al v súbore 339 detí, bola na základe merania VPT biothesiometriou zistená diabetická neuropatia u 62,5 % z nich [12]. Oproti našej práci sa však nebrali do úvahy ďalšie objektívne prejavy neuropatie, nerobilo sa ani EMG. Vyše 60% výskyt neuropatie v tejto dánskej štúdii sa zdá byť značne nadhodnotený, čo svedčí o tom, že hodnotenie DN len na základe merania VPT je nedostatočné. Na druhej strane hodnotenie vibračnej citlivosti použitím kalibrovanej ladičky je skôr skríningová metóda, presnejšie je hodnotenie biothesiometriou [13,14]. V súčasnosti už aj na našom pracovisku používame biothesiometriu, ktorú sme na začiatku štúdie ešte nemali k dispozícii. V súčasnej dobe sa vo svete čoraz viac presadzuje presnejšie testovanie senzitívnych funkcií (najmä tenkých vlákien) pomocou prístrojov na meranie vibračného, termického, bolestivého prahu, napr. systémom CASE (computer‑assisted sensory examination system).
Elektromyografické vyšetrenie, najmä vodivostné techniky, sú dominantnou metodikou na odhalenie subklinických štádií neuropatie. Doteraz neexistuje konsenzus v tom, ktorý periférny nerv je najvhodnejší na vyšetrenie, resp. aký je najoptimálnejší EMG‑algorizmus na odhalenie včasnej DN. Kým niektorí autori sa prikláňajú k vyšetrovaniu motorických nervov – najmä n. fibularis [13,15], iní odporúčajú vyšetrovanie senzitívnych nervov, najmä n. suralis [16]. Slovenskí autori Kurča a Kučera v štúdii z roku 2002 zisťujú vyššiu citlivosť senzitívneho neurogramu n. plantaris medialis v porovnaní s n. suralis [18]. Vo všeobecnosti je vyšetrenie rýchlosti vedenia (CV) citlivejšou metódou ako meranie amplitúd senzitívnych a motorických odpovedí.
Na rozdiel od väčšiny doteraz publikovaných prác sa nám ako najcitlivejší marker ukázalo vyšetrovanie n. tibialis. Pri statickom porovnávaní výsledkov bola CV n. tibialis abnormná častejšie ako CV n. fibularis (34,8 oproti 28,8 %) – tab. 3. Pri dynamickom (longitudinálnom) sledovaní sa však v priebehu piatich rokov najvýraznejšie zmenilo percento abnormalít CV n. fibularis (16,7–28,8 %). Predpokladáme, že rozdiely oproti iným štúdiám možno hľadať najmä v určitých rozdielnostiach, čo sa týka charakteristiky súboru, metodiky EMG, či nastavenia elektrofyziologických noriem (stanovenie hraníc patológie pomocou smerodajných odchýliek apod.). Rozdiel medzi senzitivitou týchto dvoch nervov v našom súbore však nie je veľký.
Vyšetrovanie n. tibialis v kombinácii s n. suralis má navyše aj praktickú výhodu, pretože pri neurologickom vyšetrení – v jednej polohe na lôžku (na bruchu) môžeme u dieťaťa vyšetriť naraz aj senzitívny aj motorických nerv, čo šetrí čas v neurologickej ambulancii pri zachovaní čo najvyššieho diagnostického prínosu pre lekára. Rozdiely medzi jednotlivými autormi môžu vychádzať jednak z rozdielnych vyšetrovacích techník, jednak odlišných noriem EMG laboratórií, ale aj z odlišnosti jednotlivých pacientskych súborov.
Vyšetrovanie autonómnych funkcií sa považuje za neodmysliteľnú súčasť diagnostiky DN. My sme pri diagnostike využívali vyšetrenie kožného sympatikového reflexu (SSR), zistili sme patologický výsledok (nevýbavnosť reflexu) u 16,7 % pacientov. Podľa niektorých autorov je jeho využitie v populácii detských diabetikov sporné, najmä pre nízku senzitivitu a špecificitu tejto metodiky. Tento test má však aj viacero výhod. Je to predovšetkých jeho technická jednoduchosť, dobrá tolerabilita zo strany pacienta‑dieťaťa a samozrejme bežná dostupnosť. Môžeme ho bez problémov použiť aj u malých detí. Vyššiu senzitivitu a špecificitu majú kardiovaskulárne testy navrhnuté Ewingom, ktoré sú však u malých detí nepoužiteľné.
Záver
Naša prospektívna štúdia potvrdila pomerne vysoký výskyt diabetickej neuropatie v sledovanej skupine detí, adolescentov a mladých dospelých s 1. typom diabetu. Vo väčšine prípadov sa jedná o subklinické formy neuropatie, ktoré sú dôležité z preventívneho hľadiska.
V snahe o včasný záchyt neuropatie považujeme pri diagnostike za dôležité skombinovať klinické vyšetrenie, kvantitatívne hodnotenie senzitívnych a autonómnych funkcií a elektromyografiu. Pri EMG je nutné vyšetriť aspoň jeden senzitívny a motorický nerv na dolných končatinách, nám sa osvedčila kombinácia n. tibialis a n. suralis.
Mladých diabetikov je treba neurologicky dispenzarizovať a v prípade včasnej diagnózy neuropatie túto aj adekvátne liečiť.
Prijato k recenzii: 6. 4. 2009
Prijato do tlače: 19. 11. 2009
MUDr. Gabriel Hajaš, PhD.
Neurologická klinika FSVaZ UKF a FN Nitra
Špitálska 6
950 01 Nitra
e-mail: hajas@fnnitra.sk
Sources
1. Donaghue KC, Bonney M, Simpson JM, Schwingshandl J, Fung AT, Howard NJ et al. Autonomic and peripheral nerve function in adolescents with and without diabetes. Diabet Med 1993; 10(7): 664–671.
2. Donaghue KC, Silink M. Diabetic neuropathy in childhood. Diabetes Nutr Metab 1999; 12(2): 154–160.
3. Tesfaye S, Stevens LK, Stephenson JM, Fuller JH, Plater M, Ionescu‑Tirgoviste C et al. Prevalence of diabetic peripheral neuropathy and its relation to glycaemic control and potential risk factors: the EURODIAB IDDM Complication Study. Diabetologia 1996; 39(11): 1377–1384.
4. The Diabetes Control and Complications Trial Research Group. The effect of intensive treatment of diabetes on the development and progression of long term complications in insulin dependent diabetes mellitus. N Engl J Med 1993; 329(14): 977–986.
5. Bognetti E, Caroli G, Meschi F, Marcellaro P, Bonfanti R, Chiumello G. Prevalence and correlations of early microvascular complications in young type I diabetic patients: role of puberty. J Pediatr Endocrinol Metab 1997; 10(6): 587–592.
6. dos Santos LH, Bruck I, Antoniuk SA, Sandrini R. Evaluation of sensorimotor polyneuropathy in children and adolescents with type I diabetes: associations with microalbuminuria and retinopathy. Pediatr Diabetes 2002; 3(2): 101–108.
7. Solders G, Thalme B, Aguirre‑Aquino M, Brandt L,Berg U, Persson A. Nerve conduction and autonomic nerve function in diabetic children. A 10‑year follow‑up study. Acta Paediatr 1997; 86(4): 361–366.
8. Sosenko JM, Andrew JM, Boulton MRCP, Kubrusly DB, Jagdish K, Weintraub BA et al. The vibratory perception threshold in young diabetic patients: associations with glycaemia and puberty. Diabetes Care 1985, 8: 605–607.
9. Hyllienmark L, Brismar T, Ludvigsson J. Subclinical nerve dysfunction in children and adolescents with IDDM. Diabetologia 1995; 38(6): 685–692.
10. Olsen BS, Nir M, Kjær I, Vølund A, Mortensen HB. Elevated vibration perception threshold in young patients with Type I diabetes in comparison to non‑diabetic children and adolescents. Diabetic Med 1994; 11(9): 888–892.
11. The Diabetes Control and Complications Trial Research Group. The effect of intensive diabetes treatment on the development and progression of long term complications in adolescents with insulin‑dependent diabetes mellitus. Diabetes Control and Complications Trial. J Pediatr 1994; 125(2): 177–188.
12. Olsen BS, Sjølie AK, Hougaard P, Johannesen J, Borch‑Johnsen K, Marinelli K et al. A 6‑year nationwide cohort study of glycaemic control in young people with type I diabetes. Risk markers for the development of retinopathy, nephropathy and neuropathy. J Diabetes Complications 2000; 14(6): 295–300.
13. Dorchy H, Noel P, Kruger M, de Maertelaer V, Dupont E, Toussaint D et al. Peroneal motor nerve conduction velocity in diabetic children and adolescents. Eur J Pediatr 1985; 144(4): 310–315.
14. Käär ML, Saukkonen AL, Pitkänen M, Akerblom HK. Peripheral neuropathy in diabetic children and adolescents. A cross‑sectional study. Acta Paediatr Scand 1983; 72(3): 373–378.
15. Gamstorp I. Normal conduction velocity of ulnar, median and peroneal nerves in infancy, childhood and adolescence. Acta Paediatr Scand 1963; 52 (Suppl 146): 68–76.
16. Ludvigsson J, Johannesson G, Heding L, Hager A, Larsson Y. Sensory nerve conduction velocity and vibratory sensibility in juvenile diabetics. Acta Paediatr Scand 1979; 68(5): 739–743.
17. Dyck PJ. Detection, characterisation and staging of polyneuropathy: assessed in diabetics. Muscle Nerve 1998; 11(1): 21–32.
18. Kurča E, Kučera P. Senzitívny neurogram nervus plantaris medialis v diagnostike diabetickej neuropatie. Neurol pro prax 2002; 3(4): 214–216.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 1
Most read in this issue
- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Kongenitální myastenické syndromy – kazuistiky
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
