Hydrocefalus po subarachnoidálním krvácení – vliv modality léčby aneuryzmatu
Hydrocephalus after Subarachnoidal Hemorrhage – The Effects of Therapeutical Modalities for Aneurysm
Hydrocephalus as a consequence of subarachnoidal hemorrhage has been a well-known and studied complication for a long period. The authors have observed the hydrocephalus incidence in a set of patients and compared the occurrence in dependence on the applied method of withdrawing the bleeding aneurysm – surgical and endovascular treatments. Within 2001–2002, 103 patients (43 males and 60 females, aged 9–85 years, mean 49.5 years) were treated immediately after subarachnoidal hemorrhage. After establishing the diagnosis, 45 patients underwent surgery, aneurysms of 58 patients were withdrawn by an endovascular method. In the further course of therapy and follow-up, 20 patients (19.4%) died. In the whole set of 103 patients the hydrocephalus incidence reached 14.6%, 11.1% in surgical subjects and 13.8% in those after coiling.
Key words:
hydrocephalus – subarachnoidal hemorrhage – surgery – endovascular treatment – coiling
Authors:
M. Mohapl; F. Kramář; V. Beneš
Authors‘ workplace:
Neurochirurgická klinika 1 LF UK a IPVZ, ÚVN, Praha
Published in:
Cesk Slov Neurol N 2007; 70/103(3): 284-289
Category:
Short Communication
Podpořeno grantem IGA MZ ČR NR/9436-3.
Overview
Hydrocefalus jako následek subarachnoidálního krvácení je dlouhodobě známou a sledovanou komplikací. Autoři sledují výskyt hydrocefalu v souboru nemocných a porovnávají incidenci v závislosti na použitém způsobu vyřazení krvácejícího aneuryzmatu – chirurgického a endovaskulárního ošetření. V letech 2001–2002 bylo bezprostředně po subarachnoidálním krvácení ošetřeno 103 nemocných. Jednalo se o 43 mužů a 60 žen ve věkovém rozpětí 9–85 let, průměrný věk byl 49,5 roku. Po diagnostice bylo 45 nemocných ošetřeno chirurgicky, u 58 nemocných bylo aneuryzma vyřazeno endovaskulární cestou. V dalším průběhu terapie a sledování zemřelo 20 nemocných, tj. 19,4 %. Incidence hydrocefalu v celém souboru 103 nemocných byla 14,6 %; 11,1 % u chirurgických nemocných a 13,8 % u nemocných po coilingu.
Klíčová slova:
hydrocefalus – subarachnoidální krvácení – chirurgie – endovaskulární léčba – coiling
Úvod
Subarachnoidální krvácení (subarachniod hemorrhage – SAH), jeho následky a terapie patří po celou historii neurochirurgie mezi nejvíce diskutovaná témata. Svými důsledky jak pro jednotlivce, tak pro celou společnost (SAH postihuje lidi středního věku ) zůstává stále palčivým problémem.
S postupem chirurgických technik a pooperační péče (zavedení blokátorů kalciových kanálů, triple H-léčby a zlepšení intenzivní péče spolu s jednodušší diagnostikou vazospazmů a hydrocefalu) se kromě přežití nemocného dostává do centra zájmu i kvalita jeho dalšího života.
Jednou z věcí, které mohou velmi výrazně ovlivnit následnou kvalitu života nemocného po SAH, je hydrocefalus, který se rozvíjí několik týdnů až měsíců po iniciálním krvácení.
Otázka diagnostiky hydrocefalu (CT, MRI, monitoring ICP, studie vstřebávání moku) i léčby (V-P-shunty, LP-shunty) byly studovány velkými randomizovanými studiemi a jsou v současné době prakticky vyřešeny. Nevyřešeným problémem zůstává možnost ovlivnění vzniku hydrocefalu v době po krvácení a v perioperačním období.
Rozvíjející se neuroradiologické intervenční techniky přinášejí možnost ošetřit aneuryzma bez nutnosti otevřené operace. U akutního SAH tak sice odpadá nový inzult traumatizující mozek, odpadá však i otevření SA-prostorů a odstranění koagul na bazi mozku, které jsou rutinní součástí každé operace a jsou považovány za faktory snižující riziko vývoje hydrocefalu.
Pomocí dlouhodobé zevní lumbální drenáže mozkomíšního moku lze denně odvést 100-250 ml moku. Kromě snížení intrakraniálního tlaku je možno derivací krvavého likvoru zmenšit množství rozpadových produktů krve a alespoň teoreticky snížit pravděpodobnost rozvoje vazospazmů. Z hlediska prevence pozdního rozvoje hydrocefalu lze předpokládat, že časnější vyčištění mozkomíšního moku přispěje ke snadnější úpravě normálních likvorových cest a normalizaci vstřebávání mozkomíšního moku.
Soubor a metodika
Do souboru byli zahrnuti všichni nemocní s diagnózou subarachnoidálního krvácení z aneuryzmatu léčení na Neurochirurgické klinice ÚVN Praha v letech 2001-2002. Po přijetí na oddělení bylo u všech nemocných provedeno CT-vyšetření, diagnostická angiografie, a na základě výsledků bylo rozhodnuto o terapeutickém postupu – chirurgickém, nebo endovaskulárním ošetření. Zavedení lumbální drenáže bylo součástí operace, u nemocných řešených endovaskulárně byla drenáž zavedena v rámci pooperační péče. Odpad drenáže nebyl omezován objemově, bylo použito přepadu ve výšce 3-5 cm nad úrovní zevního zvukovodu v závislosti na individuální toleranci, drenáž byla zrušena při prvních klinických nebo laboratorních známkách infekce, nebo před vertikalizací, tj. 8.-10. den po operaci. Všichni nemocní podstoupili CT-vyšetření za nejméně 48 hodin po odstranění drenáže, v případě rozvoje známek intrakraniální hypertenze bylo CT-vyšetření opakováno a zvažována potřeba zkratové operace. Další CT-vyšetření byla prováděna v intervalu 3 a 12 měsíců.
K měření rozměrů komorového systému jsme používali Evansův index – poměr šíře frontálních rohů postranní komory k biparietálnímu průměru, FD/ID index – poměr šíře frontálních rohů postranní komory a vnitřního rozměru lebky ve stejném místě a měření rozměru III. komory. V literatuře uváděné měření temporálního rohu komory se nám jevilo jako velmi nepřesné a z praxe jsme jej vyřadili.
Zkratová operace byla indikována na základě klinického stavu, CT-vyšetření a výsledku lumbálniho infuzního testu.
Výsledky
V letech 2001-2002 bylo na Neurochirurgické klinice ÚVN ošetřeno 199 nemocných s diagnózou intrakraniálního aneuryzmatu. U 96 nemocných bylo AN diagnostikováno bez předešlého krvácení. Do studie tak bylo zahrnuto 103 nemocných ošetřených bezprostředně po subarachnoidálním krvácení. Jednalo se o 43 můžů a 60 žen ve věkovém rozpětí 9-85 let, průměrný věk byl 49,5 roku, popis věkového rozvrstvení podává graf 1. Klinický stav nemocných jsme hodnotili stupnicí dle Hunta-Hesse, informace o souboru jsou shrnuty v grafu 2. Stupeň krvácení na vstupním CT jsme hodnotili Fisherovou škálou, rozvrstvení souboru uvádí graf 3.



Po diagnostické angiografii a její následné analýze bylo rozhodnuto o chirurgickém řešení u 45 nemocných, endovaskulárně jsme řešili aneuryzma u 58 nemocných. V dalším průběhu terapie a sledování zemřelo 20 nemocných tj. 19,4 %. V průběhu pooperační péče jsme provedli zkratovou operaci u 5 nemocných, u dalších 8 jsme hydrocefalus diagnostikovali během následných kontrol na základě CT a rozvoje příznaků hydrocefalu. Těmto nemocným jsme provedli lumbální infuzní test a na základě průkazu poruchy resorpce (za pozitivní jsme lumbální infuzní test považovali, pokud hodnota resistance to outflow - Rout převyšovala 14 mm Hg/ml/min) indikovali zkratovou operaci. Incidence hydrocefalu v celém souboru 103 nemocných byla 14,6 %.
U nemocných s intraventrikulárním krvácením byla incidence hydrocefalu 19,4 % (6 z 31 nemocných), u nemocných bez známek přítomnosti krve v komorách to bylo jen 9,7 % (7 ze 72 nemocných). Incidenci hydrocefalu v závislosti na lokalizaci zdroje krvácní zachycuje graf 6 – nejčastěji vznikal po krvácení z arteria cerebri anterior.
V našem materiálu jsme hydrocefalus zaznamenali u 8 z 58 léčených endovaskulárně a u 5 z 45 chirurgických nemocných. Procentuálně je to 13,8 % vs 11,1 % ve prospěch chirurgického ošetření (dle provedené statistické analýzy není rozdíl statisticky signifikantní p > 0,1). Srovnání parametrů chirurgické a endovaskulární větve souboru přinášejí grafy 4-5.


Diskuse
Vývoj hydrocefalu po subarachnoidálním krvácení je komplikace dobře známá, opakovaně pozorovaná a popisovaná. První popis je z roku 1928, kdy byly prvně popsány důsledky arteficiálního podání krve do subarachnoidálního prostoru [1]. Údaje o incidenci chronického hydrocefalu se v literatuře výrazně liší, pokud jsou zmíněna, tak pouze jako vedlejší diagnóza v práci o léčbě subarachnoidálního krvácení. Většinou nebývají uvedena kritéria, podle kterých je rozšíření komor považováno za projev hydrocefalu, měření rozměrů a výpočet indexů zpravidla chybí.
Incidenci hydrocefalu po subarachnoidálním krvácení jsme se již na stránkách tohoto časopisu věnovali [2] – zde byla literární fakta zpracována v tabulkách, v další diskusi proto nebudeme uvádět všechny dostupné údaje, vždy budeme srovnávat jen naše údaje s trendem podchyceným v literatuře.
Opakovaně byla sledována závislost mezi iniciálním klinickým stavem bezprostředně po krvácení a výskytem hydrocefalu. V důsledku těžkého poškození mozku dochází k vývoji edému mozku, subarachnoidální (SA) prostory jsou tak podstatně zmenšeny, koncentrace krve v nich se tak zvětšuje a pomalé proudění moku také nijak nepřispívá k rychlejšímu vyčistění mokových cest – literárních důkazů je celá řada [3-9]. U klinicky nejméně postižených nemocných, tj. skupina I dle Hunta a Hesse (H-H), se incidence HC pohybuje 0-4,6 %. U nemocných, kteří byli iniciálním krvácením nejhůře postiženi (tedy skupiny H-H IV a V), byl hydrocefalus pozorován u 13,1-55 %. Výskyt hydrocefalu ve skupině IV často převyšuje incidenci ve skupině V, je to dáno menším množstvím přežívajících ve skupině H-H V [8]. V našem materiálu jsme hydrocefalus diagnostikovali nejčastěji u nemocných ve skupině 3 a 4 dle Hunt-Hesse, incidence byla velmi podobná 27,2 a 27,7 %
Úměrně s množstvím krve v SA prostorech po krvácení roste pravděpodobnost rozvoje chronického hydrocefalu – pravděpodobným patofyziologickým vysvětlením je zhoršení cirkulace likvoru, těžší zánětlivá reakce, větší riziko rozvoje vazspazmů [3,7-12]. Tento trend dokládají i literární údaje – incidence HC roste s tíží krvácení – nejinak tomu bylo i u našeho souboru, u skupiny 1 dle Fishera jsme hydrocefalus nezaznamenali, naopak nejvyšší incidence byla u nemocných skupiny 4.
Přítomnost intraventrikulárního hematomu jasně koreluje s vyšším rizikem chronického hydrocefalu – předpokládá se zhoršení proudění moku a jeho stagnace v důsledku zvýšení viskozity mozkomíšního moku a zhoršení úklidové reakce celého SA-prostoru [5,8,13]. Náš soubor zcela odpovídá literárním údajům – 9,2 % vs 19,3 % .
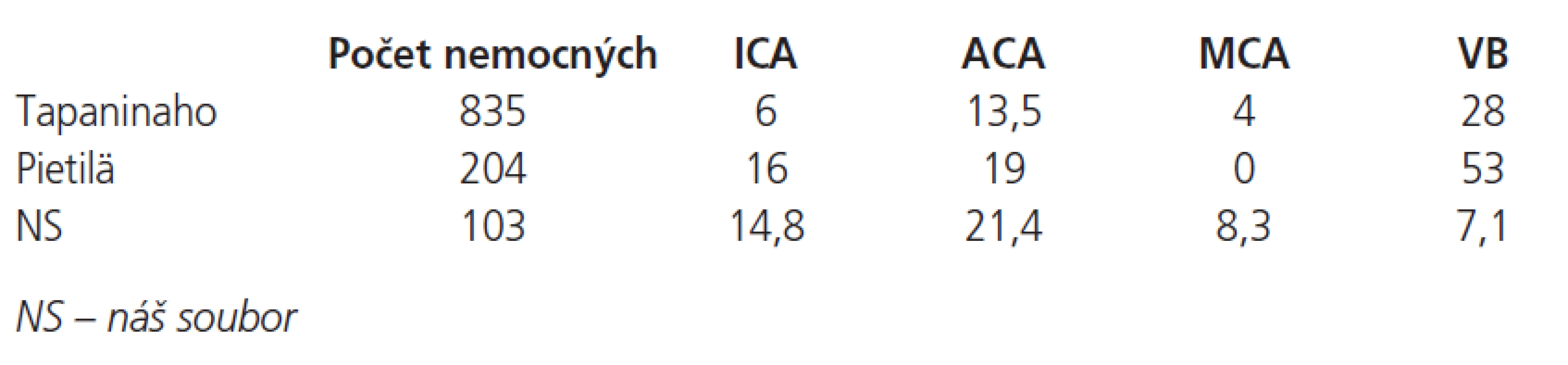
V literatuře existuje velké množství prací dokazujících souvislost mezi lokalizací zdroje krvácení a incidencí HC [5,7,8,10] – nejnižší incidence byla zaznamenána u AN arteria cerebri media, nejvyšší pak u AN vertebrobazilárního (VB) povodí, náš soubor charakterizuje graf 2. V rozdělení incidence hydrocefalu podle zdroje krvácení se náš materiál nejvíce liší od publikovaných materiálů, krvácení z aneuryzmat VB-povodí byla spojena s vůbec nejnižším rizikem rozvoje hydrocefalu – jen 7,1 %, dokonce i krvácení z aneuryzmatu a. cerebri media bylo spojeno s vyšší incidencí 8,3 %. (tab. 1).
Nemocní ve vyšším věku mají signifikantně vyšší riziko hydrocefalu po SAH [4,7,9,10,16-18] V našem souboru jsme tento trend nezaznamenali, nejvyšší incidence byla u nemocných ve věkové skupině 40-49 let (graf 6).

Publikované práce se shodují, že riziko HC po SAH je vyšší u žen než u mužů [10,14,16,19] . V našem souboru byl trend podobný, rozdíl však nebyl příliš výrazný – 11,6 % u mužů a 13,3 % u žen.
V literatuře existují 3 práce srovnávající incidenci hydrocefalu v závislosti na použité metodě vyřazení aneuryzmatu [3,7,15]. Gruber et al v souboru 187 nemocných zaznamenali vyšší procento výskytu u chirurgické větve - 23,2 % ze 125 versus 17,7 % ze 62 u endovaskulárně léčených nemocných. Porovnávané soubory byly srovnatelné v parametrech jako věk, H-H, Fisher, incidence opakovaného krvácení, lišily se však v lokalizaci aneuryzmat, v chirurgické části bylo větší zastoupení nemocných s aneuryzmatem z arteria communicans anterior a v druhé skupině bylo výrazně více nemocných s aneuryzmaty VB-povodí, kteří s vyjímkou 2 pacientů s basilar tip AN mezi chirurugickými nemocnými zcela chyběli.
Sethi et al srovnávali 2 skupiny po 50 nemocných, procento nemocných s definitivním shuntem bylo u obou skupin stejné – 3 %. Výrazný rozdíl v incidenci uvádí Dorai – 19,9 % u chirurgické větve, 47,1 % u endovaskulární – vysvětlením je výrazně horší iniciální klinický stav nemocných léčených endovaskulárně.
Incidence hydrocefalu je v obou skupinách našeho souboru nižší než u našeho materiálu z roku 2000, kdy jsme u endovaskulárního řešení zaznamenali 24 % nemocných s hydrocefalem a 15 % u chirurgických pacientů. Tehdy jsme lumbální drenáže využívali peroperačně k usnadnění preparace aneuryzmatu a v bezprostředním perioperačním období, u endovaskulárně ošetřených nemocných jen při masivním SAH. Vzhledem k tomu, že jsme nezměnili námi používanou chirurgickou ani endovaskulární techniku, můžeme snížení incidence hydrocefalu přičíst používání lumbální drenáže. Rovněž snížení incidence hydrocefalu u aneuryzmat VB-povodí by bylo možno vysvětlit extenzivní drenáží, která odvede krvavý likvor, sníží tak jeho pasáž do subarachnoidálních prostorů nad hemisférou, a tím zmenší zánětlivou reakci v místě resorbce mozkomíšního moku.
Závěr
Hydrocefalus po subarachnoidálním krvácení zůstává komplikací, která postihuje nemalou část nemocných. V našem souboru jsme zaznamenali nižší incidenci při chirurgickém vyřazení krvácejícího aneuryzmatu než při léčbě endovaskulární. Dlouhodobá derivace sangvinolentního moku se jeví jako prospěšná a přispívá k nižší incidenci hydrocefalu.
Přijato k recenzi: 18. 8. 2006
Přijato do tisku: 6. 11. 2006
MUDr. Milan Mohapl
Neurochirurgická klinika 1 LF UK
U vojenské nemocnice 1200
169 02 Praha 6
E-mail: mohapl@uvn.cz
Sources
1. Bagley C Jr. Blood in the cerebrospinal fluid. Resultant functional and organic alterations in the central nervous system. AO experimental data. Arch Surg 1928; 17:18-38.
2. Mohapl M, Kramář F, Beneš V. Hydrocefalus jako následek subarachnoidálního krvácení – review. Cesk Slov Neurol N 2004; 67: 309-19.
3. Foltz EL, Ward AA Jr. Communicating hydrocephalus from subarachnoidbleeding. J Neurosurg 1956; 13: 546-66.
4. Gruber A, Reinprecht A, Bavinzski G, Czech T, Richling B. Chronic shunt-dependent hydrocephalus after early surgical and early endovascular treatment of ruptured intracranial aneurysms. Neurosurgery 1999; 44: 503-12.
5. Pietila TA, Heimberger KC, Palleske H, Brock M. Influence of aneurysm location on the development of chronic hydrocephalus following SAH. Acta Neurochir 1995; 137: 70-3.
6. Milhorat TH. Acute hydrocephalus after aneurysmal subarachnoid hemorrhage. Neurosurgery 1987; 20: 15-20.
7. Saveland H, Hillman J, Brandt L, Edner G, Jakobsson KE, Algers G. Overall outcome in aneurysmal subarachnoid hemorrhage. A prospective study from neurosurgical units in Sweden during a 1-year period. J Neurosurg 1992; 76: 729-34.
8. Dorai Z, Hynan LS, Kopitnik TA, Samson D. Factors related to hydrocephalus after aneurysmal subarachnoid hemorrhage. Neurosurgery 2003; 52: 763-71.
9. Vale FL, Bradley EL, Fisher WS. The relationship of subarachnoid hemorrhage and the need for postoperative shunting. J Neurosurg 1997; 86: 462-6.
10. Tapaninaho A, Hernesniemi J, Vapalahti M, Niskanen M, Kari A, Luukkonen M et al. Shunt-dependent hydrocephalus after subarachnoid haemorrhage and aneurysm surgery: timing of surgery is not a risk factor. Acta Neurochir 1993; 123: 118-24.
11. Graff-Radford NR, Torner J, Adams HP Jr, Kassell NF. Factors associated with hydrocephalus after subarachnoid hemorrhage. A report of the Cooperative Aneurysm Study. Arch Neurol 1989; 46: 744-52.
12. Vaverka M, Charamza J, Kikalová K, Krahulík D. Morfologická studie lamina terminalis a její klinický význam. Cesk Slov Neurol N 2006; 69: 217–21.
13. Pang D, Sclabassi RJ, Horton JA. Lysis of intraventricular blood clot with urokinase in a canine model: Part 3. Effects of intraventricular urokinase on clot lysis and posthemorrhagic hydrocephalus. Neurosurgery 1986; 19: 553-72.
14. Vale FL, Bradley EL, Fisher WS. The relationship of subarachnoid hemorrhage and the need for postoperative shunting. J Neurosurg 1997; 86: 462-6.
15. Sethi H, Moore A, Dervin J, Clifton A, MacSweeney JE. Hydrocephalus: comparison of clipping and embolization in aneurysm treatment. J Neurosurg 2000; 92: 991-4.
16. Vermeij FH, Hasan D, Vermeulen M, Tanghe HL, Gijn van J. Predictive factors for deterioration from hydrocephalus after subarachnoid hemorrhage. Neurology 1994; 44:1851-5.
17. Yoshioka H, Inagawa T, Tokuda Y, Inokuchi F. Chronic hydrocephalus in elderly patients following subarachnoid hemorrhage. Surg Neurol 2000; 53: 119-25.
18. Lanzino G, Kassell NF, Germanson TP, Kongable GL, Truskowski LL, Torner JC et al. Age and outcome after aneurysmal subarachnoid hemorrhage: why do older patients fare worse? J Neurosurg 1996; 85: 410-8.
19. Sheehan JP, Polin RS, Sheehan JM, Baskaya MK, Kassell NF. Factors associated with hydrocephalus after aneurysmal subarachnoid hemorrhage. Neurosurgery 1999; 45: 1120-8.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2007 Issue 3
Most read in this issue
- Chiariho malformace – vlastní zkušenosti
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Osteoplastická dekompresivní kraniotomie
