Ozáření kraniospinální osy u dětí s meduloblastomy v supinační poloze - dlouhodobé výsledky
Craniospinal Irradiation in Children with Medulloblastoma in Supine Position: Long-Term Results
Radiotherapy is an essential method of treatment for medulloblastoma, but the surgery is the primary treatment of choice in the disorder mentioned. In this study, a total number of 33 pediatric patients under 15 years (median age 8.7 years) were irradiated post-operatively within January 1997 and March 2005. All tumors were located infratentorially in the posterior fossa. Chemotherapy was administered in 26 patients (78 %). The patients with craniospinal irradiation were placed in supine position and fixed with a vacuum-form body immobilizer and a head mask. Irradiation was delivered using a planned dose 26–30 Gy with standard 1.3–1.8 Gy daily fractions for the craniospinal axis with photon beam (6 MV). The median overall survival for the whole group was 55.3 months. The median disease-free survival was 20.6 months, 8 patients (24 %) died. No statistical difference in survival rate between standard and high-risk patients was shown. No relationship was found between survival and age, sex or the tumor size. Endocrine deficits occurred in 30% (8 patients of the group were hypothyroid, growth retardation occurred in 7 patients). Our therapeutical results (those of overall and disease-free survival) and side-effects of the craniospinal axis irradiation technique in supine position are comparable with the treatment results and technique toxicity in prone position.
Key words:
medulloblastoma – radiotherapy – craniospinal irradiation
Authors:
P. Šlampa 1; K. Zitterbart 2; L. Dušek 3; O. Magnová 2; H. Doleželová 1; P. Čoupek 1; P. Pospíšil 1; Š. Sovadinová 1; Z. Pavelka 2; J. Štěrba 2; M. Chrenko 1; K. Miklóšová 1
Authors‘ workplace:
Odd. radiační onkologie, Masarykův onkologický ústav, Brno
1; Klinika dětské onkologie, LF MU a FN Brno
2; Centrum informatiky a analýz, Masarykova univerzita, Brno
3
Published in:
Cesk Slov Neurol N 2007; 70/103(3): 308-314
Category:
Short Communication
Overview
Radioterapie patří mezi základní léčebné metody meduloblastomu, nicméně primární léčebnou metodou je neurochirurgický zákrok. Práce přináší výsledky léčby 33 ozařovaných pacientů dětského věku (medián věku 8,7 roku), kteří byli pooperačně ozařováni v období od ledna 1997 do března 2005. Každý nádor byl histologicky verifikován a všechny byly umístěny infratentoriálně v zadní jámě. Chemoterapie byla aplikována u 26 pacientů (78 %). Pacienti byli kraniospinálně ozařováni v supinační poloze na zádech a fixováni pomocí vakuové dlahy a umělohmotnou obličejovou maskou. Ozařování brzdným svazkem 6 MV lineárního urychlovače bylo provedeno standardní frakcionací 5× 1,5–1,8 Gy/týden, celková dávka 24–30 Gy. Medián celkového přežití celého souboru je 55,3 měsíce a medián bezpříznakového období 20,6 měsíce. Během sledování celkem 8 pacientů (24 %) zemřelo. Ve studii nebyly pozorovány statistické rozdíly v přežití mezi pacienty se standardním a vysokým rizikem. Nebyly také pozorovány statisticky významné rozdíly v závislosti na věku, pohlaví a lokalizaci tumoru, tato skutečnost je dána relativně krátkým mediánem sledování a velikostí souboru. Nebyly rovněž pozorovány rozdíly v závislosti na věku, pohlaví a lokalizaci tumoru. Endokrinní poruchy byly popsány přibližně u třetiny pacientů, především ve formě snížené funkce štítné žlázy a růstové retardace. Léčebné výsledky a vedlejší účinky léčby ozařování kraniospinální osy v supinační poloze jsou srovnatelné s pronační technikou.
Klíčová slova:
meduloblastom – radioterapie – kraniospinální osa
Úvod
Meduloblastom představuje nejčastější maligní nádor centrálního nervového systému dětského věku. Je charakterizován výbornou citlivostí k radioterapii a chemoterapii, avšak úspěšná chirurgická resekce primárního nádoru zůstává základní metodou léčby. Histopatologicky je meduloblastom popisován jako primitivní neuroektodermální tumor (PNET) mozečku, histogenezí spadá mezi embryonální nádory CNS, spolu s ependymoblastomem, supratentoriálním primitivním neuroektodermovým nádorem (meduloepiteliom) a atypickým teratoidem/rabdoidním nádorem CNS.
Meduloblastom má mezi všemi intrakraniálními nádory dětského věku největší tendenci k neuroaxiální diseminaci spinální cestou (11-43 %). Ve vzácných případech se lze setkat i s extraneurálním postižením (skelet, kostní dřeň, mízní uzliny, játra, plíce), zpravidla však v konečné fázi progrese onemocnění. Meduloblastom vyrůstá nejčastěji z vermis mozečku a obyčejně při svém růstu uzavře čtvrtou komoru za vzniku vnitřního hydrocefalu. Incidence je udávána mezi 0,2-0,6/100 000 dětí, s mírou převahou u chlapců, vrchol výskytu je přibližně v pátém roku života. Základní metoda léčby - chirurgický zákrok je doplněn radioterapií (v některých případech bývá ozáření aplikováno konkomitantně s některými cytostatiky, např. vinkristinem, temozolomidem, karboplatinou); u dětí je standardem léčby i následná adjuvantní chemoterapie. Kompletní resekce nádoru je dosahováno v 40-50 %; celkově umožňuje kombinovaná léčba dosáhnout u pacientů standardního rizika 5leté přežití v 70-80 %, u vysokého rizika pouze asi v 25-40 % [1,2,3].
Meduloblastom je radiosenzitivní nádor, radioterapie je součástí většiny léčebných protokolů. Historicky starší technikou radioterapie kraniospinální osy je ozařování v poloze pronační, na břiše. Nově používanou technikou je radioterapie v poloze ozařovaného těla v supinaci, na zádech. U nízce rizikových meduloblastomů se dnes dává přednost nižším dávkám záření na oblast kraniospinální osy, 24 Gy; u vysoce rizikové skupiny 30-36 Gy. Obava z pozdních následků ozařování u dětí standardního rizika starších 3 a mladších 8 let vedla k formulaci postupu radioterapie v současnosti probíhající COG studie (Children´s Oncology Group), kde jsou ozařovaní pacienti randomizováni podle dávky záření na osu - 23,4 Gy versus 18,0 Gy. Všichni pacienti obdrží následnou chemoterapii alternujícími cykly založenými na kombinaci obsahující cisplatinu a nebo cyklofosfamid. Výsledky jsou s napětím očekávány. Za pacienta vysokého rizika je považováno dítě s pooperačním reziduem větším než 1,5 cm² na MR snímku provedeném do 48 hodin po chirurgickém výkonu, pacient s prokázanou diseminací do likvoru či míšního kanálu (M+ nemoc dle tzv. Changovy klasifikace) a dále všechny děti mladší 3 let. Velkobuněčný fenotyp nádoru a přítomnost některých negativních biologických znaků (např. amplifikace protoonkogenů MYCC a MYCN) jsou nově považovány rovněž za nepříznivé prognostické faktory přežití [4,5,6].
Role adjuvantní chemoterapie je v léčbě dětí nezpochybnitelná a byla prokázána v řadě randomizovaných studií. Nejvíce jsou používány platinové deriváty a alkylační preparáty (cDDP, CBDCP, cyklofosfamid, CCNU, temozolomid). U dospělých pacientů, vzhledem vzácnému výskytu onemocnění, nebyla randomizovaná studie prokazující přínos adjuvantní chemoterapie provedena a doporučení vychází z retrospektivních analýz. Přesto je dnes adjuvantní chemoterapie považována za přínosnou i u dospělých, především u pacientů s vysokým rizikem recidivy. Vysokodávkovaná chemoterapie s autologní transplantací kostní dřeně u PNET tumorů patří mezi metody klinických studií, které mají za cíl další zlepšení léčebných výsledků u rizikových nádorů a relapsů onemocnění [7,2,8].
Materiál a metodika
V období od ledna 1997 do března 2005 bylo pooperačně ozářeno na brněnských pracovištích (1997-2000 FN u sv. Anny, v dalším období v Masarykově onkologickém ústavě) celkem 33 pacientů dětského věku s histologicky verifikovaným meduloblastomem (pod odborným vedením stejného radioterapeuta). Charakteristiku souboru uvádí tab. 1. Medián věku je 8,7 roku, celkem 22 nemocných je chlapců. Každý nádor byl histologicky verifikován a všechny byly umístěny infratentoriálně v zadní jámě. Chemoterapie byla pooperačně aplikována u 26 pacientů (78 %). Pacienti byli kraniospinálně ozařováni v supinační poloze na zádech. Ozařování brzdným svazkem 6 MV lineárního urychlovače bylo provedeno standardní frakcionací 5x1,5-1,8 Gy/týden do celkové dávky 24 Gy (standardní riziko) a 30 Gy (vysoce riziková skupina).
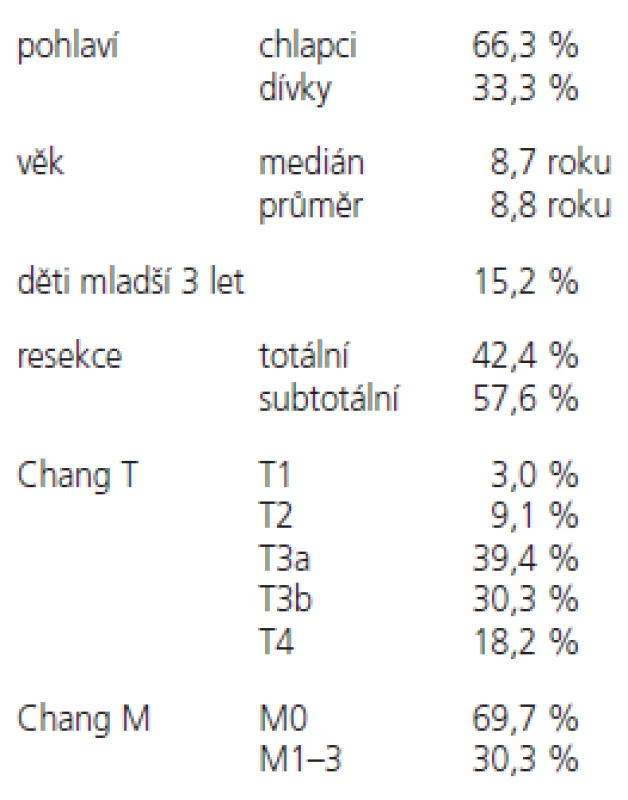
Poloha pacienta na ozařovacím lůžku je na zádech, supinační, hlava je fixována individuální umělohmotnou maskou, tělo event. vakuovou dlahou. Barevné značení laserových značek na kůži pro určení stejné polohy pacienta během ozařování je prováděno v celém rozsahu viditelnosti laserového paprsku na těle ozařovaného (obr. 1). U velmi malých a neklidných dětí byla provedena příprava a ozařování za krátkodobé celkové narkózy a za přítomnosti anesteziologa a monitorování životních funkcí s možnou kontrolou anesteziologem mimo ozařovnu.
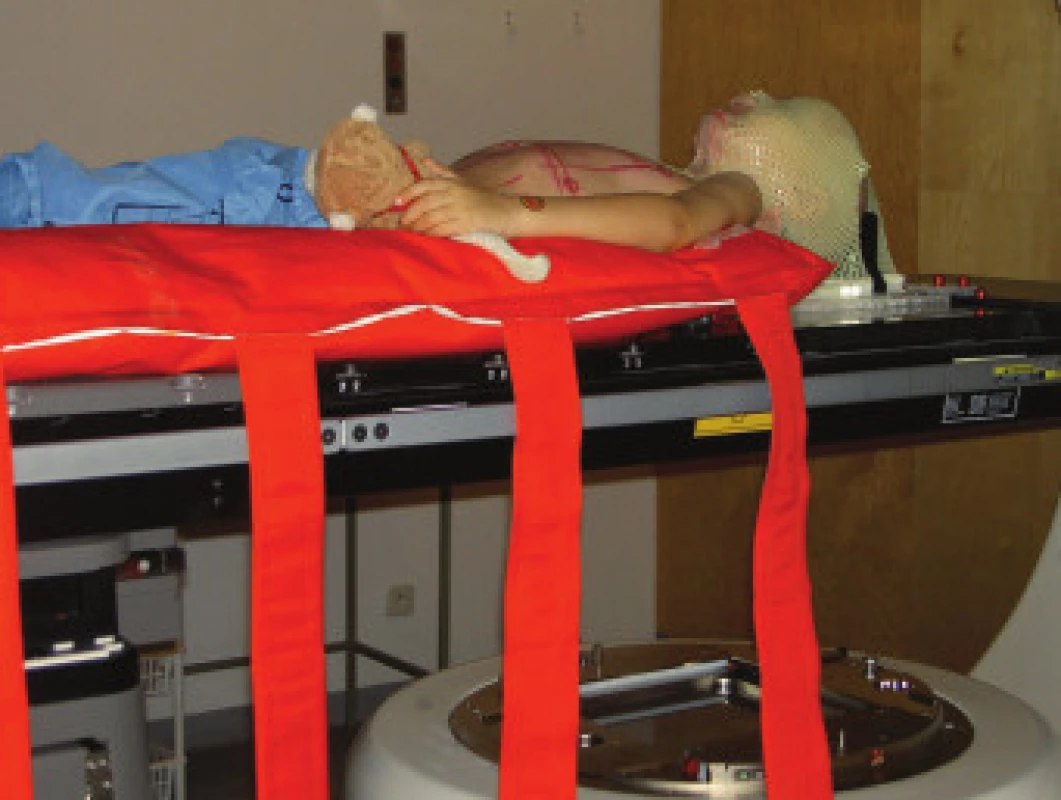
Plánovaný cílový objem (PTV) je určen anatomickým rozsahem mozkomíšních obalů (mozkovna, spinální vak s kaudální hranicí úrovně těl obratlů S2-4) a provádí se na oblast celého objemu mozkovny; v plánovaném objemu léčby by měla být i hypofýza. V cílovém objemu musí být zahrnuta celá mozkovna s bezpečnostním lemem 1-2 cm od vnitřních okrajů jejího skeletu, hranice plánovaného cílového objemu probíhá 5 mm pod frontálními siny a l cm pod okraji temporálních laloků. V oblasti krční míchy při ozařování laterolaterálními poli je ventrální hranice ozařovacího pole 5 mm před okrajem těl obratlů. Z hlediska prevence vzniku pozdních asymetrií těl obratlů po ozáření jsou v plánovaném cílovém objemu zahrnuty celé obratle i s příčnými výběžky.
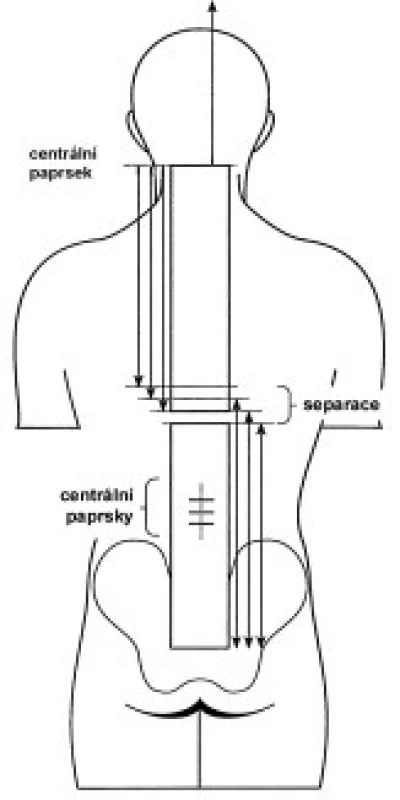
Technika radioterapie - mozkovna s kraniální částí krční míchy (na úroveň obratlů C2-4) je ozařována dvěma laterolaterálními poli, spinální osa je ozařována přímými poli z dorzálního směru. Všechna pole jsou ozařována brzdným svazkem lineárního urychlovače. Poloha a technika ozáření jsou znázorněny na obr. 2 a 3. Hranice mezi laterolaterálními poli a proximálním spinálním pole je zajištěna využitím asymetrických clon. Úpravou divergence svazku záření asymetrickým uzavřením clon sousedních polí v rovině centrálního paprsku je dosáhnuto velmi přesného napojení dvou sousedních ozařovaných polí. Separace dvou sousedních ozařovaných páteřních polí je určena pomocí 3D plánovacího systému. V průběhu celé doby ozařování spinální osy je vhodné aspoň 2krát měnit velikost polí v kraniokaudálním rozměru při zachování optimální separace polí. Tím se omezí riziko předávkování (vlivem překrývání sousedních polí) či poddávkování zářením v oblasti míchy (příliš velká separace sousedních ozařovaných polí).
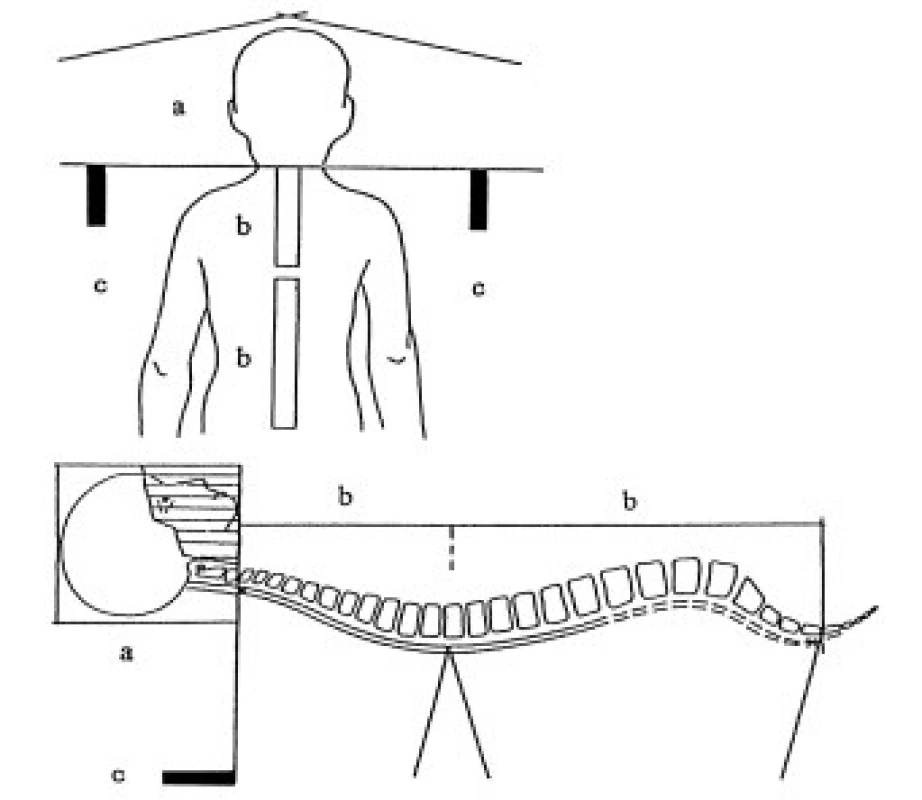
Frakcionace a dávka - u ozařování dětí je dávka a frakcionace určena přímo mezinárodním léčebným protokolem POG (Pediatric Oncology Group). Standardním postupem je dávka 24-30 Gy na celou kraniospinální osu (23,4-25 Gy u standardně rizikových nádorů PNET, u vysoce rizikových nádorů PNET 30 Gy), pak cílené ozáření zadní jámy a lůžka tumoru do dávky 54 Gy. Dávka záření je plánována a počítána dle doporučení ICRU (Int. Commission on Radiation Units and Measurements) na střed laterolaterálního průměru mozkovny a zadní okraj těla obratle.
Plánování radioterapie - CT plánování: v oblasti míšního kanálu je vzdálenost plánovacích scanů 3-5 cm, v oblasti mozkovny 0,5-2 cm. Po vymezení cílového objemu ošetřujícím lékařem v plánovací konzole pro 3D plánování jsou určeny optimální velikosti polí, separace sousedních polí. Dále jsou připraveny individuální vykrývací bloky nebo je využit systém vykrývacích lamel v hlavici přístroje pro vykrytí obličejové části hlavy (tzv. vícelamelový kolimátor - lamely upravují ozařovací pole na nepravidelný tvar). Lokalizace ozařovaných polí je ověřena na RTG simulátoru.
Statistické zpracování bylo provedeno pomocí χ2-test podle Kruskal-Wallis rank testu. Přežití a lokální kontrola byla zpracována Kaplanovou-Meierovou metodou.
Výsledky
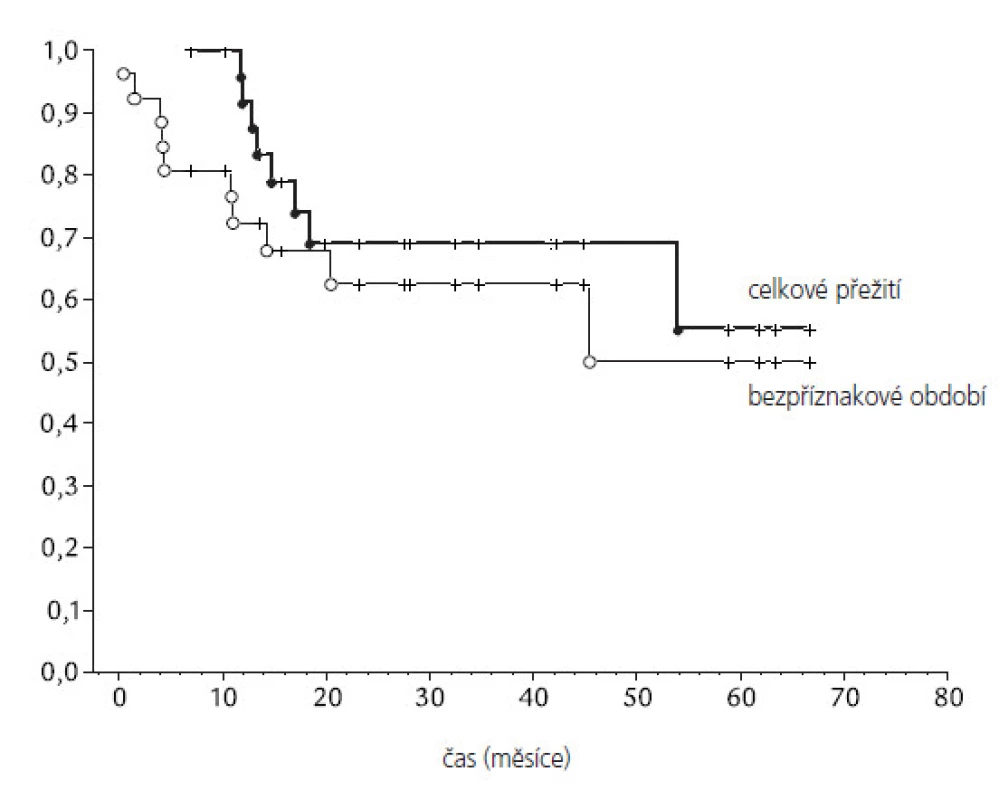
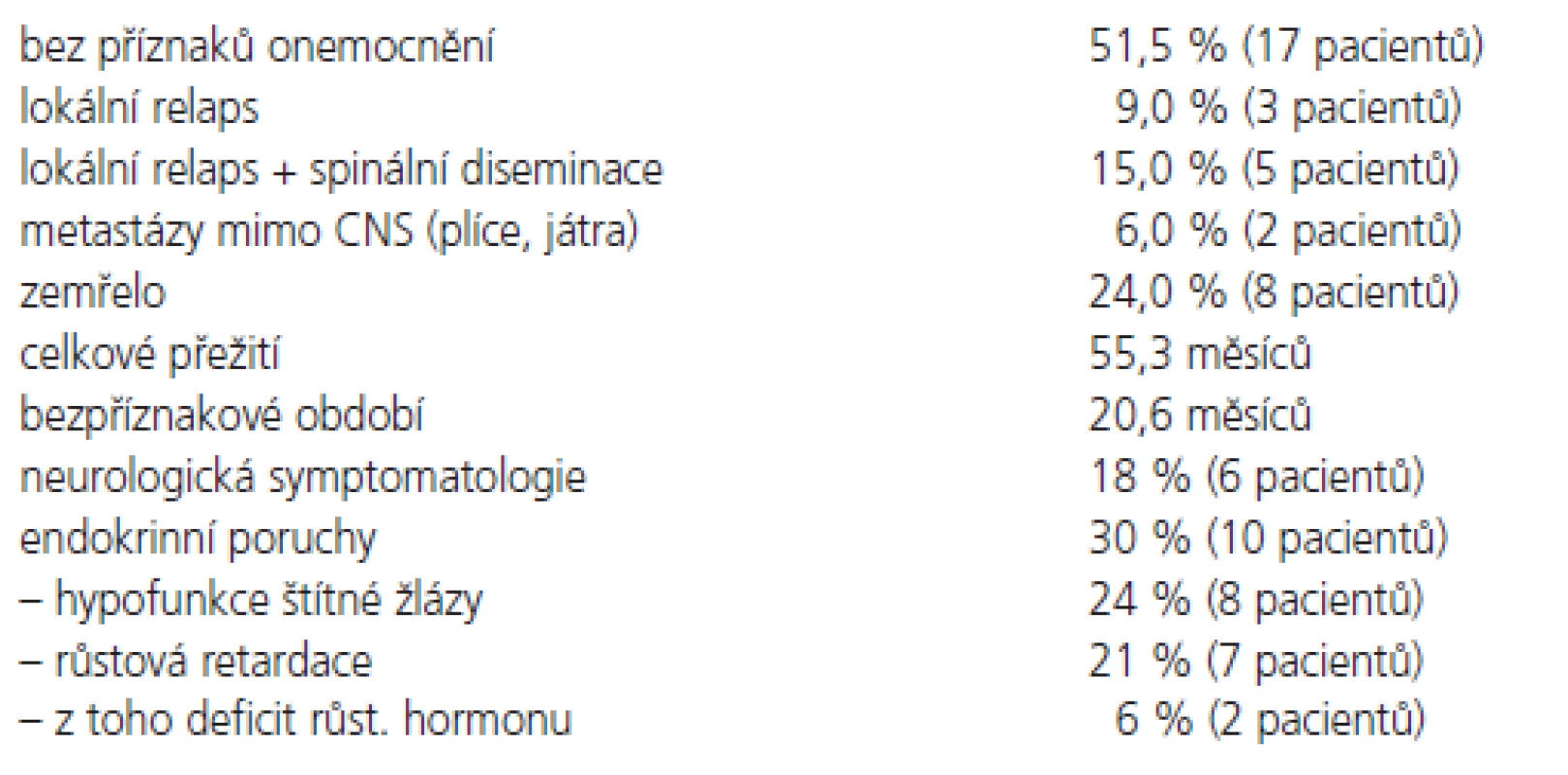
Všichni pacienti obdrželi na oblast kraniospinální osy plánovanou dávku záření. V době vyhodnocování léčebných výsledků (leden 2006) celkem 17 pacientů (51,5%) žije bez příznaků choroby, jeden pacient má lokální recidivu. Medián celkového přežití všech pacientů souboru je 55,3 měsíců a medián bezpříznakového období 20,6 měsíců (obr. 4). Během sledování celkem 8 pacientů (24 %) zemřelo. Lokální relaps onemocnění byl pozorován u 3 pacientů (9 %), lokální recidiva s diseminací do spinálního vaku u 5 pacientů (15 %), vzdálené metastázy byly pozorovány u 2 pacientů - skelet a játra. Nebyly pozorovány statistické rozdíly v přežití mezi pacienty se standardním a vysokým rizikem, ze statistického hlediska je výsledek ovlivněn nízkým počtem pacientů v souboru. Nebyly také pozorovány rozdíly v závislosti na věku, pohlaví a lokalizaci tumoru (tab. 2), výsledek je opět ovlivněn nízkým počtem pacientů v souboru. U 6 pacientů (18 %) jsou přítomné vážnější neurologické symptomy (parézy, neurokognitivní poruchy), které vznikly po chirurgické léčbě. Endokrinní poruchy byly popsány celkem přibližně u třetiny pacientů. Známky hypofunkce štítné žlázy se projevily u 8 z 33 pacientů, u 7 pacientů je přítomna významná růstová retardace s podezřením na deficit růstového hormonu, u dvou z těchto pacientů byl prokázán deficit růstového hormonu a je jim podávána substituční terapie.
Radioterapie v supinační poloze byla velmi dobře tolerována. Během ozařování se objevila kožní radiodermatitida 1. st. (WHO) u všech pacientů, radiodermatitida 2. st. se projevila u 8 pacientů (24 %) zvláště v oblasti ušních boltců. Gastrointestinální a hematologické vedlejší účinky 1.-2. st. (WHO) se objevily u všech pacientů, nevyskytla se reakce 3. st. (leukopenie 1. st. byla vyjádřena u 70 %, 2. st. u 18 % pacientů; trombocytopenie 1. st. byla popsána u 35 % pacientů; průjem 1. st. se projevil u 47 %, 2. st. u 23 % pacientů; nauzea se objevila v 36 % případů). Částečný podíl na gastrointestinální a hematologické toxicitě je možno u některých pacientů přisoudit rovněž konkomitantně podané chemoterapii (vinkristin, temozolomid).
Diskuse
Radioterapie představuje nedílnou součást komplexní terapie většiny dětských malignit. Indikace, plánování a provádění vlastní radioterapie u dětí podléhá přísnějším pravidlům než léčba dospělých především pro vyšší riziko vzniku nežádoucích následků, s nimiž budou děti léta žít. Používají se proto moderní techniky záření se snahou minimalizovat pozdní ireverzibilní komplikace, aniž by byla snížena šance na vyléčení. Ozařování se provádí na lineárních urychlovačích fotonovým zářením s energií v rozmezí 4-10 MV nebo elektronovým zářením a ve vybraných centrech protonovým zářením. Děti jsou během záření uloženy ve stabilizované, snadno reprodukovatelné poloze, fixovány pomocí masky z termoplastického materiálu při ozařování v oblasti hlavy, krku, či vakuovou matrací při ozařování oblasti trupu či končetin. Plánování se provádí na základě snímků z plánovacího CT vyšetření nebo na základě fúze CT a MR vyšetření na plánovacích počítačových systémech, které umožňující trojrozměrné plánování, a řídí se jasně danými pravidly [4,9].
Ozáření mozku nejmenších dětí (do tří let věku), zvláště v kombinaci s intratekální aplikací cytostatik přináší snížení intelektu až u poloviny takto léčených dětí (IQ kolem 70). I u starších dětí dochází ozářením mozku k ovlivnění emotivních a kognitivních funkcí (snížená pozornost, nižší koncentrace, horší krátkodobá paměť, snížení IQ). Může vzniknout i sekundární encefalopatie a epilepsie. Ozáření hypotalamu, hypofýzy a pineálního tělíska může vyvolat poruchy růstu a vývoje puberty, tyreopatie i další hormonální dysfunkce. Rovněž samotná radioterapie na kraniospinální osu, i bez hormonálního deficitu, vede k mírné růstové retardaci svým efektem na dětský skelet. U některých pacientů se lze často setkat s přítomností více než jednoho endokrinního deficitu (možná je např. kombinace periferní hypotyreózy a deficitu růstového hormonu [10-14].
Popsaná technika ozáření kraniospinální osy je odlišná od jiných, v odborné literatuře publikovaných technik. Zásadním rozdílem uvedené techniky ozáření kraniospinální osy je poloha nemocného na zádech - supinační poloha. Tato poloha je pro nemocné snesitelnější, přirozenější a tedy pohodlnější. Navíc zkracuje dobu vlastního ozáření vzhledem ke snadnějšímu nastavení ozařovací polohy. Tyto výhody se projeví především u nemocných s neurologickou symptomatologií po chirurgickém zákroku (parézy, poškození motorických a senzorických funkcí aj). Manipulace s nemocným do polohy na břiše a zajištění stejné reprodukovatelné polohy je nepoměrně obtížnější pro samotného nemocného i pro ošetřující personál. Dávky záření a frakcionace jsou stejné jako u publikovaných technik ozáření kraniospinální osy v pronační poloze na břiše [4,15,16].
V supinační poloze na zádech jsou pro fixaci pacienta používány standardní pomůcky pro individuální fixaci - umělohmotné obličejové masky a v případě potřeby i vakuové dlahy. Což znamená i ekonomickou výhodu proti složitě připravovaným nebo nákladným firemně vyráběným individuálním fixačním pomůckám pro polohu na břiše. Standardní fixace hlavy umělohmotnou maskou a ev. trupu a končetin vakuovou dlahou nahradilo ve všech případech i nutnost celkové anestezie během vlastního ozařování, která je v řadě prací doporučována [1,17].
Technika asymetrických clon je využívána i pro techniku ozařování kraniospinální osy v poloze pronační, na břiše [18]. Úpravou divergence svazku záření asymetrickými clonami je dosaženo velmi přesného napojení dvou sousedních ozařovaných polí, především v případě, kdy asymetrické uzavření clon sousedních polí je v rovině centrálního paprsku (ověřeno filmovou dozimetrií). Snižuje se riziko nehomogenního ozáření spinálního vaku, které je největším problémem při napojení laterolaterálních a spinálního přímého pole v oblasti krční míchy za použití symetrických polí [1,15,17].
Ozáření kraniospinálního přechodu v supinační poloze a za pomoci techniky asymetrických polí snižuje riziko slizničních reakcí v dutině ústní a poškození chrupu po ozáření. Svazek záření ze spinálního pole obyčejně nezasahuje mandibulu a dutinu ústní (obr. 2), na rozdíl od technik záření při pronační poloze ozařovaného [19,20].
Standardním postupem brněnské techniky v průběhu vlastní doby radioterapie (v případě ozařování spinální osy) je měnit velikost polí v kraniokaudálním rozměru při zachování optimální separace polí. Tím se omezí riziko předávkování (vlivem překrývání sousedních polí) či poddávkování zářením v oblasti míchy (příliš velká separace sousedních ozařovaných polí). Obdobné změny jsou prováděny i u pronačních technik ozařování [18,20-22].
Technika ozáření spinální osy v supinační poloze při použití vakuové dlahy u neklidných dětí znamená zvýšení povrchové dávky záření na kůži. Toto zvýšení dávky je však únosné s ohledem na celkově aplikovanou dávku záření (25-30 Gy) do cílového objemu. Nemůže dojít k překročení tolerančních dávek kůže na záření. Při dozimetrickém ověření techniky s použitím vakuových dlah bylo změřeno maximálně 35% zvýšení dávky záření na kůži. Vliv 5cm šířky vakuové dlahy v ozařovaném poli se projevuje zanedbatelným 1% zmenšením hloubkové dávky [23,24].
Nejčastější komplikací ozáření kraniospinální osy u pacientů našeho souboru byly změny v hodnotách krevního obrazu, a dále gastrointestinální obtíže, u nichž nelze vyloučit i vliv v některých případech aplikované konkomitantní chemoterapie. Velmi častou komplikací byla deskvamační reakce kůže v oblasti ušních boltců, která se více projevuje až při ozařování zmenšenými poli na oblast původního tumoru v zadní jámě lební. Tato reakce byla ve všech případech symptomatickou lokální terapií zvládnuta. Obdobné komplikace léčby jsou popisovány na větších souborech nemocných [8,25,26].
V roce 2001 byly publikovány dvě práce zabývající se otázkou ozařování kraniospinální osy v supinační poloze. Rades et al na souboru 12 nemocných (ozářených v letech 1997-2000) popisují dozimetrickou kontrolu separace 3 sousedních polí v oblasti krční páteře (2 laterolaterální pole na mozkovnu a přímé pole na spinální část CNS) pomocí filmu. Nedílnou součástí plánování této techniky je také trojrozměrné 3D plánování a potřeba fixačních pomůcek (masky, dlahy). Filmovou dozimetrií ověřené hodnoty záření v místě separace odpovídají plánovaným dávkám. Metodu autoři pokládají za standardní techniku ozáření kraniospinální osy a z více důvodů (větší komfort, menší potřeba celkové anestezie aj) za přijatelnější, zvláště pro pacienty [27]. Hawkins et al také charakterizují svou metodu ozáření kraniospinální osy v supinaci za adekvátní alternativu ozáření v pronační poloze. Technika je tvořena ze 2 laterolaterálních polí na oblast mozkovny s individuálním vykrytím a 1 přímého pole na spinální osy z větší vzdálenosti zdroje než 100 cm. Výpočtem stanovený úhel kolimačního systému (v 3D plánovacím systému) a vzdálenost zdroje je základem nastavení optimální separace polí v oblasti krční míchy. Správnost nastavení je denně ověřována portálním snímkováním přímo na ozařovacím přístroji. Tato technika nevyužívá možností asymetrických clon kolimačního systému [21].
Celkové 10leté přežití pacientů s meduloblastomy se obvykle v odborné literatuře udává mezi 40-50 %, 70-80 % u pacientů standardního a asi 25-40 % u vysokého rizika. Za základní faktory ovlivňující léčebné výsledky se pokládá radikalita chirurgického výkonu, věk pacienta, přítomnost metastatického postižení leptomening a pozitivní nález nádorových elementů v mozkomíšním moku [1-3,9,26,28].
Věk v době diagnózy je významným prognostickým faktorem. Děti starší 3 let mají lepší prognózu než mladší děti. Naopak u adolescentů je oproti mladším dětem akcentována vyšší hematologická a neurologická toxicita, která může u podstatné skupiny adolescentů vést ke zpožděním zahájení jednotlivých metod léčby podle protokolů a k modifikaci dávek chemoterapie. V našem souboru nebyl pozorován signifikantní rozdíl v závislosti na věku dítěte, nicméně výsledek je relativní vzhledem ke statistickému nízkému počtů pacientů v souboru [13,15,19,25,26].
Riziko chronických postradiačních změn se snižuje při použití hyperfrakcionovaného způsobu radioterapie, 2krát denně menší dávkou než 2 Gy, obvykle 1,2 Gy. Tento způsob techniky radioterapie nepatří do standardních metod ozařování kraniospinální osy, navíc zvyšuje riziko akutních a subakutních komplikací v oblasti CNS. Provedené studie s hyperfrakcionačním režimem prozatím neprokázaly zlepšení léčebných výsledků a ani snížení výskytu pozdních ireverzibilních změn po ozáření kraniospinální osy [20,25,26].
Radioterapie s modulovanou intenzitou svazku (Intensity Modulated Radiation Therapy, IMRT) je moderní konformní způsob radioterapie využívající dynamický vícelamelový kolimátorový systém vymezující nepravidelný tvar ozařovaného pole během vlastního záření a inverzní způsob plánování dávky v cílovém objemu a v okolních orgánech a strukturách. Ozařování kraniospinální osy IMRT technikou přináší nižší riziko poškození vnitřního ucha [29].
Závěr
Popisovaná technika radioterapie potvrzuje v praxi zlepšení reprodukovatelnosti polohy při ozařování. Významné je i zlepšení komfortu ozařovaných nemocných při vlastním ozařování. Standardní fixace (umělohmotné masky, vakuové dlahy) v supinační poloze minimalizuje potřebu fixace nemocného dítěte za pomoci celkové anestezie. Uváděná technika ozáření kraniospinální osy v supinační poloze prokazuje v mnoha směrech přínos pro pacienta i pro ošetřující radioterapeutický personál než dosud uváděné standardní techniky s pronační polohou nemocného při ozařování. Jednodušší reprodukovatelnost polohy a snadnější manipulace s nemocným určitě snižuje i míru rizika chyb v nastavení polohy ozařovaného. Při teoretickém zvládnutí uváděné techniky z dozimetrického hlediska neznamená její příprava žádné zvýšení nároků na plánující fyzikální jednotku. Studie provedené na větším počtu pacientů potvrzují, že léčebné výsledky a vedlejší účinky léčby ozařování kraniospinální osy v supinační poloze jsou srovnatelné s pronační technikou. Výsledky uváděné v předložené retrospektivní studii odpovídají literárním údajům, nicméně jsou statisticky ovlivněny nízkým počtem pacientů v souboru [27,30].
Při ozařování kraniospinální osy je také důležitá prevence vzniku deformit páteře u rostoucího organizmu pravidelným procvičováním a zpevňováním zádového svalstva. V těchto činnostech je nenahraditelná úloha poučených a spolupracujících rodičů.
Přijato k recenzi: 12. 5. 2006
Přijato do tisku: 2. 11. 2006
doc. MUDr. Pavel Šlampa, CSc.
Masarykův onkologický ústav
Odd. radiační onkologie
Žlutý kopec 7,
656 53 Brno
e-mail: slampa@mou.cz
Sources
1. Boom HJG, Glees J, Bell J. The treatment and long-term prognosis of children with intracranial tumors.A study of 610 cases, 1950-1981. Int J Rad Oncol Biol Phys 1990; 18: 723-45.
2. Freeman CR, Taylor RE, Kortmann RD, Carrie Ch. Radiotherapy for medulloblastoma in children: A perspective on current international clinical research efforts. Med Pediatr Oncol 2002; 39: 99-108.
3. Rood BR, MacDonald TJ, Packer RJ. Current treatment of medulloblastoma: Recent advances and future challanges. Semin Oncol 2004; 31: 666-75.
4. Gilbertson RJ. Medulloblastoma: signalling a change in treatment. The Lancet Oncology 2004; 5: 209-18.
5. Stiller CA, Bunch KJ. Trends in survival for childhood cancer in Britain diagnosed 1971-85. Br J Cancer 1990; 62: 806-15.
6. Thomas PRM, Deutsch M, Kepner JL, James M, Boyett M. Low-stage medulloblastoma: final analysis of trial camparing standard-dose with reduced-dose neuraxis irradiation. J Clin Oncol 2000; 18: 3004-11.
7. Duffner PK, Horowitz ME, Krischer JP, Friedman S. Postoperative chemotherapy and delayed radiation in children less than three years of age with malignant brain tumore. N Engl J Med 1993; 328: 1725-31.
8. Bergman I, Jakacki RI, Heller G, Finlay J. Treatment of standard risk medulloblastoma with craniospinal irradiation, carboplatin, and vincristine. Med Pediatr Oncol 1997; 29: 563-7.
9. Kortmann RD, Kuhl J, Timmermann B, Mittler U, Urban C, Budach V et al. Postoperative neoadjuvant chemotherapy before radiotherapy as compared to immediate radiotherapy followed by maintenance chemotherapy in the treatment of medulloblastoma in childhood: results of the German prospective randomized trial HIT´91. Int J Radiat Oncol Biol Phys 2000; 46: 269-79.
10. Corrias A, Picco P, Einaudi S. Growth hormone treatment in irradiated children with brain tumors. J Pediatr Endocrinol Metab 1997; 10: 41-9.
11. Chin D, Sklar C, Donahue B, Naaveen U, Geneiser N, Allen J et al. Thyroid dysfunction as a late effect in survivors of pediatric medulloblastoma/primitive neuroectodermal tumors: a comparison of hyperfractionated versus convectional radiotherapy. Cancer 1997; 80: 798-804.
12. Jannoun L, Boom HJG. Long-term psychological effects in children treated for intracranial tumors. Int J Rad Oncol Biol Phys 1990; 18: 747-53.
13. Sarah FH, Driever PH, Thilmann C, Mose S, Wilson P, Sharpe G et al. Survival of very young children with medulloblastoma (PNET of the posterior fossa) treated with craniospinal irradiation. Int J Radiat Oncol Biol Phys 1998; 42: 959-67.
14. Ribi K, Relly C, Landolt MA, Alber FD, Boltshauser E, Groetzer M et al. Outcome of medulloblastoma in children: long-term complications and quality of life. Neuropediatrics 2005; 36: 357-65.
15. David KM, Carey AT, Hayward RD. Medulloblastoma: is the 5-years survival rate improving ? A rewiev of 80 cases from a single institution. J Neurosurg 1997; 86: 13-21.
16. Taylor RE. The SIOP/UKCCSG PNET strategy and future SIOP medulloblastoma studies. Med Pediatr Oncol 2000; 35: 220.
17. Miralbell R, Bleher A, Huquenin P, Ries G, Kann R, Mirimanoff R et al. Pediatric medulloblastoma: radiation treatment technique and patterns of failure. Int J Rad Oncol Biol Phys 1997; 37: 523-9.
18. Griffiths SE, Short ChA. Radiotherapy: Principles to Practice. First Ed. Edinburgh: Churchill Livingstone 1994.
19. Goldwein JW, Ratcliffe J, Johnson J, Moshang T, Pacher RJ, Sutton LN et al. Uptadet results of a pilot study of low dose craniospinal irradiation plus chemotherapy for children under five years with cerebellar primitive neuroectodermal tumors (medulloblastoma). Int J Rad Oncol Biol, Phys 1996; 34: 899-904.
20. Marymont MH, Geohas J, Tomita T. Hyperfractionated craniospinal radiation in medulloblastoma. Pediatr Neurosurg 1996; 24: 178-84.
21. Hawkins R. A simple method of radiation treatment of craniospinal fields with patient supine. Int J Rad. Oncol Biol Phys 2001; 49: 261-4.
22. Slampa P, Seneklova Z, Sterba J, Dembicka D, Burianova L, Burkon P et al. The new technique of craniospinal irradiation. Med Pediatr Oncol 2000; 35: 318.
23. Slampa P, Burkon P, Sterba J, Petera J, Seneklova Z, Dembicka D et al. The technique of craniospinal irradiation in the management of intracranial ependymomas. J BUON 2002; 7: 131-6.
24. Šlampa P, Pecina J, Vývoda M. Využití vakuových dlah při ozařování. Klinická onkologie 1992; 5: 154-6.
25. Allen JC, Donahue B, Da Rosso G, Nierenberg A. Hyperfractionated craniospinal radiation and adjuvant chemotherapy for children with newly diagnosed medulloblastoma and other primitive neuroectodermal tumors. Int J Rad Oncol Biol Phys 1996; 36: 1155-61.
26. Penzzotta S, Cordero ML, Knerich R. CNS-85 trial: a cooperative pediatric CNS tumor study - results of treatment of medulloblastoma patients. Childs Nerv Syst 1996; 12: 87-96.
27. Rades D, Baumann R, Bremer M, Lehwer M, Karstens JH et al. Application of a new verification technique allowing craniospinal irradiation in supine position. Radiother Oncol 2001; 58: 217.
28. Bolek-Gorska M, Korab-Chrzanowska E, Zcepko R, Betlej M, Adamek D, Pawlega J. Medulloblastoma in adults. A case presentation and rewiev of the literature. Rep Pract Oncol Radiother, 2006; 11: 49-54.
29. Huang E, Teh BS, Strother DR, Davis QG, Chiu JK, Carpenter LS et al. Intensity-modulated radiation therapy for pediatric medulloblastoma: Early report on the reduction of ototoxicity. Int J Rad Oncol Biol Phys 2002; 52: 599-605.
30. Parker WA, Freeman CR. A simple technique for craniospinal radiotherapy in the supine position. Radiot Oncol 2006; 78: 217-22.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2007 Issue 3
Most read in this issue
- Chiariho malformace – vlastní zkušenosti
- Osmotický demyelinizační syndrom – diagnostika magnetickou rezonancí: kazuistika
- MRI zobrazení mozku u pacientů s myotonickou dystrofií DM 1
- Osteoplastická dekompresivní kraniotomie
