Vaskulární koridor pro implantaci stimulační elektrody do nucleus anterior thalami – experimentální studie
Autoři:
D. Hrabovský 1; M. Joukal 2; M. Baláž 3; J. Kunst 3; J. Chrastina 1
Vyšlo v časopise:
Cesk Slov Neurol N 2023; 86(2): 140-145
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccsnn2023140
Souhrn
Cíl: U nemocných s farmakorezistentní epilepsií bez možnosti jiné operační terapie lze zvážit stimulaci předního talamického jádra (anterior thalamic nucleus; ATN). ATN prominuje do postranní komory jako tuberculum thalami, jehož ohraničení a koridor pro implantaci elektrody tvoří v. thalamostriata laterálně a choroidální plexus s v. chorioidea superior mediálně. Cílem práce bylo studium šířky tohoto vaskulárního koridoru z hlediska bezpečnosti implantace a redukce záchvatů (nejlepší při stimulaci přední části jádra). Soubor a metodika: Po disekci obou hemisfér preparátů s nástřikem intrakraniálních cév bylo identifikováno tuberculum thalami (ATN) s cévním ohraničením. Měření šířky koridoru byla prováděna 2, 4 a 6 mm od překrytí v. thalamostriata a plexus chorioideus nebo od junkce zmíněných žil. Výsledky: Měření byla provedena celkem na šesti preparátech. Medián šířky koridoru byl 2 mm od žilní junkce 2,5–3 mm a ve vzdálenosti 4 a 6 mm 4–4,5 mm. V dorzální části tuberculum thalami byla pozorována malá nekonstantní žilní struktura. Po odečtení 1,3 mm (průměr elektrody) od šířky koridoru je rezervní prostor ve vzdálenosti 2 mm 1,2–1,8 mm a ve vzdálenosti 4 i 6 mm od junkce 2,7–3,2 mm. Závěr: Úzký vaskulární koridor (především v přední části ATN) klade vysoké nároky na předoperační plánování a přesnost implantace, aby se maximalizoval účinek stimulační léčby a zároveň se zabránilo riziku vaskulárního konfliktu.
Klíčová slova:
epilepsie – hluboká mozková stimulace – stereotaktické techniky – přední talamické jádro – vena thalamostriata
Úvod
U nemocných s farmakorezistentní epilepsií, u nichž není možné provést resekci epileptogenního ložiska nebo epileptochirurgická resekce nevede k poklesu četnosti záchvatů, lze zvážit elektrickou stimulaci nervus vagus vlevo. Tento výkon přináší více než 50 % nemocných šanci na alespoň 50% redukci frekvence epileptických záchvatů [1]. U nemocných, u nichž vagová stimulace nevede k významné redukci tíže a frekvence záchvatů, připadá v úvahu stimulace hlubokých struktur mozku (deep brain stimulation; DBS). V současnosti je nejčastěji využívanou cílovou strukturou přední talamické jádro (anterior thalamic nukleus; ATN). ATN je funkční a anatomickou součástí Papezova limbického okruhu s rozsáhlými spoji do subikulárního kortexu, cingula, corpora mamillaria a retrospleniálního kortexu. Dále je funkční součástí hipokampálního systému. Při stimulaci ATN dochází tedy k funkční modulaci rozsáhlých oblastí mozku potenciálně odpovědných za vznik, šíření a klinickou symptomatologii epileptického záchvatu [2,3].
Zkušenosti s lezionálními operacemi předního talamického jádra pro epilepsii publikovali v roce 1967 Mullan et al [4]. První poznatky o stimulaci ATN u nemocných s farmakorezistentní epilepsií byly publikovány roku 1985 [5]. I když tato pionýrská práce Uptona et al a např. sdělení Hodaie et al [6] popisovaly pozitivní výsledky stimulace ATN z hlediska redukce počtu záchvatů, rozhodujícím podnětem pro širší využití stimulace ATN u nemocných s refrakterní epilepsií se stala multicentrická dvojitě zaslepená randomizovaná studie SANTE (Stimulation of the Anterior Nucleus of the Thalamus for Epilepsy). Studie zahrnovala 110 nemocných, u nichž byla provedena oboustranná implantace stimulačních elektrod do ATN. V iniciální slepé fázi studie (3 měsíce) nebyla stimulace aktivována u poloviny nemocných. U těchto nemocných byl medián poklesu počtu záchvatů 14,5 %. Ve skupině s aktivní stimulací dosahoval medián poklesu počtu záchvatů 3 měsíce po operaci 40,4 %. S odstupem 2 let po implantaci dosáhla střední redukce frekvence záchvatů 56 % [2]. Z recentních prací potvrzujících pozitivní efekt stimulace ATN je možné uvést randomizovanou dvojitě slepou studii Hermanna et al [7]. Roku 2018 Úřad pro kontrolu potravin a léčiv (Food and Drug Administration; FDA) schválil stimulaci ATN pro terapii nemocných s farmakorezistentní epilepsií [8].
Anatomické vztahy ATN se v některých aspektech zásadně liší od jiných cílových struktur stereotaktických operací (např. nucleus subthalamicus, nucleus ventralis intermedius thalamu a globus pallidus internus). Na rozdíl od výše uvedených struktur se ATN nachází subependymálně v oblasti postranní komory mozku těsně za foramen Monroi. Jeho horní plocha se vyklenuje do nitra postranní komory (obr. 1). Při pohledu z nitra postranní komory ATN odpovídá tuberculum thalami, které z laterální strany ohraničuje v. thalamostriata a ze strany mediální choroidální plexus s drénující žilou (v. chorioidea superior). Při implantaci stimulační elektrody transventrikulárním přístupem musí stimulační elektroda procházet tímto koridorem (obr. 2). Alternativou transventrikulárního přístupu je zavedení elektrody z laterálního přístupu pod v. thalamostriata, ovšem i zde je anatomický koridor ohraničen v. thalamostriata a horním okrajem insuly (sulcus circularis insulae) (obr. 3). Tato trajektorie je využívána méně často [8].
Fig. 1. The position of the anterior thalamic
nucleus (green borders) and its relationship
to the structures of the ventricular
system (modified from the Schaltenbrand
Bailey e-atlas).
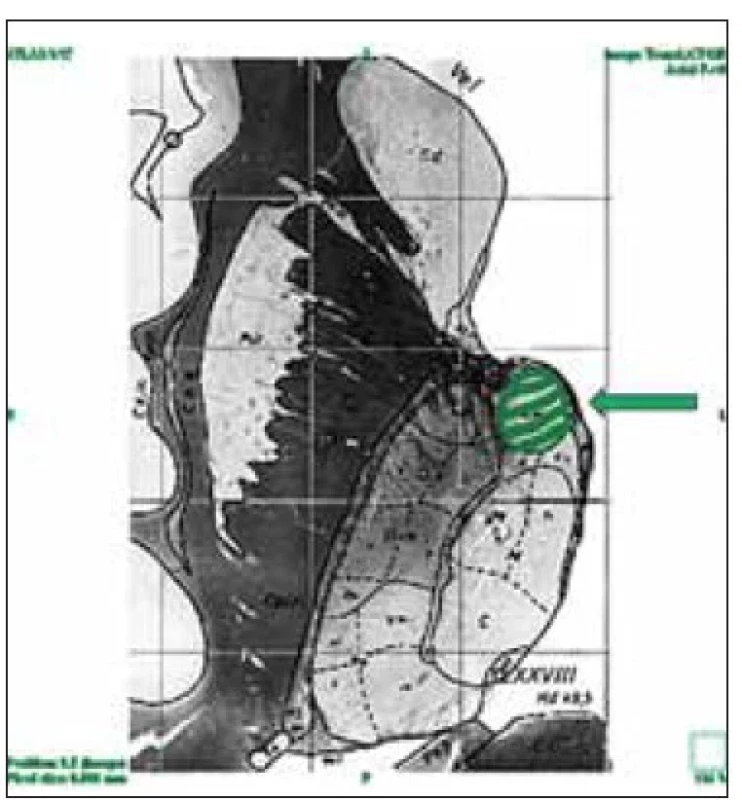
Fig. 2. Coronal section of the brain at the
level of the anterior thalamic nucleus –
the probe shows the transventricular trajectory
to the nucleus anterior thalami
(blue arrow). Subependymal vein located
in the roof of the lateral ventricle in
the proximity of the intended trajectory
(green arrow).
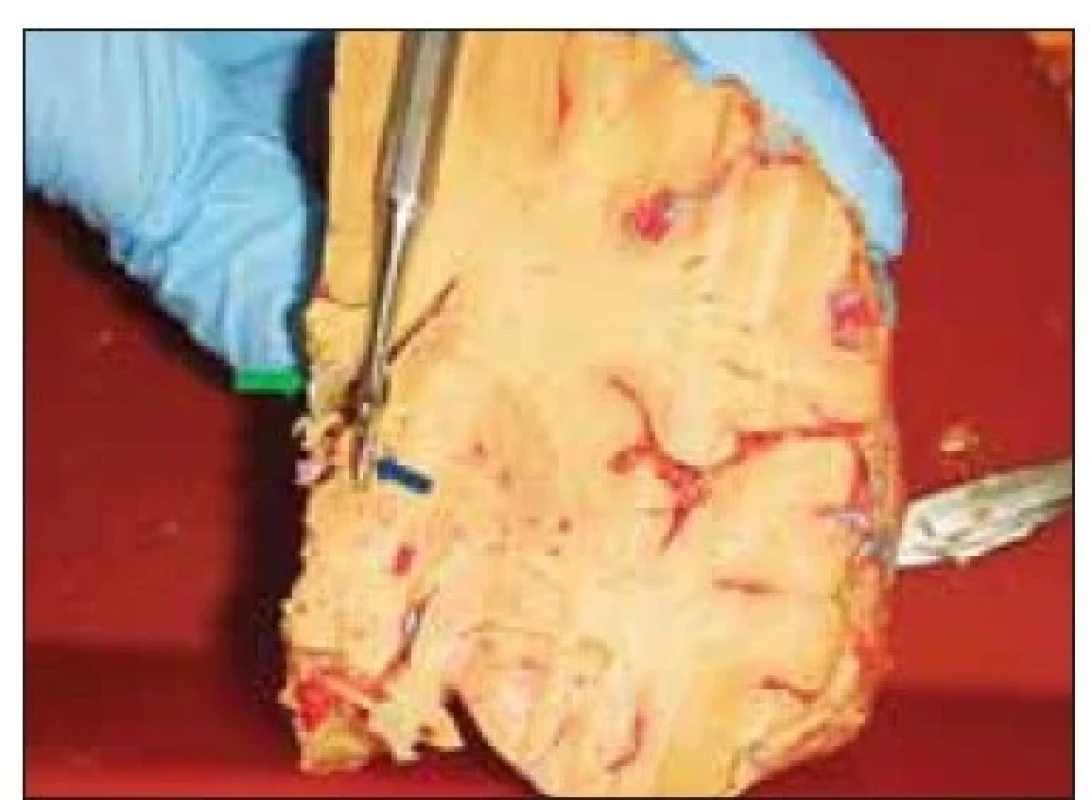
Fig. 3. Lateral trajectory of the anterior
thalamic nucleus electrode – marked by
the probe. Blue arrows delineate the lateral
corridor for the anterior thalamic
nucleus (red dot) electrode.
Cílem předložené experimentální práce byla anatomická analýza trajektorie stereotaktické implantace stimulační elektrody do ATN na kadaverózních modelech zaměřená na cévní vztahy trajektorie elektrody především v oblasti popisovaného žilního koridoru. Tyto struktury jsou zásadní pro bezpečnou a přesnou implantaci stimulační elektrody do ATN.
Soubor a metodika
Pro studii byly využity preparáty Anatomického ústavu LF MU v Brně s provedeným nástřikem nitrolebních arterií a žil primárně připravené pro edukační kurzy zaměřené na neurochirurgické a otorhinolaryngologické operační přístupy.
Prvním krokem při přípravě preparátů byla disekce společných krkavic, vertebrálních tepen a vnitřních jugulárních žil. Následovala jejich kanylace a odstranění krevních sraženin a zbytků formalínu pomocí vysokoobjemové irigace vodou. Poté byly manuálně aplikovány injekce kolorovaného silikonu – přibližně 100 ml silikonu pro arteriální struktury a 150 ml pro žilní kmeny v jednom preparátu. Po nástřiku byly preparáty přibližně den skladovány v roztoku 66% alkoholu [9]. I když byla kvalita preparátů velmi ovlivněna dosaženou fixací mozkové tkáně, identifikace vaskulárních struktur byla možná bez výrazných obtíží.
Již v rámci studie byly na obou hemisférách po preparaci sulcus frontalis superior, sulcus cinculi a sulcus corporis callosi s vyhodnocením kvality nástřiku cévních struktur provedeny horizontální řezy v úrovni těla postranní komory. Tento postup umožnil kromě zhodnocení nástřiku cévních struktur a kvality fixace mozkové tkáně především identifikaci foramen Monroi a okolních struktur – tuberculum thalami, v. thalamostriata a plexus chorioideus s v. chorioidea superior. Cévní struktury bylo možné bezpečně identifikovat i na preparátech s nedokonalou fixací mozkové tkáně. Pro lepší identifikaci struktur a pořízení fotografické dokumentace bylo možné využít disekční mikroskop.
Základem práce bylo měření šířky cévního koridoru mezi v. thalamostriata a choroidálním plexem s v. chorioidea superior, kterým prochází stimulační elektroda do ATN. Šířka koridoru byla měřena ve vzdálenostech 2, 4 a 6 mm od oblasti překrytí choroidálního plexu a v. thalamostriata, nebo při autolyzovaném plexu od soutoku v. thalamostriata a v. chorioidea superior. Měření byla prováděna pomocí přiloženého měřítka a porovnáním velikosti struktur s nástroji o známém průměru – např. olivková sonda o průměru 1 mm. Měření bylo možné provést na šesti preparátech.
Výsledky
Jak ukazuje obr. 2, standardním místem vstupu stimulační elektrody je oblast gyrus frontalis superior, ovšem v závislosti na jeho šíři mohou vstup a počáteční úsek trajektorie elektrody zasahovat do blízkosti sulcus frontalis superior nebo i přes něj procházet. Ze skutečnosti, že se nucleus anterior thalami nachází blízko střední čáry a trajektorie elektrody svírá se střední rovinou velmi ostrý úhel, vyplývá také reálná možnost průchodu elektrody přes sulcus cinguli nebo sulcus corporis callosi, jak je rovněž patrné z obr. 2.
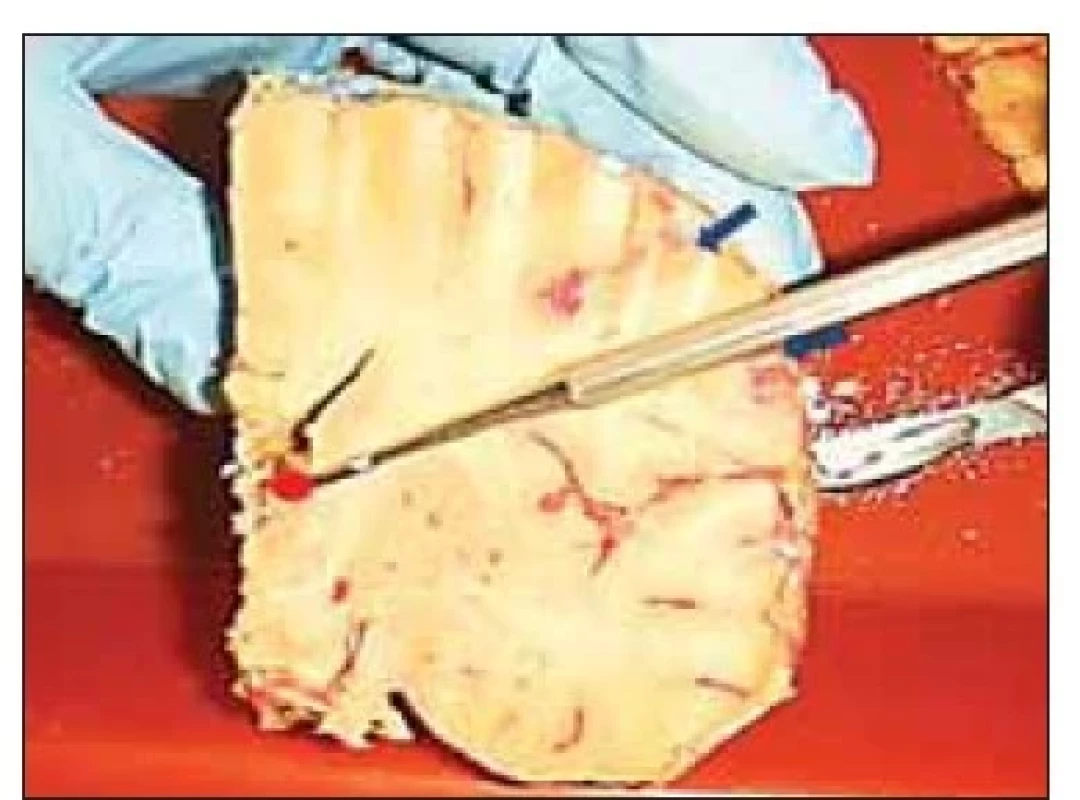
Po průchodu přes strop postranní komory stimulační elektroda prochází postranní komorou a vstupuje do tuberculum thalami mezi choroidálním plexem s odvodnou žílou a v. thalamostriata. (obr. 4). I když fixace preparátu zachyceného na obr. 5 není tak kvalitní jako na přechozím obrázku, díky kvalitně provedenému nástřiku je možné identifikovat cévní struktury a proměřit šířku koridoru pro implantaci elektrody (zde simulována sondou). Měření bylo prováděno pomocí přiloženého měřítka, ovšem výsledek lze potvrdit pomocí srovnání s preparačním nástrojem (obr. 6). Ve vzdálenosti 6 mm od začátku koridoru bylo na čtyřech preparátech možné jednoznačně identifikovat drobnou žilní strukturu, zezadu ohraničující oblast tuberculum thalami. Tato struktura je zachycena i na obr. 7 (zde vstupuje do v. thalamostriata).
Fig. 4 Lateral view of the tuberculum thalami
(marked with forceps and delineated
in red). See the structure of the thalamostriatal
vein (green arrow) and venous
structure located behind the thalamic tuberculum
entering the choroid plexus
draining vein (violet arrows).
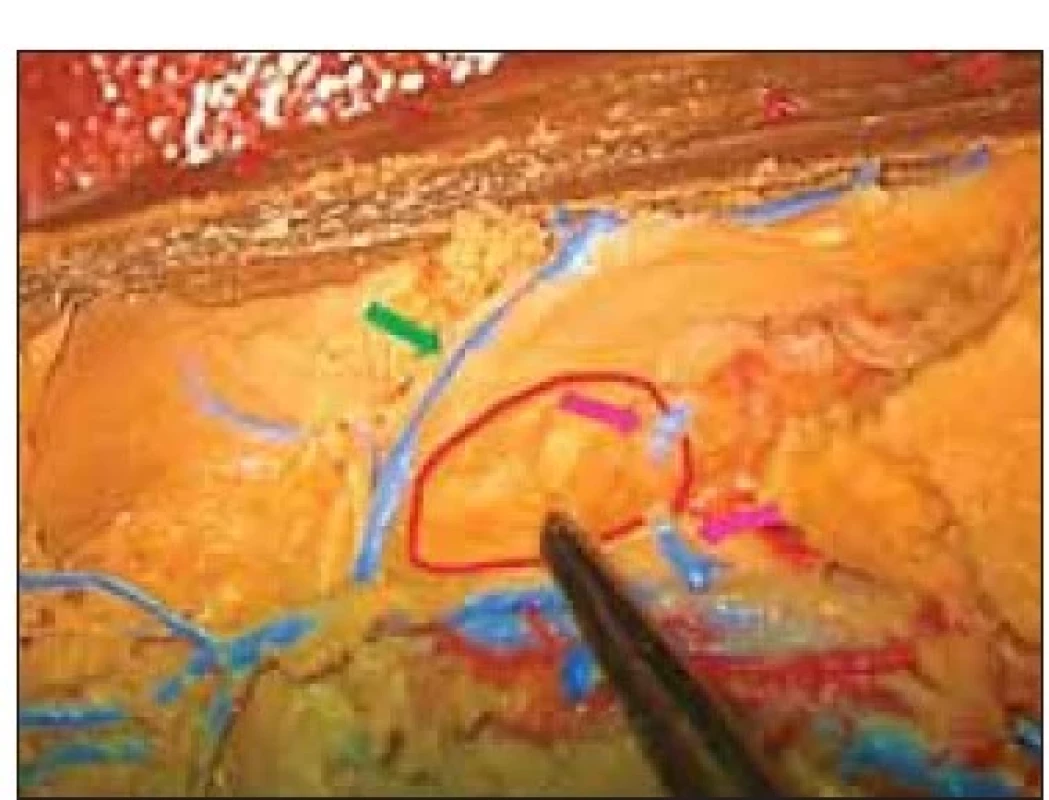
Fig. 5. Deep cerebral venous structures
with the probe mimicking the course of
the implanted stimulation electrode. The
probe passes through the lateral ventricle
and enters the tuberculum thalami between
the choroid plexus (red arrow) and
the thalamostriatal vein (green arrow).
The relationship of the tip of the implanted
electrode to the internal cerebral vein
is readily seen (yellow arrow).
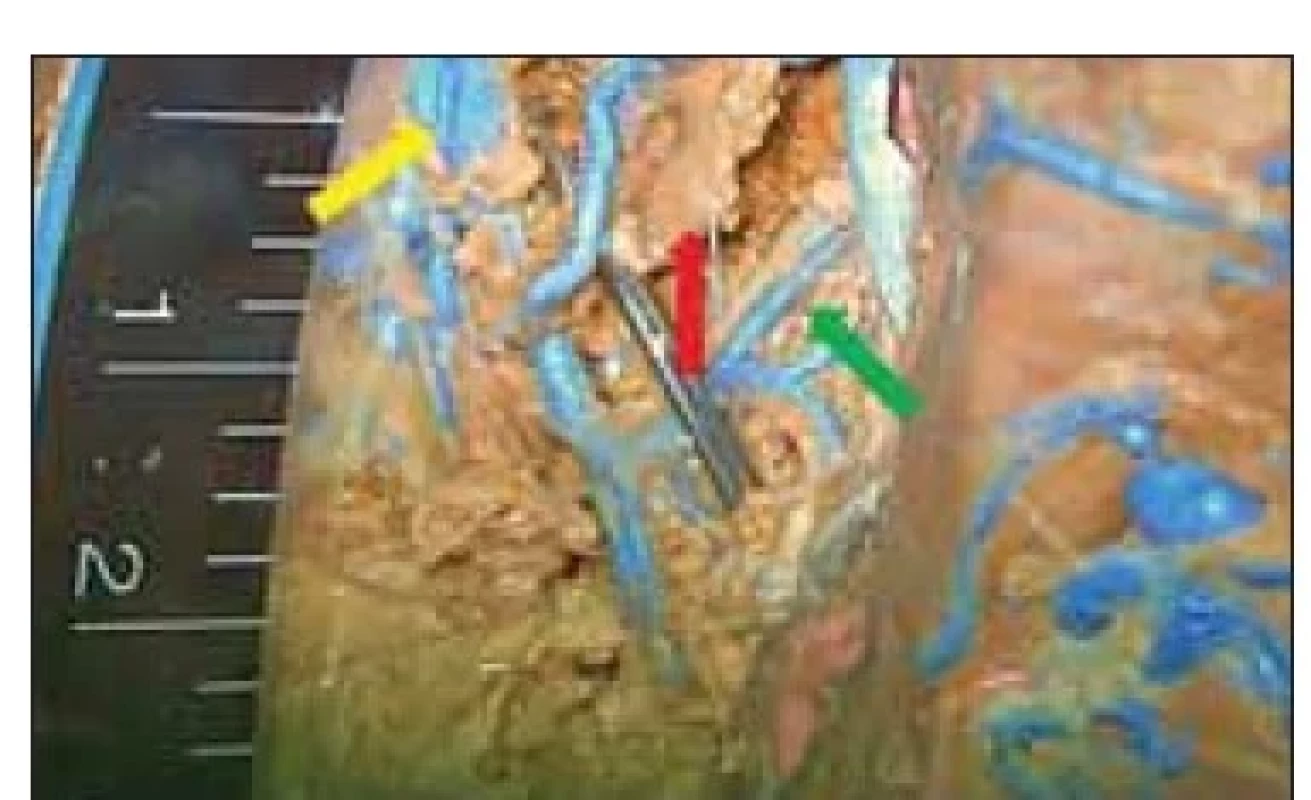
Fig. 6. Measurements of the width of the
corridor between the thalamostriatal vein
(violet arrow) and the choroid plexus (superior
choroidal vein – red arrow) on the
second side of the specimen comparing
the width of the vascular corridor (approximately
2.5–3 mm) with the probe
diameter (1.3 mm). Internal cerebral veins
are marked with a yellow arrow.
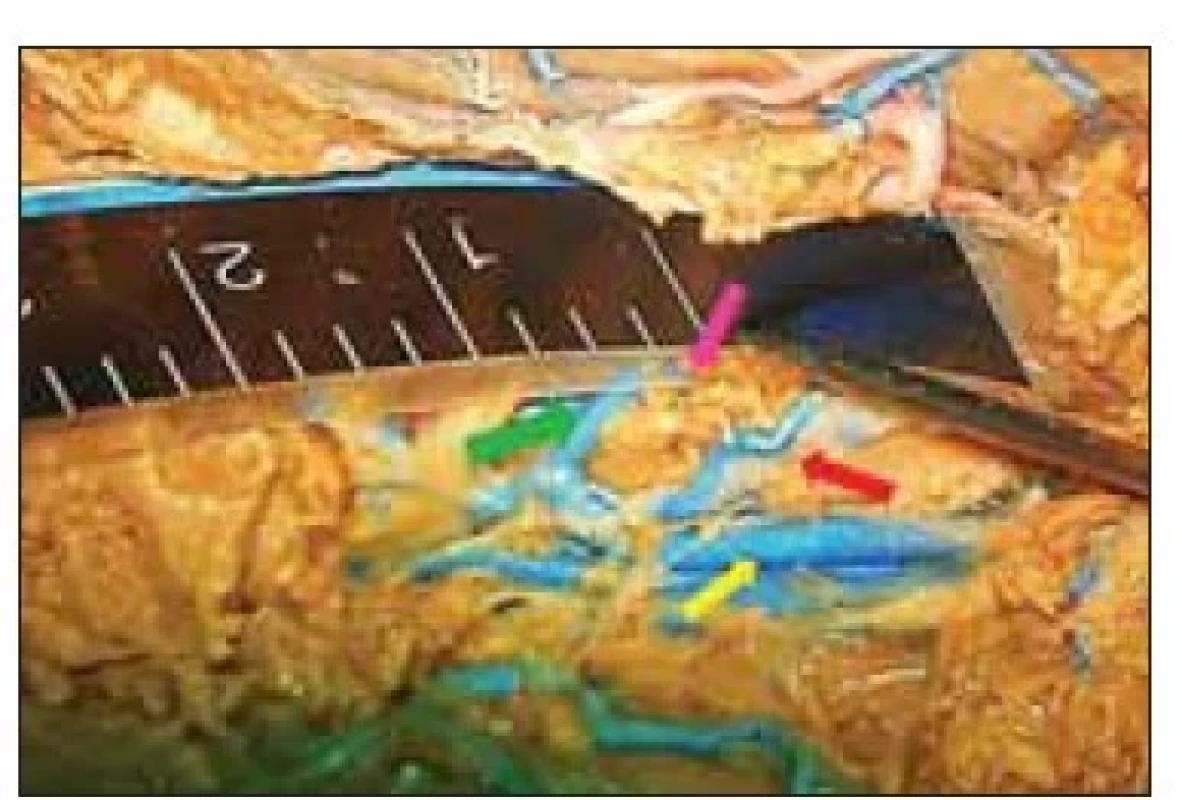
Fig. 7. The borders of the vascular corridor
for anterior thalamic electrode implantation.
Venous tributary to the thalamostriatal
vein from the anterior thalamic
nucleus (marked with a probe). Partially
preserved structures of the choroid
plexus.

Měření šířky koridoru v definovaných vzdálenostech byla provedena na celkem šesti preparátech (oboustranně u pěti, na jednom preparátu bylo vzhledem k porušení cévních struktur na pravé straně možné provést pouze levostranná měření). Získané výsledky ukazuje tab. 1.
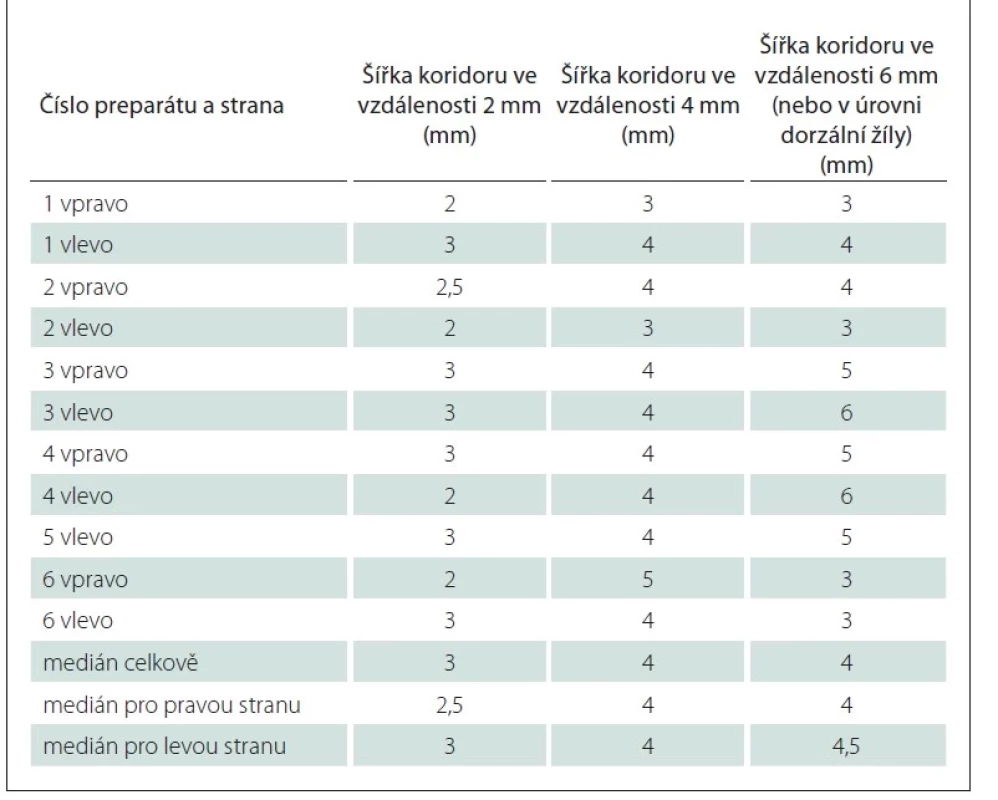
Porovnání výsledků měření prokázala u čtyř preparátů pravolevou asymetrii šířky koridoru, která ovšem nepřesahovala 1 mm.
Jako příklad vlivu šířky operačního koridoru na bezpečnost implantace uvádíme situaci s šířkou koridoru 2,5 mm a 3 mm (medián šíře cévního koridoru ve vzdálenosti 2 mm od jeho začátku pro pravou a levou stranu), 4 mm (medián šíře cévního koridoru ve vzdálenosti 4 mm od jeho začátku), a konečně 4–4,5 mm (medián 6 mm od začátku koridoru). Po odečtení 1,3 mm na průměr elektrody zůstává ve vzdálenosti 2 mm rezerva 0,85 mm pro levou stranu a 0,6 mm pro stranu pravou a ve vzdálenosti 4 mm rezerva 1,35 mm mezi okrajem elektrody a okrajem v. thalamostriata a v. chorioidea superior (pokud by elektroda byla zavedena přesně středem koridoru). Ve vzdálenosti 6 mm je rezerva 1,35–1,6 mm.
Diskuze
Cílem stereotaktického plánování cílové struktury pro implantaci stimulační elektrody je nejen zavedení elektrody do optimální oblasti z hlediska funkčního výsledku, ale také minimalizace rizik výkonu. Výsledky experimentální studie zhodnotíme z obou hledisek.
Hemoragické komplikace stereotaktických výkonů v oblasti hlubokých mozkových struktur jsou vzácné, ale potenciálně fatální. Ve studii SANTE byla hemoragická komplikace popsána u 4,5 % nemocných [2]. Pro srovnání s jinými cílovými strukturami Binder et al uvádějí vyšší četnost hemoragických komplikací při implantaci elektrod do pallida (6,7 % z celkového počtu elektrod) než při implantaci elektrod do subtalamického jádra (2,5 % z celkového počtu elektrod) [10]. Pro ilustraci možných příčin hemoragických komplikací při implantaci elektrod do předního talamického jádra je nutné shrnout anatomické charakteristiky stereotaktické trajektorie (obr. 2). Důležitým faktorem je blízkost cílové struktury ke střední čáře. Standardní koordináty ATN ve vztahu k interkomisurální linii se uvádějí v rozmezí 0–2 mm před jejím středem, 10–12 mm nad interkomisurální linií a především pouze 5,5 mm laterálně od střední čáry. Pro srovnání – laterální koordináta cíle v globus pallidus internus se pohybuje v rozmezí 19–21 mm. Jak vyplývá z této skutečnosti a vztahu cílové struktury k v. thalamostriata nacházející se při jejím laterálním okraji, je nutné trepanaci pro zavedení intracerebrální elektrody umístit blíže ke střední čáře než např. při implantaci elektrod do globus pallidus internus (20–25 mm od střední čáry). I když se vstup elektrody obvykle nachází v gyrus frontalis superior, trajektorie může v závislosti na anatomických poměrech zasahovat i do sulcus frontalis superior, což zvyšuje riziko krvácení [11]. V dalším průběhu trajektorie se elektroda dostává do blízkosti laterálního okraje sulcus cinguli a sulcus corporis callosi s možností poranění větví a. pericallosa a a. callosomarginalis.
Moderní techniky stereotaktického plánování sice umožňují detailní analýzu plánované trajektorie ve vztahu k cévním strukturám, ovšem Nowinsky et al uvádějí, že používané plánovací skeny MR (1,5 nebo výjimečně 3T) nemusejí být z hlediska zobrazení chirurgicky významných cévních struktur dostatečné. Jimi navržený 3D stereotaktický cerebrovaskulární atlas (odvozený z 3T a 7T skenů MR) zachycuje více než 900 cév s přiřazeným jménem a určeným průměrem nacházejících se v blízkosti standardních stereotaktických trajektorií. Při standardní implantaci stimulační elektrody do nucleus subthalamicus nebo globus pallidus internus přes gyrus frontalis medius je nutné zohlednit několik tepenných struktur – anteromediální frontální větev arteria cerebri anterior, prefrontální větev téže tepny a arteriální zásobení sulcus precentralis vycházející z a. cerebri media s průměrem v rozmezí v rozmezí 0,4–0,6 mm. Všechny zmíněné tepny je nutné zohlednit i při přístupu cestou gyrus frontalis superior. Z relevantních žilních kmenů je možné uvést prefrontální, přední kaudátovou a medulární žílu (rozsah průměru 0,1–2,3 mm) a pro implantaci elektrody do ATN navíc v. thalamostriata a v. chorioidea superior, ale také v rámci studie identifikovanou nekonstantní žilní strukturu ohraničující tubeculum thalami dorzálně [12].
Riziky spojenými s transventrikulárním zavedením elektrody se zabývá práce Eliase et al, podle které bylo asymptomatické intraventrikulární zakrvácení při průchodu elektrody přes mozkovou komoru prokázáno u 5 % nemocných [11]. Z hlediska vaskulárních struktur spojených s rizikem nitrokomorové hemoragie při průchodu elektrody přes mozkovou komoru jsou důležité subependymální žíly. Nejzásadnějším vaskulárním problémem při implantaci elektrody do ATN ovšem zůstává koridor mezi v. thalamostriata a choroidálním plexem s v. chorioidea superior. Jak ukazují naše výsledky, tento vaskulární koridor je nejužší v přední části. Pokud tedy zvažujeme pouze riziko poranění cév, může být pro implantaci elektrody bezpečnější lehce širší zadní část cévního koridoru. Ovšem zde je nutné vzít v úvahu i jiné faktory související s funkční anatomií předního talamického jádra.
Na základě měření na 3T MR dosahuje střední délka ATN v předozadní ose 10 mm, šířka přibližně 5,5 mm a výška 4,5 mm. Ovšem zdánlivě velké přední talamické jádro se skládá ze tří částí (anteromediální, anteroventrální a anterodorzální) [13]. Pro funkci anteroventrálního jádra jsou nejdůležitější spoje s temporálním lalokem a anteromediální jádro je rozsáhle zapojeno do orbitofrontálního okruhu. Anterodorzální jádro v zadní části nucleus anterior thalami je součástí jiného funkčního okruhu zahrnujícího laterální mamilární jádro a je považováno za zodpovědné za paměť a navigaci v prostoru. Vzhledem k těmto funkčním vztahům lze předpokládat větší efekt stimulace na parciální záchvaty při stimulaci anteroventrálního (spoje s temporálním lalokem) nebo anteromediálního jádra (orbitofrontální kortex) [2]. V souladu s touto úvahou Lehtimäki et al při analýze polohy jednotlivých kontaktů ATN elektrod prokázali, že dobré výsledky z hlediska kontroly záchvatů jsou dosaženy při stimulaci kontaktů umístěných v přední části ATN (odpovídající anteroventrálnímu a anteromediálnímu jádru) [14]. Wu et al u non-respondérů prokázali tendenci k lokalizaci stimulovaných kontaktů v zadní a laterální části ATN. Jiným nálezem je menší velikost ATN u non-respondérů [15]. Protizáchvatový efekt nebyl pozorován při stimulaci zadní a dolní části jádra ani v animálním modelu [16]. Výše uvedené výsledky tedy podporují nutnost implantace aktivního kontaktu do oblasti anteroventrálního a anteromediálního jádra talamu, tedy do přední části jádra, cestou přední části cévního koridoru [17]. Důležitým faktorem je také pravolevá asymetrie polohy ATN. Podle Lehtimäkiho et al bylo u většiny nemocných ATN vpravo lokalizováno více vepředu ve srovnání s levou stranou [14]. Problematikou pravolevé symetrie polohy cílových struktur jsme se nezabývali, ale měření u čtyř preparátů prokázala pravolevou asymetrii šířky koridoru, která ovšem nepřesahovala jeden mm.
I když je tato problematika v provedené anatomické studii zmíněna pouze okrajově, považujeme za vhodné uvést i několik poznámek stran alternativní trajektorie pro implantaci elektrody DBS do ATN z laterálního přístupu (obr. 3). U všech nemocných zařazených do studie SANTE byly elektrody implantovány transventrikulárně [2]. Při zpětné analýze průběhu šesti elektrod zavedených do oblasti ATN z laterálního přístupu Lehtimäki et al zjistili, že se o žádném kontaktu nedalo říct, že je jednoznačně umístěn v ATN, natož pak v anteromediální nebo anteroventrální části jádra [14].
Optimističtěji data poskytuje studie MORE, jejímž cílem bylo porovnání transventrikulárního a laterálního (extraventrikulárního) přístupu stran lokalizace stimulačních kontaktů. Do studie bylo zařazeno 73 nemocných a laterální přístup byl využit pro implantaci 53 % elektrod. Alespoň jeden kontakt stimulační elektrody byl lokalizován v ATN u 90 % elektrod implantovaných transventrikulárně a u 71 % elektrod implantovaných z laterálního přístupu. U 84 % nemocných s elektrodami implantovanými transventrikulárně zasahovaly obě elektrody oblast ATN, což platilo pouze pro 58 % nemocných s elektrodami implantovanými z paraventrikulárního přístupu [18].
Co se týče limitací studie, mimo nekonstantně kvalitní fixace (která ale nepředstavovala problém pro identifikaci žilních struktur) je nutné zmínit předpoklad, že věk dárců je vyšší, než jaký je věk nemocných, u kterých je implantace elektrod do oblasti ATN prováděna (podle dat ze studie SANTE 36,1 ± 11,2 let) [2]. Věkem podmíněný pokles objemu ATN postihuje především mediální a přední části této struktury, což je možné vysvětlit atrofií čelních a temporálních laloků [14,19].
Závěr
Při využití transventrikulárního přístupu pro implantaci elektrod do nucleus anterior thalami u nemocných s jinak neovlivnitelnou farmakorezistentní epilepsií je zásadní otázkou průchod stimulační elektrody přes cévní koridor ohraničující tuberculum thalami. Jeho zevní hranicí je v. thalamostriata a mediálně je ohraničen choroidálním plexem a drénující žílou v. chorioidea superior. Při anatomické studii byly prokázány i nekonstantní drobné žilní struktury, ohraničující tuberculum thalami dorzálně. Změřená šířka tohoto koridoru se pohybuje v rozmezí 2–3 mm v přední části, 3–5 mm v části střední a v zadní části dosahuje 3–6 mm. Vzhledem k tomu, že funkčně optimální oblast pro implantaci elektrody se nachází v přední části tohoto koridoru, se po odečtení průměru elektrody rezerva pohybuje v rozmezí 0,6–0,8 mm pro vzdálenost 2 mm od začátku koridoru a dosahuje 1,3 mm pro vzdálenost 4 mm od začátku koridoru, což klade vysoké nároky na přesnost stereotaktických systémů a plánování trajektorie
Etické aspekty
Studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy Etické komise FN u sv. Anny v Brně odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v roce 2000. Veškeré preparáty pocházely od dárců těl pro anatomický ústav, kteří již za svého života projevili souhlas s využitím pro anatomické studie. Z tohoto důvodu nebylo požadováno schválení etickou komisí.
Grantová podpora
Podpořeno projektem PRESEnCE – AZV-NV - 19-04 – 00343. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena
Prohlášení o konfliktu zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů
prof. MUDr. Jan Chrastina, Ph.D.
Neurochirurgická klinika
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: jan.chrastina@fnusa.cz
Přijato k recenzi: 29. 12. 2022
Přijato do tisku: 2. 3. 2023
Zdroje
1. Elliott RE, Morsi A, Kalhorn SP et al. Vagus nerve stimulation in 436 consecutive patients with treatment-resistant epilepsy: long term outcomes and predictors of response. Epilepsy Behav 2011; 20 (1): 57–63. doi: 10.1016/j.yebeh.2010.10.017.
2. Fisher R, Salanova V, Witt T et al. Electrical stimulation of the anterior nucleus of thalamus for treatment of refractory epilepsy. Epilepsia 2010; 51 (5): 899–908. doi: 10.1111/j.1528-1167.2010.02536.x.
3. Lehtimäki K, Möttönen K, Järventausta K et al. Outcome based definition of the anterior thalamic deep braion stimulation target in refractory epilepsy. Brain Stimul 2016; 9 (2): 268–275. doi: 10.1016/j.brs.2015.09.014.
4. Mullan S, Vailati G, Karasick J et al. Thalamic lesions for the control of epilepsy. A study of nine cases. Arch Neurol 1967; 16 (3): 277–285. doi: 10.1001/archneur.1967.00470210053006.
5. Upton AR, Cooper IS, Springman M et al. Supression of seizures and psychosis of limbic system origin by chronic stimulation of anterior nucleus of the thalamus. Int J Neurol 1985; 19–20 : 223–230.
6. Hodaie M, Wennberg RA, Dostrovsky JO et al. Chronic anterior thalamic stimulation for intractable epilepsy. Epilepsia 2002; 43 (6): 603–608. doi: 10.1046/j.1528-1157.2002.26001.x.
7. Herrman H, Egge A, Konglund AE et al. Anterior thalamic deep brain stimulation in refractory epilepsy: a randomized, double blinded study. Acta Neurol Scand 2019; 139 (3): 294–304. doi: 10.1111/ane.13047.
8. Perez-Malagon CD, Lopez-Gonzales MA. Epilepsy and deep brain stimulation of anterior thalamic nucleus. Cureus 2021; 13 (9): e18199. doi: 10.7759/cureus.18 199.
9. Sanan A, Abdel Aziz KM, Janjua RM et al. Colored silicone injection for use in neurosurgical dissections: anatomic technical note. Neurosurgery 1999; 45 (5): 1267–1271. doi: 10.1097/00006123-199911000-00058.
10. Binder DK, Rau G, Starr PA. Haemorrhagic complications of microelectrode-guided deep brain stimulation. Stereotact Funct Neurosurg 2003; 80 (1–4): 28–31. doi: 10.1159/000075156.
11. Elias WJ, Sansur CA, Frysinger RC. Sulcal and ventricular trajectories in stereotactic surgery. J Neurosurg 2009; 110 (2): 201–207. doi: 10.3171/2008.7.17625.
12. Nowinski WL, Chua BC, Volkau I et al. Simulation and assessment of cerebrovascular damage in deep brain stimulation using a stereotactic atlas of vasculature and structure derived from multiple 3 - and 7-tesla scans. J Neurosurg 2010; 113 (6): 1234–1241. doi: 10.3171/2010.2.JNS091528.
13. Möttönen T, Katisko J, Haapasalo T et al. Defining the anterior nucleus of the thalamus (ANT) as a deep brain stimulation target in refraktory epilepsy: delineation using 3T MRI and intraoperative microelectrode recording. Neuroimage Clin 2015; 7 : 823–829. doi: 10.1016/j.nicl.2015.03.001.
14. Lehtimäki K, Möttönen K, Järventausta K et al. Outcome based definition of the anterior thalamic deep brain stimulation target in refractory epilepsy. Brain Stimul 2016; 9 (2): 268–275. doi: 10.1016/j.brs.2015.09. 014.
15. Wu Ch, D’Haese P-F, Pallavaram S et al. Variation in thalamic anatomy affect targeting in deep brain stimulation for epilepsy. Stereotactic Funct Neurosurg 2016; 94 (6): 387–396. doi: 10.1159/000449009.
16. Wang S, Wu DC, Fan XN et al. Mediodorsal thalamic stimulation is not protective against seizures induced by amyloid kindling in rats. Neurosci Lett 2010; 481 (2): 97–101. doi: 10.1016/j.neulet.2010.06.060.
17. Son BC, Shon YM, Kim SH et al. Technical implications in revision surgery for deep brain stimulation (DBS) of the thalamus for refractory epilepsy. J Epilepsy Res 2018; 8 (1): 12–19. doi: 10.14581/jer.18003.
18. Lehtimäki K, Coenen VA, Ferreira AG et al. The surgical approach to the anterior nucleus of thalamus in patients with refractory epilepsy: experience from the international multicenter registry (MORE). Neurosurgery 2019; 84 (1): 141–150. doi: 10.1093/neuros/nyy023.
19. Hughes EJ, Bond J, Svrckova P et al. Regional changes in thalamic shape and volume with increasing age. Neuroimage 2012; 63 (3): 1134–1142. doi: 10.1016/j.neuroimage.2012.07.043.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2023 Číslo 2
Nejčtenější v tomto čísle
- Problematika posuzování invalidity po prodělané cévní mozkové příhodě
- Současné a budoucí terapeutické možnosti léčby generalizované formy myasthenia gravis
- Cenobamát v léčbě farmakorezistentní fokální epilepsie
- Standardizované a pokročilé techniky MR v diagnostice dětských nádorů mozku
