Role skórovacích systémů v indikaci léčby meningeomů u pacientů vyššího věku
The role of scoring systems in treatment indication of meningiomas in elderly patients
Introduction: The incidence of meningiomas increases exponentially after the age of 65. However, this age is characterized by a higher incidence of comorbidities and the benefit of the surgery may not always exceed its risk. Treatment optimization should therefore be objectively assessed using scoring systems as well. Materials and methods: A retrospective analysis evaluated the group of patients treated at the Brno University Hospital between 2013–2018 (N = 108). Patients were older than 65 years of age. Three procedures were considered in the treatment: watch and wait strategy, surgery and stereotactic radiosurgery. The groups of patients were evaluated in terms of the incidence of comorbidities and the outcome of the patients with regard to the choice of treatment modality. Scoring systems were used in the indication for individual types of treatment. Furthermore, short-term and long-term morbidity and mortality were evaluated in individual groups. Results: Significant dependence in the analysis of annual mortality in the SKALE system has been proved. No statistically significant relationship was found between mortality and sex, collateral oedema, and tumour location. In contrast, age, tumour size, and Karnofsky score before treatment were significant predictors of prognosis. Conclusion: Individualized patient analysis and neurosurgeon experience continue to be important factors in treatment selection in elderly patients with a diagnosis of meningioma. However, the scoring systems used to select a treatment modality in elderly patients make it possible to significantly optimize the treatment process and, ultimately, the prognosis of the disease.
Keywords:
geriatric patient – Meningioma – scoring systems
Autoři:
I. Rošková; A. Mrlian; M. Smrčka; M. Duba; V. Juráň
Působiště autorů:
Neurochirurgická klinika LF MU a FN Brno
Vyšlo v časopise:
Cesk Slov Neurol N 2022; 85(6): 471-476
Kategorie:
Původní práce
doi:
https://doi.org/10.48095/cccsnn2022471
Souhrn
Úvod: Incidence meningeomů po 65. roku života exponenciálně roste. Tento věk je ovšem typický vyšším výskytem komorbidit a benefit operace nemusí být vždy vyšší než její riziko. Optimalizace léčby by proto měla být objektivně posouzena i s využitím skórovacích systémů. Materiál a metodika: Retrospektivní analýzou byla zhodnocena skupina pacientů léčených ve FN Brno v období 2010–2018 (n = 108). Pacienti byli starší 65 let. V léčbě byly uplatňovány tři postupy: strategie „watch and wait“, operace a stereotaktická radiochirurgie. Skupiny pacientů byla vyhodnocena z pohledu výskytu komorbidit a celkového stavu pacienta s ohledem na výběr terapeutické modality. V indikaci k jednotlivým typům léčby se uplatňovaly skórovací systémy. Dále byly v jednotlivých skupinách vyhodnoceny krátkodobá i dlouhodobá morbidita a mortalita. Výsledky: Pozorovali jsme významnou závislost při analýze roční mortality u systému SKALE. Mezi mortalitou a pohlavím, kolaterálním edémem a lokalizací nádoru nebyla nalezena statisticky významná závislost. Naopak věk, velikost nádoru a skóre Karnofsky před zahájením léčby byly významnými prediktory prognózy. Závěr: Individualizovaná analýza pacientů a zkušenosti neurochirurga nadále zůstávají významnými faktory ve výběru léčby u starších pacientů s diagnózou meningeomu. Nicméně skórovací systémy uplatňované u výběru léčebné modality u pacientů vyššího věku umožňují významně optimalizovat léčebný postup a v konečném důsledku prognózu onemocnění.
Klíčová slova:
geriatrický pacient – meningiom – skórovací systémy
Úvod
S roční incidencí 5/100 000 je meningeom nejčastějším primárním intrakraniálním extraaxiálním nádorem [1]. Je to většinou pomalu rostoucí nádor vyrůstající z arachnoidálních buněk. U dospělých tvoří přibližně 30 % všech intrakraniálních nádorů [2]. U dětí je vzácný a tvoří 0,4–4,6 %. Výskyt se zvyšuje s věkem, zejména v 5.–7. dekádě. Pozoruhodnou převahu vykazuje u žen, poměr výskytu je 4: 1. Meningeomy jsou často zjištěny náhodně, přičemž je označujeme jako „incidentalom“. Při dalším sledování většinou dlouho vykazují nulový nebo pouze minimální růst, často u starších osob, kdy jsou také přítomny kalcifikace v tumoru.
Meningeomy jsou tumory vyznačující se pomalým růstem, a proto jejich klinická manifestace může být typická ve vyšším věku, zpravidla v 6. deceniu [1,3]. Po 65. roku života stoupá incidence meningeomů exponenciálně. U pacientů v 7. a 8. deceniu se mnohdy setkáváme s tzv. asymptomatickými meningeomy [4]. To je dáno pravděpodobně tím, že klinické příznaky mohou být velmi nespecifické a často se připisují jiným, zejména psychiatrickým nemocem. Nenápadné projevy jako apatie nebo organický psychosyndrom, jež nastupují velmi pozvolna, si pacient ani jeho okolí mnohdy neuvědomují [5]. V terapii meningeomů se uplatňují tři hlavní léčebné postupy, které se mohou vzájemně kombinovat. Zásadní terapeutickou metodou je operace. Radikalita je kvantifikována podle klasifikace dle Simpsona a bývá zpravidla pozitivním prediktorem prognózy pacientů [1]. Druhou léčebnou variantou je stereotaktická radiochirurgie, která je rezervovaná pro menší, pomalu rostoucí asymptomatické meningeomy, a poslední možností je tzv. strategie „watch and wait“. Poslední varianta je indikována v případě nerostoucích menších expanzí, resp. u starých, polymorbidních pacientů. U málo se vyskytujících zhoubných variant je po operaci indikována adjuvantní radioterapie [6].
Pacienti vyššího věku mívají četné interní komorbidity, což může znamenat vyšší riziko perioperační morbidity a mortality. Hodnocení pacienta před operací se zpravidla opírá o zhodnocení perioperačního rizika praktickým lékařem, resp. internistou (předoperační vyšetření) a o zhodnocení anesteziologem v rámci tzv. premedikace, kdy se stanovuje riziko pomocí kódu American Society of Anesthesiologists (ASA) [7]. Pokud pacient splňuje interní kritéria a je z pohledu neurochirurga indikován k operačnímu řešení, tak je operace zpravidla i provedena. Pooperačně se standardně hodnotí morbidita a mortalita. Komplikace po operaci mohou být spojeny s operačním výkonem a jedná se zpravidla o přechodný nebo trvalý neurologický deficit nebo komplikace ve smyslu hematomu, resp. infekce v operačním lůžku [7,8]. Druhou variantou jsou komplikace typu postižení kardiovaskulárního a plicního systému, resp. poruchy vnitřního prostředí a hematologické komplikace. I přes pečlivé zhodnocení pacienta před operací se starší pacient jeví jako zvýšeně rizikový z pohledu výskytu perioperačních a časných pooperačních komplikací [8]. Cílem naší práce bylo retrospektivní vyhodnocení výskytu možných komplikací s ohledem na určitý „bias“ očekávání související se zkušeností a intuicí neurochirurga, i s ohledem na jistou tendenci přiklánět se k radikálnímu řešení. Práce by měla odpovědět na otázku, zdali je starší pacient opravdu schopen se vypořádat s tíhou mnohahodinového neurochirurgického výkonu a s náročnou pooperační periodou.
Materiál a metodika
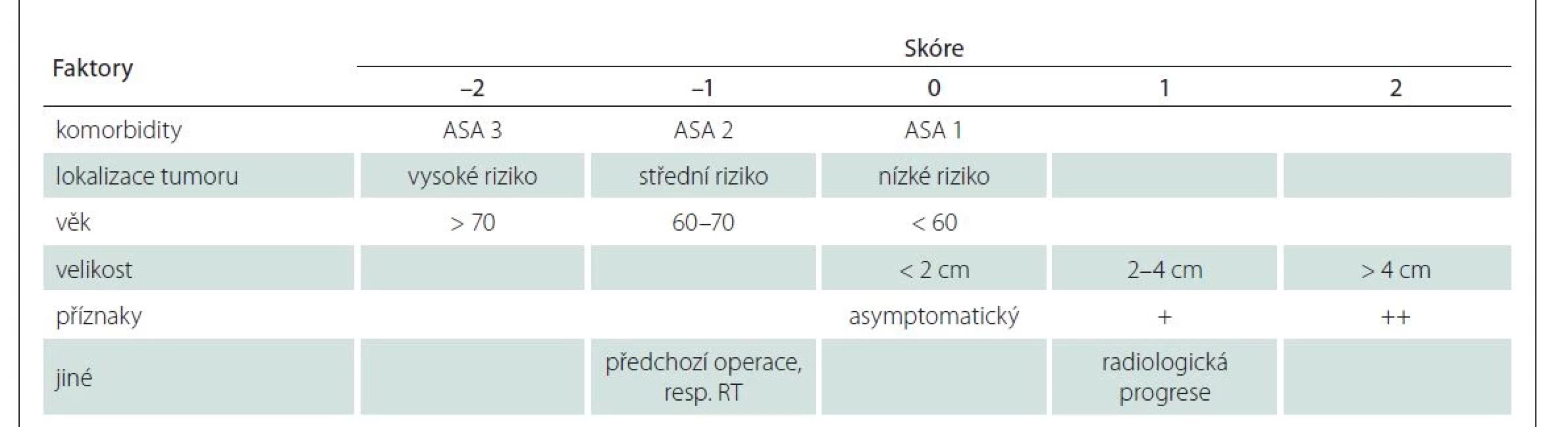
Předmětem článku je retrospektivní vyhodnocení skupiny pacientů (n = 108) za období 2010–2018 s ohledem na začlenění skórovacích systémů využívaných standardně v neurochirurgii, ale i v geriatrii do předoperačního vyšetřovacího algoritmu. Účelem bylo stanovení možností snížení rizika morbidity a mortality po operacích meningeomů u geriatrických pacientů. Pacienti byli v 7. a 8. deceniu, medián věku byl 74 let. Na Neurochirurgické klinice ve FN Brno se standardně ve vyhodnocování míry perioperačního rizika začalo využívat skóre CLASS [9]. Hodnotící faktory jsou komorbidity, lokalizace tumoru, věk pacienta, klinická manifestace tumoru a jiné faktory, jako např. předchozí operace, radioterapie, resp. radiologická progrese předtím sledovaného meningeomu (tab. 1). Pokud je podle skóre CLASS dosaženo hodnoty vyšší než –1 je operace významně méně riziková ve srovnání se skupinou pacientů s hodnotou skóre ≤ –2, pro které by měl být volen konzervativní postup.
Dalším skórovacím systémem hodnoceným v rámci naší práce byl systém SKALE. Systém hodnotí vliv pohlaví, Karnofsky skóre, ASA, lokalizace tumoru a edému. Monden et al prokázali signifikantně vyšší procento roční mortality u starších pacientů se skóre SKALE ≥ 8 (5,1 vs. 25 %; p = 0,0479) [10].
Třetím hodnoceným skórovacím systémem byl Geriatric Scoring Scale [11]. Hodnotí kumulativní riziko výskytu interních komorbidit s ohledem na věk pacientů a závažnost interního onemocnění. Závažnost interního onemocnění je hodnocena na čtyřstupňové škále. Výsledkem skórování jsou čtyři skupiny pacientů: 1) zdraví, 2) vulnerabilní, 3) fragilní a 4) „přiliš nemocní“ (tab. 2).

GIT – trávicí trakt; ORL – otorhinolaryngologie
Posledním skórovacím systémem zohledněným v naší práci byl Charlson Comorbidity index. Ten přímo nehodnotí míru rizika operace. Po vyhodnocení věku a interních komorbidit vypočítává pravděpodobnost desetiletého přežití u pacientů. S ohledem na biologické chování meningeomů, pomalý růst a častou absenci klinických příznaků i při větších expanzích je hodnocení desetiletého přežití v kontextu náročného neurochirurgického výkonu velmi přínosné. K rychlému vyhodnocení slouží tabulka standardně přístupná na webu [12].
Soubor pacientů a výsledky
Hodnocený soubor čítal 108 pacientů. Poměr muži vs. ženy byl 1: 2,2. Medián věku byl 74 let. Z interních komorbidit byla nejčastěji přítomna onemocnění kardiovaskulárního systému jako arteriální hypertenze, ischemická choroba srdeční, ischemická choroba dolních končetin (92 %). Dále se ve 20 % vyskytovaly poruchy metabolizmu cukrů a tuků (diabetes mellitus, hyperlipidemie). Obezita hodnocená podle Body Mass Index (BMI) byla přítomna u 20 % pacientů, onemocnění pohybového aparátu u 56 % pacientů a jiné onkologické onemocnění v anamnéze se vyskytovalo u 22 %.
Supratentoriální lokalizaci tumoru mělo 89 pacientů, infratentoriální 19 pacientů. Anatomicky byla nejvíce zastoupena lokalizace v přední jámě lební (konvexita, planum sphenoidale, křídlo kosti klínové – mediální i laterální varianta, tuberculum sellae, sinus cavernosus). U infratentoriálních meningeomů bylo zastoupení různorodé, žádná lokalizace neměla významnou převahu. Stran léčebné modality byly zastoupeny všechny tři varianty, strategie „watch and wait“, chirurgická léčba i stereotaktická radiochirurgie. Celkem 64 pacientů (59 %) bylo operováno, primooperace byla provedena u 42 pacientů a operace recidivy u 22 pacientů. Radikalita resekce se standardně hodnotila klasifikací dle Simpsona [13], 14 pacientům byl meningeom odstraněn radikálně vč. excize postižené tvrdé pleny, resp. přilehlé kosti (S1). V 19 případech došlo k makroskopicky totální resekci, tvrdá plena byla ošetřena bipolární koagulací (S2), 23 pacientů mělo odstraněný tumor (near total resection) bez resekce tvrdé pleny (S3) a v 8 případech jsme tumor odstranili částečně – radikalita operace variovala od biopsie až po parciální resekci (S4, S5). Dle výsledku histologického vyšetření bylo 55 případů hodnoceno jako nezhoubné (grade I), 9 pacientů mělo meningeom grade II. Žádný z pacientů neměl meningeom grade III.
Celkem 44 pacientů (41 %) operovaných nebylo, stereotaktický radiochirurgický zákrok absolvovalo 23 pacientů, bez jakékoli intervence zůstalo 21 pacientů.
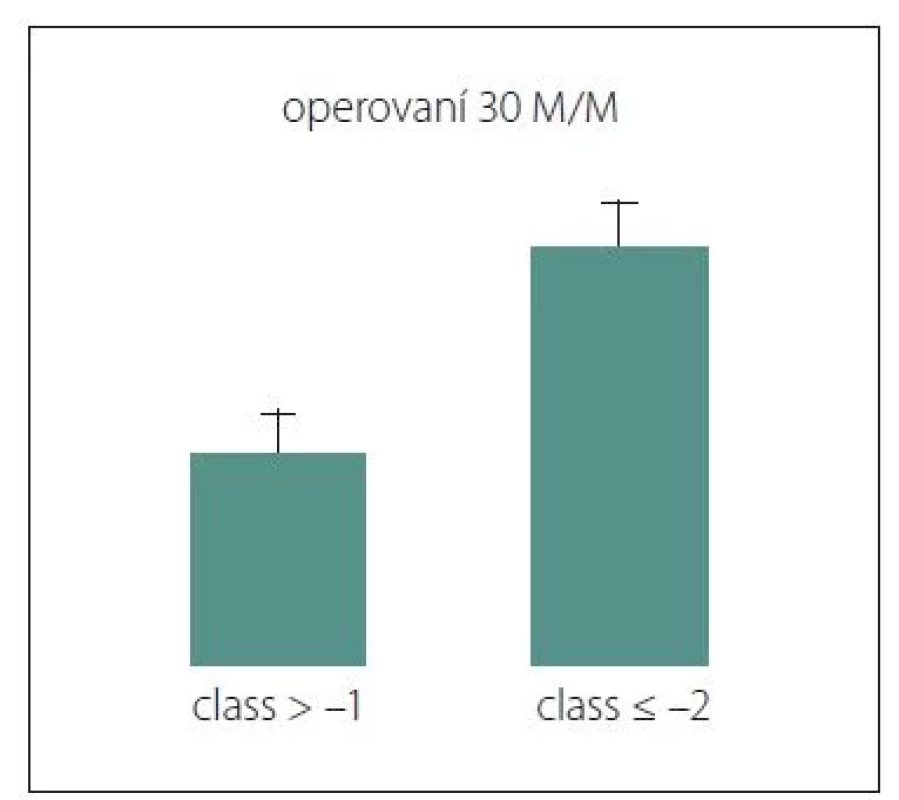
U operovaných pacientů byly vyhodnoceny 3měsíční morbidita a mortalita. Jako chirurgické komplikace byly označeny komplikace ve smyslu hematomu, edému, infekce a likvorové píštěle vyžadující opětovnou operaci. Ve sledovaném souboru se vyskytly ve 14,4 %. Nový neurologický deficit a nový epileptický záchvat se vyskytly u 11,8 % pacientů. Nechirurgické komplikace (oběhové a respirační poruchy, akutní koronární léze, tromboembolická nemoc, poruchy vnitřního prostředí, zánětové odpovědi organizmu, multiorgánové selhání) se vyskytovalo u 8 %. Mortalita byla na úrovni 3 %. Retrospektivní analýzou 3měsíční morbidity/mortality sledovaného souboru se potvrdila validita skóre CLASS, kdy byl nalezen statisticky významný rozdíl mezi skupinou pacientů s hodnotou skóre vyšší než –1 ve srovnání s pacienty s hodnotou skóre nižší nebo rovnou –2 (p = 0,00724) (obr. 1). Hodnocení pacientů podle systému SKALE nepřineslo statisticky významné výsledky.
Fig. 1. Statistically significant difference in
30-day morbidity and mortality in operated
patients. For a score value higher than
–1, surgery is significantly less risky than
for patients with a score value lower than
or equal to –2, when a conservative procedure
should be chosen.
Při analýze roční mortality byla pozorována statisticky významná závislost pouze u systému SKALE. Věk, velikost nádoru a Karnofsky skóre před zahájením léčby byly významnými prediktory prognózy pacientů (p < 0,01). Na druhou stranu pohlaví, kolaterální edém a lokalizace nádoru nehrály významnou roli ve vztahu k roční mortalitě (p = 0,326).
Ve skupině pacientů léčených stereotaktickou radiochirurgií byla 30denní morbidita na úrovni 0,04 %, u jedné pacientky se vyskytla klinicky manifestní progrese kolaterálního edému, jež vyžadovala hospitalizaci a aplikaci antiedematozní léčby (dexametazon). Roční mortalita skupiny byla na úrovni 17 %. U 11 pacientů (47 %) došlo v horizontu 24 měsíců k MR verifikované velikostní regresi tumoru. Celkem 8 pacientů (34 %) nevykazovalo při opakovaných MR kontrolách žádné velikostní změny.
Pacienti v režimu „watch and wait“ nebyli podrobeni bližší statistické analýze. Jednalo se o skupinu pacientů s výskytem mnoha komorbidit nebo o pacienty s malým, kalcifikovaným, velikostně stacionárním meningeomem bez indikace k jakékoli intervenci.
Diskuze
Prodlužování průměrné délky života a častější využívání dokonalejších diagnostických zobrazovacích metod v posledních letech má za následek zvyšující se počet zachycených případů meningeomů u starší až velmi staré populace [14]. Dennodenně se neurochirurgové potýkají s dilematem, zda meningeom u pacientů této věkové skupiny operovat. Operace u starší populace mohou být spojeny s rizikem závažných, nebo dokonce život ohrožujících pooperačních komplikací v důsledku fyziologie stárnutí a mnohočetných komorbidit. Je však třeba také poznamenat, že perioperační a pooperační management všech intrakraniálních lézí se v posledních desetiletích dramaticky zlepšil a chirurgická léčba intrakraniálních meningeomů se stala validní terapeutickou možností i u starší populace [15,16]. Uváděná 30denní úmrtnost se pohybuje od 0 do 13,5 % a celková míra komplikací se pohybuje mezi 3 a 30 %. Morbiditu mezi jednotlivými sledovanými soubory je obtížné přímo porovnávat, protože komplikace jsou zřídkakdy podrobně popsány a není jasně daná metodika výběru [17]. V našem souboru operovaných pacientů byla mortalita 1,6 %, neurologická morbidita 7,2 % a celková morbidita vč. neurologického zhoršení i závažných, život ohrožujících vnitřních komplikací 29,2 %. Obdobné výsledky popsal v roce 2020 ve své práci Czernicki [18].
Práce zabývající se stanovením perioperačního rizika definují četné předoperační ukazatele nemocnosti u starší populace, přičemž prokázaly prediktivní hodnotu pokročilejšího věku pacienta, mužského pohlaví, velikosti tumoru, lokalizace tumoru, přítomnosti a závažnosti edému a obecných zdravotních ukazatelů vyjádřených pomocí skóre ASA [19–21]. V naší práci jsme klasifikaci pacientů pomocí ASA považovali za standardní a spolehlivý prediktor komplikací, a proto jsme ho izolovaně do analýzy nezařadili. Jeho hodnocení nicméně bylo součástí komplexního systému SKALE [10,22]. Podle závěrů práce Mondena et al jsou chirurgická morbidita a mortalita významně vyšší u pacientů starších 70 let s hodnotou skóre SKALE vyšší než 8. Autor dále upozorňuje, že skórovací systém SKALE není spolehlivý, pokud se posuzují jeho jednotlivé komponenty izolovaně. Pouze jako komplexní hodnocení všech pěti zahrnutých parametrů nabízí hodnotný odhad prognózy pooperačního průběhu. Práce má však nedostatek v jisté předpojatosti, protože do retrospektivní analýzy byli zahrnuti pouze operovaní pacienti. V naší skupině byly jednoznačná kritéria pro zařazení do skupiny pacientů ošetřených Leksellovým gama nožem. Indikací k ošetření byla velikost tumoru do 30 mm v maximálním rozměru, lokalizace tumoru a MR verifikovaná velikostní progrese. Proto se tato skupina hodnotila jen 30denní morbiditou a roční mortalitou.
Zdá se, že přesný předoperační výběr pacientů, kteří mohou profitovat z operace, bude i v budoucnu zásadní pro dosažení lepších výsledků [23,24]. Za tímto účelem bylo navrženo a popsáno několik dalších skórovacích systémů, které by mohly vést k usnadnění rozhodovacího procesu [25]. Snaha vyvinout validní skórovací systémy usnadňující chirurgické indikace, zahrnující několik relevantních prognostických faktorů se jeví jako oprávněnější, než se spoléhat izolovaně na jednotlivé faktory. Caroli et al zjistili, že vyšší skóre v jejich klinicko-radiologickém klasifikačním systému (Clinical Radiological Grading system; CRGS) a ženské pohlaví významně korelují s nižší 3měsíční a jednoletou mortalitou [26]. Mezi podskupinami položek CRGS neměly na 3měsíční nebo roční mortalitu žádný vliv velikost a umístění nádoru, předoperační Karnofsky skóre a předoperační neurologický stav. Dva faktory však vykazovaly statisticky významný trend. Přítomnost edému zvýšila 3měsíční mortalitu a přítomnost komorbidit zvýšila jednoletou mortalitu. Naše práce se retrospektivním hodnocením pacientů pomocí uvedeného skórovacího systému nezabývala. Systém byl opakovaně podroben vědeckým analýzám a jeho přínos zůstává předmětem dalších analýz [26].
Na druhé straně, hodnota námi uvedených skórovacích systémů jako prediktorů rizika pooperační morbidity a mortality nebyla rovněž v literatuře jednomyslně potvrzena. Někteří autoři neuvádějí žádný vztah nebo vztah pouze některých z prediktorů k výsledku léčby [27]. Delgado-Fernández et al potvrdili prediktivní hodnotu CRGS, SKALE a GSS na morbiditu a mortalitu, na druhé straně Konglund et al uvedli, že žádný ze systémů hodnocení neměl žádný vliv na morbiditu a pouze skóre SKALE korelovalo s mortalitou, zatímco ostatní systémy hodnocení, jako např. CRGS, neměly na mortalitu žádný vliv [28,29].
Radikalita resekce je jedním s nejvýznamnějších faktorů úspěšné léčby meningeomů u mladších pacientů [30,31]. Významně ovlivňuje riziko recidivy. U pacientů 7., případně 8. decenia je s ohledem na předpokládanou délku dožití diskuze o pravděpodobnosti recidivy menší [32].
Hlavním omezením této studie je její retrospektivní povaha. Hodnoceni byli pacienti, kteří již byli vybráni k operaci, bez přesného protokolu, takže výběr do určité míry závisel na zkušenostech a subjektivním hodnocení neurochirurga. Kromě toho mohl výsledky ovlivnit i chybějící zavedený protokol, podle kterého by pacienti s těžkými komorbiditami neměli být indikováni k operaci.
Závěr
Individualizovaná analýza pacientů a zkušenosti neurochirurga nadále zůstávají významnými faktory ve volbě léčebného postupu u geriatrických pacientů s diagnózou meningeomu [33–35]. Skórovací systémy uplatňované při výběru léčebné modality u pacientů vyššího věku s meningeomem nicméně umožňují významně ovlivnit riziko dané léčebné modality, a tím optimalizovat léčebný postup a v konečném důsledku celkové přežití pacientů a prognózu onemocnění [36]. Aplikace skórovacích systémů indikuje strategii „watch and wait“ u pacientů s malými asymptomatickými i pomalu rostoucími extraaxiálními expanzemi, které v případě absence neurologické symptomatologie mohou být lokalizovány i v elokventních oblastech mozku [37]. Podmínkou je polymorbidita nebo vysoký věk pacientů, kde hraje významnou roli faktor 5letého přežití. S kvantifikací rizika interních komorbidit významně pomáhají Geriatric scoring scale a Charlson Comorbidity index. Nestanovují přímo riziko neurochirurgického výkonu, nicméně by měly být aplikovány ještě před zvážením chirurgického výkonu [38]. K indikaci k radiochirurgii přistupujeme u meningeomů rostoucích, bez kolaterálního edému, s maximálním rozměrem do 30 mm. Operační řešení volíme u pacientů s diagnostikovaným velkým, klinicky manifestním meningeomem za předpokladu příznivých hodnot zejména ve skórovacích systémech CLASS a SKALE. Klinická symptomatologie je faktorem natolik významným a opakovaně popsaným v literatuře, že pravděpodobnost pětiletého přežití v konkrétních případech hraje sekundární roli [39,40].
Etické aspekty
Práce byla provedena ve shodě s Helsinskou deklarací z roku 1975 a jejími revizemi v letech 2004 a 2008. Jedná se o retrospektivní studii nepodléhající schválení etickou komisí.
Grantová podpora
Podpořeno MZ ČR – RVO (FNBr, 65269705).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
MUDr. Andrej Mrlian, Ph.D.
Neurochirurgická klinika
LF MU a FN Brno
Jihlavská 20
625 00, Brno
e-mail: mrlian.andrej@fnbrno.cz
Přijato k recenzi: 6. 6. 2022
Přijato do tisku: 17. 11. 2022
Zdroje
1. Buerki RA, Horbinski CM, Kruser T et al. An overview of meningiomas. Future Oncol 2018; 14 (21): 2161–2177. doi: 10.2217/fon-2018-0006.
2. Apra C, Peyre M, Kalamarides M. Current treatment options for meningioma. Expert Rev Neurother 2018; 18 (3): 241–249. doi: 10.1080/14737175.2018.1429920.
3. Wiemels J, Wrensch M, Claus EB. Epidemiology and etiology of meningioma. J Neurooncol 2010; 99 (3): 307–314. doi: 10.1007/s11060-010-0386-3.
4. Ekaireb RI, Edwards CS, Ali MS et al. Meningioma surgical outcomes and complications in patients aged 75 years and older. J Clin Neurosci 2021; 88: 88–94. doi: 10.1016/j.jocn.2021.03.032.
5. Ikawa F, Kinoshita Y, Takeda M et al. Review of current evidence regarding surgery in elderly patients with meningioma. Neurol Med Chir (Tokyo) 2017; 57 (10): 521–533. doi: 10.2176/nmc.ra.2017-0011.
6. Eseonu C, Vivas-Buitrago T, Quiñones-Hinojosa A. Meningiomas in the elderly. Handb Clin Neurol 2020; 169: 261–271. doi: 10.1016/B978-0-12-804280-9.00017-2.
7. Ahmeti H, Borzikowsky C, Hollander D et al. Risks and neurological benefits of meningioma surgery in elderly patients compared to young patients. J Neurooncol 2021; 154 (3): 335–344. doi: 10.1007/s11060-021-038 32-5.
8. Amano T, Nakamizo A, Michiwaki Y et al. Surgical outcome in elderly patients with intracranial meningioma. J Clin Neurosci 2018; 56: 63–66. doi: 10.1016/ j.jocn.2018.07.009.
9. Kim YJ, Kang J, Kim MJ et al. Development and validation of the VitaL CLASS score to predict mortality in stage IV solid cancer patients with septic shock in the emergency department: a multi-center, prospective cohort study. Korean Shock Society (KoSS) Investigators.BMC Med 2020; 18 (1): 390. doi: 10.1186/s12916-020-01875-5.
10. Monden D, Raimann FJ, Neef V et al. Meningioma surgery in patients – 70 years of age: clinical outcome and validation of the SKALE score. J Clin Med 2021; 10: 1820. doi: 10.3390/jcm10091820.
11. Zhao X, Zhao D, Wu Y et al. Meningioma in the elderly: characteristics, prognostic factors, and surgical strategy. J Clin Neurosci 2018; 56: 143–149. doi: 10.1016/ j.jocn.2018.06.011.
12. Charlson Comorbidity Index. [online]. Available from: https: //www.mdcalc.com/calc/3917/charlson-comorbidity-index-cci.
13. Simpson D. The recurrence of intracranial meningiomas after surgical treatment. J Neurol Neurosurg Psychiatry 1957; 20 (1): 22–39. doi: 10.1136/jnnp.20.1.22.
14. Brusselaers N, Lagergren J. The Charlson comorbidity index in registry-based research. Methods Inf Med 2017; 56 (5): 401–406. doi: 10.3414/ME17-01-0051.
15. Rafiq R, Katiyar V, Garg K et al. Comparison of outcomes of surgery for intracranial meningioma in elderly and young patients – a systematic review and meta-analysis. Clin Neurol Neurosurg 2021; 207: 106772. doi: 10.1016/j.clineuro.2021.106772.
16. Goldbrunner R, Stavrinou P, Jenkinson MD et al. EANO guideline on the diagnosis and management of meningiomas. Neuro Oncol 2021; 23 (11): 1821–1834. doi: 10.1093/neuonc/noab150.PMID: 34181733.
17. Troya Castilla M, Chocrón Gonzalez Y, Márquez Rivas FJ. Complications and outcomes in the elderly with intracranial meningioma. Rev Esp Geriatr Gerontol 2016; 51 (2): 82–87. doi: 10.1016/j.regg.2015.06.004.
18. Czernicki T. Surgical Management of intracranial meningiomas in the elderly: early and long-term outcomes. Clin Interv Aging 2020; 15 (4): 2439–2451. doi: 10.2147/CIA.S283678.
19. Di Cristofori A, Zarino B, Bertani G et al. Surgery in elderly patients with intracranial meningioma: neuropsychological functioning during a long-term follow-up. J Neurooncol 2018; 137 (3): 611–619. doi: 10.1007/s11060-018-2754-3.
20. Brokinkel B, Holling M, Spille DC et al. Surgery for meningioma in the elderly and long-term survival: comparison with an age – and sex-matched general population and with younger patients. J Neurosurg 2017; 126 (4): 1201–1211. doi: 10.3171/2016.2. JNS152611.
21. Díaz J, Carballares J, Zabalo G et al. Comparison of intracranial meningioma outcome scales in operated patients older than 65 years old. Our experience between 2002–2012 and a literature review. Neucir 2016; 27 (1): 2–9. doi: 10.1016/j.neucir.2015.04.003.
22. Zoia C, Bongetta D, Guerrini F et al. Outcome of elderly patients undergoing intracranial meningioma resection: a single-center experience. J Neurosurg Sci 2021; 65 (5): 513–517. doi: 10.23736/S0390-5616.18.04333-3.
23. Chen ZY, Zheng CH, Tang Li et al. Intracranial meningioma surgery in the elderly (over 65 years): prognostic factors and outcome. Acta Neurochir (Wien) 2015; 157 (9): 1549–1557. doi: 10.1007/s00701-015-2502-9.
24. Joubert C, Sellier A, Sahuc P et al. Neurosurgery for intracranial meningioma in patients aged more than 80 years: benefits and rationale. Br J Neurosurg 2021; 35 (4): 470–475. doi: 10.1080/02688697.2021.1875397.
25. Caroli M, Locatelli M, Prada F et al. Surgery for intracranial meningiomas in the elderly: a clinical-radiological grading system as a predictor of outcome. J Neurosurg 2005; 102 (2): 290–294. doi: 10.3171/jns.2005.102.2.0290.
26. Kim L. A narrative review of targeted therapies in meningioma. Chin Clin Oncol 2020; 9 (6): 76. doi: 10.21037/cco-2020-mbt-01.
27. Behling F, Fodi C, Hoffmann E et al. The role of Simpson grading in meningiomas after integration of the updated WHO classification and adjuvant radiotherapy. Neurosurg Rev 2021; 44 (4): 2329–2336. doi: 10.1007/s10143-020-01428-7.
28. Delgado-Fernández J, García-Pallero MA, Gil-Simoes R et al. Validation of grading scores and outcome prognostic factors in intracranial meningiomas in elderly patients. World Neurosurg 2018; 114: e1057–e1065. doi: 10.1016/j.wneu.2018.03.146.
29. Konglund A, Rogne SG, Helseth E et al. Meningioma surgery in the very old-validating prognostic scoring systems. Acta Neurochir (Wien) 2013; 155 (12): 2263–2271. doi: 10.1007/s00701-013-1872-0.
30. Brokinkel B, Spille DC, Brokinkel C et al. The Simpson grading: defining the optimal threshold for gross total resection in meningioma surgery. Neurosurg Rev 2021; 44 (3): 1713–1720. doi: 10.1007/s10143-020-01369-1.
31. Horvath B, Kloesel B, Todd MM et al. The evolution, current value, and future of the American Society of Anesthesiologists Physical Status Classification System. Anesthesiology 2021; 135 (5): 904–919. doi: 10.1097/ALN. 0000000000003947.
32. Kan HJ, Kharrazi H, Leff B et al. Defining and assessing geriatric risk factors and associated health care utilization among older adults using claims and electronic health records. Med Care 2018; 56 (3): 233–239. doi: 10.1097/MLR.0000000000000865.
33. Brastianos PK, Galanis E, Butowski N et al. Advances in multidisciplinary therapy for meningiomas. Neuro Oncol 2019; 21 (Suppl 1): i18–i31. doi: 10.1093/neuonc/noy136.
34. Goldbrunner R, Stavrinou P, Jenkinson MD et al. EANO guideline on the diagnosis and management of meningiomas. Neuro Oncol 2021; 23 (11): 1821–1834. doi: 10.1093/neuonc/noab150.
35. Ikawa F, Isobe N, Michihata N et al. In-hospital complications after surgery in elderly patients with asymptomatic or minor symptom meningioma: a nationwide registry study. World Neurosurg 2021; 148: e459–e470. doi: 10.1016/j.wneu.2021.01.001.
36. Black P, Kathiresan S, Chung W. Meningioma surgery in the elderly: a case-control study assessing morbidity and mortality. Acta Neurochir (Wien) 1998; 140 (10): 1013–1017. doi: 10.1007/s007010050209.
37. Ekşi MŞ, Canbolat Ç, Akbaş A et al. Elderly patients with intracranial meningioma: surgical considerations in 228 patients with a comprehensive analysis of the literature. World Neurosurg 2019; 132: e350–e365. doi: 10.1016/j.wneu.2019.08.150.
38. Schul DB, Wolf S, Krammer MJ et al. Meningioma surgery in the elderly: outcome and validation of 2 proposed grading score systems. Neurosurgery 2012; 70 (3): 555–565. doi: 10.1227/NEU.0b013e318233a 99a.
39. Cohen-Inbar O. Geriatric brain tumor management part I: Meningioma. J Clin Neurosci 2019; 67: 5–9. doi: 10.1016/j.jocn.2019.05.063.
40. Pamir MN, Özduman K. Current decision-making in meningiomas. Handb Clin Neurol 2020; 169: 229–252. doi: 10.1016/B978-0-12-804280-9.00015-9.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2022 Číslo 6
Nejčtenější v tomto čísle
- Doporučení pro vývojovou dysfázii – verze 2022
- Validační studie a představení nového testu porozumění větám TEPO pro děti ve věku 3–8 let
- Nové farmakologické možnosti v léčbě Alzheimerovy nemoci
- Pletencové svalové dystrofie
