Chronická zánětlivá senzitivní polyradikulopatie asociovaná s monoklonální gamapatií nejasného významu
Autoři:
P. Potužník; J. Vejskal
Působiště autorů:
Neurologická klinika LF UK a FN Plzeň
Vyšlo v časopise:
Cesk Slov Neurol N 2022; 85(6): 509-510
Kategorie:
Dopis redakci
doi:
https://doi.org/10.48095/cccsnn2022509
Vážená redakce,
chronická zánětlivá senzitivní polyradikulopatie (chronic immune sensory polyradiculopathy; CISP) je vzácné onemocnění s chronickým zánětlivým fokálním senzitivním demyelinizačním postižením zadních míšních kořenů a s normálními elektromyografickými senzitivními kondukčními studiemi [1]. V roce 2021 byla publikována revidovaná diagnostická kritéria chronické zánětlivé demyelinizační polyneuropatie (chronic inflammatory demyelinating polyneuropathy; CIDP), která CISP již neřadí mezi varianty CIDP, i když patofyziologicky mají tyto jednotky některé charakteristiky podobné.
Klinická kritéria typické CIDP zahrnují progresivní či relabující symetrickou slabost distálních a/nebo proximálních svalů dolních a horních končetin, senzitivní lézi alespoň na dvou končetinách, dobu trvání nemoci nejméně 8 týdnů a chybění či snížení šlachookosticových reflexů. K paraklinickým kritériím CIDP patří potvrzení demyelinizační polyneuropatie pomocí EMG, odpověď na léčbu, průkaz zesílení cervikálních a lumbosakrálních nervových kořenů či nervových pletení na MR a/nebo ultrasonograficky a/nebo průkaz enhancementu v těchto oblastech na MR po podání k. l. Pokud jsou diagnostická kritéria splněna, není již nutné doplňovat vyšetření mozkomíšního moku, ale je vhodné ho zvážit kvůli diferenciální diagnostice a podpoření diagnózy. Mezi diferenciální diagnostiku senzitivní CIDP patří CISP, CANVAS (syndrom cerebelární ataxie, neuropatie a vestibulární areflexie), postižení zadních provazců míšních, hereditární senzitivní neuropatie, idiopatická senzitivní polyneuropatie, senzorická neuronopatie a toxické neuropatie [2].
CISP se klinicky projevuje senzitivní ataxií. Do diagnostických kritérií patří průkaz preganglionární léze senzitivních míšních kořenů, jež je u této jednotky přítomna. Pomocná vyšetření zahrnují normální senzitivní a motorické kondukční studie a současné potvrzení senzitivní periferní léze na somatosenzorických evokovaných potenciálech (SSEP) a/nebo zesílení či kontrastní sycení míšních kořenů na MR [3]. Dle některých doporučení by pomocí zobrazovacích metod (mozku a míchy vč. míšních kořenů) měly být vyloučeny další možné příčiny ataxie [4]. Dle retrospektivní analýzy Shellyho et al je u 92 % pacientů s CISP v likvoru zvýšená proteinorachie [1].
V naší kazuistice popisujeme případ 75letého pacienta. Jedná se o kardiovaskulárně kompromitovaného nemocného léčeného mimo jiné i pro diabetes mellitus 2. typu.
Důvodem přijetí na neurologickou kliniku byla v řádu 4 měsíců subakutně progredující porucha stability s klinickým obrazem senzitivní ataxie s areflexií na dolních končetinách a ztrátou schopnosti samostatné chůze. Subjektivně pacient dále vnímal intermitentní senzitivní příznaky – brnění od kolen distálně, zejména v lýtkách a na nártech.
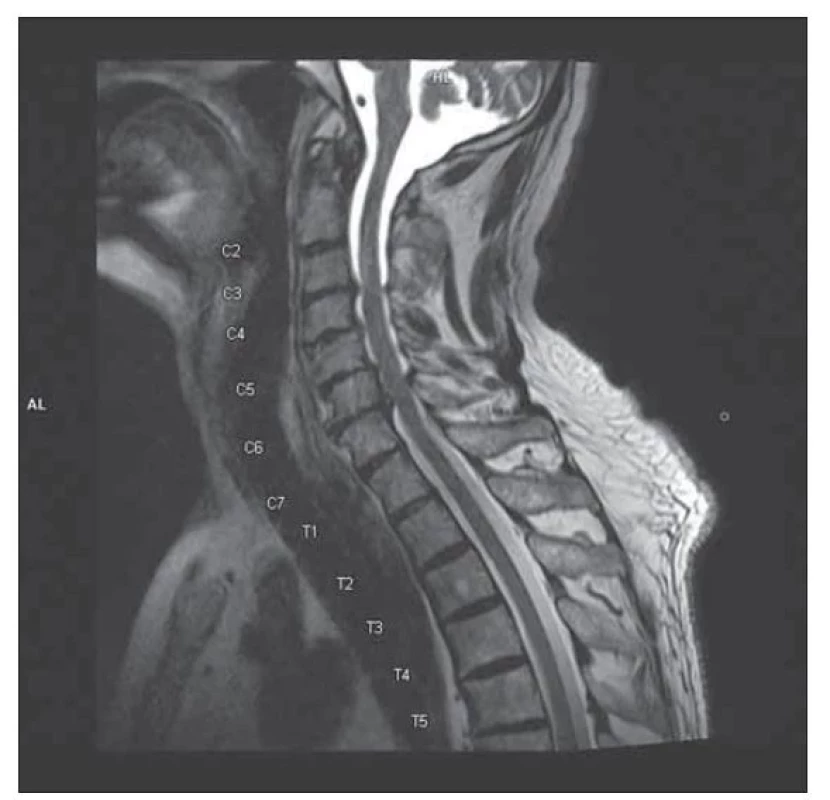
Vstupní nativní CT mozku prokázala pouze atrofii odpovídající věku, bez ložiskového nálezu. Laboratorně byla přítomna lehká renální insuficience suspektně při diabetické a hypertenzní nefropatii. EMG neprokázala polyneuropatii, ale nebyly výbavné H-reflexy. Doplněná MR C a LS páteře ozřejmila tandemovou absolutní stenózu s maximem nálezu v oblasti L4–S1 (obr. 1) a C3–7 (obr. 2), bez myelopatických změn a bez známek zesílení kořenů a jejich kontrastního sycení. Výsledky SSEP potvrdily klinicky přítomné periferní postižení všech končetin a absenci centrální léze. Tento nález tedy splňuje kritéria pro postižení pregangliové části senzitivních kořenů v rámci CISP. Lumbální punkce prokázala proteinocytologickou disociaci (celková bílkovina 0,73 g/l) bez průkazu oligoklonálních pásů. Širší laboratorní náběry (vč. kompletního krevního obrazu, biochemie, sedimentace erytrocytů, elektroforézy bílkovin, panelu autoimunitních systémových chorob a vaskulitid, imunoglobulinů, vitaminu B12, kyseliny listové, hormonů štítné žlázy a protilátek proti transglutamináze) ozřejmily gamapatii imunoblobulinu G (IgG). CT trupu doplněná v rámci onkoscreeningu byla bez neoplazie, paraneoplastické protilátky negativní. Pro nález gamapatie IgG lambda byla v režii hematoonkologie provedena trepanobiopsie s mírně hypercelulární kostní dření se zmnoženými plazmatickými buňkami s dominancí IgG lambda, dle cytoflowmetrie bez průkazu hematomalignity. Vyšetření karyotypu nenalezlo strukturální či početní aberace. Jedná se tedy o monoklonální gamapatii nejasného významu. V séru se prokázala pozitivita anti-GM2 IgG + M 89,4 %, ostatní protilátky proti gangliosidům byly negativní vč. anti-MAG.
Fig. 1. MRI of lumbosacral spine, T1 weighted image, sagittal
plane: lumbar spinal stenosis L4–S1.
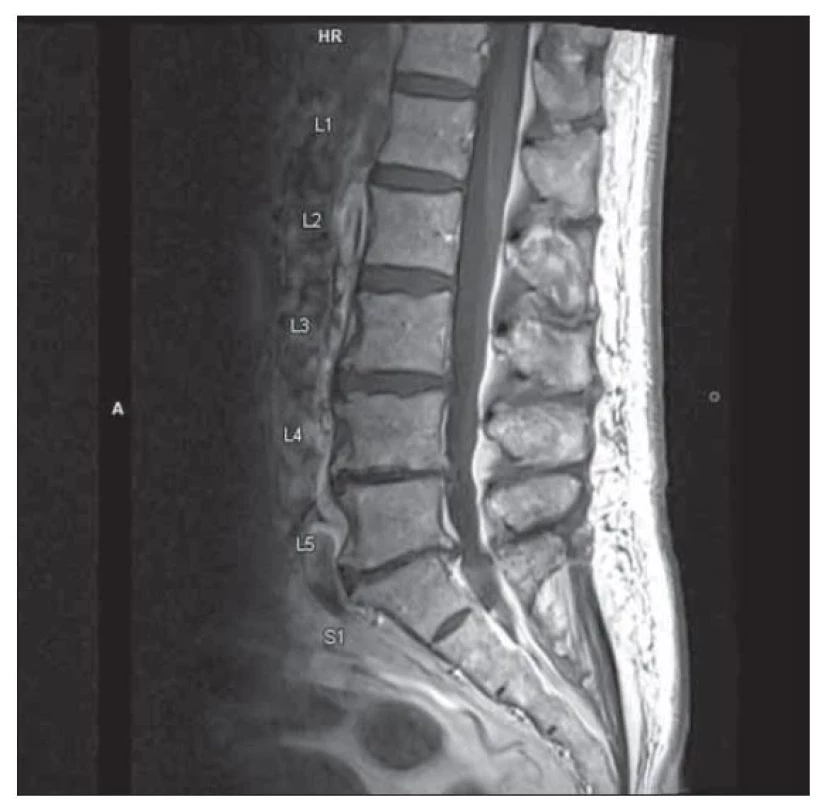
Fig. 2. MRI of cervical spine, T2 weighted image, sagittal plane:
cervical spinal stenosis C3–7.
CISP stejně jako CIDP a její varianty asociované s gamapatií IgG dle literárních údajů vykazují dobrou terapeutickou odpověď na standardní prvoliniovou imunosupresivní/modulační léčbu (intravenózní imunoglobuliny, výměnné plazmaferézy, kortikosteroidy), v některých případech byl indikován i azathioprin a rituximab [1,5]. V rámci imunosupresivní/modulační léčby byla zahájena kortikoterapie (5 g metylprednisolonu intravenózně s následným převodem na perorální prednison) s uspokojivými glykémiemi; symptomaticky nasazen pregabalin.
Při klinické kontrole s 3měsíčním odstupem od zahájení léčby se subjektivní potíže pacienta výrazně zlepšily, v objektivním nálezu nadále trvá senzitivní ataxie s pozitivní Rombergovou zkouškou, chůze je již na krátkou vzdálenost plně samostatná, s hůlkou ujde 1 km.
Na CISP, která patří do diferenciální diagnostiky senzitivní CIDP, bychom měli myslet při klinických příznacích a normálním EMG nálezu. V tomto případě je vždy nutné doplnit SSEP a/nebo MR se zaměřením na míšní kořeny a nervové plexy vč. podání k. l. Lékem první volby jsou kortikosteroidy, intravenózní imunoglobuliny nebo výměnné plazmaferézy [1]. Diferenciálně diagnostiky CISP odlišíme od senzitivní CIDP, CANVAS, hereditární senzitivní neuropatie, idiopatické senzitivní polyneuropatie, senzorické neuronopatie (vč. paraneoplastické) a toxických neuropatií elektrofyziologicky pomocí EMG. Na rozdíl od CISP jsou u výše uvedených jednotek patologické senzitivní kondukční studie (pouze u některých vzácných variant hereditární senzitivní neuropatie mohou být kondukční studie v normě).
MUDr. Pavel Potužník Ph.D.
Neurologická klinika
LF UK a FN Plzeň
e-mail: potuznikp@fnplzen.cz
Přijato k recenzi: 19. 7. 2022
Přijato do tisku: 21. 11. 2022
Zdroje
1. Shelly S, Shouman K, Paul P et al. Expanding the spectrum of chronic immune sensory polyradiculopathy: CISP-Plus. Neurology 2021; 96 (16): e2078–e2089. doi: 10.1212/WNL.0000000000011792.
2. Van den Bergh PYK, van Doorn PA, Hadden RDM et al. European Academy of Neurology/Peripheral Nerve Society guideline on diagnosis and treatment of chronic inflammatory demyelinating polyradiculoneuropathy: Report of a joint Task Force-Second revision. J Peripher Nerv Syst 2021; 26 (3): 242–268. doi: 10.1111/jns.12455.
3. Menon D, Katzberg HD, Bril V. Treatment approaches for atypical CIDP. Front Neurol 2021; 12: 653734. doi: 10.3389/fneur.2021.653734.
4. Sinnreich M, Klein CJ, Daube JR et al. Chronic immune sensory polyradiculopathy: a possibly treatable sensory ataxia. Neurology 2004; 63 (9): 1662–1669. doi: 10.1212/01.wnl.0000142507.12763.58.
5. Cocito D, Durelli L, Isoardo G. Different clinical, electrophysiological and immunological features of CIDP associated with paraproteinaemia. Acta Neurol Scand 2003; 108 (4): 274–280. doi: 10.1034/j.1600-0404.2003.00 127.x.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2022 Číslo 6
Nejčtenější v tomto čísle
- Doporučení pro vývojovou dysfázii – verze 2022
- Validační studie a představení nového testu porozumění větám TEPO pro děti ve věku 3–8 let
- Nové farmakologické možnosti v léčbě Alzheimerovy nemoci
- Pletencové svalové dystrofie
