Cenobamát
Cenobamate
Cenobamate (CNB) is a novel antiepileptic drug with a dual mechanism of action indicated for the adjunctive treatment of focal-onset seizures in adult patients with epilepsy inadequately controlled despite prior treatment with at least two antiepileptic drugs. In therapeutic doses, it most likely acts through positive allosteric modulation of γ-aminobutyric acid type A (GABAA) receptors at the non-benzodiazepine binding site, as well as preferential inhibition of persistent sodium currents and enhancement of the deactivated state of voltage-gated sodium channels. Numerous clinical experiences with cenobamate testify to its high effectiveness in terms of achieving seizure-freedom, even in patients who are still drug-resistant. At the same time, CNB appears to be a well-tolerated drug with a minimum of adverse events. However, attention must be paid to potential pharmacokinetic interactions and gradual titration when starting treatment. It is contraindicated in patients with a rare familial occurrence of a short QT interval. Its recommended dosage is 200–400 mg/d taken in one daily dose.
Keywords:
pharmacoresistance – Epilepsy – cenobamate – adjunctive treatment
Autoři:
prof. MUDr. Milan Brázdil, Ph.D.
Působiště autorů:
1. neurologická klinika
; LF MU a FN u sv. Anny v Brně
; Centrum pro epilepsie Brno
Vyšlo v časopise:
Cesk Slov Neurol N 2022; 85(5): 417-420
Kategorie:
Lékový profil
Souhrn
Cenobamát (CNB) je nové antiepileptikum s duálním mechanizmem účinku, indikované k přídatné léčbě fokálních záchvatů u dospělých pacientů s epilepsií bez adekvátní kontroly navzdory předchozí léčbě nejméně dvěma antiepileptiky. V terapeutických dávkách účinkuje nejspíše prostřednictvím pozitivní alosterické modulace receptorů GABAA na nebenzodiazepinovém vazebném místě a také přednostní inhibicí perzistentních sodíkových proudů a posílením deaktivovaného stavu napěťově řízených sodíkových kanálů. Četné klinické zkušenosti s cenobamátem svědčí pro jeho vysokou účinnost ve smyslu dosažení bezzáchvatovosti, a to i u pacientů dosud farmakorezistentních. Současně se CNB jeví být lékem dobře tolerovaným a s minimem nežádoucích účinků. Pozornost při jeho užívání nicméně musí být věnována případným farmakokinetickým interakcím a pozvolné titraci při zahájení léčby. Kontraindikován je u pacientů se vzácným familiárním výskytem krátkého QT intervalu. Jeho doporučené dávkování je 200–400 mg užívané v jedné denní dávce.
Klíčová slova:
epilepsie – farmakorezistence – cenobamát – přídatná léčba
Farmakologická skupina
Cenobamát (CNB) patří do farmakologické skupiny antiepileptik. Recentně je termín antiepileptikum celosvětově nahrazován kostrbatějším, ale přesnějším termínem protizáchvatový lék (anti-seizure medication; ASM), který bude dále používán i v tomto článku. Podobně jako felbamát, retigabine či karisbamát je CNB derivátem alkyl-karbamátů (obr. 1). ATC kód: N03AX25
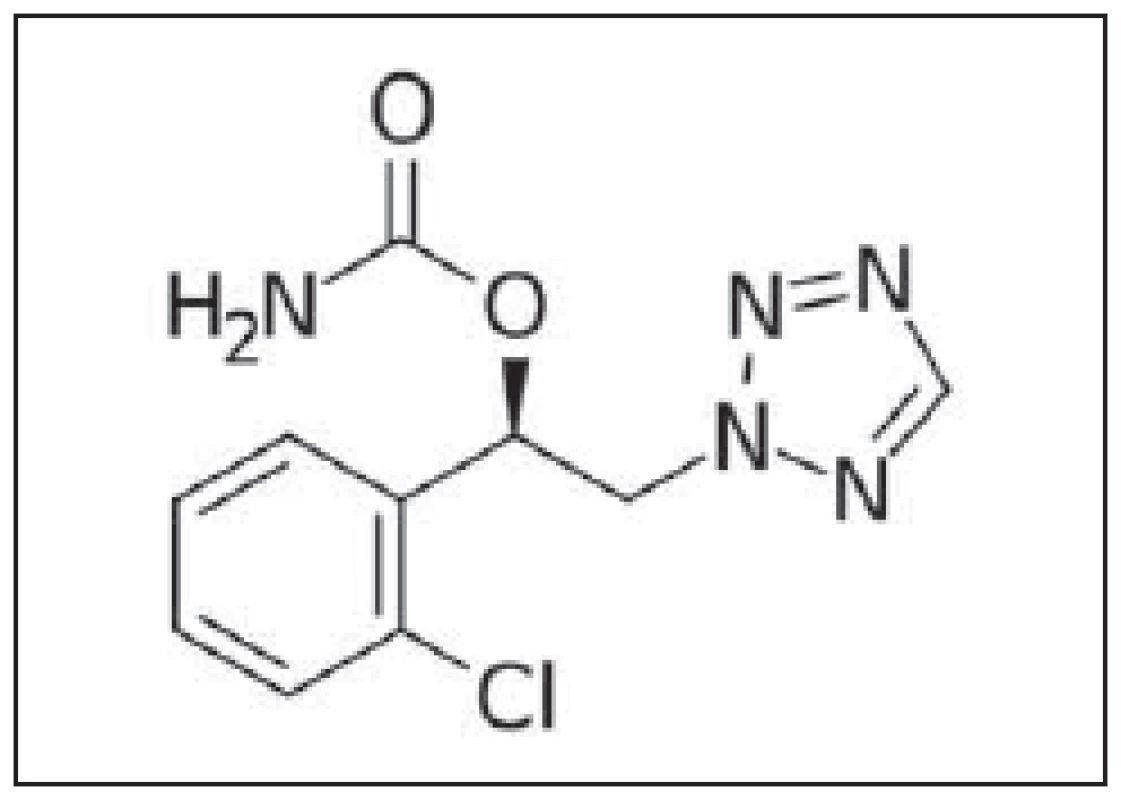
Mechanizmus účinku, farmakodynamika
Cenobamát patří mezi protizáchvatové léky, které cílí na sodíkové kanály, avšak vedle inhibice perzistentních sodíkových proudů a posílení deaktivovaného stavu napěťově řízených sodíkových kanálů byl prokázán ještě jeden jeho komplementární mechanizmus účinku, a to pozitivní alosterická modulace receptorů kyseliny gama-aminomáselné (GABAA) na nebenzodiazepinovém vazebném místě [1]. Zda jsou to pouze tyto mechanizmy, které jsou zodpovědné za protizáchvatové působení CNB, zatím není zcela jasné.
Srdeční elektrofyziologie
V placebem kontrolované studii intervalu QT (QTc) u zdravých dobrovolníků bylo při podávání CNB pozorováno mírné zkrácení QTc závisející na dávce, avšak u žádného ze 108 vyšetřených jedinců nebylo pozorováno klinicky relevantní zkrácení intervalu QTc (tj. pod 340 ms). Současně bylo v dané studii potvrzeno, že CNB nemá klinicky významný efekt na tepovou frekvenci či jiné parametry EKG a v terapeutických dávkách neprodlužuje interval QT. Z důvodu popsaného efektu CNB na QTc je kontraindikováno podávání cenobamátu u jedinců s vrozeným syndromem krátkého intervalu QT. Je doporučena opatrnost při současném podávání léků zkracujících QTc [2].
Farmakokinetické vlastnosti
Po perorálním podání je CNB, nezávisle na jídle, minimálně z 88 % absorbován v gastrontestinálním traktu a své maximální plazmatické koncentrace dosahuje do 1–4 h. V krevní plazmě se z 60 % váže na bílkoviny, primárně na albumin. Hlavní metabolickou drahou je glukuronidace prostřednictvím UGT2B7 a v menší míře UGT2B4. Mezi méně významné cesty CNB metabolizmem patří oxidace prostřednictvím CYP2E1, CYP2A6, CYP2B6 a v menší míře CYP2C19 a CYP3A4/5. CNB a jeho metabolity jsou vylučovány primárně močí, více než 50 % dávky je vyloučeno během 72 h. CNB se proto má používat s opatrností a u pacientů s mírnou až středně závažnou (clearance kreatininu 30 až < 90 ml/min) nebo závažnou (clearance kreatininu < 30 ml/min) poruchou funkce ledvin lze zvážit snížení cílové dávky. Maximální doporučená dávka u pacientů s mírnou, středně závažnou nebo závažnou poruchou funkce ledvin je 300 mg/den. CNB nemají užívat pacienti v terminálním stadiu poruchy funkce ledvin nebo pacienti podstupující hemodialýzu. Zdánlivý terminální poločas CNB v plazmě byl 50–60 h v terapeutickém rozmezí 100–400 mg/den. Rovnovážného stavu je dosaženo do 14 dnů [3]. Jak již bylo uvedeno, CNB je rozsáhle metabolizován, může snižovat expozici přípravkům primárně metabolizovaným pomocí CYP3A4 a 2B6 a zvyšovat expozici přípravkům primárně metabolizovaným pomocí CYP2C19. Při zahájení nebo vysazení léčby cenobamátem nebo při změně dávky může trvat 2 týdny, než je dosaženo nové úrovně aktivity enzymu. Lékové interakce s jinými ASM uvádí tab. 1.
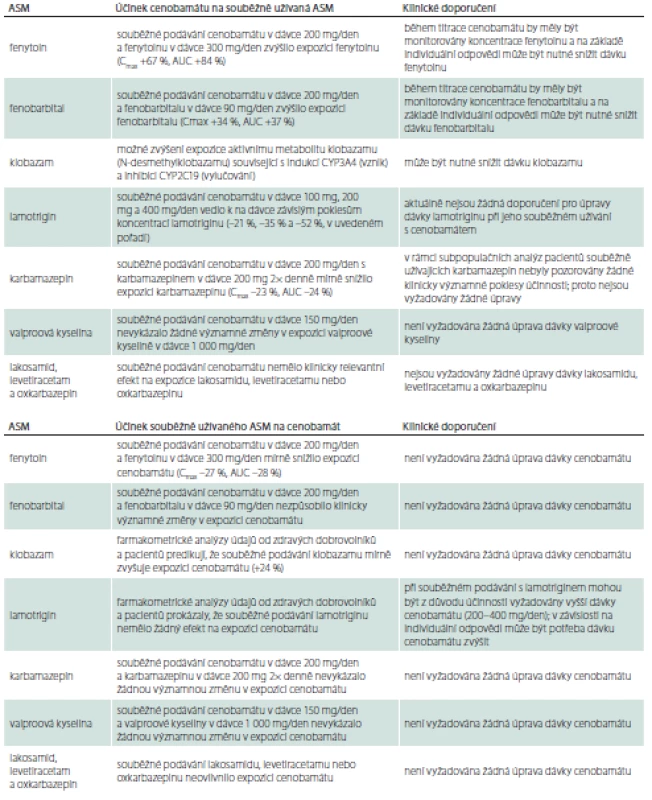
Z praktického hlediska je vhodné uvedené farmakokinetické interakce zohlednit při nasazení CNB u pacientů s již užívanou protizáchvatovou medikací, konkrétně při souběžném podávání s CNB může být nutné snížit dávky fenytoinu, fenobarbitalu a klobazamu [4].
Klinické zkušenosti
Randomizované, placebem kontrolované studie
Klinická účinnost a bezpečnost léčby CNB byla před jeho uvedením na trh hodnocena ve 22 studiích fáze I, dvou placebem kontrolovaných multicentrických studiích účinnosti a bezpečnosti fáze II (C013 a C017) a jedné probíhající otevřené studii bezpečnosti fáze III (C021). Ve studiích fáze II / III bylo cenobamátu exponováno celkově 4068,6 pacientů-let a minimálně jedna dávka CNB byla podána více než 2 500 jedincům. Ve studiích fáze II a III byl testován efekt CNB v dávkách 50–200, respektive 400 mg/d. Výsledky těchto studií shodně prokázaly překvapivě vysoký podíl pacientů, kteří dosáhli v průběhu klinického hodnocení (konkrétně v průběhu 12týdenní udržovací fáze) úplného vymizení záchvatů (při dávce 200 mg/d to bylo ve skupině s CNB 28,3 % pacientů oproti 8,8 % ve skupině s placebem a při dávce 400 mg/d pak 21 % oproti 1 % ve skupině s placebem) [5,6]. Ještě nadějnější pak byl průkaz vysokého procenta pacientů dlouhodobě setrvávajících na léčbě CNB v otevřené pokračující studii C021 [7]. Tzv. retention rate byl po roce 79 % a po 2 letech poklesl jen mírně na 76 %. Podobně vysoký retention rate prokázali na souhrnných datech z pokračující fáze uvedených klinických studií i Sander et al [8].
Dostupná data z reálné praxe
Nadějně ve smyslu vysoké účinnosti cenobamátu vyznívají i první publikovaná data z jeho použití v běžné klinické praxi. V recentní retrospektivní studii, hodnotící účinnost, snášenlivost a lékové interakce v kohortě 45 dospělých a adolescentních farmakorezistentních pacientů sledovaných při léčbě CNB v průměru po dobu 10 měsíců, prokázali Elliott et al [9] dosažení bezzáchvatovosti u 16 % léčených jedinců. V malém souboru 27 dospělých pacientů s epilepsií a neurovývojovými poruchami léčenými v reálné klinické praxi po dobu půl roku dosáhla bezzáchvatovosti téměř polovina pacientů (konkrétně 48,2 %) [10]. Bezpečnost a dobrá snášenlivost CNB byly při respektování pomalé titrace léku prokázány jak v předregistračních randomizovaných klinických studiích, tak i v reálné praxi, přičemž nejčastějšími nežádoucími účinky CNB byly (podobně jako u většiny dostupných ASM) ospalost, závratě a únava [11]. Respektování pomalé titrace léku při zahájení léčby CNB je více než nutné i z důvodu prevence rozvoje závažné idiosynkratické reakce DRESS (rash, eozinofilie, lymfadenopatie a další systémová postižení), která byla ojediněle pozorována v úvodních fázích klinického testování CNB, avšak při pomalé (doporučené) titraci se již nevyskytla u žádného pacienta, a to dokonce ani u jedinců s polékovým rashem v anamnéze [9,11].
Zařazení do současné palety léčiv
Moderní farmakologická léčba epilepsie se vyznačuje poměrně vysokou účinností. Přesto, navzdory aktuální dostupnosti téměř třiceti protizáchvatových léků, zůstává stále asi třetina pacientů, u kterých bohužel není možné medikamentózně dosáhnout ultimátního cíle, tj. bezzáchvatovosti. Je to právě tato cílová skupina farmakorezistentních pacientů, která legitimizuje urgentní potřebu nového, bezpečného a vysoce účinného ASM. Léku, který by podobně jako svého času fenobarbital (1912), fenytoin (1938), karbamazepin (1965) či levetiracetam (2001) doslova změnil pravidla hry v léčbě epilepsie. I když je ještě brzy činit definitivní závěry stran CNB, dostupná data i první klinické zkušenosti naznačují, že právě CNB by se takovým přelomovým ASM mohl stát. Mohl by nabídnout reálnou naději na dosažení bezzáchvatovosti i u dosud farmakorezistentních pacientů. Zda tomu tak skutečně bude a CNB se stane prubířským kamenem farmakorezistence, nám ukáže již blízká budoucnost.
Dávkování
U dospělých jedinců je doporučená počáteční dávka CNB 12,5 mg denně, s postupnou titrací vždy v intervalech po dvou týdnech na 25, 50, 100, 150 a 200 mg/den (doporučená cílová dávka je 200 mg denně) (obr. 2). Na základě klinické odpovědi může být dávka zvýšena na maximálně 400 mg denně, v krocích po 50 mg/den každé 2 týdny [3].
![Titrační schéma pro zahájení léčby cenobamátem (převzato ze Steinhoff et al [12]).
Titration scheme for cenobamate treatment initiation (adapted from Steinhoff et al [12]).](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/05ca9cd4e95b940732d12168c3fa60c3.png)
prof. MUDr. Milan Brázdil, Ph.D.
autor článku
Centrum pro epilepsie Brno,
1. neurologická klinika
LF MU a FN u sv. Anny v Brně
e-mail: milan.brazdil@ceitec.muni.cz
prof. MUDr. Petr Marusič, Ph.D.
Neurologická klinika
2. LF UK a FN Motol, Praha
Zdroje
1. Latimer DR, Edinoff AN, Ruff RD et al. Cenobamate, a sodium channel inhibitor and positive allosteric modulator of GABAA ion channels, for partial onset seizures in adults: a comprehensive review and clinical implications. Neurol Int 2021; 13 (2): 252–265. doi: 10.3390/neurolint13020026.
2. Darpo B, Sager PT, Xue H et al. A phase 1 clinical study evaluating the effects of cenobamate on the QT interval. Clin Pharmacol Drug Dev 2022; 11 (4): 523–534. doi: 10.1002/cpdd.1077.
3. Summary of product characteristics. Ontozry (Cenobamate) Angelini Pharma S.p.A., 26. 3. 2021.
4. Roberti R, De Caro C, Iannone LF et al. Pharmacology of cenobamate: mechanism of action, pharmacokinetics, drug-drug interactions and tolerability. CNS Drugs 2021; 35 (6): 609–618. doi: 10.1007/s40263-021-00 819-8.
5. Chung SS, French JA, Kowalski J et al. Randomized phase 2 study of adjunctive cenobamate in patients with uncontrolled focal seizures. Neurology 2020; 94 (22): e2311–e2322. doi: 10.1212/WNL.0000000000009530.
6. Krauss GL, Klein P, Brandt C et al. Safety and efficacy of adjunctive cenobamate (YKP3089) in patients with uncontrolled focal seizures: a multicentre, double-blind, randomised, placebo-controlled, dose-response trial. Lancet Neurol 2020; 19 (1): 38–48. doi: 10.1016/S1474-4422 (19) 30399-0.
7. Sperling MR, Klein P, Aboumatar S et al. Cenobamate (YKP3089) as adjunctive treatment for uncontrolled focal seizures in a large, phase 3, multicenter, open-label safety study. Epilepsia 2020; 61 (6): 1099–1108. doi: 10.1111/epi.16525.
8. Sander L, Rosenfeld WE, Halford JJ et al. Long-term individual retention in cenobamate in adults with focal seizures: Pooled data from the clinical development program. Epilepsia 2022; 63 (1): 139–149. doi: 10.1111/epi.17134.
9. Elliott T, Ridley-Pryor T, Gienapp AJ et al. Initial real- -world experience with cenobamate in adolescents and adults: a single center experience. Pediatr Neurol 2022; 129: 19–23. doi: 10.1016/j.pediatrneurol.2022.01.001.
10. Connor GS, Williamson A. Effectiveness and safety of adjunctive cenobamate for focal seizures in adults with developmental disability treated in clinical practice. Epilepsy Behav Rep 2022; 18: 100533. doi: 10.1016/j.ebr.2022.100533.
11.Rosenfeld WE, Ferrari L, Kamin M. Efficacy of cenobamate by focal seizure subtypes: Post-hoc analysis of a phase 3, multicenter, open-label study. Epilepsy Res 2022; 183: 106940. doi: 10.1016/j.eplepsyres.2022.106940.
12. Steinhoff BJ, Rosenfeld WE, Serratosa JM et al. Practical guidance for the management of adults receiving adjunctive cenobamate for the treatment of focal epilepsy – expert opinion. Epilepsy Behav 2021; 123: 108270. doi: 10.1016/j.yebeh.2021.108270.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2022 Číslo 5
Nejčtenější v tomto čísle
- Onemocnění bederní páteře – nová neurologická nemoc z povolání
- Cenobamát
- Gyrus dentatus – anatomie, cévní zásobení, funkce a neuropatologie
- Karotický web
