Využití rohovkové konfokální mikroskopie u neurologických onemocnění
Use of corneal confocal microscopy in neurological disorders
Rohovková konfokální mikroskopie je rychlá a především neinvazivní zobrazovací metoda, která umožňuje zobrazit in vivo nervová vlákna subbazálního plexu rohovky. Tuto metodu lze využít při sledování postižení nervových vláken u řady neurologických onemocnění, zejména u skupiny chorob postihujících tzv. tenká nervová vlákna. Řada studií srovnává tuto metodu s dalšími, které jsou používány v klinické praxi při diagnostice těchto onemocnění, a potvrzuje vhodnost využití této metody jak pro diagnostiku časného rozvoje periferní neuropatie, tak i jako metodu sloužící k hodnocení klinického efektu léčby novými přístupy a preparáty u různých onemocnění. Ačkoliv stále chybí rozsáhlejší práce jednoznačně potvrzující validitu této metody, současné výsledky významně podporují možnosti její aplikace v praxi. Jedním z důvodů dosud malého využití je i její omezená dostupnost, nicméně vzhledem k postupujícímu výzkumu a dosaženým výsledkům lze do budoucna předpokládat širší využití nejen ve výzkumu, ale i v klinické praxi. Naším cílem bylo shrnout dosud publikované poznatky o využití této metody při sledování stavu nervových vláken u různých neurologických onemocnění.
Keywords:
Confocal microscopy – Cornea – small fiber neuropathy – peripheral neuropathies
Autoři:
J. Štorm 1; M. Česká Burdová 1; V. Potočková 2; R. Mazanec 2; G. Mahelková 1
Působiště autorů:
Oční klinika dětí a dospělých, 2. LF UK a FN Motol, Praha
1; Neurologická klinika, 2. LF UK a FN Motol, Praha
2
Vyšlo v časopise:
Cesk Slov Neurol N 2021; 84/117(4): 341-346
Kategorie:
Přehledný referát
doi:
https://doi.org/10.48095/cccsnn2021341
Souhrn
Rohovková konfokální mikroskopie je rychlá a především neinvazivní zobrazovací metoda, která umožňuje zobrazit in vivo nervová vlákna subbazálního plexu rohovky. Tuto metodu lze využít při sledování postižení nervových vláken u řady neurologických onemocnění, zejména u skupiny chorob postihujících tzv. tenká nervová vlákna. Řada studií srovnává tuto metodu s dalšími, které jsou používány v klinické praxi při diagnostice těchto onemocnění, a potvrzuje vhodnost využití této metody jak pro diagnostiku časného rozvoje periferní neuropatie, tak i jako metodu sloužící k hodnocení klinického efektu léčby novými přístupy a preparáty u různých onemocnění. Ačkoliv stále chybí rozsáhlejší práce jednoznačně potvrzující validitu této metody, současné výsledky významně podporují možnosti její aplikace v praxi. Jedním z důvodů dosud malého využití je i její omezená dostupnost, nicméně vzhledem k postupujícímu výzkumu a dosaženým výsledkům lze do budoucna předpokládat širší využití nejen ve výzkumu, ale i v klinické praxi. Naším cílem bylo shrnout dosud publikované poznatky o využití této metody při sledování stavu nervových vláken u různých neurologických onemocnění.
Klíčová slova:
konfokální mikroskopie – rohovka – neuropatie tenkých vláken – periferní neuropatie
Úvod
Rohovková konfokální mikroskopie je rychlá a především neinvazivní zobrazovací metoda, která mimo jiné umožňuje u pacienta zobrazit in vivo nervová vlákna subbazálního plexu rohovky. Možné využití in vivo konfokální mikroskopie rohovky (in vivo confocal microscopy; IVCM) k pozorování a hodnocení stavu nervových vláken subbazálního plexu rohovky je zkoumáno již více než 20 let [1]. Postupně došlo k výraznému nárůstu počtu studií popisujících využití IVCM při studiu vlivu různých onemocnění na změny nervových vláken rohovky. Dostupná literatura se v poslední době významně rozšířila o řadu studií s výsledky, které naznačují možnosti aplikace této metody v klinické praxi. V následujícím textu shrnujeme poznatky o využití IVCM pro sledování postižení tenkých nervových vláken u neurologických onemocnění.
Inervace rohovky
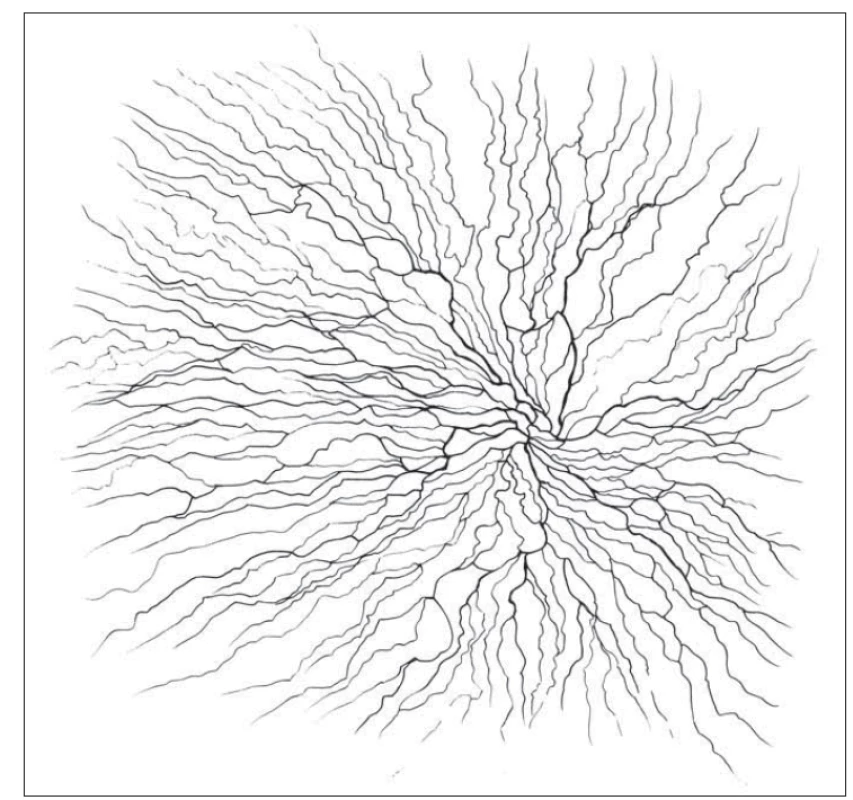
Rohovka je tkáň s nejhustší sítí nervových vláken (až 7 000 volných nervových zakončení na čtvereční milimetr). Tato vlákna se dostávají do oblasti oka cestou n. ophthalmicus (odstupující z 1. větve n. trigeminus) a jsou zodpovědná především za senzitivní inervaci rohovky. Do stromatu rohovky vstupují v oblasti limbu nemyelinizovaná i myelinizovaná vlákna, která dále perilimbálně ztrácejí myelinovou pochvu a zůstávají obklopena pouze Schwannovými buňkami. Tato vlákna prostupují stromatem a v oblasti předního stromatu a Bowmanovy membrány vytvářejí subbazální a subepiteliální nervový plexus. Terminální volná nervová zakončení inervují povrch rohovky. Vlákna subbazálního nervového plexu se spirálovitě stáčí inferonazálně směrem k paracentrální oblasti (obr. 1) [2,3]. Na základě stupně myelinizace a rychlosti vedení nervového vzruchu můžeme vlákna rohovky klasifikovat jako tenká, slabě myelinizovaná vlákna typu Ad a nemyelinizovaná vlákna typu C [4].
Fig. 1. Subbasal plexus illustration.
In vivo konfokální mikroskopie rohovky
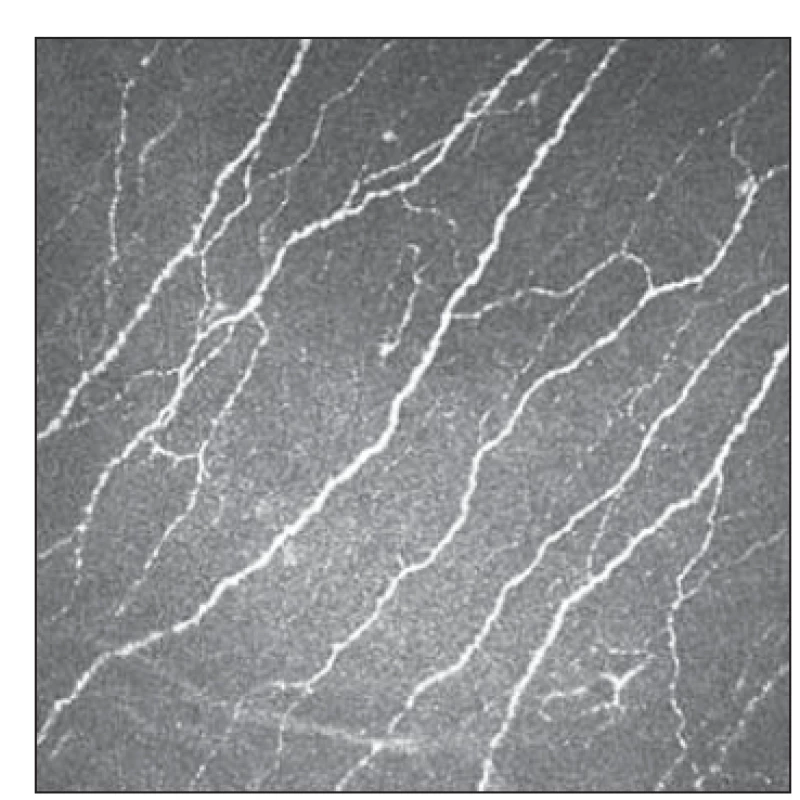
Konfokální mikroskopie rohovky je neinvazivní vyšetřovací metoda umožňující zobrazení jednotlivých vrstev rohovky in vivo na mikroskopické úrovni, pořizování digitálních snímků a jejich následnou analýzu. Ačkoli se ve starší literatuře můžeme setkat s několika druhy přístrojů, v současnosti je jak pro výzkum, tak pro klinickou praxi využíván prakticky výhradně laserový skenovací konfokální mikroskop Heidelberg Retina Tomograph s rohovkovým modulem Rostock Cornea (HRT III; Heidelberg Engineering, Heidelberg, Německo), jenž umožňuje dobře zobrazit vlákna subbazálního nervového plexu rohovky [5] a byl použit ve všech citovaných studiích. Laterální rozlišení přístroje je dle údajů výrobce 1,04 µm a axiální rozlišení 4 µm. Zobrazuje plochu o rozloze 400 × 400 µm a ukládá do snímku 386 × 386 px. Snímky jsou pořizovány po vrstvách jednotlivě, případně v sekvenci, což umožňuje přesné zachycení vláken subbazálního nervového plexu a jejich hodnocení (obr. 2) [6,7].
Fig. 2. Physiological configuration of
subbasal plexus as captured by Heidelberg
Retina Tomograph III.
Současná literatura definuje čtyři stěžejní parametry, které jsou u nervových vláken hodnoceny pomocí počítačové analýzy obrazu, a to buď manuálně, vyškoleným odborníkem, nebo pomocí automatizovaného softwaru. Pro použití s přístrojem HRT III je nyní dostupný program CCMetrics vyvinutý a ověřený pracovní skupinou v Manchesteru (Velká Británie) [8]. Alternativu nabízí program Neuron J (Erik Meijering, Sydney, Austrálie) umožňující manuální analýzu snímku [9]. Lze použít i jiné softwary pro analýzu obrazu upravené pro hodnocení nervových vláken rohovky [10–12]. S rozvojem moderních výpočetních technologií, zejména strojového učení, probíhá intenzivní vývoj dalších automatizovaných programů [13]. Hodnocenými parametry jsou obvykle hustota nervových vláken (corneal nerve fiber density; CNFD), hustota větvení (corneal nerve branch density; CNBD), celková délka vláken a jejich větví v zachycené oblasti (corneal nerve fiber length; CNFL) a tortuozita vláken (corneal nerve fiber tortuosity; CNFT). Byla prokázána korelace těchto parametrů s věkem a pohlavím jedince [11,14]. Díky spolupráci několika center využívajících shodné metody a postupy vznikla i multicentrická normativní databáze hodnot [15].
Neuropatie tenkých vláken
Neuropatie tenkých vláken (small fibre neuropathy; SFN) je definována jako strukturální abnormita tenkých nervových vláken s patologickou degenerací axonových terminál nervových vláken [16,17].
Mezi tenká nervová vlákna řadíme slabě myelinizovaná vlákna typu Ad a nemyelinizovaná vlákna typu C. Oba typy vláken vedou informaci o termické a algické percepci. Vlákna typu C jsou navíc součástí postgangliových autonomních nervů [18,19].
Mezi typické klinické příznaky SFN patří neuropatická bolest, pozitivní neuropatické příznaky charakteru dysestézií (pálení, mrazení, píchaní apod.) a z negativních příznaků se setkáváme nejčastěji se sníženou citlivostí na algické a termické podněty. Dané symptomy se iniciálně objevují nejčastěji na akrech a distálních částech dolních končetin s pozvolnou propagací rostrálně. Důsledkem poškození autonomního nervového systému mohou být poruchy vazomotoriky, sudomotoriky, dysfunkce kardiovaskulárního a gastrointestinálního systému, urosexuální dysfunkce atd. [20,21].
Celosvětově je nejčastější příčinou SFN porucha glukózového metabolizmu, tj. diabetes mellitus (DM) 1. i 2. typu a prediabetes (zvýšená lačná glykémie nebo vyšší glykémie po glykemické zátěži) [22,23]. V ČR jsou dalšími rizikovými faktory pro vznik SFN hypercholesterolémie a chronický abúzus etanolu [24]. V mnoha případech se příčinu SFN nepodaří objasnit. Idiopatická SFN se vyskytuje přibližně u 50 % pacientů [25]. Mezi další příčiny SFN patří např. hypotyreóza, urémie, lymeská borelióza, infekce HIV (human immunodeficiency virus), neurotoxické noxy (alkohol, chemoterapie, antiretrovirotika) a některá systémová autoimunitní, zánětlivá a geneticky podmíněná onemocnění [20]. Podle současných poznatků se navíc patologické postižení tenkých vláken (small fiber pathology; SFP) vyskytuje i u řady dalších neurologických onemocnění.
Vyšetření funkce tenkých nervových vláken
Neuropatie tenkých vláken je standardními elektrofyziologickými metodami, jako je elektromyografie (kondukční studie a jehlová elektromyografie), nedetekovatelná. Těmito v praxi běžně používanými metodami lze stanovit pouze poškození silných nervových vláken typu Ab.
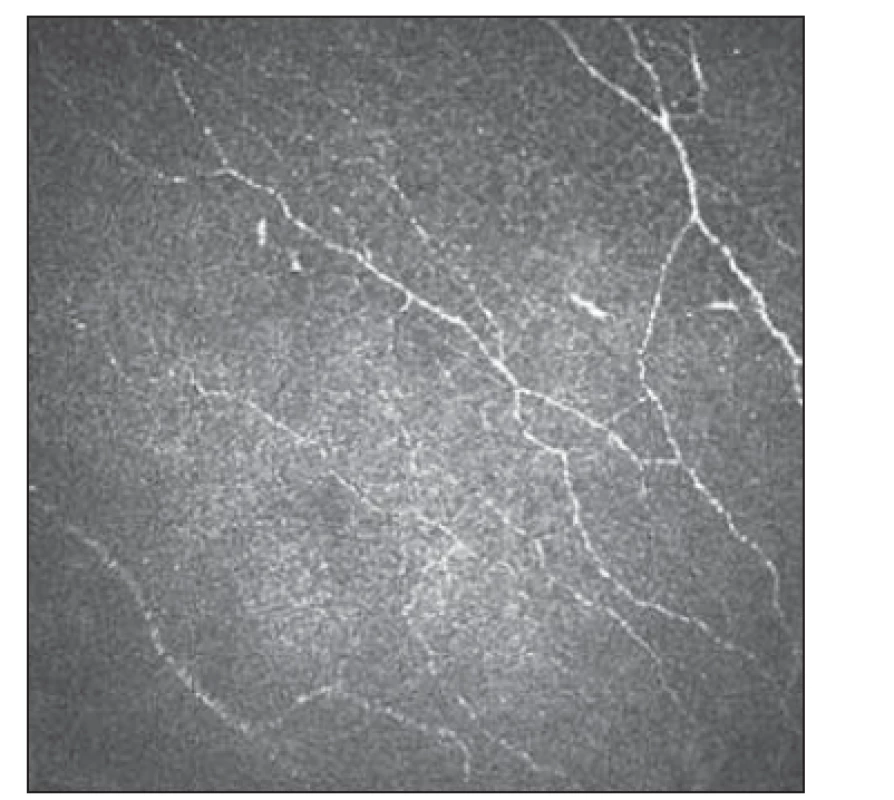
Základním vyšetřením funkce tenkých nervových vláken v rámci běžného neurologického vyšetření je orientační zhodnocení termoalgického čití pomocí speciálních pomůcek, jakými jsou Neurotips (ostré vs. tupé) a Tiptherm (chladný vs. teplejší podnět). Sudomotorické funkce je možné orientačně hodnotit použitím speciální náplasti aplikované na oblast plosky (např. Neuropad®, TRIGOcare International GmbH, Wiehl, Německo), které vyšetřují produkci potu na ploskách. Při hodnocení sudomotoriky vykazuje tato metoda dobrou senzitivitu i specificitu [26,27]. Kvantitativními diagnostickými metodami SFN je přístrojově asistované kvantitatitivní testování termického a termoalgického čití [28]. Ke kvantitativnímu zhodnocení potivosti plosek a dlaní lze využít vyšetření Sudoscanem (Impeto Medical, Paříž, Francie), které odráží funkci postgangliových sympatických vláken typu C [29]. Sofistikovanější elektrofyziologickou metodou reflektující funkci tenkých nervových vláken jsou evokované potenciály vyvolané kontaktním teplem [30]. Zlatým standardem průkazu SFN v současnosti nadále zůstává kožní biopsie se zhodnocením hustoty intraepidermálních tenkých vláken (intraepidermal nerve fiber density; IENFD). Jde však o vyšetření invazivní a vyžadující spolupráci se specializovaným histopatologickým týmem [23]. IVCM také nabízí morfologické hodnocení tenkých nervových vláken, navíc se jedná o vyšetření neinvazivní, které lze dle potřeby opakovat (obr. 3, 4).
Fig. 3. Subbasal plexus with fiber
reduction 1.
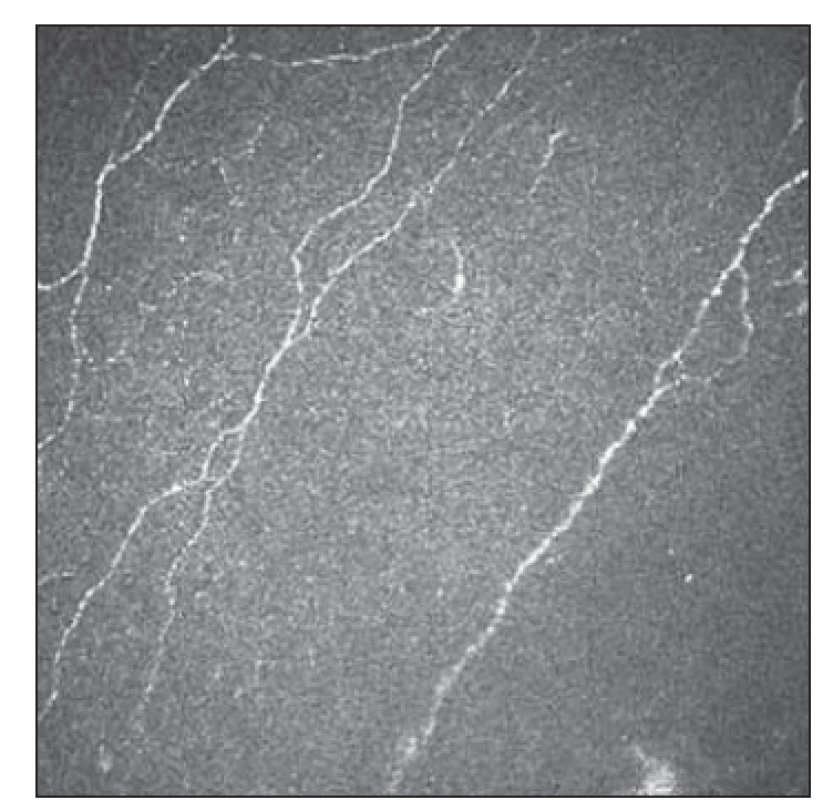
Fig. 4. Subbasal plexus with fiber
reduction 2.
Diabetická neuropatie
Dobrá senzitivita a specificita vyšetření stavu nervových vláken pomocí IVCM (zejména parametru CNFL) při identifikaci diabetické senzomotorické polyneuropatie byla opakovaně prokázána [10,11,31–34]. Pokles nervových vláken byl dále prokázán i u pacientů s poruchou glukózové tolerance, což potvrzuje předpoklad, že k poškození nervových vláken u diabetiků dochází velmi časně [35–37], a po zlepšení kompenzace byla popsána regenerace nervových vláken, což naznačuje využití IVCM i pro sledování efektu léčby [11,31,35,38]. Některé studie upozorňují také na přítomnost vyššího počtu Langerhansových buněk (Langerhans cells; LC) v oblasti subbazálního nervového plexu rohovky u pacientů s DM proti kontrolním skupinám, což podporuje představu o roli imunitního systému v etiopatogenezi diabetické neuropatie [39,40]. V současné době se pozornost zaměřuje na standardizaci metody a upřesnění stanovení prahových hodnot sledovaných parametrů indikujících poškození [15,41].
Neuropatie indukovaná protinádorovou chemoterapií
Chemoterapií indukovaná neurotoxicita je častým nežádoucím efektem některých chemoterapeutik. U pacientů bylo pozorováno snížení CNFD, CNFL i CNBD bez ohledu na klinické příznaky neuropatie [42]. Pokles hodnot CNFD koreloval s postupem onemocnění od prvních symptomů po zahájení terapie, CNBD a CNFL byly obecně asociovány s počtem metastatických uzlin. Po ukončení léčby bylo pozorováno zlepšení stavu nervových vláken, zvláště CNFL, což svědčí o schopnosti regenerace nervových vláken [43].
Neuropatie u infekce HIV
Neuropatie patří mezi komplikace samotné infekce HIV a dále je častým důsledkem léčby HIV antiretrovirovými preparáty. Pomocí IVCM byly u pacientů s klinicky rozpoznatelnými projevy neuropatie pozorovány pokles CNFD, CNFL a CNFB a zvýšená CNFT. Nebyl nalezen žádný vztah těchto parametrů k věku, době trvání terapie, době onemocnění, CD4 markerům ani k virové náloži. Ke konečnému zhodnocení vhodnosti využití IVCM k diagnostice a monitoringu neuropatie tenkých vláken v souvislosti s HIV jsou třeba ještě další studie [44].
Možné využití IVCM u dalších onemocnění projevujících se typicky příznaky SFN
Pokles hodnot sledovaných parametrů nervových vláken a korelace výsledků IVCM a klinického hodnocení stupně rozvoje onemocnění byla popsána také u řady dalších chorob, pro které je postižení tenkých nervových vláken charakteristické. Při hodnocení SFP u pacientů s diagnózou familiární (transthyretinové) amyloidové polyneuropatie pomocí IVCM byl prokázán vztah klinických projevů neuropatie a CNFL [45]. Bolestivá neuropatie se rovněž řadí mezi časté komplikace u sarkoidózy. U části pacientů byly pomocí IVCM prokázány změny ve stavu nervových vláken rohovky, výsledky však nebyly v souladu s výsledky vyšetření IENFD. Na základě této studie autoři usuzují o možnosti existence různých variant neuropatie [46]. Rovněž byla popsána asociace změn nervových vláken rohovky s hodnotami Mainz Severity Score Index u Fabryho choroby [47]. Výsledky studií zabývajících se chronickou zánětlivou demyelinizační polyneuropatií zůstávají prozatím nejednoznačné. Ačkoliv nebyla prokázána korelace změn rohovkových nervových vláken k délce onemocnění ani ke klinickým skórovacím škálám, byl v oblasti subbazálního nervového plexu u těchto pacientů prokázán významně vyšší počet LC [48–50]. V tomto případě jde však dominantně o jednotku s postižením silných vláken.
Neuropatie u fibromyalgie
Fibromyalgie (FM) je onemocnění projevující se chronickou generalizovanou bolestí a příznaky únavy, bolestí hlavy, poruchami kognitivních funkcí a spánku. Diagnóza se opírá o přítomnost chronické bolesti bez jasné příčiny nejméně po dobu 3 měsíců [51]. Patofyziologie onemocnění zůstává nejasná, ovšem nedávné studie upozornily na častý výskyt SFP u pacientů s FM. Byla prokázána korelace výsledků IENFD a IVCM [52]. Přítomnost SFP jako typického příznaku onemocnění FM však zůstává kontroverzní. Prevalence SFP u pacientů s FM je na základě nedávné metaanalýzy odhadována na 49 %. Prevalence odhadovaná na základě výsledků IVCM byla vyšší než prevalence odhadovaná na základě kožní biopsie (59 vs. 45 %), což naznačuje, že IVCM může být citlivější metodou [53]. To může naznačovat, že do budoucna nové poznatky povedou k rozdělení FM na více klinických jednotek. Použití IVCM tak může pomoci při diagnostice, hodnocení SFP i vztahu rozvoje SFN v závislosti na době trvání nemoci.
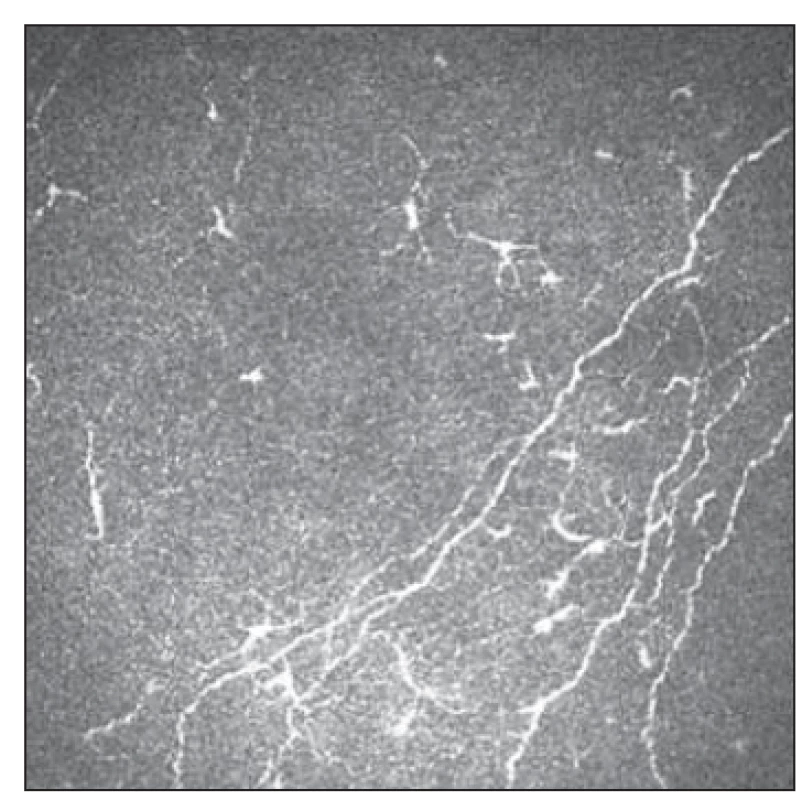
Pomocí IVCM byl též hodnocen výskyt LC v oblasti subepiteliálního plexu rohovky a jeho možná asociace se SFP u FM [54]. V obraze IVCM můžeme rozlišovat dva typy LC – klidové (okrouhlá hyperreflexní ložiska) a aktivované (hyperreflexní ložiska s dendritickými výběžky) (obr. 5, 6). U pacientek s FM byl prokázán pokles denzity aktivovaných LC oproti kontrolní skupině. Rozdíl celkového počtu LC oproti kontrolní skupině nebyl statisticky významný. Výsledky umožňují spekulovat o roli poklesu jejich aktivity na neurotrofiku a rozvoj SFP [54].
Fig. 5. Small fiber pathology with Langerhans
cell activity 1.
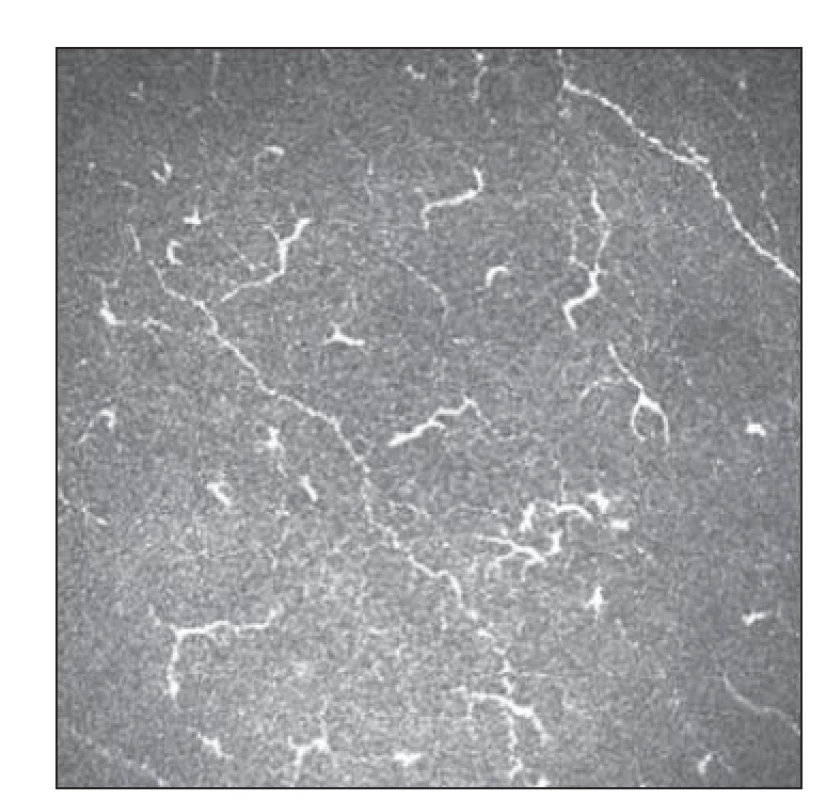
Fig. 6. Small fiber pathology with Langerhans
cell activity 2.
Parkinsonova choroba
Parkinsonova choroba je progresivní neurodegenerativní onemocnění charakterizované především motorickými příznaky. V současnosti je však již dobře zdokumentováno i non-motorické postižení a častý výskyt periferní neuropatie [51,55]. Dosud není jasné, zda postižení periferních nervových vláken vzniká jako součást neurodegenerativní patologie Parkinsonovy choroby nebo jako nežádoucí účinek léčby levodopou [51,56]. Některé studie sledovaly přítomnost poškození tenkých nervových vláken pomocí IVCM a IENFD a prokázaly pokles CNFD a CNFL, souvislost změn pozorovaných pomocí IVCM a IENFD však nebyla jednoznačná. Zajímavým zjištěním bylo stranově asymetrické postižení, které bylo v souladu s asymetrií klinických projevů onemocnění. Podobný charakter změn nervových vláken na IVCM dosud nebyl u jiné nemoci asociované se SFN pozorován [51,57–59]. Výsledky vyšetření pomocí IVCM oproti IENFD lépe korelovaly s klinickými autonomními symptomy a parasympatickou dysfunkcí. Hodnoty IENFD se zdály být spíše závislé na době onemocnění a kumulativní dávce léčby levodopou. Tyto výsledky pozorované zmíněnými metodami dle autorů naznačují různou etiopatogenezi neuropatologie [41]. V současnosti probíhá studie Nadace Michaela J. Foxe pro výzkum Parkinsonovy choroby, která se zaměřuje na progresi poškození nervů subbazálního plexu rohovky v průběhu onemocnění. Pokud se prokáže závislost stavu nervových vláken rohovky a progrese celkových příznaků onemocnění, bylo by možné IVCM používat k hodnocení výsledků klinických studií zaměřených na vývoj nové terapie Parkinsonovy choroby [60].
Roztroušená skleróza
Několik studií se zabývalo možnými změnami nervových vláken rohovky u pacientů s RS. Byl prokázán pokles hodnot CNFD, CNFL a CNBD u těchto pacientů ve srovnání s kontrolní skupinou zdravých jedinců. Na rozdíl od hodnot tloušťky nervových vláken sítnice měřených pomocí optické koherenční tomografie nebyly hodnoty nervových parametrů měřených pomocí IVCM závislé na výskytu epizod optické neuritidy ani subtypů RS relaps-remitentní (relapsing-remitting) či sekundárně progresivní (secondary progressive). Rovněž nebyly hodnoty parametrů nervových vláken rohovky závislé na věku, době trvání choroby či stadiu choroby. Byl však prokázán vztah mezi hodnotou disability vyjádřené pomocí Expanded Disability Status Scale (EDSS) a hodnotou CNBD. Nálezy naznačují, že změny nervových vláken rohovky u pacientů s RS mohou sloužit jako časný biomarker pro detekci neuroaxonálního postižení [61,62].
Demence
Ve snaze najít snadno testovatelný časný biomarker rozvoje Alzheimerovy choroby je v současnosti výrazná pozornost upřena na tkáně oka. Použití IVCM bylo navrhováno vzhledem k sílícím důkazům o tom, že nervová vlákna rohovky mohou dobře reflektovat postupující centrální i periferní neurodegeneraci [63,64]. Byl prokázán statisticky významný pokles CFNL, CNFD i CNBD u skupiny pacientů s mírnou kognitivní poruchou a pacientů s demencí v porovnání s kontrolní skupinou zdravých osob. Ke zhodnocení schopnosti rozlišit mezi jednotlivými etiologiemi demence a také prognostického významu výsledků je nezbytné doplnit studie na rozsáhlejších souborech pacientů [64].
Cévní mozková příhoda
Změny nervových vláken subbazálního plexu rohovky byly studovány také u pacientů s CMP. Ve skupinách pacientů s CMP s DM i bez DM byl oproti kontrolní skupině zdravých jedinců pozorován významný pokles CNFD, CNFL a CNBD [65,66]. U pacientů s recidivující CMP bylo postižení nervových vláken rohovky dále významně prohloubeno. Vedle toho byla u pacientů s CMP prokázána i snížená denzita endotelových buněk [66]. Význam těchto výsledků pro případné využití k predikci rizika a prevenci CMP však zůstává nejasný [67].
Možné využití IVCM u dalších onemocnění
Výskyt SFP byl pomocí IVCM popsán i u onemocnění, pro které postižení tenkých nervových vláken není považováno za typické. Příkladem může být Friedreichova ataxie [68]. Významný pokles hodnot CNFD a CNFL naznačuje subklinické postižení tenkých nervových vláken také u amyotrofické laterální sklerózy [69]. U nemoci Charcot-Marie-Tooth 1A byl v porovnání s kontrolní skupinou patrný pokles hodnot ve všech hodnocených parametrech nervových vláken [70]. U Behçetovy choroby byly popsány pokles CNFD a CNFL a zvýšení hustoty LC [71].
Závěr
Konfokální mikroskopie rohovky je rychlá a především neinvazivní metoda umožňující zobrazení stavu nervových vláken subbazálního nervového plexu rohovky. Publikované studie naznačují její možné využití pro konfirmaci a další sledování postižení tenkých nervových vláken u periferních neuropatií, což může přispět při diagnostice těchto chorob. Vedle toho může tato metoda přispět i k průkazu neurodegenerativních změn u některých dalších neurologických onemocnění. V některých případech však může jít pouze o nespecifické změny, a proto je praktický význam u jednotlivých jednotek ještě nutné ověřit na rozsáhlejších souborech pacientů. Dalším limitujícím faktorem využití této metody je její zatím omezená dostupnost (v současnosti používaná ve FN Brno a FN Motol). Její neinvazivní charakter a relativně jednoduchá metodika však dává předpoklady pro její budoucí širší využití nejen ve vědecké, ale i klinické praxi.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
MUDr. Josef Štorm
Oční klinika dětí a dospělých
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha
e-mail: josef.storm@fnmotol.cz
Přijato k recenzi: 20. 3. 2021
Přijato do tisku: 28. 6. 2021
Zdroje
1. Oliveira-Soto L, Efron N. Morphology of corneal nerves using confocal microscopy. Cornea 2001; 20 (4): 374–384. doi: 10.1097/00003226-200105000-00008.
2. Shaheen BS, Bakir M, Jain S. Corneal nerves in health and disease. Surv Ophthalmol 2014; 59 (3): 263–285. doi: 10.1016/j.survophthal.2013.09.002.
3. Patel DV, McGhee CN. Mapping of the normal human corneal sub-Basal nerve plexus by in vivo laser scanning confocal microscopy. Invest Ophthalmol Vis Sci 2005; 46 (12): 4485–4488. doi: 10.1167/iovs.05-0794.
4. Cruzat A, Qazi Y, Hamrah P. In vivo confocal microscopy of corneal nerves in health and disease. Ocul Surf 2017; 15 (1): 15–47. doi: 10.1016/j.jtos.2016.09.004.
5. Mahelková G, Česká Burdová M, Odehnal M et al. In vivo corneal confocal microscopy: basic principles and applications [in Czech]. Cesk Slov Oftalmol 2017; 73 (4): 155–160.
6. Petroll WM, Robertson DM. In vivo confocal microscopy of the cornea: new developments in image acquisition, reconstruction, and analysis using the HRT-Rostock Corneal Module. Ocul Surf 2015; 13 (3): 187–203. doi: 10.1016/j.jtos.2015.05.002.
7. Zhivov A, Stachs O, Stave J et al. In vivo three-dimensional confocal laser scanning microscopy of corneal surface and epithelium. Br J Ophthalmol 2009; 93 (5): 667–672. doi: 10.1136/bjo.2008.137430.
8. Petropoulos IN, Alam U, Fadavi H et al. Rapid automated diagnosis of diabetic peripheral neuropathy with in vivo corneal confocal microscopy automated detection of diabetic neuropathy. Invest Ophthalmol Vis Sci 2014; 55 (4): 2071–2078. doi: 10.1167/iovs.13-13787.
9. Dehghani C, Pritchard N, Edwards K et al. Fully automated, semiautomated, and manual morphometric analysis of corneal subbasal nerve plexus in individuals with and without diabetes. Cornea 2014; 33 (7): 696–6702. doi: 10.1097/ico.0000000000000152.
10. Česká Burdová M, Kulich M, Dotřelová D et al. Effect of diabetes mellitus type 1 diagnosis on the corneal cell densities and nerve fibers [in Czech]. Physiol Res 2018; 67 (6): 963–974. doi: 10.33549/physiolres.933899.
11. Česká Burdová M, Lainová Vrabcová T, Dotřelová D et al. Possibilities of in vivo corneal confocal microscopy of corneal nerves in diabetes [in Czech]. Cesk Slov Oftalmol 2017; 73 (4): 161–167.
12. Mahelková G, Burdová MC, Malá Š et al. Higher total insulin dose has positive effect on corneal nerve fibers in DM1 patients [in Czech]. Invest Ophthalmol Vis Sci 2018; 59 (10): 3800–3807. doi: 10.1167/iovs.18-24265.
13. Williams BM, Borroni D, Liu R et al. An artificial intelligence-based deep learning algorithm for the diagnosis of diabetic neuropathy using corneal confocal microscopy: a development and validation study. Diabetologia 2020; 63 (2): 419–430. doi: 10.1007/s00125-019-05023-4.
14. Niederer RL, Perumal D, Sherwin T et al. Age-related differences in the normal human cornea: a laser scanning in vivo confocal microscopy study. Br J Ophthalmol 2007; 91 (9): 1165–1169. doi: 10.1136/bjo.2006.112656.
15. Tavakoli M, Ferdousi M, Petropoulos IN et al. Normative values for corneal nerve morphology assessed using corneal confocal microscopy: a multinational normative data set. Diabetes Care 2015; 38 (5): 838–843. doi: 10.2337/dc14-2311.
16. Hoeijmakers JG, Faber CG, Lauria G et al. Small-fibre neuropathies – advances in diagnosis, pathophysiology and management. Nat Rev Neurol 2012; 8 (7): 369–379. doi: 10.1038/nrneurol.2012.97.
17. Hovaguimian A, Gibbons CH. Diagnosis and treatment of pain in small-fiber neuropathy. Curr Pain and Headache Rep 2011; 15 (3): 193–200. doi: 10.1007/s11916-011-0181-7.
18. Vlckova-Moravcova E, Bednarik J, Belobradkova J et al. Small-fibre involvement in diabetic patients with neuropathic foot pain. Diabet Med 2008; 25 (6): 692–699. doi: 10.1111/j.1464-5491.2008.02446.x.
19. Ambler Z, Bednařík J, Růžička E a kol. Klinická neurologie část obecná. Praha: Triton 2008.
20. Terkelsen AJ, Karlsson P, Lauria G et al. The diagnostic challenge of small fibre neuropathy: clinical presentations, evaluations, and causes. Lancet Neurol 2017; 16 (11): 934–944. doi: 10.1016/s1474-4422 (17) 30329-0.
21. Ambler Z, Bednařík J, Keller O. Doporučený postup pro praktické lékaře Česká lékařská společnost Jana Evangelisty Purkyně. [online]. Polyneuropatie 2002. Dostupné z URL: https: //www.cls.cz/seznam-doporucenych-postupu.
22. Sumner CJ, Sheth S, Griffin JW et al. The spectrum of neuropathy in diabetes and impaired glucose tolerance. Neurology 2003; 60 (1): 108–111. doi: 10.1212/wnl.60.1.108.
23. Devigili G, Tugnoli V, Penza P et al. The diagnostic criteria for small fibre neuropathy: from symptoms to neuropathology. Brain 2008; 131 (7): 1912–1925. doi: 10.1093/brain/awn093.
24. Bednarik J, Vlckova-Moravcova E, Bursova S et al. Etiology of small-fiber neuropathy. J Peripher Nerv Syst 2009; 14 (3): 177–183. doi: 10.1111/j.1529-8027.2009.00229.x.
25. Themistocleous AC, Ramirez JD, Serra J et al. The clinical approach to small fibre neuropathy and painful channelopathy. Pract Neurol 2014; 14 (6): 368–379. doi: 10.1136/practneurol-2013-000758.
26. Lacigová S, Rušavý Z, Jirkovská A et al. Doporučený postup diagnostiky a léčby diabetické neuropatie. Diabetologie, metabolismus, endokrinologie, výživa 2016; 19 (2): 57–63.
27. Ponirakis G, Fadavi H, Petropoulos IN et al. Automated quantification of neuropad improves its diagnostic ability in patients with diabetic neuropathy. J Diabetes Res 2015; 2015: 847854. doi: 10.1155/2015/847854.
28. Potočková V, Malá Š, Tomek A et al. Význam testování termických prahů v detekci neuropatie tenkých vláken u diabetiků 1. typu. Cesk Slov Neurol N 2016; 79 (6): 692–697.
29. Smith AG, Lessard M, Reyna S et al. The diagnostic utility of Sudoscan for distal symmetric peripheral neuropathy. J Diabetes Complications 2014; 28 (4): 511–516. doi: 10.1016/j.jdiacomp.2014.02.013.
30. Raputová J, Vlčková E, Kočica J et al. Evokované potenciály vyvolané kontaktním teplem – vliv fyziologických proměnných. Cesk Slov Neurol N 2019; 82 (1): 76–83. doi: 10.14735/amcsnn201976.
31. Perkins BA, Lovblom LE, Bril V et al. Corneal confocal microscopy for identification of diabetic sensorimotor polyneuropathy: a pooled multinational consortium study. Diabetologia 2018; 61 (8): 1856–1861. doi: 10.1007/s00125-018-4653-8.
32. Ahmed A, Bril V, Orszag A et al. Detection of diabetic sensorimotor polyneuropathy by corneal confocal microscopy in type 1 diabetes: a concurrent validity study. Diabetes Care 2012; 35 (4): 821–828. doi: 10.2337/dc11-1396.
33. Hertz P, Bril V, Orszag A et al. Reproducibility of in vivo corneal confocal microscopy as a novel screening test for early diabetic sensorimotor polyneuropathy. Diabet Med 2011; 28 (10): 1253–1260. doi: 10.1111/j.1464-5491.2011.03299.x.
34. Kovaľová I, Horáková M, Vlčková E et al. Hodnocení rohovkové inervace pomocí konfokální mikroskopie. Cesk Slov Neurol N 2017; 80 (1): 49–57. doi: 10.14735/amcsnn201749.
35. Azmi S, Jeziorska M, Ferdousi M et al. Early nerve fibre regeneration in individuals with type 1 diabetes after simultaneous pancreas and kidney transplantation. Diabetologia 2019; 62 (8): 1478–1487. doi: 10.1007/s00125-019-4897-y.
36. Tavakoli M, Quattrini C, Abbott C et al. Corneal confocal microscopy: a novel noninvasive test to diagnose and stratify the severity of human diabetic neuropathy. Diabetes Care 2010; 33 (8): 1792–1797. doi: 10.2337/dc10-0253.
37. Asghar O, Petropoulos IN, Alam U et al. Corneal confocal microscopy detects neuropathy in subjects with impaired glucose tolerance. Diabetes Care 2014; 37 (9): 2643–2646. doi: 10.2337/dc14-0279.
38. Mehra S, Tavakoli M, Kallinikos PA et al. Corneal confocal microscopy detects early nerve regeneration after pancreas transplantation in patients with type 1 diabetes. Diabetes Care 2007; 30 (10): 2608–2612. doi: 10.2337/dc07-0870.
39. Tavakoli M, Boulton AJ, Efron N et al. Increased Langerhan cell density and corneal nerve damage in diabetic patients: role of immune mechanisms in human diabetic neuropathy. Cont Lens Anterior Eye 2011; 34 (1): 7–11. doi: 10.1016/j.clae.2010.08.007.
40. Ferdousi M, Romanchuk K, Mah JK et al. Early corneal nerve fibre damage and increased Langerhans cell density in children with type 1 diabetes mellitus. Sci Rep 2019; 9 (1): 1–6. doi: 10.1038/s41598-019-45 116-z.
41. Schaldemose EL, Hammer RE, Ferdousi M et al. An unbiased stereological method for corneal confocal microscopy in patients with diabetic polyneuropathy. Sci Rep 2020; 10 (1): 12550. doi: 10.1038/s41598-020-69314-2.
42. Argyriou AA, Kyritsis AP, Makatsoris T et al. Chemotherapy-induced peripheral neuropathy in adults: a comprehensive update of the literature. Cancer Manag Res 2014; 6: 135–147. doi: 10.2147/CMAR.S44261.
43. Ferdousi M, Azmi S, Petropoulos IN et al. Corneal confocal microscopy detects small fibre neuropathy in patients with upper gastrointestinal cancer and nerve regeneration in chemotherapy induced peripheral neuropathy. PLoS One 2015; 10 (10): e0139394. doi: 10.1371/journal.pone.0139394.
44. Kemp HI, Petropoulos IN, Rice ASC et al. Use of corneal confocal microscopy to evaluate small nerve fibers in patients with human immunodeficiency virus. JAMA Ophthalmol 2017; 135 (7): 795–800. doi: 10.1001/jamaophthalmol.2017.1703.
45. Rousseau A, Cauquil C, Dupas B et al. Potential role of in vivo confocal microscopy for imaging corneal nerves in transthyretin familial amyloid polyneuropathy. JAMA Ophthalmol 2016; 134 (9): 983–989. doi: 10.1001/jamaophthalmol.2016.1889.
46. Oudejans L, Niesters M, Brines M et al. Quantification of small fiber pathology in patients with sarcoidosis and chronic pain using cornea confocal microscopy and skin biopsies. J Pain Res 2017; 10: 2057–2065. doi: 10.2147/jpr.s142683.
47. Bitirgen G, Turkmen K, Malik RA et al. Corneal confocal microscopy detects corneal nerve damage and increased dendritic cells in Fabry disease. Sci Rep 2018; 8 (1): 12244. doi: 10.1038/s41598-018-30688-z.
48. Pitarokoili K, Sturm D, Labedi A et al. Neuroimaging markers of clinical progression in chronic inflammatory demyelinating polyradiculoneuropathy. Ther Adv Neurol Disord 2019; 12: 175628641985548. doi: 10.1177/1756286419855485.
49. Stettner M, Hinrichs L, Guthoff R et al. Corneal confocal microscopy in chronic inflammatory demyelinating polyneuropathy. Ann Clin Transl Neurol 2015; 3 (2): 88–100. doi: 10.1002/acn3.275.
50. Schneider C, Bucher F, Cursiefen C et al. Corneal confocal microscopy detects small fiber damage in chronic inflammatory demyelinating polyneuropathy (CIDP). J Peripher Nerv Syst 2014; 19 (4): 322–327. doi: 10.1111/jns.12098.
51. Ghasemi M, Rajabally YA. Small fiber neuropathy in unexpected clinical settings: a review. Muscle Nerve 2020; 62 (2): 167–175. doi: 10.1002/mus.26808.
52. Evdokimov D, Frank J, Klitsch A et al. Reduction of skin innervation is associated with a severe fibromyalgia phenotype. Ann Neurol 2019; 86 (4): 504–516. doi: 10.1002/ana.25565.
53. Grayston R, Czanner G, Elhadd K et al. A systematic review and meta-analysis of the prevalence of small fiber pathology in fibromyalgia: implications for a new paradigm in fibromyalgia etiopathogenesis. Semin Arthritis Rheum 2019; 48 (5): 933–940. doi: 10.1016/j.semarthrit.2018.08.003.
54. Klitsch A, Evdokimov D, Frank J et al. Reduced association between dendritic cells and corneal sub-basal nerve fibers in patients with fibromyalgia syndrome. J Peripher Nerv Syst 2020; 25 (1): 9–18. doi: 10.1111/jns.12360.
55. Chaudhuri KR, Healy DG, Schapira AH et al. Non-motor symptoms of Parkinson‘s disease: diagnosis and management. Lancet Neurol 2006; 5 (3): 235–245. doi: 10.1016/S1474-4422 (06) 70373-8.
56. Lin CH, Chao CC, Wu SW et al. Pathophysiology of small-fiber sensory system in Parkinson‘s disease: skin innervation and contact heat evoked potential. Medicine (Baltimore) 2016; 95 (10): e3058. doi: 10.1097/MD.00 00000000003058.
57. Kass-Iliyya L, Javed S, Gosal D et al. Small fiber neuropathy in Parkinson‘s disease: a clinical, pathological and corneal confocal microscopy study. Parkinsonism Relat Disord 2015; 21 (12): 1454–1460. doi: 10.1016/j.parkreldis.2015.10.019.
58. Podgorny PJ, Suchowersky O, Romanchuk KG et al. Evidence for small fiber neuropathy in early Parkinson‘s disease. Parkinsonism Relat Disord 2016; 28: 94–99. doi: 10.1016/j.parkreldis.2016.04.033.
59. Nolano M, Provitera V, Manganelli F et al. Loss of cutaneous large and small fibers in naive and l-dopa-treated PD patients. Neurology 2017; 89 (8): 776–784. doi: 10.1212/WNL.0000000000004274.
60. Corneal confocal microscopy: a novel imaging biomarker for Parkinson‘s disease. [online]. Michael J. Fox foundation for Parkinson’s research. Dostupné z URL: https: //www.michaeljfox.org/grant/corneal-confocal-microscopy-novel-imaging-biomarker-parkinsons-disease.
61. Petropoulos IN, Kamran S, Li Y et al. Corneal confocal microscopy: an imaging endpoint for axonal degeneration in multiple sclerosis. Invest Opthalmol Vis Sci 2017; 58 (9): 3677–3681. doi: 10.1167/iovs.17-22050.
62. Bitirgen G, Akpinar Z, Malik RA et al. Use of corneal confocal microscopy to detect corneal nerve loss and increased dendritic cells in patients with multiple sclerosis. JAMA Ophthalmol 2017; 135 (7): 777–782. doi: 10.1001/jamaophthalmol.2017.1590.
63. Dehghani C, Frost S, Jayasena R et al. Ocular biomarkers of Alzheimer‘s disease: the role of anterior eye and potential future directions. Invest Opthalmol Vis Sci 2018; 59 (8): 3554–3563. doi: 10.1167/iovs.18-24694.
64. Ponirakis G, Hamad HA, Sankaranarayanan A et al. Association of corneal nerve fiber measures with cognitive function in dementia. Ann Clin Transl Neurol 2019; 6 (4): 689–697. doi: 10.1002/acn3.746.
65. Khan A, Akhtar N, Kamran S et al. Corneal confocal microscopy detects corneal nerve damage in patients admitted with acute ischemic stroke. Stroke 2017; 48 (11): 3012–3018. doi: 10.1161/strokeaha.117.018289.
66. Khan A, Kamran S, Akhtar N et al. Corneal confocal microscopy detects a reduction in corneal endothelial cells and nerve fibres in patients with acute ischemic stroke. Sci Rep 2018; 8 (1): 17333. doi: 10.1038/s41598-018-35298-3.
67. Kamran S, Khan A, Salam A et al. Cornea: A window to white matter changes in stroke; corneal confocal microscopy a surrogate marker for the presence and severity of white matter hyperintensities in ischemic stroke. J Stroke Cerebrovasc Dis 2020; 29 (3): 104543. doi: 10.1016/j.jstrokecerebrovasdis.2019.104543.
68. Pagovich OE, Vo ML, Zhao ZZ et al. Corneal confocal microscopy: neurologic disease biomarker in Friedreich ataxia. Ann Neurol 2018; 84 (6): 893–904. doi: 10.1002/ana.25355.
69. Ferrari G, Grisan E, Scarpa F et al. Corneal confocal microscopy reveals trigeminal small sensory fiber neuropathy in amyotrophic lateral sclerosis. Front Aging Neurosci 2014; 6: 278. doi: 10.3389/fnagi.2014.00278.
70. Tavakoli M, Marshall A, Banka S et al. Corneal confocal microscopy detects small-fiber neuropathy in Charcot-Marie-Tooth disease type 1A patients. Muscle Nerve 2012; 46 (5): 698–704. doi: 10.1002/mus.23377.
71. Bitirgen G, Kayitmazbatir ET, Satirtav G et al. In vivo confocal microscopic evaluation of corneal nerve fibers and dendritic cells in patients with Behçet’s disease. Front Neurol 2018; 9: 204. doi: 10.3389/fneur.2018.00204.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2021 Číslo 4
Nejčtenější v tomto čísle
- Poruchy čichu po COVID-19 – diagnostika, význam a léčba
- Proč se dráhy kříží? Základní principy uspořádání mozku obratlovců
- CANVAS – nově identifikovaná genetická příčina ataxie s pozdním nástupem. Popis prvních diagnostikovaných pacientů v České republice
- COVID-19 asociovaná myelitida – kazuistika vzácné komplikace závažné SARS-CoV-2 infekce
