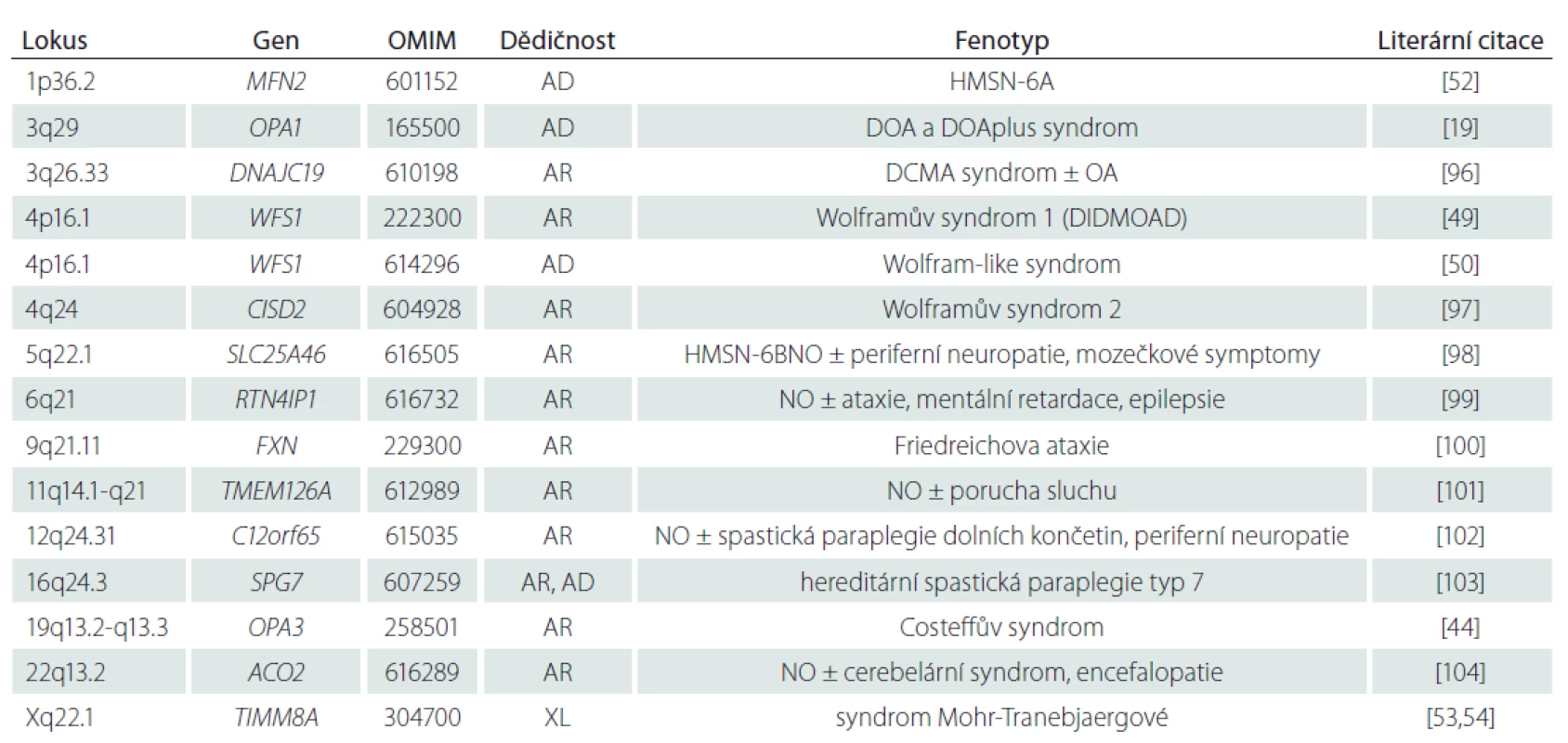
Dominantní (Kjerova) atrofie optiku asociovaná s mutacemi v OPA1 genu
Dominant (Kjer’s) optic atrophy associated with mutations in OPA1 gene
Dominant optic atrophy (DOA) is an autosomal dominant disorder manifesting by slowly progressive painless bilateral visual acuity loss with variable degree of severity. DOA is caused by mutations in nuclear DNA encoding proteins associated with the inner mitochondrial membrane. Most individuals with DOA harbour a disease-causing mutation in the OPA1 gene; however, other genes and loci associated with DOA have also been identified. First symptoms usually manifest in the first two decades of life. The disease mechanism lies in neurodegenerative damage of retinal ganglion cells leading to optic nerve atrophy. Decrease of visual acuity is associated with colour vision alterations and central or paracentral visual field defects. On fundoscopic examination, optic head nerve pallor can be noticed, occasionally with excavation. Extraocular symptoms are present in some patients, causing so-called DOA plus syndrome. Bilateral sensorineural hearing loss, is the most common one; chronic progressive external ophthalmoplegia, myopathy, peripheral neuropathy, multiple sclerosis-like disorder, and spastic paraplegia of lower limbs are rare. Currently, there is no effective treatment available that would prevent the development of visual impairment. Genetic diagnostics and follow-up of patients with DOA are held in the Centre for Patients with Mitochondrial Optic Neuropathies, General University Hospital in Prague. The aim of this review is to increase awareness of the most common genetically determined optic neuropathy.
Keywords:
dominant optic atrophy – Leber‘s hereditary optic neuropathy – optic neuropathy/atrophy – Mitochondrial diseases
Autoři:
S. Kelifová 1; T. Honzík 1; M. Tesařová 1; B. Kousal 2; P. Lišková 1,2; P. Havránková 3; H. Kolářová 1
Působiště autorů:
Klinika dětského a dorostového lékařství 1. LF UK a VFN v Praze
1; Oční klinika 1. LF UK a VFN v Praze
2; Neurologická klinika 1. LF UK a VFN v Praze
3
Vyšlo v časopise:
Cesk Slov Neurol N 2020; 83(1): 33-42
Kategorie:
Přehledný referát
doi:
https://doi.org/10.14735/amcsnn202033
Souhrn
Dominantní atrofie optiku (dominant optic atrophy; DOA) je autozomálně dominantně děděné onemocnění manifestující se pomalou a nebolestivou bilaterální ztrátou zrakové ostrosti s různým stupněm závažnosti. DOA je podmíněna mutacemi v genech jaderné DNA kódující proteiny asociované s vnitřní membránou mitochondrií. Ve většině popsaných případů DOA se jedná o mutaci v OPA1 genu, jsou ale známy i další geny a lokusy podmiňující DOA. K manifestaci onemocnění obvykle dochází v prvních dvou dekádách života. Onemocnění se rozvíjí na podkladě neurodegenerativního postižení gangliových buněk sítnice vedoucího k atrofii zrakového nervu. Snížení zrakové ostrosti je doprovázeno poruchou barvocitu a centrálními nebo paracentrálními defekty v zorném poli. Při vyšetření očního pozadí lze pozorovat bledý terč zrakového nervu, případně i jeho exkavaci. U části pacientů jsou popisovány extraokulární příznaky, tzv. DOA plus syndrom. Nejčastěji se jedná o bilaterální senzorineurální poruchu sluchu; vzácněji je přítomna i chronická progresivní zevní oftalmoplegie, myopatie, periferní neuropatie, onemocnění podobné RS nebo spastická paraplegie dolních končetin. V současnosti není známa účinná terapie, která by zabránila rozvoji zrakového postižení. V Centru pro pacienty s mitochondriálními neuropatiemi optiku při VFN v Praze probíhá genetická diagnostika a dispenzarizace jedinců s DOA. Cílem přehledného článku je zvýšit povědomí o této nejčastější geneticky podmíněné neuropatii optiku.
Klíčová slova:
dominantní optická atrofie – Leberova hereditární neuropatie optiku – neuropatie/atrofie optiku – mitochondriální onemocnění
Úvod
Dominantní atrofie optiku (dominant optic atrophy; DOA; OMIM #165500) je autozomálně dominantně děděné neurodegenerativní onemocnění vedoucí k pomalu progredující ztrátě zrakové ostrosti s charakteristickým začátkem v první dekádě života [1]. Klinické příznaky tohoto onemocnění byly poprvé popsány již na konci 19. století [2,3]. Až v roce 1959, kdy dánský oftalmolog Poul Kjer publikoval fenotyp 19 rodin s DOA a odlišil toto onemocnění od Leberovy hereditární neuropatie optiku (Leber´s Hereditary Optic Neuropathy; LHON), bylo onemocnění uznáno jako samostatná klinická jednotka a alternativně je dodnes označováno jako Kjerova atrofie optiku [4]. V roce 1972 Damien P. Smith formuloval hlavní klinické znaky onemocnění: autozomálně dominantní dědičnost, nástup příznaků mezi 4. a 8. rokem života, mírný až střední pokles zrakové ostrosti (0,4 – 0,1). Mezi další příznaky zařadil i temporální nablednutí papil zrakového nervu, centrální či centrocekální skotomy a poruchu barvocitu – konkrétně tritanopii [5]. Postupně, díky objasnění molekulárně genetické příčiny onemocnění a novým kohortovým studiím, se pohled na klinické projevy tohoto onemocnění změnil. Nové poznatky odlišující se od Smithovy původní definice budou uvedeny dále.
Kromě poruchy zraku je DOA v části případů sdružována se senzorineurální poruchou sluchu a dalšími neurologickými symptomy (ataxie, polyneuropatie, myopatie, chronická progresivní zevní oftalmoplegie [chronic progressive external ophthalmoplegia; CPEO]). Pro tuto komplikovanou formu je používán termín „DOA plus“ syndrom [6].
Dominantní atrofie optiku je geneticky heterogenní onemocnění způsobené mutacemi v genech jaderné DNA kódující proteiny asociované s vnitřní membránou mitochondrií. Nejčastěji se jedná o mutace v OPA1 genu (OMIM 605290) nacházející se na chromozomu 3 [7 – 9]. Protein OPA1 je mitochondriální dynaminu podobná GTPáza, jež se podílí na biogenezi a na udržování membránové integrity mitochondrií. Jsou ale známy i další geny a lokusy, jež podmiňují nejen DOA, ale i klinickým průběhem velmi podobné autozomálně recesivně či gonozomálně děděné jednotky, které byly historicky pod tento termín zahrnuty. Podrobný výčet těchto vzácněji se vyskytujících onemocnění není předmětem této publikace a bude krátce shrnut v závěru.
Dominantní atrofie optiku představuje nejčastější formu hereditární neuropatie zrakového nervu. Obecně je její prevalence udávána 1 : 12 000 až 1 : 25 000; údaje se liší dle studované populace [10,11]. V roce 2013 byla publikována data epidemiologické studie ze severní Anglie, v níž byla prevalence DOA stanovena na 1 : 25 000 a prevalence nosičství OPA1 mutace na 1 : 34 000 [11]. Pro srovnání – nejnižší stanovená prevalence manifestní LHON, druhé nejčastěji se vyskytující hereditární neuropatie optiku, je dle studie ze stejné oblasti 1 : 31 000 [12]. Vyšší prevalence DOA na podkladě efektu zakladatele je popisována v Dánsku (1 : 12 000) [10,13].
Přesné epidemiologické údaje o DOA v ČR nejsou známy. Vzhledem k výše uvedeným poznatkům z jiných evropských zemí se však jistě jedná o onemocnění poddiagnostikované. Při předpokládané prevalenci 1 : 25 000 by se v ČR jednalo o minimálně 400 pacientů, v našem sledování je však nyní jen několik desítek jedinců s diagnostikovaným či předpokládaným onemocněním.
Cílem práce je přehledně shrnout známé poznatky o DOA, jejím klinickém průběhu a doprovodných symptomech, které mohou být nápomocny v diferenciálně diagnostickém postupu u pacientů s atrofií optiku. Závěrem se zmiňujeme o nových terapeutických i experimentálních možnostech.
Klinický obraz
Pro onemocnění je charakteristická postupná, pomalu progredující bilaterální ztráta zrakové ostrosti, ke které dochází na podkladě degenerace retinálních gangliových buněk (retinal ganglion cells; RGC) [1]. Penetrance onemocnění se liší dle dostupných prací. V menší studii publikované v roce 2001 byla u dvou diagnostikovaných rodin penetrance rozvoje atrofie optiku stanovena na 43 a 62 % [14]. Ve větší australské studii zahrnující 11 rodin s DOA byla potvrzena mutace u 157 jedinců a známky onemocnění byly přítomny u 82,5 % z nich [15].
Tíže onemocnění je velmi variabilní; zraková ostrost se může pohybovat od normální (≥ 0,8 v decimálních hodnotách) u jedinců diagnostikovaných pouze na podkladě pozitivní rodinné anamnézy až k praktické slepotě v plně rozvinutých případech. Průměrná zraková ostrost symptomatických pacientů s OPA1 mutací byla v souboru 45 pacientů 0,097 [16]. Rozdíly zrakové ostrosti jsou patrné jak inter-, tak intrafamiliárně [17 – 19]. Tyto fenotypové rozdíly lze demonstrovat na výsledcích Alminda et al z roku 2012, kteří publikovali široké rozmezí výsledné zrakové ostrosti u dvou mutací – c.983A>G (NM 130837.2) přítomné u 35 jedinců (10 rodin) s klinickou manifestací ve věku od 3 do 62 let s rozsahem zrakové ostrosti 0,03 – 1,0 a c.2708_2711del identifikované u 21 členů (11 rodin), kde se vznik obtíží pohyboval v rozmezí od 3 do 48 let (průměr 13 let, medián 8 let) a zraková ostrost rovněž mezi 0,03 – 1,0 [20].
Vzhledem k velmi pozvolnému zhoršování zraku si ne všichni pacienti zpětně uvědomují vznik prvních příznaků. Dříve byla DOA považována za onemocnění, jež postihuje jedince výlučně již v časném dětském věku (4 – 8 let), a tato skutečnost byla zahrnuta i do diagnostických kritérií [5]. Z novějších studií nicméně vyplývá, že se onemocnění může manifestovat jak v dřívějším, tak i v pozdějším věku [21]. Většina souhrnných prací se shoduje, že první příznaky vznikají obvykle před 20. rokem života. Studie ze severní Anglie uvádí u 40 pacientů průměrný věk vzniku obtíží 7 let s věkovým rozpětím 1 – 16 let. V této práci bylo 80 % jedinců symptomatických před dosažením 10. roku života, horší prognózu měli pacienti s missense mutacemi [16]. Jsou ale publikovány i výsledky dalších studií, ve kterých byla pouze necelá polovina jedinců diagnostikována před 20. rokem života. V italské kohortě nositelů OPA1 mutací byl průměrný věk v době vzniku obtíží 12,5 roku. Dle závěru byla téměř polovina z 52 pacientů diagnostikována před 20. rokem života [22], obdobně tak ve finském souboru 14 rodin se 31 jedinci s manifestním onemocněním byla diagnóza stanovena u poloviny pacientů před 20. rokem [23].
Dlouhodobá prognóza onemocnění je variabilní, progrese je popisována u 50 – 67 % pacientů [16,19,23], průměrný pokles zrakové ostrosti byl v anglické studii o 1,6 písmene na ETDRS (Early Treatment Diabetic Retinopathy Study) optotypech [16], zraková ostrost horší než 0,05 – 0,1 byla přítomna u 13 – 36 % jedinců [15,19,23].
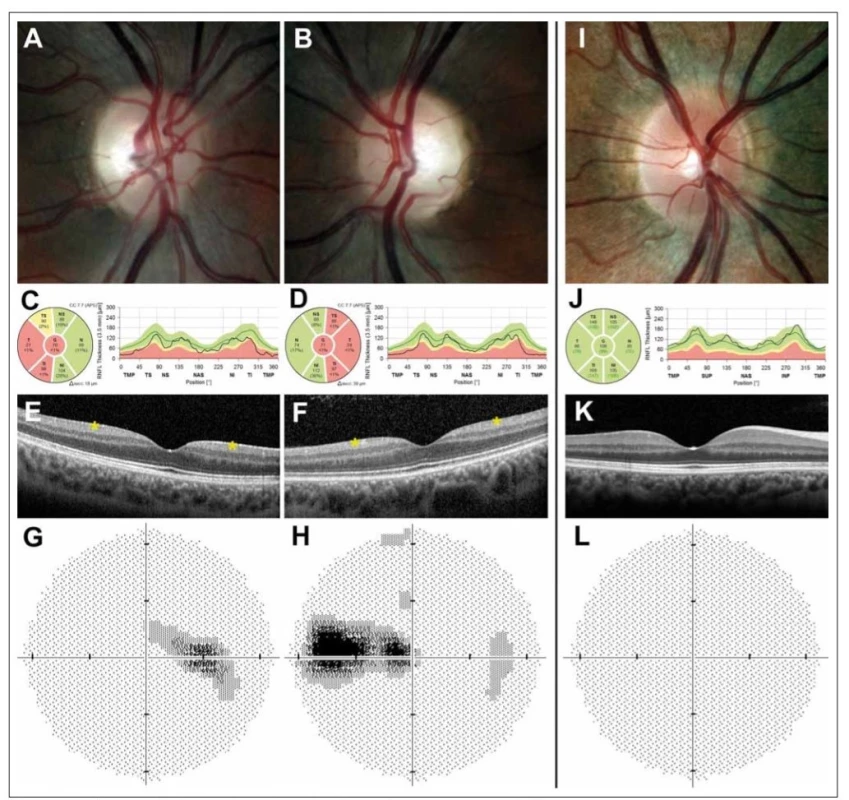
Při vyšetření fundu je patrný bilaterálně symetrický přesně konturovaný bledý terč, event. i mělce miskovitě vyhloubený (tzv. atrofická exkavace) (obr. 1A, B). Predominatně dochází k postižení v temporálním kvadrantu, u části pacientů lze ale pozorovat atrofii ve všech kvadrantech [22,24]. Při vyšetření optickou koherenční tomografií (OCT) Barboni et al popisují jako první patologické změny u pacientů s DOA sníženou vrstvu gangliových buněk v makule jevící se jako perifoveální snížení tlouštky komplexu vrstvy gangliových buněk a vnitřní plexiformní vrstvy, což následně vede i k zeslabení tloušťky vrstvy retinálních nervových vláken (retinal nerve fibre layer; RNFL) s predominantním poškozením papilomakulárního svazku (obr. 1C – F). U mírných případů dochází pouze k významné ztrátě makulárních RGC a RNFL se může pohybovat v pásmu normálních hodnot [25,26]. Postižení zrakového nervu se klinicky a při vyšetření zrakového pole projevuje typicky caekocentrálními, méně často centrálními a paracentrálními skotomy při zachovaném periferním vidění (obr. 1G, H).
Barevná fotografi e papily zrakového nervu pravého (A) a levého (B) oka s bledým temporálním kvadrantem u 29letého muže s manifestací
onemocnění v 18 letech. Měření tloušťky vrstvy nervových vláken peripapilárně dokládá redukci tloušťky vrstvy nervových vláken v temporální
polovině (žluté a červené pásmo) pravého (C) a levého (D) oka. Vymizení vrstvy gangliových buněk sítnice (označeno hvězdičkou) v perifoveální
oblasti pravého (E) a levého (F) oka na horizontálním skenu z optické koherenční tomografi e se spektrální doménou. Zorné pole s caekocentrálním
skotomem pravého (G) a levého (H) oka. Pravé oko zdravého kontrolního jedince pro srovnání (I–L).
Fig. 1. Ocular fi ndings in a patient with dominant optic atrophy caused by mutation in the OPA1 gene.
Colour fundus photographs showing the right (A) and (B) left optic disc of a 29-year-old male with disease onset at the age of 18 years; note
the pale appearance in the temporal quadrant. Retinal nerve fi bre layer measurements showing reduction in thickness (yellow and red band)
in the right (C) and left (D) eye and retinal ganglion cell layer loss (marked with an asterisk) in the perifoveal area of the right (E) and left (F) eye
on a horizontal scan obtained by spectral domain optical coherence tomography. Corresponding centrocaekal scotomas in the right (G) and
left (H) eye. Right eye of a healthy control individual for comparison (I–L).
Přibližně polovina pacientů s manifestní DOA má klinicky vyjádřeno poruchu barvocitu [22,23]. Tritanopie (spektrum modrá/ žlutá), která byla dříve považována za typický projev DOA [5], se dle recentních studií vyskytuje v souborech méně často v porovnání se smíšenou poruchou barvocitu (spektrum červená/ zelená/ modrá), vyskytující se u 55 – 72 % pacientů, zatímco tritanopie je přítomna pouze u 16 – 28 % [23,24].
Zornicové reakce nejsou narušeny ani u nejtěžších případů DOA. Je to podmíněno zachováním melanopsin-exprimujících RGC tvořících asi 1 % všech RGC. Tyto buňky nejen reprezentují první neuron dráhy pupilárního reflexu, ale nejspíše komunikují i s hlavním cirkadiánním pacemakerem v suprachiazmatickém jádru hypotalamu, jež prostřednictvím sekrece melatoninu ovlivňuje sekundární regulační centra, která jsou cirkadiánními rytmy ovlivněna [27]. Vyšetření 4 pacientů s DOA potvrdilo zachované uvolňování melatoninu v závislosti na změně osvětlení [28,29].
Zrakové evokované potenciály (visual evoked potentials; VEP) jsou dle tíže postižení prodloužené či nevýbavné. Elektroretinografie na strukturované podněty (pattern ERG; PERG) vykazuje abnormální poměr vln N95:P50 se sníženou amplitudou vlny N95, jež naznačuje narušení vrstvy RGC. Tyto nálezy jsou nespecifické, ale mohou být pomocným ukazatelem při nejednoznačných výsledcích ostatních diagnostických metod [30].
Magnetická rezonance mozku obvykle bývá normální. Při pokročilejším onemocnění mohou být patrny známky bilaterální atrofie optiku. Její provedení je důležité zejména k vyloučení komplikací či jiné etiologie klinických obtíží (viz níže). Příklady typického nálezu ve srovnání s normou jsou uvedeny na obr 1. Jedná se o oční nálezy pacienta s potvrzenou již publikovanou c. 869G>A mutací p.(Agr290Gln) (NM 15560) [8,31].
Extraokulární projevy DOA
U části pacientů s DOA se kromě neuropatie optického nervu vyskytují i další přidružené příznaky, jež podmiňují tzv. DOA plus syndrom. Ve velké multicentrické studii zahrnující 104 pacienty ze 45 rodin s DOA na podkladě OPA1 mutace byla extraokulární neurologická manifestace popsána až ve 20 %. Obdobně jako u zrakové ostrosti i tyto příznaky podléhaly významné intrafamiliární variabilitě [32]. Ve třetině studovaných rodin byli jak jedinci mající pouze oční postižení, tak jedinci s extraokulárními příznaky, i přes nosičství stejné mutace v genu pro OPA1 a předpokládaného sdíleného prostředí, a tím i možných okolních vlivů.
Nejčastěji se vyskytujícím extraokulárním projevem je senzorineurální porucha sluchu, jež postihuje přes 60 % pacientů s DOA plus syndromem [32]. Vzhledem k tomu, že při vyšetření dochází k narušení pouze kmenových sluchových evokovaných potenciálů (brain stem auditory evoked potentials; BAEP), ale otoakustické emise bývají zachovány, předpokládá se, že sluchový nerv je buď poškozen pouze ve své terminální nemyelinizované části, nebo je alterováno spirální ganglion. V souladu s touto teorií dochází k významnému zlepšení sluchových funkcí při použití kochleárních implantátů [33,34]. K manifestaci poruchy sluchu nejčastěji dochází ve 2. – 3. dekádě života (medián 14 let) [35]. Sluchové postižení je obvykle oboustranné s variabilní tíží ztráty sluchu od mírné až střední nedoslýchavosti (ztráta 60 dB) u 67 % pacientů (14/ 21) až po velmi těžkou ztrátu sluchu (> 90 dB) u 19 % jedinců (4/ 21) [35]. Oční postižení obvykle předchází poruchu sluchu, nicméně byly zaznamenány i izolované případy s diagnózou sluchového postižení stanovenou ve stejnou dobu jako porucha zraku, případně před ní. Nejčastěji je postižení sluchu spjato s OPA1 c.1334G>A (p.Arg445His; NM 15560) mutací, jež se vyskytuje u třetiny až poloviny případů [32,35].
Dalšími extraokulárními příznaky, které se mohou rozvinout u DOA, jsou CPEO, která byla přítomna ve studovaném souboru Yu-Wai-Mana et al u 46 % pacientů, myopatie (36 %), ataxie (30 %), či periferní neuropatie (30 %). Tyto příznaky se zpravidla přidávají od 3. dekády věku, CPEO se manifestuje obvykle později, ve 4. dekádě věku (obr. 2) [32]. Mezi méně časté neurologické projevy patří spastická paraplegie dolních končetin [32,36].
Fig. 2. Evolution of the main symptoms of dominant optic atrophy plus syndrome [32].
![Vývoj hlavních symptomů dominantní atrofi e optiku plus syndromu [32].<br>
Fig. 2. Evolution of the main symptoms of dominant optic atrophy plus syndrome [32].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/5cf7ed6b21cb21e18437c043c8ae0fb3.png)
V souboru 40 pacientů s DOA plus syndromem byl u 12 (30 %) popsán abnormální nález na MR mozku, u dvou z nich byly přítomny léze prakticky neodlišitelné od obrazu RS s pozitivitou oligoklonálních pásů v mozkomíšním moku [32,37]. V roce 2015 byla publikována jiná studie zabývající se zobrazením mozku pacientů s OPA1 mutacemi, kdy u 12 z 22 (55 %) byl přítomen abnormální nález na MR, 23 % pacientů mělo cerebelární atrofii především postihující vermis, dále byly přítomny i nespecifické léze v bílé hmotě a kortikální atrofie. Změny na MR mozku byly častější u starších pacientů, s horším a progredujícím zrakovým postižením a u pacientů s postižením sluchu [38].
Pacienti s manifestujícími se extraokulárními příznaky měli v souboru statisticky horší prognózu stran míry postižení zraku (zraková ostrost 0,086) v porovnání s pacienty pouze s izolovaným postižením zraku (zraková ostrost 0,14). Naopak velmi vzácně se u jedinců s DOA plus symptomy porucha zraku nevyskytuje (dle metaanalýzy Yu-Wai-Mana et al byla prevalence očního postižení 95,6 % [87/ 91 pacientů]) [32].
Diagnostika
V rámci diferencicální diagnostiky DOA mohou být obzvláště významné některé anamnestické údaje. Nejdůležitějšími jsou počátek v dětství, pomalá progrese a vícegenerační postižení svědčící pro dominantní dědičnost.
Oční vyšetření by mělo zahrnovat stanovení zrakové ostrosti a kontrastní citlivosti, vyšetření barvocitu a zorného pole, biomikroskopii fundu a OCT se spektrální doménou. Vhodné je doplnění VEP. Při podezření na DOA plus syndrom je nutné provést i BAEP, audiometrii, neurologické vyšetření a MR mozku.
Dále je indikováno genetické vyšetření, a to sekvenace OPA1 genu, ev. OPA3 genu. V případě nejednoznačného klinického nálezu při negativní rodinné anamnéze se v rámci diferenciální diagnostiky doplňuje vyšetření tří nejčastějších mutací asociovaných s LHON, ev. dostupná molekulárně genetická vyšetření možných jiných syndromů v rámci panelů genů, jejichž mutace způsobují dědičné poruchy zraku. Při diagnostických rozpacích přistupujeme v rámci výzkumných účelů k celoexomovému či celogenomovému sekvenování.
Studiem svalové tkáně získané jak od DOA plus pacientů, tak od jedinců pouze se zrakovým postižením byla u obou skupin histochemicky prokázána COX-deficitní svalová vlákna, u DOA plus syndromu byl ale nález významnější. U většiny pacientů z obou klinických skupin byla ve svalové tkáni prokázána delece mitochondriální DNA (mtDNA) [32]. U pacientů se suspektním DOA plus syndromem je možné doplnit svalovou biopsii.
Diferenciální diagnostika
Diferenciální diagnostika neuropatií optiku je široká. Patří sem geneticky podmíněné i získané příčiny vedoucí k poškození zrakového nervu.
Byly identifikovány další geny, o nichž je známo, že vzácněji podmiňují jak autozomálně dominantní, tak autozomálně recesivní a X-vázanou dědičnost atrofie optiku a mohou být doprovázeny extraokulární symptomatikou. Příčinou DOA může být např. mutace v genu pro OPA3, kde bývají klinicky kromě neuropatie optiku přítomny také presenilně vzniklá katarakta nebo extraokulární příznaky, jako např. senzorineurální porucha sluchu a neurologické příznaky [39,40].
Časnou manifestací atrofie optiku asociovanou se spinocerebelární degenerací vedoucí k cerebelární ataxii, pyramidovým jevům, periferní neuropatii, spasticitě a opožděnému psychomotorickému vývoji je charakterizován Behrův syndrom [41]. Jedná se o geneticky heterogenní soubor příznaků, u kterého je popsána jak autozomálně recesivní, tak dominantní dědičnost [42,43]. Původně byl tento syndrom spojován především s autozomálně recesivní mutací v genu pro OPA3 podmiňující 3-metylglutakonovou acidurii typ 3 (Costeffův syndrom) [44,45]. Nově však byly u tohoto syndromu potvrzeny i mutace v genu pro OPA1, dominantně i recesivně děděné [46 – 48]. U Behrova syndromu byl u dvou nepříbuzných dětí v roce 2017 poprvé popsán i tzv. Leigh-like syndrom, na MR mozku byly nalezeny progresivní cerebelární atrofie, hyperintenzity v bazálních gangliích a patologické akumulace laktátu, geneticky byl přítomen nález složené heterozygotní a homozygotní mutace v genu pro OPA1 [43].
Významnou jednotkou v rámci diferenciální diagnostiky je pro svou incidenci a klinický obraz především LHON, podmíněná mutacemi v mtDNA, pro kterou je charakteristická bilaterální nebolestivá rychlá ztráta zraku typicky postihující častěji muže ve 2. a 3. dekádě života. DOA společně s LHON představují nejčastější mitochondriální onemocnění vedoucí k atrofii optického nervu.
Vzácněji může být atrofie optiku symptomem i v rámci jiných mitochondriálních onemocnění s komplexním fenotypem, které tímto lze zařadit i do diferenciální diagnostiky DOA plus syndromu. Jedná se např. o Wolframův syndrom, autozomálně recesivní onemocnění manifestující se diabetem insipidem, diabetem mellitem, atrofií optiku a hluchotou [49]. Další klinickou jednotkou, která může být v diferenciální diagnostice zvažována, je autozomálně dominantní Wolframův syndrom, mezi jehož symptomy patří kongenitální progredující porucha sluchu, atrofie optiku a porucha glukózové tolerance [50,51], dále hereditární motoricko-senzorická neuropatie typu 6 způsobená mutacemi v mitofusinu 2 (MFN2), jež vede k periferní neuropatii a atrofii optiku [52]. Pomalu progredující ztráta zrakové ostrosti je přítomna společně s poruchou sluchu a pomalu progredující dystonií a demencí u syndromu Mohr-Tranebjaergové, X-vázaného onemocnění patřícího svým klinickým obrazem také do diferenciálně diagnostické rozvahy [53,54]. Neuropatie optiku je někdy popisována i u geneticky heterogenního Leighova syndromu [55], syndromu myoklonické epilepsie s červenými vlákny (myoclonic epilepsy with ragged red fibres; MERRF) [56] či Friedreichovy ataxie [57]. V tab. 1 jsou uvedena mitochondriální onemocnění, u nichž je neuropatie optiku jedním z dominantních klinických příznaků, a která proto představují hlavní diferenciálně diagnostické jednotky DOA.
Mezi získané příčiny patří neuropatie optiku vznikající např. na podkladě zánětlivé etiologie (neuritida optiku u roztroušené sklerózy, neuromyelitida optického nervu, neurosarkoidóza), vaskulárního onemocnění, komprese zrakového nervu či toxické a nutriční příčiny [58,59].
Patofyziologie DOA
Nejčastější příčinou DOA jsou mutace v OPA1 genu [8,9], jež dle literatury podmiňují okolo 65 % případů [15,16,60]. OPA1 je nukleární gen, kánonický transkript 1 kodující izoformu 1 (NM 015560.2) je složen z 29 exonů (dle databáze Lovd). OPA1 protein, který je tímto genem kódován, je dynaminu podobná GTPáza, jež se nachází v mitochondriálním intermembranózním prostoru, kde je ukotvena k vnitřní mitochondriální membráně (VMM) [61]. Ve tkáních se vyskytuje ubikvitně, ale největší zastoupení má v retině, mozku, testes, srdci a kosterním svalstvu [8].
OPA1 proteinu byla zprvu připisována pouze schopnost fúze (splynutí) VMM [62]. V dnešní době je však známo, že jeho funkce jsou komplexnějšího rázu (tab. 2). Úzce spolupracuje s dalšími dynaminu podobnými GTPázami umožňujícími jak fúzi vnější membrány mitochondrií (mitofuziny MFN1, MFN2) [63], tak její štěpení (DRP1 a DNM2) [64]. Dynamická rovnováha mitochondriální sítě je zásadní z hlediska adaptace buňky na aktuální energetickou potřebu. Další funkcí OPA1 proteinu je udržování struktury mitochondriálních krist [65] a stability mtDNA, pravděpodobně prostřednictvím jejího kotvení k VMM [66]. Tím umožňuje kompartmentalizaci cytochromu ca dalších proapoptotických faktorů a podílí se tak na řízení apoptózy [65]. Mezi další popsané funkce proteinu OPA1 v mitochondriích patří sestavování superkomplexů respiračního řetězce, udržování Ca2+ a redoxní homeostázy a je i důležitou součástí kontrolního systému mitochondriální kvality [67].

OPA1 se vyskytuje v osmi izoformách značených čísly 1 – 8, které vznikají alternativním štěpením exonů 4, 4b a 5 (obr. 3). Vzniklé proteiny jsou tvořeny z 924 – 1014 aminokyselin. Sestávají se z N-terminální oblasti, kde je lokalizována sekvence, jež cílí protein do mitochondrie (mitochondria-targeting sequence; MTS), dále následuje transmembránová doména kotvící protein k VMM, a coiled-coil domény. Následující část je tvořena dynaminovou oblastí – GTPázová doména, prostřední doménou a C-terminální oblastí obsahující GTPázovou efektorovovou doménu (GED) (obr. 4) [68].
Fig. 3. Schematic representation of 8 possible transcripts arising from alternative
OPA1 gene splicing [9].
![Schématické znázornění 8 možných OPA1 transkriptů vznikajících alternativním
sestřihem [9].<br>
Fig. 3. Schematic representation of 8 possible transcripts arising from alternative
OPA1 gene splicing [9].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/7a5c61c02df95d00fd36a495f09b28c5.png)
GED – GTPázová efektorová doména; MTS – sekvence, jež cílí protein do mitochondrie
Fig. 4. Structure of the OPA1 gene. Exons are numbered [9].
GED – GTPase eff ector domain; MTS – mitochondria-targeting sequence
![Struktura OPA1 genu. Exony očíslované [9].<br>
GED – GTPázová efektorová doména; MTS – sekvence, jež cílí protein do mitochondrie<br>
Fig. 4. Structure of the OPA1 gene. Exons are numbered [9].<br>
GED – GTPase eff ector domain; MTS – mitochondria-targeting sequence](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image_pdf/47960b7916133aae465900018b9332a6.png)
Exprese jednotlivých izoforem je velmi variabilní v různých tkáních. Předpokládá se, že fyziologicky dochází v jednotlivých buňkách k expresi osmi izoforem v různém poměru, které určují specifickou funkci konkrétní buňky [61]. Studie buněčných modelů, v nichž byly variabilně exprimovány jednotlivé izoformy, ukazují, že všechny mají schopnost zachovat integritu mtDNA i strukturu mitochondriálních krist [69]. Navíc se některé izoformy specificky uplatňují ve fúzi mitochondrií a udržení membránového potenciálu [61].
Zatím bylo popsáno více než 400 patogenních mutací v OPA1 genu (dle databáze Lovd). Přibližně polovina má za následek tzv. haploinsuficienci, tzn. snížené množství proteinu v buňce, které je způsobeno stavem, kdy přepsaný alternativní transkript je v průběhu kontrolních procesů v buňce rozpoznán jako nefunkční a je následně v buňce degradován prostřednictvím tzv. nonsense zprostředkované degradace [16,22,31]. U missense mutací se předpokládá dominantně negativní mechanizmus vedoucí k těžšímu fenotypovému projevu a extraokulárním příznakům u DOA plus syndromů [32,70].
Dle studie Yu-Wai-Mana et al je 2 – 3× vyšší riziko rozvoje DOA plus u jedinců s missense mutací a mutací lokalizovaných v GTPázové oblasti a 4× nižší riziko u OPA1 mutací ve střední dynaminové doméně [32].
Mutace v genu vedou k narušení fyziologických funkcí OPA1 proteinu. Dochází k fragmentaci mitochondriální sítě, která má za následek nestabilitu dýchacího řetězce a nadprodukci reaktivních forem kyslíku (reactive oxygen species; ROS). Oba tyto procesy vedou ke snížené tvorbě adenozintrifosfátu (ATP) a neregulovanému uvolňovaní proapoptototického cytochromu c do cytosolu buňky [62]. Ve fibroblastech nesoucích OPA1 mutaci byla popsána dysfunkce komplexu I a IV mající za následek narušenou tvorbu ATP [71,72]. Dále dochází k nestabilitě mtDNA a nahromadění mtDNA delecí [73], vzácněji k depleci mtDNA [74].
Není jasné, proč preferenčně dochází k porušení RGC, když je OPA1 gen exprimován ve všech lidských buňkách. Jedná se nejspíše o kombinaci anatomických, fyziologických a genetických faktorů, jež zvyšují jejich vulnerabilitu. Přesto v tuto chvíli nejsou známy konkrétní rizikové či naopak protektivní faktory prostředí, jež by měly vliv na penetranci onemocnění [75].
Post mortem histologické vyšetření jedinců s manifestní DOA prokázalo degeneraci RGC a následující atrofii vláken optického nervu [76]. Obdobně jako u LHON jsou u DOA preferenčně postiženy parvocelulární RGC malého kalibru v papilomakulárním svazku, u kterých se předpokládá, že mohou mít menší rezervy mitochondriální energie v porovnání s magnocelulárními RGC, jež se nachází v jiných oblastech retiny [77,78]. Dále se předpokládá, že v menších RGC dochází v poměru k větší produkci ROS než k jejich detoxifikaci v porovnání s většími RGC [79]. Axony retinálních buněk ve svém průběhu procházejí lamina cribrosa, distálněji jsou axonální vlákna myelinizovaná, proximálně jsou však nemyelinizovaná s vysokým obsahem mitochondrií a sodíkových kanálů. Na patogenezi se může podílet i fototoxicita světla dopadajícího na sítnici [80].
Jiné geny, jejichž mutace jsou vzácněji spjaty s neuropatií optiku, vedou také k narušení správné mitochondriální funkce v buňce. OPA3 gen podmiňuje OPA3 protein, jehož funkce není stále příliš jasná. Zdá se, že hraje roli ve stabilitě mitochondriální sítě [81,82]. Byla popsána missense mutace v genu pro MFN2, která vedla k DOA plus syndromu, přičemž ve fibroblastech pacientů byly zjištěny snížená exprese MFN2, deficit dýchacího řetězce, fragmentace mitochondriální sítě a opožděná reparace mtDNA po oxidativním stresu. Tito pacienti také měli ve svalové biopsii přítomny mtDNA delece [83].
Terapie
Terapeutické možnosti DOA jsou v současné době velmi omezené, ale vzhledem k pomalé progresi zrakového postižení vedoucího ke ztrátě zraku jen u části pacientů, má onemocnění lepší prognózu než např. LHON. Péče o pacienty se zrakovým postižením zůstává stále symptomatická. Dlouhodobá multidisciplinární péče je však nezbytná především z důvodu eventuální terapie poruchy sluchu pomocí kochleárních implantátů nebo operačního řešení u pacientů s doprovodnou ptózou víček. Časná diagnostika extraokulárních symptomů zabrání zbytečnému dalšímu pátrání po etiologii příznaků.
Vzhledem k narušené aktivitě komplexu I a zvýšené tvorbě ROS se stejně jako u LHON zkoušejí látky, které umožňují přesun elektronů dýchacího řetězce, čímž se obchází nefunkční komplex I. V současnosti se nabízí využití nové generace analogů koenzymu Q10, resp. ubiquinonu – idebenon a EPI-743. Malé studie s idebenonem a EPI-743 u pacientů s LHON přinesly první výsledky a zdůraznily nutnost časné diagnostiky [84,85]. Podávání idebenonu sedmi pacientům s OPA1 mutací vedlo v pilotní klinické studii pouze k mírnému zlepšení zrakových funkcí u pěti z nich; studie navíc nebyla zaslepená podáváním placeba [86]. Obdobně i kontrolovaná studie na DOA myších z roku 2016 prokázala pouze minimální pozitivní efekt idebenonu. Zajímavostí je jeho škodlivý efekt na RGC kontrolní skupiny divokého typu (wild-type) [87]. Komplexní úloha OPA1 proteinu v mitochondriálních funkcích může vysvětlovat, proč podávání idebenonu pacientům s DOA má variabilní výsledky na rozdíl od LHON [88]. K odpovídajícímu vyhodnocení efektivity idebenonu u DOA je nutné provedení dlouhodobé a zaslepené studie na velké skupině pacientů.
Protože je DOA monogenní onemocnění, je vhodným kandidátem pro genovou terapii, která by cíleně vedla k expresi wild-type alely [67,89]. Povzbudivé jsou výsledky probíhajících klinických studií u pacientů s LHON, kterým je intravitreálně jednorázově aplikována injekce adeno-asociovaného viru 2 (AAV2) nesoucího gen pro MT-ND4 podjednotku komplexu 1 [90,91]. Vzhledem k nukleární lokalizaci genu navíc odpadá nutnost složité úpravy genu k jeho nasměrování do místa působení v mitochondrii. Výše uvedená existence několika různých izoforem však může naopak představovat komplikaci této terapie. Proto je podstatné zaměřit se v dalších studiích na stanovení profilu exprimovaných izoforem ve wild-type a mutantních lidských RGC tak, aby se našla optimální izoforma, která by zajistila správnou hladinu OPA1 proteinu s perspektivou individualizované terapie [67]. Jako slibná možnost genové terapie se u DOA zdá být především izoforma 1. Mírná nadprodukce této izoformy chránila a vedla u myšího modelu k úpravě dynamiky mitochondriální sítě, ultrastruktury krist a organizaci komplexů a superkomplexů mitochondriálního respiračního řetězce [92]. Autoři Sarzi et al v roce 2018 publikovali výsledky první studie genové terapie na myším modelu s c.2708_2711del (NM 015560) Opa1 mutací. Intravitreální aplikace AAV2 vektoru nesoucího komplementární DNA kódující izoformu 1 zabránila degeneraci RGC. Skotopická prahová odpověď byla stejná jako u zdravých kontrol, nicméně byl přítomen patologický nález na VEP, což by mohlo naznačovat, že terapie nemusí být dostatečná k udržení převodu signálu dále po zrakové dráze [93].
Nedílnou součástí péče je genetická konzultace ostatních rodinných příslušníků. Prenatální a preimplantační diagnostika v rodině je možná [94].
Česká kohorta pacientů
Vzhledem k nutnosti centralizované péče vzniklo při VFN v Praze a 1. LF UK v Praze Centrum pro pacienty s mitochondriálními neuropatiemi optiku. Jedná se o specializované pracoviště při klinice dětského a dorostového lékařství, jež díky spolupráci s Oční klinikou umožňuje diagnostiku, komplexní péči a dispenzarizaci nejen pacientů, ale i zdravých rodinných příslušníků a přenašečů onemocnění. V centru jsou vedeni kromě pacientů s LHON právě i jedinci s DOA.
V době vydání této práce byla diagnóza DOA molekulárně geneticky potvrzena u 35 jedinců z 19 rodin, bez preference pohlaví. Klinické údaje byly dostupné u 25 pacientů z 14 rodin. Počátek příznaků byl u 18 z 25 pacientů (72 %) před 20. rokem, přičemž před 6. rokem to bylo u 7/ 25 (28 %). Zraková ostrost horší než 0,1 na lepším oku byla přítomna u 7 pacientů z 25 (28 %). Průměrná zraková ostrost všech očí v souboru byla 0,22 (rozsah 1,0 – 0,02). U 7 pacientů ze 4 rodin se onemocnění manifestuje i plus symptomatologií (porucha sluchu, ptóza víček, CPEO, periferní neuropatie a myopatie). V roce 2013 naše skupina popsala a publikovala novou missense mutaci v OPA1 genu, jež se projevovala závažným DOA plus syndromem s neuropatií optiku, ztrátou sluchu, ptózou víček, CPEO, polyneuropatií a ataxií [95].
Závěr
Dominantní atrofie optiku je geneticky podmíněné onemocnění, na které by se mělo pomýšlet v rámci diferenciální diagnostiky u jedinců s neuropatií optiku, variabilně s přidruženými dalšími symptomy, jako jsou porucha sluchu, ptóza víček, CPEO, ataxie či periferní neuropatie. Zvláštní pozornost pak budí anamnesticky plíživý nástup obtíží, obvykle od dětství, a pozitivní rodinná anamnéza. Diagnostický proces a další sledování pacientů by mělo být multidisciplinární, zahrnující nejenom podrobné zhodnocení očního nálezu a stanovení molekulárně genetické příčiny, ale nutné je i vyšetření neurologické a foniatrické. Nedílnou součástí by také mělo být aktivní vyhledávání přenašečů v rodině a jejich důsledná dispenzarizace, neboť v posledních letech probíhají studie zabývající se možnostmi terapeutického ovlivnění, které se zdá být nejefektivnější v časných fázích onemocnění před rozvojem ireverzibilní atrofie optického nervu.
Grantová podpora
Práce byla podpořena grantem AZV 16-32341A.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Přijato k recenzi: 4. 11. 2019
Přijato do tisku: 26. 11. 2019
MUDr. Hana Kolářová, Ph.D.
Klinika dětského a dorostového lékařství
1. LF UK a VFN v Praze
Ke Karlovu 2
128 08 Praha
e-mail: hana.kolarova@vfn.cz
Zdroje
1. Lenaers G, Hamel C, Delettre C et al. Dominant optic atrophy. Orphanet J Rare Dis 2012; 7 : 46. doi: 10.1186/ 1750-1172-7-46.
2. Batten B. A family suffering from hereditary optic atrophy. Trans Ophthalmol Soc UK 1896; 16 : 125.
3. Snell S. Diseases of the optic nerve. I. Hereditary or congenital optic atrophy and allied cases. Trans Ophthal Soc UK 1897; 17 : 66 – 81.
4. Kjer P. Infantile optic atrophy with dominant mode of inheritance: a clinical and genetic study of 19 Danish families. Acta Ophthalmol Suppl 1959; 164 (Suppl 54): 1 – 147.
5. Smith DP. Diagnostic criteria in dominantly inherited juvenile optic atrophy. A a report of three new families. Am J Optom Arch Am Acad Optom 1972; 49(3): 183 – 200. doi: 10.1097/ 00006324-197203000-00001.
6. Amati-Bonneau P, Valentino ML, Reynier P et al. OPA1 mutations induce mitochondrial DNA instability and optic atrophy ‘plus’ phenotypes. Brain 2008; 131(Pt 2): 338 – 351. doi: 10.1093/ brain/ awm298.
7. Eiberg H, Kjer B, Kjer P et al. Dominant optic atrophy (OPA1) mapped to chromosome 3q region. I. Linkage analysis. Hum Mol Genet 1994; 3(6): 977 – 980. doi: 10.1093/ hmg/ 3.6.977.
8. Alexander C, Votruba M, Pesch UE et al. OPA1, encoding a dynamin-related GTPase, is mutated in autosomal dominant optic atrophy linked to chromosome 3q28. Nat Genet 2000; 26(2): 211 – 215. doi: 10.1038/ 79944.
9. Delettre C, Griffoin JM, Kaplan J et al. Mutation spectrum and splicing variants in the OPA1 gene. Hum Genet 2001; 109(6): 584 – 591. doi: 10.1007/ s00439-001-0633-y.
10. Kjer B, Eiberg H, Kjer P et al. Dominant optic atrophy mapped to chromosome 3q region. II. Clinical and epidemiological aspects. Acta Ophthalmol Scand 1996; 74(1): 3 – 7. doi: 10.1111/ j.1600-0420.1996.tb00672.x.
11. Yu-Wai-Man P, Chinnery PF. Dominant optic atrophy: novel OPA1 mutations and revised prevalence estimates. Ophthalmology 2013; 120(8): 1712. doi: 10.1016/ j.ophtha.2013.04.022.
12. Yu-Wai-Man P, Griffiths PG, Brown DT et al. The epidemiology of Leber hereditary optic neuropathy in the North East of England. Am J Hum Genet 2003; 72(2): 333 – 339. doi: 10.1086/ 346066.
13. Thiselton DL, Alexander C, Morris A et al. A frameshift mutation in exon 28 of the OPA1 gene explains the high prevalence of dominant optic atrophy in the Danish population: evidence for a founder effect. Hum Genet 2001; 109(5): 498 – 502. doi: 10.1007/ s004390100600.
14. Toomes C, Marchbank NJ, Mackey DA et al. Spectrum, frequency and penetrance of OPA1 mutations in dominant optic atrophy. Hum Mol Genet 2001; 10(13): 1369 – 1378. doi: 10.1093/ hmg/ 10.13.1369.
15. Cohn AC, Toomes C, Potter C et al. Autosomal dominant optic atrophy: penetrance and expressivity in patients with OPA1 mutations. Am J Ophthalmol 2007; 143(4): 656 – 662. doi: 10.1016/ j.ajo.2006.12.038.
16. Yu-Wai-Man P, Griffiths PG, Burke A et al. The prevalence and natural history of dominant optic atrophy due to OPA1 mutations. Ophthalmology 2010; 117(8): 1538 – 1546. doi: 10.1016/ j.ophtha.2009.12.038.
17. Hoyt CS. Autosomal dominant optic atrophy. A spectrum of disability. Ophthalmology 1980; 87(3): 245 – 251. doi: 10.1016/ s0161-6420(80)35247-0.
18. Votruba M, Fitzke FW, Holder GE et al. Clinical features in affected individuals from 21 pedigrees with dominant optic atrophy. Arch Ophthalmol 1998; 116(3): 351 – 358. doi: 10.1001/ archopht.116.3.351.
19. Johnston RL, Seller MJ, Behnam JT et al. Dominant optic atrophy. Refining the clinical diagnostic criteria in light of genetic linkage studies. Ophthalmology 1999; 106(1): 123 – 128. doi: 10.1016/ S0161-6420(99)90013-1.
20. Almind GJ, Ek J, Rosenberg T et al. Dominant optic atrophy in Denmark – report of 15 novel mutations in OPA1, using a strategy with a detection rate of 90%. BMC Med Genet 2012; 13 : 65. doi: 10.1186/ 1471-2350-13-65.
21. Nochez Y, Arsene S, Gueguen N et al. Acute and late-onset optic atrophy due to a novel OPA1 mutation leading to a mitochondrial coupling defect. Mol Vis 2009; 15 : 598 – 608.
22. Pretegiani E, Rosini F, Rufa A et al. Genotype-phenotype and OCT correlations in autosomal dominant optic atrophy related to OPA1 gene mutations: report of 13 Italian families. J Neurol Sci 2017; 382 : 29 – 35. doi: 10.1016/ j.jns.2017.09.018.
23. Puomila A, Huoponen K, Mantyjarvi M et al. Dominant optic atrophy: correlation between clinical and molecular genetic studies. Acta Ophthalmol Scand 2005; 83(3): 337 – 346. doi: 10.1111/ j.1600-0420.2005.00448.x.
24. Votruba M, Thiselton D, Bhattacharya SS. Optic disc morphology of patients with OPA1 autosomal dominant optic atrophy. Br J Ophthalmol 2003; 87(1): 48 – 53. doi: 10.1136/ bjo.87.1.48.
25. Barboni P, Savini G, Cascavilla ML et al. Early macular retinal ganglion cell loss in dominant optic atrophy: genotype-phenotype correlation. Am J Ophthalmol 2014; 158(3): 628. doi: 10.1016/ j.ajo.2014.05.034.
26. Park SW, Hwang JM. Optical coherence tomography shows early loss of the inferior temporal quadrant retinal nerve fiber layer in autosomal dominant optic atrophy. Graefes Arch Clin Exp Ophthalmol 2015; 253(1): 135 – 141. doi: 10.1007/ s00417-014-2852-7.
27. Paul KN, Saafir TB, Tosini G. The role of retinal photoreceptors in the regulation of circadian rhythms. Rev Endocr Metab Disord. 2009; 10(4): 271 – 278. doi: 10.1007/ s11154-009-9120-x.
28. Gonzalez-Menendez I, Reinhard K, Tolivia J et al. Influence of opa1 mutation on survival and function of retinal ganglion cells. Invest Ophthalmol Vis Sci 2015; 56(8): 4835 – 4845. doi: 10.1167/ iovs.15-16743.
29. La Morgia C, Ross-Cisneros FN, Sadun AA et al. Melanopsin retinal ganglion cells are resistant to neurodegeneration in mitochondrial optic neuropathies. Brain 2010; 133(8): 2426 – 2438. doi: 10.1093/ brain/ awq155.
30. Holder GE, Votruba M, Carter AC et al. Electrophysiological findings in dominant optic atrophy (DOA) linking to the OPA1 locus on chromosome 3q 28-qter. Doc Ophthalmol 1998; 95(3 – 4): 217 – 228.
31. Liskova P, Tesarova M, Dudakova L et al. OPA1 analysis in an international series of probands with bilateral optic atrophy. Acta Ophthalmol 2017; 95(4): 363 – 369. doi: 10.1111/ aos.13285.
32. Yu-Wai-Man P, Griffiths PG, Gorman GS et al. Multi-system neurological disease is common in patients with OPA1 mutations. Brain 2010; 133(3): 771 – 786. doi: 10.1093/ brain/ awq007.
33. Amati-Bonneau P, Guichet A, Olichon A et al. OPA1 R445H mutation in optic atrophy associated with sensorineural deafness. Ann Neurol 2005; 58(6): 958 – 963. doi: 10.1002/ ana.20681.
34. Huang T, Santarelli R, Starr A. Mutation of OPA1 gene causes deafness by affecting function of auditory nerve terminals. Brain Res 2009; 1300 : 97 – 104. doi: 10.1016/ j.brainres.2009.08.083.
35. Leruez S, Milea D, Defoort-Dhellemmes S et al. Sensorineural hearing loss in OPA1-linked disorders. Brain 2013; 136(7): 236. doi: 10.1093/ brain/ aws340.
36. Pretegiani E, Rufa A, Gallus GN et al. Spastic paraplegia in “dominant optic atrophy plus” phenotype due to OPA1 mutation. Brain 2011; 134(11): 195. doi: 10.1093/ brain/ awr101.
37. Verny C, Loiseau D, Scherer C et al. Multiple sclerosis--like disorder in OPA1-related autosomal dominant optic atrophy. Neurology 2008; 70(13 Pt 2): 1152 – 1153. doi: 10.1212/ 01.wnl.0000289194.89359.a1.
38. Roubertie A, Leboucq N, Picot MC et al. Neuroradiological findings expand the phenotype of OPA1-related mitochondrial dysfunction. J Neurol Sci 2015; 349(1 – 2): 154 – 160. doi: 10.1016/ j.jns.2015.01.008.
39. Sergouniotis PI, Perveen R, Thiselton DL et al.Clinical and molecular genetic findings in autosomal dominant OPA3-related optic neuropathy. Neurogenetics 2015; 16(1): 69 – 75. doi: 10.1007/ s10048-014-0416-y.
40. Reynier P, Amati-Bonneau P, Verny C et al. OPA3 gene mutations responsible for autosomal dominant optic atrophy and cataract. J Med Genet 2004; 41(9): 110. doi: 10.1136/ jmg.2003.016576.
41. Behr C. Die komplizierte, hereditar-familiare Optikusatrophie des Kindesalters – ein bisher nicht beschriebener Symptomkomplex. Klin Mbl Augenheilkd 1909; 47 : 138 – 160.
42. Kleffner I, Wessling C, Gess B et al. Behr syndrome with homozygous C19ORF12 mutation. J Neurol Sci 2015; 357(1 – 2): 115 – 158. doi: 10.1016/ j.jns.2015.07.009.
43. Rubegni A, Pisano T, Bacci G et al. Leigh-like neuroimaging features associated with new biallelic mutations in OPA1. Eur J Paediatr Neurol 2017; 21(4): 671 – 677. doi: 10.1016/ j.ejpn.2017.04.004.
44. Anikster Y, Kleta R, Shaag A et al. Type III 3-methylglutaconic aciduria (optic atrophy plus syndrome, or Costeff optic atrophy syndrome): identification of the OPA3 gene and its founder mutation in Iraqi Jews. Am J Hum Genet 2001; 69(6): 1218 – 1224. doi: 10.1086/ 324651.
45. Yu-Wai-Man P, Chinnery PF. Reply: Early-onset Behr syndrome due to compound heterozygous mutations in OPA1. Brain 2014; 137(10): 302. doi: 10.1093/ brain/ awu187.
46. Lee J, Jung SC, Hong YB et al. Recessive optic atrophy, sensorimotor neuropathy and cataract associated with novel compound heterozygous mutations in OPA1. Mol Med Rep 2016; 14(1): 33 – 40. doi: 10.3892/ mmr.2016.5209.
47. Bonneau D, Colin E, Oca F et al. Early-onset Behr syndrome due to compound heterozygous mutations in OPA1. Brain 2014; 137(10): 301. doi: 10.1093/ brain/ awu184.
48. Pyle A, Ramesh V, Bartsakoulia M et al. Behr’s syndrome is typically associated with disturbed mitochondrial translation and mutations in the C12orf65 gene. J Neuromuscul Dis 2014; 1(1): 55 – 63. doi: 10.3233/ JND-140003.
49. Barrett TG, Bundey SE, Fielder AR et al. Optic atrophy in Wolfram (DIDMOAD) syndrome. Eye (Lond) 1997; 11(6): 882 – 888. doi: 10.1038/ eye.1997.226.
50. Eiberg H, Hansen L, Kjer B et al. Autosomal dominant optic atrophy associated with hearing impairment and impaired glucose regulation caused by a missense mutation in the WFS1 gene. J Med Genet 2006; 43(5): 435 – 440. doi: 10.1136/ jmg.2005.034892.
51. Soares A, Mota A, Fonseca S et al. Ophthalmologic manifestations of Wolfram syndrome: report of 14 cases. Ophthalmologica 2019; 241(2): 116 – 119. doi: 10.1159/ 000490535.
52. Voo I, Allf BE, Udar N et al. Hereditary motor and sensory neuropathy type VI with optic atrophy. Am J Ophthalmol 2003; 136(4): 670 – 677. doi: 10.1016/ s0002-9394(03)00390-8.
53. Tranebjaerg L, Schwartz C, Eriksen H et al. A new X linked recessive deafness syndrome with blindness, dystonia, fractures, and mental deficiency is linked to Xq22. J Med Genet 1995; 32(4): 257 – 263. doi: 10.1136/ jmg.32.4.257.
54. Mohr J, Mageroy K. Sex-linked deafness of a possibly new type. Acta Genet Stat Med 1960; 10 : 54 – 62. doi: 10.1159/ 000151118.
55. Leigh D. Subacute necrotizing encephalomyelopathy in an infant. J Neurol Neurosurg Psychiatry 1951; 14(3): 216 – 221. doi: 10.1136/ jnnp.14.3.216.
56. DiMauro S, Hirano M. MERRF. In: Adam MP, Ardinger HH, Pagon RA et al (eds.). GeneReviews®. Seattle (WA): University of Washington 1993 – 2017. [online]. Available from URL: https: / / www.ncbi.nlm.nih.gov/ books/ NBK1119.
57. Fortuna F, Barboni P, Liguori R et al. Visual system involvement in patients with Friedreich’s ataxia. Brain 2009; 132(1): 116 – 123. doi: 10.1093/ brain/ awn269.
58. Finsterer J, Mancuso M, Pareyson D et al. Mitochondrial disorders of the retinal ganglion cells and the optic nerve. Mitochondrion 2018; 42 : 1 – 10. doi: 10.1016/ j.mito.2017.10.003.
59. Otradovec J. Toxické a nutriční neuropatie optiku. In: Otradovec J (ed). Klinická neurooftalmologie 1. Praha: Grada 2003 : 191 – 192.
60. Ferre M, Caignard A, Milea D et al. Improved locus--specific database for OPA1 mutations allows inclusion of advanced clinical data. Hum Mutat 2015; 36(1): 20 – 25. doi: 10.1002/ humu.22703.
61. Del Dotto V, Fogazza M, Carelli V et al. Eight human OPA1 isoforms, long and short: What are they for? Biochim Biophys Acta Bioenerg 2018; 1859(4): 263 – 269. doi: 10.1016/ j.bbabio.2018.01.005.
62. Olichon A, Baricault L, Gas N et al. Loss of OPA1 perturbates the mitochondrial inner membrane structure and integrity, leading to cytochrome c release and apoptosis. J Biol Chem 2003; 278(10): 7743 – 7746. doi: 10.1074/ jbc.C200677200.
63. Guillery O, Malka F, Landes T et al. Metalloprotease-mediated OPA1 processing is modulated by the mitochondrial membrane potential. Biol Cell 2008; 100(5): 315 – 325. doi: 10.1042/ bc20070110.
64. Lee JE, Westrate LM, Wu H et al. Multiple dynamin family members collaborate to drive mitochondrial division. Nature 2016; 540(7631): 139 – 143. doi: 10.1038/ nature20555.
65. Frezza C, Cipolat S, Martins de Brito O et al. OPA1 controls apoptotic cristae remodeling independently from mitochondrial fusion. Cell 2006; 126(1): 177 – 189. doi: 10.1016/ j.cell.2006.06.025.
66. Elachouri G, Vidoni S, Zanna C et al. OPA1 links human mitochondrial genome maintenance to mtDNA replication and distribution. Genome Res 2011; 21(1): 12 – 20. doi: 10.1101/ gr.108696.110.
67. Del Dotto V, Fogazza M, Lenaers G et al. OPA1: How much do we know to approach therapy? Pharmacol Res 2018; 131 : 199 – 210. doi: 10.1016/ j.phrs.2018.02.018.
68. Belenguer P, Pellegrini L. The dynamin GTPase OPA1: more than mitochondria? Biochim Biophys Acta 2013; 1833(1): 176 – 183. doi: 10.1016/ j.bbamcr.2012.08.004.
69. Del Dotto V, Mishra P, Vidoni S et al. OPA1 Isoforms in the hierarchical organization of mitochondrial functions. Cell Rep 2017; 19(12): 2557 – 2571. doi: 10.1016/ j.celrep.2017.05.073.
70. Olichon A, Landes T, Arnaune-Pelloquin L et al. Effects of OPA1 mutations on mitochondrial morphology and apoptosis: relevance to ADOA pathogenesis. J Cell Physiol 2007; 211(2): 423 – 430. doi: 10.1002/ jcp.20950.
71. Zanna C, Ghelli A, Porcelli AM et al. OPA1 mutations associated with dominant optic atrophy impair oxidative phosphorylation and mitochondrial fusion. Brain 2008; 131(2): 352 – 367. doi: 10.1093/ brain/ awm335.
72. Agier V, Oliviero P, Laine J et al. Defective mitochondrial fusion, altered respiratory function, and distorted cristae structure in skin fibroblasts with heterozygous OPA1 mutations. Biochim Biophys Acta 2012; 1822(10): 1570 – 1580. doi: 10.1016/ j.bbadis.2012.07.002.
73. Hudson G, Amati-Bonneau P, Blakely EL et al. Mutation of OPA1 causes dominant optic atrophy with external ophthalmoplegia, ataxia, deafness and multiple mitochondrial DNA deletions: a novel disorder of mtDNA maintenance. Brain 2008; 131(2): 329 – 337. doi: 10.1093/ brain/ awm272.
74. Spiegel R, Saada A, Flannery PJ et al. Fatal infantile mitochondrial encephalomyopathy, hypertrophic cardiomyopathy and optic atrophy associated with a homozygous OPA1 mutation. J Med Genet 2016; 53(2): 127 – 131. doi: 10.1136/ jmedgenet-2015-103361.
75. Caporali L, Maresca A, Capristo M et al. Incomplete penetrance in mitochondrial optic neuropathies. Mitochondrion 2017; 36 : 130 – 137. doi: 10.1016/ j.mito.2017.07.004.
76. Kjer P, Jensen OA, Klinken L. Histopathology of eye, optic nerve and brain in a case of dominant optic atrophy. Acta Ophthalmol (Copenh) 1983; 61(2): 300 – 312. doi: 10.1111/ j.1755-3768.1983.tb01424.x.
77. Sadun AA, Win PH, Ross-Cisneros FN et al. Leber’s hereditary optic neuropathy differentially affects smaller axons in the optic nerve. Trans Am Ophthalmol Soc 2000; 98 : 223 – 232, discussion 32 – 35.
78. Pan BX, Ross-Cisneros FN, Carelli V et al. Mathematically modeling the involvement of axons in Leber’s hereditary optic neuropathy. Invest Ophthalmol Vis Sci 2012; 53(12): 7608 – 7617. doi: 10.1167/ iovs.12-10452.
79. Levin LA. Superoxide generation explains common features of optic neuropathies associated with cecocentral scotomas. J Neuroophthalmol 2015; 35(2): 152 – 160. doi: 10.1097/ WNO.0000000000000250.
80. Yu-Wai-Man P. Therapeutic approaches to inherited optic neuropathies. Semin Neurol 2015; 35(5): 578 – 586. doi: 10.1055/ s-0035-1563574.
81. Grau T, Burbulla LF, Engl G et al. A novel heterozygous OPA3 mutation located in the mitochondrial target sequence results in altered steady-state levels and fragmented mitochondrial network. J Med Genet 2013; 50(12): 848 – 858. doi: 10.1136/ jmedgenet-2013-101774.
82. Ryu SW, Jeong HJ, Choi M et al. Optic atrophy 3 as a protein of the mitochondrial outer membrane induces mitochondrial fragmentation. Cell Mol Life Sci 2010; 67(16): 2839 – 2850. doi: 10.1007/ s00018-010-0365-z.
83. Rouzier C, Bannwarth S, Chaussenot A et al. The MFN2 gene is responsible for mitochondrial DNA instability and optic atrophy “plus” phenotype. Brain 2012; 135(1): 23 – 34. doi: 10.1093/ brain/ awr323.
84. Sadun AA, Chicani CF, Ross-Cisneros FN et al. Effect of EPI-743 on the clinical course of the mitochondrial disease Leber hereditary optic neuropathy. Arch Neurol 2012; 69(3): 331 – 338. doi: 10.1001/ archneurol.2011.2972.
85. Carelli V, La Morgia C, Valentino ML et al. Idebenone treatment in Leber’s hereditary optic neuropathy. Brain 2011; 134(9): 188. doi: 10.1093/ brain/ awr180.
86. Barboni P, Valentino ML, La Morgia C et al. Idebenone treatment in patients with OPA1-mutant dominant optic atrophy. Brain 2013; 136(2): 231. doi: 10.1093/ brain/ aws280.
87. Smith TG, Seto S, Ganne P et al. A randomized, placebo-controlled trial of the benzoquinone idebenone in a mouse model of OPA1-related dominant optic atrophy reveals a limited therapeutic effect on retinal ganglion cell dendropathy and visual function. Neuroscience 2016; 319 : 92 – 106. doi: 10.1016/ j.neuroscience.2016.01.042.
88. Quiros PM, Ramsay AJ, Sala D et al. Loss of mitochondrial protease OMA1 alters processing of the GTPase OPA1 and causes obesity and defective thermogenesis in mice. EMBO J 2012; 31(9): 2117 – 2133. doi: 10.1038/ emboj.2012.70.
89. Naso MF, Tomkowicz B, Perry WL et al. Adeno-associated virus (AAV) as a vector for gene therapy. Bio-Drugs 2017; 31(4): 317 – 334. doi: 10.1007/ s40259-017-0234-5.
90. Wan X, Pei H, Zhao MJ et al. Efficacy and safety of rAAV2-ND4 treatment for leber’s hereditary optic neuropathy. Sci Rep 2016; 6 : 21587. doi: 10.1038/ srep21587.
91. Guy J, Feuer WJ, Davis JL et al. Gene therapy for leber hereditary optic neuropathy: low - and medium-dose visual results. Ophthalmology 2017; 124(11): 1621 – 1634. doi: 10.1016/ j.ophtha.2017.05.016.
92. Civiletto G, Varanita T, Cerutti R et al. Opa1 overexpression ameliorates the phenotype of two mitochondrial disease mouse models. Cell Metab 2015; 21(6): 845 – 854. doi: 10.1016/ j.cmet.2015.04.016.
93. Sarzi E, Seveno M, Piro-Megy C et al. OPA1 gene therapy prevents retinal ganglion cell loss in a dominant optic atrophy mouse model. Sci Rep 2018; 8(1): 2468. doi: 10.1038/ s41598-018-20838-8.
94. Hlavatá L, Ďuďáková Ľ, Trková M et al. Preimplantační genetická diagnostika a dědičná onemocnění oka. Cesk Slov Oftalmol 2016; 72(5): 167 – 171.
95. Liskova P, Ulmanova O, Tesina P et al. Novel OPA1 missense mutation in a family with optic atrophy and severe widespread neurological disorder. Acta Ophthalmol 2013; 91(3): 225 – 231. doi: 10.1111/ aos.12038.
96. Davey KM, Parboosingh JS, McLeod DR et al. Mutation of DNAJC19, a human homologue of yeast inner mitochondrial membrane co-chaperones, causes DCMA syndrome, a novel autosomal recessive Barth syndrome-like condition. J Med Genet 2006; 43(5): 385 – 393. doi: 10.1136/ jmg.2005.036657.
97. El-Shanti H, Lidral AC, Jarrah N et al. Homozygosity mapping identifies an additional locus for Wolfram syndrome on chromosome 4q. Am J Hum Genet 2000; 66(4): 1229 – 1236. doi: 10.1086/ 302858.
98. Abrams AJ, Hufnagel RB, Rebelo A et al. Mutations in SLC25A46, encoding a UGO1-like protein, cause an optic atrophy spectrum disorder. Nat Genet 2015; 47(8): 926 – 932. doi: 10.1038/ ng.3354.
99. Angebault C, Guichet PO, Talmat-Amar Y et al. Recessive mutations in RTN4IP1 cause isolated and syndromic optic neuropathies. Am J Hum Genet 2015; 97(5): 754 – 760. doi: 10.1016/ j.ajhg.2015.09.012.
100. Harding AE. Friedreich’s ataxia: a clinical and genetic study of 90 families with an analysis of early diagnostic criteria and intrafamilial clustering of clinical features. Brain 1981; 104(3): 589 – 620. doi: 10.1093/ brain/ 104.3.589.
101. Hanein S, Perrault I, Roche O et al. TMEM126A, encoding a mitochondrial protein, is mutated in autosomal-recessive nonsyndromic optic atrophy. Am J Hum Genet 2009; 84(4): 493 – 498. doi: 10.1016/ j.ajhg.2009.03.003.
102. Shimazaki H, Takiyama Y, Ishiura H et al. A homozygous mutation of C12orf65 causes spastic paraplegia with optic atrophy and neuropathy (SPG55). J Med Genet 2012; 49(12): 777 – 784. doi: 10.1136/ jmedgenet-2012-101212.
103. De Michele G, De Fusco M, Cavalcanti F et al. A new locus for autosomal recessive hereditary spastic paraplegia maps to chromosome 16q24.3. Am J Hum Genet 1998; 63(1): 135 – 139. doi: 10.1086/ 301930.
104. Spiegel R, Pines O, Ta-Shma A et al. Infantile cerebellar-retinal degeneration associated with a mutation in mitochondrial aconitase, ACO2. Am J Hum Genet 2012; 90(3): 518 – 523. doi: 10.1016/ j.ajhg.2012.01.009.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2020 Číslo 1
Nejčtenější v tomto čísle
- Novorozenecké záchvaty – současný pohled na problematiku
- Možnosti prevence Alzheimerovy choroby
- Primární non-Hodgkinův B-lymfom centrálního nervového systému
- Neuropsychiatrické symptomy jako časná manifestace Alzheimerovy nemoci
