AMETYST – výsledky observační studie fáze IV sledující účinky intramuskulárně podávaného interferonu beta-1a u pacientů s klinicky izolovaným syndromem/ klinicky definitivní roztroušenou sklerózou
AMETYST – Results of an Observational Phase IV Clinical Study Evaluating the Effect of Intramuscular Interferon Beta-1a Therapy in Patients with Clinically Isolated Syndrome or Clinically Definite Multiple Sclerosis
Introduction:
AMETYST, a prospective, non-interventional phase IV clinical study, evaluating subjective and objective parameters of 3-year intramuscular interferon beta-1a therapy in patients with clinically isolated syndrome or clinically definite multiple sclerosis.
Aim:
The primary objective of the study was to evaluate the impact of the study treatment on quality of life assessed by the patient using the visual analogue scale (VAS) and 36-item Short Form Health Survey. Secondary objectives included quality of life assessed using the VAS by the physician, assessment of cognitive functions by the physician using the PASAT test, the occurrence of relapses in the course of the study and the development of clinically definite multiple sclerosis in patients with clinically isolated syndrome, and the evaluation of weekly intramuscular injection administration by patient.
Material and methods:
The study was conducted in centres specialized in the treatment of multiple sclerosis – 14 sites in the Czech Republic and 10 sites in Slovakia. A total of 559 patients were enrolled in the study. Clinical parameters were assessed every six months, the other parameters every 12 months. An analysis of data was performed using descriptive statistic methods. To eliminate the impact of prematurely withdrawn patients on the study results, the data of patients who completed all study visits were analysed separately.
Results:
An improvement of the quality of life was detected during the study treatment; however, this improvement was only mild or unconvincing. The quality of life assessed by patient corresponded very well to the quality of life assessed by the physician.
Conclusion:
It was confirmed that the treatment has an important effect on relapse rate reduction and stabilization of patients’ clinical status, including their cognitive functions.
Key words:
multiple sclerosis – clinically isolated syndrome – quality of life – cognition – clinical course
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Chinese summary - 摘要
AMETYST - 观察性IV期临床研究结果评估肌肉干扰素β-1a治疗对临床孤立综合征或临床确诊多发性硬化症患者的影响介绍:
AMETYST,一项前瞻性、非介入性IV期临床研究被用来评估临床孤立综合征或临床确诊多发性硬化症患者3年肌注干扰素β-1a治疗的主观和客观指标。
目标:
该研究的主要目的是使用由病人自评的视觉模拟量表(VAS)和36项简版健康调查来评估研究治疗对生活质量的影响。次要目的包括:由医生使用VAS评估患者的生活质量,由医生使用PASAT测试评估其认知功能,研究过程中的发病率,独立症状多发性硬化症的发展、以及患者对每周肌内注射的评价。
材料和方法:
这项研究是在专门治疗多发性硬化症的中心进行的,在捷克共有14个中心,斯洛伐克有10个中心。共有559名患者参加了这项研究。临床数据每6个月评估一次,其他参数每12个月评估一次。数据分析使用描述性统计方法进行。为了消除提前退出患者对研究结果的影响,仅对完成了所有访问的患者的数据进行了分析。
结果:
研究发现患者治疗期间的生活质量有一定改善。然而,这种改善只是轻微的或不能令人信服。患者自评的生活质量与医生评估的生活质量非常吻合。
结论:
确认治疗对降低复发率和稳定患者临床状况(包括认知功能)有重要作用。
关键词:
多发性硬化 - 临床孤立综合征 - 生活质量 - 认知 - 临床过程
Autoři:
P. Štourač 1; D. Horáková 2
;
e. Klímová 3; P. Turčáni 4
Působiště autorů:
Neurologická klinika LF MU a FN Brno
1; Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
2; FZ PU a FNsP J. A. Reimana v Prešově
3; Neurologická klinika 1. LF UK a UN Bratislava
4
Vyšlo v časopise:
Cesk Slov Neurol N 2017; 80(6): 660-665
Kategorie:
Původní práce
doi:
https://doi.org/10.14735/amcsnn2017660
Poděkování kolektivu lékařů českých a slovenských MS center a firmě Biogen za provedení klinické studie AMETYST.
Souhrn
Úvod:
Prospektivní neintervenční studie fáze IV (AMETYST), jejíž výsledky uvádíme v této publikaci, hodnotila po dobu 3 let subjektivní i objektivní parametry účinnosti intramuskulárního interferonu beta-1a u pacientů s klinicky izolovaným syndromem a klinicky definitivní roztroušenou sklerózou.
Cíl:
Primárním cílem studie AMETYST bylo stanovit vliv léčby na parametry kvality života hodnocené pacientem pomocí vizuální analogové škály (VAS) a krátkého standardizovaného dotazníku kvality života SF-36. Vedlejším cílem bylo hodnocení kvality života pacienta lékařem pomocí VAS, kognitivních funkcí pomocí testu PASAT (neurokognitivní test postupného přičítání) a sledování počtu relapsů a progrese onemocnění (EDSS).
Soubor a metodika:
Studie probíhala na 14 pracovištích v České republice a 10 pracovištích na Slovensku. Do studie bylo zařazeno 559 pacientů s léčbou přípravkem Avonex® v indikaci klinicky izolovaný syndrom nebo klinicky definitivní roztroušená skleróza.
Výsledky:
Kvalita života hodnocená pacienty pomocí VAS a SF-36 se během 3 let mírně zlepšila a velmi přesně korelovala s hodnocením kvality života lékařem. Ke značnému zlepšení během hodnocené léčby došlo u kognitivních funkcí, ve snížení počtu relapsů a ve vnímání zátěže z injekční aplikace pacientem. EDSS zůstala po celou dobu studie stabilní.
Závěr:
Výsledky studie AMETYST potvrdily významný dlouhodobý vliv léčby intramuskulárním interferonem beta-1a na redukci počtu atak a stabilizaci zdravotního stavu pacienta.
Klíčová slova:
roztroušená skleróza mozkomíšní – klinicky izolovaný syndrom – kvalita života – kognice – klinický průběh
Úvod
Intramuskulárně podávaný interferon beta-1a(IM IFNβ-1a) vykazuje dlouhodobý účinek v podobě redukce počtu relapsů, zlepšení v nálezech na magnetické rezonanci a snížení progrese onemocnění [1,2]. Nicméně i kvalita života pacienta hodnocená pomocí dotazníků je stále více považována za důležitý faktor u chronických onemocnění, jakým je i roztroušená skleróza (RS) mozkomíšní, charakterizovaná vysokou morbiditou, nízkou mortalitou a pouze částečně účinnou léčbou s řadou vedlejších účinků a potenciálních rizik [3]. Cílem studie AMETYST je stanovení vlivu IM IFNβ-1a na parametry kvality života hodnocené pacienty a lékaři – vizuální analogová škála (VAS) a Short Form Health Survey-36 (SF-36) u klinicky izolovaného syndromu (clinically isolated syndrome; CIS) a klinicky definitivní RS (clinically definite multiple sclerosis; CDMS) u pacientů léčených po dobu 3 let. Kromě dalších parametrů studie hodnotí postižení (disabilitu) pomocí Expanded Disability Status Scale (EDSS), kognitivní funkce orientačně pomocí Paced Auditory Serial Addition Test (PASAT) a pomocí VAS i zátěž pacientů vyplývající z podání IM injekce jednou týdně. V této publikaci jsou prezentovány finální výsledky studie AMETYST.
Metodika
AMETYST je prospektivní, observační, neintervenční studie fáze IV s IM IFNβ-1a u pacientů s CIS a CDMS prováděná v centrech specializovaných na léčbu RS – 14 v ČR a 10 na Slovensku.
Do studie byli zařazeni pacienti, kteří dosáhli nejméně 18 let věku, měli diagnózu CIS/ CDMS, dosud nebyli léčeni žádnou nemoc modifikující terapií (DMT), léčba IM IFNβ-1a byla zahájena nejpozději 3 měsíce před vstupem do studie a pacienti měli relaps v posledním roce, ne však v posledních 30 dnech před vstupem do studie.
Kvalita života byla pacienty hodnocena každých 12 měsíců za pomoci VAS a dotazníkem SF-36 [4]. VAS hodnotí kvalitu života vyjádřenou mírou subjektivní zátěže na stupnici 0– 100, kde vyšší hodnoty vyjadřují nižší kvalitu života. Lékař hodnotil kvalitu života pacienta za použití VAS každých 12 měsíců. Kognitivní funkce byly hodnoceny orientačně, a to každých 12 měsíců testem PASAT, který měří rychlost zpracování informace a flexibilitu, stejně jako početní dovednost [5]. Fyzické postižení bylo hodnoceno každých 6 měsíců lékařem za použití EDSS.
Statistická analýza
Data byla hodnocena deskriptivními statistickými metodami. Abychom vyloučili potenciální zkreslení způsobené postupným vyřazováním pacientů, kterým léčba nevyhovovala, což by mohlo vést k falešně pozitivním výsledkům, je u nejdůležitějších sledovaných parametrů předložena analýza výsledků jen pro pacienty, kteří setrvali ve studii po celou dobu (populace s dokončenou účastí). U každé tabulky nebo grafu s výsledky je uvedena použitá populace i s celkovým počtem pacientů (n), u nichž byla k dispozici data pro provedení analýzy.
Výsledky
Pacienti
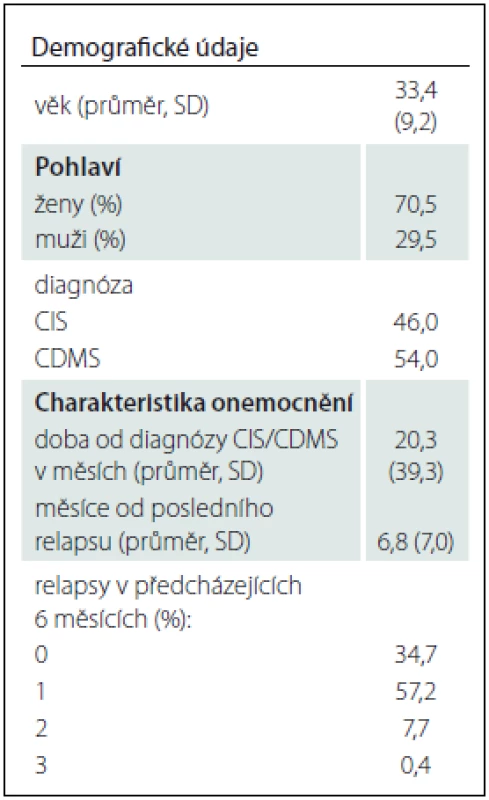
Do studie bylo zařazeno 559 pacientů, jejichž demografická data a charakteristiky onemocnění jsou souhrnně uvedeny v tab. 1. Věkový průměr souboru a zastoupení mužů a žen odpovídalo zhruba typické populaci s RS. V populaci byl přibližně stejný podíl pacientů s CIS a CDMS. Pacienti byli diagnostikováni průměrně 20 měsíců před zařazením do studie a poslední relaps měli zhruba 7 měsíců před zařazením do studie. Tomu odpovídá i skutečnost, že za poslední půlrok před zařazením do studie byla bez relapsu asi 1/ 3 pacientů.
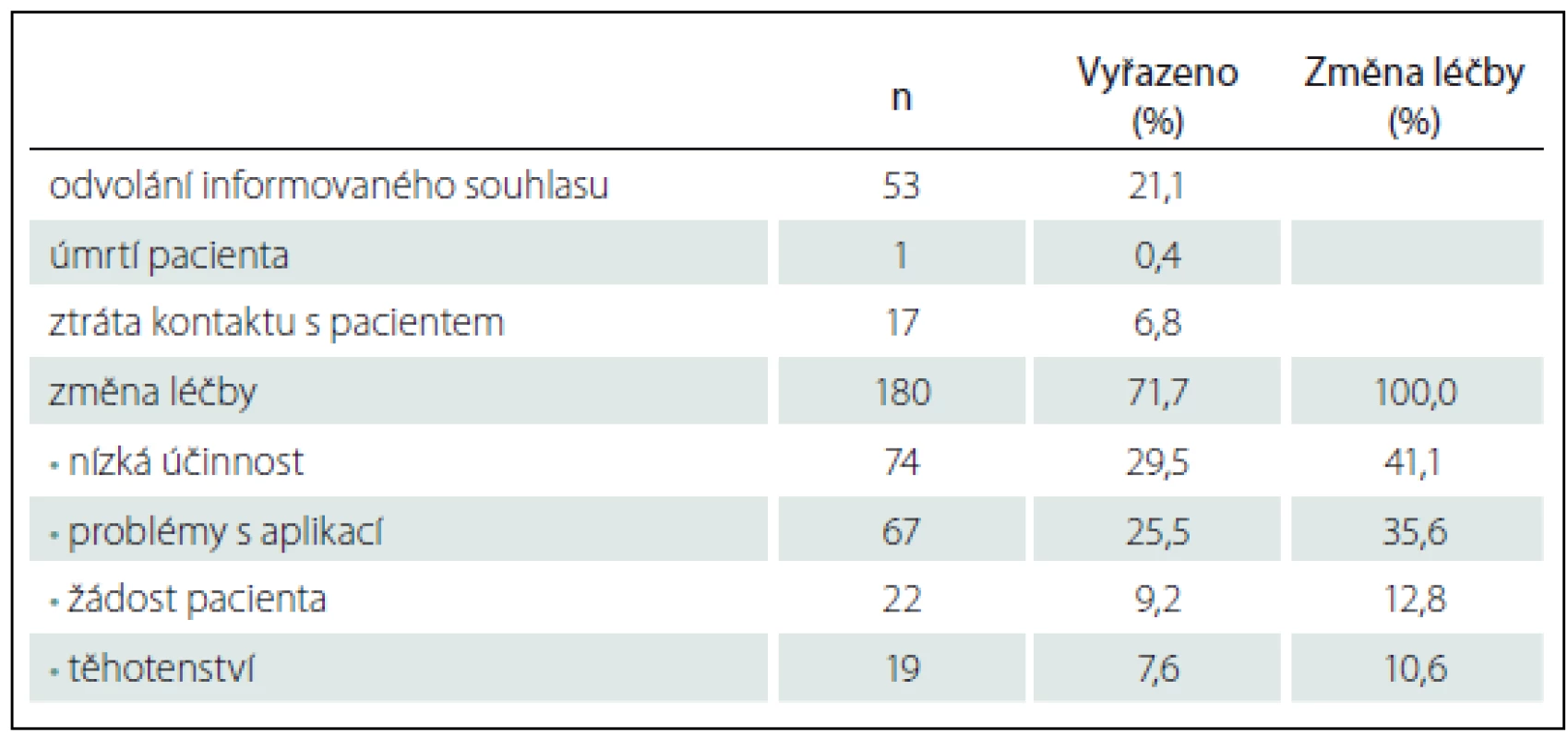
Během studie bylo z různých důvodů vyřazeno 228 pacientů, a proto populace s dokončenou účastí zahrnuje 331 pacientů. Důvody vyřazení podrobněji popisuje tab. 2, kdy šlo zejména o změnu léčby (180 pacientů), odvolání informovaného souhlasu s účastí ve studii (53 pacientů), ztrátu kontaktu s pacientem (17 pacientů) a v jednom případě i pro úmrtí pacienta.
Kvalita života
V grafu 1 uvádíme výsledky analýzy kvality života pomocí VAS hodnocené pacientem i lékařem každých 12 měsíců pouze pro populaci pacientů, kteří řádně dokončili sledované období 3 let ve studii (populace s dokončenou účastí). Kromě snížení skóre VAS (pokles představuje zlepšení hodnoceného parametru) byla ve studii zachycena značná korelace mezi hodnocením kvality života pacientem a lékařem – na stobodové stupnici byl nejvyšší rozdíl pouze 1,3 bodu.

Graf 2 zobrazuje výsledky hodnocení kvality života pacientem podle jednotlivých domén dotazníku SF-36 v populaci pacientů s dokončenou účastí. Nejnižší skóre (nižší skóre znamená pro pacienta větší zátěž a nárůst představuje zlepšení hodnoceného parametru) byla pozorována při hodnocení domén: hodnocení změny zdravotního stavu, zdravotní stav obecně a vitalita. Naopak nejvyšší skóre byla pozorována u domén fyzické funkce, bolest a omezení rolí z důvodu emočních problémů.

Kognitivní funkce (PASAT)
Hodnoty skóre PASAT (udávané jako podíl správných odpovědí) se v populaci pacientů s dokončenou účastí zvýšily z průměrné hodnoty 80,0 (SD = 18,63) na 87,8 (SD = 13,87) po 3 letech hodnocené léčby (graf 3).

Disabilita (EDSS)
Jak uvádí graf 4, průměrné skóre EDSS se v populaci pacientů s dokončenou účastí pohybovalo v intervalu 1,56 (SD = 0,765) v 12. měsíci až 1,69 (SD = 0,805) v 36. měsíci. Nicméně medián zůstával po celou dobu 3leté léčby stabilní (1,5).

Relapsy
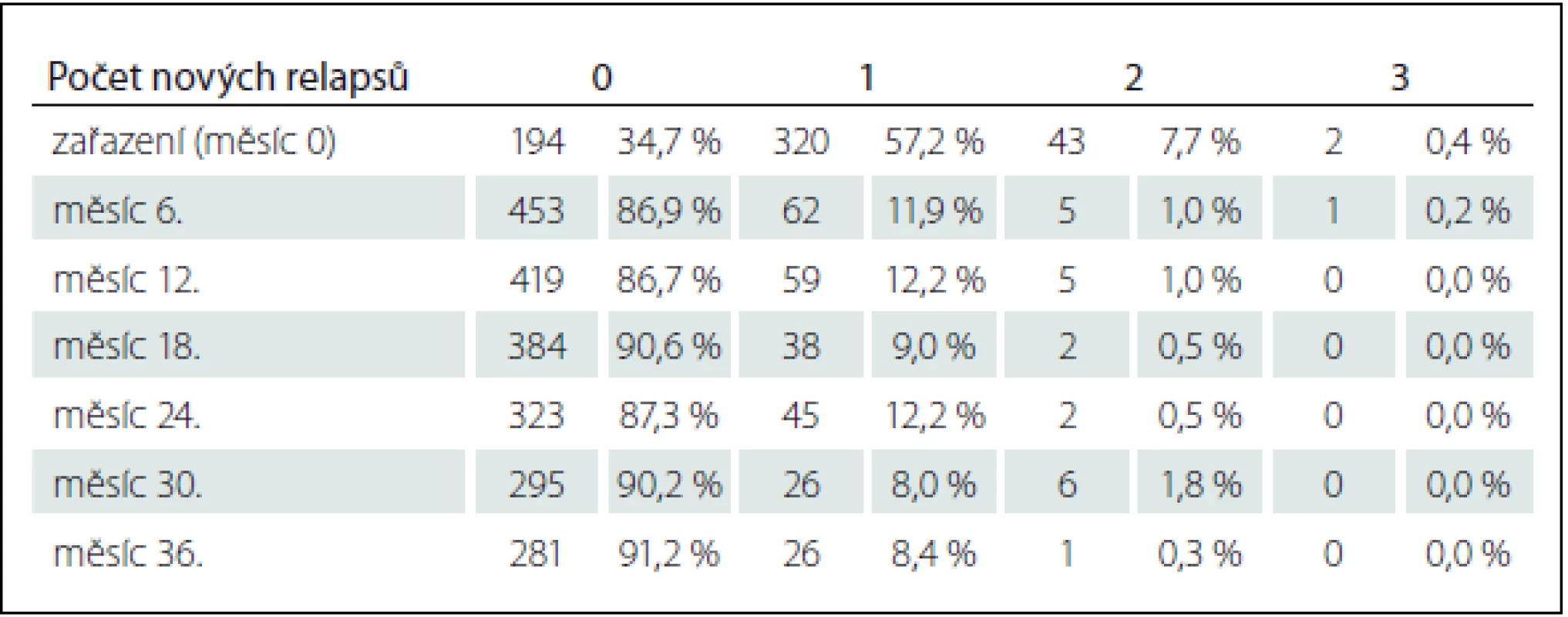
V průběhu studie AMETYST byl u pacientů každých 6 měsíců sledován počet relapsů od předchozí návštěvy. Jak je shrnuto v tab. 3, v průběhu hodnocené léčby došlo k výraznému poklesu počtu relapsů.
Vývoj CDMS u pacientů s CIS během hodnocené léčby
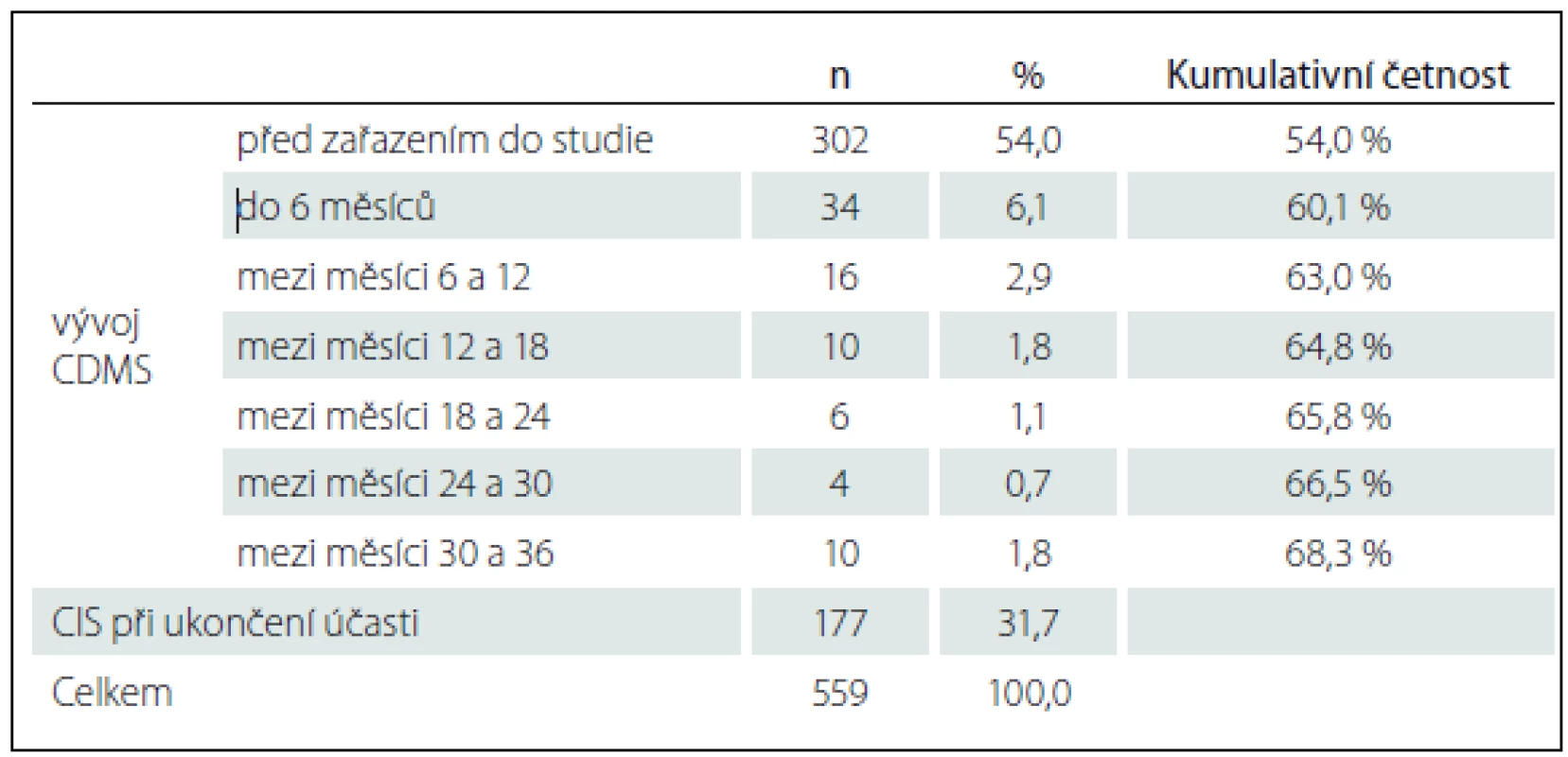
Z celkového počtu 559 pacientů zařazených do studie jich 257 (46 %) mělo diagnózu CIS. V průběhu studie AMETYST došlo k rozvoji CDMS u celkem 80 pacientů, kteří při zahájení účasti ve studii měli diagnózu CIS. Průměrná doba do stanovení diagnózy CDMS u pacienta s CIS při zařazení byla 21,1 měsíců (SD = 22,53; medián 15 měsíců; min. 1 měsíc a max. 131 měsíců). Tab. 4 uvádí přehled zachycených konverzí CIS do CDMS v průběhu studie AMETYST.
Hodnocení zátěže vyplývající z injekční aplikace IM IFNβ-1a jednou týdně
V průběhu studie AMETYST pacienti jednou ročně odpovídali na otázku: „Jak moc vás obtěžuje podání injekce léku Avonex®?“ a odpověď zaznamenávali na škále VAS od 0 (vůbec mě to neobtěžuje) do 100 (velmi). V průběhu studie se pacientem hodnocená zátěž kromě mírného nárůstu po 1 roce dále snižovala, jak je uvedeno v grafu 5.

Diskuze
Vzhledem k tomu, že byla hodnocená léčba sledována po velmi dlouhé období až 3 let, bylo nejdůležitějším problémem při hodnocení výsledků odstranit potenciální vliv pacientů, kteří hodnocenou léčbu předčasně přerušili, protože by mohli navodit falešně pozitivní nárůst účinnosti léčby (ve studii by zůstali pouze pacienti, kterým léčba plně vyhovuje). Výsledky tedy byly analyzovány odděleně i pro populaci pacientů, kteří ve studii řádně dokončili všechny návštěvy. Pouze u četnosti relapsů a konverzi CIS do CDMS byla použita celá populace zařazených pacientů, protože naopak vyloučení pacientů, kteří léčbu předčasně ukončili, by mohlo vést k falešně pozitivnímu ovlivnění výsledku.
Hodnocení parametrů, jako jsou kvalita života nebo kognice, které nelze měřit objektivními metodami, je tradičně metodologicky nesnadné a všechny používané nástroje mají svá omezení. Ve studii AMETYST byly k posouzení parametrů souvisejících s kvalitou života zvoleny testy VAS a SF-36. Zejména u škály VAS bylo v průběhu léčby pozorováno mírné zlepšení v hodnocení kvality života. U dotazníku SF-36 byl průběh hodnocení kvality života během 3 let ještě mírnější až stabilní. Nicméně pozitivní vliv IM IFNβ-1a na kvalitu života nemocných s RS popsali např. Jongen et al, kteří doložili zvýšení kvality života u pacientů s relaps remitentní RS po dvou letech dané terapie, přičemž nejvýrazněji se pozitivní vliv projevil u mladších pacientů s málo rozvinutou disabilitou [6]. Studie Pattiho et al porovnávala skupinu léčených intramuskulárně i subkutánně podávaným IFNβ-1a oproti pacientům bez této léčby, kdy po 2 letech došlo ke statisticky významnému zlepšení u pacientů s léčbou IFNβ-1a bez ohledu na zvolenou lékovou formu [7]. Podle Mowry et al pacienty hodnocená kvalita života dokonce souvisí se závažností nálezu lézí a atrofie mozku při vyšetření pomocí magnetické rezonance [8].
Zlepšení kognitivních funkcí zaznamenané během studie AMETYST (průměrné skóre PASAT bylo při zahájení 80,0 a při poslední návštěvě 87,8) se shoduje se závěry studie Pennera et al, kteří také popsali kladný účinek 2leté léčby IFNβ-1a na kognitivní funkce u pacientů po prvním výskytu příznaku svědčícího pro RS [9].
Skóre EDSS bylo zvoleno jako objektivní parametr fyzického postižení. V průběhu hodnocené léčby EDSS zůstávala stacionární. Vickrey et al prokázali, že změny v EDSS po léčbě IFNβ-1a mají při hodnocení kvality života souvislost jenom s doménou fyzického zdraví [10]. Během studie AMETYST se průměrné skóre fyzických funkcí v rámci dotazníku SF-36 zlepšilo (87,48 při zahájení na 90,03 v měsíci 36), nicméně medián zůstal stejný po celou dobu studie (95), což je v souladu s výsledky skóre EDSS, kde byl medián (1,5) rovněž stabilní po celou dobu hodnocené léčby.
U IFNβ-1a byl prokázán klinický účinek u klinicky jisté RS zpomalením progrese onemocnění, tzv. fyzické disability, redukcí klinických relapsů, redukcí ložisek při zobrazení magnetickou rezonancí a snížením progrese atrofie mozku [11– 14]. Účinnost IM IFNβ-1a podávaného jedenkrát týdně byla potvrzena i u CIS, kde bylo prokázáno statisticky signifikantní prodloužení konverze do CDMS [1]. Výsledky studie AMETYST potvrzují snížení četnosti relapsů – počet pacientů bez relapsu se za posledních 6 měsíců zvýšil z 34,7 % při zařazení na 86,7 až 91,2 % během ostatních návštěv. Naopak počet pacientů s jedním i více relapsy za posledních 6 měsíců výrazně klesl a tento snížený počet relapsů přetrval po celou dobu studie.
Křivka průměrných skóre VAS zátěže pro pacienty vyplývající z injekčního podání IFNβ-1a (27,3 při zahájení; 27,6 ve 12. měsíci; 23,9 ve 24. měsíci a 23,1 v 36. měsíci) naznačuje, že po jednom roce léčby jsou pacienti se způsobem podání smířenější. Do budoucna je možné problém s nekomfortním způsobem podání vyřešit aplikací IM IFNβ-1a pomocí pera s autoinjektorem, což podle závěrů studie PERSIST [15] po jednom roce této léčby vedlo u pacientů s RS k vysoké úrovni perzistence, compliance a adherence.
Závěr
Výsledky studie AMETYST potvrzují, že u pacientů léčených IM IFNβ-1a došlo k poklesu počtu relapsů a stabilizaci EDSS. Léčba měla také pozitivní vliv na kvalitu života hodnocenou pacientem i lékařem podle skóre VAS a na kognitivní funkce podle skóre PASAT. U ostatních sledovaných parametrů došlo k mírnému zlepšení nebo zůstaly po celou dobu konstantní. Z dlouhodobého hlediska tedy léčba pomocí IM IFNβ-1a v běžné klinické praxi navodila stabilizaci onemocnění, a ačkoliv terapie musí být dlouhodobá a má pro pacienta nekomfortní způsob podání, nedošlo po celou dobu sledování ke zhoršení kvality života pacienta.
Seznam účastnících se center
Česká republika
- Neurologická klinika 1. LF UK a VFN v Praze, Karlovo nám. 32, 120 00 Praha 2 (MU Dr. Dana Horáková)
- Neurologická klinika 2. LF UK a FN Motol, V Úvalu 84, 150 06 Praha 5 (MU Dr. Eva Meluzínová)
- Neurologická klinika LF UK a FN Hradec Králové, Sokolská 581, 500 05 Hradec Králové (doc. MU Dr. Martin Vališ, Ph.D.)
- Neurologická klinika LF MU a FN Brno, Jihlavská 20, 625 00 Brno (doc. MU Dr. Pavel Štourač, Ph.D.)
- Neurologická klinika LF OU a FN Ostrava, 17. listopadu 1790, 708 52 Ostrava (Ing. MU Dr. David Zeman, Ph.D.)
- Neurologická klinika LF MU a FN u sv. Anny, Pekařská 53, 656 91 Brno (MU Dr. Michal Dufek)
- Neurologická klinika LF UP a FN Olomouc, I. P. Pavlova 6, 775 20 Olomouc (prof. MU Dr. Jan Mareš, Ph.D.)
- Neurologická klinika Thomayerovy nemocnice, Vídeňská 800, 140 00 Praha 4 (MU Dr. Romana Vančurová)
- Neurologické oddělení, Nemocnice České Budějovice a.s., B. Němcové 585/ 54, 370 87 České Budějovice (MU Dr. Libuše Lhotáková)
- Neurologická klinika LF UK a FN Plzeň, Alej Svobody 80, 304 60 Plzeň (prim. MU Dr. Jiří Fiedler, Ph.D.)
- Neurologické oddělení, Krajská zdravotní, a.s. – Nemocnice Teplice, o.z., Duchcovská 53, 415 28 Teplice (prim. MU Dr. Marta Vachová)
- Neurologická klinika 3. LF UK a FN Královské Vinohrady, Šrobárova 50, 100 34 Praha 10 (doc. MU Dr. Ivana Štětkářová, CSc.)
- Neurologické oddělení, Nemocnice Jihlava, Vrchlického 59, 586 33 Jihlava (MU Dr. Radek Ampapa)
Slovenská republika
- Neurologická ambulancia, Gorkého 1, 811 01 Bratislava (prof. MU Dr. Peter Turčáni, PhD.)
- II. Neurologická klinika SZU a FNsP F. D. Roosevelta Banská Bystrica, Námestie gen. L. Svobodu 1, 975 17 Banská Bystrica (doc. MU Dr. Vladimír Donáth, PhD.)
- Neurologická klinika FZ PU a FNsP J. A. Reimana, Hollého 14, 081 81 Prešov (doc. MU Dr. Eleonóra Klímová, CSc.)
- II. Neurologická klinika LF UK a UN Bratislava, Nemocnica akademika L. Dérera, Limbova 5, 833 05 Bratislava (MU Dr. Ľubica Procházková, CSc.)
- Neurologická klinika SZU a UN Bratislava, Nemocnica Ružinov, Ružinovská 6, 826 06 Bratislava (prof. MU Dr. Ľubomír Lisý, DrSc.)
- Neurologická klinika LF UPJŠ a UN L. Pasteura Košice, Trieda SNP 1, 040 11 Košice (doc. MU Dr. Jarmila Szilasiová, PhD.)
- Klinika neurológie ÚVN SNP Ružomberok – FN, Gen. Miloša Vesela 21, 034 26 Ružomberok (MU Dr. Anna Šaffová)
- Neurologické oddelenie, FNsP Trnava, A. Žarnova 11, 917 75 Trnava (MU Dr. Georgi Krastev, PhD.)
- Neurologická klinika FN Nitra, Špitálska 6, 949 01 Nitra (doc. MU Dr. Miroslav Brozman, CSc.)
- Neurologická klinika LF UK a FN Martinská, Kollárova 2, Martin 036 01 (MU Dr. Milan Grofik)
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Pavel Štourač, Ph.D.
Neurologická klinika LF MU a FN Brno
Jihlavská 20, 625 00 Brno
e-mail: stourac.pavel@fnbrno.cz
Přijato k recenzi: 27. 7. 2017
Přijato do tisku: 11. 9. 2017
Zdroje
1. Jacobs LD, Beck RW, Simon JH, et al. Intramuscular interferon beta-1a therapy initiated during a first demyelinating event in multiple sclerosis. N Eng J Med 2000;343(13):898– 904.
2. Kinkel RP, Kollman C, O’Connor P, et al. IM interferon beta-1a delays definite multiple sclerosis 5 years after a first demyelinating event. Neurology 2006;66(5):678– 84. doi: 10.1212/ 01.wnl.0000200778.65597.ae.
3. Miller DM, Kinkel RP. Health-related quality of life assessment in multiple sclerosis. Rev Neurol Dis 2008;5(2):56– 64.
4. Ware JE jr, Kosinski M, Gandek B. How to score version 2 of the SF-36 health survey: standards & acute forms. Lincoln RI: Quality Metric Incorporated 2000.
5. Cutter GC, Beier ML, Rudick RA, et al. Development of a multiple sclerosis functional composite as a clinical trial outcome measure. Brain 1999;122(5):871– 82.
6. Jongen PJ, Sindic C, Carton H, et al. Functional composite and quality of life in avonex-treated relapsing multiple sclerosis patients study group. 2010. Improvement of health-related quality of life in relapsing remitting multiple sclerosis patients after 2 years of treatment with intramuscular interferon-beta-1a. J Neurol 2010; 257(4):584– 9. doi: 10.1007/ s00415-009-5378-x.
7. Patti F, Pappalardo A, Montanari E, et al. Interferon-beta-1a treatment has a positive effect on quality of life of relapsing-remitting multiple sclerosis: results from a longitudinal study. Neurol Sci 2014;337(1– 2):180– 5. doi: 10.1016/ j.jns.2013.12.006.
8. Mowry EM, Beheshtian A, Waubant E, et al. Quality of life in multiple sclerosis is associated with lesion burden and brain volume measures. Neurology 2009;72:1760– 5.
9. Penner IK, Stemper B, Calabrese P, et al. Effects of interferon beta-1b on cognitive performance in patients with a first event suggestive of multiple sclerosis. Mult Scler 2012;18(10):1466– 71. doi: 10.1177/ 1352458512442438.
10. Vickrey BG, Lee L, Moore F, et al. EDSS change relates to physical HRQoL while relapse occurrence relates to overall HRQoL in patients with multiple sclerosis receiving subcutaneous interferon β-1a. MultScler Int 2015:631989. doi: 10.1155/ 2015/ 631989.
11. Jacobs LD, Cookfair DL, Rudick RA, et al. Intramuscular interferon beta-1a for disease progression in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG). Ann Neurol 1996;39(3):285– 94. doi: 10.1002/ ana.410390304.
12. Rudick RA, Goodkin GE, Jacobs MD, et al. Impact of interferon beta-1a on neurologic disability in relapsing multiple sclerosis. Neurology 1997;49(2):358– 63.
13. Vermersch P, de Seze J, Stojkovic T, et al. Interferon beta-1a (Avonex) treatment in multiple sclerosis: similarity of effect on progression of disability in patients with mild and moderate disability. J Neurol 2002;249(2):184– 7.
14. Simon JH, Jacobs LD, Campion M, et al. Magnetic resonance studies of intramuscular interferon beta-1a for relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research group. Ann Neurol 1998;43(1):79– 87.
15. Hupperts R, Becker V, Friedrich J, et al. Multiple sclerosis patients treated with intramuscular IFN-β-1a autoinjector in a real-world setting: prospective evaluation of treatment persistence, adherence, quality of life and satisfaction. Expert Opin Drug Deliv 2015;12(1):15– 25. doi: 10.1517/17425247.2015.989209.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2017 Číslo 6
Nejčtenější v tomto čísle
- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Moderní techniky MR zobrazení u roztroušené sklerózy
- H-reflex – jeho role v neurofyziologii a klinice
- Uzatvárať foramen ovale patens?
