Průkaz boreliové DNA u pacientů s neuroboreliózou
Detection of Spirochetal DNA from Patients with Neuroborreliosis
Aim:
To assess the importance of Borrelia burgdorferi sensu lato DNA verification in neuroborreliosis.
Material and methods:
Seventy-one hospitalized patients with clinically and laboratory-confirmed neuroborreliosis were included. PCR of plasma, urine and CSF was performed in parallel before and after the treatment, and after 3 and 6 months for plasma and urine. DNA was isolated using the QIAamp DNA Mini Kit, PCR was arranged as a two-step amplification (nested PCR). Each sample was examined by the five amplification systems in parallel: two were targeted at plasmide genes encoding OspA and OspC proteins and three at genes for 16S rDNA, flagellin and p66 protein.
Results:
Of all 71 patients, the specific DNA was found in 51 cases (71.8%) before treatment. After the treatment, the DNA was proven in 25 patients (35.2%). PCR positivity persisted in 19 (26.8%) after three months and still in five (7%) patients after six months. The highest frequency of PCR-positive results was obtained by the 16S rDNA system, slightly lower sensitivity was achieved with the OspA, OspC and flagellin primers and the lowest frequency of positives was in the p66 target.
Conclusion:
Borrelial DNA was most frequently found in CSF, less frequently in urine and the lowest number of positive results were in plasma. PCR positivity decreased gradually during the observation period, the test was still positive in some patients after six months. It is possible to recommend testing with a minimum of two target sequences to improve diagnostic sensitivity. Our results suggest that the PCR testing should only be used in neuroborreliosis as an supplementary diagnostic method and subject to correct clinical interpretation.
Key words:
neuroborreliosis – nested PCR – plasma – cerebrospinal fl uid – urine
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
D. Pícha; L. Moravcová; D. Smíšková
Působiště autorů:
Klinika infekčních nemocí 2. LF UK a Nemocnice Na Bulovce, Praha
Vyšlo v časopise:
Cesk Slov Neurol N 2016; 79/112(5): 566-571
Kategorie:
Původní práce
Souhrn
Cíl:
Ověření významu průkazu DNA Borrelia burgdorferi sensu lato u nervových forem lymeské boreliózy.
Soubor a metodika:
Bylo vyšetřeno 71 hospitalizovaných pacientů s prokázanou neuroboreliózou. Polymerázová řetězová reakce (PCR) byla vyšetřována paralelně v plazmě, moči a mozkomíšním moku před léčbou a po léčbě a dále po třech a šesti měsících v plazmě a moči. DNA byla izolována pomocí QIAamp DNA Mini Kitu. PCR probíhala jako dvoustupňová amplifikace (nested PCR). Každý biologický materiál byl testován paralelně pomocí pěti amplifikačních systémů: dva primery byly specifické pro plazmidové geny kódující OspA a OspC protein a tři pro chromozomální geny kódující 16S rDNA, flagelin a p66 protein.
Výsledky:
Z celkového počtu 71 pacientů byla alespoň v jedné tělní tekutině prokázána DNA před léčbou u 51 (71,8 %). Po léčbě byla DNA detekována u 25 pacientů (35,2 %). Po třech měsících pozitivita přetrvávala nadále u 19 (26,8 %) a po šesti měsících u pěti (7 %) nemocných. Nejvíce pozitivních výsledků bylo dosaženo pro 16S rDNA systém, o něco nižší citlivost byla zachycena s primery pro OspA, OspC a flagelin, nejnižší vykazoval p66 systém.
Závěr:
Boreliová DNA byla prokázána nejčastěji v mozkomíšním moku, méně v moči a nejmenší záchyt byl v plazmě. Pozitivita PCR během sledovaného období klesala postupně, u části pacientů byl test pozitivní ještě po šesti měsících. Z důvodu zlepšení diagnostické senzitivity lze doporučit paralelní vyšetření minimálně dvou cílových sekvencí. Na základě uvedených skutečností lze vyšetření DNA použít pouze jako doplňující test za předpokladu správné klinické interpretace jeho výsledků.
Klíčová slova:
neuroborelióza – nested PCR – plazma – mozkomíšní mok – moč
Úvod
Lymeská borelióza (LB) je onemocnění, které má řadu nervových projevů. Již delší dobu je známo, že obrana organizmu proti jejímu vyvolavateli spirochétě Borrelia burgdorferi sensu lato je často málo intenzivní a vykazuje řadu odchylek proti jiným bakteriálním infekcím. Vzhledem k tomuto faktu je diagnostika boreliózy v některých případech obtížná. Infekce probíhá nejprve lokálně v kůži, po generalizaci může vyvolat multiorgánové postižení zejména nervového a kloubního systému. Klinický obraz není s výjimkou některých kožních forem většinou patognomický. Patogeneze neuroboreliózy (NB) není dosud plně objasněna. Diagnostika LB je založena především na klinických příznacích, které by měly být podpořeny laboratorním vyšetřením [1]. Nejrozšířenější metodou je stanovení specifických protilátek, které je zapotřebí konfirmovat western blottingem [2]. Avšak i přes neustálé zdokonalování metod průkazu protilátek zůstává jejich hlavním handicapem poměrně nízká specifita, i když senzitivita zejména v pozdních stadiích zpravidla převyšuje 90 % [3]. Přímý průkaz borelií kultivací z biologických tekutin je pomalý, finančně náročný a má malou citlivost. Proto není vhodný k rutinnímu vyšetřování [4]. Další používanou technikou na přímý průkaz borelií je elektronová mikroskopie, v našich podmínkách zavedená zejména zásluhou referenční laboratoře pro LB v Praze. Jedná se o metodu relativně nákladnou, a tedy vhodnou pro speciální účely. Podstatnou slabinou je její nízká senzitivita, která má stejnou příčinu jako u kultivace [5,6].
Průkaz specifické DNA pomocí polymerázové řetězové reakce (PCR) je metoda vhodná zejména pro diagnostiku mikroorganizmů, které se obtížně kultivují. PCR byla úspěšně použita na průkaz celé řady bakteriálních patogenů v biologických vzorcích [7], vč. Borrelia burgdorferi sensu lato [8,9]. Metodou PCR byla boreliová DNA detekována v kožních biopsiích, v krvi, v mozkomíšním moku, synoviální tekutině a moči. Většímu klinickému rozšíření PCR brání především nízká diagnostická citlivost. Úspěšnost průkazu DNA borelií závisí na mnoha faktorech, jako je výběr biologického materiálu, izolace DNA, volba cílové sekvence, vlastní postup PCR. Dalším neméně důležitým problémem omezujícím zvýšení senzitivity PCR je fakt, že spirochéta se nachází v tělních tekutinách pouze přechodně a ve velmi nízké koncentraci. I přes uvedené problémy se v současné době jeví metody průkazu DNA spirochéty jako jedno z mála dostupných řešení rozvoje přímé laboratorní diagnostiky boreliové infekce.
Problematikou průkazu DNA spirochéty v biologických tekutinách jsme se zabývali již dříve [10,11]. V předkládané studii jsme testovali pět amplifikačních nested PCR systémů. Sledovali jsme citlivost a dynamiku PCR vyšetření v mozkomíšním moku, plazmě a moči u pacientů s NB a její klinické využití.
Soubor pacientů a metodika
Soubor pacientů
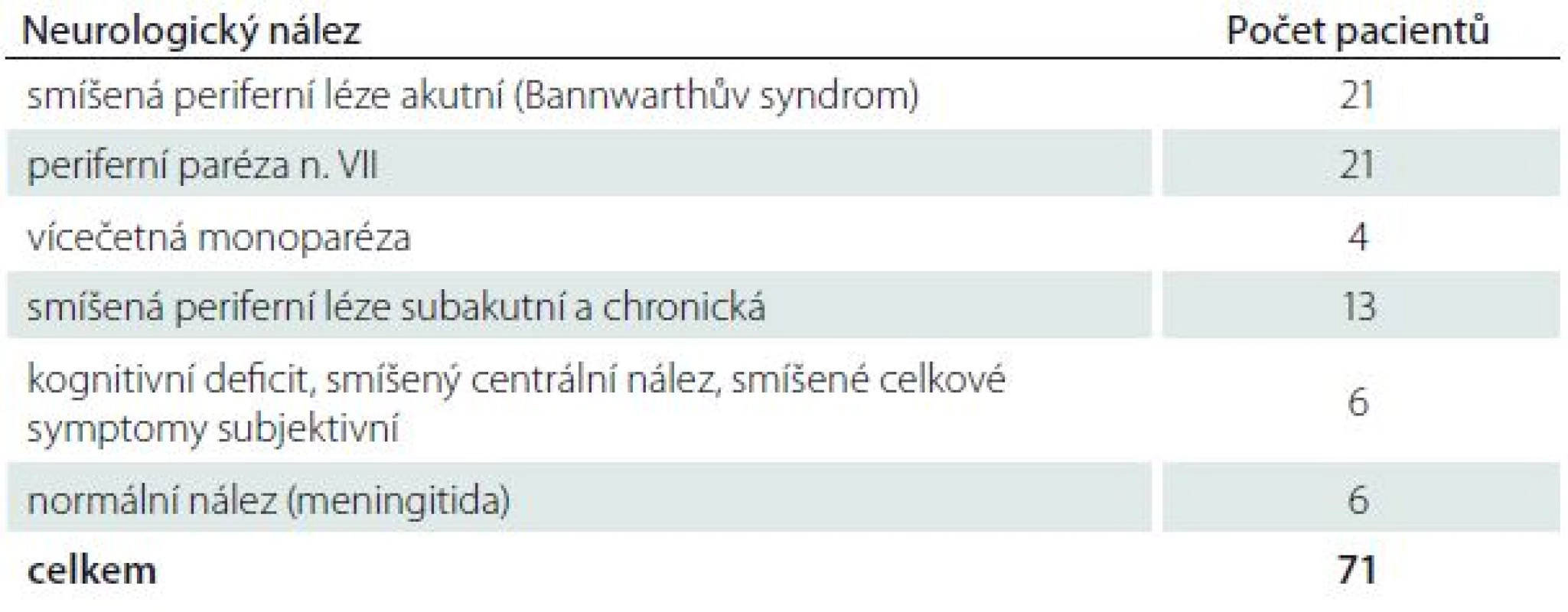
Ve studii bylo sledováno 71 hospitalizovaných pacientů s nervovými formami LB. NB byla diagnostikována na základě recentní neurologické symptomatiky a přítomnosti specifických protilátek v mozkomíšním moku prokázaných pomocí intratékální syntézy. Přehled typů nervového postižení a zastoupení jednotlivých neurologických nálezů uvádí tab. 1 a 2. Většinu postižených tvořili pacienti s časnou NB v počtu 54, 17 nemocných mělo chronické projevy infekce (trvání klinických projevů bylo delší než šest měsíců). Pacienti byli vyšetřeni klinicky i laboratorně před zahájením terapie, po ukončení léčby a v odstupu tří a šest měsíců. Intratékální syntéza specifických protilátek (pozitivní protilátkový index; AI) byla prokázána pomocí AI u 49 nemocných, v 18 případech byly specifické protilátky nalezeny pouze v mozkomíšním moku. U čtyř pacientů byla prokázána boreliová DNA v mozkomíšním moku bez současného průkazu specifických protilátek. Všichni pacienti byli hospitalizováni a léčeni antibiotiky, jejichž volba a délka podávání závisela na ošetřujícím lékaři.
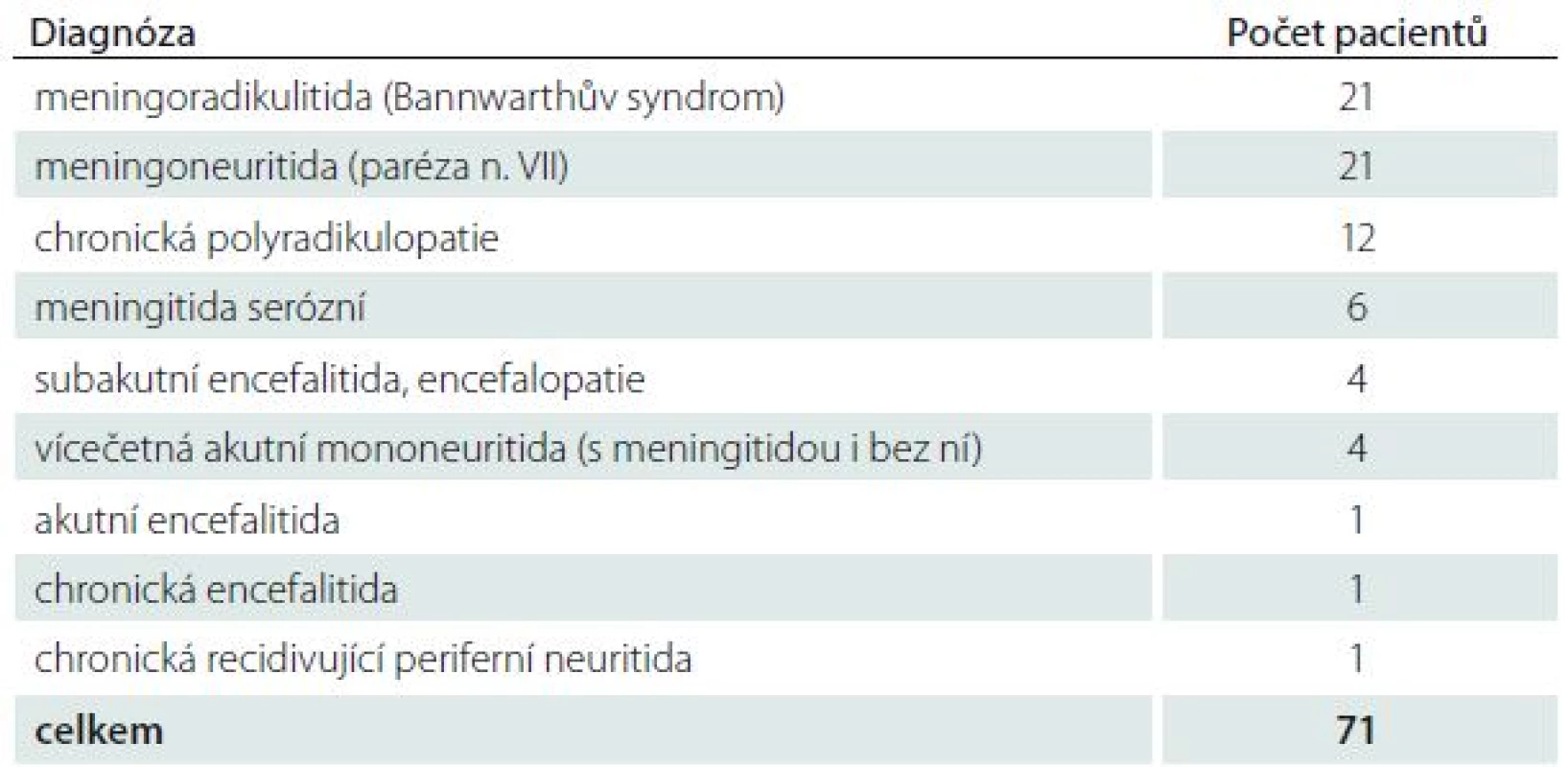
Stanovení specifických protilátek bylo prováděno komerční soupravou ELISA-Viditest anti-borrelia recombinant IgG VlsE/IgM (VIDIA s. r. o., ČR) Výsledky byly konfirmovány Western blottingem (Blot-Line Borrelia HGAIgM/HGAIgG TestLine, Clinical diagnostic s. r. o., ČR).
Protilátkový index (AI) byl počítán programem VidiTab (Vidia s. r. o., ČR). AI je poměr koncentrace specifických antiboreliových protilátek v likvoru a séru ve vztahu ke stavu hematolikvorové bariéry a koncentraci celkových imunoglobulinů v likvoru a séru. Hodnota indexu AI ≥ 1,5 ukazovala na intratékální syntézu specifických protilátek.
DNA izolace
Na izolaci DNA z biologického materiálu byl použit QIAamp DNA Mini Kit (QIAGEN GmbH, Německo) s mírnou modifikací. Na rozdíl od výrobce byl zpracováván větší objem výchozího materiálu určeného na izolaci DNA: 0,5 ml plazmy, 1 ml mozkomíšního moku a 15 ml moče. Čerstvě odebraný biologický materiál byl centrifugován (5 000 g/10 min), supernatant odstraněn a sediment rozsuspendován v 180 µl ATL pufru. Další kroky izolace již probíhaly podle postupu doporučeného výrobcem.
Primery
Každý biologický materiál byl testován na pět primerů (East Port s.r.o, ČR), dva pro plazmidové geny kódující OspA a OspC protein a tři pro chromozomální geny kódující 16S rDNA, flagelin a p66 protein. Na výběr oligonukleotidových primerů byla použita databáze www.ncbi.nlm.nih.gov.
Nested PCR
Na stanovení DNA byla použita in house nested PCR. Amplifikační i technické podmínky všech pěti systémů byly stejné. Objem reakční směsi byl 20 µl. Podmínky amplifikace první reakce: 14 min 92 °C (posílená denaturace a aktivace polymerázy), následuje devět cyklů, při kterých denaturace probíhala při 92 °C (30 s), přihybridizování primerů začínalo při teplotě 59 °C a teplota postupně klesala po každém cyklu o 1 °C až na 51 °C (30 s). Syntéza nově tvořeného vlákna probíhala při 72 °C (30 s). Poté následovalo 50 cyklů vlastní PCR, která se skládala z denaturace vzorků 92 °C (20 s), přihybridizování primerů při 50 °C (20 s), a syntézy nově tvořeného vlákna při 72 °C (20 s). Podmínky amplifikace druhé reakce byly identické, pouze počet cyklů byl snížen na 35. Uvedená amplifikace probíhala v iCycleru (BIO-RAD, USA) [8].
Analýza amplifikované DNA
DNA byla elektroforeticky rozdělena na 3% agarózovém gelu obarveném etidium bromidem a vizualizována v UV světle.
Výsledky
V tab. 3 a grafu 1 jsou uvedeny výsledky stanovení specifické DNA v jednotlivých biologických tekutinách. Před léčbou byly současně vyšetřovány mozkomíšní mok, plazma a moč. Ze 71 pacientů byla alespoň v jednom vzorku DNA spirochéty prokázána na začátku léčby u 51 (71,8 %) nemocných. Záchytnost PCR vyšetření byla v mozkomíšním moku a moči prakticky stejná, mozkomíšní mok byl pozitivní 32krát (42,3 %), moč 29krát (40,8 %). Citlivost PCR vyšetření v plazmě byla nižší. DNA spirochéty se podařilo prokázat pouze 17krát (23,9 %). V průběhu dalšího sledování už byla testována jenom plazma a moč. Po léčbě se DNA spirochéty podařilo prokázat u třetiny pacientů (25 pacientů, 35,2 %, 17krát v moči, 15krát v plazmě) po třech měsících PCR pozitivita přetrvávala u 19 pacientů (26,8 %, 10krát v moči, 12krát v plazmě). Po šesti měsících byla specifická DNA nalezena jen u pěti nemocných (7 %, pětkrát v moči a jedenkrát v plazmě). Všech pět pacientů vykazovalo PCR pozitivitu po celou dobu sledování.
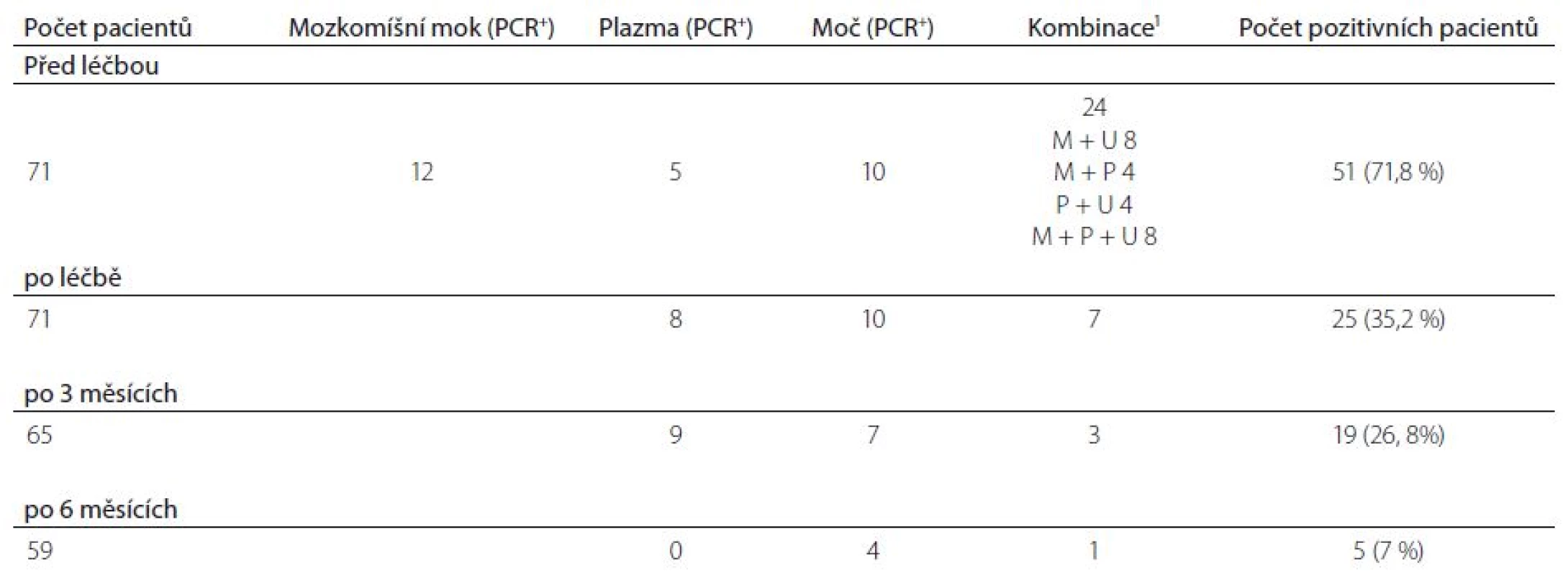

Pokud vyhodnotíme výsledky PCR před léčbou, tak 27 (38 %) pacientů bylo pozitivních v jedné biologické tekutině, 16 (22,5 %) ve dvou a osm (11,3 %) ve všech třech biologických tekutinách. U tří pacientů byla nalezena PCR pozitivita až po terapii.
Všechna PCR vyšetření byla prováděna paralelně na pět cílových sekvencí. Před léčbou bylo nejvíce pozitivních vzorků (49) dosaženo s primerem specifickým pro 16S rDNA, o něco nižší byl počet pozitivních vzorků při použití primerů pro flagelin (25), OspA (27) a OspC (19). Nejnižší počet pozitivních amplifikací byl zachycen s primerem pro p66 protein (4). Primer 16S rDNA měl vyšší záchytnost ve srovnání s ostatními primery i v dalším sledovaném období.
V grafu 2 jsou shrnuty informace o diagnostické senzitivitě metody PCR ve vztahu k počtu paralelně vyšetřených PCR amplifikací (s různými cíli). Při použití jednoho primeru bylo zachyceno 30 pozitivních pacientů, diagnostická senzitivita byla 42,2 %. Se dvěma primery bylo diagnostikováno 41 pacientů (57,7 %) a se třemi primery bylo zachyceno 48 (67,6 %) nemocných. Použitím čtyř a pěti primerů se počet pozitivit již významně nezvýšil (69, resp. 71,8 %).

Diskuze
K hlavním cílům studie patřilo testování metody PCR s ohledem na senzitivitu zvolených primerů. Dále byla v popředí zájmu délka vylučování specifické DNA po antibiotické terapii a otestování funkčnosti vybraných primerů. Laboratorní diagnostika LB je stále založena na průkazu specifických protilátek. Ty se obvykle dají prokázat již za 3–4 týdny od začátku infekce [7], ale včasná antibiotická terapie může protilátkovou odpověď potlačit. Nespornou výhodou protilátkové diagnostiky je vysoká senzitivita, která zejména v pozdějších a hlavně chronických stadiích infekce přesahuje 90 %. Nevýhodou sérologických testů je nutnost jejich konfirmace pomocí western blottingu a v neposlední řadě fakt, že průkaz protilátek není totožný s průkazem infekce. Z tohoto důvodu je stále aktuální potřeba přímého průkazu infekce u LB. Hlavní příčinou, která komplikuje situaci, je nízká koncentrace spirochét v krvi i v dalších tělních tekutinách. Tato skutečnost vylučuje použití mikroskopických a kultivačních technik v široké klinické praxi. Z tohoto důvodu zbývá jako prakticky jediná možnost přímého průkazu spirochéty stanovení specifické DNA pomocí PCR.
Opakované studie [8,12,13] i naše zkušenosti [10,11] ukázaly, že PCR amplifikace části genomu Borrelia burgdorferi sensu lato je potenciálně vhodná metoda pro průkaz boreliové infekce (zejména při absenci protilátkové odpovědi), klinická aplikace však skýtá některá úskalí. V prvé řadě se jedná o rizika vyplývající z metodiky samotné – možnost falešně negativních a pozitivních reakcí. Tento problém lze řešit pouze informovaností klinických pracovníků a v případě diskrepance vyšetření opakovat. Senzitivitu metody PCR zvyšuje paralelní amplifikace různých cílových sekvencí z jednoho vzorku. Protože koncentrace spirochét v tělních tekutinách je nízká, je tento fakt zdrojem dalších komplikací. K průkazu DNA je nutno použít dostatečně citlivé varianty PCR (v našem případě nested-PCR). Na druhou stranu se tím však zvyšuje riziko falešně pozitivních reakcí.
Pro diagnostiku infekce pomocí specifické DNA je nutno vzít v úvahu další okruh problémů. Přestože je průkaz DNA patogenu považován obecně za přímý průkaz infekce, neplatí to v každém ohledu. Pokud je metodika využívána k diagnostice infekcí, které jsou typické vysokou koncentrací infekčního agens v organizmu nebo ložisku, platí většinou, že po eradikaci infekce dochází k rychlé negativizaci testu (např. u hnisavých meningitid v mozkomíšním moku apod.). U spirochétové infekce je známo, že koncentrace bakterií klesá jen velmi zvolna, což má za následek pomalou úpravu klinického nálezu a ještě pomalejší uvolňování boreliové DNA z organizmu.
Při ověřování funkčnosti jednotlivých primerů je z dosažených výsledků patrné, že DNA spirochéty se nám podařilo prokázat u všech testovaných nervových forem LB. V období před léčbou byla pozitivita PCR u pacientů s NB vysoká (71,8 %). Tato dosažená citlivost testované metodiky PCR byla vyšší ve srovnání s jinými publikovanými studiemi, kdy je senzitivita v akutní fázi nejčastěji udávána v rozmezí 30–50 % [4]. Je však třeba vzít v úvahu, že bylo současně testováno více tělních tekutin a vyšetření PCR bylo prováděno paralelně s pěti primery. Takové uspořádání pokusu lze pro finanční i pracovní náročnost použít prakticky pouze v experimentální studii. Díky tomu ale byl prokázán jasný pokles PCR pozitivity na konci léčby. Tato skutečnost zřejmě souvisí s baktericidním efektem léčby.
Pozornost si také nepochybně zasluhují pozitivní výsledky vyšetření DNA s odstupem tří a šesti měsíců po ukončení léčby. Přestože samotný průkaz DNA borelií v klinických vzorcích neumožňuje rozlišení, zda nalezená DNA pochází ze živé nebo mrtvé spirochéty [14], lze s ohledem na jednoznačně příznivý klinický vývoj (do ukončeného 6. měsíce po terapii nebyl zachycen žádný klinicky zjistitelný relaps) předpokládat, že se alespoň u většiny sledovaných jednalo o DNA z mrtvých borelií. Také v pokusech na experimentálně infikovaných opicích a myších, které byly léčeny antibiotiky, bylo prokázáno, že DNA Borrelia burgdorferi může přetrvávat ve tkáních i týdny po antibiotické terapii [15,16]. Tento fakt podporují i výsledky našich předchozích studií [10,11]. Jednoznačné vysvětlení nelze v současné době podat. Lze se jenom domnívat, že dlouhodobé vylučování specifické DNA je způsobeno buď postupným uvolňováním DNA z tkání, nebo postupnou likvidací spirochét imunitním aparátem. Posledně jmenovanou skutečnost lze klást do souvislosti s opakovaným nálezem morfologicky změněných forem borelií tzv. L-forem, což je reverzibilní varianta, která vzniká spontánně vlivem nepříznivých podmínek, a které byly prokázány opakovaně ve tkáních u dlouhodobě probíhající infekce nebo po antibiotické terapii. Bohužel na základě dosud publikovaných poznatků není možné v současné době připisovat patogenní roli morfologickým variantám borelií ani u typických forem LB, ani u chronických stadií [17].
Ve studii byly také hodnoceny výsledky amplifikace s jednotlivými primery. Byly nalezeny rozdíly v četnosti pozitivity PCR vyšetření při použití jednotlivých primerů. Nejvyšší senzitivitu vykazovala sekvence pro 16S rDNA. Výsledky tak potvrzují známou skutečnost, že chromozomální geny bakterií jsou značně konzervativní, a proto primery od nich odvozené mají vyšší senzitivitu v PCR diagnostice v porovnání s primery odvozenými od plazmidových genů. Tato rozdílnost v senzitivitě může být dále způsobena variabilitou genů kódujících OspA i OspC protein, o nichž je známo, že se jejich nukleotidová sekvence u všech tří borelií patogenních pro člověka liší v 21–23 % [8,18]. Nejméně citlivý se jevil systém pro p66 protein. Zde byla zachycena pozitivita pouze čtyřikrát (dvakrát plazma, dvakrát moč). Vysoká senzitivita s primery pro p66 protein byla však nalezena u skupiny 30 pacientů s ECM, kde byli současně vyšetřovány také tři biologické vzorky (krev 16/30, moč 6/30, kožní biopsie 11/30) [19]. Samotná vysoká pozitivita PCR v kožních biopsiích nepřekvapuje, protože se jedná o materiál, o němž je všeobecně známo, že je zde průkaz boreliové DNA nejcitlivější. Na rozdíl od námi získaných výsledků byla ale v citované práci zjištěna vysoká senzitivita PCR v krvi (50 %).
Vyšetření DNA v moči lze stále ještě považovat za nejednoznačné. Řada autorů [4,9] poukazuje na velmi nízkou citlivost vyšetření a zejména na přítomnost inhibitorů DNA polymerázy v moči. Existují však publikované studie [20,21] vč. našich [10,11], kde se podařilo metodiku dovést do klinicky velmi uspokojivých výsledků. V naší studii byl (v období před léčbou) záchyt pozitivních výsledků v moči (celkem 29 pacientů) zcela srovnatelný s vyšetřením PCR v mozkomíšním moku (32 pozitivních pacientů). Který ze vzorků je snadněji dostupný, je nasnadě. V souvislosti s řečeným je ale nutné si uvědomit, že naše laboratoř pracuje jako experimentální a DNA z každého vzorku moči byla izolována do jedné hod po odebrání.
Závěr
Na základě získaných výsledků lze stanovit jistá doporučení pro klinické vyšetřování. Předně se ve shodě s řadou dalších pracovišť domníváme, že stanovení specifické DNA není v současné době diagnostická metoda 1. linie. Tuto výsadu má vyšetření specifických protilátek – za podmínky, že klinický nález je kompatibilní s LB. O PCR vyšetření se dá uvažovat např. u chronických a klinicky nejednoznačných případů a spíše na specializovaných pracovištích. Nejvyšší profit lze při vyšetření DNA očekávat u mozkomíšního moku. Na vyšetření DNA v moči není dosud jednotný názor. Doporučujeme přenechat pracovištím s dostatkem vlastních zkušeností. Citlivost PCR v krvi (plazmě) je obecně nejnižší.
Jak vyplývá z grafu 2, lze považovat za optimální použití tří dobře fungujících primerů. Pro klinickou praxi by bylo možné akceptovat i vyšetření dvou cílových sekvencí. Z námi použitých primerů se dají doporučit sekvence odvozené od chromozomálního genu kódujícího 16S rDNA nebo flagelin a sekvence odvozené od plazmidových genů kódujících OspA nebo OspC protein. Díky prokázané pomalé negativizaci PCR testu po léčbě nelze hodnotit efekt antibiotické léčby pomocí tohoto vyšetření minimálně po dobu 3–6 měsíců. Důrazně doporučujeme vyšetření provádět v renomovaných laboratořích, neboť z důvodu absence celostátního externího hodnocení kvality metodik (zcela běžného u většiny jiných metod) jsou výsledky dosažené na různých pracovištích kriticky rozdílné. Proto nemůžeme doporučit zakládat diagnózu LB na základě jedné izolované pozitivity v PCR.
PCR je bezesporu perspektivní metoda v diagnostice LB, zůstává však stále na hranici experimentálního použití.
Práce byla podpořena granty IGA NR8293, NT13467.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Dušan Pícha, CSc.
Klinika infekčních nemocí
2. LF UK a Nemocnice Na Bulovce
Budínova 2
180 81 Praha
e-mail: dusan.picha@bulovka.cz
Přijato k recenzi: 17. 3. 2016
Přijato do tisku: 22. 4. 2016
Zdroje
1. Dlouhý P, Honegr K, Krbková L, et al. Lymeská borrelióza – Doporučený postup v diagnostice, léčbě a prevenci. Klin Mikrobiol Inf Lék 2011; 17 (4): 144–53.
2. Ang CW, Notermans DW, Hommes M, et al. Large differences between test strategies for the detection of anti-Borrelia antibodies are revealed by comparing eight ELISAs and five immunoblots. Eur J Clin Microbiol Infect Dis 2011; 30 (8): 1027–32. doi: 10.1007/s10096-011-1157-6.
3. Steere AC, McHugh G, Damle N, et al. Prospective study of serologic tests for Lyme Disease. Clin Infect Dis 2008; 47 (2): 188–95. doi: 10.1086/589242.
4. Wilske B, Fingerle V, Schulte-Spechtel U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunol Med Microbiol 2007; 49 (10): 13–21.
5. Hulínská D, Votýpka J, Vaňousová D, et al. Identification of Anaplasma phagocytophilum and Borrelia burgdorferi sensu lato in patients with erythema migrans. Folia Microbiol 2009; 54 (3): 246–56. doi: 10.1007/s12223- 0090039-0.
6. Berenová D, Krsek D, Šípová L, et al. Short-term stability of Borrelia garinii in cerebrospinal fluid. Folia Microbiol 2016; 61 (1): 45–50. doi: 10.1007/s12223-015-0408-9.
7. Forbes BA. Introducing a molecular test into the clinical microbiology laboratory: development, evaluation, and validation. Arch Pathol Lab Med 2003; 127 (9): 1106–11.
8. Lebech AM. Polymerase chain reaction in diagnosis of Borrelia burgdorferi infections and strudies on taxonomic classification. APMIS Suppl 2002; 105: 1–40.
9. Nolte O. Nucleid acid amplification based diagnostic of Lyme (neuro-) borreliosis-lost in the jungle of methods, targets, and assays? Open Neurol J 2012; 6: 129–39. doi: 10.2174/1874205X01206010129.
10. Pícha D, Moravcová L, Žďárský E, et al. PCR in lyme neuroboreliosis: a prospective study. Acta Neurol Scand 2005; 112 (5): 287–92.
11. Pícha D, Moravcová L, Holečková D, et al. Examination of specific DNA by PCR in patients with different forms of Lyme borreliosis. Int J Dermatol 2008; 47 (10): 1004–10. doi: 10.1111/j.1365-4632.2008.03709.x.
12. Dumler JS. Molecular methods for ehrlichiosis and Lyme disease. Clin Lab Med 2003; 23 (4): 867–84.
13. Cerar T, Ogrinc K, Cimperman J, et al. Validation of cultivation and PCR methods for diagnosis of Lyme neuroborreliosis. J Clin Microbiol 2008; 46 (10): 3375–9. doi: 10.1128/JCM.00410-08.
14. Iyer R, Mukherjee P, Wang K, et al. Detection of Borrelia burgdorferi nucleic acids after antibiotic treatment does not confirm viability. J Clin Microbiol 2012; 51 (3): 857–62. doi: 10.1128/JCM.02785-12.
15. Hodzic E, Feng S, Holden K, et al. Persistence of Borrelia burgdorferi following antibiotic treatment in mice. Antimicrob Agents Chemother 2008; 52 (5): 1728–36. doi: 10.1128/AAC.01050-07.
16. Embers ME, Barthold SW, Borda JT, et al. Persistence of Borrelia burgdorferi in rhesus macaques following antibiotic treatment of disseminated infection. PLoS ONE 2012; 7 (1): e29914. doi: 10.137/journal.phone0029 914.
17. Lantos PM, Auwaerter PG, Wormser GP. A systematic review of Borrelia burgdorferi morpfologic variants does not support a role in chronic Lyme disease. Clin Infect Dis 2014; 58 (4): 663–71. doi: 10.1093/cid/cit810.
18. Theisen M, Frederiksen B, Lebech AM, et al. Polymorphism in OspC gene of Borrelia burgdorferi and immunoreactivity of OspC protein: implication for taxonomy and for use of OspC protein as a diagnostic antigen. J Clin Microbiol 1993; 31 (10): 2570–6.
19. Pauluzzi P, Bonin S, Gonzalez Inchaurraga MA, et al. Detection of spirochaetal DNA simultaneously in skin biopsies, peripheral blood and urine from patients with erythema migrans. Acta Derm Venereol 2004; 84 (2): 106–10.
20. Bergmann AR, Schmidt BL, Derler AM, et al. Importance of sample preparation for molecular diagnosis of Lyme borreliosis from urine. J Clin Microbiol 2002; 40 (12): 4581–4.
21. Aberer E, Bergmann AR, Derler AM, et al. Course of Borrelia burgdorferi DNA shedding in urine after treatment. Acta Derm Venereol 2007; 87 (1): 39–42.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2016 Číslo 5
Nejčtenější v tomto čísle
- Současná kortikoterapie u nádorů mozku
- Rasmussenova encefalitída
- Neurofyziologická vyšetření u traumatických lézí brachiálního plexu
- Průkaz boreliové DNA u pacientů s neuroboreliózou
