Význam magnetické rezonance v diagnostice epilepsie
The Contribution of Magnetic Resonance Imaging to the Diagnosis of Epilepsy
Epilepsy, a central nervous system disorder causing recurrent unprovoked seizures, remains a severe medical problem with a profound social impact on quality of life. The prevalence in population is 0.5–1%. Epilepsy is associated with various brain lesions such as developmental and metabolic disorders, some tumours, vascular malformations, postinfectious and postoperative changes or traumatic brain injury. Epilepsy can also develop as a result of prenatal, perinatal or early postnatal insults to the brain. The aim of diagnostic imaging is to identify underlying pathologies and to determine etiology of epilepsy. Identification of the epileptogenic focus is important especially for patients with pharmacoresistant epilepsy who could benefit from surgical treatment.
Key words:
epilepsy – magnetic resonance imaging –malformations of cortical development – focal cortical dysplasia of Taylor – tuberous sclerosis – classical lissencephalies and subcortical band heterotopias – lissencephaly – polymicrogyria – schizencephaly – hemimegalencephaly – Sturge-Weber syndrom
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
M. Pažourková 1; A. Svátková 1; J. Kočvarová 2; J. Chrastina 3; P. Cimflová 1,4
Působiště autorů:
Klinika zobrazovacích metod LF MU a FN u sv. Anny v Brně
1; Neurologická klinika LF MU a FN u sv. Anny v Brně
2; Neurochirurgická klinika LF MU a FN U sv. Anny v Brně
3; Mezinárodní centrum klinického výzkumu, FN u sv. Anny v Brně
4
Vyšlo v časopise:
Cesk Slov Neurol N 2015; 78/111(4): 394-400
Kategorie:
Přehledný referát
doi:
https://doi.org/10.14735/amcsnn2015394
Souhrn
Epilepsie, onemocnění mozku projevující se opakovanými spontánními záchvaty, představuje závažný medicínský i sociální problém postihující 0,5– 1 % populace. Epilepsie může být způsobena širokým spektrem lézí, mezi které patří vrozené vývojové či metabolické vady mozku, některé tumory, cévní anomálie, pozánětlivé, potraumatické nebo pooperační změny. Epilepsie se může rozvinout také v důsledku inzultů v prenatálním, perinatálním a časně postnatálním období. Úkolem zobrazovacích metod je co nejspolehlivěji prokázat potenciálně epileptogenní intrakraniální změny a pomoci určit etiologii epilepsie. Záchyt epileptogenní léze je významný zvláště u pacientů s farmakorezistentní epilepsií, kteří by mohli být vhodnými kandidáty pro chirurgickou léčbu.
Klíčová slova:
epilepsie – magnetická rezonance – poruchy vývoje mozkové kůry – fokální kortikální dysplazie – tuberózní skleróza – heterotopie šedé hmoty – lissencefalie – polymikrogyrie –schizencefalie – hemimegalencefalie – Sturgeův-Weberův syndrom
Úvod
Epilepsie je onemocnění mozku projevující se opakovanými spontánními (neprovokovanými) záchvaty. Představuje závažný medicínský i sociální problém. Jedná se o poměrně časté neurologické onemocnění jak v dospělosti, tak v dětství [1,2]. Její prevalence v populaci je 0,5– 1 % [3]. Ojedinělý epileptický záchvat se může vyskytnout asi u 5 % populace, většinou po excesech různého druhu (požití většího množství nebo naopak odnětí chronicky užívaného alkoholu, drog či některých léků) nebo v souvislosti s akutně probíhajícím onemocněním mozku (cévní mozková příhoda, trauma mozku, infekce CNS, metabolický rozvrat atd.). Takový epileptický záchvat může svědčit jen pro zvýšenou záchvatovou pohotovost a nemusí se opakovat (tzv. akutní symptomatický epileptický záchvat). Podmínkou stanovení diagnózy epilepsie je přítomnost nejméně dvou neprovokovaných epileptických záchvatů v rozmezí větším než 24 hod nebo prodělání jediného záchvatu a současně přítomným velmi vysokým rizikem opakování záchvatu (např. přítomnost aktivní epileptické abnormity v EEG, přítomnost vysoce epileptogenní strukturální patologie – např. hipokampální sklerózy nebo fokální kortikální dysplazie na magnetické rezonanci (MR) mozku).
Epileptický záchvat je projevem neuronální hyperexcitability, která vyplývá z porušení normálních excitačních a inhibičních mechanizmů. Současná klasifikace epilepsií a epileptických syndromů Mezinárodní ligy proti epilepsii (ILAE) z r. 1989 (modifikována v r. 2010) dělí epilepsie podle příčiny a distribuce epileptického děje. Podle příčiny se epileptické syndromy rozdělují na genetické (zahrnující většinu idiopatických epilepsií), strukturálně‑metabolické a neznámého původu. Epileptické záchvaty se podle distribuce dělí na generalizované, fokální (lokalizované), neurčené a zvláštní syndromy [4]. Geneticky podmíněné (idiopatické) záchvaty nemusí mít detekovatelný strukturální podklad při MR vyšetření. U parciálních záchvatů se strukturální lézi daří prokázat zhruba u 55 % pacientů. Případný záchyt epileptogenní léze je velice důležitý zvláště u pacientů s farmakorezistentní epilepsií s ohledem na rozšiřující se možnosti chirurgické léčby. Farmakorezistentní je přibližně třetina pacientů s parciálními záchvaty [1,3,5].
Význam a možnosti MR
Předností MR jako metody volby pro průkaz epileptogenních lézí je možnost zobrazování v libovolných rovinách a vysoká kvalita obrazu daná kromě prostorového rozlišení vysokým kontrastem mezi šedou a bílou hmotou i výrazně vyšším kontrastem mezi fyziologickou a patologicky změněnou tkání ve srovnání s vyšetřením CT. MR tak má vyšší senzitivitu i specificitu. Výtěžnost MR vyšetření závisí na charakteru léze, technice (parametrech přístroje, příslušenství a protokolu zobrazení) a erudici neuroradiologa, který vyšetření hodnotí. MR obraz je do jisté míry specifický jen u některých lézí – například kavernomů či arteriovenózních malformací. Svízelnější může být interpretace hyperintenzních ložisek v T2 váženém MR obraze.
Hlavním cílem MR vyšetření u pacientů s epilepsií je detekce strukturálních i funkčních abnormalit v předpokládaných epileptogenních oblastech mozku, predikce specifického epileptogenního substrátu či detekce přídatných abnormalit. Každý pacient s nově diagnostikovanou epilepsií je indikován k MR vyšetření [6,7]. V případě prvního epileptického záchvatu se standardně provádí CT mozku k vyloučení příčin akutního symptomatického záchvatu (intrakraniální krvácení, expanzivní proces apod.)
Protože MR nedokáže detekovat epileptogenicitu léze, je často iniciální strategií kombinace skalpového EEG a MR vyšetření [8]. V současné diagnostice má význam také difuzní MR zobrazování. V několika studiích bylo zjištěno zvýšení hodnot ADC (Apparent Diffusion Coeficient) u hipokampální sklerózy, a to i v případech, kdy konvenční MR skeny byly bez průkazu strukturálních změn [9]. Protonová MR spektroskopie má uplatnění v upřesnění diagnostiky strukturálních lézí (např. meziotemporální sklerózy, heterotopie šedé hmoty, fokální kortikální dysplazie) [10].
Uvedení MR do klinické praxe zásadně změnilo spektrum epileptochirurgických výkonů. V současné době je často cílem provedení prosté či rozšířené lezionektomie – odstranění detekované epileptogenní léze v užším slova smyslu, především meziotemporální sklerózy a fokální kortikální dysplazie. Kandidátem takového výkonu je pacient, který trpí farmakorezistentní fokální epilepsií s dobře zobrazenou epileptogenní lézí v resekovatelné oblasti, souhlasí s operací, má předpoklad pro zlepšení kvality života po operaci a nemá kontraindikace operačního výkonu.
V případě indikace k epileptochirurgické léčbě mohou být doplněna další vyšetření, jakými jsou funkční magnetická rezonance (fMR) či MR traktografie (Diffusion Tensor Imaging; DTI); fMR se využívá pro mapování eloquentního kortexu (především řečového a motorického) [9,11]. Pomocí MR fraktografie, která umožňuje mapovat a vizualizovat mozkové dráhy, lze predikovat a eventuálně i předejít funkčnímu poškození mozkové tkáně. V současné době se využívá zejména k mapování kortikospinálního traktu, fasciculus arcuatus či optické radiace [12,13], ale i dalších drah v závislosti na uložení epileptogenní léze a plánované resekci.
Technické a akviziční parametry MR vyšetření
Standardní vyšetření by mělo probíhat na přístrojích s magnetickým polem alespoň 1,5T. V současnosti se projevuje snaha dále zvýšit výtěžnost MR nejenom vyššími výkony (3T– 7T), ale i aplikací povrchových a kurvilineárních cívek, které umožní detailnější zobrazení kortexu [6]. Obecně pro MR diagnostiku platí, že T1 vážené obrazy (T1W) umožňují detailnější anatomické hodnocení. To je podmíněno jejich lepším tkáňovým kontrastem, v mozku tedy výraznějším rozdílem mezi bílou a šedou hmotou. T2 vážené obrazy (T2W) zase citlivěji detekují patologické změny intenzity signálu z mozkové tkáně. Výjimku představují nejmenší děti, u nichž díky nezralé myelinizaci a vyššímu obsahu vody v mozkové tkáni až zhruba do věku dvou let poskytují kvalitnější informace o anatomii T2W a naopak léze s vyšším obsahem vody nebo derivátů železa se především u novorozenců a kojenců lépe zobrazí v T1W. T1W s vyšším tkáňovým kontrastem získáme pomocí IR (Inversion Recovery) sekvencí. Inverzní T1W sekvence (TIR) nejlépe vykreslí anatomické poměry např. u fokální kortikální dysplazie a heterotopie šedé hmoty. Zvlášť citlivé jsou sekvence FLAIR (Fluid Attenuated Inversion Recovery). Při pátrání po epileptogenní lézi je u FLAIR sekvencí nejdůležitější zvýšení kontrastu lézí oproti šedé i bílé hmotě nejen periventrikulárně, ale i v oblasti kortikosubkortikálního přechodu. Této výhody se nejvíce využívá při průkazu meziotemporální sklerózy, kortikálních tuberů nebo fokální kortikální dysplazie. Možnost MR dále rozšiřuje tzv. 3D zobrazení (třírozměrné, volumetrické), kdy lze ze získaných obrazových dat bez potřeby dalšího vyšetřování a ve srovnatelné kvalitě obdržet vrstvy v libovolných rovinách. Pomocí 3D T1W lze provést i měření objemu hipokampů – volumetrii. Výtěžnost MR vyšetření ovlivňuje i aplikace kontrastní látky, její rutinní použití není u epileptických pacientů s výjimkou podezření na tumorozní, event. zánětlivou etiologii nutné [14,15]. Nezbytná je i znalost základních artefaktů MR obrazu, které zobrazování MR doprovázejí a které mohou vést k chybné nebo nepřesné geometrické či anatomické prezentaci skutečnosti, jako jsou pohybové artefakty způsobené pulzací cév a tokem mozkomíšního moku, artefakty z rozhraní voda/ tuk – tzv. chemický posun a artefakty způsobené magnetickou susceptibilitou. Susceptibilního efektu se s výhodou využívá při detekci drobných dep hemosiderinu jako konečného degradačního produktu hemoglobinu po často nepatrných zakrváceních, např. do kavernomů, nebo potraumatické krvácení. Z tohoto důvodu je vhodné do vyšetřovacího algoritmu u pacientů s epilepsií zařadit i T2* GE(GRE) sekvenci. Využití MR omezují obecné kontraindikace MR vyšetření, jako jsou kovové feromagnetické předměty v těle pacienta, stimulátory různého typu (i vagové). Rutinní vyšetřovací protokol mozku obecně zahrnuje základní sekvence používané na většině pracovišť (T2 a PD TSE (FSE) transverzálně, T1 SE sagitálně, T2 FLAIR (TIRM) transverzálně, event. T2 TSE (FSE) koronárně, DWI (Diffusion Weighted Imaging), ADC mapping. Speciální protokoly pro vyšetřování pacientů s epilepsií obsahují navíc sekvence T2 TSE v rovině kolmé na podélnou osu temporálních laloků, cílené na amygdalohipokampální komplexy k detekci patologického zvýšení intenzity signálu (obr. 1), T2 FLAIR (TIRM) ve stejné rovině, T2* GE(GRE) citlivé na depa hemosiderinu, 3D sekvence typu T1 FSPGR a v případě potřeby detailního anatomického zhodnocení poruch gyrifikace a migrace i T1 inverzní sekvence.
U strukturálních patologií, které nelze zobrazit pomocí standardního MR, můžeme využít matematické modely k detekci morfologicky změněné tkáně a zvýšit tak citlivost vyšetření. K analytickým metodám, které můžeme využít, patři voxel‑based morfometrie (VBM), kurvilineární model a metoda junctions [16]. VBM je statistická kvantitativní analytická metoda, která umožňuje detekovat lokální i globální změny objemu či koncentrace bílé a šedé hmoty [17] a je využitelná u pacientů, u kterých nelze zobrazit strukturální lézi na konvenčním MR. Kurvilineární modelováni kortexu 3D MR snímku slouží k zobrazení struktury mozkových gyrů, anatomické konvexity hemisfér a může pomoci přesně určit anatomickou lokalizaci strukturálních abnormalit, čímž zlepšuje identifikaci jemných odchylek gyrifikace ve smyslu dysplazie anebo polymikrogyrie [18].
Za předpokladu standardního technického vybavení rozhoduje o výtěžnosti MR vyšetření především subjektivní faktor – vhodně zvolený protokol a zkušenost – erudice hodnotícího neuroradiologa podílejícího se na akvizici a interpretaci obrazových dat.
Standardní MR vyšetření, které je provedeno v axiální rovině a odečítáno nedostatečně erudovaným radiologem, jenž nemá zkušenosti s vyšetřováním epilepsie, vede k přehlédnutí více než 50 % fokálních epileptogenních lézí [19].
MR obraz nejčastějších patologických nálezů pacientů s farmakorezistentní epilepsií
Epileptogenní léze mají velmi různorodý charakter. Jedná se o léze vrozené i získané, nejčastěji se objevují v korové oblasti, ve frontálních a temporálních lalocích. Zatímco u dospělých je nejběžnějším nálezem obraz hipokampální nebo meziotemporální sklerózy, u dětí dominuje nález fokální kortikální dysplazie.
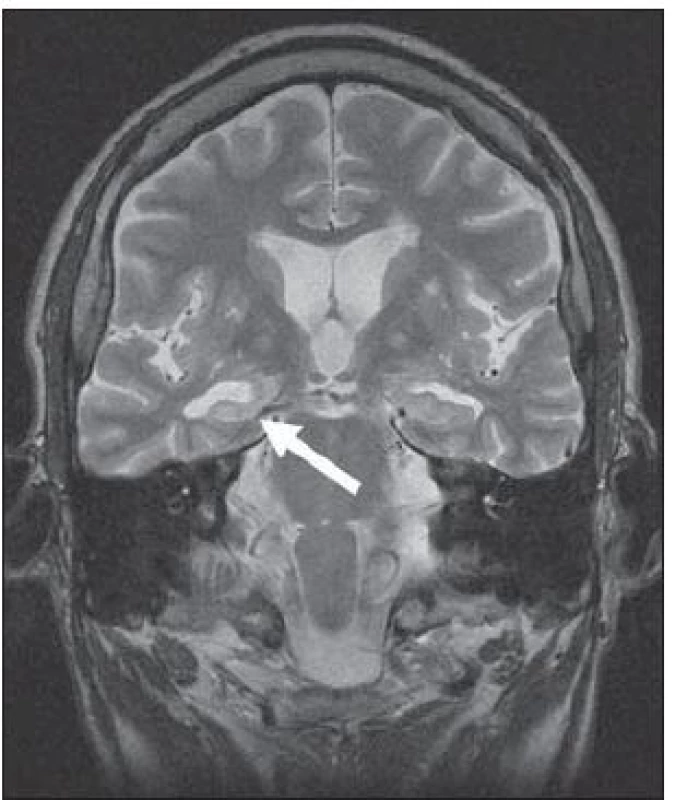
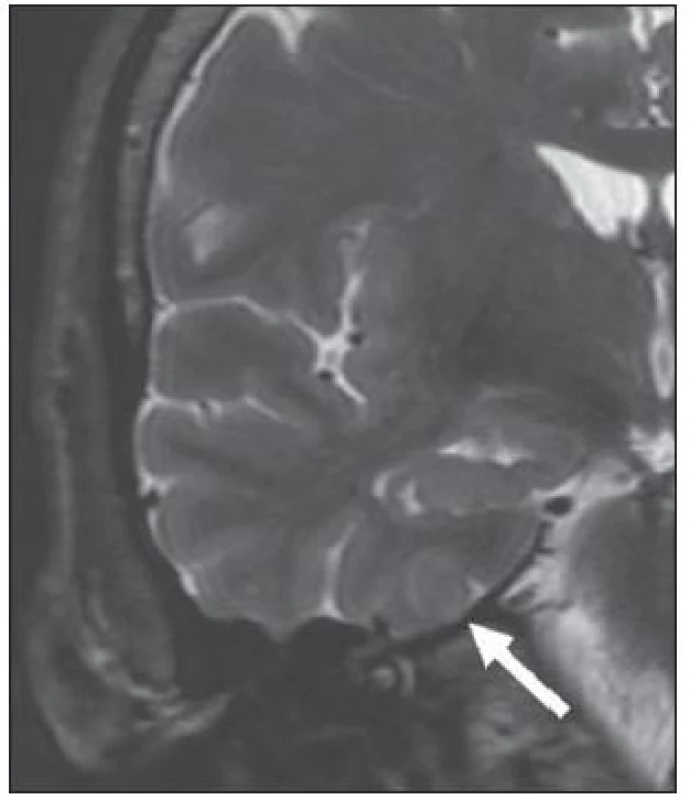
Meziotemporální skleróza (MTS) je nejčastější patologie, která si vyžádá epileptochirurgický výkon. Jedná se o gliózu, k níž typicky dochází po ztrátě neuronů (zejména pyramidových buněk) v cornu Ammonis – části hipokampu [20]. Při změnách limitovaných pouze na hipokampus hovoříme o hipokampální skleróze (HS). Pokud charakteristické změny postihují i jiné meziotemporální struktury (nejčastěji přilehlou entorinální kůru a amygdalu), používáme raději označení meziotemporální skleróza. Zavedení MR do rutinní diagnostiky významně zlepšilo detekci tohoto onemocnění. MR prokazuje velmi vysokou senzitivitu (až 95 %). Jako nejpřínosnější se ukazují koronární T2 SE (TSE) a FLAIR sekvence s tenkými vrstvami (2– 3 mm), na nichž jsou nejlépe patrné typické znaky HS/ MTS, obr. 1:
- hipokampus s vyšším signálem v T2W a FLAIR obrazech,
- redukce objemu a oploštění hipokampu (patrné při úbytku > 50 % počtu neuronů),
- setření vnitřní struktury hipokampu,
- rozšíření temporálního rohu postranní komory a chorioidální fisury.
Dále můžeme prokázat:
- setření rozdílu v intenzitě signálu mezi bílou a šedou hmotou v temporálním laloku, zvláště v jeho ventrálním pólu,
- celkové zmenšení temporálního laloku,
- nižší obsah NAA v MRS.
Za základní etiopatogenetický moment jsou v současné době považovány prolongované opakované, případně lateralizované febrilní záchvaty v dětství, které vedou k hypoxii, na niž jsou zvláště některé oblasti meziálního kortexu velmi citlivé [21]. Z tohoto hlediska by se jednalo o získané onemocnění. Situace je však složitější. Část pacientů s MTS může trpět vývojovou abnormalitou hipokampu a u nich pak patologie nemusí být omezena jen na hipokampus a jeho okolí, ale obvykle se dysgenetické změny mohou vyskytovat i jinde v temporálním laloku a rovněž i extratemporálně. Tato tzv. duální patologie je poměrně častá. U pacientů s MTS je popisována až v 15 % případů a její průkaz má zásadní vliv na zvolení správné léčebné strategie. Existuje i bilaterální postižení hipokampů, jehož MR diagnostika je obtížnější, protože se nemůžeme opírat o srovnání s kontralaterálním nálezem. Oboustranná HS může být důsledkem neuroinfekce, traumatu či hypoxie. Další patologií je hipokampální malrotace (HIMAL). Jedná se o poruchu hipokampálního utváření, která se objevuje v průběhu fetálního vývoje. Hipokampus je inkompletně rotován, má normální velikost a intenzitu signálu v MR obraze, je však abnormálně zaoblený. Ve všech rovinách má stejný rozměr a má setřelou vnitřní strukturu. Současně je patrná atypie ipsilaterálního kolaterálního sulku, který je uložen více vertikálně a bývá pozorována i atypická pozice a velikost fornixu [22]. Další častou příčinou epilepsie jsou vrozené vývojové vady mozku, zvl. poruchy vývoje mozkové kůry. Tvoří rozsáhlou a poměrně různorodou skupinu poruch s variabilní prognózou. Jejich rozsah kolísá od diskrétních mikroskopických změn nedetekovatelných zobrazovacími metodami až po rozsáhlé komplexní malformace.
Podle současné klasifikace se rozdělují na poruchy buněčné proliferace nebo apoptózy (mikroencefalie, megalencefalie, fokální kortikální dysplazie, tuberózní skleróza, hemimegalencefalie, gangliogliom, gangliocytom, tumory typu DNET), poruchy neuronální migrace (heterotopie šedé hmoty, lissencefalie) a poruchy kortikální organizace (polymikrogyrie a schizencefalie, mikrodysgeneze) [23].
Mikroencefalie je těžká vývojová porucha projevující se zakrněním (primární mikroencefalie) či předčasným ukončením (sekundární mikroencefalie) růstu mozku a obvykle i celé hlavy. Nejvíce bývá vyjádřeno postižení předního mozku s vyhlazením a redukcí počtu sulků.
Megalencefalie je definována jako částečně nebo kompletní zvětšení jedné nebo obou mozkových hemisfér. V MR obraze je typické zesílení kortexu s dilatací stejnostranné postranní komory.
Fokální kortikální dysplazie (FCD) je nejčastější příčinou farmakorezistentní epilepsie u dětí a až u 20 % dospělých. Aktuální klasifikace z roku 2011 podle ILAE je obsažena v tab. 1.
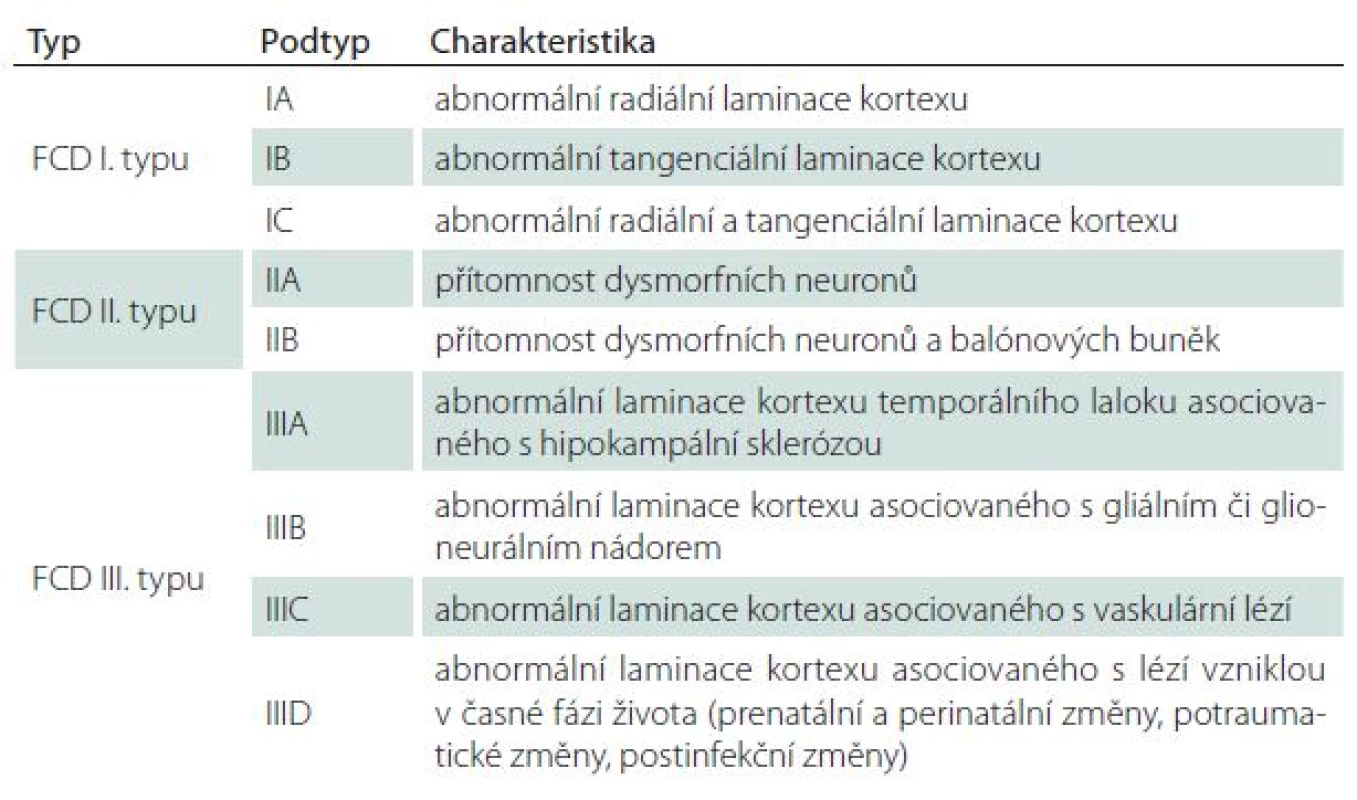
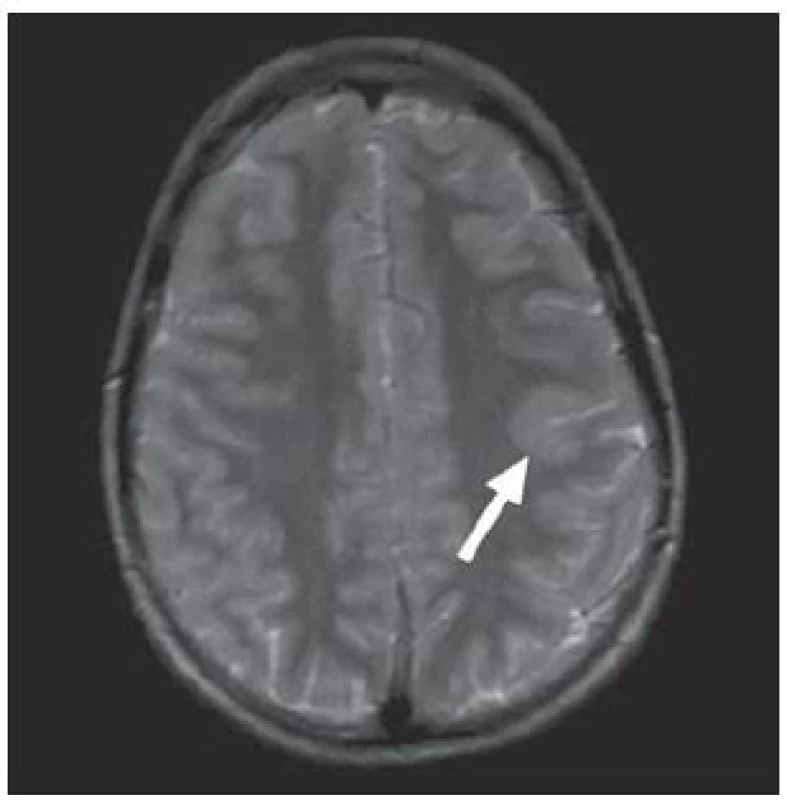
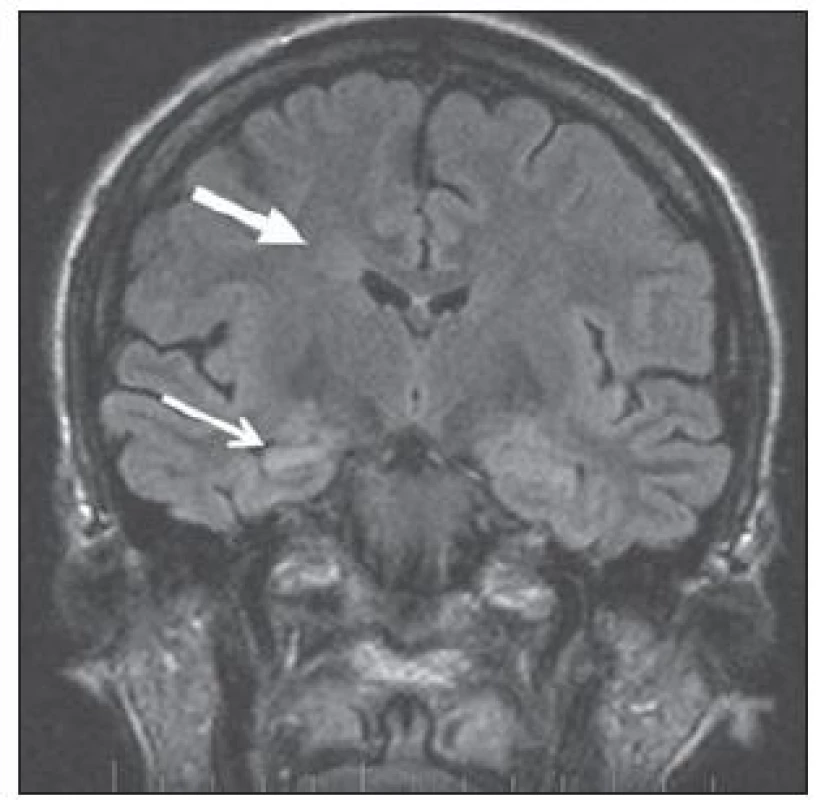
V MR je pro typ I typické setření hranice šedé a bílé hmoty, zvýšení signálu subkortikální bílé hmoty a oblasti kortikosubkortikální junkce na T2W a zejména FLAIR sekvenci s regionální redukcí objemu bílé hmoty, obr. 2. U fokální kortikální dysplazie typu II lze na MR navíc prokázat ztluštění kortexu a určité nepravidelnosti gyrifikace [24]. V některých případech může být patrný abnormální signál propagující se od kortexu ke komorovému systému, obr. 3.
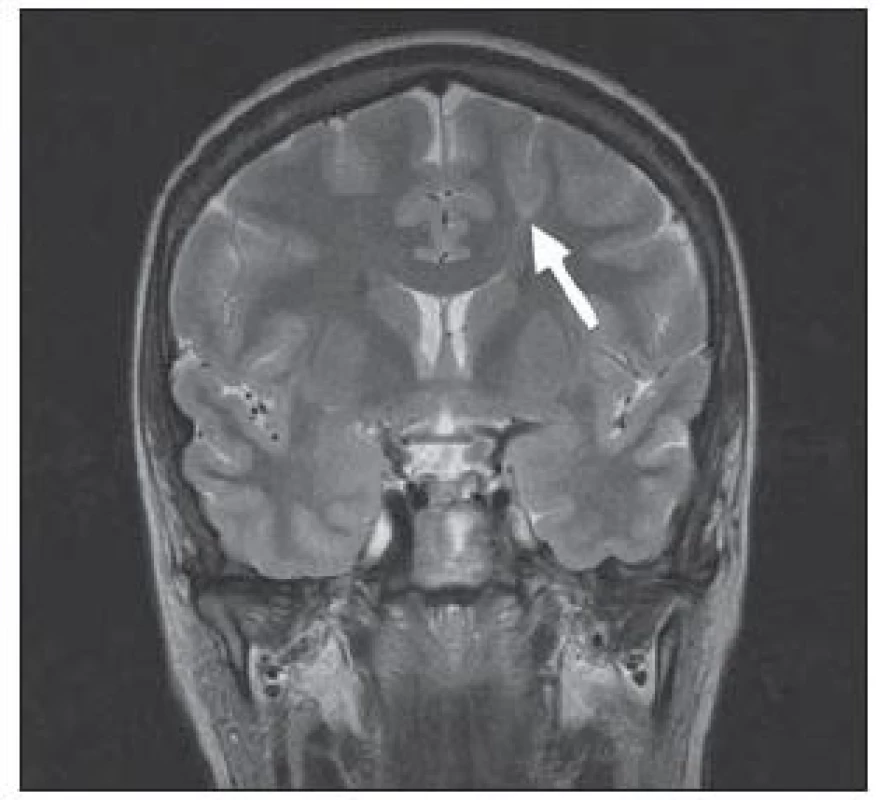
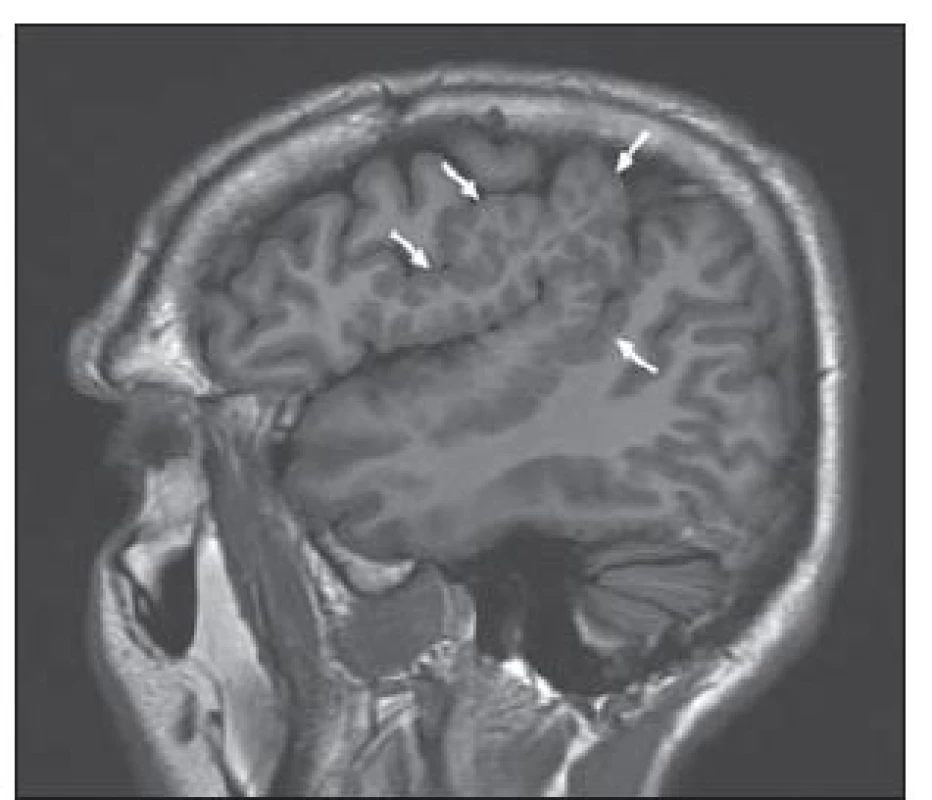
Tuberózní skleróza je autozomálně dědičné onemocnění s incidencí 1 na 6 000 porodů řazené mezi fakomatózy [25]. Kortikální tubery obsahují dysmorfní neurony a zvláště početné balónovité buňky, které se shlukují do skupin. Na MR jsou tyto kortikální a subkortikální léze (tubery) hyperintenzní v T2W a postižené gyry bývají zbytnělé se změnami i bílé hmoty, obr. 4. Strukturálně podobné subependymální hamartomy jsou zase často kalcifikované, obr. 5. U pacientů s tuberozní sklerózou můžeme na MR prokázat i subependymální obrovskobuněčné astrocytomy a kortikální heterotopii.
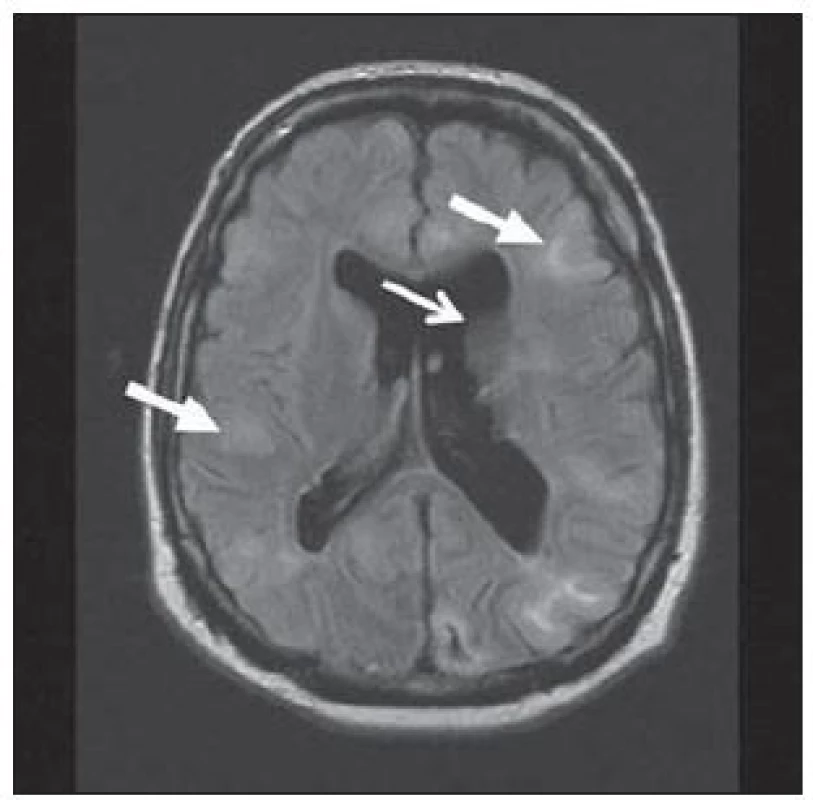
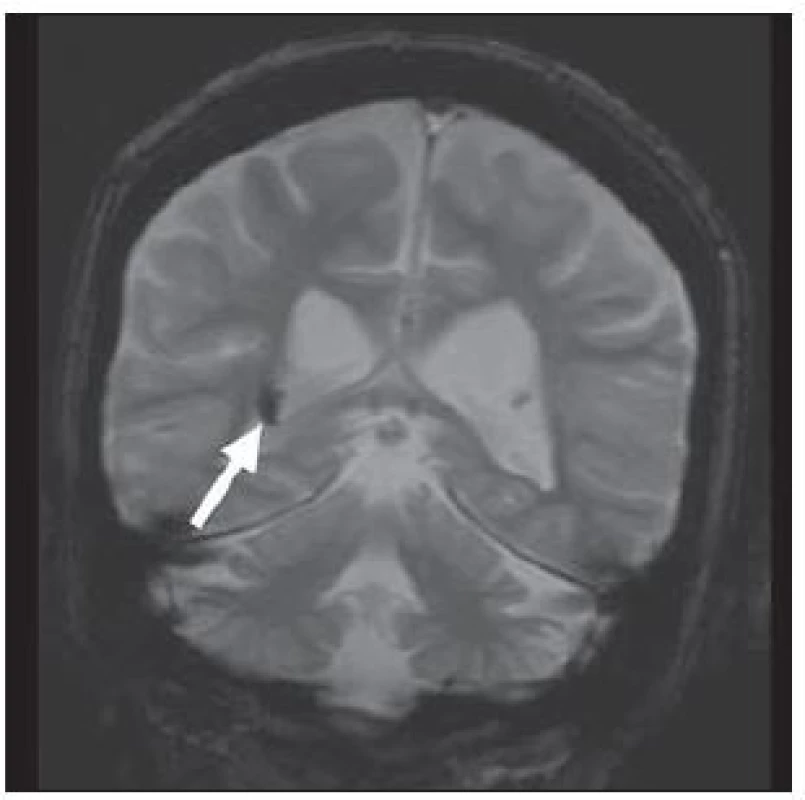
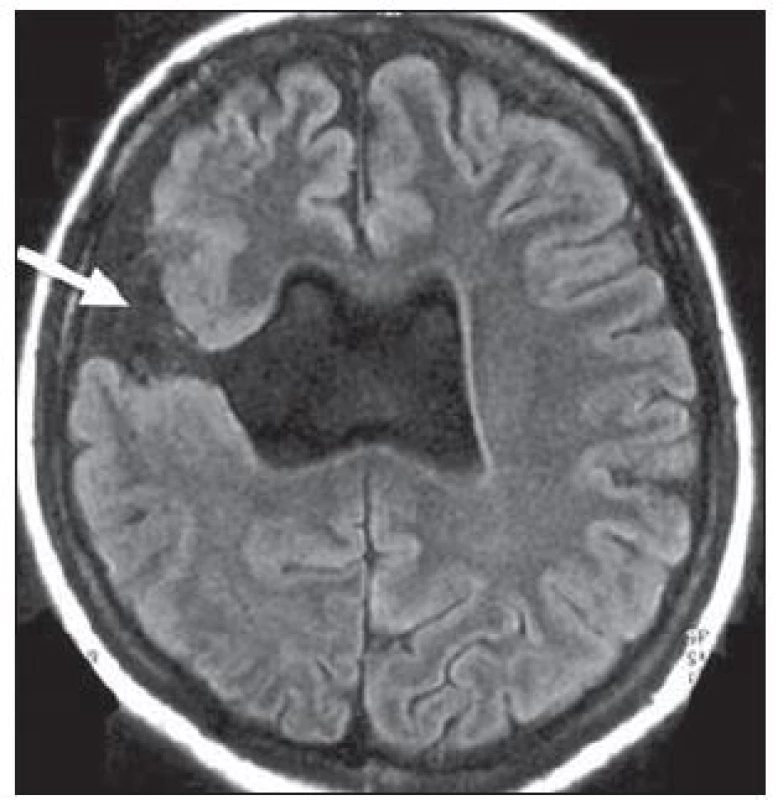
U hemimegalencefalie prokazujeme nápadné zvětšení a hamartomatózní přestavbu celé hemisféry nebo její větší části. Ve tkáni této hemisféry nacházíme nápadné změny ze spektra migračních anomálií – fokální kortikální dysplazie, polymikrogyrie, abnormity bílé hmoty, heterotopie, obr. 6 [26]. Povšechná hyperplazie hemisféry vede ke středočárovému přesunu k normální straně. Stejnostranná postranní komora bývá rozšířena, nezřídka s elongovaným frontálním rohem. Je patrná i abnormní gyrifikace a změny signálu bílé hmoty.
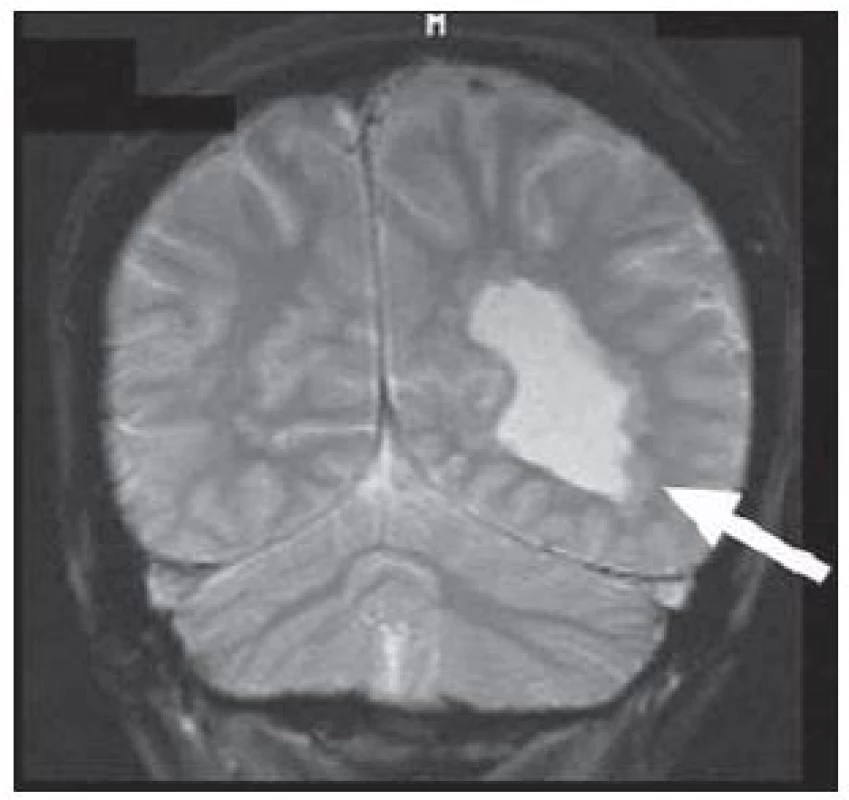
Nádory jsou dalším poměrně častým nálezem v mozkové tkáni resekované pro refrakterní epilepsii. Nádory vyskytující se u pacientů s epilepsií mají několik společných rysů. Většinou jsou pomalu rostoucí s nízkou proliferační aktivitou a nízkým maligním potenciálem. Poměrně často se jedná o jinak vzácné tumory s neuronální složkou, tedy nádory neuronální a smíšené glioneuronální. Mezi takové patří například dysembryoplastický neuroepiteliální tumor (DNET) (obr. 7), gangliocytom nebo gangliogliom, obr. 8. Mnohdy jsou tyto nádory sdruženy s fokálními kortikálními dysplaziemi (např. DNET téměř ve 100 % a gangliogliom asi ve 30 %). Typická je pro ně kortikální lokalizace a velmi často se vyskytují v temporálním laloku [27]. Tvoří ohraničené uzly, které mají obecně zvýšený signál na T2W a snížený v T1W. Jejich struktura bývá nezřídka heterogenní, často s cystickou složkou či kalcifikacemi. Rozsah postkontrastního sycení je různý a kolaterální edém u nich chybí.
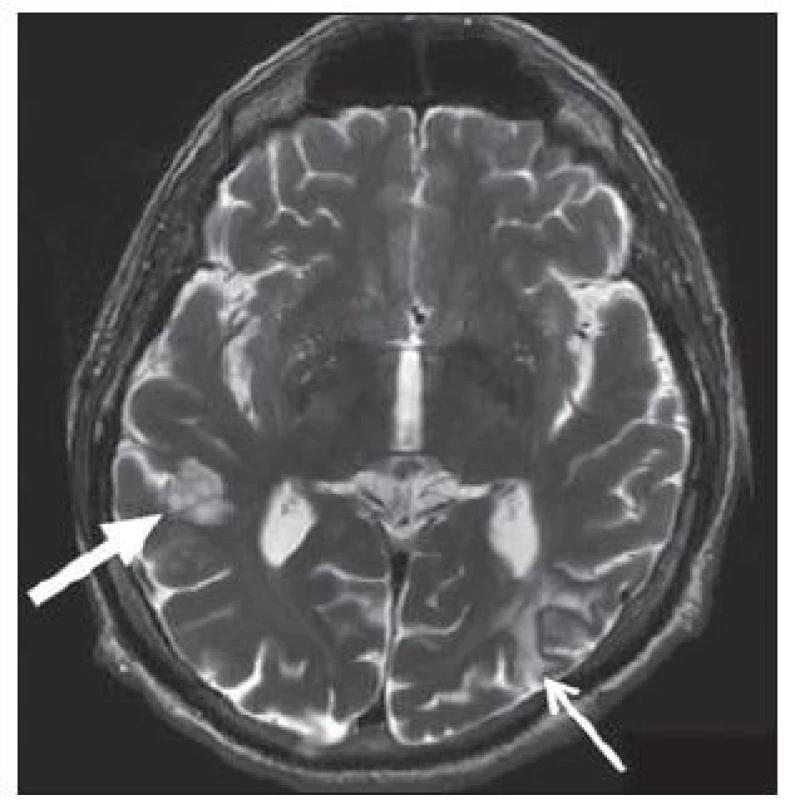
Jako heterotopie se označují poměrně ostře ohraničené ostrůvky šedé hmoty, které v průběhu neuronální migrace „nedoputovaly“ až do kortexu. Jedná se o zralé nervové buňky, které svým vzhledem připomínají spíše kortikální neurony než neurony hluboké šedi a mohou být protknuty svazky myelinizovaných vláken. Podle lokalizace rozlišujeme periventrikulární, subkortikální nebo subpiální (leptomeningeální) heterotopie. Podle tvaru pak heterotopie nodulární a laminární (pruhovité). Uzlíky či pruhy heterotopické tkáně jsou ve všech sekvencích izointenzní s mozkovým kortexem [28]. Periventrikulárně uložené heterotopie mívají nodulární tvar, obr. 9. Izolované heterotopie v této oblasti jsou nedědičné. Někdy se setkáme s obrazem bilaterální periventrikulární heterotopie, kdy heterotopie vytvářejí více či méně symetrický „růženec“ uzlíků, které prominují do lumen postranních komor. Subkortikální heterotopie se často kombinují s fokální kortikální dysplazií. Zvláštní formou pruhovité heterotopie je subkortikální laminární heterotopie (někdy nesprávně označovaná jako „double cortex“). Může se jednat o frustní vyjádření lissencefalie. Pásy šedé hmoty leží těsně pod kortexem, od něhož je dělí proužek bílé hmoty. Heterotopie může lemovat celý obvod hemisfér, někdy jen frontální nebo parieto‑ okcipitální oblasti.
Lissencefalie představuje anomální gyrifikaci, která může být zcela vyhlazená (agyrie), nebo pouze zhrubělá s plochými a ztluštělými gyry (pachygyrie) [23]. Korová vrstva je silná, ale obsahuje pouze čtyři vrstvy neuronů. Naopak objem bílé hmoty je redukovaný. Lissencefalii nezřídka provázejí další anomálie, jako heterotopie, pasivní rozšíření komor a ageneze corpus callosum. Sylviovy rýhy jsou široce rozevřené a v axiálních řezech připomíná tvar mozku číslo osm. Nejlépe v sekvenci IR (Inversion Recovery) lze případně detekovat vrstvu heterotopických neuronů oddělenou od vlastního kortexu proužkem tenké, na buňky chudé bílé hmoty. U lissencefalie typu 2 (angl. cobblestone dysplasia) může být v různé míře kromě poruchy gyrifikace vyjádřena i hypogeneze kmene, hypogeneze či polymikrogyrie mozečku, anomálie bílé hmoty nebo hydrocefalus.
Mezi poruchy gyrifikace patří také polymikrogyrie, malformace kortikálního vývoje, charakterizovaná zmnoženými malými gyry, oddělenými plytkými sulky, obr. 10 [18]. Ve své ložiskové formě se objevuje zpravidla perisylvicky či perirolandicky. V MR obraze působí postižené oblasti kortexu zesíleným dojmem, se setřelou hranicí mezi šedou a bílou hmotou, v přilehlé bílé hmotě mohou být patrné okrsky gliózy a rozšířené subarachnoidální prostory v okolí léze. V tenkých T1W vrstvách lze někdy identifikovat drobné gyry. U některých jedinců postihuje polymikrogyrie symetricky obě hemisféry. V některých případech může být složité odlišit pachygyrii a polymikrogyrii. Znaky, kterými se tyto dvě patologie liší, jsou: 1. povrch kortexu je u pachygyrie hladký, u polymikrogyrie nepravidelný; 2. hranice mezi bílou a šedou hmotou je hladká u pachygyrie a nerovná u pacientů s polymikrogyrií; 3. tloušťka kortexu je variabilní u polymikrogyrie, u pachygyrie je abnormálně ztluštělá [29].
Schizencefalii charakterizuje likvorem vyplněný defekt – rozštěp hemisféry, spojující postranní komoru se subarachnoidálním prostorem zevně na konvexitě. Štěrbinovité (close lip) nebo široce otevřené až cystické (open lip) defekty (obr. 11) se objevují nejčastěji v centrální oblasti hemisfér a jsou lemovány více či méně změněnou korovou vrstvou, často polymikrogyricky utvářenou. Postižení může být jednostranné anebo oboustranné s různým stupněm symetrie. Zvláště cystická forma se velmi často sdružuje s absencí septum pellucidum. Jednostranná schizencefalie může provázet FCD v kontralaterální hemisféře.
Arteriovenózní malformace také bývají spojeny s rozvojem epilepsie. Příčinou bývá pravděpodobně glióza a ztráta neuronů v přilehlých oblastech v důsledku ischemických změn na podkladě steal fenoménu a excitotoxicity depozit hemosiderinu po prokrvácení.
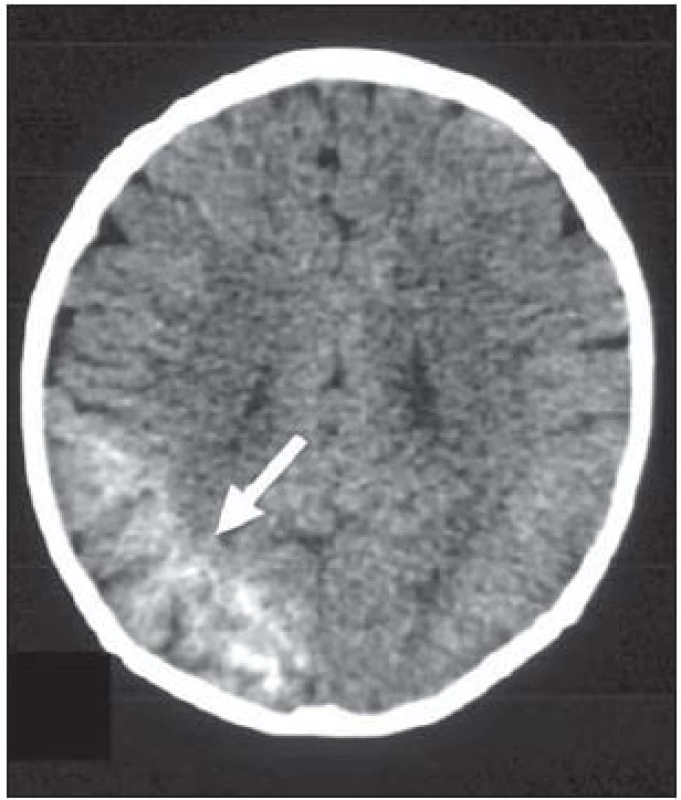
Cerebrovaskulární malformace – u pacientů s epilepsií je nejčastější nález kavernomů (kavernózních angiomů), zvláště v kortikální lokalizaci. Jejich MR obraz je poměrně patognomický – jedná se většinou o dobře ohraničené léze smíšeného signálu, se středem nehomogenně hyperintenzním, připomínajícím „popcorn“, a lemem nízkého signálu podmíněným depozity hemosiderinu. Tento lem nejvíce vynikne na T2* GE, na kterých poměrně často prokážeme i další drobnější kavernomy (asi v 50 % bývají vícečetné) [30]. Typický je familiární výskyt kavernomů a mohou se vyskytovat současně s venózním angiomem. Farmakorezistentními epileptickými záchvaty se projevuje i Sturgeův‑ Weberův syndrom s kapilárně‑venózními angiomy nejčastěji v parieto‑ okcipitální korové oblasti, obr. 12. Chronická ischemizace v důsledku krevní stázy vede ke kortikální atrofii a v přilehlé bílé hmotě mohou být změny ve smyslu gliózy, které se projeví hyperintenzitou v T2W. Krevní stáza postupně vede ke kalcifikacím a laminární kortikální nekróze. Typické povrchové gyriformní kalcifikace jsou lépe patrné na CT, na MR jsou k jejich detekci nejvhodnější gradientní sekvence [31].
Záněty – epilepsie se může objevit již v průběhu zánětlivého procesu mozku (meningoencefalitidy, encefalitidy, mozkového abscesu i granulomatózních zánětů), ale hlavně jako jejich následek. Vysoké riziko rozvoje epileptických záchvatů je na rozdíl od aseptické meningitidy zvláště u pacientů s trvalým neurologickým deficitem po proběhlé bakteriální hnisavé meningitidě, u kterých bývá fibrózní ztluštění mozkových plen a po odeznění edematózního prosaku následná nepravidelná glióza v přilehlé kůře [16]. U Rassmussenova syndromu (chronická fokální encefalitida) prokazujeme progresivní atrofii a gliózu, která může postihovat různě velké oblasti hemisféry až hemisféru celou.
Traumata – kraniocerebrální poranění je také jednou z možných příčin vzniku epilepsie, riziko jejího rozvoje závisí hlavně na závažnosti a typu traumatu. Vznik epilepsie je pravděpodobně důsledkem kombinace různých faktorů, hlavně reparativní gliové reakce v okolí, která může změnit elektrofyziologické poměry v postižené oblasti, a přítomnosti iontů železa uvolněného z hematomu. K odlišení vlastního defektu kortexu od okolního edému či gliózy nejvíce přispěje sekvence FLAIR. Pomocí T2* GE sekvencí můžeme v případě kontuzně‑hemoragických ložisek zase nejlépe prokázat prokrvácení. K narušení kortexu, a tedy k epileptickým záchvatům mohou vést i postischemické změny [32].
Závěr
Díky výraznému technickému pokroku MR přístrojů a správně zvolenému akvizičnímu protokolu jsme schopni identifikovat velké množství strukturálních lézí, které jsou podkladem epileptických záchvatů. Jejich detekce má význam také pro plánovaní epileptochirurgické resekce u pacientů s farmakorezistentní epilepsií.
Neméně důležitým faktorem, který ovlivňuje výtěžnost MR vyšetření u pacientů s epilepsií, je erudice vyšetřujícího neuroradiologa. Nezbytná je také spolupráce s ošetřujícím neurologem, který může dodat cenné informace o možné topizaci léze z klinických neurologických vyšetření.
Podpořeno z Evropského regionálního rozvojového fondu – Projekt FNUSA – ICRC (CZ.1.05/ 1.1.00/ 02.0123), Evropského sociálního fondu a státního rozpočtu České republiky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 12. 5. 2015
Přijato do tisku: 18. 6. 2015
MUDr. Petra Cimflová
Klinika zobrazovacích metod
LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: cimflova.petra@fnusa.cz
Zdroje
1. Ošlejšková H. Klinické projevy a specifika léčby epileptických záchvatů v dětství a adoslescenci. Postgrad Med 2009; 9: 962– 972.
2. Wallace JS, Farell K et al. Epilepsy in Children. 2nd ed. London: Arnold 2004.
3. Brázdil M, Hadač J, Marušic P et al. Farmakorezistentní epilepsie. Triton: Praha 2004.
4. Rektor I, Ošlejšková H. Stručná epileptologie pro praxi. Neurol Prax 2010; 11 (Suppl 3): 5– 44.
5. Arroyo S. Evaluation of drug‑resistant epilepsy. Rev Neurol 2000; 30(9): 881– 886.
6. Krijtová H, Marusič P. První epileptický záchvat – diagnostický postup a indikace k zahájení terapie. Neurol Praxi 2010; 11(6): 386– 390.
7. King MA, Newton MR, Jackson GD, Fitt GJ, Mitchell LA, Silvapulle MJ et al. Epileptology of the first‑ seizure presentation: a clinical, electroencephalographic, and magnetic resonance imaging study of 300 consecutive patients. Lancet 1998; 352(9133): 1007– 1011.
8. Latchaw RE, Kucharczyk J, Moseley ME. Imaging of the nervous system, diagnostic and therapeutic applications. Philadelphia, PA: Elsevier– Mosby 2005.
9. Hugg JW, Butterworth EJ, Kuznieck RI. Diffusion mapping applied to mesial temporal lobe epilepsy: preliminary observations. Neurology 1999; 53(1): 173– 176.
10. Li LM, Cendes F, Bastos AC, Andermann F, Dubeau F,Arnold DL. Neuronal metabolic dysfunction in patients with cortical developmental malformations: a proton magnetic resonance study. Neurology 1998; 50(3): 755– 759.
11. Limotai C, Mirsattari SM. Role of functional MRI in presurgical evaluation of memory function in temporal lobe epilepsy. Epilepsy Res Treat 2012; 2012: 687219. doi: 10.1155/ 2012/ 687219.
12. Winston GP, Daga P, Stretton J, Modat M, Symms MR, McEvoy AW et al. Optic radiation tractography and vision in anterior temporal lobe resection. Ann Neurol 2012; 71(3): 334– 341. doi: 10.1002/ ana.22619.
13. Basser PJ, Pierpaoli C. Microstructural and physiological features of tissues elucidated by quantitative‑ diffusion- tensor MRI. J Magn Reson 2011; 213(2): 560– 570. doi: 10.1016/ j.jmr.2011.09.022.
14. Kwan P, Brodie M. Early identification of refractory epilepsy. N Engl J Med 2000; 342: 314– 319.
15. Vanicek J, Stastnik M, Kianicka B, Bares M, Bulik M. Rare neurological presentation of human granulocytic anaplasmosis. Eur J Neurol 2013; 20(5): e70– e72. doi: 10.1111/ ene.12110.
16. Pail M, Mareček R, Brázdil M. Analytické zpracování MR obrazů v diagnostice farmakoresistentní epilepsie. Neurol Praxi 2012; 13(2): 87– 91.
17. Ashburner J, Friston K. Voxel‑based morphometry – the methods. Neuroimage 2000; 11(1): 805– 821.
18. Mavili E, Coskun A, Per H, Donmez H, Kumandas S, Yikilmaz A. Polymicrogyria: correlation of magnetic resonance imaging and clinical findings. Childs Nerv Syst 2012; 28(6): 905– 909. doi: 10.1007/ s00381‑ 012‑ 1703‑ 2.
19. Von Oertzen J, Urbach H, Jungbluth S, Kurthen M, Reuber M, Fernandez G et al. Standard magnetic resonance imaging inadeaqute for patients with refractory focal epilepsy. J Neurol Neurosurg Psychiatry 2002; 73(6): 643– 647.
20. Wieser HG. ILAE Commission Report. Mesial temporal lobe epilepsy with hippocampal sclerosis. Epilepsia 2004; 45(6): 695– 714.
21. Riney CJ, Harding B, Harkness WJ, Scott RC, Cross JH. Hippocampal sclerosis in children with lesional epilepsy is influenced by age at seizure onset. Epilepsia 2006; 47(1): 159– 166.
22. Gamss RP, Slasky SE, Bello JA, Miller TS, Shinnar S. Prevalence of hippocampal malrotation in a population without seizures. AJNR Am J Neuroradiol 2009; 30(8): 1571– 1573. doi: 10.3174/ ajnr.A1657.
23. Barkovich AJ, Dobyns WB, Guerrini R. MR of neuronal migration abnormalities. Cold Spring Harb Perspect Med 2015; 5(5): pii: a022392. doi: 10.1101/ cshperspect.a022392.
24. Tassi L, Colombo N, Garbelli R, Francione S, Lo Russo G, Mai R et al. Focal cotical dysplasia: neuropathological subtypes, EEG, neuroimaging and surgical outcome. Brain 2002; 125(8): 1719– 1732.
25. Kwiatkowski DJ, Manning BD. Tuberous sclerosis: a GAP at the crossroads of multiple signaling pathway. Hum Mol Genet 2005; 14(2): R251– R258.
26. Santos AC, Escorsi‑ Rosset S, Simao GN, Terra VC, Velasco T, Neder L et al. Hemispheric dysplasia and hemimegalencephaly: imaging definitions. Pediatr Neurol 2014; 51(1): 178– 180. doi: 10.1007/ s00381‑ 014‑ 2476‑ 6.
27. García‑ Fernández M, Fournier‑ Del Castillo C, Ugalde‑ Canitrot A, Pérez‑ Jiménez Á, Álvarez‑ Linera J, De Prada‑ Vicente I et al. Epilepsy surgery in children with developmental tumours. Seizure 2011; 20(8): 616– 627. doi: 10.1016/ j.seizure.2011.06.003.
28. Nalbantoglu M, Erturk‑ Cetin O, Gozubatik Celik G, Demirbilek V. The diagnosis of band heterotopia. Pediatric Neurology 2014; 51(1): 178– 180. doi: 10.1016/ j.pediatrneurol.2014.02.018.
29. Raybaud C, Canto‑ Morein N, Girard N, Poncet M. Polymicrogyria. MR appearance and its relantionship to fetal development of the cortex and its microvasculare. Int J Neuroradiol 2012; 1: 161– 170.
30. Moran NF, Fish DR, Kitechen N, Shorvon S, Kendall BE,Stevens JM. Supratentorial cavernous haemangiomas and epilepsy: a review of the literature and case series. J Neurol Neurosurg Psychiatry 1999; 66(5): 561– 568.
31. Thomas‑ Sohl KA, Vaslow DF, Maria BL. Sturge‑ Weber syndrome: a review. Pediatr Neurol 2004; 30(5): 303– 310.
32. Vanicek J, Bulik M, Brichta J, Jancalek R. Utility of a rescue endovascular therapy for the treatment of major strokes refractory to full‑dose intravenous thrombolysis. Br J Radiol 2014; 87(1036): 20130545. doi: 10.1259/ bjr.20130545.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2015 Číslo 4
Nejčtenější v tomto čísle
- Léčba pudendální neuralgie – klinické zkušenosti po pěti letech
- Význam magnetické rezonance v diagnostice epilepsie
- Experimentální léčba poranění míchy
- Léčba foraminálního výhřezu meziobratlové ploténky u istmické spondylolistézy technikou TLIF
