Využití elektromagnetické navigace při léčbě hydrocefalu a arachnoidálních cyst u dětí do jednoho roku věku
The Use of Electromagnetic Navigation in Surgeries for Hydrocephalus and Arachnoid Cysts in Children under One Year of Age
Aim:
Surgery for hydrocephalus and arachnoid cysts in small children is still burdened with a high complication rate. Our five-years of experience with the electromagnetic navigation used in surgeries on children under one year of age, is to be presented in the form of a retrospective study.
Material and method:
We were using the electromagnetic navigation in surgeries for hydrocephalus and arachnoid cysts in 30 consecutive children with an average age of 15.3 weeks (one week– 11 months) in our department from January 2009 till December 2013. We performed 19 ventriculoperitoneal shunts, one ventriculoatrial, four endoscopic third ventriculostomies, two cavum septi pellucidi stomies, two arachnoid cyst endoscopic fenestrations and two combined procedures – endoscopic fenestrations and a shunt surgery in one session.
Results:
We always inserted the ventricular catheter into the desired place on the first attempt in our group of patients. We didn’t detect any technical problem which would have led to an inappropriate navigational deviation and, therefore made the next navigation impossible. All patients had a checkup after surgery (by ultrasound through an anterior fontanel or magnetic resonance imaging). A ventricular catheter malfunction (always blocked by choroid plexus) was detected in four patients (18.2%), a shunt infection appeared in one patient (4.5%). A one year “shunt survival rate” appears in 58.8% of our patients. We had to re-operate on two patients after the endoscopic surgery (20%) due to stoma failure and on one patient for liquorrhea.
Conclusions:
Electromagnetic navigation has enabled us to perform shunt and endoscopic surgeries for hydrocephalus and arachnoid cyst in very young children with the same accuracy as in adult patients, without the necessity of head clamping.
Key words:
hydrocephalus – arachnoid cyst – surgical treatment – electromagnetic navigation –endoscope
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
P. Vacek; D. Štěpánek; V. Přibáň
Působiště autorů:
Neurochirurgické oddělení, LF UK a FN Plzeň
Vyšlo v časopise:
Cesk Slov Neurol N 2014; 77/110(6): 741-746
Kategorie:
Krátké sdělení
Podpořeno MZ ČR- RVO (Fakultní nemocnice Plzeň – PNPI, 00669806).
Souhrn
Cíl:
Operační výkony pro hydrocefalus a arachnoidální cysty u malých dětí jsou stále zatíženy nemalým procentem komplikací. Formou retrospektivní studie prezentujeme naše pětileté zkušenosti s využitím elektromagnetické neuronavigace při těchto výkonech u dětí do jednoho roku věku.
Soubor a metodika:
Od ledna 2009 do prosince 2013 jsme na našem pracovišti použili elektromagnetickou neuronavigaci při operaci hydrocefalu nebo arachnoidální cysty u celkem 30 dětí průměrného věku 15,3 týdne (jeden týden– 11 měsíců). Provedli jsme 19 ventrikuloperitoneálních drenáží, jednu ventrikuloatriální, čtyři endoskopické ventrikulostomie třetí komory, dvě septostomie cavum septi pellucidi, dvě endoskopické fenestrace arachnoidálních cyst a dva kombinované výkony – endoskopickou fenestraci a drenážní operaci v jedné době.
Výsledky:
V souboru pacientů jsme komorový katétr nebo endoskop zavedli vždy na první pokus do požadovaného prostoru a nezaznamenali jsme žádný technický problém navigace, který by vyústil v nepřiměřenou navigační odchylku, a znemožnil tak její použití. Všichni pacienti měli po operaci grafickou kontrolu (sonograficky přes velkou fontanelu nebo magnetickou rezonanci). Malfunkci komorového katétru (vždy obturaci komorovým plexem) jsme zaznamenali u čtyř pacientů (18,2 %), infekce drenážního systému vznikla u jednoho pacienta (4,5 %). „Roční přežití“ drenážního systému bez revize je v našem souboru 58,8 %. Dva pacienty (20 %) po endoskopickém výkonu jsme reoperovali pro selhání vytvořené komunikace a jednoho (10 %) pro likvoreu.
Závěry:
Elektromagnetická neuronavigace nám umožňuje provádět i u velmi malých dětí drenážní a endoskopické operace hydrocefalu a arachnoidálních cyst se stejnou přesností intraoperačního navigování jako u dospělých pacientů, bez nutnosti pevně fixovat hlavu v tříbodovém rámu.
Klíčová slova:
hydrocefalus – arachnoidální cysta – chirurgická léčba – elektromagnetická navigace – endoskop
Seznam použitých zkratek
EMN elektromagnetická neuronavigace
ETV endoskopická ventrikulostomie třetí komory
MR magnetická rezonance
VP ventrikuloperitoneální drenáž
Úvod
Nejčastější operační výkony v dětské neurochirurgii jsou drenážní a endoskopické operace hydrocefalu a operace arachnoidálních cyst, dnes už nejčastěji rovněž endoskopickou technikou [1]. Tyto operace jsou stále zatíženy nemalým procentem technických komplikací [2,3]. Každá technická chyba při tomto typu operací přináší riziko zvýšení další morbidity pacientů a výrazně zvyšuje cenu jejich léčby [4]. Při plánování přístupu pro neuroendoskopii a při zavádění komorového katétru intrakraniálně je tedy vyžadována naprostá přesnost, proto i při těchto výkonech používáme v neurochirurgii neuronavigaci [5,6]. Díky ní můžeme přístup při endoskopii naplánovat tak, abychom dosáhli cíle ideálním koridorem postihujícím co nejméně mozkové tkáně, a při zavedení komorového katétru se snažíme jeho konec uložit co nejdále od komorového plexu. Neuronavigace ve své klasické podobě ale vyžaduje pevné upnutí hlavy, které u dětí pod dva roky není vůbec možné a i u dětí starších může být spojeno s komplikacemi (fraktury kalvy, epidurální hematomy). Pro navigování operací malých dětí byla proto vyvinuta neuronavigace elektromagnetická (EMN). Technika EMN byla poprvé popsána již v roce 1991 [7]. První komerční systémy byly schváleny FDA (Food and Drug Administration) v roce 1997 [8,9]. Studií na fantomech pak byla prokázána stejná míra přesnosti EMN jako u navigace optické [10]. K širšímu využívání EMN dochází až v několika posledních letech [11], i když oproti navigaci optické nabízí u dětí několik výhod [12]:
- hlava se nemusí pevně fixovat, a může se s ní tedy hýbat i po registraci;
- referenční senzor se na hlavu pouze lepí, rovněž nemusí být fixován šroubky;
- navigovaný nástroj nemusí být navigací „viděn“, nehrozí tedy vizuální konflikt např. s rukou operatéra, s dalším nástrojem apod.;
- pro navigování EMN jsou již kalibrovány některé nástroje, takže je lze navigovat bez upínání dalších referencí (např. mandrén pro zavádění katétrů se do katétru přímo zasune atd.).
V české literatuře zatím práce o využití EMN chybí, proto v našem sdělení prezentujeme pětileté zkušenosti s tímto typem navigace při léčbě hydrocefalu a arachnoidálních cyst u dětí do dvou let věku.
Soubor a metodika
Od ledna 2009 do prosince 2013 jsme na našem pracovišti použili EMN při operaci hydrocefalu nebo arachnoidální cysty u celkem 30 dětí ve věku od jednoho týdne do 11 měsíců. Provedli jsme 19 ventrikuloperitoneálních (VP) drenáží, jednu ventrikuloatriální, čtyři endoskopické ventrikulostomie třetí komory (ETV), dvě septostomie cavum septi pellucidi, dvě endoskopické fenestrace arachnoidálních cyst a dva kombinované výkony – endoskopickou fenestraci a drenážní operaci v jedné době. Detaily souboru pacientů jsou uvedeny v tab. 1, která je dostupná na webu časopisu (www.csnn.eu)
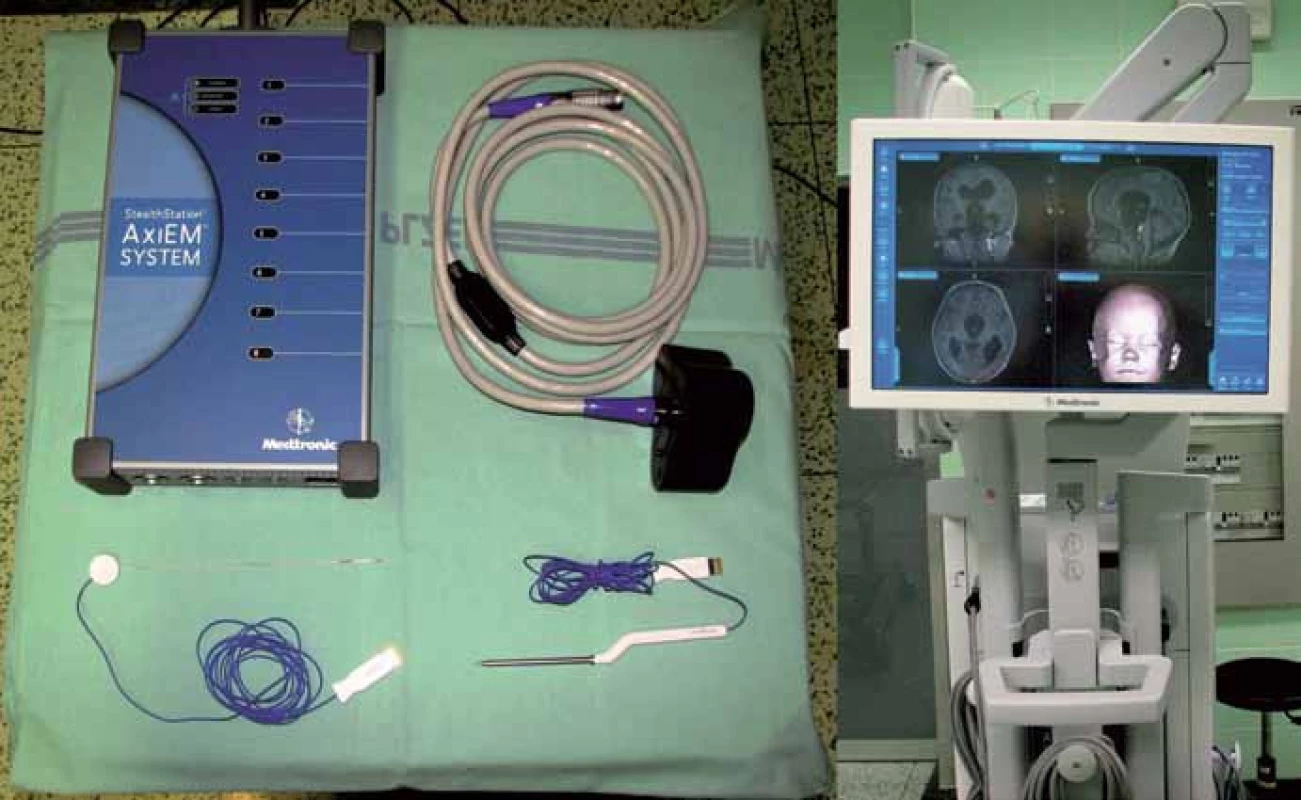
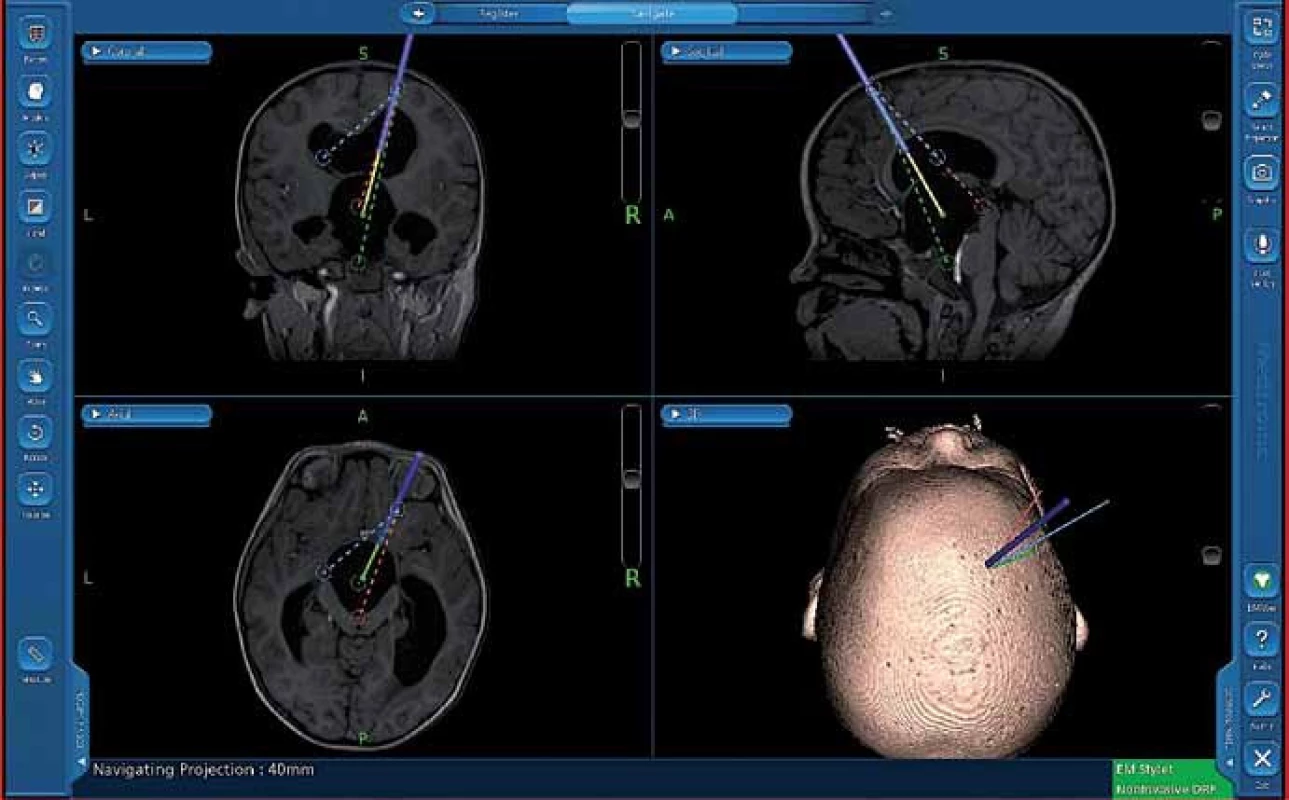
K navigaci používáme přístroj AxiEM™ – StealthStation® S7® (Medtronic Czechia s.r.o.). Systém využívá pro simultánní sledování nástrojů a anatomické struktury tzv. elektromagnetický lokalizační systém. Emitor vyzařuje nízkoenergetické magnetické pole a vzhledem k tomu, že každý bod v navigačním poli má jedinečnou intenzitu pole, systém může stanovit jeho polohu změřením intenzity pole v daném umístění. K tomuto účelu jsou v referenčním senzoru a navigovatelných nástrojích zabudovány mikrosenzory (obr. 1).
Všechny děti byly předoperačně vyšetřeny na 1,5T magnetické rezonanci (MR) navigačním protokolem T1w GE FLASH iso s rozlišením 1 × 1 × 1 mm, délka trvání 6 min a 11 s. Protokol je zahrnut do MR vyšetření, které děti absolvovaly v rámci diagnostiky, nebyly tedy zatěžovány dalším vyšetřením v narkóze jenom kvůli použití EMN. Vlastní plánování přístupu bylo provedeno přímo na operačním sále během uvádění dítěte do narkózy. U drenážní operace byl zvolen vstup katétru intrakraniálně parietookcipitálně s ohledem na nutné správné uložení gravitačního ventilu rovnoběžně s dlouhou osou těla. Zároveň byla naplánována poloha katétru v dlouhé ose komory tak, aby mohl být zaveden co možná nejhlouběji s ohledem na další růst dítěte. Výjimku představovaly děti s kombinovanými výkony u izolované IV. komory s hydrocefalem, u nichž jsme volili přístup frontální. U endoskopických výkonů jsme na navigaci naplánovali přístup tak, aby trajektorie zavedení endoskopu dovolovala provést bezpečně zamýšlený výkon.
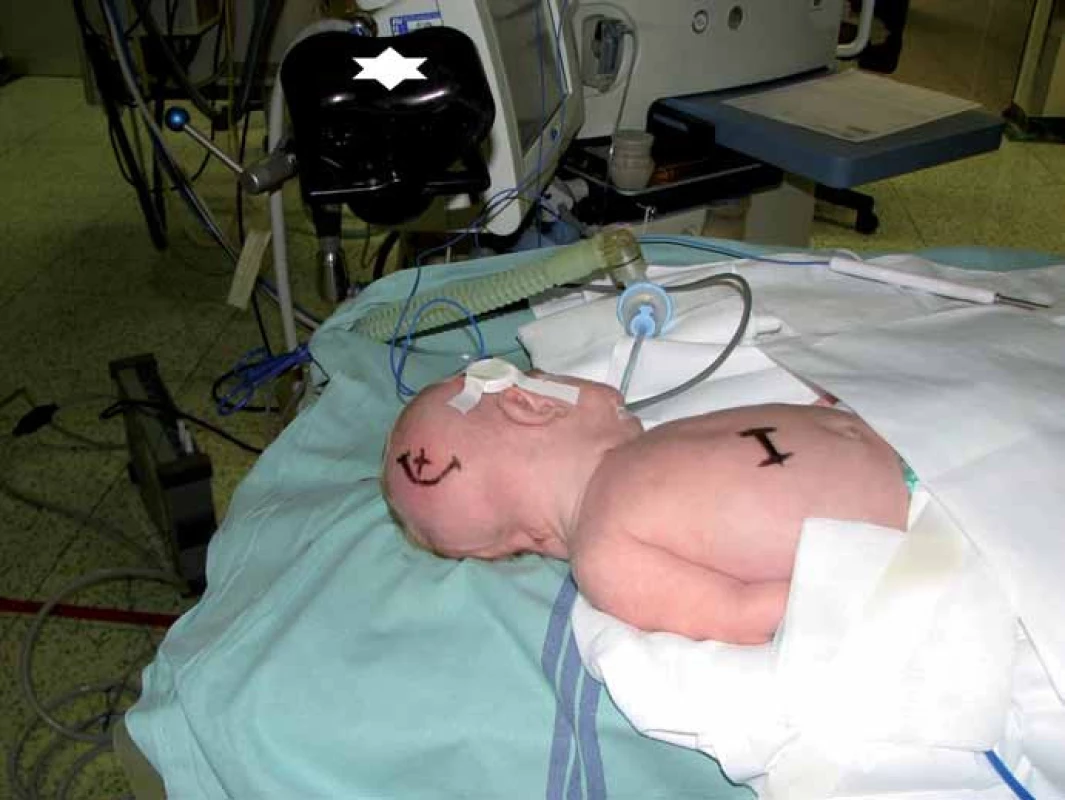
Při vlastní implantaci VP drenáže zprava dítě leží na zádech s hlavou doleva v mírné anteflexi s fixací pouze náplasťovým pruhem. Referenční senzor je nalepen frontolaterálně vpravo (obr. 2). I v této poloze lze dobře provést registraci metodou „surface matching“, protože registrační pointer nemusí být navigací „viděn“. Referenční senzor je před operací normálně zakryt rouškami. K zavedení komorového katétru při operaci používáme navigovaný mandrén, který lze zasunout přímo do katétru. To umožňuje jeho přesné uložení v komoře v její nejdelší ose co nejhlouběji (obr. 3, 4).
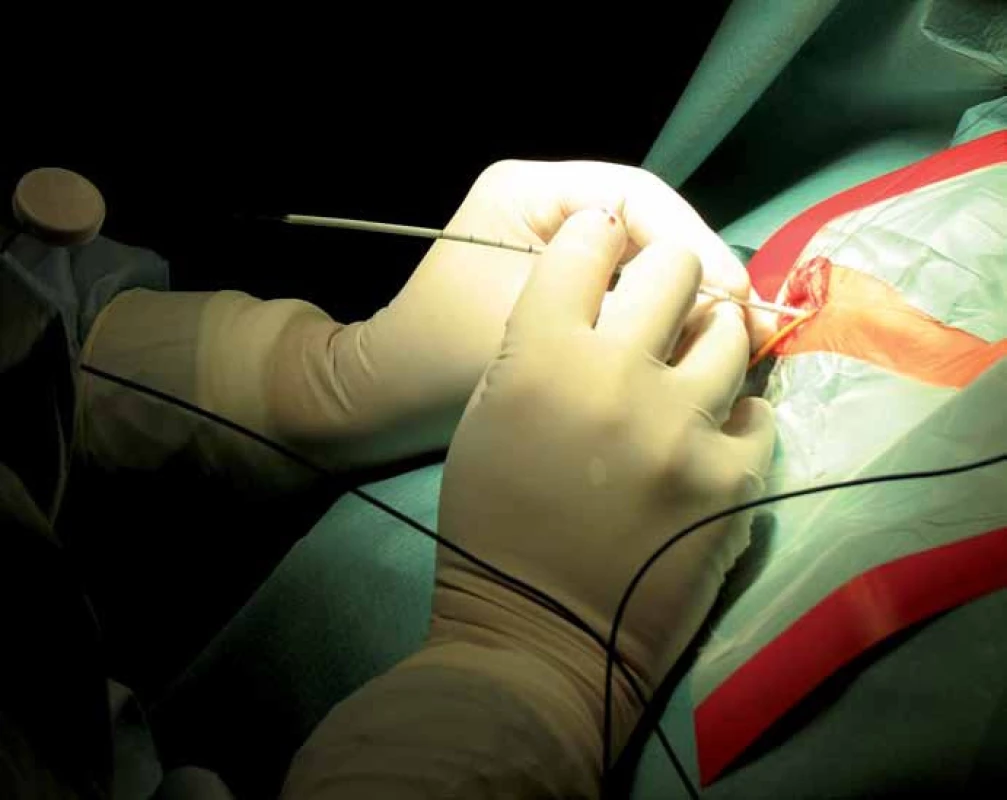
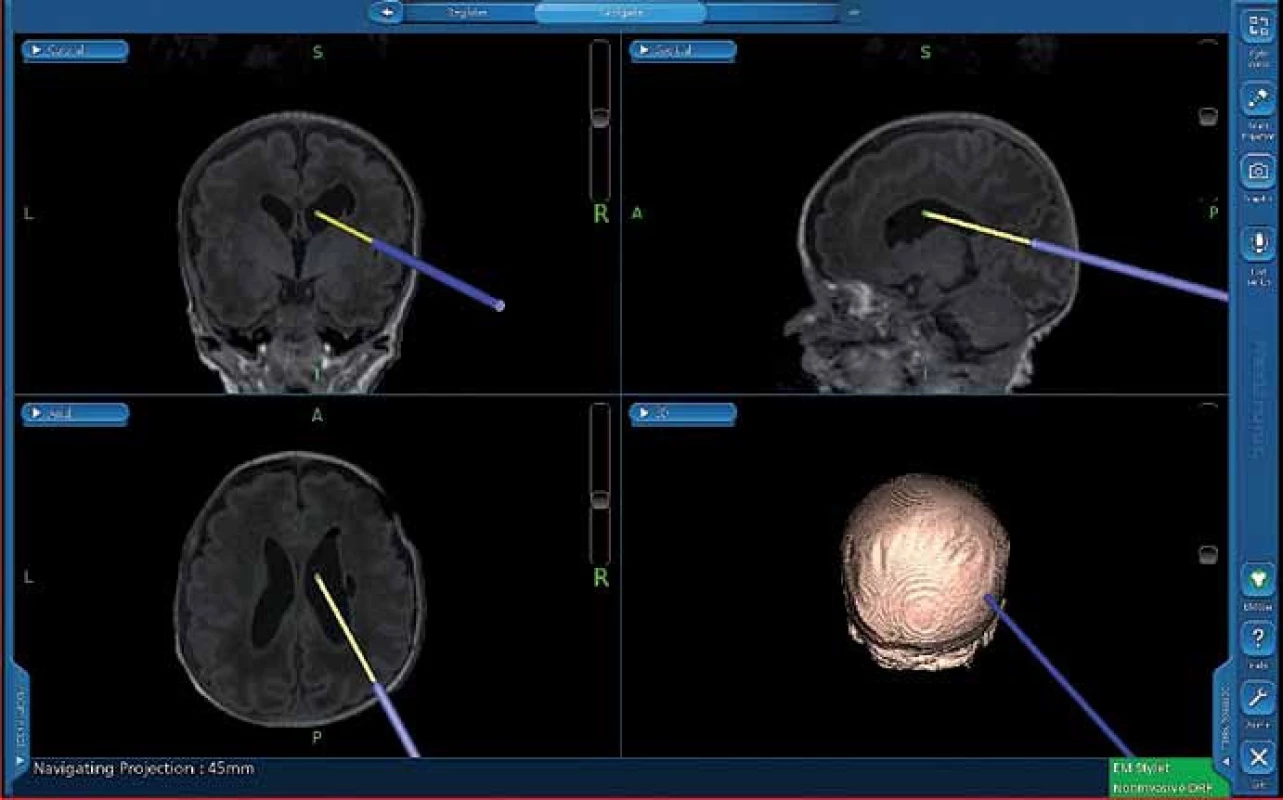
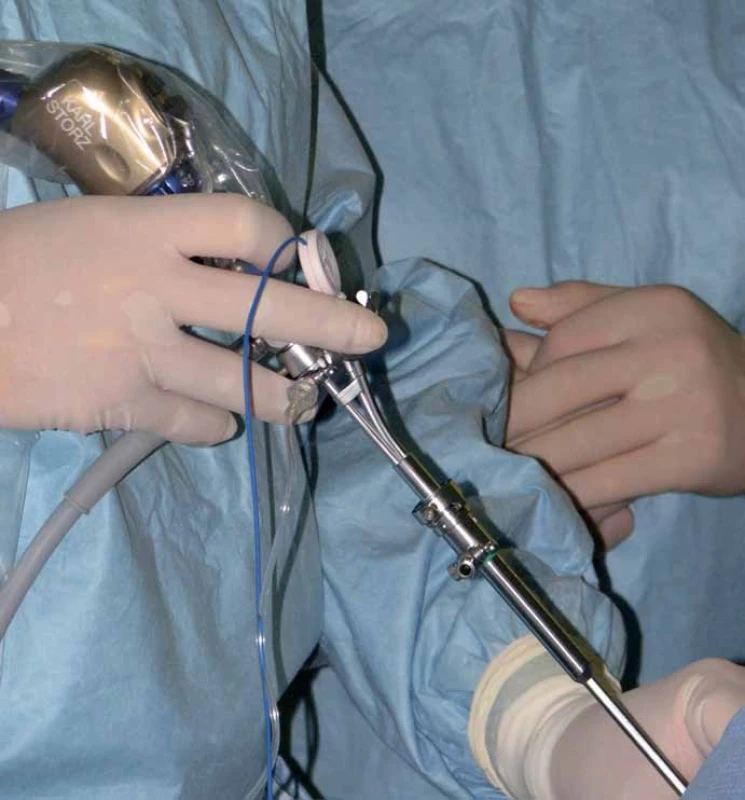
Při neuroendoskopických výkonech je poloha dítěte volena tak, aby trepanace byla nejvyšším bodem těla. Zde je největší přínos navigace při určení místa zavedení endoskopu intrakraniálně vzhledem k požadované trajektorii (obr. 5). S navigovaným mandrénem postupně zavádíme do komory nebo cysty nejprve komorový katétr a poté tzv. peel- away sheet (plastový zavaděč), který slouží jako vstupní kanál během výkonu. Vlastní výkon pak již probíhá většinou pouze pod optickou kontrolou endoskopu, ale je možné navigovat i endoskop zasunutím navigovaného mandrénu do pracovního kanálu endoskopu (obr. 6). Toho využíváme např. uvnitř cyst, kdy není jasně vidět skrze stěnu cysty komory nebo cisterny, do kterých chceme vytvořit komunikaci. U kombinovaných výkonů, při zavádění komorového katétru pod endoskopickou kontrolou, sledujeme jeho polohu rovněž zavedením navigovaného mandrénu.
Výsledky
V souboru pacientů s drenážními výkony jsme komorový katétr zavedli vždy na první pokus, nezaznamenali jsme žádný technický problém navigace, který by vyústil v nepřiměřenou navigační odchylku, a znemožnil tak navigovat (např. posun přilepeného referenčního senzoru). Všichni pacienti měli po operaci sonografickou kontrolu přes velkou fontanelu prokazující správné uložení katétru v komoře. Malfunkci komorového katétru (vždy obturaci komorovým plexem) jsme zaznamenali u čtyř pacientů (18,2 %), v průměru za šest měsíců po zavedení. Infekce drenážního systému vznikla u jednoho pacienta (4,5 %) za šest týdnů po operaci. Roční „přežití“ drenážního systému bez revize je v našem souboru 58,8 %. Detaily souboru jsou opět uvedeny v tab. 1.
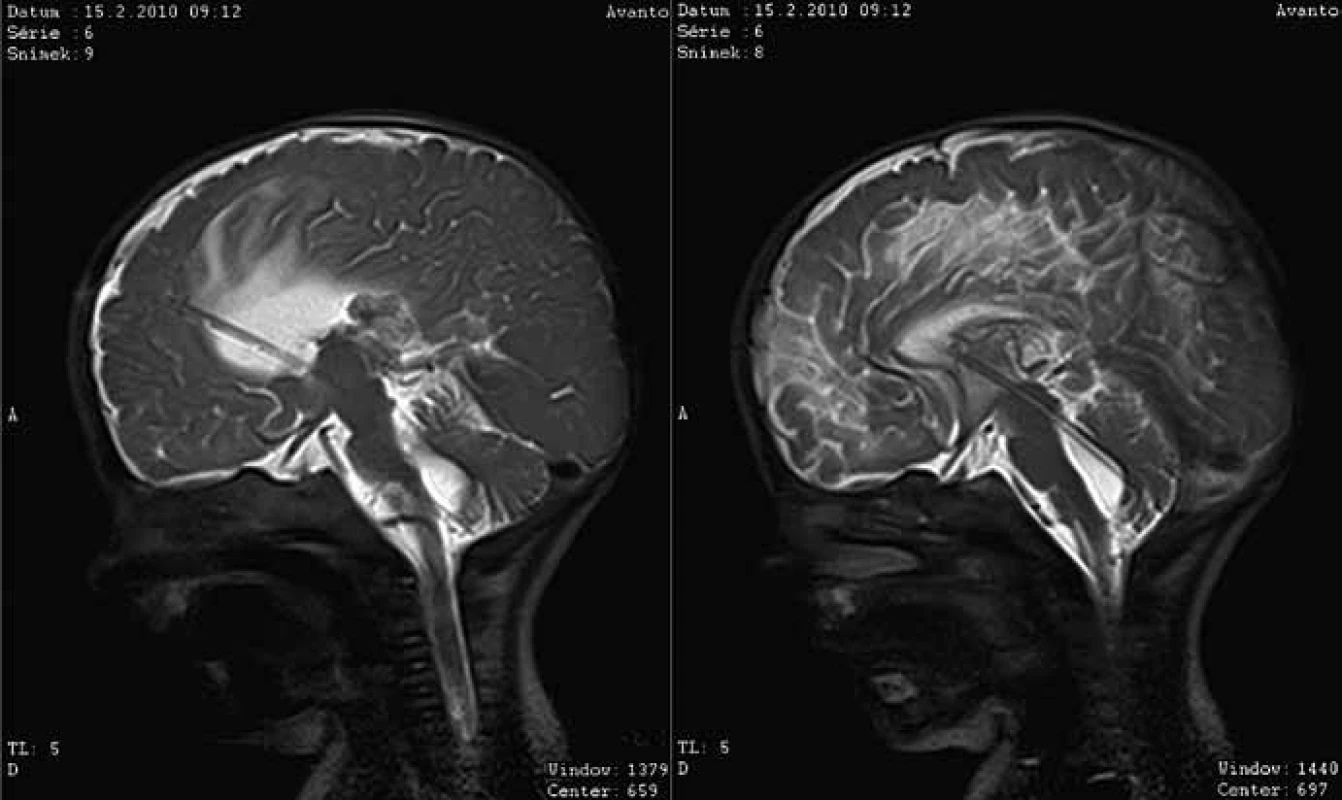
V souboru pacientů s endoskopickým výkonem jsme vždy zavedli endoskop do požadovaného prostoru (cysty, komory) na první pokus. Ve všech případech jsme provedli plánovaný endoskopický výkon bez jakéhokoliv technického problému, který by znemožnil provedení navigace. Všichni pacienti po endoskopickém výkonu měli po operaci MR kontrolu (obr. 7). Dva pacienty (20 %) jsme reoperovali pro selhání vytvořené komunikace. Pacienta po ETV za šest týdnů a pacientku po ventrikulocystostomii za 12 týdnů. U pacienta po druhé ETV jsme za sedm dní provedli plastiku rány pro likvoreu.
Diskuze
Variabilita anatomie u dětských pacientů s hydrocefalem a arachnoidálními cystami je veliká. Proto je navigace využívána k individualizaci přístupu a trajektorie výkonu u každého pacienta podle jeho vlastních anatomických poměrů [13,14]. Neuronavigace se tak stává nástrojem, který zvyšuje bezpečnost a přesnost operace dětských pacientů. Je třeba ale vždy mít na paměti možný posun intrakraniálních struktur při vypuštění mozkomíšního moku. Důležitá je poloha pacienta tak, aby pokud možno byl operační přístup „nejvyšším“ bodem pacienta [15]. Pomocí EMN můžeme navigovat endoskopické a drenážní operace i malých dětí neinvazivně, bez nutnosti pevně fixovat hlavu v tříbodovém rámu s možností pohybu hlavou i po kalibraci navigace. Možnost navigovat do hloubky mozku flexibilní mandrén lze využít právě při operacích s cílem uvnitř mozkových komor. U komorových katétrů zaváděných bez navigace se v literatuře uvádí uložení katétru mimo komorový systém až ve 4 % [16]. Naproti tomu u katétrů zaváděných pomocí EMN lze dosáhnout dle literatury prakticky bezchybného uložení [17], což potvrdily i výsledky v našem souboru drénovaných pacientů.
Ačkoliv při použití EMN je třeba vždy zvažovat narušení magnetického pole kovovými nástroji (např. rozvěračem), dle údajů z literatury [18] a i zkušeností z našeho souboru je toto riziko minimální, a není tedy nutné používat např. nemagnetické nástroje. Nevýhodou zůstává, že referenční senzor je na hlavu pouze nalepen, a je třeba tedy dbát zvýšené opatrnosti při rouškování, aby nedošlo k jeho posunutí. Značná výhoda EMN je stálá detekce navigovaného nástroje, aniž je třeba vizuální kontakt s navigačním přístrojem. To je velmi užitečné při práci s intrakraniálně zavedeným endoskopem, kdy jsou možnosti pohybu omezené. Výrazně se tak zvyšuje bezpečnost výkonu.
Obecnou nevýhodou neuronavigace zůstává práce pouze s předoperačním grafickým vyšetřením, což může vést k nepřesnosti při intraoperační změně intrakraniální anatomie. To při zavedení katétru nebo endoskopu do komory obvykle problém není, protože se jedná o jednorázový děj před případným vypuštěním mozkomíšního moku. Jediná navigace v „reálném čase“ je navigace ultrasonografická [19], která ale v porovnání s EMN vyžaduje větší trepanaci a nelze ji samozřejmě použít uvnitř katétru nebo pracovního kanálu endoskopu.
Dalším „diskutabilním“ bodem je zvýšení ceny operace s EMN – jednorázový set (referenční senzor + mandrén) stojí cca 14 000 Kč. To však může být relativně levné v porovnání s náklady na případnou reinzerci komorového katétru, nemluvě o jistě nižší bezpečnosti výkonu při zavádění endoskopu intrakraniálně bez navigace.
Navigování drenážních operací pro hydrocefalus je též kritizováno pro prodloužení operačního času. Podle našich zkušeností kalibrace navigace s registrací pacienta prodlužuje operaci maximálně o 10 min, podobný údaj uvádí i další pracoviště [20]. O prodloužení operace se nepochybně jedná, ale podle našeho názoru je lze akceptovat, vede-li k eliminaci chybného uložení komorového katétru.
Podle literárních údajů použití navigace u drenážních výkonů nezvyšuje riziko infekce drenáže [21]. V našem souboru bylo procento infekčních komplikací rovněž nízké, odpovídající této rizikové skupině pacientů.
Při zavádění komorového katétru u drenážních výkonů lze kromě EMN a ultrazvuku použít také endoskop a katétr zavést pod endoskopickou kontrolou. Zde ale v literatuře benefit prokázán nebyl [22]. Navíc použijeme-li pouze endoskop, odpadá možnost si dle EMN naplánovat optimální místo trepanace, což je u parietookcipitálního přístupu poměrně důležité. K dispozici je i tzv. Shunt Scope – semirigidní endoskop, který se dá zasunout do již zavedeného komorového katétru. Ten musí být na konci předem perforován a tímto otvorem lze vizuálně potvrdit jeho uložení uvnitř likvorového prostoru. Na pracovišti autorů byl již vyzkoušen, jeho použití je jednoduché. Nevýhodou zůstává samozřejmě horší kvalita obrazu, jež je při průměru endoskopu 1 mm pochopitelná.
Závěr
EMN umožňuje provádět i u velmi malých dětí drenážní a endoskopické operace hydrocefalu a arachnoidálních cyst se stejnou přesností intraoperačního navigování jako u dospělých pacientů. U tohoto typu operací navíc můžeme využít některých odlišností EMN od navigace optické – navigovaný mandrén v lumen katétru nebo endoskopu, absenci vizuálního konfliktu navigovaného nástroje a ostatních nástrojů anebo rukou v operačním poli. Dosahujeme tak potřebné přesnosti při zavádění katétru nebo endoskopu intrakraniálně při minimálním časovém prodloužení výkonu a bez zvýšení infekčních komplikací.
Dle našich zkušeností doporučujeme při tomto typu operací používat paušálně některou z možností navigace nebo kontroly polohy ventrikulárního katétru. K tomuto názoru se ostatně v literatuře přiklání i většina celosvětově renomovaných dětských neurochirurgů [23].
MUDr. Petr Vacek
Neurochirurgické oddělení
LF UK a FN Plzeň
Alej Svobody 80
323 00 Plzeň
e-mail: pepe.vacek@seznam.cz
Přijato k recenzi: 31. 3. 2014
Přijato do tisku: 21. 5. 2014
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Zdroje
1. Greenfield JP, Souweidane MM. Endoscopic management of intracranial cysts. Neurosurg Focus 2005; 19(6): E7.
2. Kang JK, Lee IW. Long-term follow-up of shunting therapy. Childs Nerv Syst 1999; 15(11– 12): 711– 717.
3. Kestle J, Drake J, Milner R, Sainte- Rose C, Cinalli G, Boop F et al. Long-term follow-up data from the Shunt Design Trial. Pediatr Neurosurg 2000; 33(5): 230– 236.
4. Cochrane D, Kestle J, Steinbok P, Evans D, Heron N. Model for the cost analysis of shunted hydrocephalic children. Pediatr Neurosurg 1995; 23(1): 14– 19.
5. Roth J, Beni- Adani L, Biyani N, Constantini S. Classical and real- time neuronavigation in pediatric neurosurgery. Childs Nerv Syst 2006; 22(9): 1065– 1071.
6. Kim YB, Lee JW, Lee KS, Lee KC. Image- guided placement of ventricular shunt catheter. J Clin Neurosci 2006; 13(1): 50– 54.
7. Kato A, Yoshimine T, Hayakawa T, Tomita Y, Ikeda T,Mitomo M et al. A frameless, armless navigational system for computer- assisted neurosurgery. Technical note. J Neurosurg 1991; 74(5): 845– 849.
8. Mascott CR. The Cygnus PFS image- guided system. Neurosurgery 2000; 46(1): 235– 238.
9. Rousu JS, Kohls PE, Kall B, Kelly PJ. Computer- assisted image- guided surgery using the Regulus Navigator. Stud Health Technol Inform 1998; 50: 103– 109.
10. Benardete EA, Leonard MA, Weiner HL. Comparison of frameless stereotactic systems: Accuracy, precision and applications. Neurosurgery 2001; 49(6): 1409– 1416.
11. Mangano FT, Limbrick DD jr, Leonard JR, Park TS, Smyth MD. Simultaneous image- guided and endoscopic navigation without rigid cranial fixation: application in infants: technical case report. Neurosurgery 2006; 58 (4 Suppl 2): ONS- E377.
12. Hayhurst C, Byrne P, Eldridge PR, Mallucci CL. Application of electromagnetic technology to neuronavigation: a revolution in image- guided neurosurgery. Technical note. J Neurosurg 2009; 111(6): 1179– 1184. doi: 10.3171/ 2008.12.JNS08628.
13. Gumprecht H, Trost HA, Lumenta CB. Neuroendoscopy combined with frameless neuronavigation. Br J Neurosurg 2000; 14(2): 129– 131.
14. Rohde V, Reinges MH, Krombach GA, Gilsbach JM. The combined use of image- guided frameless stereotaxy and neuroendoscopy for the surgical management of occlusive hydrocephalus and intracranial cysts. Br J Neurosurg 1998; 12(6): 531– 538.
15. Dorward N, Alberti O, Velani B, Gerritsen FA, Harkness WF, Kitchen ND et al. Postimaging brain distortion: magnitude, correlates, and impact on neuronavigation. J Neurosurg 1998; 88(4): 656– 662.
16. Sainte- Rose C, Piatt JH, Renier D, Pierre-Kahn A, Hirsch JF, Hoffman HJ et al. Mechanical complications in shunts. Pediatr Neurosurg 1991; 17(1): 2– 9.
17. Azeem SS, Origitano TC. Ventricular catheter placement with a frameless neuronavigational system: a 1-year experience. Neurosurgery 2007; 60 (Suppl 2): 243– 248.
18. Schicho K, Figl M, Donat M, Birkfellner W, Seemann R, Wagner A et al. Stability of miniature electromagnetic tracking systems. Phys Med Biol 2005; 50(9): 2089– 2098.
19. Whitehead WE, Jea A, Vachhrajani S, Kulkarni AV, Drake JM. Accurate placement of cerebrospinal fluid shunt ventricular catheters with real- time ultrasound guidance in older children without patent fontanelles. J Neurosurg 2007; 107 (Suppl 5): 406– 410. doi: 10.3171/ PED- 07/ 11/ 406.
20. Hayhurst C, Beems T, Jenkinson MD, Byrne P,Clark S, Kandasamy J et al. Effect of electromagnetic- navigated shunt placement on failure rates: a prospective multicenter study. Clinical article. J Neurosurg 2010; 113(6): 1273– 1278. doi: 10.3171/ 2010.3. JNS091237.
21. Cochrane DD, Kestle JR. The influence of surgical operative experience on the duration of first ventriculoperitoneal shunt function and infection. Pediatr Neurosurg 2003; 38(6): 295– 301.
22. Kestle JR, Drake JM, Cochrane DD, Milner R, Walker ML, Abbott R 3rd et al. Endoscopic Shunt Insertion Trial participants: Lack of benefit of endoscopic ventriculoperitoneal shunt insertion: A multicenter randomized trial. J Neurosurg 2003; 98(2): 284– 290.
23. Albright AL. Hydrocephalus shunt practice of experienced pediatric neurosurgeons. Childs Nerv Syst 2010; 26(7): 925– 929. doi: 10.1007/ s00381- 010- 1082- 5.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2014 Číslo 6
Nejčtenější v tomto čísle
- Diazepam i. m. – nejčastěji užívaný, ale nevhodný lék ke zvládání akutní úzkosti, agitovanosti a agresivity
- Střelné poranění hlavy replikou historické zbraně – patofyziologie a popis kazuistiky
- Adultní forma Pompeho nemoci
- Test neverbální fluence – Five Point Test: normativní data pro dospělé
