Predikce pooperačního stavu u spondylogenní cervikální myelopatie
Prediction of Postoperative Clinical Outcome in Cervical Spondylotic Myelopathy
Objective:
In this retrospective study we outline the relationship between a chosen surgical approach as it relates to the localization of spinal cord lesion assessed by the use of evoked potentials and the effect of this approach on the postoperative state of patients with cervical spondylotic myelopathy.
Methodology:
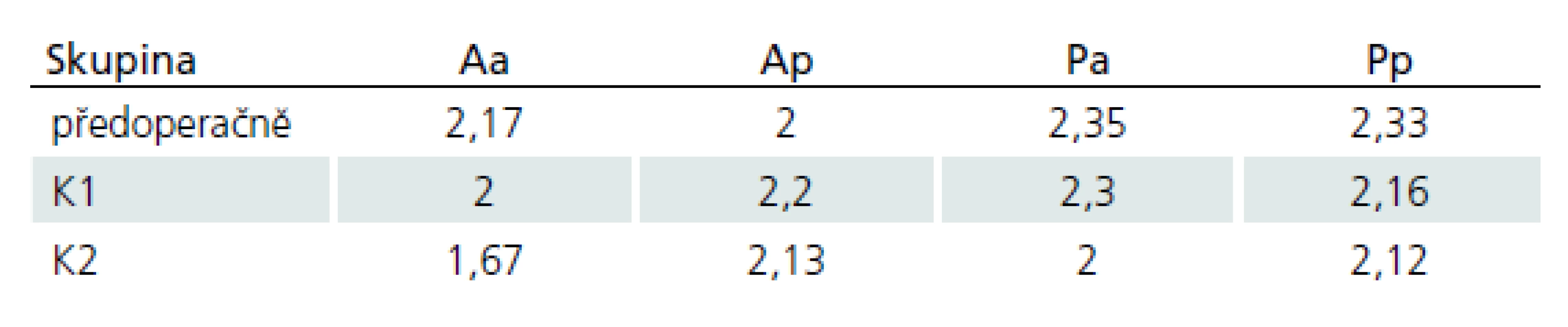
The study, from 2006 to 2010, comprised 65 patients with clinical signs of cervical myelopathy. These patients had been indicated for surgery, which subsequently was performed by using either the anterior – A or posterior – P approach. The patients were assessed using Nurick and mJOA scores before surgery, then at 12, 24 months after surgery. In addition, they were preoperatively examined with a battery of evoked potentials (EP) – somatosensory evoked potential (SEP) and motor evoked potential (MEP) tests. Based on EP, principal spinal cord disability was determined: A – anterior (maximum changes in MEP), P – posterior (maximum change in SEP). The entire group was, on the basis of EP partitioning and the surgical approach used, divided into four groups: Aa, Ap, Pa, Pp. The results of individual examinations were compared within groups and in between groups.
Results:
Objective postoperative improvement mJOA score was found in all four groups. Statistically significant improvement was, however, detected only in the groups of anterior approaches regardless of the primacy of SEP or MEP lesion (Aa: p = 0.011, Ap: p = 0.005). Overall mJOA improvement was revealed in 65 % patients in this study.
Conclusion:
Objectively significant postoperative improvements were achieved with anterior approaches, regardless of the fact whether the dominant spinal cord pathology was located ventrally or dorsally. As a result of this study, there seems to be no benefit to choosing a surgical approach based on the localization of dominant spinal cord pathology assesses by EP.
Key words:
spondylotic cervical myelopathy – motor evoked potentials – somatosensory evoked potentials – surgical decompression
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Autoři:
D. Štěpánek; S. Žídek; D. Bludovský; M. Choc; V. Přibáň; I. Holečková
Působiště autorů:
LF UK a FN Plzeň
Vyšlo v časopise:
Cesk Slov Neurol N 2014; 77/110(1): 39-46
Kategorie:
Původní práce
Souhrn
Cíl:
V retrospektivní studii u pacientů s cervikální myelopatií byl sledován vzájemný vztah lokalizace míšní léze hodnocené pomocí evokovaných potenciálů a operačního přístupu a jejich vliv na objektivní pooperační stav pacienta.
Metodika:
Do studie bylo v letech 2006 až 2010 zařazeno 65 pacientů indikovaných k operaci s klinickými a grafickými známkami cervikální myelopatie. Operace byla provedena předním (anterior – A) či zadním (posterior – P) přístupem. Pacienti byli před operací, 12 a 24 měsíců po operaci hodnoceni pomocí Nurickovy škály a mJOA skóre. Dále byli předoperačně vyšetřeni baterií evokovaných potenciálů (EP) – somatosenzorický evokovaný potenciál (SEP) a motorický evokovaný potenciál (MEP). Na základě EP bylo určeno dominantní míšní postižení A – anterior (maximum změn na MEP), P – posterior (maximum změn na SEP). Celý soubor byl pak na základě členění pomocí EP a operačního přístupu rozdělen do 4 skupin: Aa, Ap, Pa, Pp. Výsledky jednotlivých vyšetření byly porovnávány uvnitř skupin a mezi skupinami.
Výsledky:
Dominantní míšní postižení ventrálně (MEP) bylo u 30 pacientů, dorzálně (SEP) u 35 pacientů. Ventrální operační přístup byl indikován u 43 pacientů, dorzální u 22 pacientů. Nebyla nalezena shoda mezi předoperačním grafickým útlakem míchy zpředu na MR a alterací MEP, resp. grafickým útlakem zezadu a alterací SEP. Objektivní pooperační zlepšení hodnocené parametrem mJOA skóre bylo registrováno u všech čtyř skupin. Statisticky významné zlepšení zaznamenáno pouze u skupin předních přístupů. Celkově bylo zlepšení zaznamenáno u 65 % pacientů ve studii, u zbylých 35 % zůstal klinický stav stacionární.
Závěr:
Výsledky studie nepotvrdily přínos volby operačního přístupu (přední vs. zadní) na základě lokalizace dominující míšní patologie, hodnocené dle výsledků EP. Statisticky významné zlepšení objektivního nálezu bylo zaznamenáno pouze u skupin předních přístupů.
Klíčová slova:
spondylogenní cervikální myelopatie – motorické evokované potenciály – somatosenzorické evokované potenciály – dekompresní operace
Úvod
Cervikální spondylogenní myelopatie (CSM) je nejčastější míšní postižení u vyšších věkových skupin populace. Onemocnění probíhá chronicky s možnými náhlými výkyvy ve smyslu zhoršování stavu a může vést k trvalé invalidizaci pacienta. Lehké formy jsou indikovány ke konzervativnímu postupu. Indikací k chirurgickému řešení je progresivní zhoršování klinického stavu nebo těžší neurologický deficit i u stacionárního klinického stavu [1]. Smyslem a principem každé operace je míšní dekomprese při zachování či obnovení stability krční páteře. Operace je chápána jako preventivní výkon s cílem zamezit progresi onemocnění. Pooperačně však často lze pozorovat zlepšování klinického stavu. Mezi běžné dekompresivní výkony patří skupina předních přístupů, jako jsou diskektomie (mono‑ či vícesegmentální) a somatektomie s odstraněním zadních osteochondróz či osteofytů. Stabilita je povětšinou zajištěna fúzí operovaného segmentu [2,3] nebo u oligosegmentální dekomprese (jeden, dva segmenty) artroplastikou. Ventrální přístupy postupně v této operativě získávají dominantní pozici. Druhou rozsáhle používanou metodikou je skupina dorzálních přístupů, obvykle užívaných při vícesegmentálním útlaku. Nejčastěji užívané výkony jsou laminektomie a laminoplastiky. Laminektomie mohou být v případě hrozící instability a vzniku kyfotizace doplněny následnou instrumentací stabilizující dekomprimovaný úsek páteře [3,4]. V případě komplikovanější geometrie osy krční páteře v kombinaci s rozsáhlejší kompresí míchy je možné oba přístupy kombinovat a zadní přístup opět eventuálně doplnit fixací [2]. Anterolaterální přístup slibuje mnohé výhody z obou uvedených skupin [5], ve větším rozsahu ale není všeobecně používán. Volba dekompresivního výkonu se dosud odvíjí převážně od grafického nálezu na krční páteři. Vliv dominujícího klinického nálezu, jako je převládající postižení tractus corticospinalis či drah zadních provazců a tractus spinothalamicus, na volený způsob operačního řešení a volbu operačního přístupu zůstává minimální.
Pro potvrzení diagnózy CSM se používají elektrofyziologické metody – somatosenzorický (SEP) a motorický (MEP) evokovaný potenciál, elektromyografie (EMG) a kožní útlumová perioda [6]. Největší význam mají evokované potenciály, většina provedených studií popisuje pro průkaz časných forem CSM větší senzitivitu MEP [7– 10]. Potvrzen byl ale i přínos SEP, který je pro identifikaci léze somatosenzorické dráhy citlivější než klinické vyšetření [11]. U pacientů s klinicky jasně vyjádřenou CSM, kteří představují většinu pacientů indikovaných k chirurgickému výkonu, bývá abnormální MEP i SEP [12]. Evokované potenciály (EP) nejen slouží k diagnostice a sledování CSM [13– 15], ale mohou být využity i jako pomocné metody při indikaci vlastní operace [9,16].
Na základě klinického a grafického nálezu jsou pacienti indikováni k operačnímu řešení CSM. Na podkladě klinického nálezu nelze ale rozhodnout o vhodném operačním přístupu. Současná strategie chirurgického řešení se dominantně opírá o grafický předoperační nález (MR, RTG). V předoperačním období však koreluje klinický stav více s výsledky elektrofyziologickými než s grafickým nálezem na MR [11]. Studie, jež hodnotí výsledky operačních řešení v porovnání s konzervativní léčbou CSM, dokládají, že u obou skupin dochází u části pacientů ke zlepšení a u části ke zhoršení. Kadaňka et al [17] nezjistili významný rozdíl mezi výsledky konzervativní a chirurgické léčby po 10 letech u pacientů s neprogredující lehkou a střední formou CSM. V obou skupinách byli pacienti se zlepšením i se zhoršením výsledného klinického stavu.
Nabízí se tedy otázka, zda by indikace operačního přístupu na základě výsledků EP nemohla vést k lepším pooperačním výsledkům než indikace na základě grafického vyšetření. Náš přístup od dosud provedených prací byl rozdílný. Autoři zkoumali vzájemný vztah lokalizace míšní léze, tj. dominantní postižení předních nebo zadních drah, hodnocené pomocí evokovaných potenciálů (SEP, MEP) a operačního přístupu (přední nebo zadní přístup). Cílem bylo určit, zda pacienti profitovali z míšní dekomprese, která odpovídala dominantnímu postižení drah určených pomocí EP, tj. dorzální míšní dekomprese při větším dorzálním míšním postižení a analogicky ventrální dekomprese při větším ventrálním míšním postižení. Ve studii byl posuzován objektivní vývoj klinického stavu na podkladě korelace dominantní patologie EP a typu zvoleného operačního přístupu. Byl sledován i objektivní pooperační vývoj klinického stavu pomocí mJOA skórování v rámci celého souboru pacientů.
Soubor a metodika
Do retrospektivně vedené studie bylo v letech 2006 až 2010 zařazeno 65 pacientů (48 mužů, 17 žen) operovaných pro cervikální myelopatii. Průměrný věk v souboru byl 56 let (rozpětí 28 až 81 let). Všichni pacienti podepsali informovaný souhlas se studií, která byla schválena etickou komisí FN Plzeň.
Předoperační období
U všech pacientů proběhlo předoperační neurologické klinické vyšetření, které prokázalo cervikální míšní postižení. Do studie nebyli zařazeni pacienti s příznaky jiných neurologických onemocnění.
U pacientů byly ambulantním týmem provádějícího pracoviště sledovány objektivní parametry tíže cervikální myelopatie na podkladě klinického neurologického vyšetření: Nurickova škála [18] a modifikované skóre Japonské ortopedické asociace ( Japanese Orthopaedic Association score (mJOA)) [19].
U všech bylo předoperačně provedeno grafické vyšetření krční páteře magnetickou rezonancí, kde byla verifikována míšní komprese. Při sporném nálezu byly doplněny dynamické MR projekce prokazující dynamickou krční stenózu (při předklonu, resp. při záklonu). Pacienti s prokázaným měkkým výhřezem disku způsobujícím cervikální myelopatii byli ze sestavy, vzhledem k rozdílnému patofyziologickému mechanizmu onemocnění, vyloučeni [20]. Dále byla předoperačně doplněna baterie RTG skenů zahrnující předozadní, bočnou projekci a dynamické snímky – anteflexe, retroflexe v bočné projekci. Komplex grafického vyšetření byl podkladem při rozhodování o chirurgickém operačním přístupu.
Všichni pacienti byli vyšetřeni evokovanými potenciály – SEP, MEP.
Elektrofyziologické vyšetření
Před operací byli všichni pacienti pro posouzení funkce vzestupných a sestupných míšních drah vyšetřeni baterií evokovaných potenciálů. Tato baterie zahrnovala somatosenzorický evokovaný potenciál (SEP) smíšeného nervu horní končetiny (n. medianus) a dolní končetiny (n. tibialis) a motorický evokovaný potenciál (MEP) registrovaný ze svalů horní končetiny (m. abductor pollicis brevis) a svalu dolní končetiny (m. tibialis anterior).
Somatosenzorické evokované potenciály (SEPs) n. medianus a n. tibialis
SEP byl registrován při stimulaci smíšeného nervu na zápěstí, resp. za vnitřním kotníkem bilaterálně. Parametry stimulace i registrace byly prováděny dle doporučení IFCN (The International Federation of Clinical Neurophysiology) [21]. Odpověď byla registrována na čtyřech kanálech elektrodiagnostického přístroje Nicolet Viking IV (Viasis Biomedical Inc., Madison, WI).
Pro SEP n. medianus byla registrována odpověď z brachiálního plexu N9 (registrace Erb ipsi – Erb contra), cervikální míšní odpověď generována z oblasti zadních rohů míšních N13 (registrace Cv6– jugulum) a kortikální parietální N20 (registrace C3‘/ C4‘– Fz). Byla měřena latence vlny N13, N20 a centrální kondukční čas (CCT, Central Conduction Time) mezi odpovědí N13– N20.
Kritéria pro hodnocení léze SEP n. medianus: k posuzování léze drah zadních provazců pro horní končetiny (HK) byla k dalšímu zpracování využita latence vlny N139, vlny N20. Rozdíl latencí mezi vlnou N20 a N13 pak představuje CCT (CCT= lat N20 – lat N13), který byl dále použit jako hlavní parametr pro určení léze drah zadních provazců pro HK. Norma naší laboratoře pro latenci vlny N13 = 13,3 ms (SD = 0,88 ms), pro latenci vlny N20 = 18,9 ms (SD = 1,13 ms) a pro latenci CCT = 5,8 ms (SD = 0,6 ms). Jako patologické byly označeny takové odpovědi, u kterých došlo k vymizení odpovědi či prodloužení latence o více než 2 SD ve srovnání s normativními daty naší laboratoře.
Pro SEP n. tibialis byla registrována postsynaptická sakro‑lumbální míšní komponenta ze zadních rohů míšních N22 (registrace Th12– Th10) a kortikální komponenta P40 (registrace Cz‘– Fz). Byly měřeny latence vlny N22, latence vlny P40 a CCT mezi odpovědí N22– P40.
Kritéria pro hodnocení léze SEP n. tibialis: K posuzování léze drah zadních provazců pro dolní končetiny (DK) byla k dalšímu zpracování použita latence vlny N22, P40, jejich odečtením pak byl počítán CCT (CCT = lat P40 – lat N22), který byl pak použit jako hlavní parametr pro určení léze drah zadních provazců pro DK. Norma naší laboratoře pro latenci vlny N22 = 21,6 ms (SD = 1,1 ms), pro latenci vlny P40 = 38,8 ms (SD = 2,1 ms) a pro latenci CCT = 16,4 ms (SD = 2,1 ms). Jako patologické byly označeny takové odpovědi, u nichž došlo k vymizení odpovědi či prodloužení latence o více než 2 SD ve srovnání s normativními daty naší laboratoře.
Motorické evokované potenciály (MEPs) m. abductor pollicis brevis (m. APB) a m. tibialis anterior (m. TA)
MEPs byly evokovány magnetickým stimulátorem Magstim 200 (The Magstim Company Ltd., Spring Gardens, Wales, UK) pomocí cirkulární cívky 90 mm dle doporučení IFCN (The International Federation of Clinical Neurophysiology) [22]. Cívka byla přikládána na kranium tangenciálně v místě předpokládané lokalizace motorické oblasti pro vyšetřovaný sval. Vyšetření bylo prováděno vsedě, při transkraniální stimulaci byla použita supramaximální intenzita stimulu a pacient byl vyzván k lehké volní kontrakci vyšetřovaného svalu, čímž bylo dosaženo facilitace měřené odpovědi. Při spinální stimulaci nebyla facilitace prováděna. Sumační svalový akční potenciál (CMAP) byl registrován z příslušného svalu povrchovými elektrodami bilaterálně pomocí Nicolet Viking IV (Viasis Biomedical Inc., Madison, WI). Bylo registrováno pět odpovědí z každého svalu.
Pro všechny vyšetřené svaly byla k další analýze použita nejkratší naměřená latence při transkraniální (centrální motorická latence – CML) a nejkratší latence při spinální (periferní motorická latence – PML) stimulaci. Byl vypočítán centrální motorický kondukční čas (CMCT = CML–PML).
Kritéria pro hodnocení léze MEPs: K posuzování léze kortikospinálního traktu pro HK i DK byl použit CMCT. Norma naší laboratoře pro CMCT pro m. APB = 7,2 ms (SD = 1 ms), pro m. TA == 14,6, ms (SD = 1,3 ms). Jako patologické byly označeny odpovědi, u kterých nebyla odpověď při transkraniální stimulaci získána, a jestliže došlo k prodloužení latence CMCT o více než 2 SD ve srovnání s normativními daty naší laboratoře.
Kritéria pro posouzení vzájemného poměru postižení motorických (MEPs) a somatosenzorických (SEPs) drah míšních
Pacienti byli rozděleni do dvou skupin na základě tíže postižení motorických a somatosenzorických drah míšních.
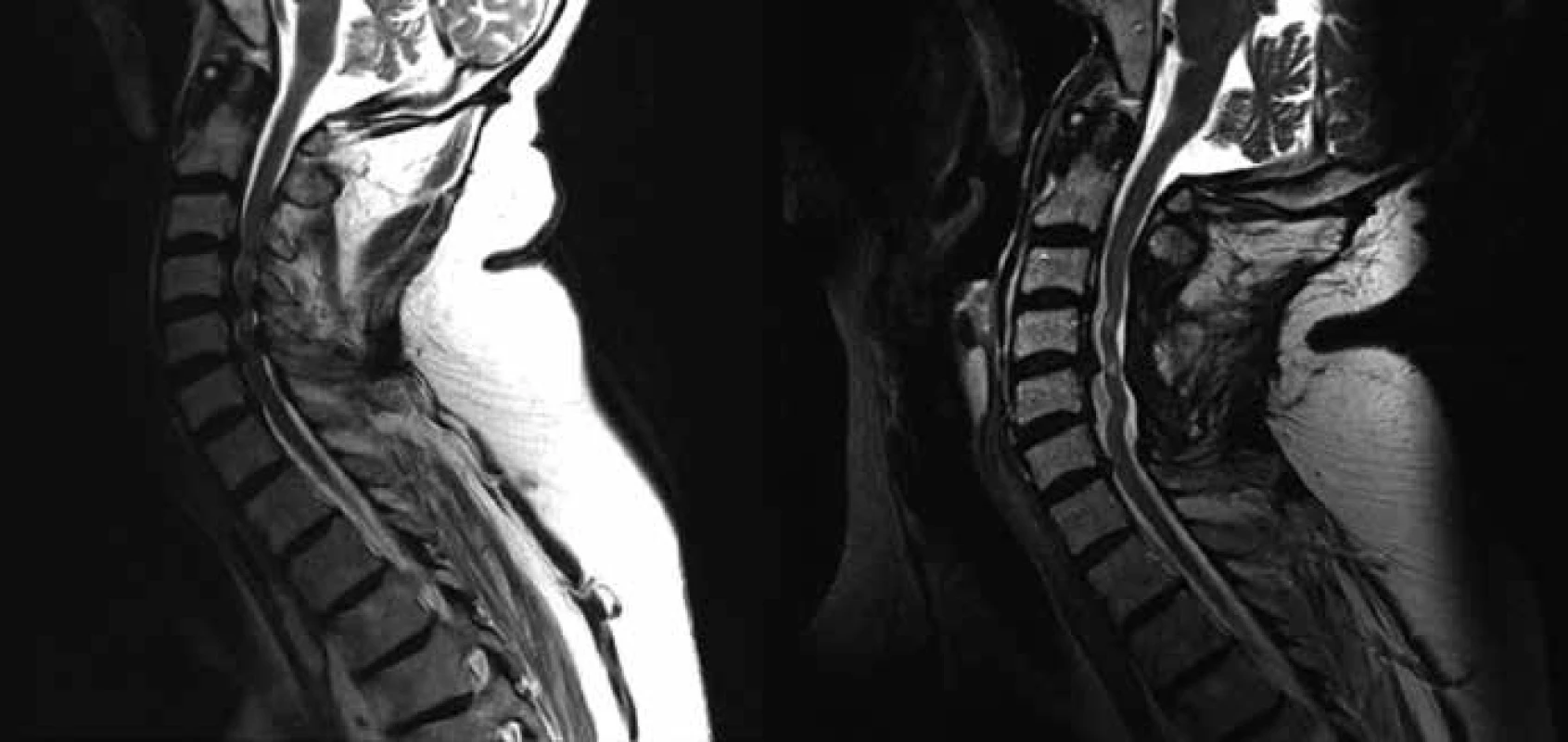
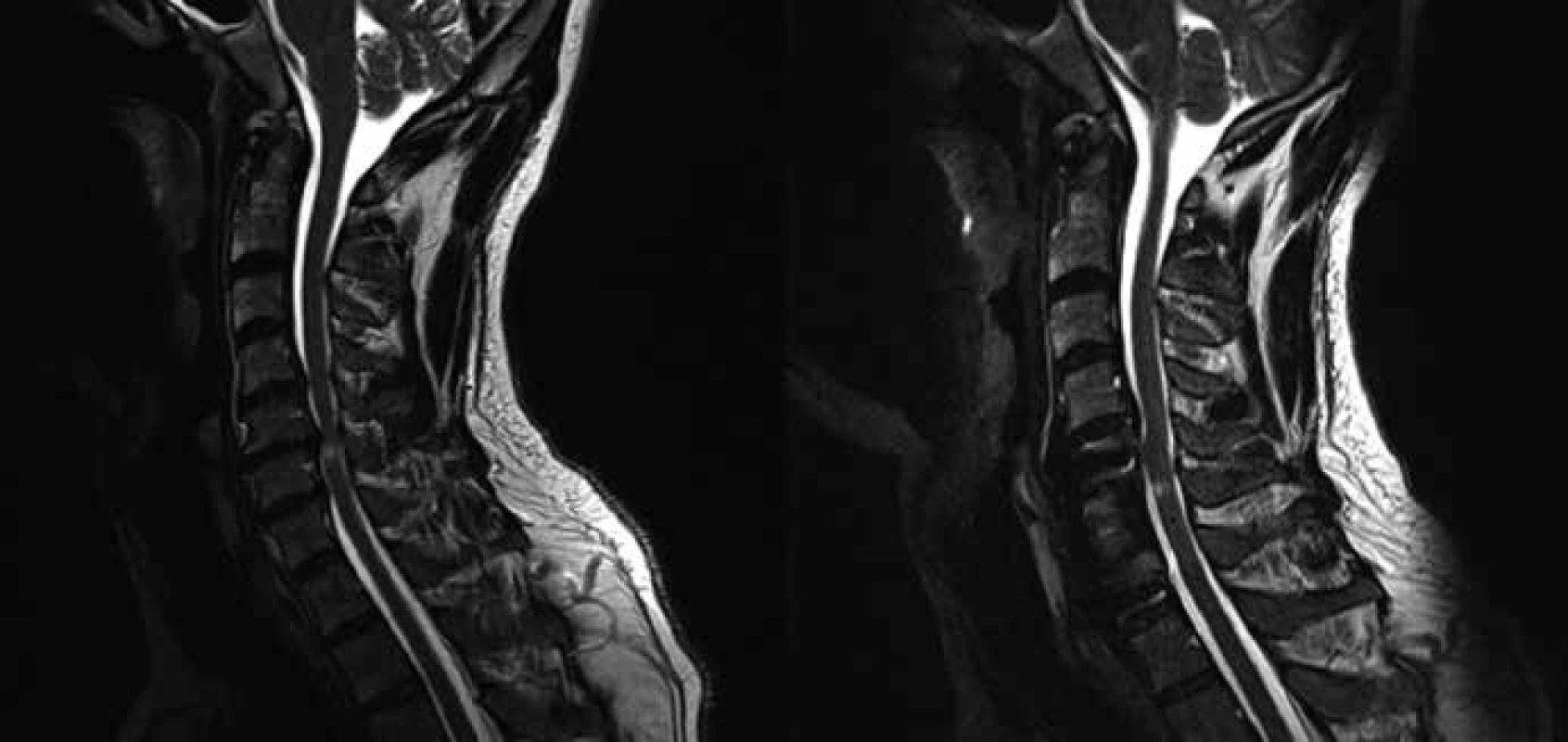
Do skupiny A byli zařazeni pacienti s větším postižením motorických drah míšních, tzn. pacienti, u kterých největší registrované postižení (hodnocené podle toho, o kolik SD byla naměřená veličina větší ve srovnání s normativními daty naší laboratoře) bylo naměřeno alespoň pro jednu hodnocenou veličinu MEP (obr. 1).
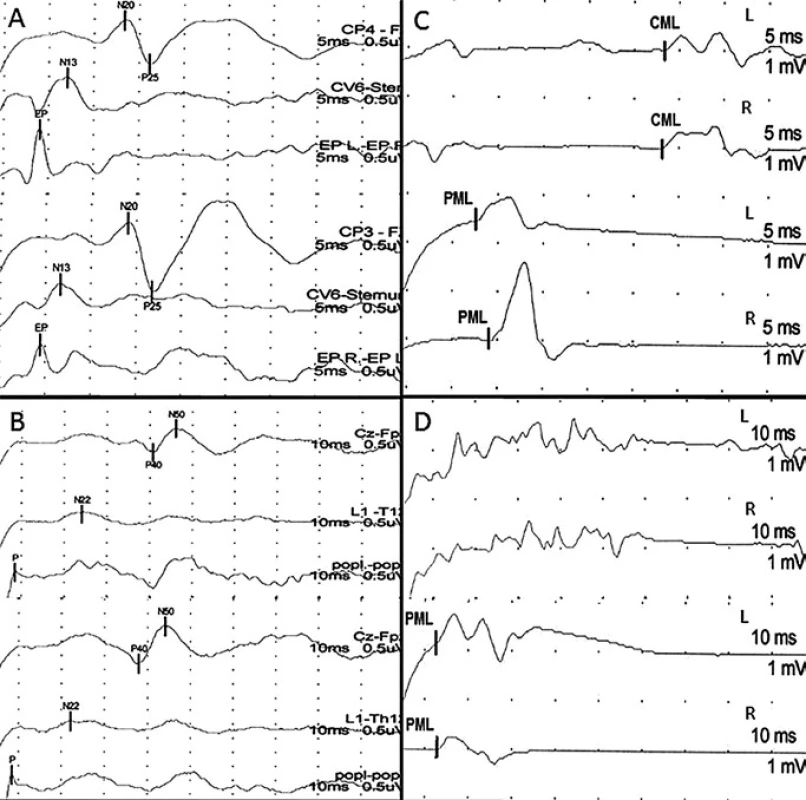
Do skupiny P byli zařazeni pacienti s větším postižením somatosenzorických drah míšních, tzn. pacienti, u kterých největší registrované postižení (hodnocené podle toho, o kolik SD byla naměřená veličina větší ve srovnání s normativními daty naší laboratoře) bylo naměřeno alespoň pro jednu hodnocenou veličinu SEP (obr. 2).
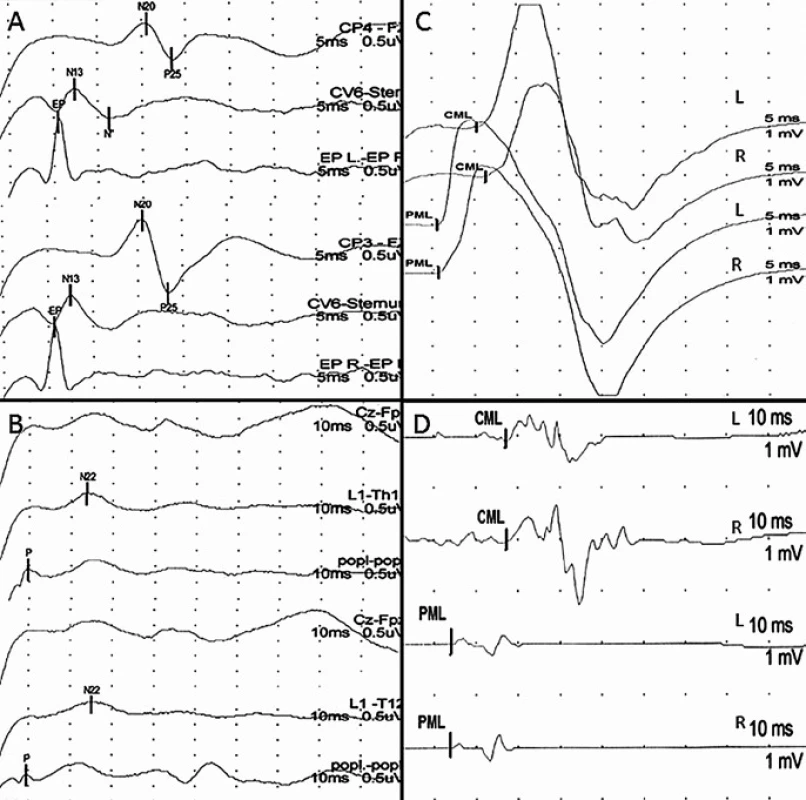
Operační strategie
Volba chirurgické strategie proběhla zcela standardně dle zavedených zvyklostí pracoviště na základě nálezu získaného z grafické dokumentace a zcela nezávisle na zhotoveném elektrofyziologickém vyšetření. Ventrální přístupy dominovaly u monosegmentálních patologií, dorzálních osteofytů či osteochondróz s protruzemi disků, méně často ve dvou a ojediněle ve třech etážích. Dorzální přístupy převažovaly u tří‑ a víceetážových postižení s přihlédnutím ke geometrii krční páteře a u dvouetážových patologií s dominující hypertrofií žlutých vazů. Při předoperačně manifestní kyfóze krční páteře byl zvolen vždy přístup přední. Při vyrovnané krční lordóze či lehké kyfotizaci, u pacientů ve vyšším věku s pokročilou degenerací (sesedlými disky při významných spondylogenních změnách typu přemosťujících osteofytů) byla indikována jak přední, tak i zadní dekomprese, a to individuálně dle konkrétní situace. V managementu rozhodování převažovaly u mladších jedinců spíše ventrální dekomprese, u starších pak většinou dekomprese dorzální. U vybraných nemocných hrálo při rozhodování roli i dynamické vyšetření MR, které v několika případech prokázalo stenózu kanálu páteřního na podkladě řasení žlutých vazů při retroflexi krční páteře či naopak zvýraznění protruzí disků při anteflexi krční páteře.
Celý soubor byl na základě vyšetření elektrofyziologického (ELF) a zvoleného operačního přístupu rozčleněn na čtyři podskupiny – Aa, Ap, Pa, Pp (tab. 1).

Porovnán byl vývoj klinického stavu, hodnocený dle mJOA, uvnitř skupin a mezi skupinami. Vzhledem k nezávislým souborům malého rozsahu, u kterých jsme nepředpokládali normální rozdělení dat, byly pro ověření hypotézy použity neparametrické testy. Na porovnání distribucí jednotlivých veličin byl využit Wilcoxonův test. Předložená hypotéza byla ověřena na hladině významnosti 5 %.
Pooperační období
Pooperačně probíhaly kontroly v intervalech 12 (K1) a 24 (K2) měsíců. Při všech kontrolách proběhlo klinické neurologické vyšetření, vyhodnocení mJOA a Nurickovy škály. U všech pacientů byly zhotoveny RTG skeny, u mobilních náhrad i dynamické projekce. V rozpětí 12 až 24 měsíců proběhla kontrola magnetickou rezonancí.
Výsledky
Elektrofyziologické předoperační vyšetření
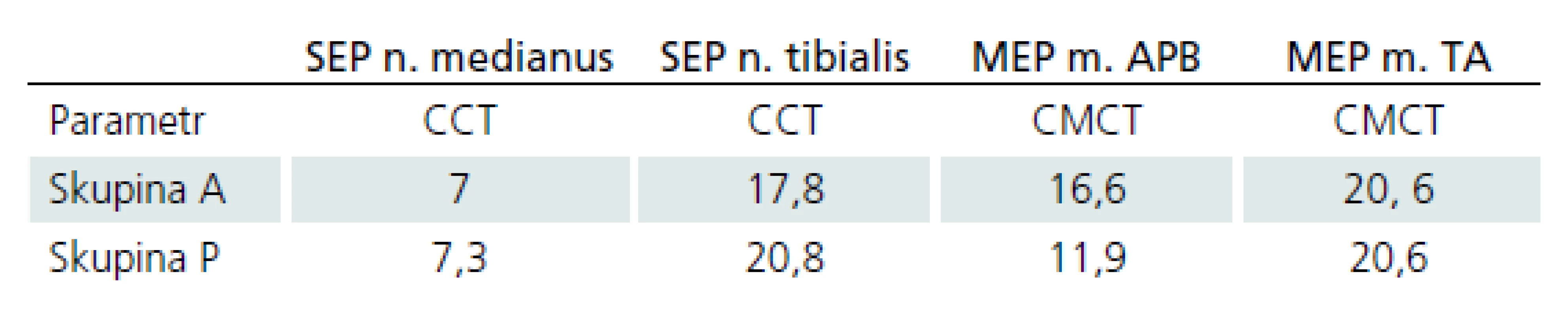
Pacienti byli na základě ELF vyšetření rozděleni do dvou skupin (princip rozdělení viz metodika). U skupiny A (tzn. u pacientů s větším postižením kortikospinálního traktu) byla průměrná hodnota MEP m. APB‑ CMCT více alterována než ve skupině P (tzn. u pacientů s větším postižením drah zadních provazců). Hodnoty MEP m. TA‑ CMCT byly srovnatelné mezi oběma skupinami (stejně alterovány). U skupiny P byla průměrná hodnota SEP n. medianus‑ CCT více alterována než u skupiny A. Hodnoty SEP n. tibialis‑ CCT byly alterovány přibližně stejně v obou skupinách (tab. 2).
Korelace EP a grafického předoperačního nálezu na MR
Pro potřebu srovnat elektrofyziologický a grafický nález byla vyhodnocena na MR skenech dominující komprese míchy. Pacienti byli členěni do tří skupin dle převažující patologie v kanálu páteřním: skupina s dominujícím ventrálním útlakem míchy, skupina s dominujícím dorzálním útlakem míchy a skupina s oboustranným, tj. centrálním útlakem míchy (tab. 3).
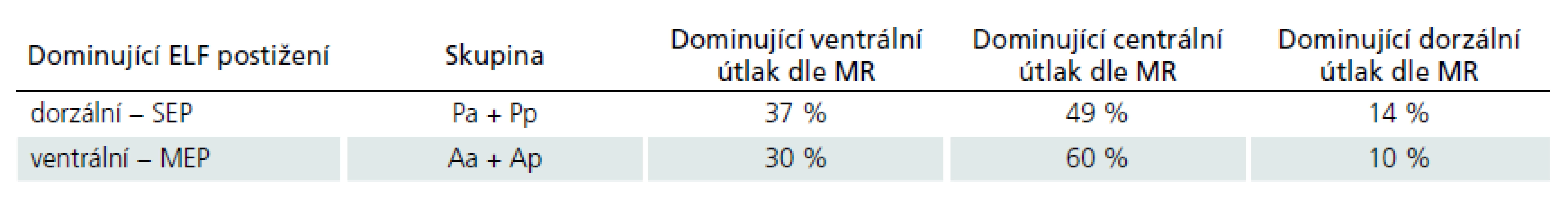
Ve skupinách A i P (členění dle dominujícího elektrofyziologického postižení) byl obdobný nález na předoperační MR. Nebyla tedy nalezena shoda mezi grafickým útlakem zpředu a alterací MEP, resp. grafickým útlakem zezadu a alterací SEP.
Operace
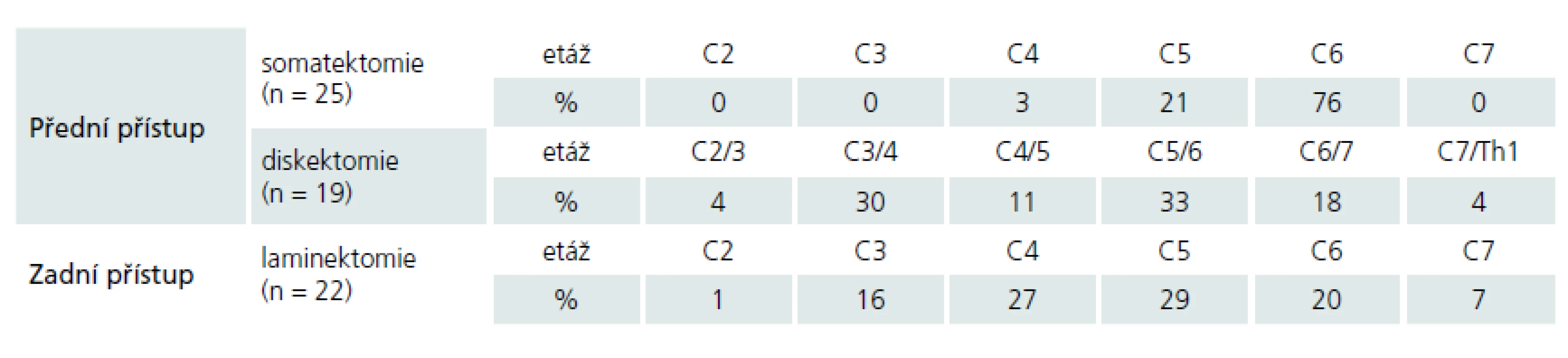
U 22 pacientů byl indikován dorzální přístup – skupina P, provedena byla laminektomie (obr. 3). Všechny dorzální operační přístupy proběhly v poloze vsedě s hlavou částečně flektovanou. U 43 pacientů – skupina A – proběhla operace z předního přístupu (obr. 4) – diskektomie + fúze, diskektomie + artroplastika, somatektomie. Všechny ventrální přístupy proběhly v supinační poloze.
Rozsah laminektomie byl v průměru 3,4 odstraněného oblouku (v rozmezí 2 až 6), nejčastěji dekomprimovaným segmentem byla etáž C5 (tab. 4). U ventrálních přístupů, somatektomií, byla jednoznačně nejčastěji dekomprimována etáž C6, u diskektomií s resekcí dorzálních osteofytů potom prostor C5/ 6 (tab. 4). U pacientů, kteří podstoupili diskektomii (n = 19), byla v pěti případech implantována mobilní náhrada, u tří pacientů byla provedena víceetážová diskektomie (2× dvě etáže, 1× tři etáže).
U operovaných pacientů nebyla po dobu sledování zaznamenána žádná chirurgická komplikace, která by vyžadovala revizní operaci či by vedla k ovlivnění vývoje CSM.
Na kontrolní MR byla prokázána suficientní dekomprese v operované oblasti.
Vývoj klinického stavu
Průměrné hodnoty Nurick skóre viz tab. 5.
Průměrné hodnoty mJOA škály viz tab. 6.
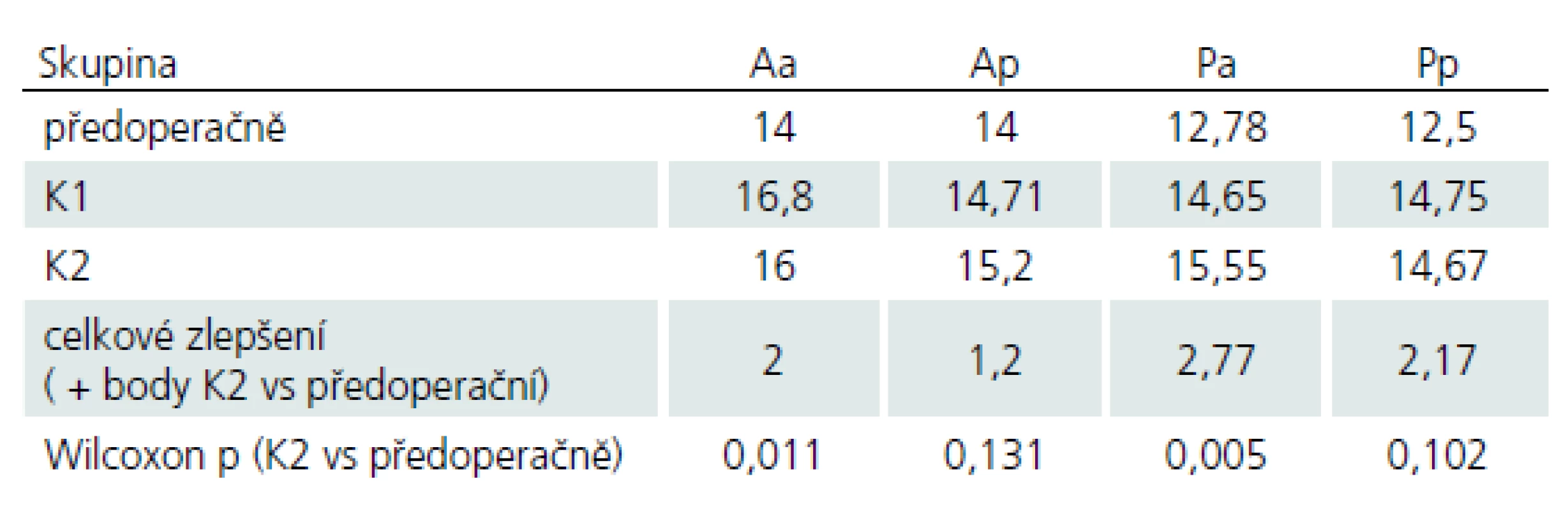
U žádného z pacientů nedošlo v období sledování, tj. 24 měsíců, k další progresi myelopatie. Celkově nastalo u 65 % pacientů zlepšení objektivního klinického stavu, u 35 % zůstal klinický stav neměnný. Nebyly rozdíly mezi jednotlivými sledovanými skupinami. Při hodnocení průměrných výsledků mJOA jednotlivých skupin lze pozorovat u všech zlepšování stavu, statisticky významné pouze u skupin operovaných předním přístupem.
Diskuze
Studie byla zaměřena na možné ovlivnění výsledného klinického pooperačního stavu u CSM operačním přístupem určeným na základě funkčního vyšetření míchy pomocí většího postižení SEPs či většího postižení MEPs.
Po rozhodnutí o indikaci chirurgického řešení CSM spočívá chirurgická taktika v zhodnocení grafického nálezu a dle grafického nálezu je rozhodnuto o chirurgickém výkonu [2– 4,23,24]. Při běžném způsobu indikování není zohledněna tíže funkčního míšní postižení.
Přínos funkčního vyšetření míchy pomocí SEPs a MEPs pro diagnózu CSM byl však v řadě prací potvrzen [21,22,25,26]. Bylo prokázáno, že u lehčích forem CSM, s klinicky lehkými a nespecifickými symptomy, bývají abnormální MEPs [12]. Pacienti s klinicky jasnými známkami CSM mají patologické jak MEPs, tak SEPs. EP tedy pomáhají v klinické praxi určit tíži míšní komprese a dle některých autorů dokonce předpovídat výsledek chirurgické léčby [9]. V naší studii pacientů se středně těžkou CSM byly v obou skupinách (A i P), ve shodě s literárními údaji, registrovány změny SEPs i MEPs z horních i dolních končetin. Ve shodné míře byly registrovány patologické SEPs a MEPs z dolních končetin. Rozdíly pak byly v postižení drah pro horní končetiny, kdy u skupiny A bylo výraznější postižení MEPs a u skupiny P větší postižení SEPs. Literární nálezy i nálezy v naší skupině lze vysvětlit na základě somatotopického rozložení míšních drah, kdy laterálně uložené dráhy pro dolní končetiny mohou být poškozeny při menším tlaku na míchu, tedy u lehčích forem CSM. Centrálněji uložené dráhy pro HK jsou pak poškozeny při výraznějším útlaku, tedy u těžších forem CSM [8], což byl soubor pacientů v naší studii. Ve skupině P by pak větší postižení SEPs pro horní končetiny mohlo nasvědčovat většímu tlaku zezadu a větší postižení MEPs pro horní končetiny u skupiny A většímu tlaku zpředu.
Bylo potvrzeno, že korelace mezi grafickými a elektrofyziologickými známkami CSM se dle jednotlivých studií různí, podle některých autorů dosahují pouze 50 % [11]. V naší studii, v níž byli k operaci indikováni pacienti se středně těžkou formou myelopatie, byl u všech pacientů registrován jak patologický grafický nález, tak i patologické elektrofyziologické vyšetření SEPs i MEPs. Při hodnocení topografie grafického nálezu (tedy je‑li větší tlak na míchu zpředu či zezadu) a porovnání s elektrofyziologickým postižením (tedy zda je větší postižení drah anterolaterálního či zadního míšního segmentu) nebyl zjištěn rozdíl mezi oběma skupinami (tab. 3). Ve skupině pacientů A i ve skupině pacientů P byl procentuálně stejně zastoupen tlak na míchu zpředu i zezadu. Největší zastoupení v obou dvou skupinách však měla stenóza centrální, kde nebylo možno rozhodnout o převažujícím předním či zadním útlaku.
Z výše uvedeného vyplývá, že tlak na míchu zpředu či zezadu nerozhoduje o tom, zda bude více poškozena funkce zadních či předních míšních drah. Na podkladě grafického zobrazení nelze tudíž jednoznačně rozhodnout o dominantním funkčním postižení míchy.
V literatuře nebyla nalezena práce, která by se týkala vztahu operačního přístupu a lokalizace míšního postižení hodnoceného dle EP na pooperační vývoj CSM. V naší studii bylo potvrzeno významné klinické zlepšení pacientů operovaných předním přístupem, a to bez souvislosti s iniciálním elektrofyziologickým postižením. Tento fakt lze vysvětlit tím, že přední míšní dekomprese, je‑li doplněna fúzí, může vést k výraznějšímu uvolnění míchy než dekomprese zadní, u níž je zachován pohyb páteře, a nejsou zde tudíž vyloučeny dynamické příčiny stenózy.
Výraznější klinické zlepšení u předních ve srovnání se zadními přístupy publikovali i Hirai et al [27]. Horší výsledky u dorzálních přístupů by mohly být vysvětleny na podkladě přetrvávajícího možného ventrálního útlaku v součinnosti s možným reziduálním vaskulárním postižením (traumatizace a. spinalis anterior) [28– 30]. Tento fakt potvrzuje další pozorování, kdy Hirai et al prokázali, že výsledný klinický stav skupiny dorzálních přístupů, kde po operaci nebyl přítomen žádný reziduální útlak míchy zpředu na grafickém kontrolním vyšetření, je totožný se skupinou pacientů operovanou zpředu [31].
Dalším možným důvodem výraznějšího zlepšení u ventrálních dekompresí je menší rozsah míšního postižení (mono‑ či bisegmentální dekomprese) oproti obvykle extenzivnějšímu míšnímu útlaku, který dominoval u skupiny dorzálních dekompresí (v naší sestavě průměrně dekomprimováno 3,4 laminy).
Přirozený průběh CSM je spíše nepředvídatelný, proto je stále zvažována otázka vhodnosti a načasování operace [32– 34]. Stranou stojí těžší a rychle progredující formy onemocnění, kde se většina prací shoduje ve vhodnosti indikace dekomprese [1]. U lehkých a středně těžkých forem jsou jak práce poukazující na ekvivalenci konzervativní a chirurgické terapie [35,36], tak studie prokazující jednoznačný přínos operace, a to nejen povšechně, ale i pro speciální případy lehkých forem [36,37]. V naší práci bylo prokázáno objektivní neurologické zlepšení hodnocené dle mJOA skóre v každé ze sledovaných skupin. Celkově se jednalo o zlepšení u 65 % pacientů. Tyto výsledky jsou srovnatelné s literárními údaji. Hirai et al [31] uvádějí ve své práci pooperační zlepšení JOA skóre až u 62 z 64 pacientů po dobu pěti let.
Závěr
Studie prokázala statisticky významné zlepšení objektivního nálezu pouze u skupin předních operačních přístupů bez ohledu na fakt, zda byla dominantní míšní patologie předoperačně dle EP lokalizována ventrálně či dorzálně. Výsledky studie nepotvrzují přínos volby operačního přístupu na základě lokalizace dominantní míšní patologie dle výsledků EP.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 15. 2. 2013
Přijato do tisku: 15. 5. 2013
MUDr. David Štěpánek
FN Plzeň
Alej Svobody 80
304 60 Plzeň
e-mail: stepanekd@fnplzen.cz
Zdroje
1. Bednařík J, Ambler Z, Růžička E. Klinická neurologie: část speciální II. 1st. ed. Praha: Triton; 2010: 711– 1277.
2. Mummaneni PV, Haid RW, Rodts GE. Combined ventral and dorsal surgery for myelopathy and myeloradiculopathy. Neurosurgery 2007; 60 (Suppl 1): S82– S89.
3. Kim PD, Ludwig SC, Gelb D, Poelstra K. Cervical Spine Update on the management of axial neck pain, cervical radiculopathy and myelopathy. Current Orthopaedic Practice 2008; 19(4): 425– 429.
4. Lu JJ. Cervical laminectomy: technique. Neurosurgery 2007; 60 (Suppl 1): S149– S153.
5. Kiris T, Killincer C. Cervical Spondylotic Myelopathy Treated by Oblique Corpectomy: A Prospective Study. Neurosurgery 2008; 62(3): 674– 682.
6. Stetkárova I, Kofler M. Cutaneous silent periods in the assessment of mild cervical spondylotic myelopathy. Spine 2009; 34(1): 34 – 42.
7. Lo YL. How has electrophysiology changed the management of cervical spondylotic myelopathy? Eur J Neurol 2008; 15(8): 781– 786.
8. Lo YL. The role of electrophysiology in the diagnosis and management of cervical spondylotic myelopathy. Ann Acad Med Singapore 2007; 36(11): 886– 893.
9. Takahashi J, Hirabayashi H, Hashidate H, Ogihara N,Yamazaki I, Kamimura M et al. Assessment of cervical myelopathy using transcranial magnetic stimulation and prediction of prognosis after laminoplasty. Spine 2008; 33(1): E15– E20.
10. Simó M, Arányi Z. Role of motor evoked potentials in the diagnosis of myelopathy associated with cervical spondylosis. Ideggyogy Sz 2003; 56(1– 2): 51– 57.
11. Nové‑ Josserand A, André‑ Obadia N, Mauguière F. Cervical spondylotic myelopathy: motor and somatosensory evoked potentials, clinical and radiological correlation. Rev Neurolog 2002; 158(12): 1191– 1197.
12. Simó M, Szirmai I, Arányi Z. Superior sensitivity of motor over somatosensory evoked potentials in the diagnosis of cervical spondylotic myelopathy. Eur J Neurol 2004; 11(9): 621– 626.
13. Bednařík J, Kadaňka Z, Dušek L, Kerkovsky M, Vohanka S, Novotny O et al. Presymptomatic spondylotic cervical myelopathy: an updated predictive model. Eur Spine J 2008; 17(3): 421– 431.
14. Kadaňka Z, Mareš M, Bednařík J, Smrcka V, Krbec M,Chaloupka R et al. Predictive factors for spondylotic cervical myelopathy treated conservatively or surgically. Eur J Neurol 2005; 12(1): 55– 63.
15. Kadaňka Z, Mareš M, Bednařík J, Smrcka V, Krbec M,Chaloupka R et al. Predictive factors for mild forms of spondylotic cervical myelopathy treated conservatively or surgically. Eur J Neurol 2005; 12(1): 16– 24.
16. Martín R, Carda JR, Montiaga F, Pinto JI, Sanz F, Paternina B et al. Cervical myelopathy: retrospective analysis of surgical results in 53 cases treated by anterior cervical discectomy and interbody fusion. Neurocirugia 2005; 16(3): 235– 255.
17. Kadaňka Z, Bednařík J, Novotný O, Urbánek I, Dušek L. Cervical spondylotic myelopathy: conservative versus surgical treatment after 10 years. Eur Spine J 2011; 20(9): 1533– 1538.
18. Nurick S. The natural history and the results of surgical treatement of the spinal cord disorder associated with cervical spondylosis. Brain 1972; 95(1): 101– 108.
19. Benzel EC, Lancon J, Kesterson L, Hadden T. Cervical laminectomy and dentate ligament section for cervical spondylotic myelopathy. J Spin Disord 1991; 4(3): 286– 295.
20. Kim Y, Kim Y, Ko Y. Myelopathy Caused by Soft Cervical Disc Herniation : Surgical Results and Prognostic Factors. J Korean Neurosurg Soc 2007; 42(6): 441– 445.
21. Cruccu G, Aminoff MJ, Curio G, Guerit JM, Kakigi R, Mauguiere F et al. Recommendations for the clinical use of somatosensory‑ evoked potentials. Clin Neurophysiol 2008; 119(8): 1705– 1719.
22. Groppa S, Oliviero A, Eisen A, Quartarone A, Cohen LG, Mall V et al. A practical guide to diagnostic transcranial magnetic stimulation: report of an IFCN committee. Clin Neurophysiol 2012; 123(5): 858– 882.
23. Wen S, Wong IO, Long MJ, Li J, Li X, Guo D et al. Effectiveness of Three Surgical Decompression Strategies for Treatment of Multilevel Cervical Myelopathy in Three Spinal Centres in China. Spine 2012; 37(17): 1463– 1469.
24. Kristof RA, Kiefer T, Thudium M, Ringel F, Stoffel M, Kovacs A et al. Comparison of ventral corpectomy and plate‑ screw‑ instrumented fusion with dorsal laminectomy and rod‑ screw‑ instrumented fusion for treatment of at least two vertebral‑ level spondylotic cervical myelopathy. Eur Spine J 2009; 18(12): 1951– 1956.
25. Di Lazzaro V, Restuccia D, Colosimo C, Tonali P.The contribution of magnetic stimulation of the motor cortex to the diagnosis of cervical spondylotic myelopathy. Correlation of central motor conduction to distal and proximal upper limb muscles with clinical and MRI findings. Electroencephalogr Clin Neurophysiol 1992; 85(5): 311– 320.
26. Chistyakov AV, Soustiel JF, Hafner H, Feinsod M.Motor and somatosensory conduction in cervical myelopathy and radiculopathy. Spine 1995; 20(19): 2135– 2140.
27. Hirai T, Okawa A, Arai Y, Takahashi M, Kawabata S, Kato T et al. Middle‑term results of a prospective comparative study of anterior decompression with fusion and posterior decompression with laminoplasty for the treatment of cervical spondylotic myelopathy. Spine 2011; 36(23): 1940– 1947.
28. Fehlings MG, Skaf G. A review of the pathophysiology of cervical spondylotic myelopathy with insights for potential novel mechanisms drawn from traumatic spinal cord injury. Spine 1998; 23(24): 2730– 2737.
29. Baptiste DC, Fehlings MG. Pathophysiology of cervical myelopathy. Spine J 2006; 6 (Suppl 6): S190– S197.
30. Shedid D, Benzel EC. Cervical spondylosis anatomy: pathophysiology and biomechanics. Neurosurgery 2007; 60 (Suppl 1): S7– S13.
31. Hirai T, Kawabata S, Enomoto M, Kato T, Tomizawa S, Sakai K et al. Presence of anterior compression of the spinal cord after laminoplasty inhibits upper extremity motor recovery in patients with cervical spondylotic myelopathy. Spine 2012; 37(5): 377– 384.
32. Epstein JA. The surgical management of cervical spinal stenosis, spondylosis, and myeloradiculopathy by means of the posterior approach. Spine 1988; 13(7): 864– 869.
33. Melvin, D, Law MD, Bernhardt M, White AA. Evaluation and Management of Cervical Spondylotic of Myelopathy. J Bone Joint Surg 1994; 76(9): 1420– 1433.
34. Rowland LP. Surgical treatment of cervical spondylotic myelopathy: time for a controlled trial. Neurology 1992; 42(1): 5– 13.
35. Kadanka Z, Bednarík J, Vohánka S, Vlach O, Stejskal L, Chaloupka R et al. Conservative treatment versus surgery in spondylotic cervical myelopathy: a prospective randomised study. Eur Spine J 2000; 9(6): 538– 544.
36. Shimomura T, Sumi M, Nishida K, Maeno K, Tadokoro K, Miyamoto H et al. Prognostic factors for deterioration of patients with cervical spondylotic myelopathy after nonsurgical treatment. Spine 2007; 32(22): 2474– 2479.
37. Sampath P, Bendebba M, Davis JD, Ducker TB. Outcome of patients treated for cervical myelopathy. A prospective, multicenter study with independent clinical review. Spine 2000; 25(6): 670– 676.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2014 Číslo 1
Nejčtenější v tomto čísle
- Mikrochirurgická léčba symptomatických pineálních cyst
- Chirurgická léčba hydrocefalu
- Stiff‑ person syndrom sdružený s myotonickou dystrofií 2. typu – kazuistika
- Mezinárodní standardy pro neurologickou klasifikaci míšního poranění – revize 2013
