Úskalí diagnostiky progresivní multifokální leukoencefalopatie u pacientů infikovaných lidským virem imunodeficience – kazuistiky
Difficulties Diagnosing Progressive Multifocal Leukoencephalopathy in Patients Infected with the Human Immunodeficiency Virus – Case Reports
Progressive Multifocal Leukoencephalopathy (PML) is a focal inflammatory process of white brain matter induced by polyomaviral infection that affects HIV‑ positive individuals, patients with hematologic malignancies and recently also patients on a biological treatment. PML is a typical opportunistic infection of patients with AIDS. Examination with magnetic resonance imaging (MRI) and detection of JC virus (JCV) DNA in the cerebrospinal fluid (CSF) are the most important approaches to the diagnosis of PML. Case reports document that PML diagnosis is not easy. The disease may develop before the number of CD4+ lymphocytes drops below 100 cells/ µl. Appearance of lesions on a CT scan and MRI is not completely specific and may be mistaken for brain toxoplasmosis, an ischemic lesion or other intracranial processes; sometimes it can start with one lesion only, suggesting a unifocal process. The paper draws a reader’s attention to the use of molecular biological diagnostics. It describes initial experience with JCV detection in the CSF using PCR in the Czech Republic and, at the same time, it discusses limited sensitivity of the method. PML prognosis is poor but disease progression can be slowed down by well managed combined antiretroviral therapy (cART). The initiation of cART in persons with severe immunodeficiency may in rare cases lead to paradoxical development of PML as a sign of immune reconstitution inflammatory syndrome (IRIS).
Key words:
progressive multifocal leukoencephalopathy – human immunodeficiency virus – acquired immunodeficiency syndrome – JC virus
Autoři:
H. Rozsypal 1; D. Jilich 1; P. Hubáček 2; M. Holub 1
Působiště autorů:
Klinika infekčních a tropických nemocí 1. LF UK a Nemocnice Na Bulovce, Praha
1; Laboratoř molekulární genetiky, Ústav lékařské mikrobiologie a Klinika dětské hematologie a onkologie 2. LF UK a FN v Motole, Praha
2
Vyšlo v časopise:
Cesk Slov Neurol N 2013; 76/109(4): 501-507
Kategorie:
Kazuistika
Práce vznikla s podporou výzkumného záměru PRVOUK P2/ 1LF/ 3, podpořeno projektem MZČR koncepčního rozvoje FN Motol 00064203 a v rámci specifického vysokoškolského výzkumu SVV‑ 2012- 264506.
Autoři děkují MU Dr. Miroslavu Kašparovi, CSc., za poskytnutí CT a MR snímků.
Souhrn
Progresivní multifokální leukoencefalopatie (PML) je ložiskové zánětlivé postižení bílé hmoty mozku vyvolané polyomavirovou infekcí, které postihuje HIV pozitivní osoby, pacienty s hematologickými malignitami a v poslední době i pacienty léčené biologickou léčbou. PML je typická oportunní infekce pacientů s AIDS. K diagnóze nejvíce přispěje vyšetření magnetickou rezonancí (MR) a záchyt DNA JC viru (JCV) v mozkomíšním moku. Kazuistiky dokumentují, že diagnostika PML není jednoduchá. Onemocnění může přicházet dříve, než počet CD4+ lymfocytů klesne pod 100 bb/µl, vzhled lézí u zobrazovacích metod – CT a MR zobrazení – není zcela specifický a může být zaměněn s mozkovou toxoplazmózou, ischemickým ložiskem a jinými nitrolebními procesy; někdy může začít jediným ložiskem, čímž imponuje jako unifokální proces. Sdělení poukazuje na možnost molekulárně biologické diagnostiky, uvádí první zkušenosti s průkazem DNA JCV metodou PCR v likvoru u nás a současně upozorňuje na její nepříliš vysokou senzitivitu. Prognóza PML je infaustní, ale zpomalení progrese je zaznamenáváno u řádně vedené kombinované antiretrovirové terapie (cART). Ta může zvýšením zánětlivé odpovědi ve vzácných případech vést k paradoxnímu vyvolání nemoci – PML jako projevu syndromu imunitní obnovy (IRIS) – u osob s hlubokým imunodeficitem.
Klíčová slova:
progresivní multifokální leukoencefalopatie – virus lidské imunodeficence – syndrom získané imunodeficience – JC virus
Úvod
Progresivní multifokální leukoencefalopatie (PML) je fokální zánětlivé postižení bílé hmoty mozku vyvolané polyomavirovou infekcí, které postihuje HIV pozitivní osoby, pacienty s hematologickými malignitami a v poslední době i pacienty léčené biologickou léčbou. PML je typickou oportunní infekcí pacientů s AIDS, ale objevily se i případy v souvislosti s podáním monoklonálních protilátek, jako jsou rituximab, natalizumab a efalizumab [1– 4].
Úhrnný výskyt PML v populaci je zaznamenán v 4,4 případech na 100 000 obyvatel/ rok [5]. Pacienti s AIDS tvoří 4/ 5 analyzovaných pacientů v literatuře. Onemocnění se vyskytuje u 3– 7 % pacientů s AIDS. Po mozkové toxoplazmóze je PML druhá nejčastější oportunní infekce nervového systému [6]. V literatuře se objevují ojedinělé zprávy o výskytu PML u imunokompetentních jedinců [7,8].
Původcem onemocnění je JC virus patřící podle současné klasifikace Mezinárodního výboru pro taxonomii virů (International Committe for Taxonomy of viruses [http:/ / ictvonline.org]) do rodu Polyomavirus a čeledě Polyomaviridae. Byl poprvé izolován v roce 1971 a pojmenován iniciálami prvního pacienta. Je široce rozšířen a podle sérologických studií se usuzuje až na 80% promořenost v závislosti na studované populaci [9– 11]. Lidé zřejmě intermitentně vylučují virus, který dlouho přežívá v prostředí, např. v odpadních vodách, kontaminuje pitnou vodu a potraviny. Člověk se nakazí obvykle již v dětství požitím kontaminované vody nebo potravy, těsným kontaktem v domácnosti. Vstupní branou je dutina ústní, horní dýchací cesty a gastrointestinální trakt. Místem primárního pomnožení viru je tkáň tonzil, odtud se dostává hematogenně do dalších tkání a orgánů. Hlavním rezervoárem viru v těle jsou ledviny a kostní dřeň. K aktivaci latentního viru dochází při poklesu CD4+ lymfocytů pod 200 bb/ µl, ale obvykle pod 100 bb/ µl. Imunosuprese dovolí migraci viru do centrálního nervového systému a genetickou změnu, která umožní množení v nervové tkáni. Virus izolovaný z mozku postiženého PML se totiž geneticky liší od viru izolovaného odjinud [12].
Morfologickým korelátem PML jsou ložiska demyelinizace hlavně v parietálních, méně okcipitálních, pak frontálních a nakonec temporálních lalocích. Méně často je postižena šedá hmota, zejména bazálních ganglií. PML může zasáhnout i mozeček, mozkový kmen a corpus callosum. Mikroskopicky jsou ložiska demyelinizace obklopena zónou lymfomonocytární infiltrace. V jádrech oligodendrocytů jsou patrné velké acidofilní inkluze a astrocyty jsou přeměněny v obrovské buňky s laločnatými jádry bizarních tvarů [13].
Příznaky PML záleží na přednostní lokalizaci lézí. U nemocného zvolna nastupují některé z následujících neurologických nebo psychických příznaků: porucha hybnosti končetin, porucha vizu, poruchy paměti, bolesti hlavy, křeče a poruchy koordinace a rovnováhy. Objektivně se prokáže ložiskový neurologický nález – spastická monoparéza či hemiparéza, výpadek zorného pole, bývají změny osobnosti, bradypsychie a známky demence. Časté jsou motorické poruchy jako ataxie, adiadochokinéza a titubace. Je popisován i záchvat křečí. Poruchy čití, horečka a bolesti hlavy jsou neobvyklé a svědčí spíše pro mozkovou toxoplazmózu. Onemocnění má chronický, progredující průběh. Vývoj vede během řady týdnů až měsíců k úplné ztrátě soběstačnosti a pohyblivosti.
Laboratorní nálezy nebývají charakteristické. Důležitým předpokladem diagnózy je hluboká CD4+ lymfopenie (obvykle pod 100 bb/ µl). Vyšetření likvoru poskytuje nespecifické abnormity asi u třetiny pacientů, častým nálezem je proteinocytologická disociace. Významný je průkaz DNA JCV v likvoru, jeho senzitivita není příliš vysoká – asi 80%; specificita je vyhovující – vyšší než 90%. O významu detekce JC viru v likvoru bude pojednáno podrobněji.
Pro diagnózu jsou významná některá zobrazovací vyšetření. Při vyšetření výpočetní tomografií (CT) se prokazují postupně rostoucí hypodenzní okrsky bílé hmoty nejvíce parietálních a okcipitálních laloků zasahující ke kortikomedulární junkci bez vztahu k cévám. Jsou obvykle oboustranná, ale ne symetrická. Ložiska nejeví známky expanze, nicméně u PML jako projev IRIS mohou být zastižena i expanzivně se chovající ložiska s postkontrastně se sytícím lemem. Rovněž v mozečku někdy mohou být přítomny známky expanze a naznačený postkontrastní lem. Nevýhoda CT je, že obraz se často opožďuje za klinickými příznaky. Magnetickorezonanční (MR) zobrazení je citlivější metoda. MR vyšetření zachytí ve stejnou dobu jako CT obvykle více ložisek – hyposignálních v T1W obraze a hypersignálních v T2W obraze a ve FLAIR sekvenci. Zpočátku je postižena především subkortikální bílá hmota – tzv. U vlákna intrakortikálních spojů. S postupem choroby se léze šíří na ostatní bílou hmotu. Vzhledem k tomu, že onemocnění začíná ve většině případů pozvolna jako unifokální (nikoli multifokální) proces subkortikální bílé hmoty, stanovení diagnózy může narazit na jistá úskalí. Příznaky a obraz v počítačové tomografii (CT) bývají zpočátku hodnoceny jako projevy mozkové toxoplazmózy, primárního mozkového lymfomu nebo ischemické léze mozku [14,15].
Podle lokalizace lézí může být přínosné vyšetření perimetru. Elektroencefalografické vyšetření (EEG) ukazuje spíše fokální polymorfní zpomalení (théta a delta rytmus) nebo difuzní zpomalení (podobně jako u HIV encefalopatie). Evokované potenciály mohou detekovat postižení zadní jámy i při negativitě CT obrazu.
Mozková biopsie dovoluje některá vyšetření pro definitivní stanovení diagnózy: histologicky se prokáží fokální demyelinizace, bizarní velké astrocyty a zduřelé oligodendrocyty s inkluzemi, elektronmikroskopicky, imunocytochemicky a molekulárněgeneticky (hybridizací in situ a PCR) se detekuje JC virus.
V éře před kombinovanou antiretrovirovou léčbou (cART) se udával medián přežití od prvních příznaků 3– 6 měsíců; jinde se uvádí, že do osmi měsíců umírá asi 80 % pacientů. Progrese byla pomalejší při vyšších hodnotách CD4+ lymfocytů (nad 200 bb/ µl) [16– 18].
Není známa účinná léčba. V minulosti zkoušené léky, jako foscarnet, interferon, cytostatika, např. topotecan, irinotecan nebo cytarabin, se neukázaly být účinnými [19]. Naděje se vkládaly do cidofoviru a kamptotecinu. Kamptotecin je alkaloid s cytostatickým účinkem. Inhibuje topoizomerázu I, enzym důležitý pro replikaci JC viru. V klinické studii s derivátem kamptotecinu – topotekanem – byl prokázán na malém počtu pacientů dobrý klinický efekt, nicméně došlo k jednomu úmrtí v důsledku hematotoxicity [20– 22]. Sporný efekt léčby byl zaznamenán i po podání cidofoviru. Tento nukleotidový derivát používaný pro léčbu cytomegalovirové (CMV) retinitidy však po metaanalýze zahrnující 370 pacientů nakonec propadl. K jistému zkreslení došlo tím, že cidofovir byl podán pacientům s rychle progredujícím onemocněním [23,24]. V posledních letech byla navržena léčba 5-HT2a inhibitory nebo serotoninovými inhibitory, protože serotoninergní receptor na gliových buňkách je i receptorem pro JC virus [25]. Bylo publikováno několik anekdotických sdělení s risperidonem a mirtazapinem, ale kontrolované studie nejsou k dispozici [26– 29]. Rozhodující v léčbě zůstává cART. Zlepšení imunologického profilu vede ke zpomalení progrese PML [30– 36]. Problémem může být paradoxní zhoršení v důsledku IRIS. V této souvislosti se popisuje specifická forma PML – PML jako projev IRIS [37– 40]. Kombinovaná ART tak přesto zůstává reálnou šancí zlepšení krátkodobé prognózy. Vzhledem k synergizmu HIV a JC viru je doporučována volba antiretrovirotik s dobrou penetrací do CNS, např. zidovudinu, emtricitabinu, abacaviru, nevirapinu a lopinaviru [41].
Metodika
Retrospektivní studie zahrnuje všechny případy PML diagnostikované a hospitalizované na lůžkách Infekční kliniky Nemocnice Na Bulovce v Praze za 26 let – od založení AIDS centra v roce 1985 do 31. srpna 2011. Během této doby bylo ošetřováno 11 případů PML u AIDS. Pacienti byli vyšetřováni standardním způsobem, provedena rutinní imunologická a virologická vyšetření; zobrazovací vyšetření byla provedena na Radiodiagnostické klinice 1. LF UK a Nemocnice Na Bulovce a pitvy na Patologicko‑anatomickém oddělení Nemocnice Na Bulovce. Vyšetření mozkomíšního moku na přítomnost DNA JCV metodou PCR byla provedena v Laboratoři molekulární genetiky Ústavu lékařské mikrobiologie FN Motol. Hodnota virové nálože je uvedena v exponenciálním tvaru, normalizovaná na 10 000 lidských genomových ekvivalentů.
Kazuistika 1
Zřejmě první typický průběh PML byl na AIDS centru Nemocnice Na Bulovce diagnostikován již v roce 1999. Tehdy se objevil u 74leté ženy infikované HIV od svého manžela hemofilika a z tohoto důvodu řadu let dispenzarizované a léčené na ambulanci infekční kliniky. Protože možnosti léčby antiretrovirotiky byly tehdy velmi omezené, v posledních vyšetřeních buněčné imunity počet CD4+ lymfocytů klesl na 30 bb/ µl. Pacientka byla přijata pro několik týdnů se rozvíjející dezorientaci, která vyústila až v neschopnost běžných denních úkonů. Po přijetí byla dehydratovaná, úzkostná a zmatená. Po rehydrataci a počáteční stabilizaci se klinický stav mírně zlepšil, kardiopulmonálně byla kompenzována, v neurologickém nálezu dominovaly příznaky organického psychosyndromu, bez známek lateralizace. Byla provedena lumbální punkce s negativním likvorovým nálezem a CT mozku, kde byla popsána hypodenzní ložiska v bílé hmotě zejména okcipitální oblasti, imponující jako ischemické změny. JC virus v likvoru se nepodařilo elektronmikroskopicky prokázat (vyšetření JCV DNA nebylo v ČR ještě k dispozici). Přestože byla diagnóza PML, event. v kombinaci s aterosklerotickými změnami považována za nejpravděpodobnější, byl zaveden terapeutický pokus s protitoxoplazmovými chemoterapeutiky. Efekt léčby nebyl patrný a psychická deteriorace zvolna progredovala. Pacientka byla výrazně bradypsychická, dezorientovaná, později se objevily febrilní špičky. V dalším průběhu se objevily klonické křeče levostranných končetin s následnou levostrannou hemiparézou a afázií. Tři dny před smrtí se zhoršil stav vědomí, vyhasla reakce na algický podnět. Na plicích se rozvinul poslechový nález svědčící pro hypostatickou pneumonii a pacientka zemřela za šest týdnů od přijetí. Sekční nález potvrdil klinické diagnózy včetně PML.
Kazuistika 2
Druhý případ ukazuje, že ne vždy jsou léze multifokální. U 50letého pacienta, bezdomovce, byla HIV infekce diagnostikována v prosinci 1998 při záchytu plicní tuberkulózy. Tři měsíce po ukončení léčby plicní tuberkulózy byl přijat s třítýdenní anamnézou horeček a následnou centrální pravostrannou hemiparézou. CT mozku ukázalo v hloubce parietálního laloku ložisko bez postkontrastně se sytícího lemu, které na kontrolním snímku i přes protitoxoplazmovou léčbu progredovalo. Z vyšetření likvoru ani sérologií toxoplazmózy se etiologie neozřejmila. Počet CD4+ lymfocytů činil 190 bb/ µl. Byla reinicializována antiretrovirová chemoterapie. Stav pacienta se zvolna horšil, rozvinula se léze lícního nervu, expresivní afázie a prerenální uremie. V plánu bylo provedení angiografie a stereotaktické biopsie, avšak pro progresivní horšení stavu se již neuskutečnily. Pacient upadl do bezvědomí a zemřel. Vzhledem k jedinému ložisku byl na prvním místě zvažován mozkový tumor, nejspíše primární mozkový lymfom. PML se jevila méně pravděpodobnou, mimo jiné pro lepší hodnoty CD4+ lymfocytů, než je u této diagnózy obvyklé. Pitva přinesla jednoznačný histologický důkaz PML.
Kazuistika 3
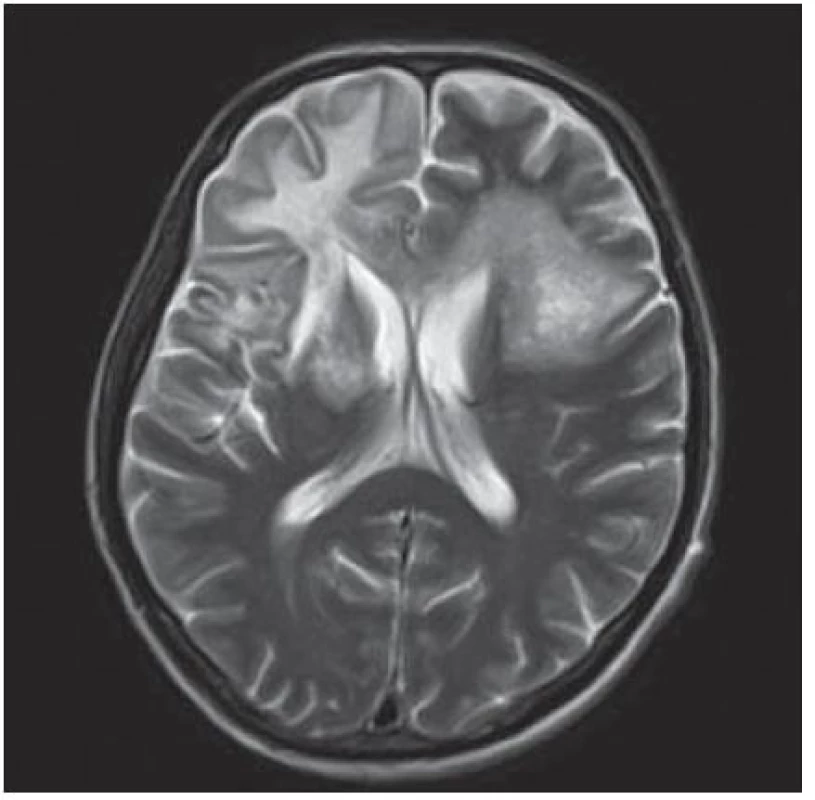
Další pacient byl 44letý HIV pozitivní muž s amblyopií levého oka a po prodělané syfilidě v roce 1980. Infekce HIV byla zjištěna v roce 1990, pak byl dispenzarizován na infekční klinice a léčen antiretrovirotiky. Nicméně postupně se vyvinula multirezistence, naposledy byl léčen kombinací enfuvirtid (Fuzeon) + lopinavir/ ritonavir (Kaletra) + tenofovir (Viread) s ne zcela uspokojivým efektem. Řádně užíval profylaxi cotrimoxazolem (i vzhledem k séropozitivitě toxoplazmózy). Přes uvedenou léčbu došlo k progresi imunodeficitu k hodnotám CD4+ lymfocytů na 93 bb/ µl a virová nálož HIV dosáhla 300 000 kopií/ ml. V lednu 2004 proběhl herpes zoster na krku vpravo, byl léčen valacyklovirem, následně se objevily parestezie v dolní čelisti vpravo, bolest pravého ramene a paže. Asi od poloviny února pozoroval zhoršení vizu – neostré vidění – na původně zdravém pravém oku, nález na fundu byl negativní, předepsané brýle nepomohly. Na konci února pozoroval další zhoršení zraku, oftalmoskopický nález prokázal jen HIV retinopatii („cotton wool spots“), byla zvažována retrobulbární neuritida. Rozhodující nález byl zjištěn při vyšetření CT. Hypodenzní ložiska v okcipitálních lalocích – více vpravo (obr. 1) – spíše byla hodnocena jako ischemická, proto bylo provedeno MR vyšetření, jež v T2W a FLAIR obraze poskytlo obraz nepravidelných neostře ohraničených hypersignálních ložisek oboustranně okcipitálně i parietálně. Retrobulbární neuritida nebyla MR a VEP potvrzena. Sérologické známky lues nevykazovaly známky aktivity. Byla zahájena léčba pulzem kortikoidů, acyklovirem, nootropními a vazodilatačními léky. Po počátečním mírném zlepšení vizu se již porucha zraku nezměnila, vatovitá ložiska na fundu ustoupila. Byla provedena lumbální punkce s minimálním nespecifickým cytobiochemickým nálezem, byl učiněn pokus o eventuální záchyt VZ viru (vztah k prodělanému pásovému oparu), EB viru (pro eventuální vztah k mozkovému lymfomu), nálože HIV (HIV encefalopatie). K průkazu JC viru bylo v roce 2005 k dispozici jen elektronmikroskopické vyšetření a JC virus se neprokázal. Žádné z vyšetření neposkytlo jednoznačnou diagnózu, byla zvažována PML. Během dalších měsíců se přidaly závratě, nemocný postupně ztratil schopnost chůze a pozbyl zbytku zraku. Zemřel v květnu 2005, sekce potvrdila diagnózu PML.
Kazuistika 4
Relativně časný výskyt PML jsme zaznamenali u 45letého pacienta srbské národnosti s HIV infekcí diagnostikovanou v roce 2005. Tehdy byly imunologické i virologické ukazatele příznivé a ještě začátkem roku 2007 měl počet CD4+ lymfocytů 474 bb/ µl. Při kontrole, ke které se dostavil až v říjnu 2007, byl zastižen poměrně překvapivý pokles CD4+ lymfocytů k hodnotě 200 bb/µl a za další měsíc 227 bb/ µl. Byla mu naléhavě nabízena antiretrovirová léčba, kterou se však rozhodl neužívat. V březnu 2008 udával horší toleranci alkoholu, občas závrať a instabilitu. Neurologicky nebyl nápadný nález, ale byla naznačena titubace a mírná hyperreflexie, počet CD4+ lymfocytů dále poklesl na 161 bb/ µl. Virová nálož nebyla vysoká. Tehdy byla zahájena cART (zidovudin, lamivudin a lopinavir s ritonavirem), současně profylaxe cotrimoxazolem. V dubnu 2008 – během jedné ze svých četných zahraničních cest – pozoroval oslabení svalové síly levostranných končetin, tamtéž hypestezie, proto byl vyšetřen neurologem, CT mozku a vyšetření likvoru byly negativní, UZ karotid nevysvětlilo postižení. Až MR zobrazení prokázalo supratentoriálně i infratentoriálně ložiska ukazující na možnost demyelinizujícího onemocnění či PML. Po návratu do České republiky se objevily další obtíže: bolesti břicha, někdy nemohl hýbat levou polovinou těla, měl závratě a občas bolesti hlavy, soor, proto v červnu 2008 musel být hospitalizován s levostrannou hemiparézou a mírným kognitivním deficitem, krevní obraz a biochemické hodnoty zůstaly bez pozoruhodností, jen CRP bylo 41 mg/ l, počet CD4+ lymfocytů byl 131 bb/ µl. Opět bylo provedeno MR vyšetření, kde se zobrazila mnohočetná ložiska v bílé hmotě bez expanzivního chování (hyposignálních v T1W a hypersignálních v T2W nesytící se po gadoliniu, převaha postižení fibrae arcuateae těsně subkortikálně spojující sousední gyry, v zadní jámě postižena bílá hmota cerebela více vpravo), v likvoru hraniční nález proteinorachie 0,6 g/ l, lymfocyty 16/ 3, segmenty 1/ 3 (bb/ 3 µl). Likvorový nález, interpretovaný jako obraz chronického serózního zánětu se známkami tkáňové destrukce, byl podnětem pro řadu sérologických vyšetření, která však nerozhodla ve prospěch konkrétní diagnózy. Na EEG byl lehce abnormální záznam pro pomalé vlny sagitálně vzadu. Ač se dg. mozkové toxoplazmózy nejevila příliš pravděpodobná, navíc při negativních protilátkových titrech a negativním průkazu DNA Toxoplasma gondii v likvoru, byla pro jistotu zahájena i preemptivní protitoxoplazmová kúra. Během ní, ale zejména na antiretrovirové léčbě, se stav stabilizoval, gnostické a motorické funkce (levostranná hemiparéza) se zvolna zlepšily. Nedetekovatelná virová nálož HIV v likvoru svědčila pro dobrou odpověď na cART, případný podíl HIV encefalopatie byl nepravděpodobný. Etiologické agens nebylo s jistotou prokázáno, ale dle sugestivního morfologického nálezu přichází v úvahu PML, jen relativně vysoký počet CD4+ lymfocytů – nad 100 bb/ µl – poněkud odváděl od diagnózy. Vzhledem k časovým vztahům a neprokázanému vzestupu CD4+ nebyl potvrzen fenomén IRIS, i když k určité akceleraci nemoci mohla antiretrovirová terapie přispět. Další osud pacienta není znám, protože se odstěhoval z České republiky.
Kazuistika 5
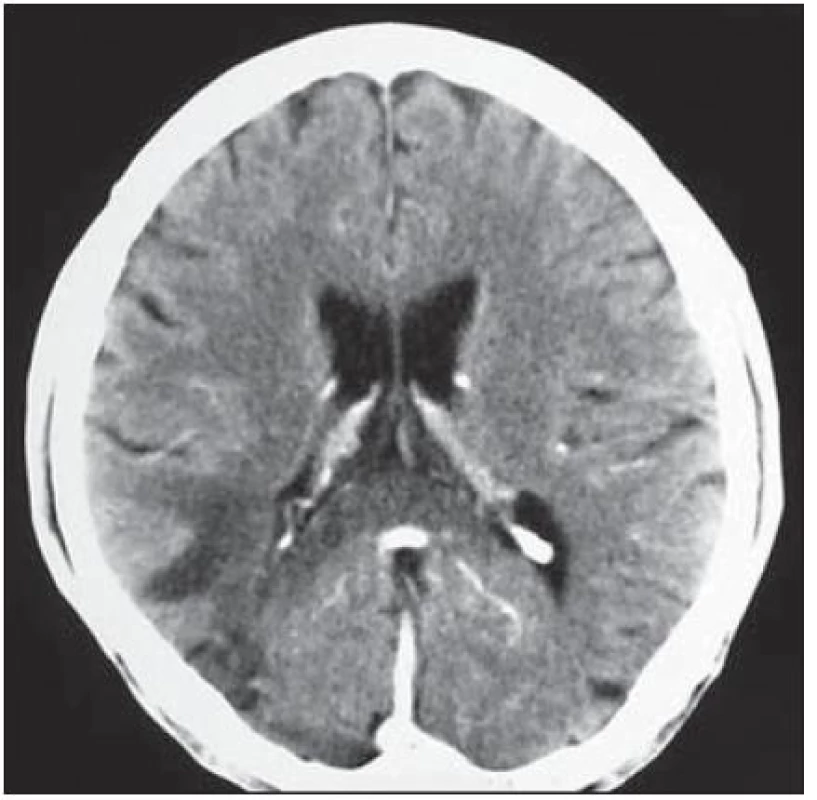
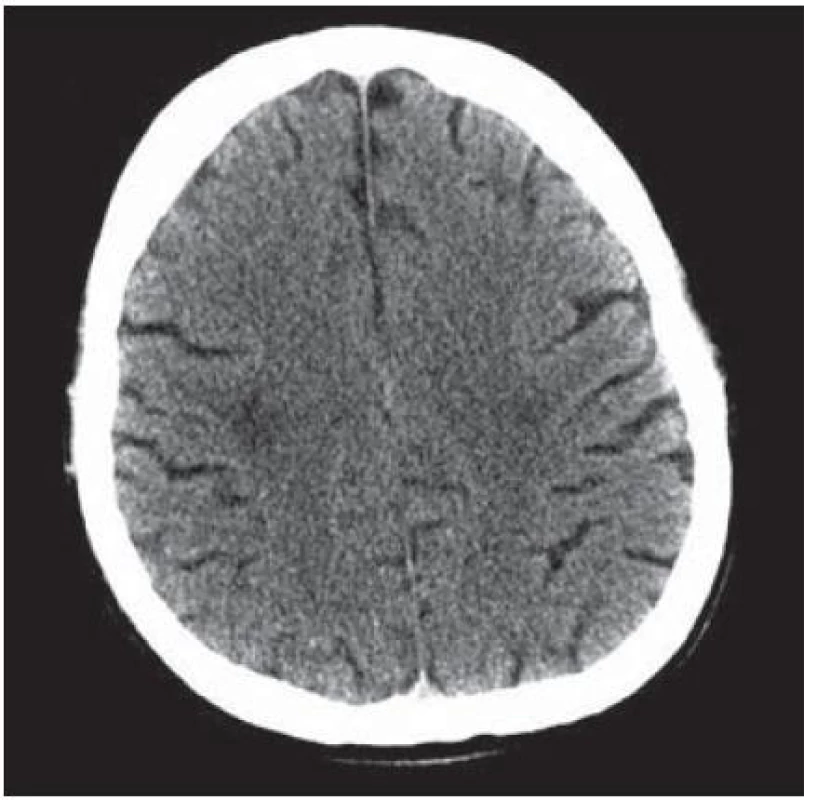
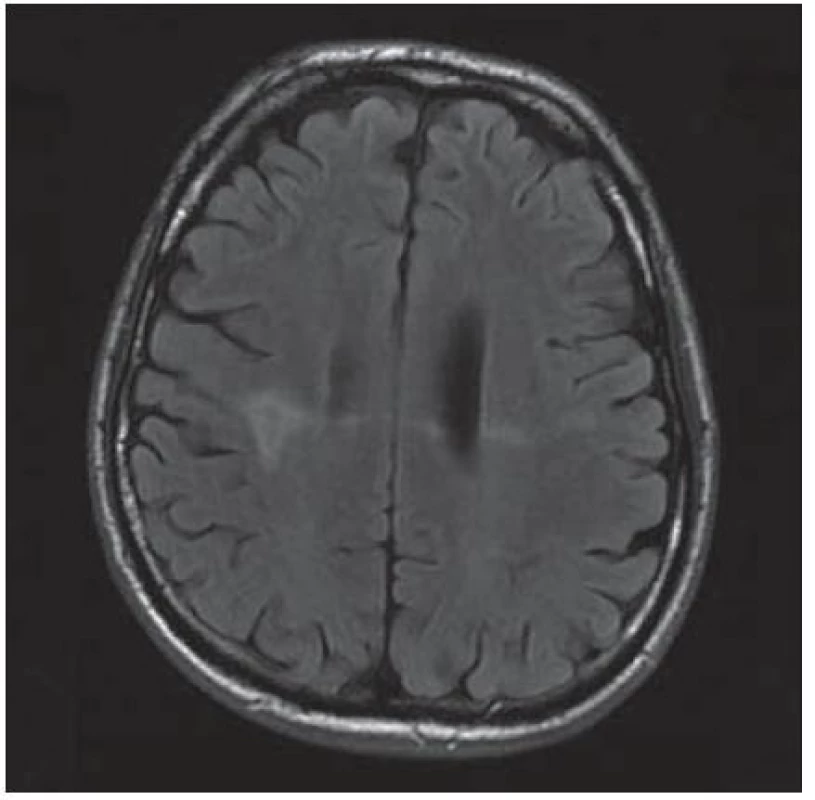
U 28letého pacienta byla v prosinci 1999 diagnostikována HIV infekce, již tehdy byl zaznamenán hluboký imunodeficit, CD4+ okolo 60 bb/ µl a suspekce na pneumocystovou pneumonii. Po jejím vyléčení byl dále ambulantně sledován, léčen antiretrovirotiky a užíval profylaxi oportunních infekcí. V roce 2004 byl v dobrém stavu, CD4+ 760 bb/µl. Později adherence vázla, takže v listopadu 2006 byl zaznamenán pokles CD4+ lymfocytů na 86 bb/µl. Ještě byl učiněn pokus se znovunasazením cART, kterou však neužíval. Ve sporadickém vyšetření z května 2008 měl počet CD4+ lymfocytů 55 bb/µl, lehkou hepatální lézi při pozitivitě protilátek HCV, která nebyla podrobněji vyšetřována. Asi od dubna 2009 se rozvinula porucha řeči, pro kterou byl hospitalizován postupně na dvou neurologických odděleních nemocnic, kde nepřiznal svůj HIV status. Objektivně byla shledána dysartrie, léze lícního nervu a lehká hemiparéza vlevo, diagnostikován multifokální mozkový proces – v CT obraze oboustranně parietálně hypodenzní ložiska (obr. 2) a na MR zobrazení vícečetná ložiska gliózy supratentoriálně (obr. 3). Během pobytu na neurologických pracovištích progredovala porucha polykání, zhoršilo se dýchání, tehdy byla sdělena HIV pozitivita matkou pacienta a pacient byl přeložen na infekční kliniku s vyjádřeným bulbárním syndromem a s kompletní afázií, kvadrupyramidovou symptomatikou a neocerebelárním syndromem. Myšlení nebylo vážněji alterováno a pantomimicky komunikoval. Byla provedena různá vyšetření, počet CD4+ lymfocytů 13 bb/µl, v likvoru lymfocytární pleocytóza. Vzhledem k neprůkazné pozitivitě JC viru v likvoru a séropozitivitě toxoplazmózy bylo pokračováno téměř čtyři týdny v terapeutickém pokusu s protitoxoplazmovou léčbou, avšak bez efektu (kontrolní MR vyšetření mozku ukázalo progresi nálezu), od poloviny června 2009 byla léčba včetně antiretrovirové redukována, protože stav nedával naději na zlepšení. V květnu došlo poměrně náhle ke zhoršení akutní respirační insuficience při jídle, zřejmě v důsledku aspirace, proto byla provedena urgentní tracheostomie. Od té doby pacient nepolykal a byl živen nazogastrickou sondou. Paliativní péče se za daných okolností jevila jako jediné rozumné řešení. Dále se průběh komplikoval horečnatými epizodami, v červenci 2009 pravostrannou orchiepididymitidou, alergickým exantémem apod. Během dlouhé – téměř 4měsíční – hospitalizace se neuropsychický stav zvolna horšil, stal se imobilním, postupně přestal komunikovat i gesty, bylo nutné zavést analgosedaci. V posledních dnech přibylo vlhkých fenoménů při poslechu plic, klesla saturace O2 i přes oxygenoterapii tracheomaskou a pacient ve svých 38 letech zemřel. Sekční nález jednoznačně potvrdil klinickou diagnózu PML. Ač se o diagnóze PML uvažovalo poměrně záhy, negativní detekce JC virus v likvoru metodou PCR poněkud odvedla od diagnózy. Nabízí se vysvětlení, že ložiska uložená v hloubce hemisfér nebyla v topografickém vztahu k likvorovým prostorům. JC virus byl prokázán i molekulárněbiologicky v sekčním materiálu – v mozku i jiných orgánech.
Kazuistika 6
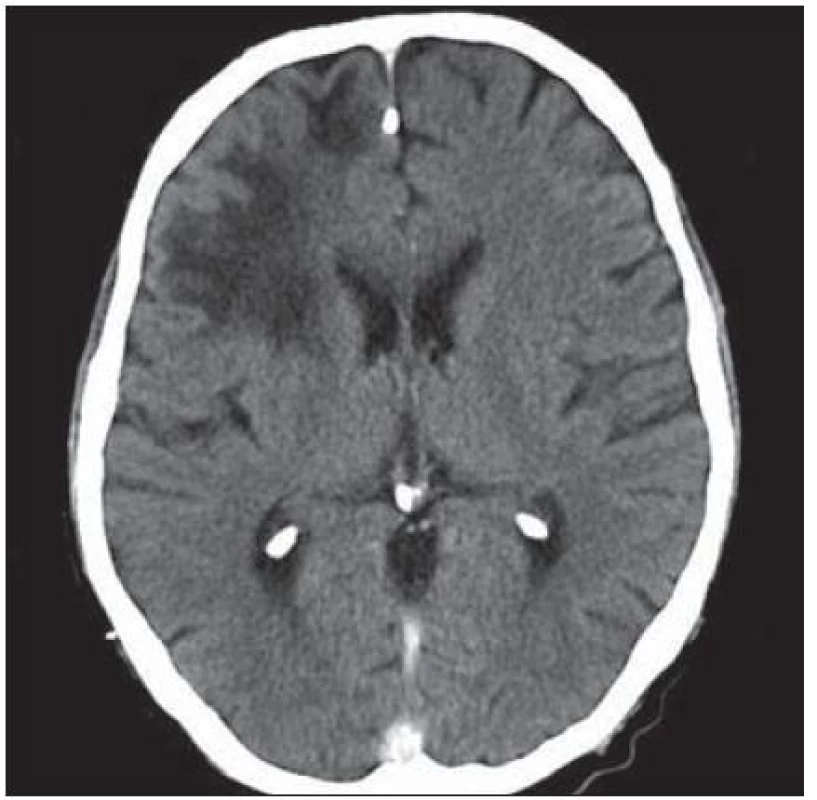
Velmi typický průběh PML jsme zaznamenali u dalšího pacienta. Již v dubnu 2004 v jeho 34 letech byla diagnostikována HIV infekce, kterou získal nejspíše homosexuálním stykem. Imunologický profil byl zpočátku uspokojivý, počet CD4+ lymfocytů byl původně 269 bb/µl, ale již v září 2005 klesl na pouhé 4 bb/µl. Vzhledem k ignorování léčby se záhy dostavila pneumocystová pneumonie. I po jejím zvládnutí antiretrovirotika užíval nespolehlivě, takže za čtyři měsíce se v březnu 2009 objevila zmatenost, opakovaně padal, při vyšetření byl dezorientovaný, zpomalený, nedokázal vyhovět jednoduchým pokynům. Po vyšetření na neurologické ambulanci byl vzhledem k udané HIV pozitivitě odeslán na infekční kliniku. Během poslední hospitalizace pacient jevil známky těžkého organického psychosyndromu. Byla provedena základní vyšetření, lumbální punkce a zobrazovací vyšetření. Po většinu hospitalizace byl krevní obraz jen s lehkým poklesem leukocytů okolo 3,6 × 106/ l, červený krevní obraz byl normální a trombocyty na dolní hranici normy (144 × 106/ l), biochemické testy vesměs bez pozoruhodností, CRP a aktivita aminotransferáz na hranici normy. Poslední imunologické vyšetření potvrdilo těžkou CD4+ lymfopenii 21 bb/µl. Likvorový nález vykázal proteinocytologickou disociaci s proteinorachií 0,83 g/ l. Na CT zobrazení z května 2009 bylo objemné hypodenzní ložisko bílé hmoty celého frontálního laloku vpravo a menší obdobné ložisko vlevo charakteru edému v terénu postischemických změn (obr. 4); MR zobrazení za dva měsíce poté prokázalo masivní postižení bílé hmoty supratentoriální části mozku: opět rozsáhlé postižení bílé hmoty frontotemporálně subkortikálně, dále bazálních ganglií a vpravo v capsula interna, oboustranně periventrikulárně, které se projevilo vysokým signálem v T2 a FLAIR zobrazení (obr. 5). Morfologický obraz byl pro diagnózu PML sugestivní a jakékoli pochybnosti rozptýlil průkaz DNA JCV pomocí PCR z likvoru v množství 22 mil. kopií/ ml likvoru. Byla podána kombinovaná antiretrovirová léčba, antibiotika a antimykotika, podávány infuze, manitol, základní parenterální výživa, korekce vnitřního prostředí a symptomatická léčba horečky. Za dva měsíce došlo ke zhoršení stavu vědomí, pacient upadl do soporu a posléze kómatu. Objevily se chrůpky na plicích, záhy v hlubokém bezvědomí došlo k zástavě dýchání a srdeční akce. Zemřel v 39 letech, diagnóza PML byla potvrzena pitvou.
Diskuze
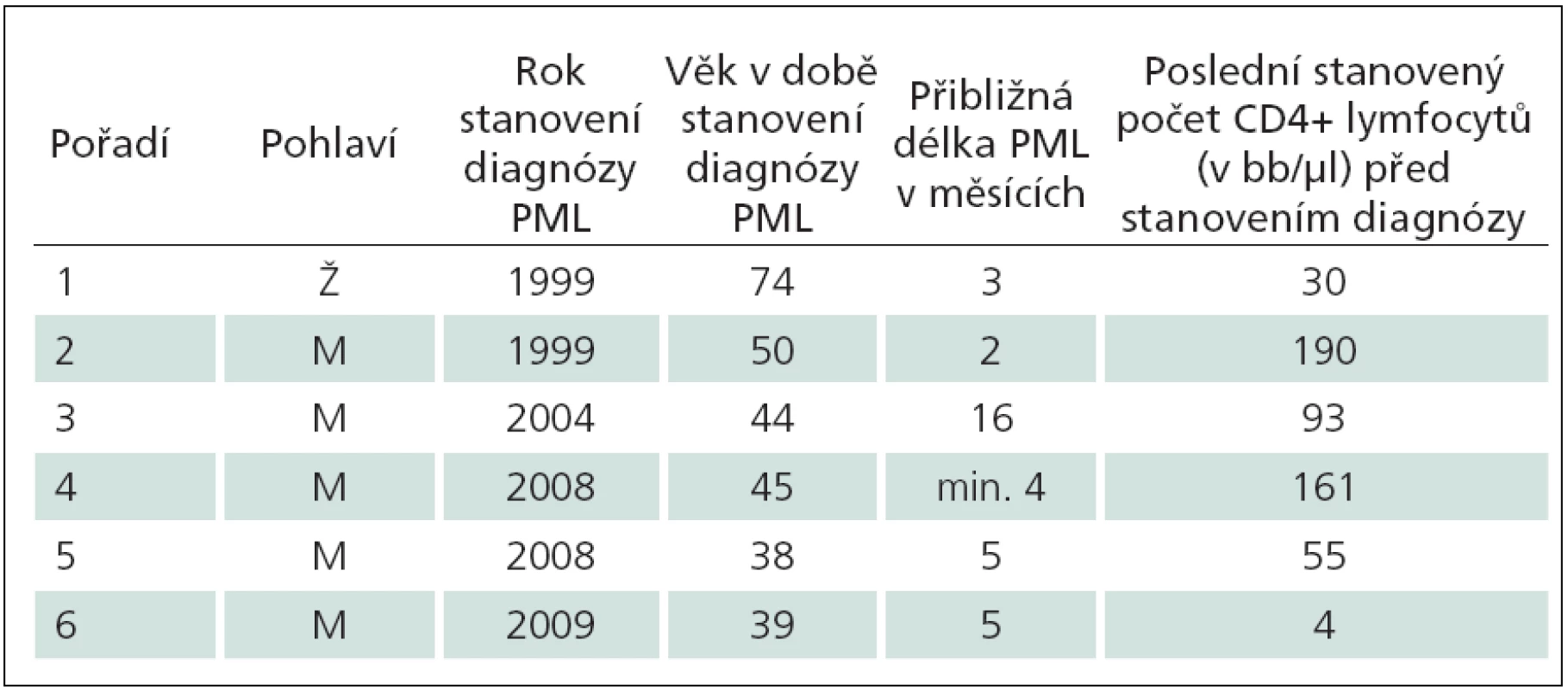
Šest kazuistik má dokumentovat zkušenosti získané za více než 26 let péče o HIV infikované na AIDS centru Nemocnice Na Bulovce (tab. 1). Nepředpokládáme, že počet případů PML je významně vyšší než počet uvedených kazuistik. Nebylo uvedeno dalších šest případů PML léčených na klinice, které jsou nám známy. Dva pacienti zemřeli na začátku 90. let – jeden z nich v 35 letech, tři roky po diagnostikované a přechodně úspěšně léčené mozkové toxoplazmóze, druhý pacient nedbající na svůj stav a jen málo vyšetřený zemřel ve 33 letech. Třetí pacient byl nepojištěný cizinec, jehož diagnóza byla zřejmá, po smrti nebyl pitván. Tři HIV pozitivní pacienti s PML dosud žijí; onemocnění jednoho z nich lze hodnotit jako PML vázanou na IRIS. Článek shrnuje zejména diagnostická úskalí, okolnosti, které vedly k váhání nad diagnózou, a dokonce skutečnosti odvádějící od diagnózy PML. Studie nepřináší zásadní epidemiologické závěry. Celkový počet pacientů sledovaných a léčených na AIDS centru lze jen odhadnout. Je přibližný, migrací proměnlivý a neznalostí dalšího osudu mnoha osob neurčitelný. Do konce srpna roku 2012 bylo v AIDS centru Nemocnice Na Bulovce v různém rozsahu ošetřeno přes 1 100 HIV pozitivních osob, většina z nich je dlouhodobě dispenzarizována a opakovaně léčena.
Naše pozorování lze porovnat s řadou údajů ze zahraničí. Nejreprezentativnější studie přinášející údaje o výskytu a průběhu PML v Evropě je obsažena ve Swiss HIV Cohort Study. Je v ní zařazeno 159 případů z let 1988– 2007 prospektivně sebraných ze švýcarských center. Podle ní vedlo zavedení cART k čtyřnásobnému poklesu incidence (z 0,25 na 0,06 případů na 100 pacientoroků) [42]. Rozsahem s naším souborem jsou porovnatelné výsledky studie portugalských autorů, kteří popsali 25 případů PML ze 724 sledovaných HIV pozitivních osob (tj. u 3,45 % sledovaných pacientů) [43]. Další studie vesměs zařazují případy PML po zavedení cART, například holandská studie Engsiga a spolupracovníků referuje o 47 případech PML z 4 649 HIV pozitivních pacientů z let 1995– 2006. I v této práci je zaznamenán téměř trojnásobný pokles incidence PML během uvedeného období [44]. Našich 12 případů se významně neodchyluje od teoretického počtu PML při výskytu infekce HIV v České republice a podílu pražského AIDS centra na péči o HIV pozitivní osoby (kumulativní počet k 31. 12. 2011 byl 1 820 HIV pozitivních českých občanů a rezidentů) [45].
Diagnóza může být vysoce pravděpodobná u HIV pozitivního pacienta s hlubokou CD4+ lymfopenií – obvykle pod 100 bb/µl – na základě přítomnosti pomalu se rozvíjející poruchy hybnosti, vizu, řeči či gnostických funkcí a obrazu multifokálního procesu pomocí zobrazovacích metod. Předběžná diagnóza na základě klinického obrazu po vyloučení mozkové toxoplazmózy je postačující. Průkaz JC viru metodou PCR je užitečný, má vysokou specificitu, ale nízkou senzitivitu. Sama negativní PCR JCV nevylučuje diagnózu, protože viremie JC viru v likvoru kolísá v širokých rozmezích a podle některých autorů ani nekoreluje s rozsahem mozkových lézí [46,47]. U některých pacientů klesá viremie JC viru vlivem antiretrovirové terapie [48]. Definitivní diagnóza vyžaduje mozkovou biopsii, ta se však v praxi provádí výjimečně.
Diferenciálně diagnosticky přichází v úvahu řada diagnóz, obvykle se však rozhoduje mezi PML a mozkovou toxoplazmózou. Toxoplazmová encefalitida se liší charakterem lézí na CT a zlepšením stavu po terapeutickém pokusu protitoxoplazmovými chemoterapeutiky. HIV encefalopatie je charakterizována poruchami gnostických funkcí a motoriky, obvykle chybí ložisková zániková symptomatologie a do CT obrazu nepatří mnohočetná ložiska. Na druhé straně koincidence PML a HIV encefalopatie není vzácností. Cévní mozková příhoda začíná náhle a léze bývá obvykle lokalizována temporálně. Primární mozkový lymfom tvoří obyčejně solitární lézi, mnohdy velmi rozsáhlou a chovající se expanzivně. Cytomegalovirová (CMV) encefalitida je obtížně odlišitelná od HIV encefalopatie, významný je průkaz CMV v likvoru.
U HIV pozitivního pacienta s multifokálním procesem mozku je diagnóza PML vždy zvažována, ale záleží na dalších okolnostech, zda je považována za nejvíce pravděpodobnou nebo zda se spíše jedná o toxoplazmovou encefalitidu, mozkový lymfom, ischemické léze mozku, klasické demyelinizační onemocnění, mozkové abscesy, embolizace, nádorové metastázy nebo jiné vzácnější choroby.
Jako zdroj omylů v jednoznačném stanovení diagnózy se ukázaly:
- relativně časný výskyt – již při imunodeficitu charakterizovaném počtem CD4+ lymfocytů pod 200 bb/µl a ne až při poklesu pod 100 bb/µl;
- nespecifický nález v CT či MR zobrazení, zejména zpočátku negativní CT obraz nebo záchyt jediného ložiska, které připouští širší diferenciálně diagnostickou rozvahu;
- negativní průkaz DNA JC viru, který vzhledem k nepříliš vysoké senzitivitě testu spojené pravděpodobně s biologickým chováním virové proliferace, nevylučuje diagnózu PML.
To odpovídá i kazuistikám referovaným v literatuře. Diagnóza PML u HIV pozitivních pacientů s typickým nálezem v MR zobrazení, pokud jsou bez signifikantního imunodeficitu, je překvapující a je zdrojem diagnostických omylů [49]. Mimoto se musí počítat s negativním výsledkem molekulárněgenetického průkazu JC viru [50].
Závěr
Společným jmenovatelem vzniku PML je pozdě nasazená nebo chybně užívaná antiretrovirové terapie. Ani zahájení cART u asymptomatického pacienta, který má již významný imunodeficit, nemusí odvrátit závažnou oportunní infekci – naopak jako projev IRIS se PML může manifestovat nebo akcelerovat. Diagnóza PML není vždy snadná. Zdrojem omylů může být relativně časný výskyt již při méně hlubokém imunodeficitu, zpočátku negativní CT obraz nebo zachycené jediné ložisko a nízká spolehlivost průkazu DNA JC viru. Kazuistiky ukazují, že pravidla se musí uvážlivě hodnotit a je nutné připouštět i výjimky.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Hanuš Rozsypal, CSc.
Klinika infekčních a tropických nemocí
1. LF UK a Nemocnice Na Bulovce
Budínova 2, 180 81 Praha 8
e-mail: rozsypalh@volny.cz
Přijato k recenzi: 21. 11. 2011
Přijato do tisku: 6. 11. 2012
Zdroje
1. Yousry TA, Major EO, Ryschkewitsch C, Fahle G, Fischer S, Hou J et al. Evaluation of patients treated with natalizumab for progressive multifocal leukoencephalopathy. N Engl J Med 2006; 354(9): 924– 933.
2. Carson KR, Evens AM, Richey EA, Habermann TM, Focosi D, Seymour JF et al. Progressive multifocal leukoencephalopathy following rituximab therapy in HIV‑ negative patients: a report of 57 cases from the Research on Adverse Drug Event and Reports project. Blood 2009; 113(20): 4834– 4840.
3. Major EO, Amemiya K, Tornatore CS, Houff SA, Berger JR. Pathogenesis and molecular biology of progressive multifocal leukoencephalopathy, the JC virus‑induced demyelinating disease of the human brain. Clin Microbiol Rev 1992; 5(1): 49– 73.
4. Tan CS, Koralnik IJ. Beyond progressive multifocal leukoencephalopathy and other disorders caused by JC virus: clinical features and pathogenesis. Lancet Neurol 2010; 9(4): 425– 437.
5. Eng PM, Turnbull BR, Cook SF, Davidson JE, Kurth T, Seeger JD. Characteristics and antecedents of progressive multifocal leukoencephalopathy in an insured population. Neurology 2006; 67(5): 884– 886.
6. Antinori A, Ammassari A, Giancola ML, Cingolani A,Grisetti S, Murri R et al. Epidemiology and prognosis of AIDS‑associated progressive multifocal leukoencephalopathy in the HAART era. J Neurovirol 2001; 7(4): 323– 328.
7. Naess H, Glad S, Storstein A, Rinaldo CH, Mørk SJ, Myhr KM et al. Progressive multifocal leucoencephalopathy in an immunocompetent patient with favourable outcome. A case report. BMC Neurology 2010; 10: 32.
8. Vaklavas C, Sotelo‑ Rafiq EP, Lovy J, Escobar MA, Tsimberidou AM. Progressive multifocal leukoencephalopathy in a patient without apparent immunosuppression. Virol J 2010; 7: 256.
9. Padgett BL, Walker DL. Prevalence of antibodies in human sera against JC virus, an isolate from a case of progressive multifocal leukoencephalopathy. J Infect Dis 1973; 127(4): 467– 470.
10. Knowles WA, Pipkin P, Andrews N, Vyse A, Minor P,Brown DW et al. Population‑based study of antibody to the human polyomaviruses BKV and JCV and the simian polyomavirus SV40. J Med Virol 2003; 71(1): 115– 123.
11. Weber T, Trebst C, Frye S, Cinque P, Vago L, Sindic CJ et al. Analysis of the systemic and intrathecal humoral immune response in progressive multifocal leukoencephalopathy. J Infect Dis 1997; 176(1): 250– 254.
12. White MK, Khalili K. Pathogenesis of progressive multifocal leukoencephalopathy – revisited. J Infect Dis 2011; 203(5): 578– 586.
13. Berger JR, Levy RM, Flomenhoft D, Dobbs M. Predictive factors for prolonged survival in acquired immunodeficiency syndrome‑associated progressive multifocal leukoencephalopathy. Ann Neurol 1998; 44(3): 341– 349.
14. Smith AB, Smirniotopoulos JG. Imaging evaluation of demyelinating processes of the central nervous system. Postgrad Med J 2010; 86(1014): 218– 229.
15. Černý R, Kapla J, Machala L. Ložiskové léze CNS u pacientů s HIV infekcí. Cesk Slov Neurol N 2010; 73/ 106(4): 374– 378.
16. Berenguer J, Miralles P, Arrizabalaga J, Ribera E, Dronda F, Baraia‑ Etxaburu J et al. Clinical course and prognostic factors of progressive multifocal leukoencephalopathy in patients treated with highly active antiretroviral therapy. Clin Infect Dis 2003; 36(8): 1047– 1052.
17. Falcó V, Olmo M, del Saz SV, Guelar A, Santos JR, Gutiérrez M et al. Influence of HAART on the clinical course of HIV‑ 1– infected patients with progressive multifocal leukoencephalopathy: results of an observational multicenter study. J Acquir Immune Defic Syndr 2008; 49(1): 26– 31.
18. Marzocchetti A, Tompkins T, Clifford DB, Gandhi RT, Kesari S, Berger JR et al. Determinants of survival in progressive multifocal leukoencephalopathy. Neurology 2009; 73(19): 1551– 1558.
19. Hall CD, Dafni U, Simpson D, Clifford D, Wetherill PE, Cohen B et al. Failure of cytarabine in progressive multifocal leukoencephalopathy associated with human immunodeficiency virus infection. AIDS Clinical Trials Group 243 Team. N Engl J Med 1998; 338(19): 1345– 1351.
20. Vollmer‑ Haase J, Young P, Ringelstein EB. Efficacy of camptothecin in progressive multifocal leucoencephalopathy. Lancet 1997; 349: 1366.
21. Royal W 3rd, Dupont B, McGuire D, Chang L, Goodkin K, Ernst T et al. Topotecan in the treatment of acquired immunodeficiency syndrome‑related progressive multifocal leukoencephalopathy. J Neurovirol 2003; 9(3): 411– 419.
22. O’Reilly S. Efficacy of camptothecin in progressive multifocal leucoencephalopathy. Lancet 1997; 350(9073): 291.
23. De Luca A, Ammassari A, Pezzotti P, Cinque P, Gasnault J, Berenguer J et al. Cidofovir in addition to antiretroviral treatment is not effective for AIDS‑associated progressive multifocal leukoencephalopathy: a multicohort analysis. AIDS 2008; 22(14): 1759– 1767.
24. Wyen C, Hoffmann C, Schmeisser N, Wöhrmann A,Qurishi N, Rockstroh J et al. Progressive multifocal leukencephalopathy in patients on highly active antiretroviral therapy: survival and risk factors of death. J Acquir Immune Defic Syndr 2004; 37(2): 1263– 1268.
25. Elphick GF, Querbes W, Jordan JA, Gee GV, Eash S,Manley K et al. The human polyomavirus, JCV, uses serotonin receptors to infect cells. Science 2004; 306(5700): 1380– 1383.
26. Verma S, Cikurel K, Koralnik IJ, Morgello S, Cunningham‑ Rundles C, Weinstein ZR et al. Mirtazapine in progressive multifocal leukoencephalopathy associated with polycythemia vera. J Infect Dis 2007; 196(5): 709– 711.
27. Focosi D, Kast RE, Maggi F, Ceccherini‑Nelli L, Petrini M. Risperidone‑induced reduction in JC viruria as a surrogate marker for efficacy against progressive multifocal leukoencephalopathy and hemorrhagic cystitis. J Clin Virol 2007; 39(1): 63– 64.
28. Focosi D, Kast RE, Maggi F, Lauria G, Ceccherini‑Nelli L, Petrini M. 5- HT2a inhibitors for progressive multifocal leukoencephalopathy: old drugs for an old disease. J Infect Dis 2008; 197(2): 328.
29. Cettomai D, McArthur JC. Mirtazapine use in human immunodeficiency virus‑ infected patients with progressive multifocal leukoencephalopathy. Arch Neurol 2009; 66(2): 255– 258.
30. Tantisiriwat W, Tebas P, Clifford DB, Powderly WG, Fichtenbaum CJ. Progressive multifocal leukoencephalopathy in patients with AIDS receiving HAART. Clin Infect Dis 1999; 28(5): 1152– 1154.
31. Albrecht H, Hoffmann C, Degen O, Stoehr A, Plettenberg A, Mertenskötter T et al. HAART significantly improves the prognosis of patients with HIV‑associated progressive multifocal leukoencephalopathy. AIDS 1998; 12(10): 1149– 1154.
32. Clifford DB, Yiannoutsos C, Glicksman M, Simpson DM, Singer EJ, Piliero PJ et al. HAART improves prognosis in HIV‑associated progressive multifocal leukoencephalopathy. Neurology 1999; 52(3): 623– 625.
33. Dworkin MS, Wan PC, Hanson DL, Jones JL. Progressive multifocal leukoencephalopathy: improved survival of HIV‑ infected patients in the protease inhibitor era. J Infect Dis 1999; 180(3): 621– 625.
34. Khanna N, Wolbers M, Mueller NJ, Garzoni C, Du Pasquier RA, Fux CA et al. JC virus‑ specific immune responses in HIV‑ 1 patients with progressive multifocal leukoencephalopathy. J Virol 2009; 83(9): 4404– 4011.
35. Khanna N, Elzi L, Mueller NJ, Garzoni C, Cavassini M,Fux CA et al. Incidence and outcome of progressive multifocal leukoencephalopathy over 20 years of the Swiss HIV Cohort Study. Clin Infect Dis 2009; 48(10): 459– 466.
36. Engsig FN, Hansen AB, Omland LH, Kronborg G, Gerstoft J, Laursen AL et al. Incidence, clinical presentation, and outcome of progressive multifocal leukoencephalopathy in HIV‑ infected patients during the highly active antiretroviral therapy era: a nationwide cohort study. J Infect Dis 2009; 199(1): 77– 83.
37. Hoffmann C, Horst HA, Albrecht H, Schlote W. Progressive multifocal leucoencephalopathy with unusual inflammatory response during antiretroviral treatment. J Neurol Neurosurg Psychiatry 2003; 74(8): 1142– 1144.
38. Marzocchetti A, Sanguinetti M, Giambenedetto SD, Cingolani A, Fadda G, Cauda R et al. Characterization of JC virus in cerebrospinal fluid from HIV‑ 1 infected patients with progressive multifocal leukoencephalopathy: insights into viral pathogenesis and disease prognosis. J Neurovirol 2007; 13(4): 338– 346.
39. Marzocchetti A, Tompkins T, Clifford DB, Gandhi RT, Kesari S, Berger JR et al. Determinants of survival in progressive multifocal leukoencephalopathy. Neurology 2009; 73(19): 1551– 1558.
40. Tan K, Roda R, Ostrow L, McArthur J, Nath A. PML‑IRIS in patients with HIV infection: clinical manifestations and treatment with steroids. Neurology 2009; 72(17): 1458– 1464.
41. EACS (European AIDS Clinical Society) Guidelines. Version 6.0 – October 2011 [online]. Available from: http:/ / www.europeanaidsclinicalsociety.org/ .
42. Khanna N, Elzi L, Mueller NJ, Garzoni C, Cavassini M,Fux CA et al. Incidence and outcome of progressive multifocal leukoencephalopathy over 20 years of the Swiss HIV Cohort Study. Clin Infect Dis 2009; 48(10): 1459– 1466.
43. Nery F, Franca M, Almeida I, Vasconcelos C. From clinical presentation to the outcome: the natural history of PML in a Portuguese population of HIV infected patients. J Clin Med Res 2011; 3(1): 17– 22.
44. Engsig FN, Hansen AB, Omland LH, Kronborg G, Gerstoft J, Laursen AL et al. Incidence, clinical presentation, and outcome of progressive multifocal leukoencephalopathy in HIV‑ infected patients during the highly active antiretroviral therapy era: a nationwide cohort study. J Infect Dis 2009; 199(1): 77– 83.
45. SZÚ. Údaje Národní referenční laboratoře pro AIDS [online]. Available from: http:/ / www.szu.cz/ uploads/ documents/ CeM/ HIV_AIDS/ rocni_zpravy/ 2012/ HIV_AIDS_08_2012.pdf.
46. Eggers C, Stellbrink HJ, Buhk T, Dörries K. Quantification of JC virus DNA in the cerebrospinal fluid of patients with HIV‑associated PML – a longitudinal study. J Infect Dis 1999; 180(5): 1690– 1694.
47. García De Viedma D, Díaz Infantes M, Miralles P, Berenguer J, Marín M, Muñoz L et al. JC virus load in progressive multifocal leukoencephalopathy: analysis of the correlation between the viral burden in cerebrospinal fluid, patient survival, and the volume of neurological lesions. Clin Infect Dis 2002; 34(12): 1568– 1575.
48. Bossolasco S, Calori G, Moretti F, Boschini A, Bertelli D, Mena M et al. Prognostic significance of JC virus DNA levels in cerebrospinal fluid of patients with HIV‑associated progressive multifocal leukoencephalopathy. Clin Infect Dis 2005; 40(5): 738– 744.
49. Delobel P, Brassat D, Delisle MB, Scaravilli F, Clanet M. Progressive multifocal leukoencephalopathy in an HIV patient with normal CD4 T‑ cell count and magnetic resonance imaging. AIDS 2004; 18(4): 702– 704.
50. Wang Y, Kirby JE, Qian Q. Effective use of JC virus PCR for diagnosis of progressive multifocal leukoencephalopathy. J Med Microbiol 2009; 58(Pt 2): 253– 255.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2013 Číslo 4
Nejčtenější v tomto čísle
- Úskalí diagnostiky progresivní multifokální leukoencefalopatie u pacientů infikovaných lidským virem imunodeficience – kazuistiky
- Chirurgie baze lební (uvnitř minimonografie video)
- Neuropsychiatrický pohľad na Huntingtonovu chorobu
- Dysembryoplastický neuroepiteliální tumor a jeho atypická varianta u dětí – kazuistiky
