Endovaskulární léčba intrakraniálních aneuryzmat – metodika, indikace, komplikace
Endovascular Therapy of Intracranial Aneurysms – Methods, Indications, Complications
Endovascular therapy of intracranial aneurysms has become the first-line treatment option whenever this option is available; it appears to be straightforward and with promising long-term effect. A neurointerventionalist performing the procedure should have appropriate radiographic equipment, training and appropriate number of patients. This can be appropriately accomplished within a specialized neurovascular center in which appropriate neurosurgical care can be instituted promptly. There are two endovascular strategies to treat cerebral aneurysms. The first involves an occlusion of the aneurysmal sac with metallic coils and preserving the parent artery. The second involves occlusion of the parent artery in order to exclude otherwise untreatable aneurysms from blood circulation. Implantation of intracranial stents stabilizes implanted coils in the aneurysmal sac of wide neck aneurysms and expands indication spectrum of endovascular therapy with long-term effect. High density mesh cylinder stents modify the blood flow by disrupting aneurysm inflow, leading to remodeling of the entire diseased arterial segment. Standard imaging protocol of acute SAH includes non-enhanced CT and CT angiography. Catheterization angiography is the imaging modality used for patients with non-conclusive or negative findings. Detection and detailed imaging of small (less then 3 mm in size) aneurysms is more reliable using catheterization angiography with 3D volume rendering technique. MR angiography is a reliable, non-invasive and cost-effective method that is gradually replacing catheterization angiography in a long-term follow-up of patients with coiled aneurysms. In comparison to neurosurgical therapy, endovascular therapy of acutely ruptured aneurysms was proved, in a one-year follow up, to significantly reduce mortality and postsurgical disability. Unruptured aneurysms form a heterogeneous entity with extreme variation in reported risk of rupture. Their prevalence is estimated at 1–2% of the adult population. However, with an increasing availability of non-invasive brain imaging methods, they are now diagnosed more frequently.
Key words:
intracranial aneurysms – subarachnoid hemorrhage – endovascular therapy
Autoři:
A. Krajina 1; Miroslav Lojík 1
; T. Česák 2; D. Krajíčková 3; J. Žižka 1; K. Zeleňák 4; J. Habalová 2; M. Mulačová 3; S. Řehák 2
Působiště autorů:
Radiologická klinika LF UK a FN Hradec Králové
1; Neurochirurgická klinika LF UK a FN Hradec Králové
2; Neurologická klinika LF UK a FN Hradec Králové
3; Radiologická klinika JLF UK a UN Martin
4
Vyšlo v časopise:
Cesk Slov Neurol N 2012; 75/108(5): 552-560
Kategorie:
Přehledný referát
Souhrn
Endovaskulární léčba intrakraniálních aneuryzmat má být preferována v případech, kdy je dostupná, radikální a s vysokou pravděpodobností dlouhodobého efektu. Neurointervenční radiologové, kteří provádějí endovaskulární léčbu, musí mít k dispozici odpovídající angiografické zařízení, pravidelný trénink a dostatečný počet nemocných. Tohoto lze vhodně dosáhnout pouze ve specializovaných neurovaskulárních centrech, kde je dostupná okamžitá neurochirurgická péče. Existují dvě strategie endovaskulární léčby mozkových výdutí. První z nich je uzávěr vaku aneuryzmatu kovovými spirálami se zachováním průchodnosti mateřské tepny. Druhou možností je uzávěr mateřské tepny s cílem vyloučit z oběhu jinak neléčitelná aneuryzmata. Ke stabilizaci spirál u aneuryzmat se širokým krčkem se využívají intrakraniální stenty, které tak rozšiřují indikace endovaskulární léčby s příznivým dlouhodobým efektem léčby. V poslední době se k léčbě aneuryzmat využívají stenty s větší hustotou úpletu, což vede k narušení toku krve do aneuryzmatu a remodelaci celého léčeného segmentu. Nativní CT a CT angiografie jsou základní zobrazovací vyšetření u akutního subarachnoidálního krvácení. Další zobrazovací metodou používanou u nemocných s negativním nebo nediagnostickým závěrem je katetrizační angiografie. Detekce a detailní zobrazení malých aneuryzmat (menších než 3 mm) je spolehlivější pomocí katetrizační angiografie s 3D technikou. U většiny již embolizovaných aneuryzmat nahrazuje MR angiografie, díky dostatečné spolehlivosti, neinvazivitě a nižším nákladům angiografii katetrizační v jejich dlouhodobém sledování. Endovaskulární léčba prasklých aneuryzmat při srovnání s léčbou chirurgickou prokázala, v jednoletém sledování po léčbě, významné snížení úmrtnosti a pooperační invalidity. Naproti tomu neprasklá aneuryzmata tvoří heterogenní skupinu s extrémní variabilitou rizika ruptury. Jejich prevalence se v dospělé populaci odhaduje na 1–2 %, avšak díky širší dostupnosti neinvazivních zobrazovacích metod mozku jsou v současnosti aneuryzmata diagnostikována častěji.
Klíčová slova:
intrakraniální aneuryzma – subarachnoidální krvácení – endovaskulární léčba
Úvod
Endovaskulární léčba intrakraniálních aneuryzmat má být preferována v případech, kdy je dostupná, radikální a s vysokou pravděpodobností dlouhodobého efektu.
Principy a technika
Zobrazovací protokol pro vyšetřování nemocných s intrakraniálními aneuryzmaty
U nemocných s podezřením na akutní subarachnoidální krvácení (SAK) je první diagnostickou metodou volby vyšetření mozku zobrazení pomocí nativního CT kombinované s CT angiografií (CTA). Podobně jako u jiných CTA protokolů je i pro intrakraniální CTA všeobecně doporučováno nižší nastavení kV (≤ 100 kV), protože molekula jódu nabízí mnohem efektivnější absorpci rtg záření při nižším napětí rentgenové lampy, čímž se zvyšuje kontrast mezi cévami a okolními tkáněmi.
S použitím moderních multidetektorových CT přístrojů trvají skeny pouze několik sekund. Správné načasování podání bolusu kontrastní látky podávané injektorem vysokou rychlostí (≥ 4 ml/s) má proto zásadní význam pro dosažení správného zobrazení. Akvizice dat začíná obvykle monitorováním zvyšující se opacifikace extrakraniálního úseku karotické tepny nebo aortálního oblouku (bolus tracking). U nespolupracujících a neklidných nemocných je nutné vyšetření provádět v celkové anestezii. Nejdůležitější a nejcitlivější pro detekci aneuryzmat se jeví vyhodnocování tenkých MIP (Maximum Intensity Projection) projekcí ve vícečetných rovinách společně s pečlivým hodnocením původních axiálních vrstev. Pro trojrozměrné zobrazení aneuryzmatu a jeho krčku jsou užitečné VRT techniky (Volume Rendering Techniques), které však mají nižší senzitivitu v primární detekci malých aneuryzmat než tenké MIP projekce.
Multidetektorové CT s duálním zdrojem energie umožňuje simultánní subtrakci kostních struktur podobně jako u digitální subtrakční angiografie (DSA), což zvýrazňuje cévní anatomii zejména v oblasti baze lební.
V komplikovaných případech, zejména u pomalu se plnících aneuryzmat nebo tam, kde jsou příčinou SAK arterivenózní píštěle či žilní trombózy, je výhodné použít dvoufázové CTA vyšetření se zobrazením arteriální i venózní fáze, což přispívá k lepším diagnostickým výsledkům. Nelze však opomenout, že použitím dvoufázového vyšetření dochází ke zdvojení radiační dávky na oční čočku, což by mělo být zvažováno zejména u mladých nemocných. Proto u spolupracujících nemocných v dobrém klinickém stavu a podezřením na SAK krvácení má být zvažována možnost použití MR angiografie.
Senzitivita CT vyšetření rapidně klesá u nemocných s minimálním subarachnoidálním krvácením. Za těchto okolností by přítomnost malého SAK měla být vyloučena nebo potvrzena pomocí MR. K nejcitlivějším sekvencím v detekci intrakraniálního krvácení patří FLAIR sekvence, T2* gradientní echo a SWI (Susceptibility Weighted Images). Jestliže CTA neodhalí žádnou cévní patologii, je při difuzním SAK indikováno DSA vyšetření. Je-li vstupní DSA negativní, doporučuje se DSA opakovat s časovým odstupem [1,2].
Historie endovaskulární léčby
I přes mnohé polemiky a diskuze se endovaskulární léčba aneuryzmat pomocí spirál stala zavedenou metodou léčby jak prasklých, tak i neprasklých intrakraniálních aneuryzmat.
Endovaskulární embolizace intrakraniálních aneuryzmat pomocí odpoutatelných balónků byla vymyšlena a zdokonalena Serbiněnkem a jeho žákem Scheglovem v 60. a 70. letech minulého století [3]. Použití této léčby však z mnoha důvodů zůstalo omezeno pouze na několik center v bývalém Sovětském svazu a později v západním světě. Endovaskulární léčbu výplně vaku mozkových aneuryzmat pomocí elektrolyticky odpoutatelných platinových spirálek poprvé popsali Guglielmi et al v roce 1991 [4].
Technika
Za skiaskopické kontroly se do vaku aneuryzmatu zavede speciální mikrokatétr, přes který jsou pak přímo do aneuryzmatu ukládány platinové spirálky příslušné velikosti a tvaru. Při nesprávně zvolené velikosti spirálky nebo její nestabilitě ve vaku je možné její vytažení, repozice nebo výměna za jinou. K vyplnění vaku aneuryzmatu se většinou používá více spirál rozličného tvaru a vlastností. Předpokladem pro jejich široké použití je možnost bezpečného, kontrolovaného zavádění. Cílem léčby je vyloučení aneuryzmatu z krevního oběhu, tohoto je dosaženo trombózou vaku v důsledku přítomnosti spirál a změny geometrie intrasakulárního toku (obr. 1).
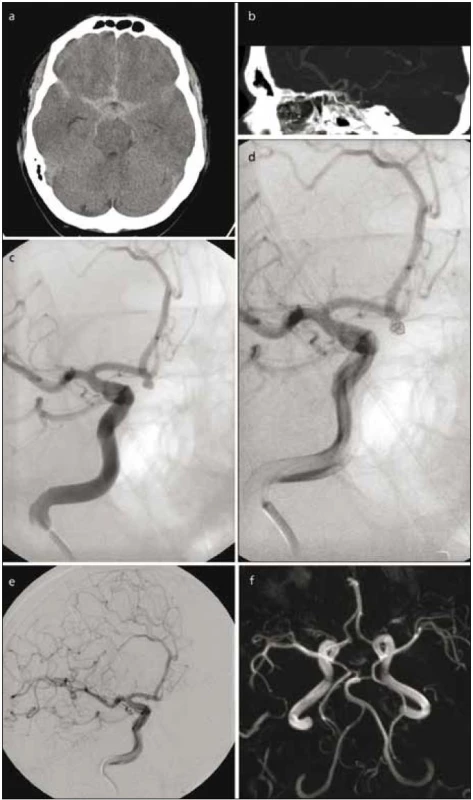
Technologický vývoj spirál a jejich zavádění spolu s dalšími doplňujícími technikami, jako je použití remodelačních balónků [5] a stentů, umožnilo léčbu i aneuryzmat se širokým krčkem a gigantických aneuryzmat [6]. Takzvané spirálky druhé generace [7], zahrnující různé tvary [8], tuhost [9] nebo speciální povrch, byly vyvinuty s cílem zlepšit dlouhodobý angiografický uzávěr po embolizaci. Existuje několik typů platinových spirál potažených různými materiály, u kterých bylo experimentálně zjištěno zvýšené vrůstání fibrózní tkáně uvnitř vaku aneuryzmatu [10,11]. U některých je tento materiál primárně uvnitř platinových spirál nebo jsou potaženy vlákny [12,13]. Tzv. hydrogelové spirálky jsou pokryty speciálním materiálem, který při kontaktu s krví zvětšuje objem. Kromě většího procenta výplně objemu vaku je rovněž očekáváno vyšší vrůstání fibrózní tkáně do masy hydrogelových spirál [14].
Existují dva endovaskulární přístupy léčby mozkových aneuryzmat. První spočívá ve výše popsané výplni vaku aneuryzmatu kovovými spirálkami se zachováním průchodnosti mateřské tepny. Druhý, dekonstrukční přístup spočívá v obliteraci aneuryzmatu i s mateřskou tepnou. Mateřská tepna může být bezpečně uzavřena pouze při dostatečném kolaterálním oběhu prostřednictvím cév Willisova okruhu nebo leptomeningeálních kolaterál, jestliže je aneuryzma lokalizováno nad úrovní Willisova okruhu (disekující, mykotická nebo některá aneuryzmata v dětském věku). Náhlý uzávěr a obětování mozkové tepny může vést k významné morbiditě. Z tohoto důvodu jsou předoperačně prováděny různé okluzní testy k selekci nemocných, kteří budou tolerovat uzávěr příslušné mozkové tepny [15]. Obvykle se provádí okluzní test pomocí angiografického balónku kombinovaný s klinickým dohledem, kontrolou mozkového kolaterálního oběhu nebo elektrofyziologickým monitorováním. Jestliže nemocný netoleruje dočasný okluzní test, je indikováno našití extra-intrakraniálního bypassu a poté opakování balónkového testu [16]. K uzávěru mateřské tepny pod aneuryzmatem se používají odpoutatelné balónky (obvykle tandemově dva balónky pro stabilizaci uzávěru). Aneuryzma je vyplněno spirálkami (přednostně hydrogelovými nebo spirálkami s polyesterovými vlákny), u disekujících aneuryzmat pak nahusto uloženými spirálkami v přívodné tepně.
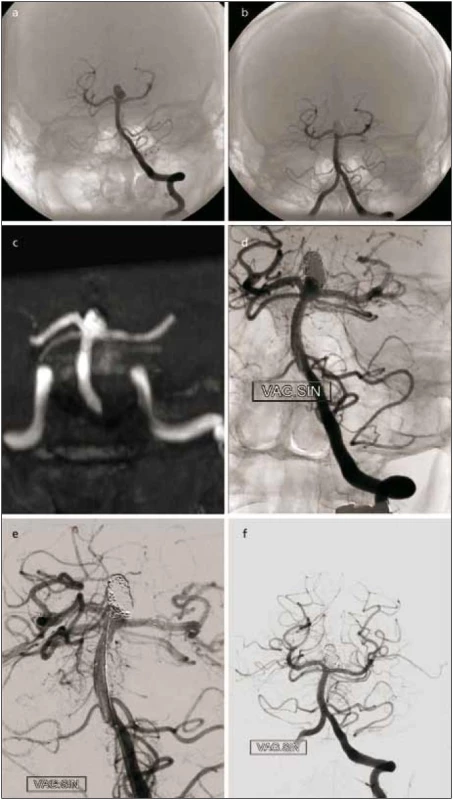
Kromě selektivního uzávěru aneuryzmatu s krčkem existují ještě další rekonstrukční metody. K udržení spirál ve vaku aneuryzmatu se širokým krčkem se nejčastěji zavádí stent do mateřské tepny s následnou výplní vaku spirálami zavedeným mikrokatétrem vsunutým přes oko tohoto stentu. Tento postup lze kombinovat také tak, že nejprve zavedeme mikrokatétr do vaku a paralelně implantujeme stent. Tato technika, tzv. jailed microcatheter, umožňuje stabilní polohu mikrokatétru v aneuryzmatu. Je používána u malých aneuryzmat, kde sondování vaku je přes stent rizikové. U široce nasedajících aneuryzmat uložených v bifurkaci tepen je možné zavést stenty do okolních větví v konfiguraci písmene Y, u aneuryzmat konce bazilární tepny či bifurkace a. cerebri media jsou možné i jiné konfigurace stentů, jako například paralelní uložení či uložení napříč z jednoho úseku P1 do druhého přístupem přes a. communicans posterior a další. Jiná možnost je koaxiální implantace stentů ke zvýšení hustoty krytí v místě krčku. Nověji se používají speciální hustě pletené stenty, tzv. flow-divertery [17,18], omezeně je možné použít i stentgrafty. Hustě pletené stenty zahájily nový trend léčby velkých, gigantických nebo velmi malých aneuryzmat pomocí změny krevního toku z aneuryzmatu do mateřské tepny. Narušení vtoku krve do aneuryzmatu vytváří pomalý průtok v aneuryzmatu a podporuje tvorbu trombu. Stent je navíc v průběhu času inkorporován do cévní stěny, což vede k remodelaci celého léčeného segmentu. Běžné stenty s 90% porozitou úpletu jsou používány jako opora pro spirálky při embolizaci (obr. 2). Na rozdíl od toho jsou nové stenty se 70% porozitou vyvinuty s cílem změnit krevní tok, zatímco tepny odstupující ze stentovaného segmentu mají zůstat průchodné. Tato potenciálně revoluční metoda by měla být stále považována za vývojovou. Dle monocentrických studií a jednoho registru bylo takto v roce 2011 léčeno více než 2 300 nemocných. Dosud nejsou známy dlouhodobé výsledky sledování, zejména riziko ischemie z trombembolických komplikací přestentovaných odstupujících tepen a okluze perforujících arterií. Její hlavní využití je u velkých a gigantických aneuryzmat na supraoftalmickém úseku vnitřní karotické tepny. A to zvláště u těch aneuryzmat, kde se klinicky uplatňuje útlak vaku aneuryzmatu do okolí. Dále pak k remodelaci tepen s fuziformními aneuryzmaty, kde by výplň jejich dutiny spirálami přes oka stentu byla obtížná či nemožná, u aneuryzmat menších než 2 mm či tzv. blister-like aneuryzmat a u recidiv endovaskulárně léčených aneuryzmat. U aneuryzmat nad 15 mm je doporučována částečná výplň spirálami před zavedením „flow-diverteru“ k prevenci ruptury stěny. Ta byla opakovaně popsána u neprasklých aneuryzmat až s odstupem jednoho měsíce od léčby flow-divertery [19]. Všeobecně u léčby velkých aneuryzmat je doporučena kortikoterapie k prevenci edému v okolí trombozujícího aneuryzmatu.
Možnou příčinou potíží a technického selhání při léčbě starých nebo hypertenzních nemocných je vinutost extrakraniálních mozkových tepen. V literatuře byla popsána řada metod k řešení tohoto problému od možnosti zavedení vodicího katétru do karotidy až po přímou punkci vertebrální tepny. Ve vertebrobazilárním řečišti se pro lepší podporu vodicího katétru využívá brachiální nebo axilární přístup.
V poslední době byl vyvinut koaxiální systém vodicích katétrů poskytujících lepší stabilitu pro zavádění některých tuhých instrumentů (např. intrakraniálních stentů) z femorálního přístupu. Ve většině případů tento systém vyžaduje zavedení 8F vodicího katétru až za odstup karotické nebo vertebrální tepny, což dává stabilitu celému přístupovému systému. Pak je možné použít další dva nebo tři koaxiální katétry k vytvoření stabilního bezpečného přístupu k léčené oblasti [20]. K vyztužení pracovního katétru se dá použít paralelní podpůrný vodič nejčastěji 0,018 palce zavedený do jeho lumen (tzv. buddy wire).
Antiagregační režim
U léčby gigantických aneuryzmat, zejména na střední mozkové tepně s použitím stentu, není podávání heparinu v prevenci trombembolických komplikací dostatečné. Snížení rizika ischemických komplikací lze dosáhnout pomocí antiagregační terapie zahájené před endovaskulární léčbou nebo v jejím průběhu [21]. Antiagregační léčba je však u akutního SAK spojena s vyšším rizikem dalšího mozkového krvácení nebo může interferovat s možnou neurochirurgickou léčbou SAK (evakuace hematomu, komorová drenáž).
Intraarteriální léčba vazospazmů
Vazospazmy mozkových tepen obvykle nastupují 3. až 5. den po vzniku aneuryzmatického SAK a dosahují maxima zúžení tepen v 5–14 dnech. Míra zúžení a rozsah postižených tepen určují stupeň závažnosti symptomů. Zhruba 40–70 % nemocných po SAK má různý stupeň zúžení tepen, ale pouze u 20–30 % se vyvine neurologická symptomatologie. Mezi symptomy patří plíživý nástup zmatenosti s poruchou vědomí, dále může následovat vznik fokálního neurologického deficitu, mozkového infarktu, kómatu a i smrti nemocného. U některých nemocných s méně významnými vazospazmy zúžení tepen spontánně ustoupí a stav se upraví k normě. Angiografický nález nemusí korelovat se symptomatologií nemocného. U mnoha nemocných může i velmi těsné zúžení tepen být zcela asymptomatické. Diagnóza vazospazmu se opírá o transkraniální dopplerovské vyšetření (TCD). Podezření na významný vazospazmus je při zvýšení průtoku na M1 úseku a. cerebri media nad 120 cm/s. Při naměřené rychlosti nad 200 cm/s je nález významného vazospazmu pravděpodobnější. Pravidelné monitorování TCD je zvláště významné u nemocných s poruchou vědomí po SAK, protože se není možné řídit neurologickýmí příznaky.
Rychlost na intrakraniálních tepnách může být ovlivněna tzv. 3H léčbou (hypervolemie, hypertenze a hemodiluce). Proto je doporučeno používat tzv. karotický index, kdy se naměřená hodnota intrakraniální rychlosti porovná s rychlostí naměřenou na extrakraniálním úseku a. carotis interna. Pokud je tento poměr = 3, je podezření vysoké, pokud je = 5 a více, je pozitivní předpovědní hodnota pro přítomnost vazospazmu vysoká.
Nemocní se SAK jsou sledováni na jednotkách intenzivní péče. Vazospazmy refrakterní na medikamentózní léčbu mohou být léčeny endovaskulárně pomocí nízkotlakých angioplastických balónků s možností intra-arteriálního podání vazodilatancí (např. nimodipin) [22,23]. Kontinuální intraarteriální infuze nimodipinu vede z důvodu proximální nebo distální vazodilatace ke zlepšení perfuze mozku bez popsané závažné morbidity. Běžné použití balónkové angioplastiky zůstává sporné kvůli možnosti významných komplikací.
Komplikace léčby
Nejzávažnějšími periprocedurálními komplikacemi jsou perforace aneuryzmatu a mozková ischemie. Výskyt obou komplikací je ovlivněn anatomickou situací u každého nemocného, jako jsou technické problémy z důvodu tortuosity přístupových tepen, aterosklerotické postižení tepen, fragilita stěny aneuryzmatu a variabilita vaku aneuryzmatu a jeho krčku. Úspěšné překonání těchto potenciálních rizik vyžaduje zkušenosti a trénink operátora, stejně tak jako schopnost operatéra předvídat tyto možné komplikace u takových nemocných.
V posledním desetiletí výrazně vzrostly možnosti léčby ischemických komplikací během endovaskulární léčby s příchodem blokátoru receptoru glykoproteinů IIb/IIIa a speciálních stentů. Významnou roli prevence ischemických komplikací u nemocných vyžadujících zavedení stentu nebo flow-diverteru hraje podání antiagregační terapie před léčbou [21]. Všeobecně je doporučováno provádět rutinně laboratorní testy na rezistenci antiagregační medikamentózní terapie.
Krvácivé komplikace
Riziko perforace aneuryzmatu během endovaskulární embolizace je výrazně vyšší u akutních dříve prasklých aneuryzmat než u aneuryzmat neprasklých, udává se v rozmezí 1,4 až 4,5 %. Podle metaanalýzy 17 publikovaných retrospektivních studií vedla perforace aneuryzmatu ke smrti ve 33 % a invaliditě v 5 %. Perforace zapříčiněné mikrokatétrem nebo spirálkou mají vyšší mortalitu než perforace způsobené mikrovodičem [24]. Ke snížení mortality a morbidity při perforaci aneuryzmatu přispívá rychlé dovyplnění vaku, vyvázání heparinu a dle CT nálezu časná komorová drenáž.
V literatuře byly popsány protruze spirálek mimo angiografickou konturu vaku aneuryzmatu bez průkazného krvácení. To může být spojeno jak s větším počtem rekanalizací aneuryzmat, tak i s krvácením skrz oslabené místo po počáteční protruzi spirálky [25]. Zdánlivá protruze spirály může být pozorována i v přítomnosti trombu ve vaku aneuryzmatu. Malá aneuryzmata jsou během embolizace pravděpodobně častěji perforována.
Rovněž byly popsány perforace piálních tepen během zavádění intrakraniálních stentů systémem „over the wire“. Intrakraniální krvácení se může objevit až několik dní po poranění, závažnost krvácení je potencována antiagregační léčbou nutnou před zaváděním intrakraniálních stentů.
Na moderních angiografických přístrojích s plochým detektorem je v současnosti možné provádět v průběhu angiografie a embolizace CT vyšetření. Technologie zatím dovoluje diferenciaci lézí pouze do rozdílu denzity 10 Hounsfieldových jednotek. To umožňuje detekovat opakované krvácení, zjistit případný intracerebrální hematom a velikost komorového systému přímo na angiografickém sále. Jisté limitace této zobrazovací metody zůstávají v oblasti zadní jámy lební [26].
Periprocedurální ischemické komplikace
Periprocedurální ischemické komplikace jsou ve většině případů trombembolického původu. Hemodynamický infarkt vzniklý periprocedurálně je poměrně vzácný. Může být zapříčiněn stenózou mateřské tepny při agravaci preexistujících vazospazmů, neokludujícím trombem nebo nedostatečným kolaterálním tokem po terapeutické okluzi mozkové tepny.
Frekvence periprocedurálních mozkových ischemií je mnohem častější než krvácivých. Její výskyt závisí na protokolu antiagregační a antikoagulační terapie, který je odlišný u akutních a elektivních případů, dále na velikosti léčeného aneuryzmatu a nutnosti implantace stentu. Výskyt trombembolických komplikací je častější při endovaskulární léčbě aneuryzmat střední mozkové tepny. Lokální trombolytická léčba je u nemocných s akutním SAK všeobecně považována za neakceptovatelně rizikovou. V případě přítomnosti akutního trombu při embolizaci je proto doporučována intravenózní terapie s podáním bolusu a následné kontinuální infuze s blokátory glykoproteinových receptorů IIb/IIIa. Úspěšnost léčby akutní trombózy po lokální infuzi těchto léků byla popsána v literatuře [27]. Při selhání infuzní léčby na rozšiřující se trombózu je možné využít mechanických extrakčních zařízení, aspiračních katétrů nebo implantace stentů.
Výsledky endovaskulární léčby
Při zavádění embolizační léčby mozkových aneuryzmat existovaly obavy neurochirurgů ohledně trvanlivosti léčby a její schopnosti zabránit opakovanému krvácení léčených aneuryzmat. Výsledek léčby po SAK v hlavní míře závisí na závažnosti počátečního krvácení. Dopad procedurálních komplikací (jak endovaskulárních, tak i neurochirurgické léčby) na klinický výsledek je lépe srovnatelný ve studiích s neprasklými aneuryzmaty nebo ve studiích prospektivně srovnávajících klipování a embolizaci u nemocných, u kterých intrakraniální aneuryzmata byla považována jako vhodná pro obě metody léčby. Tyto studie potvrdily všeobecně očekávaný fakt, že kraniektomie a mikrochirurgická preparace působí nemocným větší stres než léčba endovaskulární. Tato zátěž se zvyšuje s věkem nemocných. I přes vyšší počet opakovaného krvácení po embolizaci zapříčiněné méně stabilním uzávěrem aneuryzmatu bylo přežívání embolizovaných pacientů lepší než po chirurgické léčbě. Existují obavy limitované použitelností výsledku této studie v naší každodenní praxi, protože do studie byly vybrány selektované skupiny nemocných. Proto je odůvodnitelný individuální přístup ke každému nemocnému s nabídnutím nejlepší možné léčby a přístupu v daném případě a doporučeno tyto pacienty léčit pouze v centrech s velkým objemem nemocných [28].
Prasklá aneuryzmata
Účinnost léčby prasklých mozkových aneuryzmat je určena mírou výskytu opakovaného krvácení léčených aneuryzmat, která je vyšetřována nejčastěji pomocí MR angiografie. Studie ISAT (The International Subarachnoid Aneurysm Trial) byla prospektivní randomizovanou studií srovnávající endovaskulární léčbu s chirurgickým klipováním [29,30]. Tato studie zahrnovala nemocné z let 1994 až 2002. Z 9 500 nemocných bylo vybráno přibližně 2 100 pacientů. Aneuryzma bylo lokalizováno v přední cirkulaci v 97 % případů, 92 % z nich bylo menší než 10 mm v průměru. V dobrém neurologickém stavu po SAK (WFNS 1 a 2) bylo 88 % nemocných. Do studie byli zařazeni pouze nemocní vhodní pro oba typy léčby, a to v centrech provádějících oba způsoby léčby u více než 60 pacientů s aneuryzmatickým SAK ročně. Primárním cílem léčby cévní mozkové příhody byla prevence invalidity a úmrtí na SAK definovaných jako modifikovaná Rankinova škála 3–6 v průběhu jednoho roku po léčbě. V této studii bylo 23,7 % pacientů léčených endovaskulárně závislých na pomoci druhé osoby nebo zemřeli v průběhu jednoho roku, u chirurgicky léčených nemocných pak 30,6 % (p = 0,0019). Relativní a absolutní snížení rizika závislosti či smrti bylo při použití endovaskulární léčby oproti chirurgické 22,6 %, resp. 6,9 %. Riziko úmrtí v průběhu pěti let zůstává významně nižší u nemocných embolizovaných než klipovaných. Hlavní příčinou smrti byly komplikace v průběhu prvního roku po léčbě spojené s těžkým deficitem [31,32].
V obou skupinách se opakované krvácení z léčených aneuryzmat vyskytovalo nejčastěji během prvních 30 dnů po léčbě. V endovaskulární skupině po léčbě opětovně krvácelo 20 nemocných (1,4 %), v chirurgické 8 nemocných (0,74 %) s přibližně 50% pravděpodobností smrti v obou skupinách [32]. Podobné výsledky byly publikovány i ve studii CARAT (Cerebral Aneurysm Rerupture After Treatment), která proběhla v devíti velkoobjemových centrech v letech 1996–1998 [33]. Ve skupině 1 001 nemocných bylo zaznamenáno 19 postprocedurálních opakovaných prasknutí výdutí. Sedm-náct nemocných z těchto 19 opětovně zakrvácelo v průběhu prvního měsíce a vedlo k úmrtí v 58 %. Polovina případů opakovaného krvácení se vyskytla v průběhu prvních tří dnů po léčbě. Celkové riziko dalšího krvácení z aneuryzmat je vyšší ve skupině embolizovaných aneuryzmat (3,4 % vs 1,3 %). Většina opětovných krvácení po embolizaci byla zaznamenána u angiograficky nekompletně vyplněných aneuryzmat. V dlouhodobém sledování (po jednom roce po léčbě) se ve srovnání s chirurgickou léčbou opětovné krvácení z embolizovaných aneuryzmat mírně zvyšuje (roční výskyt je 0,11 %) [34].
Byly popsány případy, že dokonce kompletně exkludovaná aneuryzmata po embolizaci nebo klipování později praskla. Ve skupině anatomicky vhodných aneuryzmat zahrnutých do studie ISAT bylo kompletního uzávěru dosaženo v 66 % a trvalé plnění aneuryzmatu bylo pozorováno v 8 %. U zbylých 26 % aneuryzmat zůstávalo částečné plnění krčku (Raymondova klasifikace) [35]. Faktory vedoucí k primárně neúplné okluzi aneuryzmatu s následnou rekurencí jsou velikost aneuryzmatu a jeho krčku. Větší aneuryzmata a široký krček korelují s nižší pravděpodobností kompletního uzávěru po embolizaci.
Více recidiv po embolizaci bylo zaznamenáno u akutních aneuryzmat než u aneuryzmat neprasklých. Dále u aneuryzmat větších než 10 mm, aneuryzmat s krčkem širším více než 4 mm, u aneuryzmat s promývaným krčkem či částí vaku po embolizaci. Pravděpodobnost nálezu recidivy se zvyšovala s délkou sledování [35].
Neprasklá aneuryzmata
Doposud neexistuje žádná prospektivní randomizovaná studie srovnávající výsledky endovaskulární a neurochirurgické u neprasklých aneuryzmat. Diagnostika náhodně zjištěných intrakraniálních aneuryzmat se zvyšuje díky větším diagnostickým možnostem zobrazovacích metod, jimiž jsou MR a CT (obr. 3). Proto je nutné stanovit kritéria založená na velikosti, tvaru a lokalizaci aneuryzmat, věku a komorbiditách těchto nemocných.

Existují dvě skupiny nemocných, které by měly být odděleny od pacientů majících tzv. pravé incidentální aneuryzma. První z nich je skupina pacientů s tzv. koincidentálním aneuryzmatem, což znamená neprasklé aneuryzma u pacienta, který prodělal SAK z jiného mozkového aneuryzmatu. Vícečetná aneuryzmata se vyskytují asi u 20 % nemocných. Druhou skupinu tvoří pacienti s pozitivní rodinnou anamnézou SAK.
Největší prospektivní studie (International Study of Unruptured Intracranial Aneurysms Investigators, ISUIA) zabývající se přirozeným průběhem nemoci, klinickým výsledkem, rizikem chirurgické a endovaskulární léčby zahrnovala 4 060 pacientů s diagnózou neprasklých aneuryzmat v letech 1991 a 1998 [36]. Tato studie byla rozdělena na tři skupiny nemocných. První zahrnovala 1 692 nemocných, kteří neprodělali operaci aneuryzmatu, druhá skupina 1 917 nemocných podstoupila neurochirurgickou operaci a 451 nemocných bylo léčeno endovaskulárně. Nemocní s neléčenými aneuryzmaty byli rozděleni na skupiny s aneuryzmatem lokalizovaným v přední cirkulaci a zadní cirkulaci, zahrnující též aneuryzmata při odstupu a. communicans posterior.
Všichni nemocní s neprasklým aneuryzmatem byli rozděleni do skupin podle velikosti: menší než 7 mm, 7–12 mm, 13–24 mm a 25 mm a větší. U incidentálních aneuryzmat bylo pětileté kumulativní riziko prasknutí v přední cirkulaci dle velikosti 0 %, 2,6 %, 14,5 %, a 40 %, v zadní cirkulaci 2,5 %, 14,5 %, 18,4 % a 50 %.
Tyto výsledky byly srovnatelné nebo překračovaly rizika spojená s chirurgickou nebo endovaskulární léčbou v odpovídajících skupinách. U nemocných s pravým incidentálním aneuryzmatem menším než 7 mm je riziko ruptury 0,1 % za rok. Toto riziko je velmi nízké a je obtížné zlepšit přirozený průběh těchto aneuryzmat. Autoři předpokládali, že největší benefit neurochirurgické léčby by měli mít nemocní mladší než 50 let s incidentálním aneuryzmatem a. communicans posterior velikosti 7–24 mm. Naproti tomu nejsilnějším prediktivním faktorem špatného chirurgického výsledku je nemocný nad 50 let a výrazně se zvyšuje po dosažení věku 60–70 roků. Dalšími rizikovými faktory špatného výsledku po chirurgické léčbě jsou velká aneuryzmata, aneuryzmata v zadní cirkulaci (zejména konce bazilární tepny), anamnéza CMP a přítomnost jiných klinických projevů z aneuryzmatu než SAK.
V této studii není možné přímé porovnání výsledků chirurgicky a endovaskulárně léčených skupin nemocných. Do endovaskulární skupiny bylo zavzato více nemocných staršího věku, s většími aneuryzmaty a s aneuryzmaty v zadní cirkulaci. Dále nebyly stejné počty nemocných v obou skupinách. Mortalita a morbidita je však u endovaskulárně léčených nemocných nižší a zdá se, že výsledky jsou méně závislé na věku než u chirurgické léčby.
Ve studii ATENA (Analysis of Treatment by Endovascular approach of Non ruptured Aneurysms) byla provedena analýza výsledků endovaskulární léčby neprasklých aneuryzmat, zahrnovala 649 nemocných prospektivně a postupně zařazených během let 2005 až 2006. Celkem bylo provedeno 700 výkonů u 739 neprasklých aneuryzmat. Aneuryzma bylo náhodně diagnostikováno u 65 % nemocných, 20 % bylo po ruptuře jiného aneuryzmatu, během vyšetřování pro jiné neurologické potíže ve 13 %, na základě rodinného skríningu ve 2,5 %. Hypertenzí trpělo 30 % nemocných, 41 % bylo aktivními kuřáky cigaret. Endovaskulární léčba selhala ve 4,3 %, trombembolické komplikace se vyskytly v 7 % případů, prasknutí aneuryzmatu u 2,6 % výkonů. Třicetidenní morbidita byla 1,7 %, mortalita 1,4 % [37].
Na základě výše uvedených studií náš přístup při rozhodování o léčbě incidentálních aneuryzmat zahrnuje velikost aneuryzmatu, jeho lokalizaci, věk nemocného a jeho přidružené choroby. Jako kritická se zdají být neprasklá aneuryzmata mající velikost větší než 7 mm. Zvýšené riziko krvácení představují aneuryzmata v zadní cirkulaci, multilobulární a mladí nemocní s hypertenzí, kouřením cigaret, zde by mělo být vždy zvažováno elektivní ošetření. Embolizace neprasklých aneuryzmat se stává nejčastějším intrakraniálním endovaskulárním výkonem. Poměr rizika a přínosu endovaskulární léčby vůči konzervativnímu postupu bude hodnocen v probíhajících studiích [38].
Metody zobrazování intrakraniálních aneuryzmat po embolizaci
Nejsenzitivnější zobrazovací metodou endovaskulárně léčených aneuryzmat zůstává katetrizační angiografie. Několik studií nicméně prokázalo, že MR angiografie s kontrastní látkou může ve většině případů nahradit invazivní zobrazování embolizovaných aneuryzmat díky své dostatečné spolehlivosti, neinvazivitě a ceně [39,40]. Vzhledem k vyšší pravděpodobnosti recidivy endovaskulárně léčených aneuryzmat vyvstává otázka optimálního protokolu dlouhodobého sledování po SAK. Jakékoliv promývání zbytku aneuryzmatu může vést k jeho zvětšení a prasknutí. V průběhu primárního ošetření nelze však ve všech případech kompletně vyřadit všechna aneuryzmata. V dlouhodobém sledování je velmi obtížné předpovědět vývoj perfuze reziduálního krčku aneuryzmatu. Odhaduje se, že k opětovné perfuzi původně zcela embolizovaných aneuryzmat dochází přibližně ve 20 %, polovina z nich je opětovně léčena [41].
Existuje názor, že kompletně vyplněná aneuryzmata, která jsou v průběhu sledování po šesti měsících stabilní, lze považovat za vyléčená bez nutnosti dalšího sledování. Nemocní s neúplně embolizovaným aneuryzmatem musejí být buď opětovně léčeni, nebo sledováni v individuálních intervalech [42,43].
Dokonce i v ISAT studii lze obtížně porovnat pravou recidivu aneuryzmatu mezi endovaskulárně a chirurgicky léčenými skupinami nemocných a rozlišit rekurenci aneuryzmatu od primárně nedostatečné výplně. Kontrolní angiografii podstoupilo v embolizované skupině v 6měsíčním sledování po léčbě 88 % nemocných, ve skupině chirurgicky léčených pouze 46 %. Katetrizační angiografie nebývá po zaklipování většinou vyžadována. Navzdory různým protokolům sledování (v ISAT studiii i dalších) není vyšší frekvence neúplné obliterace aneuryzmatu spojena s proporcionálně vyšším počtem opakovaného krvácení. Po zaklipování bylo opakované krvácení u asymptomatických recidiv diagnostikováno relativně častěji (3krát z 9 recidiv) než u endovaskulární léčby (7/94). Zatímco nutnost veškeré opakované léčby (časné i pozdní) byla 4krát častější u embolizací (17,4 % vs 3,8 %), tak pozdní léčba byla po embolizaci 7krát častější. To znamená, že opakování léčby aneuryzmat po embolizaci může pokračovat v průběhu celého období dispenzarizace, což ospravedlňuje pravidelné zobrazování i klinické kontroly [41].
Opakované krvácení z aneuryzmat, která byla klipována pro krvácení, je 22krát častější než očekávané riziko v běžné populaci. Rizikovými faktory jsou kouření a výskyt vícečetných aneuryzmat v době léčby subarachnoidálního krvácení. Není zcela jasné, zda vyhledávání „de novo” aneuryzmat by mělo být důvodem neustálého sledování těchto nemocných [44–46].
Závěr
Existují mnohočetné připomínky a výtky ke srovnávání neurochirurgické a endovaskulární léčby intrakraniálních aneuryzmat [30,47–50]. Bylo prokázáno stírání rozdílů obou metod v přežívání bez pomoci jiné osoby a úmrtnosti [51]. Musíme však mít neustále na paměti fakt, že do studií byli vybíráni nemocní s morfologicky i klinicky vhodnými aneuryzmaty pro obě metody léčby, tzv. ISAT aneuryzmata. Mikrochirurgie je všeobecně zatížena většími periprocedurálními komplikacemi, spolehlivost uzávěru výdutě svorkou je i přes pokračující zlepšování endovaskulárních technik nadále vyšší u otevřené operace. Z tohoto důvodu se stále jedná o dvě metody, jejichž použití je voleno individuálně s ohledem na pacientovy charakteristiky a i na charakteristiky daného pracoviště [29,52,53]. Léčba nekrvácejících intrakraniálních aneuryzmat zůstává kontroverzní. Bylo sice prokázáno, že velikost aneuryzmatu přímo úměrně souvisí s rizikem krvácení [36], nicméně většina krvácejících aneuryzmat v denní praxi je menší než 10 mm. Některá aneuryzmata zřejmě zakrvácí krátce po tom, kdy vznikla. Byla formulována hypotéza, že některá aneuryzmata po svém vzniku projdou obdobím vyššího rizika ruptury, a pokud v tomto období nezakrvácí, přechází po „zhojení“ do období nízkého rizika ruptury. Proto má význam léčit jen incidentální aneuryzmata, která se třeba jen minimálně zvětší či změní tvar. Dlouhodobě stabilní aneuryzmata mají nízké riziko krvácení. Riziko krvácení velkých aneuryzmat je vysoké, ale dle ISUIA [36] rizika jejich léčby jsou rovněž vysoká. Léčba velkých aneuryzmat by tedy měla být indikována individuálně [54].
prof. MUDr. Antonín Krajina, CSc.
Radiologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: krajina@fnhk.cz
Přijato k recenzi: 24. 2. 2012
Přijato do tisku: 16. 4. 2012
Zdroje
1. Agid R, Andersson T, Almqvist H, Willinsky RA, Lee SK, terBrugge KG et al. Negative CT angiography findings in patients with spontaneous subarachnoid hemorrhage: When is digital subtraction angiography still needed? AJNR Am J Neuroradiol 2010; 31(4): 696–705.
2. Papke K, Kuhl CH, Fruth M, Haupt C, Schlunz-Hendann M, Sauner D et al. Intracranial aneurysms: role of multidetector CT angiography in diagnosis and endovascular therapy planning. Radiology 2007; 244(2): 532–540.
3. Teitelbaum GP, Larsen DW, Zelman V, Lysachev AG, Likhterman LB. A tribute to dr. Fedor A. Serbinenko, founder of endovascular neurosurgery. Neurosurgery 2000; 46(2): 462–469.
4. Guglielmi G, Viñuela F, Dion J, Duckwiller G. Electrothrombosis of saccular aneurysms via endovascular approach. Part 2: preliminary clinical experience. J Neurosurg 1991; 75(1): 8–14.
5. Moret J, Cognard C, Weill A, Castaings L, Rey A. The “Remodeling Technique” in the treatment of wide neck intracranial aneurysms. Angiographic results and clinical follow-up in 56 cases. Interv Neuroradiol 1997; 3(1): 21–35.
6. Szikora I, Guterman LR, Wells KM, Hopkins LN. Combined use of stents and coils to treat experimental wide-necked carotid aneurysms: preliminary results. AJNR Am J Neuroradiol 1994; 15(6): 1091–1102.
7. White PM, Raymond J. Endovascular coiling of cerebral aneurysms using “bioactive” or coated-coil technologies: a systematic review of the literature. AJNR Am J Neuroradiol 2009; 30(2): 219–226.
8. Wakhloo AK, Gounis MJ, Sandhu JS, Akkawi N, Schenck AE, Linfante I. Complex-shaped platinum coils for brain aneurysms: higher packing density, improved biomechanical stability, and midterm angiographic outcome. AJNR Am J Neuroradiol 2007; 28(7): 1395–1400.
9. Sluzewski M, van Rooij WJ. Packing performance of helical Guglielmi detachable coil (GDC) 18 in intracranial aneurysms: a comparison with helical GDC 10 coils and complex Trufill/Orbit coils. AJNR Am J Neuroradiol 2007; 28(7): 1384–1387.
10. Pierot L, Leclerc X, Bonafé A, Bracard S. French Matrix Registry Investigators. Endovascular treatment of intracranial aneurysms using Matrix coils: short- and mid-term results in ruptured and unruptured aneurysms. Neurosurgery 2008; 63(5): 850–858.
11. Veznedaroglu E, Koebbe CJ, Siddiqui A, Rosenwasser RH. Initial experience with bioactive Cerecyte detachable coils: impact on reducing recurrence rates. Neurosurgery 2008; 62(4): 799–806.
12. Liebig T, Henkes H, Fischer S, Weber W, Miloslavski E, Mariushi W et al. Fibered electrolytically detachable platinum coils used for the endovascular treatment of intracranial aneurysms. Initial experiences and mid-term results in 474 aneurysms. Interv Neuroradiol 2004; 10(1): 5–26.
13. van Rooij WJ, de Gast AN, Sluzewski M. Results of 101 aneurysms treated with polyglycolic/polylactic acid microfilament Nexus coils compared with historical controls treated with standard coils. AJNR Am J Neuroradiol 2008; 29(5): 991–996.
14. Gunnarsson T, Tong FC, Klurfan P, Cawley CM, Dion JE. Angiographic and clinical outcomes in 200 consecutive patients with cerebral aneurysm treated with hydrogel-coated coils. AJNR Am J Neuroradiol 2009; 30(9): 1657–1664.
15. Sorteberg A, Bakke SJ, Boysen M, Sorteberg M. Angiographic balloon test occlusion and therapeutic sacrifice of major arteries to the brain. Neurosurgery 2008; 63(4): 651–661.
16. Fox AJ, Pelz DM, Viñuela F, Barnett HJ, Peerless SJ. Results of the international extracranial/intracranial bypass study. Implications for neuroradiologists. Acta Radiol 1986; 369: 77–78.
17. Fiorella D, Kelly ME, Albuquerque FC, Nelson PK. Curative reconstruction of a giant midbasilar trunk aneurysm with the Pipeline embolization device. Neurosurgery 2009; 64(2): 212–217.
18. Lylyk P, Miranda C, Ceratto R, Ferrario A, Scrivano E, Luna HR et al. Curative endovascular reconstruction of cerebral aneurysms with the Pipeline embolization device: the Buenos Aires experience. Neurosurgery 2009; 64(4): 632–643.
19. Kulcsár Z, Houdart E, Bonafé A, Parker G, Millar J, Goddard AJ et al. Intra-aneurysmal thrombosis as a possible cause of delayed aneurysm rupture after flow-diversion treatment. AJNR Am J Neuroradiol 2011; 32(1): 20–25.
20. Kulcsár Z, Yilmaz H, Bonvin C, Lovlblad KO, Rüfenacht DA. Multiple coaxial catheter system for reliable access in interventional stroke therapy. Cardiovasc Intervent Radiol 2010; 33(6): 1205–1209.
21. Prabhakaran S, Wells KR, Lee VH, Flaherty CA, Lopes DK. Prevalence and risk for aspirin and clopidogrel resistance in cerebrovascular stenting. AJNR Am J Neuroradiol 2008; 29(2): 281–285.
22. Zubkov YN, Nikiforov BM, Shustin VA. Balloon catheter technique for dilatation of constricted cerebral arteries after aneurysmal SAH. Acta Neurochir (Wien) 1984; 70(1–2): 65–79.
23. Zwienenberg-Lee M, Hartman J, Rudisill N, Madden LK, Smith K, Eskridge J et al. Effect of prophylactic transluminal balloon angioplasty on cerebral vasospasm and outcome in patients with Fisher grade III subarachnoid hemorrhage: results of a phase II multicenter, randomized, clinical trial. Stroke 2008; 39(6):1759–1765.
24. Cloft HJ, Kallmes DF. Cerebral aneurysm perforations complicating therapy with Guglielmi detachable coils: a meta-analysis. AJNR Am J Neuroradiol 2002; 23(10): 1706–1709.
25. Kwon BJ, Chang HW, Youn SW, Kim JE, Han MH. Intracranial aneurysm perforation during endovascular coiling: impact on clinical outcome, initial occlusion, and recanalization rates. Neurosurgery 2008; 63(4): 676–683.
26. Struffert T, Richter G, Engelhorn T, Doelken M, Goelitz P, Kalender WA et al. Visualisation of intracerebral haemorrhage with flat-detector CT compared to multislice CT: results in 44 cases. Eur Radiol 2009; 19(3): 619–625.
27. Aviv RI, O’Neill R, Patel MC, Colquhoun IR. Abciximab in patients with ruptured intracranial aneurysms. AJNR Am J Neuroradiol 2005; 26(7): 1744–1750.
28. Bederson JB, Connolly ES Jr, Batjer HH, Dacey RG, Dion JE, Diringer MN et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a statement for healthcare professionals from a special writing group of the Stroke Council, American Heart Association. Stroke 2009; 40(3): 994–1025.
29. Molyneux A, Kerr R, Stratton I, Sandercock P, Clarke M, Shrimpton J et al. International Subarachnoid Aneurysm Trial (ISAT) Collaborative Group. International Subarachnoid Aneurysm Trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2,143 patients with ruptured intracranial aneurysms: a randomized trial. Lancet 2002; 360(9342): 1267–1274.
30. Derdeyn CP, Barr JD, Berenstein A, Connors JJ, Dion JE, Duckwiler GR et al. The International Subarachnoid Aneurysmal Trial (ISAT): a position statement from the Executive Committee of the American Society of Interventional and Therapeutic Neuroradiology and the American Society of Neuroradiology. AJNR Am J Neuroradiol 2003; 24(7): 1404–1408.
31. Molyneux AJ, Kerr RSC, Yu LM, Clarke M, Sneade M, Yarnold JA et al. International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: a randomized comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion. Lancet 2005; 366(9488): 809–817.
32. Molyneux AJ, Kerr RS, Birks J, Ramzi N, Yarnold J, Sneade M et al. Risk of recurrent subarachnoid haemorrhage, death, or dependence and standardised mortality ratios after clipping or coiling of an intracranial aneurysm in the International Subarachnoid Aneurysm Trial (ISAT): long-term follow-up. Lancet Neurol 2009; 8(5): 427–433.
33. CARAT Investigators. Rates of delayed rebleeding from intracranial aneurysms are low after surgical and endovascular treatment. Stroke 2006; 37(6): 1437–1442.
34. Johnston SC, Dowd CF, Higashida RT, Lawton MT, Duckwiler GR, Gress DR et al. CARAT Investigators. Predictors of rehemorrhage after treatment of ruptured intracranial aneurysms: the Cerebral Aneurysm Rerupture After Treatment (CARAT) Study. Stroke 2008; 39(1): 120–125.
35. Raymond J, Guilbert F, Weill A, Georganos SA, Juravsky L, Lambert A et al. Long-term angiography recurrences after selective endovascular treatment of aneurysms with detachable coils. Stroke 2003; 34(6): 1398–1403.
36. Wiebers DO, Whisnant JP, Huston J jr, Meissner I, Brown RD jr, Piepgras DG et al. International Study of Unruptured Intracranial Aneurysms Investigators. Unruptured intracranial aneurysms: natural history, clinical outcome, and risks of surgical and endovascular treatment. Lancet 2003; 362(9378): 103–110.
37. Pierot L, Spelle L, Vitry F. ATENA Investigators. Immediate clinical outcome of patients harboring unruptured intracranial aneurysms treated by endovascular approach: results of the ATENA study. Stroke 2008; 39(9): 2497–2504.
38. Raymond J, Molyneux AJ, Fox AJ, Johnston SC, Collet JP, Rouleau I. TEAM Collaborative Group. The TEAM trial: safety and efficacy of endovascular treatment of unruptured intracranial aneurysms in the prevention of aneurysmal hemorrhages: a randomized comparison with indefinite deferral of treatment in 2002 patient followed for 10 years. Trials 2008; 9: 43.
39. Wallace RC, Karis JP, Partovi S, Fiorella D. Noninvasive imaging of treated cerebral aneurysms, part I: MR angiographic follow-up of coiled aneurysms. AJNR Am J Neuroradiol 2007; 28(6): 1001–1008.
40. Gauvrit JY, Caron S, Taschner CA, Lejeune JP, Pruvo JP, Leclerc X. Intracranial aneurysms treated with Guglielmi detachable coils: long-term imaging follow-up with contrast-enhanced magnetic resonance angiography. J Neurosurg 2008; 108(3): 443–449.
41. Campi A, Ramzi N, Molyneux AJ, Summers PE, Kerr RS, Sneade M et al. Retreatment of ruptured cerebral aneurysms in patients randomized by coiling or clipping in the International Subarachnoid Aneurysm Trial (ISAT). Stroke 2007; 38(5): 1538–1544.
42. Sluzewski M, van Rooij WJ, Rinke GJ, Wijnalda D. Endovascular treatment of ruptured intracranial aneurysms with detachable coils: long-term clinical and serial angiographic results. Radiology 2003; 227(3): 720–724.
43. van Rooij WJ, Sluzewski M. Opinion: imaging follow-up after coiling of intracranial aneurysms. AJNR Am J Neuroradiol 2009; 30(9): 1646–1648.
44. van der Schaaf IC, Velthuis BK, Wermer MJ, Majoie C, Witkamp T, de Kort G et al. ASTRA Study Group. New detected aneurysms on follow-up screening in patients with previously clipped intracranial aneurysms: comparison with DSA or CTA at the time of SAH. Stroke 2005; 36(8): 1753–1758.
45. Wermer MJ, Greebe P, Algra A, Rinkel GJ. Incidence of recurrent subarachnoid hemorrhage after clipping for ruptured intracranial aneurysms. Stroke 2005; 36(11): 2394–2399.
46. Broderick J. Clipping or coiling: the first step for ruptured aneurysms. Lancet Neurol 2009; 8(5): 414–415.
47. Heros RC. International subarachnoid aneurysm trial analysis. J Neurosurg 2008; 108(3): 433–435.
48. Bakker NA, Metzemaekers JD, Groen RJ, Mooij JJ, van Dijk JM. International subarachnoid aneurysm trial 2009: endovascular coiling of ruptured intracranial aneurysms has no significant advantage over neurosurgical clipping. Neurosurgery 2010; 66(5): 961–962.
49. Raper DM, Allan R. International subarachnoid trial in the long run: critical evaluation of the long--term follow-up data from the ISAT trial of clipping vs coiling for ruptured intracranial aneurysms. Neurosurgery 2010; 66(6): 1166–1169.
50. Raja PV, Huang J, Germanwala AV, Gailloud P, Murphy KP, Tamarqo RJ. Microsurgical clipping and endovascular coiling of intracranial aneurysms: a critical review of the literature. Neurosurgery 2008; 62(6): 1187–1203.
51. Mitchell P, Kerr R, Mendelow D, Molynuex A. Could late rebleeding overturn the superiority of cranial aneurysm coil embolization over clip ligation seen in the International Subarachnoid Aneurysm Trial? J Neurosurg 2008; 108(3): 437–442.
52. Bendel P, Koivisto T, Könönen M, Hänninen T, Hurskainen H, Saari T et al. MR Imaging of the brain 1 year after aneurysmal subarachnoid hemorrhage: randomized study comparing surgical with endovascular treatment. Radiology 2008; 246(2): 543–552.
53. Vergouwen MD, Fang J, Casaubon LK, Stamplecoski M, Robertson A, Kapral MK et al. Higher incidence of in-hospital complications in patients with clipped versus coiled ruptured intracranial aneurysms. Stroke 2011; 42(11): 3093–3098.
54. Sato K, Yoshimoto Y. Risk profile of intracranial aneurysms: rupture rate is not constant after formation. Stroke 2011; 42(12): 3376–3381.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2012 Číslo 5
Nejčtenější v tomto čísle
- Motorické stereotypie v dětském věku – kazuistiky
- Emoční paměť – patofyziologie a klinické souvislosti
- Neurologické komplikace spojené s asistovanou reprodukcí – kazuistika
- Likvorový triplet (tau proteiny a beta-amyloid) v diagnostice Alzheimerovy-Fischerovy nemoci
