Intrakraniální hematomy u warfarinizovaných pacientů – kazuistiky a doporučení léčby
Intracranial Hematoma in Patients Receiving Warfarin – Case Reports and Recommended Therapy
Intracranial haemorrhage, whether spontaneous or the result of trauma, involves high morbidity// mortality. Older patients with medical co - morbidities often suffer from these haematomas. The authors present three case reports of intracranial haemorrhages (two of traumatic origin and one spontaneous) which involved a non‑standard approach to reversal therapy. They stress the need for rapid warfarin reversal and propose a therapeutic protocol that consists of rapid substitution of clotting factors together with urgent surgical intervention if indicated. Further, patients on oral anticoagulant therapy with intracranial haematoma should always be admitted in the centres with permanent neurosurgical services. Rapid warfarin reversal together with emergency operation in the event of clinical deterioration are conditions for the improvement of results in the treatment of intracranial haemorrhage in oral anticoagulant therapy patients.
Key words:
intracranial hemorrhage – warfarin – surgery
Autoři:
V. Přibáň 1,2; M. Holý 3; I. Vonke 4
Působiště autorů:
Neurochirurgické oddělení, Nemocnice České Budějovice, a. s.
1; Neurochirurgická klinika LF MU a FN Brno
2; Interní oddělení, Nemocnice České Budějovice, a. s.
3; Hematologické oddělení, Nemocnice České Budějovice, a. s.
4
Vyšlo v časopise:
Cesk Slov Neurol N 2009; 72/105(6): 570-574
Kategorie:
Kazuistika
Souhrn
Intrakraniální hematomy, úrazové i spontánní, jsou u warfarinizovaných pacientů zatíženy vysokou morbiditou/ mortalitou. Postiženi jsou obvykle starší, interně nemocní pacienti. Autoři prezentují kazuistiky intrakraniálních hematomů (dvou úrazových a jednoho spontánního) u antikoagulovaných pacientů s odlišným postupem substituční terapie. Je zdůrazněna nutnost časné úpravy hemokoagulačních parametrů. Dále je navržen terapeutický protokol rychlé substituce hemokoagulačních faktorů k stabilizaci hematomu a případné chirurgické intervenci. Je zdůrazněna nutnost koncentrovat warfarinizované pacienty s intrakraniálními hematomy do center s trvalou přítomností neurochirurga. Rychlá substituce spolu s okamžitou operací v případě klinické deteriorace je předpokladem zlepšení výsledků léčby intrakraniálních hematomů u antikoagulovaných pacientů.
Klíčová slova:
intrakraniální hematomy – warfarin – chirurgická léčba
Věnováno nedožitým 80. narozeninám MUDr. Miloslava Pexy, emeritního přednosty traumatologického oddělení Nemocnice České Budějovice.
Úvod
Neurochirurg je konfrontován s krvácivými komplikacemi orální antikoagulační terapie relativně často. Příčin je více, ale tou zásadní je malá terapeutická šíře preparátu warfarinu a jeho snadné předávkování. Stárnutím populace se navíc zvyšuje počet pacientů na orální antikoagulační terapii – warfarinu. Terapeutickou indikací warfarinu je žilní tromboembolická choroba; indikace preventivní zahrnují pooperační podávání po kardiochirurgických výkonech na chlopních, pooperační prevenci tromboembolie, trombofilní stavy a chronickou fibrilaci/flutter síní [1–4]. Prevalence antikoagulační terapie v populaci je odhadována na 0,5 %. Typickou komplikací antikoagulační terapie v neurochirurgii jsou intrakraniální hematomy, a to jak úrazové, tak spontánní. Incidence velkého krvácení u pacientů na warfarinu dosahuje 3,8 %, krvácení do centrální nervové soustavy pak 1 % [5]. Hematomy mohou být lokalizovány intrakraniálně subdurálně nebo intracerebrálně, méně často pak intraspinálně v epidurálním a subdurálním prostoru. Další možností je akutní krvácení do chronického subdurálního hematomu. Intrakraniální krvácivé komplikace terapie warfarinem (hematomy úrazové i spontánní) jsou zatíženy vysokou morbiditou/mortalitou [6–9]. Rychlá úprava hemokoagulačních parametrů je nezbytnou podmínkou urgentní operace [10–13]. Dalším důvodem včasné substituce faktorů hemokoagulace je skutečnost, že intrakraniální hematomy u warfarinizovaných pacientů mají tendenci k většímu nárůstu objemu v delším časovém intervalu, než je tomu u pacientů bez antikoagulace [14]. Iniciálně malé hematomy u pacientů v dobrém neurologickém stavu mají tendenci progredovat. Výsledkem nezřídka bývá klinická deteriorace s mizivou šancí na úpravu. Z těchto důvodů je na místě identifikace warfarinizovaných pacientů s kraniotraumatem a rychlá substituce u prokázaného intrakraniálního hematomu bez ohledu na aktuální indikaci k operační léčbě. Shodný terapeutický postup je indikován i u hematomů spontánních.
Kazuistika 1
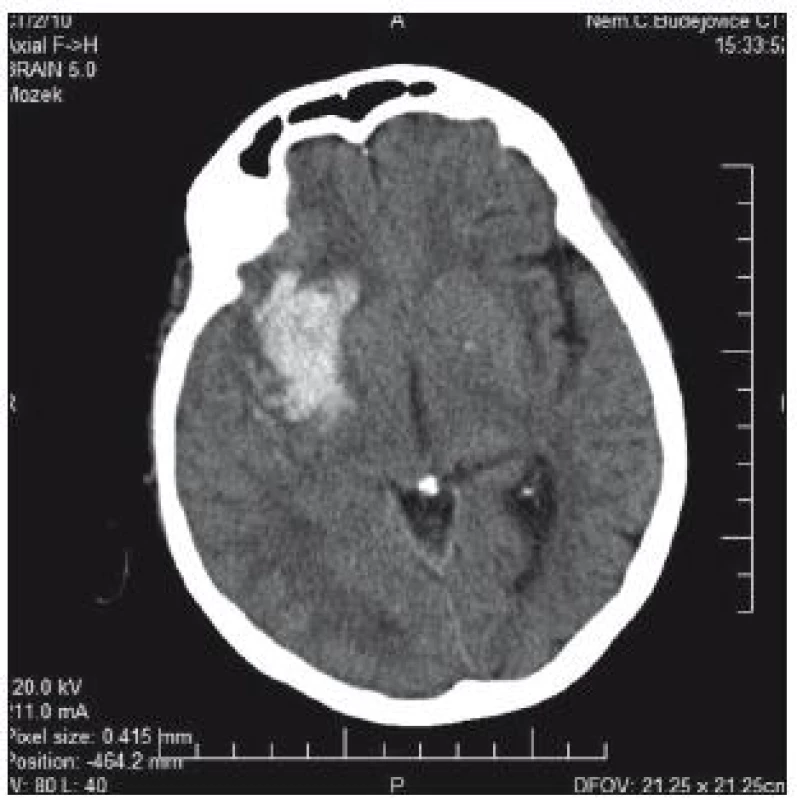
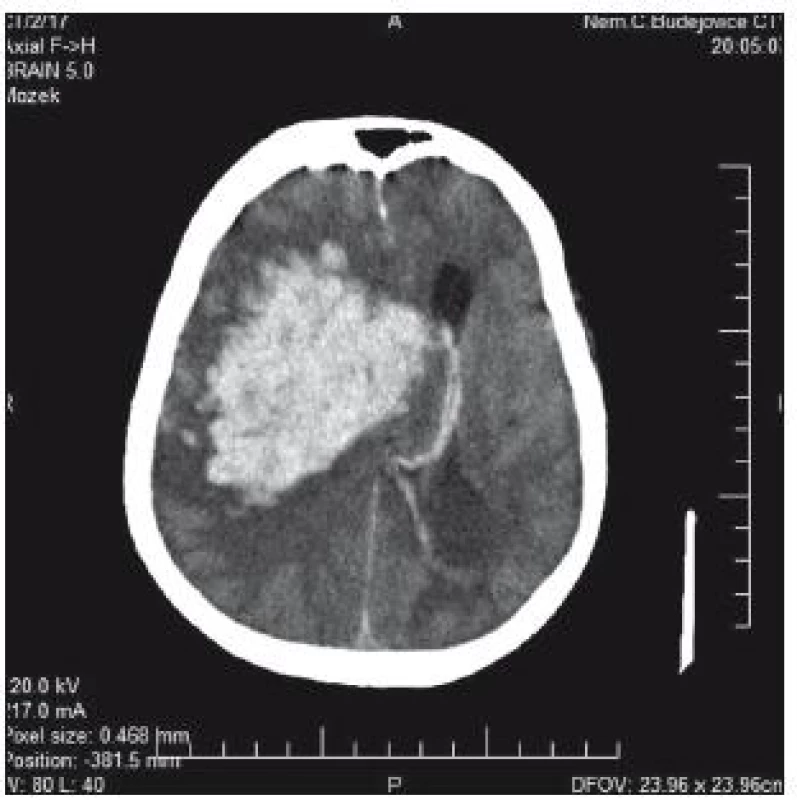
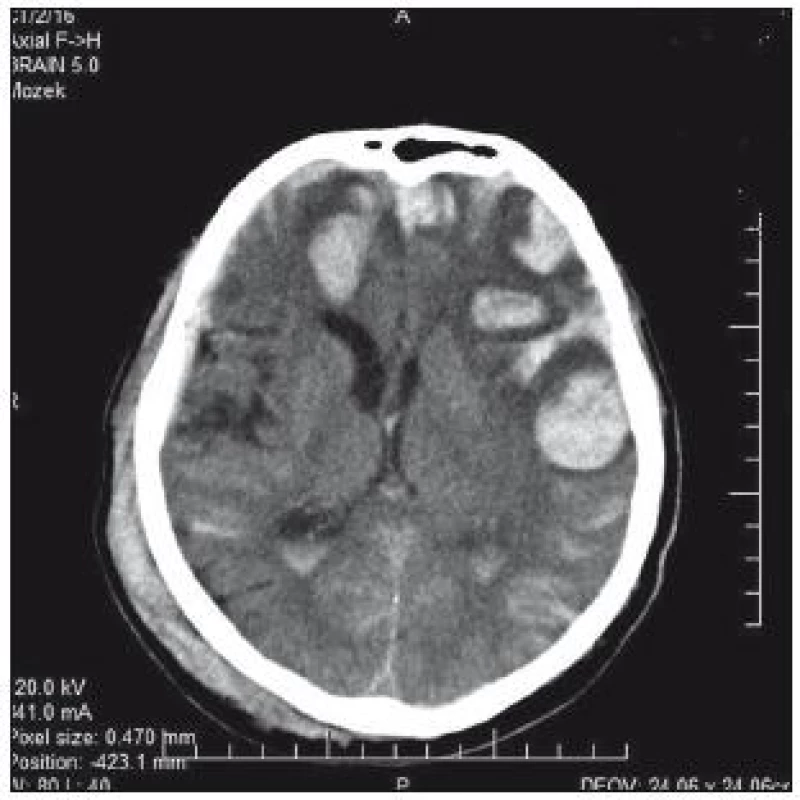
76letá pacientka byla přijata na interní oddělení nemocnice s levostrannou hemiplegií, lucidní, bazálně komunikující. V anamnéze měla operaci aortokoronárního bypassu v roce 2005, chronickou fibrilaci síní a antikoagulační léčbu. Na CT mozku se prokázalo typické hypertonické krvácení v kapsule a bazálních gangliích 5 × 3 cm (obr. 1). Operační evakuace nebyla indikována. INR hodnota byla 1,85, Quick 45 %. Substituce k úpravě hemokoagulačních parametrů provedena nebyla. Během 4 hod došlo k deterioraci stavu – hluboké kóma, bilaterální mydriáza zornic. Kontrolní CT prokazuje progresi hematomu, nyní velikosti 9 × 6 × 5 cm, s intraventrikulární extenzí a přesunem středočárových struktur o 25 mm doleva; edém kmene (obr. 2). Za další hodinu pacientka umírá.
Kazuistika 2
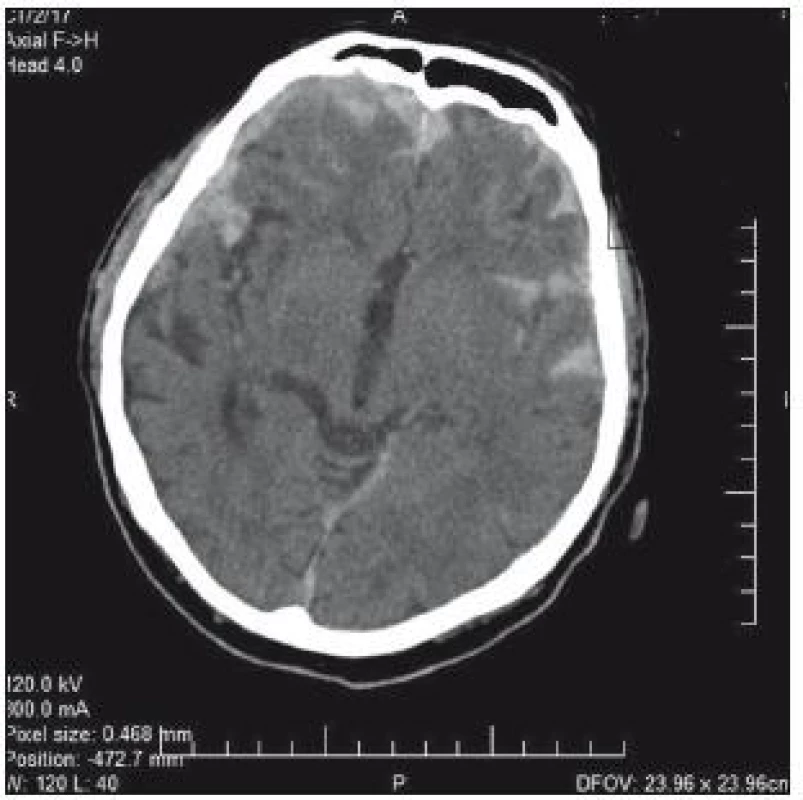
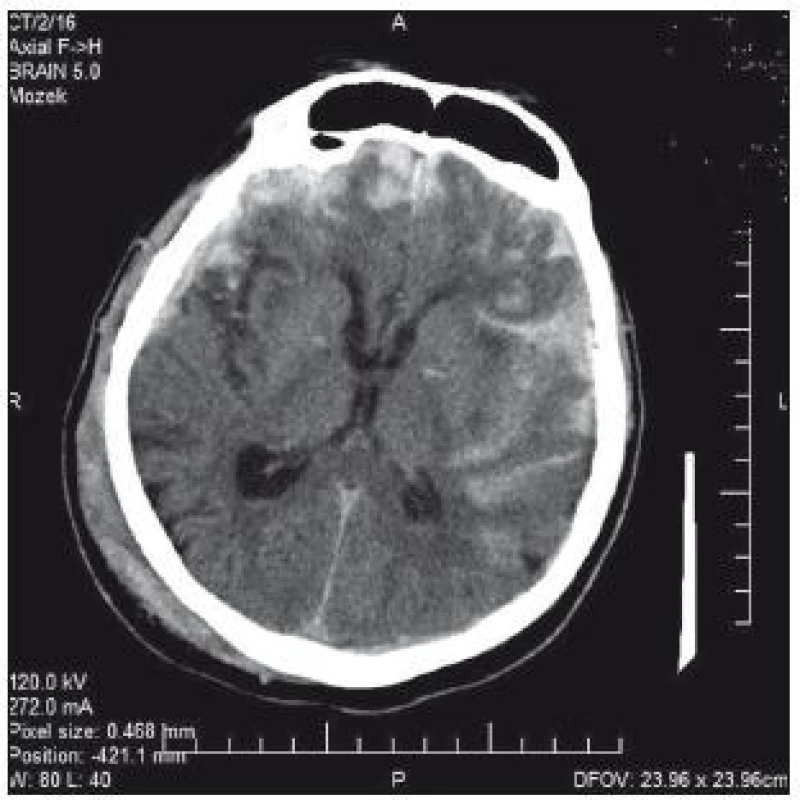
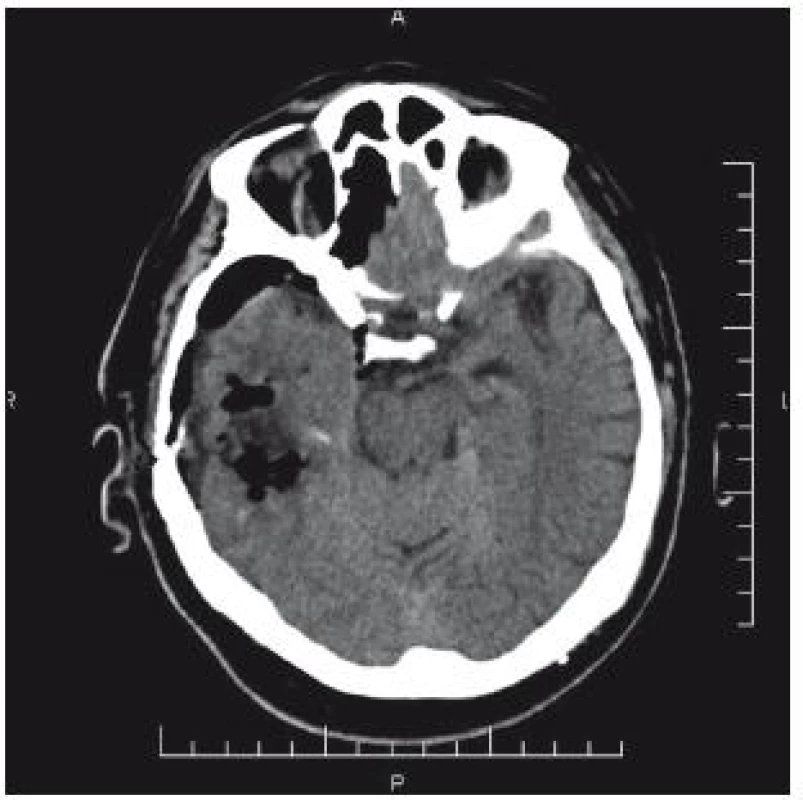
74letý pacient byl po pádu a úderu do hlavy přijat na chirurgické oddělení okresní nemocnice. V klinickém obrazu byla cílená flexe na bolest, nesrozumitelné zvuky až jednotlivá slova, zavřené oči; GCS 8–9. CT prokazuje nález diskrétního plášťového akutního subdurálního hematomu frontotemporálně vpravo, traumatického subarachnoidálního krvácení a fisury kalvy (obr. 3). V anamnéze je patrná polymorbidita: ICHS, chronická fibrilace síní, chronická bronchitida, hypertenze a diabetes II. typu na inzulinu. Dlouhodobě je pacient warfarinizován – iniciální INR 2,57; Quick 31 %. Na základě klinického nálezu a CT byl pacient přeložen k observaci na traumatologii. Indikace k urgentní operaci nebyla. Byla zahájena substituce hemokoagulačních faktorů mraženou plazmou v kombinaci s kanavitem. Na kontrolním CT v odstupu 3 hod je zřejmý nárůst kontuzí frontobazálně vpravo a subarachnoidálního krvácení vlevo temporálně (obr. 4). Klinický stav se nemění. V odstupu dalších 4 hod na kontrolním CT (obr. 3) je nepatrná progrese kontuzí. Ani toto CT není indikací k intervenci. V tomto čase je INR 1,70 a Quick 49 %. V odstupu 20 hod od úrazu je již na CT rozsáhlá progrese kontuzních ložisek (obr. 5). INR je po 24 hod podávání kanavitu v kombinaci s mraženou plazmou (celkem 10 jednotek) 1,37; Quick 65%! V této chvíli již dochází k progresi klinického stavu a nutnosti následné intubace. Před ní je GCS 3. Pacient je následně přeložen na ARO spádové nemocnice a tam umírá druhý den po přijetí.
Kazuistika 3
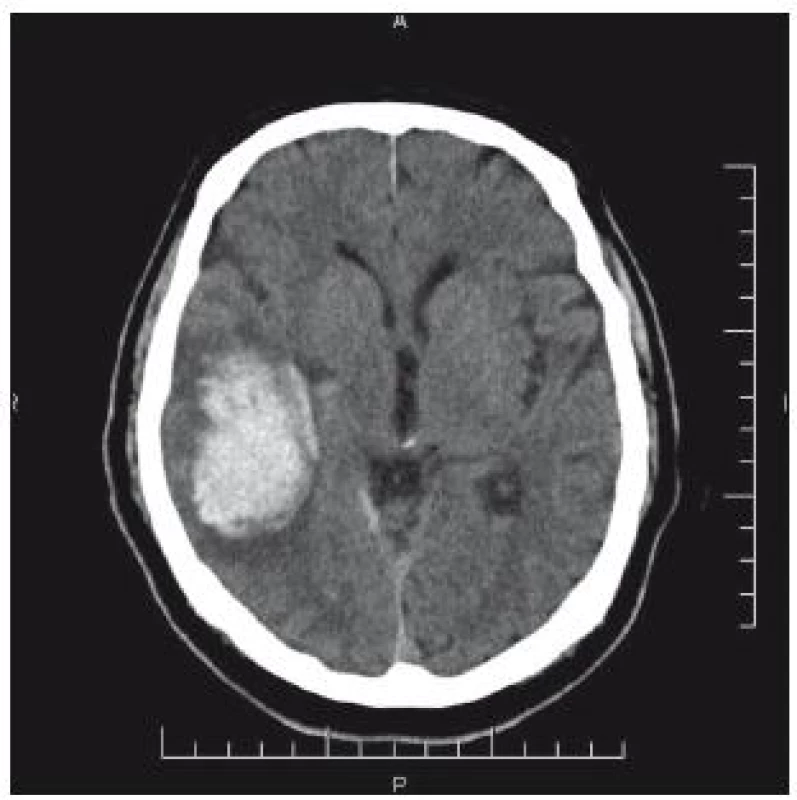
66letý pacient byl přijat na interní oddělení okresní nemocnice pro bolesti hlavy. V anamnéze byl prokázán pád s úderem do hlavy, s přechodnou diplopií a tinitem dva dny před přijetím. CT nález: intracerebrální hematom temporálně vpravo 7 × 5 cm. Přetlak středových struktur zcela diskrétní (obr. 6). Vzhledem k anamnéze je hematom nepochybně traumatické etiologie. Pacient je lucidní, kontakt dobrý bez neurologického deficitu. Osobní anamnéza: stav po nefrektomii vpravo pro tumor, diabetes mellitus na PAD, hypertenze, chronická fibrilace síní – warfarinizace! (Quick 42 %). Během hodin dochází k zhoršení kvality vědomí, zmatenosti, GCS 13. Vzhledem k triádě progrese kliniky, CT nálezu hematomu a antikoagulaci je domluven překlad na ARO Nemocnice České Budějovice. Před transportem byl podán koncentrát protrombinového komplexu. Na transport byl pacient intubován. Akutní operace proběhla za úpravy hemokoagulačních parametrů: evakuace hematomu z kraniotomie. Kontrolní CT bylo příznivé (obr. 7). Pacient byl po extubaci bez neurologického deficitu přeložen do spádového zařízení.
Diskuze
Warfarin je dobrý sluha, ale zlý pán. Původně prostředek na hubení hlodavců působí jako antagonista vitaminu K, nezbytného při tvorbě faktorů protrombinového komplexu (faktory II, VII, IX a X). Má postupný nástup účinku během několika dní. Jeho nevýhodou je úzké terapeutické rozpětí, nutnost monitorování účinku a potřeba spolupráce pacienta [2]. Účinek preparátu snižují barbituráty a některé potraviny (brokolice, papája). Předávkování může naopak nastat při kombinovaném podávání s nesteroidními antiflogistiky a na podkladě genetických faktorů – polymorfizmu cytochromu P 450 [15]. Terapeutická hladina je 2–3 INR. V tomto rozmezí je riziko závažného krvácení a intrakraniálního krvácení (ICH) relativně nízké – 0,5 % za rok, resp. 0,2 % u ICH [1]. Se zvyšujícím se INR dochází k závažnému zvýšení rizika krvácení. Uvádí se, že nárůst o každý stupeň škály INR zvyšuje dvojnásobně riziko krvácení proti předchozí hodnotě [7,16,17]. Riziko krvácení se liší s délkou podávání warfarinu. Nejvyšší je v prvním měsíci aplikace, kdy dosahuje 3 %. Zbytek prvního roku se snižuje na 0,8 % a následný rok pouhá 0,3 % [2]. Rizikové faktory intrakraniálního krvácení při antikoagulaci jsou: vyšší věk, opakované pády, nekorigovaná hypertenze, cévní mozková příhoda v anamnéze, intenzita antikoagulační léčby a kombinace s antiagregační terapií. Terapeutické podávání antikoagulace u žilní trombózy je obvykle 3–6 měsíců. Bohužel je běžnou praxí, že pacienti po prodělané žilní trombóze/plicní embolii jsou na antikoagulační léčbě mnohdy zbytečně roky. Dlouhodobá neodůvodněná antikoagulační léčba přináší zvýšené riziko vzniku život ohrožujícího krvácení. Nelze dostatečně zdůraznit úlohu praktického lékaře při správném sledování léčby a adekvátně načasovaném vysazení warfarinu. Chronická fibrilace/flutter síní se vyskytuje zejména u starších pacientů. Postihuje 4 % lidí nad 65 let [18]. Více než polovina pacientů s chronickou fibrilací/flutterem síní a antikoagulační léčbou je starší 75 let. Riziko ischemického iktu u pacientů s chronickou fibrilací síní není malé. Činí 5 % za rok při negativní anamnéze iktu. V případě pozitivní historie ischemické cévní mozkové příhody stoupá riziko až na 12 % [18,19]. Antikoagulace snižuje relativní riziko iktu o 68 % [20]. U 1 000 pacientů zabrání warfarin průměrně vzniku 23 ischemických iktů, na druhou stranu nastane 9 závažných krvácení [21].
Spontánní intracerebrální hematomy představují 10–15 % iktů s 30denní mortalitou 35–52 %. Rizikovými faktory vzniku hematomu u warfarinizovaných pacientů jsou vyšší věk, hypertenze a intenzita antikoagulace [10]. Výskyt spontánních intrakraniálních hematomů při antikoagulační léčbě je vzácný. Pokud ale krvácení nastane, pak je morbidita/mortalita extrémně vysoká. Fang et al uvádějí úmrtí nebo těžké poškození v 76 %, zatímco extrakraniální velké krvácení bylo zatíženo špatným výsledkem pouze ve 3% případů [9]. Hematomy u pacientů bez antikoagulace mají tendenci k rychlé expanzi objemu během 4 hod, u pacientů na warfarinu je tento proces prodloužen na 24–48 hod [22]. Flibotte uvádí nárůst objemu hematomu do týdne od počátku příhody u 54 % pacientů na warfarinu, zatímco u ostatních pouze v 16 % [23]. Tato pozorování jsou argumentem pro co nejrychlejší substituci.
Intrakraniální úrazové hematomy u warfarinizovaných jsou též zatíženy vysokou mortalitou. Mina et al udávají 4–5násobné riziko proti pacientům bez antikoagulace [6]. Významně stoupá mortalita u starých lidí [8,17,24,25]. Maligní je zejména kombinace vyššího věku s excesivní antikoagulací. Karni et al uvádějí u pacientů starších 65 let s INR nad 3,5 mortalitu 75 % [7]. Ivascu et al kladou důraz na rychlou identifikaci hematomů s okamžitou substitucí. Udávají významné snížení mortality ze 48 na 10 %. V terapeutickém protokolu použili mraženou plazmu v kombinaci s kanavitem [13]. Makris et al jako první upozornili na výhodnost užití koncentrátu protrombinového komplexu v kontrastu s mraženou plazmou [26]. Kalina et al srovnali efektivitu léčby protrombinového komplexu a mražené plazmy. Čas od podání do operace, čas do úpravy INR a procentuální úspěšnost úpravy vyzněla pro koncentrát. Mortalita byla v obou skupinách srovnatelná [12]. Problematika zvětšení hematomu v delším časovém intervalu s následnou deteriorací je známa [13]. Yasaka et al prokázali, že včasné podání koncentrátu protrombinového komplexu omezí nárůst hematomu ve srovnání s plazmou [14]. Nevýhodou při podání plazmy je nutnost aplikace poměrně velkých objemů (15–20 ml/kg ), což může vyústit v srdeční selhání. Navíc jsou tyto objemy podány v delším časovém intervalu a to může vést k výše zmíněnému zvětšení hematomu. Podávání plazmy s kanavitem upravuje INR o 0,18/hod [27]. To koresponduje s naší zkušeností z kazuistiky 2. Další nevýhodou je nepředvídatelná a nedefinovaná hladina koagulačních faktorů. Obsah faktoru IX je nízký a hemostáza tudíž inkompletní.
Koncentrát protrombinového komplexu je aplikován v dávce 25–50 j/kg v kombinaci s kanavitem 5–10 mg intravenózně.
Výhoda je podávání malých, přesně definovaných objemů s rychlým nástupem účinku a je v současných doporučeních upřednostněno [1,3,4,10,11].
Zkušenost s rekombinantním faktoremVIIa (NovoSeven) je zatím omezená [28,29]. Sami zkušenost s NovoSeven nemáme. Steinová et al na souboru 68 pacientů prokazují jak lepší terapeutický efekt, tak ekonomickou výhodnost podání FVIIa ve srovnání s mraženou plazmou [30]. Ekonomické závěry jsou z důvodů jiných vstupních podmínek v místě vzniku pochopitelně nepřenosné do našeho prostředí. Podávání potentních preparátů, jakými jsou rFVIIa a koncentrát protrombinového komplexu, je spojeno s rizikem trombogenicity [31]. V případě vyššího rizika trombózy je proto podání doplněno aplikací nízkomolekulárního heparinu. Standardním operačním postupem je při intrakraniálních hematomech u warfarinizovaných pacientů evakuace hematomu z kraniotomie. U akutních subdurálních hematomů bez přítomnosti kontuze nebo u akutního zakrvácení do chronického subdurálního hematomu je alternativou evakuace z trepanopunkce. To platí zejména při akutní deterioraci stavu vědomí. Paralelní substituce je samozřejmostí.
Naše doporučení pro pacienty na antikoagulační terapii s prokázaným intrakraniálním hematomem spontánním nebo úrazovým:
- Spontánní i úrazové hematomy na CT (byť minimální velikosti) jsou indikací pro substituci koncentrátem protrombinového komplexu v dávce 25–50 jednotek/kg společně s kanavitem v dávce 5–10mg intravenózně (výše dávky se řídí iniciálním INR).
- Pacienti s prokázaným intrakraniálním hematomem jsou indikování k překladu do centra s 24hodinovou dostupností okamžité neurochirurgické operace. Je‑li pacient v jiné nemocnici, pak je koncentrát podán před transportem do centra. Překlad je při pozitivním nálezu na CT uskutečněn vždy (i kdyby iniciální GCS bylo 15 bodů).
- Neurochirurgická intervence navazuje, pokud se hematom chová expanzivně za kontroly parametrů koagulace. Standardním výkonem je evakuace hematomu z kraniotomie. Při akutní deterioraci vědomí je u subdurálního hematomu alternativou evakuace z trepanopunkce.
- V případě rozsáhlého krvácení u pacientů v hlubokém kómatu postupujeme s přihlédnutím k dalším faktorům (věk) individuálně. Kontraindikace substituce a operačního zákroku musí být jasně zdůvodněna.
Závěr
Intrakraniální hematomy traumatické i spontánního původu u warfarinizovaných pacientů představují život ohrožující situaci. S ohledem na věkovou skladbu antikoagulovaných pacientů postihují obvykle starší pacienty. Prognóza bývá zlá. Časná úprava hemokoagulačních parametrů koncentrátem protrombinového komplexu umožní stabilizaci hematomu a v případě potřeby neodkladnou chirurgickou intervenci. To je předpokladem zlepšení výsledků léčby intrakraniálních hematomů u antikoagulovaných pacientů.
MUDr. V. Přibáň, Ph.D.
Neurochirurgické oddělení
Nemocnice České Budějovice, a.s.
B. Němcové 54
370 87 České Budějovice
e-mail: v.priban@centrum.cz
Přijato k recenzi: 1. 7. 2009
Přijato do tisku: 24. 8. 2009
Zdroje
1. Hirsh J, Fuster V, Ansell J, Halperin JL. American Heart Association/ American College of Cardiology Foundation Guide to Warfarin Therapy. Circulation 2003; 107(12): 1692 – 1711.
2. Schulman S, Beyth RJ, Kearon C, Levine MN. Hemorrhagic Complications of Anticoagulant and Thrombolytic Treatment. American College of Chest Physicians Evidence - Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133 (Suppl 6): 257S – 298S.
3. Baglin TP, Keeling DM, Watson HG. Guidelines on oral anticoagulation (warfarin): third edition – 2005 update. Br J Haematol 2006; 132(3): 277 – 285.
4. Gumulec J, Kessler P, Penka M, Klodová D, Králová S,Brejcha M et al. Z. Krvácivé komplikace při léčbě warfarinem 2005 [online]. Dostupné z: http:/ / www.thrombosis.cz/ sources/ Guidelines_warfarin_krvaceni_STH_XI05.pdf.
5. Wintzen AR, de Jonge H, Loeliger EA, Bots GT. The risk of intracerebral hemorrhage during oral anticoagulant treatment: a population study. Ann Neurol 1984; 16(5): 553 – 558.
6. Mina AA, Bair HA, Howells GA, Bendick PJ. Complications of preinjury warfarin use in the trauma patient. J Trauma 2003; 54(5): 842 – 847.
7. Karni A, Holtzman R, Bass T, Zorman G, Carter L, Rodriquez L. Traumatic head injury in the anticoagulated elderly patient: a lethal combination. Am Surg 2001; 67(11): 1098 – 1100.
8. Grandhi R, Duane TM, Dechert T, Malhotra AK, Aboutanos MB, Wolffe LG et al. Anticoagulation and the elderly head trauma patient. Am Surg 2008; 74(9): 802 – 805.
9. Fang MC, Go AS, Chang Y, Hylek EM, Henault LE, Jensvold NE et al. Death and disability from warfarin‑associated intracranial and extracranial hemorrhages. Am J Med 2007; 120(8): 700 – 705.
10. Broderick J, Connolly S, Feldmann E, Hanley D, Kase C, Krieger D et al. Guidelines for the management of spontaneous intracerebral hemorrhage in adults: 2007 update. a guideline from the American Heart Association/ American Stroke Association Stroke Council, High Blood Pressure Research Council, and the Quality of Care and Outcomes in Research Interdisciplinary Working Group. Stroke 2007; 38(6): 2001 – 2023.
11. Baker RI, Coughlin PB, Gallus AS, Harper PL, Salem HH, Wood EM. Warfarin Reversal Consensus Group. Warfarin reversal: consensus guidelines, on behalf of the Australasian Society of Thrombosis and Haemostasis. Med J Aust 2004; 181(9): 492 – 497.
12. Kalina M, Tinkoff G, Gbadebo A, Veneri P, Fulda G.A protocol for the rapid normalization of INR in trauma patients with intracranial hemorrhage on prescribed warfarin therapy. Am Surg 2008; 74(9): 858 – 861.
13. Ivascu FA, Howells GA, Junn FS, Bair HA, Bendick PJ, Janczyk RJ. Rapid warfarin reversal in anticoagulated patients with traumatic intracranial hemorrhage reduces hemorrhage progression and mortality. J Trauma 2005; 59(5): 1131 – 1139.
14.Yasaka M, Minematsu K, Naritomi H, Sakata T, Yamaguchi T. Predisposing factors for enlargement of intracerebral hemorrhage in patients treated with warfarin. Thromb Haemost 2003; 89(2): 278 – 283.
15. Aithal GP, Day CP, Kesteven PJ, Daly AK. Association of polymorphisms in the cytochrome P450 CYP2C9 with warfarin dose requirement and risk of bleeding complications. Lancet 1999; 353(9154): 717 – 719.
16. Hylek EM, Singer DE. Risk factors for intracranial hemorrhage in outpatients taking warfarin. Ann Intern Med 1994; 120(11): 897 – 902.
17. Pieracci FM, Eachempati SR, Shou J, Hydo LJ, Barie PS. Degree of anticoagulation, but not warfarin use itself, predicts adverse outcomes after traumatic brain injury in elderly trauma patients. J Trauma 2007; 63(3): 525 – 530.
18. Go AS, Hylek EM, Phillips KA, Chang Y, Henault LE, Selby JV et al. Prevalence of diagnosed atrial fibrillation in adults: National implications for rhythm management and stroke prevention: The AnTicoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study. JAMA 2001; 285(18): 2370 – 235.
19. Secondary prevention in non‑rheumatic atrial fibrillation after transitransient ischaemic attack or minor stroke. EAFT (European Atrial Fibrillation Trial) Study Group. Lancet 1993; 342(8882): 1255 – 1262.
20. Hart RG, Benavente O, McBride R, Pearce LA. Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: A meta‑analysis. Ann Intern Med 1999; 131(7): 492 – 501.
21. van Walraven C, Hart RG, Singer DE, Laupacis A, Connolly S, Petersen P et al. Oral anticoagulants vs aspirin in nonvalvular atrial fibrillation: an individual patient meta‑analysis. JAMA 2002; 288(19): 2441 – 2448.
22. Steiner T, Rosand J, Diringer M. Intracerebral hemorrhage associated with oral anticoagulant therapy: current practices and unresolved questions. Stroke 2006; 37(1): 256 – 262.
23. Flibotte JJ, Hagan N, O’Donnell J, Greenberg SM, Rosand J. Warfarin, hematoma expansion and outcome of intracerebral hemorrhage. Neurology 2004; 63(6): 1059 – 1064.
24. Lavoie A, Ratte S, Clas D, Demers J, Moore L, Martin M et al. Preinjury warfarin use among elderly patients with closed head injuries in a trauma center. J Trauma 2004; 56(4): 802 – 807.
25. Franko J, Kish KJ, O’Connell BG, Subramanian S, Yuschak JV. Advanced age and preinjury warfarin anticoagulation increase the risk of mortality after head trauma. J Trauma 2006; 61(1): 107 – 110.
26. Makris M, Greaves M, Phillips WS, Kitchen S, Rosendaal FR, Preston EF. Emergency oral anticoagulation reversal: The relative efficacy of infusions of fresh frozen plasma and clotting factor concentrate on correction of the coagulopathy. Thromb Haemost 1997; 77(3): 477 – 480.
27. Boulis N, Bobek M, Schmaier A, Hoff JT. Use of factor IX complex in warfarin related intracranial hemorrhage. Neurosurgery 1999; 45(5): 1113 – 1119.
28. Lin J, Hanigan WC, Tarantino M, Wang J. The use of recombinant activated factor VII to reverse warfarin‑induced anticoagulation in patients with hemorrhages in the central nervous system: preliminary findings. J Neurosurg 2003; 98(4): 737 – 740.
29. Brody DL, Aiyagari V, Shackleford AM, Diringer MN. Use of recombinant factor VIIa in patients with warfarin‑associated intracranial hemorrhage. Neurocrit Care 2005; 2(3): 263 – 267.
30. Stein DM, Dutton RP, Kramer ME, Scalea TM. Reversal of coagulopathy in critically ill patients with traumatic brain injury: recombinant factor VIIa is more cost‑effective than plasma. J Trauma 2009; 66(1): 63 – 75.
31. Lankiewicz MW, Hays J, Friedman KD, Tinkoff G, Blatt PM. Urgent reversal of warfarin with prothrombin complex concentrate. J Thromb Haemost 2006; 4(5): 967 – 970.
Štítky
Dětská neurologie Neurochirurgie NeurologieČlánek vyšel v časopise
Česká a slovenská neurologie a neurochirurgie

2009 Číslo 6
Nejčtenější v tomto čísle
- Varianty katatonie
- Rettův syndrom
- Neuropatie nervus mentalis jako manifestace systémové malignity
- Syndróm karpálneho tunela
