Přehled difuzních gliomů dle WHO klasifikace 2021 1. část – difuzní gliomy dospělého typu
Authors:
M. Hendrych 1; M. Barák 2; H. Valeková 2; T. Kazda 3; P. Pospíšil 3
; R. Lakomý 4; J. Šána 4,5; R. Jančálek 2; M. Hermanová 1
Authors‘ workplace:
I. ústav patologie, LF MU a FN u sv. Anny v Brně
1; Neurochirurgická klinika LF MU a FN U sv. Anny v Brně
2; Klinika radiační onkologie LF MU a Masarykův onkologický ústav, Brno
3; Klinika komplexní onkologické péče LF MU a Masarykův onkologický ústav, Brno
4; CEITECH – Středoevropský technologický institut, MU, Brno
5
Published in:
Cesk Slov Neurol N 2023; 86(6): 359-368
Category:
Review Article
doi:
https://doi.org/10.48095/cccsnn2023359
Overview
Recentní poznatky na poli molekulárně genetických změn difuzních gliomů u dospělých a dětských pacientů iniciovaly významné změny v jejich klasifikaci a diagnostice. Tyto změny předkládá 5. edice klasifikace WHO nádorů centrálního nervového systému zdůrazňující odsun od tradiční kategorizace tumorů na podkladu morfologie k integrované diagnostice inkorporující charakteristické molekulárně-genetické a epigenetické změny s tradičními morfologickými znaky. Tato první část přehledové práce předkládá souhrn jednotek, které jsou zařazeny do skupiny difuzních gliomů dospělého typu, s důrazem na diagnostická kritéria a grading dle 5. edice klasifikace WHO nádorů centrálního nervového systému z roku 2021.
Klíčová slova:
astrocytom – glioblastom – oligodendrogliom – difuzní gliom – WHO CNS 2021 – integrovaná diagnostika
Úvod
Gliomy představují vysoce heterogenní skupinu nejčastěji se vyskytujících primárních nádorů mozku dospělých i dětí [1]. Jejich aktuální klasifikace dle 5. edice klasifikace WHO nádorů centrálního nervového systému z roku 2021 [2,3] inkorporuje pravidla integrované diagnostiky zavedené již v předchozí přepracované 4. edici klasifikace WHO nádorů centrálního nervového systému z roku 2016 (shrnuto v přehledové práci [4]) a doplněné o nejnovější poznatky vydávané formou doporučení Consortium to Inform Molecular and Practical Approaches to CNS Tumor Taxonomy (cIMPACT-NOW) [5–10].
Tradiční dělení gliomů na difuzní a ohraničené je nově rozšířeno o rozdělení difuzních gliomů do dvou skupin – na gliomy dětského a dospělého typu. Dětský typ difuzních gliomů je dále rozdělen na nádory nízkého stupně (low-grade) a vysokého stupně malignity (high-grade) (tab. 1). Toto nové rozdělení difuzních gliomů na dospělý a dětský typ je podmíněno jejich výrazně odlišným biologickým chováním i molekulárně genetickými alteracemi, přestože morfologicky jsou mnohdy prakticky nerozlišitelné. Současně rozdělení na dospělý a dětský typ difuzních gliomů odpovídá dominantnímu výskytu nádorových jednotek, nevylučuje však výskyt dětského typu difuzního gliomu u dospělých pacientů, nebo naopak vzácné zachycení dospělého typu difuzního gliomu u dětských pacientů [2]. První část této přehledové práce bude věnována difuzním gliomům dospělého typu, zatímco druhá část se bude zabývat high-grade a low-grade difuzními gliomy dětského typu.
Nutno konstatovat, že diagnostika a klasifikace gliomů v současnosti dalece předbíhá terapeutické možnosti. Aktualizace léčebných doporučení se dlouho týkaly spíše pouze různých modifikací známé pooperační radioterapie a chemoterapie [11] (především alkylačním cytostatikem temozolomidem). Teprve v poslední době se objevují studie poukazující na možný efekt dalších léčebných postupů, jako je terapie pomocí tumor treating fields u glioblastomů [12] nebo pomocí vorasidenibu u IDH-mutovaných low-grade gliomů [13].

Typy růstu gliomu
Odlišení typu růstu gliálně diferencované neoplazie je iniciálním a zároveň esenciálním krokem diagnostiky. Pro difuzně rostoucí gliomy je charakteristický neohraničený infiltrativní růst tkání CNS predominantně preformovanými prostory okolo cév, pod pia mater či okolo/podél axonů bílých mozkových drah. Charakteristickými morfologickými známkami difuzního růstu je postupný pokles denzity nádorových buněk od centra do periferie tumoru, kde jsou patrné tzv. sekundární znaky difuzně rostoucího gliomu – perineuronální satelitóza a perivaskulární či subpiální šíření. Imunohistochemicky (IHC) lze difuzní růst vizualizovat vyšetřením neurofilament zobrazujících fragmentované reziduální axony perzistující v difuzně rostoucí nádorové mase gliomu (obr. 1A). Ohraničené gliomy naopak rostou expanzivně a okolní tkáň CNS spíše odtlačují, což lze verifikovat IHC vyšetřením neurofilament (obr. 1B) [4]. Následný diagnostický proces zahrnuje sekvenci molekulárně genetických vyšetření, která jsou spolu s morfologií nutná pro správnou klasifikaci tumoru dle integrované diagnostiky. Diagnostický postup je zjednodušeně shrnut v obr. 2.
![Zjednodušený diagnostický algoritmus upravený dle doporučení EANO 2021 [14]. </br> Fig. 2. Simplifi ed diagnostic algorithm adapted based on the EANO guidelines 2021 [14].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/ff64484022f5f862c3fe1040adaf5121.png)



Dospělý typ difuzních gliomů
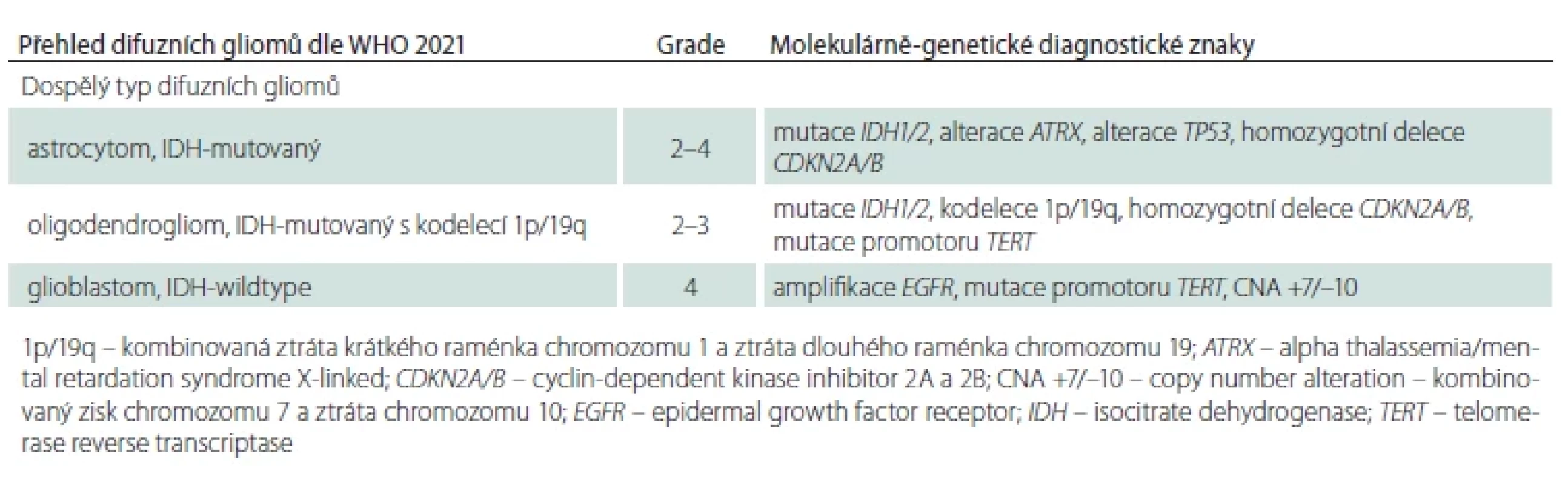
Astrocytom IDH-mutovaný (WHO G2–4)
Astrocytomy jsou difuzně rostoucí gliomy geneticky definované mutací v genu IDH1/2 současnou IHC průkaznou ztrátou exprese ATRX a/nebo mutací genu TP53 při absenci kodelece 1p/19q (tab. 2). Astrocytomy mohou být lokalizované v rozsahu celé kraniospinální osy, typicky se ale vyskytují supratentoriálně, především v oblasti frontálních a temporálních laloků. Nejvyšší incidence astrocytomu je mezi 30.–34. rokem věku [14].
Morfologicky jsou astrocytomy typicky tvořené difuzně rostoucími atypickými fibrilárními astrocyty či méně četně gemistocytárními elementy (obr. 3). Geneticky definovaný astrocytom nicméně zahrnuje i nádory s oligoastrocytární či čistě oligodendrogliální diferenciací [3,4]. Pouze vzácně byly popsány případy kompozitních IDH-mutovaných difuzních gliomů s duálním oligoastrocytárním genotypem – ztrátou exprese ATRX, mutací TP53, bez kodelece 1p/19q v astrocytární komponentně a kodelecí 1p/19q bez alterací v genech ATRX i TP53 v oligodendrogliální komponentě [15]. Status ATRX a TP53 musí být vyšetřen, pokud nebylo provedeno vyšetření kodelece 1p/19q (obr. 4). Inaktivační mutaci ATRX má však pouze 70–80 % astrocytomů, tedy absence ztráty exprese ATRX při IHC vyšetření tuto diagnózu nevylučuje. Ztráta ATRX však není pro astrocytom specifická a vyskytuje se také u všech difuzních hemisferických gliomů, H3 G34-mutovaných, části difuzních středočarových gliomů, H3 K27-alterovaných a je nesčetněkrát popsána i u glioblastomu IDH-wildtype (GBM) [16].
Astrocytom může být klasifikován jako grade 2, 3 nebo 4 dle diagnostických kritérií shrnutých v tab. 3 [7]. Prognostický význam stratifikace grade 2 a 3 astrocytomů dle mitotické aktivity je některými pracemi negován [3,7,17], nicméně jeho význam byl u IDH-mutovaných astrocytomů bez homozygotní kodelece CDKN2A/B, mimo jiné, podpořen v recentní studii Kros et al. [18]. V této studii byl mitotický index (s hranicí dvě mitózy na 10 zorných polí velkého zvětšení) u astrocytomů bez homozygotní kodelece CDKN2A/B identifikován jako nezávislý prognostický faktor pro přežití bez progrese onemocnění a je relevantní pro odlišení grade 2 (s méně než dvěma mitózami) a grade 3 astrocytomů (s dvěma a více mitózami) [18]. Nově je v rámci gradingu implementováno i vyšetření homozygotní delece genů CDKN2A/B, které představují nezávislý prediktor špatné prognózy [19,20], a dle recentních doporučení by mělo být jejich vyšetření rutinně provedeno u IDH-mutovaných astrocytomů [16]. Homozygotní delece CDKN2A/B se u primárních, terapeuticky neovlivněných IDH-mutovaných gliomů vyskytuje relativně vzácně. Dostupná literární data uvádějí u primárních IDH-mutovaných astrocytomů četnost homozygotní delece pro morfologicky definovaný grade 2 u 1,8–3,5 %, grade 3 u 3,2–6,7 % a grade 4 u 18,8–27 % [19,21]. Daleko častěji je zjištěna v recidivujících tumorech po předchozí radioterapii, což vysvětluje nutnost opakovaného testování homozygotní delece CDKN2A/B i v recidivujících IDH-mutovaných gliomech, kde je k dispozici materiál po eventuální reoperaci [19,22]. Po ozáření získaná homozygotní delece CDKN2A/B zároveň představuje potenciální biomarker predikující rezistenci k radioterapii u recidivujících IDH-mutovaných gliomů [22]. Naopak u IDH-wildtype gliomů se delece CDKN2A/B vyskytuje často i u nově diagnostikovaných, terapeuticky dosud neovlivněných tumorů [22]. Recentně byl však také popsán případ astrocytomu a oligodendrogliomu s delecí CDKN2A/B, u kterých již delece CKDN2A/B nebyla v recidivě tumoru prokázána [23].


Oligodendrogliom IDH-mutovaný s kodelecí 1p/19q (WHO G2–3)
Oligodendrogliomy jsou geneticky definovány mutací v genu IDH1/2 a současnou kompletní kodelecí 1p/19q (tab. 4). Charakteristická je supratentoriální lokalizace, přičemž až polovina případů postihuje frontální laloky. Pouze vzácně se oligodendrogliom vyskytuje infratentoriálně. Obdobně jako všechny difuzní gliomy dospělého typu i oligodendrogliom může infiltrovat více mozkových laloků, a to i oboustranně (dříve označováno jako gliomatosis cerebri), či se leptomeningeálně šířit [3,14]. V porovnání s astrocytomy se oligodendrogliomy spíše vyskytují u starších pacientů, přičemž nejvyšší incidence je u pacientů ve věku mezi 40.–44. rokem [14]. Geneticky se od astrocytomů také odlišují přítomností mutace promotoru TERT, která se vyskytuje u většiny oligodendrogliomů a její testování lze využít pro podpoření diagnózy oligodendrogliomu [16].
Charakteristický histologický obraz zahrnuje difuzně rostoucí nádorové gliální buňky oligodendrogliální diferenciace s drobnými kulatými jádry a perinukleárním projasněním (připomínající volské oko) v síti bohatě se větvících kapilár (obr. 5). V rámci tumoru jsou často zastiženy i kalcifikace. Nicméně morfologické spektrum geneticky definovaného oligodendrogliomu zahrnuje i nádory s oligoastrocytární či čistě astrocytární diferenciací [3,4].
Grading oligodendrogliomů, obdobně jako u astrocytomu, kombinuje histologické znaky – signifikantní mitotickou aktivitu, přítomnost nekróz a vaskulárních proliferátů – a genetickou alteraci – homozygotní deleci CDKN2A/B (tab. 5) [3]. Obdobně jako u astrocytomu je i u oligodendrogliomu považována přítomnost homozygotní delece CDKN2A/B za marker špatné prognózy. Prognóza pacientů s G3 oligodendrogliomem klasifikovaným na podkladě průkazu homozygotní delece CDKN2A/B je celkově horší než u pacientů s G3 oligodendrogliomem klasifikovaným pouze na podkladě histologických znaků bez průkazné homozygotní delece CDKN2A/B, nicméně tato alterace se vyskytuje u méně než 10 % případů [20]. Medián celkového přežití G2 oligodendrogliomu je 16,6 roku, což je nejvíc ze všech difuzních gliomů dospělého typu [1].



Glioblastom IDH-wildtype (WHO G4)
Glioblastom (GBM) představuje nejčastější primární nádor CNS dospělých, tvoří necelých 60 % všech gliomů. Charakteristická je supratentoriální lokalizace, přičemž nejčastěji se vyskytuje v oblasti frontálních mozkových laloků. GBM je nádor pouze dospělého věku a nejvyšší incidence dosahuje ve věkové skupině 75–84 let [1]. Pro GBM je charakteristický rychlý infiltrativní růst v CNS podmiňující klinickou symptomatologii vyjádřenou často symptomy intrakraniální hypertenze. Naopak vzdálené metastázy GBM jsou klinicky diagnostikovány velmi vzácně a bývají častěji zjištěny až postmortálně [24,25]. Medián přežití pacientů se pohybuje okolo 16 měsíců, a to i přes komplexní chirurgickou a následnou onkologickou terapii [26,27].
Diagnostická kritéria GBM byla recentně rozšířena dle doporučení cIMPACT NOW update 3 a 6 o genetické znaky definující GBM i v případě absence klasických morfologických rysů, tj. nekróz a mikrovaskulárních proliferátů (obr. 6) [5,10]. Dle platných doporučení musí být tedy u všech histologicky G2/3 IDH-wildtype difuzních gliomů vyšetřeny genetické znaky GBM – mutace promotoru TERT, amplifikace EGFR, kombinovaný zisk chromozomu 7 a ztráta chromozomu 10 (tab. 6) [16]. Na základě shodné klinické prezentace, průběhu onemocnění i shodně špatné prognózy jsou nově difuzní gliomy IDH-wildtype s genetickými znaky GBM klasifikovány jako GBM [28,29].
Právě GBM definované genetickými alteracemi jsou dle autorů Zhang et al. [30] jednak nedostatečně vyšetřené nebo časně zastižené/vyvíjející se GBM. U první skupiny nedostatečně vyšetřených GBM je nezastižení klasických morfologických znaků dáno vyšetřením okraje nádoru, a to mimo oblasti s typickými nekrózami a vaskulárními proliferáty. Druhá skupina časně zastižených/vyvíjejících se GBM zahrnuje pacienty, u kterých byl nádor resekován ještě před jeho „vyzráním“ do charakteristického morfologického obrazu GBM jak na zobrazovacích vyšetřeních, tak mikroskopicky. V průběhu onemocnění však u těchto pacientů dochází k rozvoji recidiv s již vyjádřeným charakteristickým obrazem na zobrazovacích metodách i s typickým mikroskopickým nálezem. Klasifikace GBM na podkladě genetických znaků vedla v prospektivní studii Zhang et al. [30] k agresivnějšímu terapeutickému přístupu a signifikantnímu prodloužení přežívání pacientů (medián přežití 23,8 měsíce) v porovnání s retrospektivní kontrolní kohortou klasifikovanou dle CNS WHO 2016 jako WHO G2 nebo G3 tumory, u nichž medián přežití dosahoval pouze 16,2 měsíce.
Metylace promotoru MGMT by měla být, na rozdíl od IDH-mutovaných gliomů, testovaná u všech GBM. Monoterapie temozolomidem je efektivní pouze u pacientů s metylací promotoru MGMT [16]. Pacienti s GBM s metylací promotoru MGMT mají delší medián přežití (24 měsíců) v porovnání s pacienty bez metylace promotoru MGMT (14 měsíců) [31–33], jedná se tedy jak o významný prognostický, tak i prediktivní marker. V případě IDH-mutovaných gliomů rutinní testování není doporučováno. Některé práce uvádí, že až 98 % IDH-mutovaných gliomů má metylaci promotoru MGMT [16]. Nicméně retrospektivní analýza metylačního stavu MGMT u IDH-mutovaných gliomů z roku 2022 udává četnost metylace jen 62,3 %. Význam metylace MGMT pro IDH-mutované gliomy též není zcela jasný. Zmíněná práce uvádí, že přítomnost metylace promotoru MGMT je spojena s lepšími výsledky přežití pro IDH-mutované gliomy vyššího gradu [34].


Závěr integrované diagnostiky
Doporučení pro formulaci závěru bioptického vyšetření dle WHO CNS 5 a cIMPACT-NOW vychází z konsenzuálního doporučení Mezinárodní společnosti pro neuroonkologii z roku 2014 preferující strukturovanou formu, která obsahuje výslednou diagnózu dle integrované diagnostiky, histologickou diagnózu, grading a seznam provedených molekulárně genetických vyšetření vč. jejich interpretace a použité metody (tab. 7) [2,3,5,35].
V případě, že molekulárně genetická vyšetření není možné provést či jejich výsledek není interpretovatelný, je doporučeno tumor klasifikovat na základě morfologické diagnózy s přívlastkem NOS (not otherwise specified) – např. high-grade difuzní astrocytární gliom NOS. Naopak pokud ani komplexní molekulárně genetické vyšetření neumožnuje zařazení tumoru do definované jednotky dospělého nebo dětského typu difuzního gliomu dle WHO CNS 5, je daný tumor označen přívlastkem NEC (not elsewhere classified) – např. difuzní astrocytom IDH-wildtype, H3-wildtype, NEC [6].
Závěr
Diagnostika difuzních gliomů je konstantně se vyvíjející proces, který v současné době prochází významnými změnami podmíněnými rychlým rozvojem a adopcí nových metod umožňujícími studium molekulárně genetického i epigenetického pozadí nádorů [36]. Právě studium těchto změn vedlo k stratifikaci tumorů do skupin s homogennější prognózou či terapeutickou odpovědí a tyto poznatky jsou reflektovány i v klasifikaci gliomů dle WHO CNS 2021.
Grantová podpora
Tato práce byla podpořena Grantovou agenturou Masarykovy univerzity (MUNI/A/1379/2022) a Agenturou pro zdravotnický výzkum Ministerstva zdravotnictví (NU23-03-00100).
Prohlášení o konfliktu zájmů
Autoři deklarují, že v souvislosti s předmětem práce nemají žádný konflikt zájmů.
Sources
1. Ostrom QT, Price M, Neff C et al. CBTRUS statistical report: primary brain and other central nervous system tumors diagnosed in the United States in 2015–2019. Neuro Oncol 2022; 24 (Suppl 5): v1–v95. doi: 10.1093/neuonc/noac202.
2. Louis DN, Perry A, Wesseling P et al. The 2021 WHO classification of tumors of the central nervous system: a summary. Neuro Oncol 2021; 23 (8): 1231–1251. doi: 10.1093/neuonc/noab106.
3. WHO Classification of Tumours Editorial Board. Central nervous system tumours. Lyon: International Agency for Research on Cancer 2021.
4. Hendrych M, Valeková H, Kazda T et al. Integrated diag- nostics of diffuse gliomas. Klin Onkol 2020; 33 (4): 248–259. doi: 10.14735/amko2020248.
5. Louis DN, Wesseling P, Aldape K et al. cIMPACT-NOW update 6: new entity and diagnostic principle recommendations of the cIMPACT-Utrecht meeting on future CNS tumor classification and grading. Brain Pathol 2020; 30 (4): 844–856. doi: 10.1111/bpa.12832.
6. Louis DN, Wesseling P, Paulus W et al. cIMPACT-NOW update 1: not otherwise specified (NOS) and not elsewhere classified (NEC). Acta Neuropathol 2018; 135 (3): 481–484. doi: 10.1007/s00401-018-1808-0.
7. Brat DJ, Aldape K, Colman H et al. cIMPACT-NOW update 5: recommended grading criteria and terminologies for IDH-mutant astrocytomas. Acta Neuropathol 2020; 139 (3): 603–608. doi: 10.1007/s00401-020-02127-9.
8. Ellison DW, Hawkins C, Jones DTW et al. cIMPACT-NOW update 4: diffuse gliomas characterized by MYB, MYBL1, or FGFR1 alterations or BRAF V600E mutation. Acta Neuropathol 2019; 137 (4): 683–687. doi: 10.1007/s00401-019-01987-0.
9. Louis DN, Giannini C, Capper D et al. cIMPACT-NOW update 2: diagnostic clarifications for diffuse midline glioma, H3 K27M-mutant and diffuse astrocytoma/anaplastic astrocytoma, IDH-mutant. Acta Neuropathol 2018; 135 (4): 639–642. doi: 10.1007/s00401-018-1826-y.
10. Brat DJ, Aldape K, Colman H et al. cIMPACT-NOW update 3: recommended diagnostic criteria for „Diffuse astrocytic glioma, IDH-wildtype, with molecular features of glioblastoma, WHO grade IV“. Acta Neuropathol 2018; 136 (5): 805–810. doi: 10.1007/s00401-018-1913-0.
11. Stupp R, Mason WP, van den Bent MJ et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. N Engl J Med 2005; 352 (10): 987–996. doi: 10.1056/NEJMoa043330.
12. Stupp R, Taillibert S, Kanner AA et al. Maintenance therapy with tumor-treating fields plus temozolomide vs temozolomide alone for glioblastoma a randomized clinical trial. JAMA 2015; 314 (23): 2535–2543. doi: 10.1001/jama.2015.16669.
13. Mellinghoff IK, van den Bent MJ, Blumenthal DT et al. Vorasidenib in IDH1- or IDH2-mutant low-grade glioma. N Engl J Med 2023; 389 (7): 589–601. doi: 10.1056/NEJMoa2304194.
14. Weller M, van den Bent M, Preusser M et al. EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood. Nat Rev Clin Oncol 2021; 18 (3): 170–186. doi: 10.1038/s41571-020-00447-z.
15. Miller JJ, Castro LNG, Mcbrayer S et al. Isocitrate dehydrogenase (IDH) mutant gliomas: a Society for Neuro-Oncology (SNO) consensus review on diagnosis, management, and future directions. Neuro Oncol 2023; 25 (1): 4–25. doi: 10.1093/neuonc/noac207.
16. Huse JT, Diamond EL, Wang L et al. Mixed glioma with molecular features of composite oligodendroglioma and astrocytoma: a true „oligoastrocytoma“? Acta Neuropathol 2015; 129 (1): 151–153. doi: 10.1007/s00401-014-1359-y.
17. Brat DJ, Aldape K, Bridge JA et al. Molecular biomarker testing for the diagnosis of diffuse gliomas. Arch Pathol Lab Med 2022; 146 (5): 547–574. doi: 10.5858/arpa.2021-0295-CP.
18. Carstam L, Corell A, Smits A et al. WHO grade loses its prognostic value in molecularly defined diffuse lower-grade gliomas. Front Oncol 2022; 11: 803975. doi: 10.3389/fonc.2021.803975.
19. Kros JM, Rushing E, Uwimana AL et al. Mitotic count is prognostic in IDH mutant astrocytoma without homozygous deletion of CDKN2A/B. Results of consensus panel review of EORTC trial 26053 (CATNON) and EORTC trial 22033-26033. Neuro Oncol 2023; 25 (8): 1443–1449. doi: 10.1093/neuonc/noac282.
20. Marker DF, Pearce TM. Homozygous deletion of CDKN2A by fluorescence in situ hybridization is prognostic in grade 4, but not grade 2 or 3, IDH-mutant astrocytomas. Acta Neuropathol Commun 2020; 8 (1): 169. doi: 10.1186/s40478-020-01044-y.
21. Appay R, Dehais C, Maurage CA et al. CDKN2A homozygous deletion is a strong adverse prognosis factor in diffuse malignant IDH-mutant gliomas. Neuro Oncol 2019; 21 (12): 1519–1528. doi: 10.1093/neuonc/noz 124.
22. Ceccarelli M, Barthel FP, Malta TM et al. Molecular profiling reveals biologically discrete subsets and pathways of progression in diffuse glioma. Cell 2016; 164 (3): 550–563. doi: 10.1016/j.cell.2015.12.028.
23. Kocakavuk E, Anderson KJ, Varn FS et al. Radiotherapy is associated with a deletion signature that contributes to poor outcomes in patients with cancer. Nat Genet 2021; 53 (7): 1088–1096. doi: 10.1038/s41588-021-00874-3.
24. Lee K, Kim SI, Kim EE et al. Genomic profiles of IDH-mutant gliomas: MYCN-amplified IDH-mutant astrocytoma had the worst prognosis. Sci Rep 2023; 13 (1): 6761. doi: 10.1038/s41598-023-32153-y.
25. Onda K, Tanaka R, Takahashi H et al. Cerebral glioblastoma with cerebrospinal fluid dissemination: a clinicopathological study of 14 cases examined by complete autopsy. Neurosurgery 1989; 25 (4): 533–540. doi: 10.1227/00006123-198910000-00005.
26. Hendrych M, Solar P, Hermanova M et al. Spinal metastasis in a patient with supratentorial glioblastoma with primitive neuronal component: a case report with clinical and molecular evaluation. Diagnostics 2023; 13 (2): 181. doi: 10.3390/diagnostics13020181.
27. Lakomy R, Kazda T, Selingerova I et al. Real-world evidence in glioblastoma: Stupp’s regimen after a decade. Front Oncol 2020; 10: 840. doi: 10.3389/fonc.2020.00840.
28. Tan AC, Ashley DM, López GY et al. Management of glioblastoma: state of the art and future directions. CA Cancer J Clin 2020; 70 (4): 299–312. doi: 10.3322/caac. 21613.
29. Tesileanu CMS, Dirven L, Wijnenga MMJ et al. Survival of diffuse astrocytic glioma, IDH1/2 wildtype, with molecular features of glioblastoma, WHO grade IV: a confirmation of the cIMPACT-NOW criteria. Neuro Oncol 2020; 22 (4): 515–523. doi: 10.1093/neuonc/noz200.
30. Wijnenga MMJ, Maas SLN, van Dis V et al. Glioblastoma lacking necrosis or vascular proliferations: different clinical presentation but similar outcome, regardless of histology or isolated TERT promoter mutation. Neurooncol Adv 2023; 5 (1): vdad075. doi: 10.1093/noajnl/vdad 075.
31. Zhang Y, Lucas CHG, Young JS et al. Prospective genomically guided identification of „early/evolving“ and „undersampled“ IDH-wildtype glioblastoma leads to improved clinical outcomes. Neuro Oncol 2022; 24 (10): 1749–1762. doi: 10.1093/neuonc/noac089.
32. Hegi ME, Diserens A-C, Gorlia T et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. N Engl J Med 2005; 352 (10): 997–1003. doi: 10.1056/NEJMoa043331.
33. Higa N, Akahane T, Yokoyama S et al. Prognostic impact of PDGFRA gain/amplification and MGMT promoter methylation status in patients with IDH wild-type glioblastoma. Neurooncol Adv 2022; 4 (1): vdac097. doi: 10.1093/noajnl/vdac097.
34. Alnahhas I, Alsawas M, Rayi A et al. Characterizing benefit from temozolomide in MGMT promoter unmethylated and methylated glioblastoma: a systematic review and meta-analysis. Neurooncol Adv 2020; 2 (1): vdaa082. doi: 10.1093/noajnl/vdaa082.
35. Lam K, Eldred BSC, Kevan B et al. Prognostic value of O6-methylguanine-DNA methyltransferase methylation in isocitrate dehydrogenase mutant gliomas. Neurooncol Adv 2022; 4 (1): vdac030. doi: 10.1093/noajnl/vdac 030.
36. Louis DN, Perry A, Burger P et al. International Society of Neuropathology – Haarlem consensus guidelines for nervous system tumor classification and grading. Brain Pathol 2014; 24 (5): 429–435. doi: 10.1111/bpa.12171.
37. Sahm F, Brandner S, Bertero L et al. Molecular diagnostic tools for the World Health Organization (WHO) 2021 classification of gliomas, glioneuronal and neuronal tumors; an EANO guideline. Neuro Oncol 2023; 25 (10): 1731–1749. doi: 10.1093/neuonc/noad100.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2023 Issue 6
Most read in this issue
- Diffuse glioma overview based on the 2021 WHO classification part 1 – adult type
- The effects of introducing psychoeducational programs in patients with stroke in post-acute care
- Memory reserve and memory maintenance in SuperAgers
- Treatment of sleep disorders with repetitive transcranial magnetic stimulation
