Anti-HMGCR pozitivní imunitně zprostředkovaná nekrotizující myopatie
Authors:
J. Vejskal; P. Potužník
Authors‘ workplace:
Neurologická klinika LF UK a FN Plzeň
Published in:
Cesk Slov Neurol N 2023; 86(4): 279-281
Category:
Letter to Editor
doi:
https://doi.org/10.48095/cccsnn2023279
Vážená redakce,
imunitně zprostředkované nekrotizující myopatie (IMNM) představují podskupinu vzácných autoimunitních myozitid charakterizovaných typickým histologickým obrazem ze svalové biopsie, dále přítomností specifických autoprotilátek, klinicky proximálním myopatickým syndromem a odpovědí na imunosupresivní či imunomodulační léčbu. V rámci skupiny rozlišujeme myozitidy asociované s protilátkami anti-SRP (proti signal recognition particle), protilátkami anti-HMGCR (proti 3-hydroxy-3-methylglutaryl koenzym A reduktáze) nebo nekrotizující myozitidy séronegativní (až 20 % případů) [1].
Imunitně zprostředkovaná nekrotizující myopatie asociovaná s protilátkami anti-HMGCR se překrývá s klinickou jednotkou nazývanou statiny indukovaná nekrotizující autoimunitní myopatie (SINAM), která je postavena na teorii indukce autoimunity hypolipidemiky ze skupiny statinů [2–4].
Onemocnění je vzácné s incidencí dvou případů na milion obyvatel za rok [5], resp. dvou až tří případů na 100 tisíc obyvatel léčených statiny za rok [6]. Klinicky je charakterizováno proximálním myopatickým syndromem s nebo bez svalových bolestí. Postižení jiných svalových skupin (šíjové či polykací svalstvo) je méně časté [5], mimosvalové příznaky jsou vzácné [6]. Potíže progredují v řádu týdnů, často v návaznosti na užívání statinů s odstupem 2 měsíců až několika let od zahájení, či dokonce od ukončení léčby [5]. Ženské pohlaví a věk nad 50 let jsou převažující, naopak mladší věk je méně obvyklý a predikuje horší průběh onemocnění i horší reakci na léčbu, etiologicky bývají tyto případy méně často spojovány s užíváním statinů [7] a vzácně mohou být i paraneoplastické [8].
Laboratorně zjišťujeme elevaci svalových enzymů s hodnotami kreatinkinázy (CK) v řádech desetinásobku normy [4]. Při EMG nacházíme myogenní nález se spontánní denervační aktivitou [4]. MR svalů prokazuje v časné fázi aktivní zánět bez specifického vzorce postižení jednotlivých svalových skupin [5], současně slouží k zacílení svalové biopsie [9]. V histologickém obraze nacházíme nekrózu svalových vláken s minimální buněčnou zánětlivou infiltrací, pro probíhající autoimunitní proces svědčí nadměrná exprese povrchových antigenů HLA I s vázaným membránu atakujícím komplexem (MAC) komplementu [5,6]. Sérologicky prokazujeme specifické protilátky anti-HMGCR [5].
Základem léčby je vysazení statinů s jejich trvalou kontraindikací následované imunosupresivní terapií. V první linii volíme kortikosteroidy v kombinaci s kortikoid šetřícími imunosupresivy (azathioprin, metotrexát, mykofenolát mofetil či cyklofosfamid). Jako záchranná léčba jsou pak k dispozici intravenózní imunoglobuliny (IVIG) či rituximab. Terapeutická odpověď na prvoliniovou léčbu bývá dobrá [5,6].
Mezi roky 2015–2023 bylo na našem pracovišti diagnostikováno celkem pět pacientek s diagnózou anti-HMGCR pozitivní IMNM. Prezentujeme zde dva případy.
Žena narozená v roce 1970, léčená pro diabetes mellitus 2. typu, hypertonička s hypercholesterolemií a depresivním syndromem byla v dubna 2018 vyšetřena pro progredující bolesti a slabost svalů pletenců horních i dolních končetin. Klinicky byl zjištěn proximální myopatický syndrom, pacientka nebyla schopna zdvihnout horní končetiny nad hlavu, špatně se zvedala ze židle za pomoci rukou. Laboratorně shledána elevace svalových enzymů (CK 101 μkat/l, myoglobin 1 140 μg/l). EMG prvotně s velmi lehkým myogenním nálezem.
Vzhledem k anamnéze užívání statinů (atorvastatin 20 mg denně od dubna 2014) bylo pomýšleno na statinovou myopatii a lék byl vysazen. Pro přetrvávající potíže po vysazení se setrvalou elevací svalových enzymů byla hospitalizována k dovyšetření.
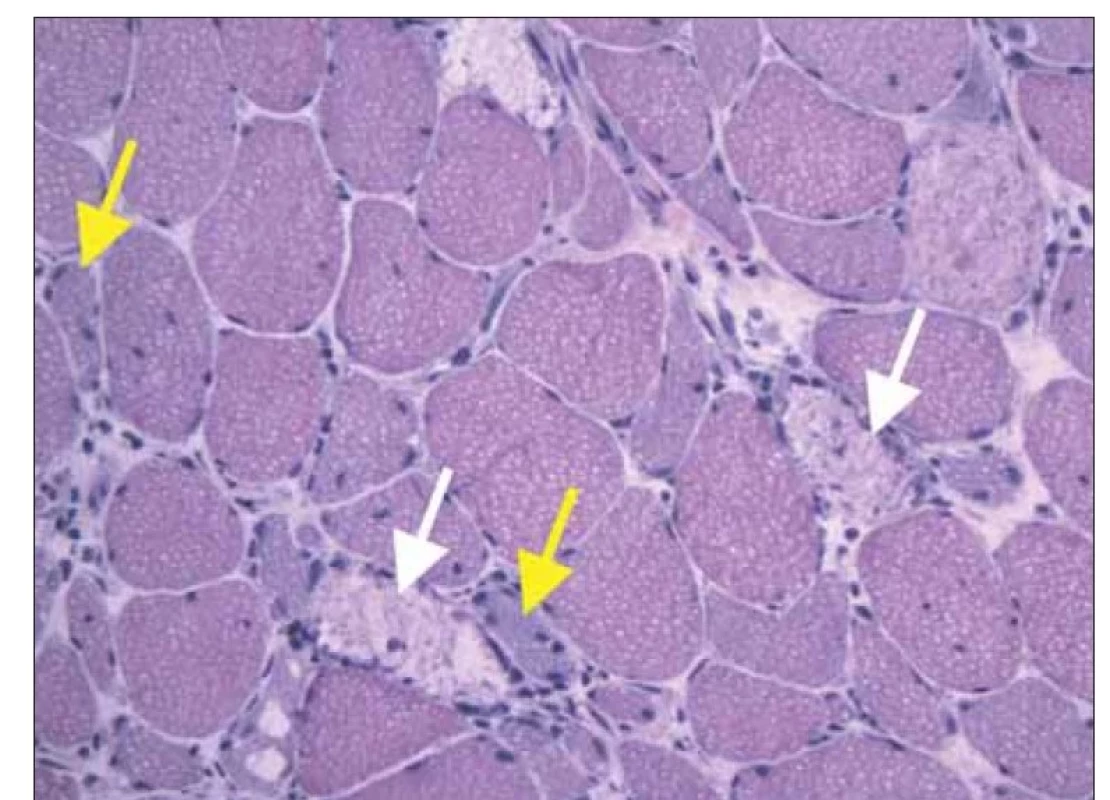
Klinicky byl přítomen středně těžký myopatický syndrom s typickou predilekcí svalové slabosti v pletencích horních i dolních končetin, bez postižení šíjového svalstva, bez mimosvalových projevů. EMG prokázala myogenní lézi se spontánní denervační aktivitou. MR proximálních svalů dolních končetin odhalila edém přední svalové skupiny stehen (obr. 1). Pro zvažovanou diagnózu zánětlivé myopatie byla doplněna svalová biopsie m. vastus lateralis vpravo. Histologické vyšetření (Ústav patologie a molekulární medicíny FN Motol v Praze) prokázalo četné svalové nekrózy, atrofie a regenerující myoblasty s minimální zánětlivou infiltrací (barvení hematoxilin-eosin) (obr. 2), dále over-expresi molekul HLA I a četná depozita složek komplementu na membránách svalových vláken (imunohistochemické zobrazení). Elektron-mikroskopický obraz neprokázal patologický nález. Histologie byla kompatibilní s diagnózou IMNM. Vyšetření panelu protilátek asociovaných s myozitidami potvrdilo pozitivitou protilátek anti-HMGCR (240,8 U/ml, Revmatologický ústav, Praha).
Fig. 1. MRI of thighs, T2 turbo inversion recovery magnitude weighted sequence. There
is evident edema of mm. quadricipites bilateraly, dominantly in mm. recti femoris and
vasti femoris laterales (white arrows).
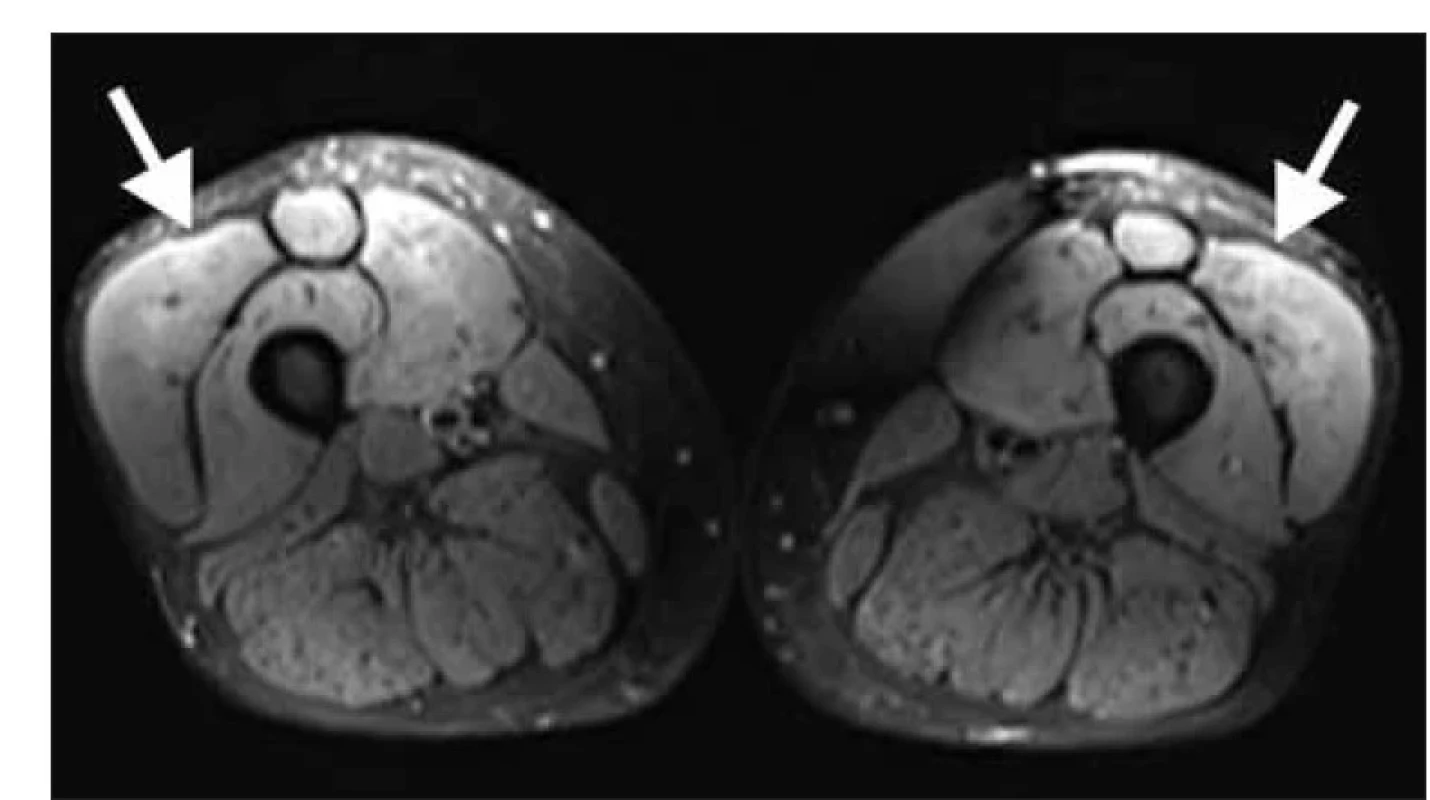
Fig. 2. Histology of muscle biopsy (rightside m. vastus lateralis), hematoxilin-eosin staining.
There are numerous necrotic muscle fibers (white arrows) with regenerating basofil myoblasts (yellow arrows). Only a few lymfocytes and macrophages are present as
a part of healing response.
Při diagnóze anti-HMGCR pozitivní IMNM jsme zahájili imunosupresivní léčbu, v úvodu intravenózní pulz methylprednisolonu s následnou perorální léčbou prednisonem (1 mg/kg) v kombinaci s azathioprinem. Terapeutický efekt byl dobrý. Při poslední kontrole v lednu 2023 byla shledána normální svalová síla, anamnesticky pacientka udávala zvýšenou svalovou únavu po fyzické aktivitě, laboratorně nadále přetrvávala mírná elevace svalových enzymů (CK 5,3 μkat/l, myoglobin 112 μg/l). Je snaha o postupnou deeskalaci kortikoterapie.
Druhý případ – žena narozená v roce 1992, vietnamské národnosti, dosud zcela zdravá a bez trvalé medikace – byla v dubnu 2022 vyšetřena pro 9 měsíců progredující svalovou slabost a bolesti s distribucí v pletencích horních i dolních končetin a oblasti šíje, anamnesticky udávala občasné potíže s polykáním, bez mimosvalových projevů. Laboratorně byla zjištěna elevace svalových enzymů (CK 141 μkat/l, myoglobin 1 231 μg/l). EMG potvrdila myopatický nález se spontánní denervační aktivitou. Pro podezření na myozitidu byla přijata k diagnostické hospitalizaci. MR svalů stehen odhalila edém s maximem postižení v m. kvadriceps. Biopsie svalu m. rectus femoris odhalila obraz nekrotizující myopatie. Laboratorně v rámci panelu byla zjištěna pozitivita autoprotilátek anti-HMGCR (150,9 U/ml), anamnesticky však pacientka nikdy statiny neužívala. Zahájili jsme imunosupresivní léčbu, v úvodu intravenózní pulz methylprednisolonu, dále pak kombinace prednisonu (1 mg/kg) s azathioprinem. Subjektivně pacientka udávala po 3 měsících léčby mírné zlepšení, objektivní nález a elevace svalových enzymů však byly stacionární. Při absenci efektu konvenční léčby jsme doplnili celotělové vyšetření PET/CT, které vyloučilo paraneoplastickou etiologii, a po dalších 3 měsících jsme přistoupili k podání intravenózních imunoglobulinů (2 g/kg). Měsíc po léčbě dochází ke znatelnému zlepšení svalové síly i poklesu svalových enzymů (CK 41 μkat/l, myoglobin 397 μg/l), sledování efektu léčby nadále pokračuje, postupně deeskalujeme kortikoterapii.
Prezentované kazuistiky v rámci našeho souboru ukazují různé podoby onemocnění. I takto vzácná a laboratorně i histologicky úzce specifikovaná myozitida se reálně projevuje v širším spektru klinických fenotypů. Čtyři z těchto našich pacientek reprezentují „klasickou“ podobu odpovídající variantně SINAM – tzn. anamnéza užívání statinů (nasazení léčby v rozpětí od 6 měsíců do 4 let před vznikem myozitidy), vyšší věk (průměrný 63,5 roku), myopatický obraz s postižením pouze pletenců a dobrá odpověď na imunosupresivní léčbu. Naopak poslední pacientka je mladého věku (30 let), bez anamnézy užívání statinů, s klinickým obrazem zahrnujícím i slabost šíje a polykacích svalů a neodpovídá na „prvolinionovou“ léčbu, jako důležitý faktor nelze opominout i rozdílnou rasu. V souboru se zároveň potvrzuje jasná dominance ženského pohlaví (100 %).
MUDr. Jakub Vejskal
Neurologická klinika
LF UK a FN Plzeň
Alej Svobody 923/80
323 00 Plzeň
e-mail: jakub.vejskal@gmail.com
Přijato k recenzi: 13. 10. 2022
Přijato do tisku: 20. 7. 2023
Sources
1. Allenbach Y, Benveniste O, Stenzel W et al. Immune-mediated necrotizing myopathy: clinical features and pathogenesis. Nat Rev Rheumatol 2020; 16 (12): 689–701. doi: 10.1038/s41584-020-00515-9.
2. Mohassel P, Mammen AL. Anti-HMGCR Myopathy. J Neuromuscul Dis 2018; 5 (1): 11–20. doi: 10.3233/JND-170282.
3. Needham M, Fabian V, Knezevic W et al. Progressive myopathy with up-regulation of MHC-I associated with statin therapy. Neuromuscul Disord 2007; 17 (2): 194–200. doi: 10.1016/j.nmd.2006.10.007.
4. Horák T, Voháňka S, Tvrdíková E et al. Statiny indukovaná nekrotizující autoimunitní myopatie. Cesk Slov Neurol N 2017; 80/113 (5): 569–577. doi: 10.14735/amcsnn2017569.
5. Babu S, Li Y. Statin induced necrotizing autoimmune myopathy. J Neurol Sci 2015; 351 (1–2): 13–17. doi: 10.1016/j.jns.2015.02.042.
6. Mammen AL. Statin-associated autoimmune myopathy. N Engl J Med 2016; 374 (7): 664–669. doi: 10.1056/ NEJMra1515161.
7. Milone M. Diagnosis and management of immune-mediated myopathies. Mayo Clin Proc 2017; 92 (5): 826–837. doi: 10.1016/j.mayocp.2016.12.025.
8. Mizuma A, Kouchi M, Netsu S et al. Paraneoplastic anti-3-hydroxy-3-methylglutary-coenzyme a reductase antibody-positive immune-mediated necrotizing myopathy in a patient with uterine cancer. Intern Med 2017; 56 (14): 1915–1918. doi: 10.2169/internalmedicine.56.8134.
9. Zámečník J. Svalová biopsie v deseti bodech. Cesk Slov Neurol N 2018; 81/114 (3): 358–361. doi: 10.14735/ amcsnn2018358
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2023 Issue 4
Most read in this issue
- Diagnostika kořenové avulze u poranění brachiálního plexu před chirurgickým výkonem
- Psychometrická validácia dotazníka MSQOL-54 na Slovensku – pilotná štúdia
- Klonální hematopoéza neurčitého potenciálu je možná a dosud nepopsaná příčina cévní mozkové příhody
- Zrakové evokované potenciály lze vyšetřit novým mobilním přístrojem kdekoliv
