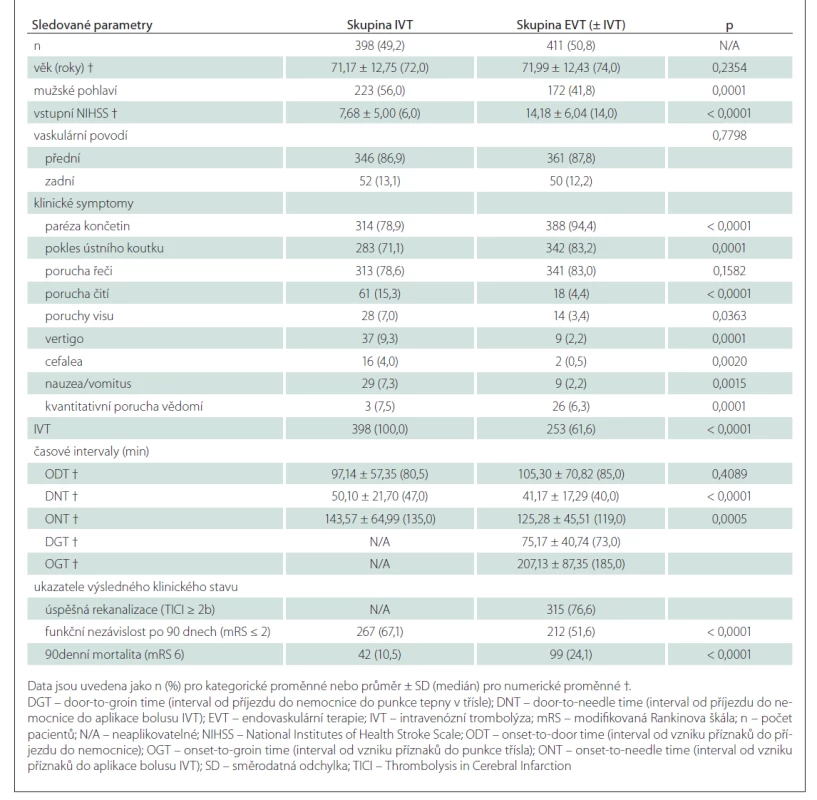
Ovlivňují iniciální klinické symptomy výsledný stav pacientů s ischemickým iktem a rekanalizační léčbou?
Do initial clinical symptoms affect the outcome of ischemic stroke patients with recanalization treatment?
Aim: The aim was to assess the dependency of the 90-day clinical outcome on the initial symptoms of ischemic stroke (IS) in patients treated with intravenous thrombolysis (IVT) and/or endovascular therapy (EVT). Materials and methods: In a retrospective, observational, one-center study, we assessed the effect of initial IS symptoms, achieved times and degree of recanalization on a 90-day clinical outcome in a set of 809 IS patients treated with IVT and/or EVT. Results: In the IVT group, age (odds ratio [OR] = 0.94, 95% confidence interval [CI]: 0.91–0.96), baseline neurological deficit (OR = 0.91, 95% CI: 0.86–0.96), and the presence of limb paresis (OR = 0.51, 95% CI: 0.25–0.97) were identified as significant negative predictors of a good 90-day clinical outcome. In the EVT (± IVT) group, age (OR = 0.93, 95% CI: 0.91–0.95) and initial neurological deficit (OR = 0.84, 95% CI: 0.80–0.89) were identified as significant negative predictors and successful recanalization (OR = 4.31, 95% CI: 2.44–7.81) as a significant positive predictor of a good 90-day clinical outcome (P < 0.05 in all cases). Conclusions: Our results showed that the presence of limb paresis was associated with a worse clinical outcome in patients treated with IVT alone, while the presence of other IS symptoms did not affect a 90-day clinical outcome in patients treated with recanalization therapy
Keywords:
acute ischemic stroke – clinical symptoms – intravenous thrombolysis – endovascular therapy – clinical outcome
Authors:
S. Halúsková 1; R. Herzig 1; D. Krajíčková 1; A. Hamza 2; A. Krajina 3; V. Chovanec 3; Miroslav Lojík 3
; J. Raupach 3; O. Renc 3; L. Šimůnek 1; E. Vítková 1; L. Sobíšek 1; M. Vališ 1
Authors‘ workplace:
Neurologická klinika, Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové
1; Neurologická klinika LF UK Hradec Králové
2; Radiologická klinika, Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové
3
Published in:
Cesk Slov Neurol N 2021; 84(5): 456-464
Category:
Original Paper
doi:
https://doi.org/10.48095/cccsnn2021456
Overview
Cíl: Cílem bylo posoudit závislost 90denního výsledného klinického stavu na úvodních symptomech ischemické CMP (iCMP) u pacientů léčených intravenózní trombolýzou (IVT) a/nebo endovaskulární terapií (EVT). Soubor a metodika: V retrospektivní observační jednocentrové studii jsme v souboru 809 pacientů s iCMP léčených IVT a/nebo EVT zkoumali vliv iniciálních symptomů iCMP, dosažených časů a stupně rekanalizace na 90denní výsledný klinický stav. Výsledky: Ve skupině IVT byly jako významné negativní prediktory dobrého 90denního výsledného klinického stavu identifikovány věk (poměr šancí [OR] = 0,94, 95% interval spolehlivosti [CI]: 0,91–0,96), vstupní neurologický deficit (OR = 0,91, 95% CI: 0,86–0,96) a přítomnost parézy končetin (OR = 0,51, 95% CI: 0,25–0,97). Ve skupině EVT (± IVT) byly věk (OR = 0,93, 95% CI: 0,91–0,95) a iniciální neurologický deficit (OR = 0,84, 95% CI: 0,80–0,89) identifikovány jako významné negativní prediktory a úspěšná rekanalizace (OR = 4,31, 95% CI: 2,44–7,81) jako významný pozitivní prediktor dobrého 90denního výsledného klinického stavu (ve všech případech p < 0,05). Závěry: Naše výsledky prokázaly, že přítomnost parézy končetin byla spojena s horším výsledným klinickým stavem u pacientů léčených pouze IVT, zatímco přítomnost dalších symptomů iCMP neměla vliv na 90denní výsledný klinický stav u pacientů s rekanalizační léčbou.
Klíčová slova:
endovaskulární terapie – intravenózní trombolýza – akutní ischemická cévní mozková příhoda – klinické symptomy – výsledný klinický stav
Úvod
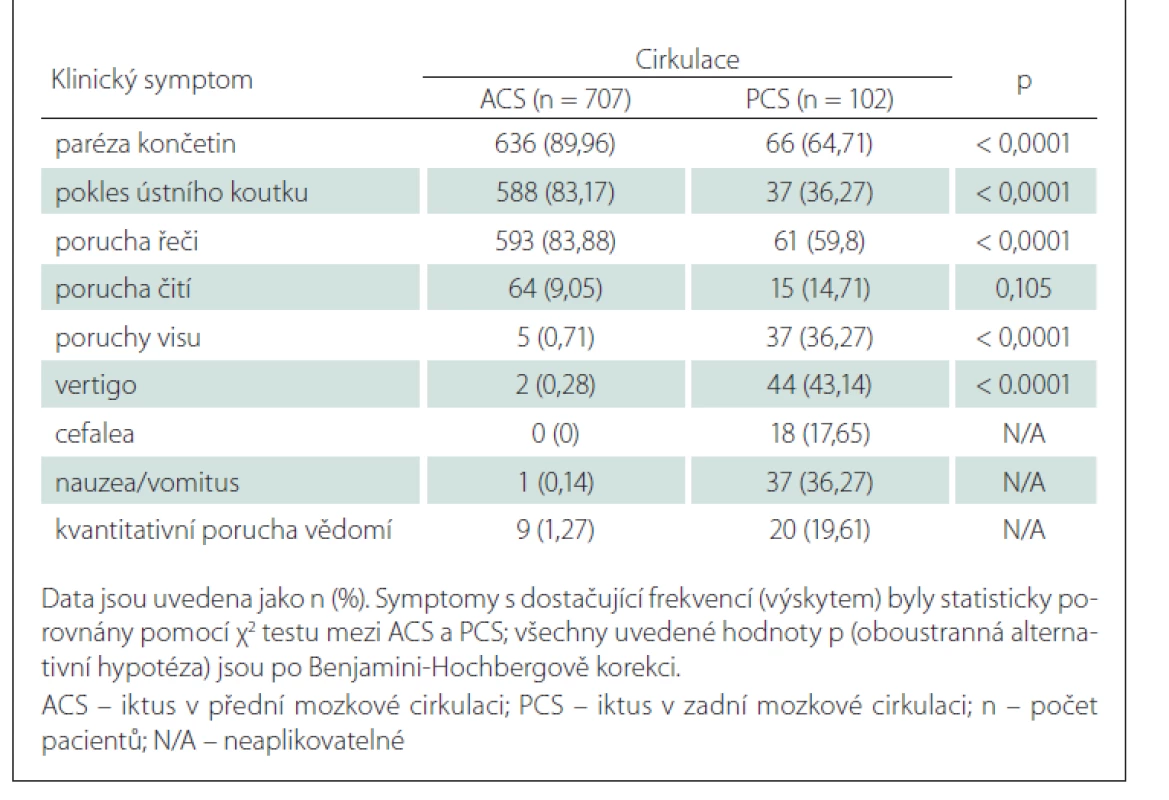
Klinická manifestace akutní ischemické CMP (iCMP) závisí zejména na lokalizaci v příslušném cévním povodí (eventuálně na pomezí cévních povodí) a na objemu postižené mozkové tkáně. Ikty v přední mozkové cirkulaci (anterior circulation stroke; ACS) představují přibližně 70–80 % všech iCMP, zbytek připadá na ikty v zadní mozkové cirkulaci (posterior circulation stroke; PCS) [1–4]. Mezi typické příznaky ACS patří kontralaterální hemiparéza a/nebo hemihypestézie, centrální léze lícního nervu, dysartrie, afázie (dominantní hemisféra) a syndrom opomíjení (nedominantní hemisféra). PCS může být na rozdíl od ACS spojen s mnoha méně specifickými příznaky, jako jsou závrať, bolest hlavy, nauzea a zvracení, diplopie, poruchy perimetru, dysartrie, ataxie chůze a končetin, ipsilaterální parézy nebo alterace vědomí [3,5].
Ačkoli nejčastěji se vyskytující klinické symptomy u ACS a PCS jsou dobře definovány, spolehlivá diferenciace mezi ACS a PCS může být někdy obtížná. Způsob, jakým jsou iniciální příznaky iktu referovány, vstupní vyšetření a management akutní fáze ovlivňují časový interval od vzniku iCMP do zahájení léčby. Několik randomizovaných kontrolovaných studií prokázalo, že intravenózní trombolýza (IVT) s podáním rekombinantního tkáňového aktivátoru plazminogenu (recombinant tissue plasminogen activator; rt-PA) a endovaskulární terapie (EVT) představují léčbu, jejíž účinek je přímo závislý na časovém faktoru – čím dříve jsou zahájeny, tím vyšší je šance na dosažení dobrého výsledného klinického stavu [6,7]. Nicméně doposud se otázkou vlivu specifických symptomů iCMP na konkrétní rekanalizační časy ve standardním terapeutickém oknu zabývalo jen několik studií, které konsenzuálně prokázaly, že existuje korelace mezi iniciálními klinickými symptomy iktu a časovou osou rekanalizační terapie – léčba byla zahájena později u pacientů s méně specifickými symptomy spojenými s PCS [8–10]. Chybí však data o tom, zda je iniciálními symptomy iktu ovlivněn i výsledný klinický stav.
Cílem studie bylo zhodnotit, zda a jakým způsobem je 90denní výsledný klinický stav u pacientů s iCMP léčených IVT nebo EVT (± IVT) ovlivněn iniciálními symptomy iktu (primární cíl), dosaženými rekanalizačními časy a stupněm dosažené rekanalizace (sekundární cíl).
Soubor pacientů a metodika
V retrospektivní observační studii byla v jednom centru provedena analýza prospektivně shromážděných dat 809 konsekutivních pacientů s iCMP ve věku ≥ 18 let léčených IVT nebo EVT (± IVT) v Centru vysoce specializované cerebrovaskulární péče (Komplexním cerebrovaskulárním centru; KCC) FN Hradec Králové (FN HK) v období od 1. ledna 2013 do 31. prosince 2018. U 98 pacientů ze skupiny EVT (± IVT) byla IVT provedena v Centrech vysoce specializované péče o pacienty s iktem (Iktových centrech; IC) podle určené spádové oblasti, s následným sekundárním transportem do KCC FN HK.
Hlavním zařazujícím kritériem byla dostupnost validní informace o postižení přední či zadní mozkové cirkulace, získaná na základě odloženého zobrazení mozku. Pacienti s nejednoznačnou lokalizací ischemické léze a také pacienti s iCMP v obou povodích byli z analýzy vyloučeni. ACS byla definována jako symptomatická ischemie v povodí a. carotis interna (ACI), a. cerebri media (ACM) nebo a. cerebri anterior (ACA). PCS jsme definovali jako symptomatickou ischemii vyskytující se v povodí a. vertebralis (AV), a. basilaris (AB) nebo a. cerebri posterior (ACP).
Indikace k rekanalizační léčbě byla stanovena v souladu s platnými národními a mezinárodními doporučeními [11–15]. Všichni kandidáti rekanalizační léčby absolvovali standardní vyšetřovací protokol sestávající z nekontrastní CT mozku vč. CTA se zobrazením krčních a intrakraniálních tepen [16]. U sekundárně transportovaných pacientů s IVT zahájenou v IC byla po příjezdu do KCC před EVT provedena kontrolní nekontrastní CT mozku k vyloučení hemoragické komplikace a rozvoje významného mozkového infarktu pouze v případě, pokud transport trval déle než 60 min nebo došlo k významnému zhoršení neurologického deficitu. IVT se standardní dávkou rt-PA (Actilyse®; Boehringer Ingelheim, Ingelheim am Rhein, Německo) 0,9 mg/kg (maximální dávka 90 mg) byla provedena do 4,5 h od rozvoje symptomů iktu (10 % dávky bylo aplikováno jako úvodní bolus a zbytek formou 60min infuze). Mechanická trombektomie (MT) pomocí stent-retrieverů byla u pacientů s ACS provedena co nejdříve, bez čekání na efekt IVT (pokud byla provedena) a během standardního 6h okna od rozvoje symptomů iktu. Pacienti s ACS s neznámým časem vzniku nebo po 6. hodině od rozvoje prvních příznaků byli léčeni EVT v případě, že perfuzní CT mozku prokázala pouze malou dokonanou ischemii (≤ 70 ml) [17] a přítomnost ischemické penumbry. U pacientů se současně přítomnou okluzí ACI (tandemová okluze) byla provedena perkutánní transluminální angioplastika ACI se zavedením stentu následovaná MT v intrakraniálním řečišti. U nemocných s PCS v důsledku okluze AB byla MT provedena v 24h časovém okně v případě absence rozsáhlého mozkového infarktu. Výběr stent-retrieveru užitého k MT byl na rozhodnutí intervenčního neuroradiologa. U většiny pacientů byla MT provedena za sedace při vědomí, a pokud to bylo po zhodnocení stavu pacienta možné, nebyla použita celková anestezie.
U všech zařazených pacientů jsme sledovali následující parametry: věk, pohlaví, tíži vstupního neurologického deficitu hodnocenou pomocí škály National Institutes of Health Stroke Scale (NIHSS) [18], postižené vaskulární povodí (přední/zadní) a přítomnost devíti vybraných klinických symptomů – paréza končetin (mono- nebo hemiparéza/plegie), pokles ústního koutku, porucha řeči (dysartrie, fatická porucha), porucha čití (hypestézie, anestézie, parestézie), poruchy visu (diplopie, defekty zorného pole), vertigo, cefalea, nauzea/vomitus, kvantitativní porucha vědomí. Výsledný klinický stav po 3 měsících od iktu byl hodnocen pomocí modifikované Rankinovy škály (mRS) (příznivý výsledný klinický stav – mRS ≤ 2; mortalita – mRS 6) [19]. Ve skupině pacientů léčených EVT (± IVT) jsme navíc hodnotili podání „bridging“ IVT před MT a lokalizaci arteriální okluze – v extrakraniálním úseku ACI (ACIe), intrakraniálním úseku ACI (ACIi), úseku M1 ACM (ACM/M1), úseku M2 ACM (ACM/M2), v ACA, ACP, AV, AB. Míra dosažené rekanalizace byla hodnocena pomocí skóre Thrombolysis in Cerebral Infarction (TICI) s úspěšnou rekanalizací definovanou jako TICI 2b/3 [20]. Na základě dostupných časových údajů jsme vyhodnotili pět klíčových časových intervalů – časy od vzniku příznaků do příjezdu do nemocnice (onset-to-door time; ODT), od příjezdu do nemocnice do aplikace bolusu IVT (door-to-needle time; DNT), od vzniku příznaků do aplikace bolusu IVT (onset-to-needle time; ONT) a ve skupině EVT (± IVT) jsme navíc hodnotili časy od příjezdu do nemocnice do punkce tepny v třísle (door-to-groin time; DGT) a od vzniku příznaků do punkce třísla (onset-to-groin time; OGT).
Skupiny IVT a EVT (± IVT) byly statisticky porovnány c2 testem nezávislosti pro kategorické proměnné (pohlaví, cévní teritorium, přítomnost konkrétních klinických příznaků, 90denní výsledný klinický stav). Skupinové rozdíly v mediánech byly porovnány neparametrickým Mann-Whitneyovým U testem s nevýběrovými směrodatnými odchylkami (SDs) pro numerické proměnné (věk, NIHSS, časové intervaly). Ve skupině pacientů léčených pouze IVT jsme hodnotili závislost 90denního výsledného klinického stavu (dvě binomicky závislé proměnné) na klinických symptomech, dosažených rekanalizačních časech, cévním teritoriu, věku, pohlaví a iniciální hodnotě NIHSS. Ve skupině nemocných s EVT (± IVT) jsme do analýzy kromě výše zmiňovaných proměnných zařadili také stupeň dosažené rekanalizace, lokalizaci arteriální okluze a podání IVT před MT. Byla provedena jednorozměrná a následně vícerozměrná regresní analýza. Na základě výsledků metody postupné selekce (stepwise selection) pro logistickou regresi byly vybrány a finálně aplikovány nejvhodnější modely s podmnožinou statistických proměnných nejlépe charakterizujících sledované parametry. Všechny analýzy byly provedeny pomocí statistického softwaru R (www.r-project.org/); byla zvolena 5% hladina významnosti a oboustranná alternativní hypotéza. Všechny uvedené hodnoty p jsou po Benjamini-Hochbergově korekci pro vícečetné testování.
Výsledky
Z 809 konsekutivních pacientů s iCMP ve sledované časové periodě bylo 398 (49,2 %) léčeno IVT a 411 (50,8 %) EVT (± IVT). Základní charakteristiky studované populace jsou uvedeny v tab. 1. Většina (74,9 %) pacientů měla izolovanou okluzi velké tepny. U některých nemocných byla přítomna současná okluze několika tepen. Nejčastějším místem uzávěru byl úsek ACM/M1 u 71,8 % pacientů, následovaný ACIi (15,1 %), ACM/M2 (13,1 %), ACIe (11,2 %), AB (8,3 %), ACP (2,9 %), AV (2,7 %) a ACA (1,9 %). Tandemová patologie (definovaná jako okluze ACI + ACM M1/M2) byla detekována u 11,2 % pacientů. Symptomy porucha čití, poruchy visu, vertigo, cefalea, nauzea/vomitus a kvantitativní porucha vědomí byly statisticky významně častěji zastoupeny ve skupině pacientů léčených pouze IVT, zatímco příznaky paréza končetin a pokles ústního koutku byly signifikantně častější ve skupině léčené EVT (± IVT). Klinické příznaky paréza končetin, pokles ústního koutku a porucha řeči byly signifikantně častější ve skupině pacientů s ACS, zatímco symptomy poruchy visu, vertigo, cefalea, nauzea/vomitus a kvantitativní porucha vědomí byly častější u pacientů s PCS (tab. 2).
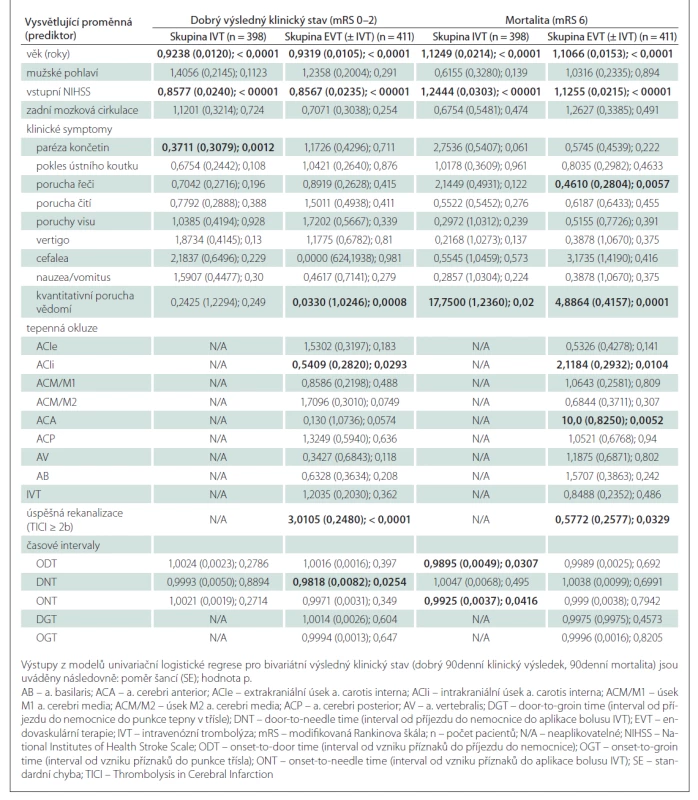
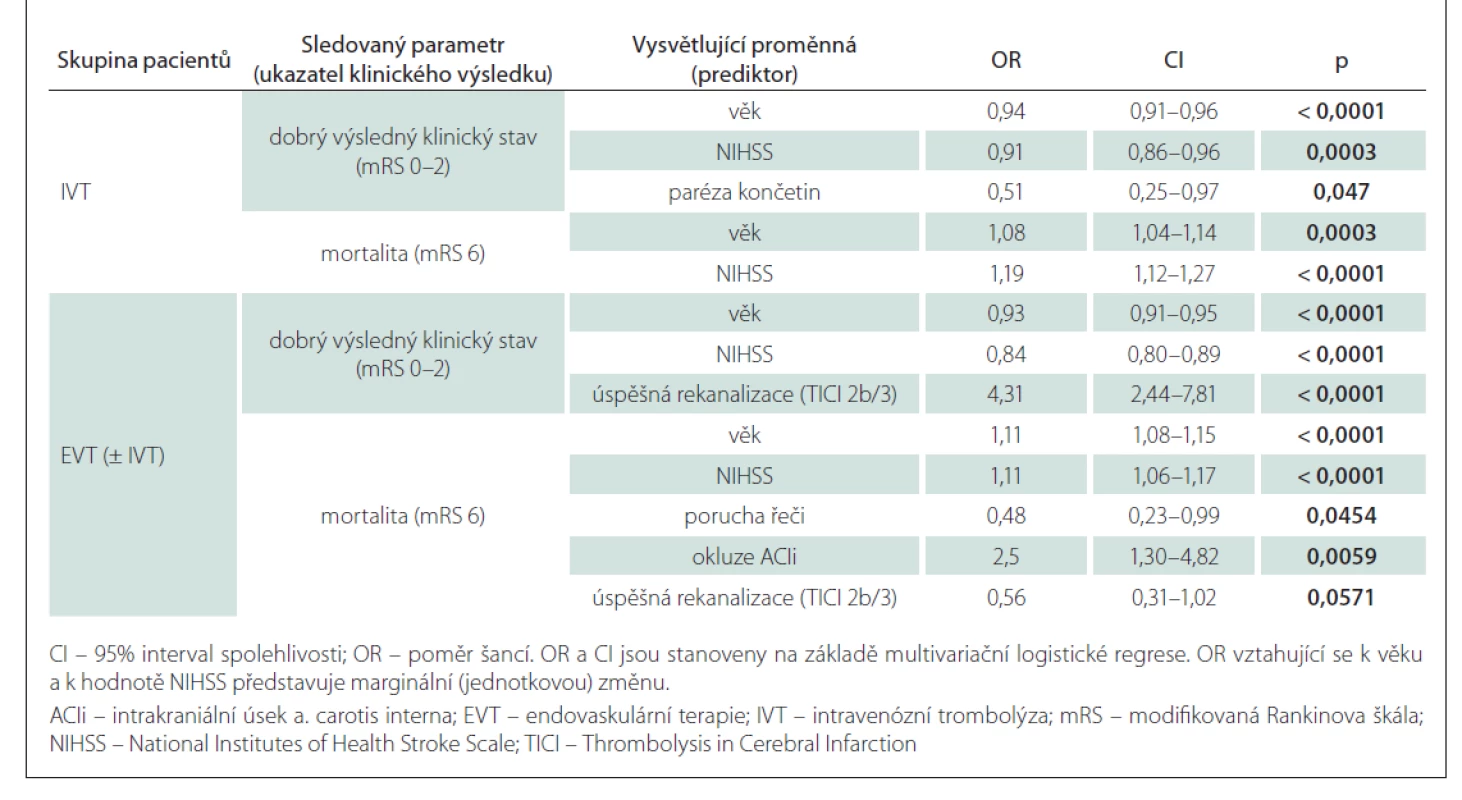
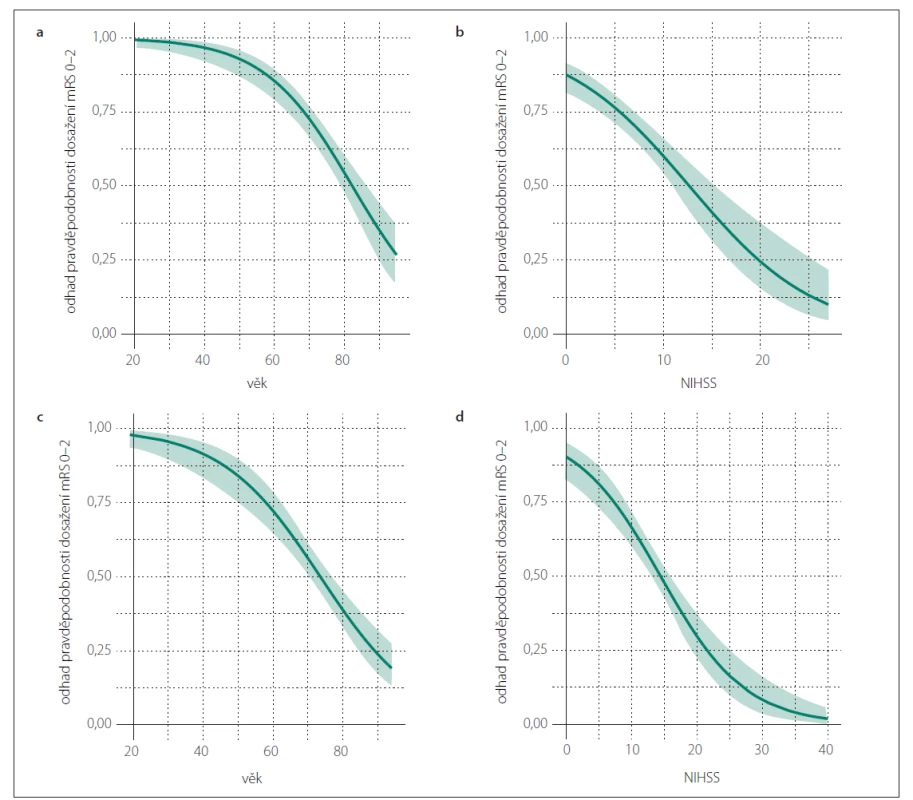
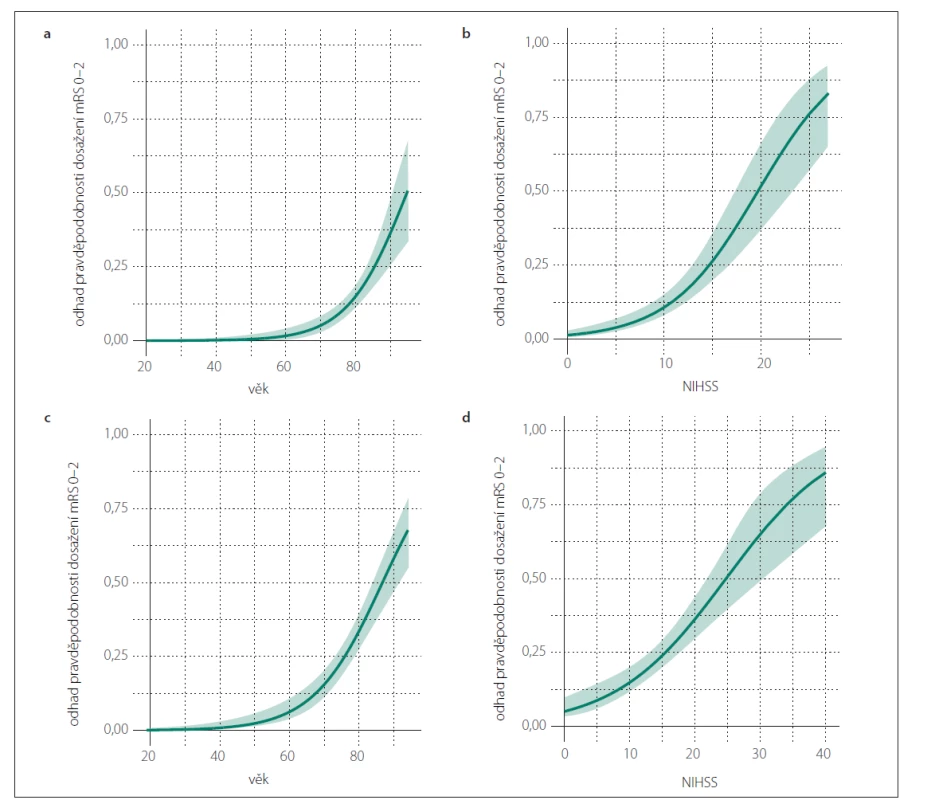
Výsledky jednorozměrné analýzy hodnotící závislost 90denního výsledného klinického stavu na dosažených rekanalizačních časech a dalších faktorech v obou skupinách jsou uvedeny v tab. 3, výsledky vícerozměrné analýzy znázorňuje tab. 4. Jak ve skupině léčené IVT, tak ve skupině s EVT (± IVT) byly věk a vstupní hodnota NIHSS identifikovány jako nezávislé negativní prediktory pro dosažení 90denního dobrého výsledného klinického stavu a jako nezávislé pozitivní prediktory 90denní mortality. Ve skupině pacientů léčených IVT je vysoce pravděpodobné, že pacienti mladší 65 let dosáhnou funkční nezávislosti po 90 dnech (obr. 1a), a existuje rovněž vysoká pravděpodobnost dosažení 90denního dobrého výsledného klinického stavu u pacientů s iniciální hodnotou NIHSS < 5 (obr. 1b). 90denní mortalita se u nemocných léčených IVT významně zvyšuje ve věkové skupině 70–90 let z přibližně 10 na 50 % (obr. 2a) a pacienti se vstupní hodnotou NIHSS > 25 mají více než 60% pravděpodobnost úmrtí do 90 dnů (obr. 2b). Ve skupině pacientů léčených EVT (± IVT) je pravděpodobnost dosažení dobrého 90denního výsledného klinického stavu u pacientů mladších 50 let vysoká (75 % a více) (obr. 1c) a stejně jako u pacientů léčených IVT je v tomto případě vysoce pravděpodobné, že nemocní s hodnotou NIHSS < 5 budou po 90 dnech od iktu soběstační (obr. 1d). U pacientů léčených EVT (± IVT) se 90denní mortalita významně zvyšuje ve věku 60–90 let z přibližně 10 na téměř 70 % (obr. 2c). Zastoupení pacientů starších 90 let nebylo dostatečné k formulaci zobecňujícího úsudku. U nemocných s iniciální hodnotou NIHSS > 30 existuje více než 50% pravděpodobnost úmrtí do 90 dnů po iktu (obr. 2d). Přítomnost symptomu paréza končetin byla identifikována jako další nezávislý negativní prediktor dosažení dobrého 90denního výsledného klinického stavu ve skupině léčené IVT a ve skupině pacientů s EVT (± IVT) úspěšná rekanalizace jako další nezávislý pozitivní prediktor dosažení příznivého klinického stavu po 90 dnech. Ve skupině pacientů léčených EVT (± IVT) byla navíc přítomnost poruchy řeči nezávislým negativním prediktorem a přítomnost okluze ACIi nezávislým pozitivním prediktorem 90denní mortality.
(a) na základě věku pro skupinu pacientů s IVT; (b) na základě hodnoty NIHSS pro skupinu pacientů s IVT; (c) na základě věku pro skupinu
pacientů s EVT (± IVT); (d) na základě hodnoty NIHSS pro skupinu pacientů s EVT (± IVT)
Zelená křivka znázorňuje odhad pravděpodobnosti (bodový odhad) pro mRS 0–2 na základě jednotlivých hodnot sledovaného
parametru (věk, NIHSS) ve skupinách IVT a EVT (± IVT). Barevné (světle zelené) pásmo zobrazuje 95% interval spolehlivosti pro odhad dané
pravděpodobnosti.
EVT – endovaskulární terapie; IVT – intravenózní trombolýza; mRS – modifikovaná Rankinova škála; NIHSS – National Institutes of Health
Stroke Scale
Fig. 1. Predicted probability of a good 90-day clinical outcome (mRS 0–2).
(a) based on the age for the IVT group; (b) based on the NIHSS for the IVT group; (c) based on the age for the EVT (± IVT) group; (d) based on
the NIHSS for the EVT (± IVT) group
The green curve shows the predicted probability (point estimator) of mRS 0–2 for the range of the observed parameter (age, NIHSS values)
in the IVT and EVT (± IVT) groups. The colored (light green) area depicts the 95% confidence interval estimate of the probability.
EVT – endovascular therapy; IVT – intravenous thrombolysis; mRS – modified Rankin Scale; NIHSS – National Institutes of Health Stroke Scale
(a) na základě věku pro skupinu pacientů s IVT; (b) na základě hodnoty NIHSS pro skupinu pacientů s IVT; (c) na základě věku pro skupinu
pacientů s EVT (± IVT); (d) na základě hodnoty NIHSS pro skupinu pacientů s EVT (± IVT)
Zelená křivka znázorňuje odhad pravděpodobnosti (bodový odhad) pro mRS 6 na základě jednotlivých hodnot sledovaného parametru
(věk, NIHSS) ve skupinách IVT a EVT (± IVT). Barevné (světle zelené) pásmo zobrazuje 95% interval spolehlivosti pro odhad dané
pravděpodobnosti.
EVT – endovaskulární terapie; IVT – intravenózní trombolýza; mRS – modifikovaná Rankinova škála; NIHSS – National Institutes of Health
Stroke Scale
Fig. 2. Predicted probability of 90-day mortality (mRS 6).
(a) based on the age for the IVT group; (b) based on the NIHSS for the IVT group; (c) based on the age for the EVT (± IVT) group; (d) based on
the NIHSS for the EVT (± IVT) group
The green curve shows the predicted probability (point estimator) of mRS 6 for the range of the observed parameter (age, NIHSS values) in
the IVT and EVT (± IVT) groups. The colored (light green) area depicts the 95% confidence interval estimate of the probability.
EVT – endovascular therapy; IVT – intravenous thrombolysis; mRS – modified Rankin Scale; NIHSS – National Institutes of Health Stroke Scale
Diskuze
Relativně velké množství různých prací potvrdilo závislost výsledného klinického stavu u pacientů s iCMP léčených rekanalizační terapií na stupni dosažené rekanalizace a dosažených rekanalizačních časech [6,7,21–27]. O korelaci iniciálních symptomů iktu a klinického výsledku pacientů s rekanalizační léčbou je však známo jen málo.
Podle publikovaných údajů bylo u pacientů léčených IVT zkrácení ODT spojeno s lepšími funkčními výsledky a kratší DNT u nich koreloval s nižší nemocniční mortalitou [28,29]. Nicméně v našem souboru nebyly ani dosažení příznivého 90denního výsledného klinického stavu, ani 90denní mortalita významně ovlivněny dosaženými rekanalizačními časy, a to jak ve skupině pacientů léčených IVT, tak i EVT (± IVT). Podobně Jung et al uvádějí, že kratší ONT a DNT u pacientů s IVT nebyly spojeny s lepšími funkčními výsledky po 90 dnech od iktu [30]. Předchozí analýzy vztahu mezi časovou osou terapie a klinickým výsledkem po EVT však prokázaly, že kratší OGT významně koreloval s lepšími celkovými výsledky, které zahrnovaly propuštění do domácího prostředí, dosažení funkční nezávislosti, absenci neurologického deficitu při dimisi a po 3 měsících a také nižší míru komplikací vč. nemocniční mortality [25]. Stejně tak i jiní autoři vč. metaanalýzy pěti prospektivních randomizovaných kontrolovaných studií potvrdili, že kratší OGT je asociován s lepším klinickým výsledkem pacientů po iCMP [23,31]. Dargazanli et al ve své analýze zjistili, že OGT se neliší mezi pacienty s vynikajícím (mRS 0–1) a dobrým (mRS 0–2) výsledným klinickým stavem s dosaženou úspěšnou reperfuzí [22]. Tato skutečnost naznačuje, že na výsledný klinický stav pacientů po iCMP mohou mít výraznější vliv i jiné faktory než pouze čas do zahájení léčby.
V naší studii jsme identifikovali věk a vstupní tíži neurologického deficitu jako nezávislé negativní prediktory pro dosažení dobrého 90denního výsledného klinického stavu a jako nezávislé pozitivní prediktory 90denní mortality. Tento výsledek je zcela v souladu s již dříve publikovanými studiemi [23,24] spolu s úspěšnou rekanalizací tepny, která byla identifikována jako další nezávislý pozitivní prediktor dobrého 90denního výsledného klinického stavu ve skupině léčené EVT (± IVT) [22,24]. Za zajímavé považujeme zjištění autorů zkoumajících vliv časné rekanalizace na klinický výsledek u pacientů s iCMP s uzávěrem velké tepny, kteří prokázali, že úspěšná rekanalizace byla nezávislým prediktorem příznivého 90denního výsledného klinického stavu pouze u těch pacientů, u kterých byl vstupně zjištěn závažný neurologický deficit (hodnota NIHSS > 15) [32].
Současná studie je první, která identifikovala jednotlivé iniciální symptomy iCMP jako další prognostické faktory 90denního funkčního výsledku u pacientů s rekanalizační léčbou – přítomnost parézy končetin jako nezávislý negativní prediktor dosažení dobrého 90denního výsledného klinického stavu ve skupině nemocných léčených IVT a přítomnost poruchy řeči jako nezávislý negativní prediktor 90denní mortality ve skupině léčené EVT (± IVT). V naší předchozí publikaci zabývající se problematikou závislosti rekanalizačních časů na klinických symptomech iCMP byla ve skupině léčené pouze IVT přítomnost parézy končetin spojena s kratšími časy ODT a ONT a přítomnost poruchy řeči s kratšími časy ODT, DNT i ONT [10]. Přesto se překvapivě na příznivém výsledném klinickém stavu projevila pouze přítomnost řečové poruchy, zatímco přítomnost končetinové parézy byla spojena s horším výsledkem, i když byly rekanalizační časy kratší u obou uvedených symptomů. U pacientů léčených EVT (± IVT) představoval navíc nález okluze ACIi nezávislý pozitivní prediktor mortality po 90 dnech od iktu.
Mezi hlavní limitace naší studie patří její retrospektivní charakter a částečně chybějící data, která představují běžnou součást datových souborů. Kvalita databáze závisí především na přesnosti a úplnosti lékařských záznamů, ale museli jsme zohlednit i skutečnost, že některé, zejména časové údaje nebylo možné zjistit (např. neznámá doba vzniku iCMP u iktů při probuzení). Analyzovaná data byla navíc extrahována z databáze pouze jednoho centra, uvedené výsledky proto nelze zobecňovat. Na druhou stranu silná stránka této studie spočívá v relativně velkém souboru pacientů a rovněž bychom chtěli vyzdvihnout, že na rozdíl od většiny publikovaných analýz jsme se zaměřili na jednotlivé klinické symptomy s cílem zhodnocení klinického profilu „ukrytého“ za hodnotami NIHSS.
Závěr
V naší studii jsme potvrdili závislost 90denního klinického stavu (dobrého výsledku i mortality) na věku a tíži neurologického deficitu v době léčby u pacientů s iCMP léčených jak pouze IVT, tak i EVT (± IVT) a ve skupině léčené EVT (± IVT) také závislost dosažení dobrého 90denního klinického stavu na dosažení úspěšné rekanalizace. Kromě toho naše výsledky prokázaly, že klinický výsledek byl také ovlivněn iniciálními symptomy iCMP a přítomností okluze ACIi. Souvislost jednotlivých úvodních klinických příznaků s dosaženými rekanalizačními časy a výsledným klinickým stavem však zůstává nadále kontroverzní a zaslouží si být předmětem dalšího výzkumu.
Etické aspekty
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 a jejími pozdějšími revizemi (vč. poslední z roku 2013). Studie byla schválena lokální etickou komisí FN HK (21. 4. 2020; č. schválení 202005 S05P). Všichni pacienti při vědomí podepsali formuláře informovaného souhlasu s vhodnou a dostupnou diagnostikou a léčbou. Nezávislí svědci ověřovali podpisy v případech, kdy došlo k technickým problémům.
Finanční podpora
Práce byla částečně podpořena z programového projektu Ministerstva zdravotnictví ČR (RVO – FNHK 00179906) a Univerzitou Karlovou (PROGRES Q40).
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
prof. MUDr. Roman Herzig, Ph.D., FESO, FEAN
Neurologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: herzig.roman@seznam.cz
Přijato k recenzi: 29. 6. 2021
Přijato do tisku: 6. 10. 2021
Sources
1. De Marchis GM, Kohler A, Renz N et al. Posterior versus anterior circulation strokes: comparison of clinical, radiological and outcome characteristics. J Neurol Neurosurg Psychiatry 2011; 82 (1): 33–37. doi: 10.1136/jnnp.2010.211151.
2. Dorňák T, Herzig R, Kuliha M et al. Endovascular treatment of acute basilar artery occlusion: time to treatment is crucial. Clin Radiol 2015; 70 (5): e20–e27. doi: 10.1016/j.crad.2015.01.008.
3. Zürcher E, Richoz B, Faouzi M et al. Differences in ischemic anterior and posterior circulation strokes: a clinico-radiological and outcome analysis. J Stroke Cerebrovasc Dis 2019; 28 (3): 710–718. doi: 10.1016/j.jstroke cerebrovasdis.2018.11.016.
4. Frid P, Drake M, Giese AK et al. Detailed phenotyping of posterior vs. anterior circulation ischemic stroke: a multi-center MRI study. J Neurol 2020; 267 (3): 649–658. doi: 10.1007/s00415-019-09613-5.
5. Tao WD, Liu M, Fisher M et al. Posterior versus anterior circulation infarction: how different are the neurological deficits? Stroke 2012; 43 (8): 2060–2065. doi: 10.1161/STROKEAHA.112.652420.
6. Emberson J, Lees KR, Lyden P et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials. Lancet 2014; 384 (9958): 1929–1935. doi: 10.1016/S0140-6736 (14) 60584-5.
7. Saver JL, Goyal M, van der Lugt A et al. Time to treatment with endovascular thrombectomy and outcomes from ischemic stroke: a meta-analysis. JAMA 2016; 316 (12): 1279–1288. doi: 10.1001/jama.2016.13647.
8. Sarraj A, Medrek S, Albright K et al. Posterior circulation stroke is associated with prolonged door-to-needle time. Int J Stroke 2015; 10 (5): 672–678. doi: 10.1111/j.1747-4949.2012.00952.x.
9. Baraban E, Lucas L, Bhatt A. Initial presenting stroke symptoms impact treatment timeline among ischemic stroke patients [abstract]. Neurology 2018; 90 (Suppl 15): P4.233.
10. Halúsková S, Herzig R, Krajíčková D et al. Acute management should be optimized in patients with less specific stroke symptoms: findings from a retrospective observational study. J Clin Med 2021; 10 (5): 1143. doi: 10.3390/jcm10051143.
11. Jauch EC, Saver JL, Adams HP Jr et al. Guidelines for the early management of patients with acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2013; 44 (3): 870–947. doi: 10.1161/STR.0b013e318284056a.
12. Neumann J, Tomek A, Školoudík D et al. Doporučený postup pro intravenózní trombolýzu v léčbě akutního mozkového infarktu – verze 2014. Cesk Slov Neurol N 2014; 77/110 (3): 381–385.
13. Powers WJ, Derdeyn CP, Biller J et al. 2015 American Heart Association/American Stroke Association focused update of the 2013 guidelines for the early management of patients with acute ischemic stroke regarding endovascular treatment: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2015; 46 (10): 3020–3035. doi: 10.1161/STR.0000000000000074.
14. Šaňák D, Neumann J, Tomek A et al. Doporučení pro rekanalizační léčbu akutního mozkového infarktu – verze 2016. Cesk Slov Neurol N 2016; 79/112 (2): 231–234.
15. Powers WJ, Rabinstein AA, Ackerson T et al. 2018 guidelines for the early management of patients with acute ischemic stroke. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2018; 49 (3): e46–e110. doi: 10.1161/STR.0000000000000158.
16. Krajíčková D, Krajina A, Herzig R et al. Mechanical recanalization in ischemic anterior circulation stroke within an 8-hour time window. A real-world experience. Diagn Interv Radiol 2017; 23 (6): 465–471. doi: 10.5152/dir.2017.17049.
17. Sanák D, Nosáľ V, Horák D et al. Impact of diffusion-weighted MRI-measured initial cerebral infarction volume on clinical outcome in acute stroke patients with middle cerebral artery occlusion treated by thrombolysis. Neuroradiology 2006; 48 (9): 632–639. doi: 10.1007/s00234-006-0105-0.
18. Goldstein LB, Samsa GP. Reliability of the National Institutes of Health Stroke Scale. Extension to non-neurologists in the context of a clinical trial. Stroke 1997; 28 (2): 307–310. doi: 10.1161/01.str.28.2.307.
19. Hong KS, Saver JL. Quantifying the value of stroke disability outcomes: WHO global burden of disease project disability weights for each level of the modified Rankin Scale. Stroke 2009; 40 (12): 3828–3833. doi: 10.1161/STROKEAHA.109.561365.
20. Yoo AJ, Simonsen CZ, Prabhakaran S et al. Refining angiographic biomarkers of revascularization: improving outcome prediction after intra-arterial therapy. Stroke 2013; 44 (9): 2509–2512. doi: 10.1161/STROKEAHA.113.001990.
21. Vergouwen MD, Algra A, Pfefferkorn T et al. Time is brain (stem) in basilar artery occlusion. Stroke 2012; 43 (11): 3003–3006. doi: 10.1161/STROKEAHA.112.666867.
22. Dargazanli C, Consoli A, Gory B et al. Is reperfusion useful in ischaemic stroke patients presenting with a low National Institutes of Health Stroke Scale and a proximal large vessel occlusion of the anterior circulation? Cerebrovasc Dis 2017; 43 (5–6): 305–312. doi: 10.1159/000468995.
23. Ota T, Nishiyama Y, Koizumi S et al. Impact of onset-to-groin puncture time within three hours on functional outcomes in mechanical thrombectomy for acute large--vessel occlusion. Interv Neuroradiol 2018; 24 (2): 162–167. doi: 10.1177/1591019917747247.
24. Rentzos A, Karlsson JE, Lundqvist C et al. Endovascular treatment of acute ischemic stroke in the posterior circulation. Interv Neuroradiol 2018; 24 (4): 405–411. doi: 10.1177/1591019918762320.
25. Jahan R, Saver JL, Schwamm LH et al. Association between time to treatment with endovascular reperfusion therapy and outcomes in patients with acute ischemic stroke treated in clinical practice. JAMA 2019; 322 (3): 252–263. doi: 10.1001/jama.2019.8286.
26. Tsivgoulis G, Saqqur M, Sharma VK et al. Timing of recanalization and functional recovery in acute ischemic stroke. J Stroke 2020; 22 (1): 130–140. doi: 10.5853/ jos.2019.01648.
27. Fuhrer H, Forner L, Pruellage P et al. Long-term outcome changes after mechanical thrombectomy for anterior circulation acute ischemic stroke. J Neurol 2020; 267 (4): 1026–1034. doi: 10.1007/s00415-019-09670-w.
28. Fonarow GC, Smith EE, Saver JL et al. Timeliness of tissue-type plasminogen activator therapy in acute ischemic stroke patient characteristics, hospital factors, and outcomes associated with door-to-needle times within 60 minutes. Circulation 2011; 123 (7): 750–758. doi: 10.1161/CIRCULATIONAHA.110.974675.
29. Ebinger M, Kunz A, Wendt M et al. Effects of golden hour thrombolysis: a prehospital acute neurological treatment and optimization of medical care in stroke (PHANTOM-S) substudy. JAMA Neurol 2015; 72 (1): 25–30. doi: 10.1001/jamaneurol.2014.3188.
30. Jung S, Rosini JM, Nomura JT et al. Even faster door-to-alteplase times and associated outcomes in acute ischemic stroke. J Stroke Cerebrovasc Dis 2019; 28 (12): 104329. doi: 10.1016/j.jstrokecerebrovasdis.2019.104 329.
31. Bush CK, Kurimella D, Cross LJ et al. Endovascular treatment with stent-retriever devices for acute ischemic stroke: a meta-analysis of randomized controlled trials. PLoS One 2016; 11 (1): e0147287. doi: 10.1371/journal.pone.0147287.
32. Skagen K, Skjelland M, Russell D et al. Large-vessel occlusion stroke: effect of recanalization on outcome depends on the National Institutes of Health Stroke Scale score. J Stroke Cerebrovasc Dis 2015; 24 (7): 1532–1539. doi: 10.1016/j.jstrokecerebrovasdis.2015.03.020.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2021 Issue 5
Most read in this issue
- Analgeticko-myorelaxační infuze v terapii vertebrogenního algického syndromu – technologické a klinické aspekty
- Ofatumumab – nová možnost vysoce účinné terapie relabujících forem roztroušené sklerózy
- Ultrasonograficky navigovaný léčebný obstřik sakroilického kloubu
- Syndrom progresivní ataxie a palatálního tremoru u pacienta s mírnou idiopatickou bilaterální hypertrofií olivárního jádra
