Evokované potenciály u neuromyelitis optica a spektra ochorení neuromyelitis optica
Evoked potentials in neuromyelitis optica and neuromyelitis optica spectrum disroders
Neuromyelitis optica (NMO) and neuromyelitis optica spectrum disorders (NMOSD) have been recognized in the last 15 years according to its clinical and laboratory findings, MRI and anti-aquaporin-4-IgG antibodies discovery, as a separate nosological entity, different from multiple sclerosis. Electrophysiological examination including evoked potentials (EPs) is not a part of formal NMO/NMOSD criteria. In the past ten years, multiple studies appeared, analyzing the contribution of EPs in the diagnostics, disease monitoring, and prognosis in NMO/NMOSD. The actual survey focuses on the most important one. Most of the studies, though retrospective and cross-sectional, show that the findings are more homogenous in the Aphro-American and Asian population than in the Caucasian one. The most often seen abnormality was the absence of EPs, amplitude reduction of VEP in optic neuritis, and MEP and/or SEP in longitudinal extension transverse myelitis. These findings reflect more severe axonal loss than demyelination in NMO/NMOSD. In the Caucasian population, the findings in EPs might be more heterogeneous, with a higher frequency of mild latency increase of EPs and less amplitude reduction or EP absence. The data from many studies point to a high correlation of the abnormity pattern in the case of the first attack of optic neuritis and/or longitudinal extension transverse myelitis and the next rebound of the disease. Although the multimodal EPs are not a part of formal NMO/NMOSD diagnostic criteria, their role in the diagnostics, monitoring disease course and prognosis of the NMO/NMOSD, is indubitable. Most of the published studies are cross-sectional, opened and retrospective, and therefore new prospective, randomized, and multicentre studies are invited.
Keywords:
neuromyelitis optica – evoked potentials – visual evoked potentials – motor evoked potentials – somatosenzoric evoked potentials – brainstem auditory evoked potentials
Authors:
G. Timárová 1; P. Havránková 2; I. Menkyová 1,2
Authors‘ workplace:
II. neurologická klinika LF UK a UN, Bratislava, Slovensko
1; Neurologická klinika a Centrum, klinických neurověd, 1. LF UK a VFN v Praze, Česká republika
2
Published in:
Cesk Slov Neurol N 2020; 83/116(supplementum 1): 44-50
doi:
https://doi.org/10.14735/amcsnn2020S44
Overview
V posledných 15 rokoch sa neuromyelitis optica (NMO) a spektrum ochorení NMO (neuromyelitis optica spectrum disorders; NMOSD) na základe klinických a paraklinických kritérií, predovšetkým MR a prítomnosti protilátok proti akvaporínu 4, jasne odčlenili od sclerosis multiplex ako samostatná nozologická jednotka. Elektrofyziologické štúdie vrátane evokovaných potenciálov (EP) nie sú zahrnuté vo formálnych kritériách NMO/NMOSD. Za posledné desaťročie sa objavilo viacero prác, ktoré sa zameriavajú na prínos EP v diagnostike, monitorovaní a prognózovaní NMO/NMOSD. V práci prinášame podrobný prehľad aktuálnych poznatkov o tejto problematike. Na základe viacerých, predovšetkým prierezových a retrospektívnych štúdií sa ukazuje, že v afroamerickej a ázijskej populácii sú nálezy homogénnejšie. Abnormality EP svojim charakterom odrážajú dominujúcu axonálnu poruchu vedenia centrálnymi úsekmi dráh s častou absenciou evokovaného potenciálu a poklesom amplitúdy evokovaných potenciálov vo VEP u optickej neuritídy a MEP a/alebo SEP u longitudinálnej myelitídy. U kaukazskej populácie sú nálezy heterogénnejšie s častejším obrazom ľahkého predĺženia latencie a menej častým poklesom amplitúdy a absenciou evokovaného potenciálu. Z viacerých štúdií vyplynula dobrá korelácia medzi charakterom abnormality v EP pri prvom ataku NMO/NMOSD a rizikom ďalšieho relapsu ochorenia. Aj keď multimodalitné EP v súčasnosti nie sú súčasťou formálnych diagnostických kritérií NMO/NMOSD, ich úloha v diagnostike, monitorovaní priebehu, efektu liečby a určení prognózy NMO/NMOSD je nespochybniteľná. Problémom súčasných štúdií je, že väčšina z nich sú prierezové, retrospektívne a otvorené. Nové prospektívne, randomizované a multicentrické štúdie sú stále aktuálne.
Klíčová slova:
neuromyelitis optica – evokované potenciály – zrakové evokované potenciály – motorické evokované potenciály – somatosenzorické evokované potenciály – sluchové evokované potenciály
Úvod
Neuromyetitis optica (NMO) a spektrum ochorení NMO (neuromyelitis optica spectrum disorders; NMOSD) predstavujú zápalové autoimunitne podmienené ochorenie CNS, ktoré sa primárne prejavuje postihnutím optického nervu vo forme optickej neuritídy (ON) a myelitídami, menej časté sú kmeňové, diencefalické a periventrikulárne lokalizované lézie. Pomerne typická je lokalizácia lézií v oblasti area postrema (singultus, nauzea a vomitus) [1,2]. NMO často prebieha podobne ako relaps-remitujúca forma sclerosis multiplex (RRSM). Pred poznaním biologického markera NMO – protilátok proti akvaporínu 4 (AQP4-IgG), bola NMO klasifikovaná ako opticko-spinálna forma sclerosis multiplex (OSMS). V súčasnosti sa považuje za samostatné ochorenie, ktoré má odlišné klinické, laboratórne aj terapeutické charakteristiky ako RRSM [3]. Prevalencia NMO sa stanovuje medzi 0,5–4,4/100 tis. obyvateľov [4,5]. Protilátky AQP4-IgG sú prítomné v rôznych kohortách pacientov s NMO/NMOSD u 61–90 % pacientov [3,5,6]. Historicky sa za NMO považovalo monofázické postihnutie oboch optických nervov a myelitída, alebo postihnutie týchto systémov v krátkom časovom intervale, ale dnes sa na základe súčasných diagnostických možností (klinický obraz, AQP4-IgG, MR nálezy) koncepcia NMO rozšírila o rôzne kmeňové syndrómy, rekurentnú izolovanú optickú neuritídu (RION) a subklinické mozgové lézie – označuje sa ako spektrum ochorení NMO (NMOSD). Časť pacientov s NMOSD vykazuje pozitivitu iných protilátok, napr. MOG-IgG protilátok [7]. U NMO sa miešna lézia často prezentuje ako transverzálna myelitída s klinickým postihnutím v podobe symetrickej para- alebo kvadruparézy/plegie s relatívne symetrickou úrovňou senzitívnej poruchy a s poruchou sfinkterov [8]. V T2 vážených obrazoch v spinálnej MR vidíme ložiská dosahujúce alebo presahujúce tri miešne segmenty (longitudinal extension transverse myelitis; LETM). U RRSM bývajú miešne lézie častejšie asymetrické a spôsobené nekompletnou – parciálnou myelitídou. NMO je z hľadiska patofyziológie definované ako astrocytopatia vykazujúca histopatologické črty postihnutia astrocytov sprevádzané demyelinizáciou, stratou neurónov a často i výraznými nekrózami s perivaskulárnou prítomnosťou imunokomplexov najmä v mieste aktívnych lézií, čo svedčí pre rozhodujúcu úlohu humorálnej imunity u NMO [8,9].
Odporúčania EFNS z roku 2010, ktoré vznikli na základe metaanalýzy dovtedy realizovaných štúdií pre diagnostiku a liečbu NMO, konštatujú, že existuje iba málo štúdií, ktoré by hodnotili elektrofyziologické nálezy u NMO [7]. Nemecká Neuromyelitis Optica Study Group (NEMOS) v roku 2013 stanovila v diagnostike a liečbe NMO/NMOSD ako rozhodujúce klinické a humorálne nálezy spolu s nálezmi v zobrazovacích metódach [10]. Medzinárodné konsenzuálne Diagnostické kritériá NMOSD prezentované v roku 2015 Wingerchukom et al sú tiež postavené na klinickom obraze, prítomnosti protilátok AQP4-IgG a na nálezoch v MR mozgu a miechy [11].
Úloha elektrofyziologických metód v diagnostických kritériách NMOSD nie je definovaná. Evokované potenciály (EP) sú v neurológii dlhodobo považované za vhodnú metódu na detekciu subklinických abnormalít nervových tkanív, ktoré nie sú zachytené v zobrazovacích metódach. V dennej klinickej praxi sú EP široko využívané v diagnostike RRSM, pretože sa považujú za metódu, ktorou je možné sledovať aktivitu a progresiu ochorenia [12]. V posledných rokoch sa objavilo viacero štúdií, ktorých snahou bolo objasniť, aké postavenie majú jednotlivé modality EP v diagnostike, monitorovaní aktivity a prognózovaní NMO/NMOSD. Podľa zistení z týchto štúdií sú u NMO/NMOSD často prítomné abnormálne nálezy v zrakových EP (VEP) ako korelát ON, v motorických a somatosenzorických EP (MEP a SEP) ako korelát LETM. Zriedka bývajú popisované abnormality v sluchových kmeňových EP (BAEP). V multietnickej kubánskej NMO štúdii boli SEP abnormálne u 86 % pacientov (42/49), VEP u 83 % (44/53) a BAEP u 37 % (19/51). Abnormality v BAEP boli častejšie u Afroameričanov ako u kaukazskej populácie (78 vs. 29 %; p = 0,003) [13]. Periférne motorické a senzitívne kondukčné štúdie boli v norme u všetkých pacientov v japonskej štúdii s 9 pacientami s OSSM [14].
Zrakové evokované potenciály u NMOSD
VEP so stimuláciou celého zorného poľa (full field) (ffVEP) sa používajú v klinickej praxi na diagnostiku, monitorovanie a prognózovanie porúch zrakovej dráhy už od 70-tych rokov 20. storočia. Pre vysokú inter- a intraindividuálnu variabilitu VEP vyvolaného zábleskom difúzneho svetla (flash VEP) [15] sa v praxi uprednostňuje u spolupracujúcich osôb stimulácia zvratom fázy (pattern reversal) [16]. Odporúčania pre vyšetrenie VEP boli aktualizované Medzinárodnou federáciou klinickej neurofyziológie (EFCN) v roku 2010 a Medzinárodnou spoločnosťou pre klinickú elektrofyziológiu zraku (ISCEV) v roku 2016 [17,18]. V roku 1994 Baseler et al popísali techniku multifokálneho VEP (mfVEP), ktorý testuje malé časti zrakového poľa [19]. mfVEP detailnejšie zmapujú poškodenie sietnice a zrakového nervu ako ffVEP, pretože celé zorné pole s rozsahom do 28 uhlových stupňov sa rozdelí na 58 častí a je možné separátne odsnímať aj časti centrálneho poľa definovaného rozsahom 4 uhlových stupňov. Táto metodika je však časovo veľmi náročná a používa sa predovšetkým vo výskume. V klinickej praxi sa najčastejšie používajú ffVEP (ďalej VEP), ktoré sú bežne dostupné a dajú sa realizovať v primeranom čase [12]. Diagnostika ON a diferenciálna diagnostika postihnutia optického nervu je v súčasnosti multimodalitná. Okrem klasického vyšetrenia VEP a mfVEP, vyšetrenia vízu, perimetra a fundoskopie sa na analýzu postihnutia optického nervu, chiazmy a retrochiazmatických oblastí používa MR mozgu a MR optických nervov [2,3,7,10,11].
Ako veľmi senzitívne a prínosné pre diagnostiku akútnej unilaterálnej ON, zvlášť u nejasných stavov, kedy ffVEP nemajú charakteristický nález, môže byť prínosné USG vyhodnotenie orbitálnej hemodynamiky [20]. Definitívne miesto tejto metódy v diagnostike, monitorovaní a prognózovaní NMO/NMOSD je však nutné stanoviť ďalšími prospektívnymi štúdiami.
Pre detekciu postihnutia jednotlivých vrstiev sietnice a topografiu jej postihnutia u ON asociovanej s NMOSD je metódou voľby optická koherenčná tomografia (OCT), výťažnosť zvyšuje kombinácia s mfVEP. Typickým nálezom je redukcia peripapilárnej vrstvy vláken optického nervu (pRNFL) a redukcia gangliovej a vnútornej plexiformnej vrstvy sietnice (GCIP) s mikrocystickou formou makulárneho edému [21–23].
Najčastejšie zmeny vo VEP u SM sú absolútny nárast latencie vlny P100, zmeny morfológie NPN komplexu a napokon absencia vlny P100. Frederiksen a Petrera [24] v prospektívnom sledovaní pacientov s akútnou ON pomocou VEP zistili signifikantnú asociáciu definitívnej diagnózy SM s predĺžením latencie P100. Celkom 35,5 % z nich v nasledujúcich 6 mesiacoch malo definitívnu diagnózu SM. Tiež zistili subklinické zmeny optického nervu na asymptomatickom oku s prítomnosťou abnormálneho VEP. Naismith et al [25] potvrdili vyššiu senzitivitu VEP v potvrdení ON v porovnaní s OCT u pacientov s aspoň jednou epizódou ON (81 vs. 60 %; p = 0,002) u klinicky izolovaného syndrómu (CIS), RRSM a NMO a pri vyšetrení asymptomatických očí. Davidson et al s cieľom zvýšiť senzitivitu VEP na ON použili dve intenzity kontrastu. Hoci zistili vyššiu frekvenciu abnormálnych VEP s nižším kontrastom, v konečnom hodnotení zistili prípady s falošnou pozitivitou [26]. Watanabe et al študovali abnormality u pacientov s SM s ohľadom na prítomnosť AQP4-IgG protilátok v sére. V skupine s negatívnymi AQP4-IgG zistili v zhode s literárnymi dátami častejšie predĺženie latencie vlny P100, kým v skupine s pozitívnymi AQP4-IgG zistili vyššie percento pacientov s absenciou vlny P100 (p = 0,003) a výraznejšou progresiou zrakovej poruchy (OR = 35,432 %; p < 0,001) [27]. Neto et al [28] popísali v prevažne afrobrazílskej kohorte 19 pacientov s NMO/NMOSD ako typický nález vo VEP prevažujúce známky axonálneho postihnutia s vymiznutím VEP u 47,37 % vyšetrených očí. U 52,63 % očí, kde VEP bol prítomný, 90 % malo normálnu latenciu P100 a len 10 % malo latenciu P100 predĺženú. Kde bol VEP prítomný, 65% malo redukciu amplitúdy pod normálnu hodnotu (pod 5,8 μV). Tento nález však v kohorte kaukazskej populácie nebol potvrdený Ringelsteinom et al [29]. V kohorte 61 pacientov (43 NMO a 18 NMOSD s pozitivitou AQP4-IgG) v porovnaní s 81 zdravými zistili heterogénne nálezy. Celkom 41,9 % očí pacientov s NMO malo predĺžené latencie P100, 12,3 % pokles amplitúdy a 14 % absenciu odpovede, pričom popísal aj subklinické abnormality VEP. Frekvencia poklesu amplitúdy a absencia odpovede VEP bola však vyššia ako vo všetkých štúdiách s SM. Rozdiely v zisteniach v porovnaní s brazílskou štúdiou vysvetlili predpokladanými etnickými rozdielmi. Rozdiely medzi štúdiami boli však aj metodické (normálna amplitúda P100 v štúdii Ringelsteina et al bola 3,0 μV).
V 5-ročnej čínskej retrospektívnej štúdii Zhou et al [30] u 128 pacientov s ON s 35,2 % pozitívnymi AQP4-IgG zistili, že 5-ročná rekurencia ON bola u séropozitívnych 82,3 vs. 42,2 % u séronegatívnych (p < 0,001). Len 1,2 % séronegatívnych sa v priebehu 5 rokov vyvinulo do NMO s myelitídou, ale u séropozitívnych až 40 %. Otázku, či sú prítomné subklinické lézie optických nervov u NMO analyzovali Ringelstein et al v longitudinálej štúdii [31] u 167 pacientov. Retrospektívne analyzovali 203 očí u 102 pacientov s mediánom troch meraní VEP s mediánom 32 mesiacov sledovania. U pacientov bez jasnej ON zistili progresívne zhoršovanie v zmysle postupného predlžovania latencie P100 (nárast o 1,67 ms za rok) a poklesu amplitúdy P100–N140 v čase (pokles o 0,53 mV za rok). U pacientov s ON počas sledovania pozorovali nárast latencie P100 o 11,7 ms za rok a pokles amplitúdy P100–N140 o 1,23 mV za rok. Predlžovanie latencie a pokles amplitúdy bez prítomnosti klinicky zjavnej ON svedčí pre progredujúce poškodenie zrakového systému u NMO napriek klinickej stabilite.
Ohnari et al [32] na kohorte 28 japonských pacientov s NMOSD s pozitivitou AQP4-IgG popísali ako typický nález absenciu VEP a absenciu MEP na dolných končatinách. U 34 pacientov s RRSM bez pozitivity AQP4-IgG popísali predĺženie latencií EP. Pri vyšetrení VEP bez klinicky zjavnej ON u väčšiny pacientov s NMOSD neboli prítomné subklinické abnormality vo VEP, kým u väčšiny pacientov s RRSM boli prítomné. U žiadneho pacienta neboli prítomné abnormality v BAEP. Pri rovnakej dĺžke trvania NMOSD a RRSM bol vyšší EDSS u pacientov s NMOSD. Podľa ich názoru je možné oddiferencovať NMOSD od RRSM na základe nálezu v EP už vo včasnom štádiu choroby. Vzhľadom na to, že AQP4-IgGpozNMOSD je primárne astrocytopatia so stratou neurónov a sekundárnou demyelinizáciou, neprekvapuje, že vo VEP je typickým nálezom pokles amplitúdy a menej výrazné predĺženie latencie P100. Shen et al [33] popísali pomocou OCT a mfVEP rozdielne štrukturálne a funkčné poškodenia zrakovej dráhy u NMO a u SM. Predošlé štúdie [21–23] potvrdili, že poškodenie gangliových buniek retiny je typicky väčšie po ON u NMO ako po ON u SM. Shen et al našli pri ON u NMO výraznejšie stenčenie vnútornej kombinovanej plexiformnej vrstvy s gangliovými bunkami (GCIP) v sietnici v prípade ON u NMO v porovnaní s ON u SM. Pokiaľ u NMO neprebehla ON, tak sa nezistilo žiadne stenčenie GCIP. To svedčí pre to, že patologický proces u NMO je epizodický, viazaný na akútne ataky ON. U pacientov s ON pri SM zistili progresiu nálezu subklinicky aj bez klinicky zjavnej ON. Nález koreloval s vyššou prítomnosťou lézií v optickej radiácii v MR u SM v porovnaní s NMO a s výsledkami v OCT a mfVEP u SM bez ON. Z nálezov bol vyvodený predpoklad, že zachytenie progredujúcich lézií v predných úsekoch zrakovej dráhy s absenciou ON môže pomôcť odlíšiť SM od NMO a že táto subklinická progresia môže byť sčasti spôsobená mozgovými léziami a retrográdnou degeneráciou [34]. V topografickej analýze sa ukazuje, že pacienti s NMOSD majú najviac štrukturálnych a funkčných porúch vo foveálnej a perifoveálnej oblasti, kým u SM je poškodenie difúzne. Mikroštrukturálne abnormality u NMO vo foveálnej oblasti majú v OCT charakter cystických zmien. Fovea vykazuje vysoké nahromadenie aquaporín-4-pozitívnych Müllerových buniek, čím je daný biologický podklad uvedených nálezov. V štúdii Oertela [23] boli tieto foveálne stenčenia prítomné u pacientov bez ON u NMO aj vtedy, keď GCIP a vlákna optického nervu v retine boli bez pozoruhodností. Tento nález na sietnici môže tiež pomôcť odlíšiť NMO od SM. Pache et al porovnali rozdiely v nálezoch v prednom segmente optickej dráhy pri ON u 16 NMO pacientov s pozitívnymi AQP4-IgG a 16 NMOSD pacientov s pozitívnymi MOG-IgG, z ktorých 8 prekonalo ON [34]. Nezistili signifikantný rozdiel v hrúbke peripapilárnej vrstvy vláken optického nervu (pRNFL) a GCIP u oboch skupín pacientov. MOG-IgG pacienti mali vyšší počet ročných relapsov ON, s čím korelovala strata pRNFL a GCIP, táto nekorelovala s počtom relapsov u AQP4-IgG pozitívnych NMO pacientov. Kim et al [35] porovnali VEP a hrúbku pRNFL v OCT u 73 pacientov s AQP4-IgG pozitivitou. VEP bol citlivejší pre prvý atak ON (67 vs. 50 %; p = 0,041), kým pre ďalší atak bola citlivejšia OCT (95 vs. 83 %; p = 0,06). V zhode s predošlými štúdiami [33,34] našli koreláciu medzi klinickým postihnutím meraným EDSS a hrúbkou pRNFL. Zastávajú názor, že OCT a VEP by mohli byť vhodným nástrojom na monitorovanie priebehu NMOSD. Záverom konštatujú, že vzhľadom na zistenia by sa mal v dizajne a hodnotení štúdií zohľadňovať aj počet prekonaných ON. V ďalšej kombinovanej štúdii s použitím OCT a VEP u 57 SM pacientov a 50 NMOSD pacientov Vabanesi et al [36] zistili, že VEP častejšie nebol výbavný u pacientov s ON u NMOSD. Pokiaľ bol prítomný, predĺženie latencie P100 bolo menej výrazné ako u ON u SM pacientov. OCT bola citlivá na axonálne poškodenie, až 88 % očí po prvom ataku ON vykazovalo stenčenie RNFL pod 60 μm. Presnosť sa zvýšila po zavedení nového Z-skóre odvodeného od OCT-VEP indexu. Predpokladajú, že kombinované OCT/VEP štúdie môžu lepšie klasifikovať postihnutie ON a tým prispieť k diagnóze. Spomalenie vedenia s relatívne zachovanou RNFL je pravdepodobnejšie u SM, kým neuro-axonálna strata po ON, až s neprítomnosťou VEP, charakterizuje NMOSD. Aj keď je detekcia farieb zhoršená po ON u pacientov s SM, ekviluminantné chromatické (červená-zelená, modrá-žltá) a achromatické (čierno-biele) stimuly nevykazovali rozdielnu senzitivitu VEP [37]. Metodiky steady-state VEP a ffVEP/mfVEP na nízkokontrastné PR stimuly vyžadujú validáciu [38,39].
Motorické a somatosenzorické evokované potenciály u NMOSD
V aktuálnych diagnostických kritériách NMOSD z roku 2015 [11] nie sú MEP a SEP zahrnuté, tiež NEMOS v roku 2014 v svojich odporúčaniach pre diagnostiku a liečbu NMOSD konštatuje iba jednou vetou, že VEP, SEP a MEP by sa u pacientov s NMOSD mali realizovať. Použitie všetkých modalít EP u SM je vysoko senzitívny spôsob detekcie subklinických lézií, posudzovania závažnosti ochorenia a prognózovania u SM. Kým sa za posledné desaťročie objavilo viacero štúdií upriamujúcich sa na nálezy ffVEP a ich porovnaním s OCT a mfVEP u NMOSD, počet vedeckých prác, ktoré analyzujú MEP a SEP u NMOSD je podstatne nižší a úloha MEP a SEP u NMOSD s ohľadom na postihnutie miechy nebola zatiaľ jasne definovaná [9]. Cabrera-Gomez et al [40] popísali abnormálne SEP u 85,7 % kubánskych pacientov s NMO. V roku 2014 Tsao et al [41] retrospektívne študovali klinický obraz a nálezy u 30 pacientov s NMO. Abnormálny MEP bol zistený u 69,2 % pacientov, predĺžený centrálny kondukčný čas (CCT) koreloval s EDSS skóre v porovnaní s normálnymi odpoveďami (p = 0,027). Abnormálne SEP našli u 69,0 % pacientov. Pacienti s vyšším EDSS mali predĺžený CCT v porovnaní s pacientami s nižším EDSS (p = 0,019). U 11 pacientov s normálnym SEP n. tibialis len jeden pacient (9,1 %) mal relaps NMO v priebehu 6 mesiacov, kým osem zo 17 s abnormálnym SEP n. tibialis (47,1 %) mali relaps v sledovanom období (p = 0,049). MEP a SEP korelovali so závažnosťou ochorenia a SEP n. tibialis (z dolných končatín) sa javil ako vhodný prediktor frekvencie relapsov u NMO. Demura et al [42] v svojej štúdií porovnávali SEP n. tibialis (vlnu P40, v práci označovaná P38) s poruchou stability pomocou stabilografie u siedmich pacientov s NMO a siedmich pacientov s SM. Poruchy rovnováhy u SM sú multifaktoriálne, spôsobené svalovou slabosťou, spasticitou, kognitívne-motorickou interferenciou a poruchou časovania svalovej aktivity. V minulosti bol popísaný výrazný podiel narušenej somatosenzorickej konduktivity v poruchách rovnováhy u SM. Lishmann v roku 1975 popísal úlohu zrakového systému v udržiavaní rovnováhy, ktorá je nadradená vestibulárnemu a somatosenzorickému systému [43]. Demura et al u pacientov s NMO zistili závažnejšie poruchy stability ako u pacientov s SM, čo korelovalo s LETM u pacientov s NMO. Tiež zistili, že pík latencie vlny P40 korigovaný podľa výšky pacienta koreloval s power spektrami v strednom frekvenčnom pásme v antero-posteriórnej osi výchyliek, čo svedčí pre poruchy postoja a rovnováhy spôsobené poruchou hlbokej citlivosti pri postihnutí dlhých dráh pri LETM [42]. Rombergov kvocient (porovnáva výsledky merania rovnováhy s otvorenými a zatvorenými očami, a to veľkosť dráhy alebo veľkosť plochy, ktorú opíše ťažisko tela pacienta, čím upozorňuje na možnosť periférnej, centrálnej alebo zmiešanej poruchy postoja) bol výrazne vyšší u pacientov s NMO s kmeňovými léziami, ako bez nich. So stupňom poruchy rovnováhy u NMO však nekorelovali power spektra vo vysokom frekvenčnom pásme (cerebelárna dysfunkcia) a nízkom frekvenčnom pásme (kombinovaná cerebelárna a somatosenzorická dysfunkcia). Zhou et al [30] v multivariačnej analýze v svojej 5-ročnej retrospektívnej štúdii ON zistili u AQP4-IgG seropozitívnych pacientov dva rizikové faktory pre LETM: bolesť oka a rekurencia ON do jedného roka.
V multimodalitnej štúdii Ohnari et al v roku 2016 [32] popísali okrem VEP aj typické nálezy v SEP a MEP u 18 pacientov s NMOSD a 28 pacientov s RRSM. Typickým nálezom bola absencia VEP a MEP na dolných končatinách u pacientov s NMOSD, kým u pacientov s RRSM boli prítomné predĺžené centrálne kondukčné časy. Pacienti s NMOSD nemali subklinické poruchy v MEP a SEP, ale pacienti s RRSM mali tieto subklinické poruchy časté. U pacientov s NMOSD nezistili žiadne abnormity v BAEP, kým u RRSM boli prítomné. Na základe svojich zistení konštatujú, že pomocou multimodalitných EP je možné odlíšiť RRSM od NMOSD už vo včasných štádiách ochorenia. Lézie u SM sú lokalizované hlavne v bielej hmote miechy, kde sú uložené senzitívne a motorické dráhy, a sú s vysokou senzitivitou detekované pomocou EP aj u asymptomatických SM pacientov. Na druhej strane pacienti s NMOSD len zriedka majú abnormálne EP z asymptomatických miest. Väčšina symptomatických pacientov s NMOSD má abnormálne EP, ako aj pacienti s RRSM. Tieto nálezy môžu odrážať patofyziologické rozdiely medzi NMOSD a SM, a to rozdielnu lokalizáciu lézii v sivej resp. bielej hmote. Lézie u SM sa v MR typicky nachádzajú v bielej hmote miechy [44]. Patologické štúdie potvrdili u SM progresívny charakter demyelinizačných lézií bielej hmoty a axonálnej neurodegenerácie už vo včasných klinických štádiách. Pre SM sú typické asymptomatické lézie bielej hmoty, ktoré s vysokou senzitivitou detekujú EP. Pre NMOSD sú naopak typické zápalové, nekrotizujúce lézie bielej aj sivej hmoty bez výraznej progredujúcej demyelinizácie, čím sa NMOSD klinicky prezentuje ako relabujúce ochorenie, bez chronicky progresívnej deteriorácie, s čím môže súvisieť aj neprítomnosť subklinických abnormalít v EP.
Záver
VEP boli v posledných rokoch dostatočne študované u NMO/NMOSD a poukazujú na rozdiely medzi klasickými obrazmi u RRSM a nálezmi u NMO/NMOSD, kde odpovede sú viac heterogénnejšie. Nanešťastie, v súčasnosti nemáme jediné vyšetrenie vizuálneho systému, ktoré by dokázalo jednoznačne odlíšiť ON u NMO/NMOSD od RRSM. Najčastejšími abnormalitami u NMO/NMOSD sú redukcia amplitúdy vlny P100 a absencia odpovede, u SM prevažuje predĺženie latencie vlny P100 (obr. 1, 2). Vo svetle nových poznatkov sa v diagnostike a prognóze ON u NMOSD javia prínosné multimodalitné vyšetrenia pomocou ffVEP, OCT a mf VEP, hoci v súčasnosti nie sú súčasťou formálnych kritérií NMO/NMOSD.
Fig. 1. Visual evoked potentials in a patient diagnosed as NMOSD.
Sixty-year-old woman with acute onset of spastic paraplegia and loss of sensitivity under L1 segment in 10/2013 with MR fi nding
of extensive intramedular lesion in segments C5–T7. VEP were still normal (A). Three month later she presented with visual loss in the
left eye, there was a pathology bilaterally in VEP with P100 amplitude decrease – more pronounced left, pathological confi guration of
NPN complex left, mild prolongation of P100 latency bilaterally compared with last examination (B).
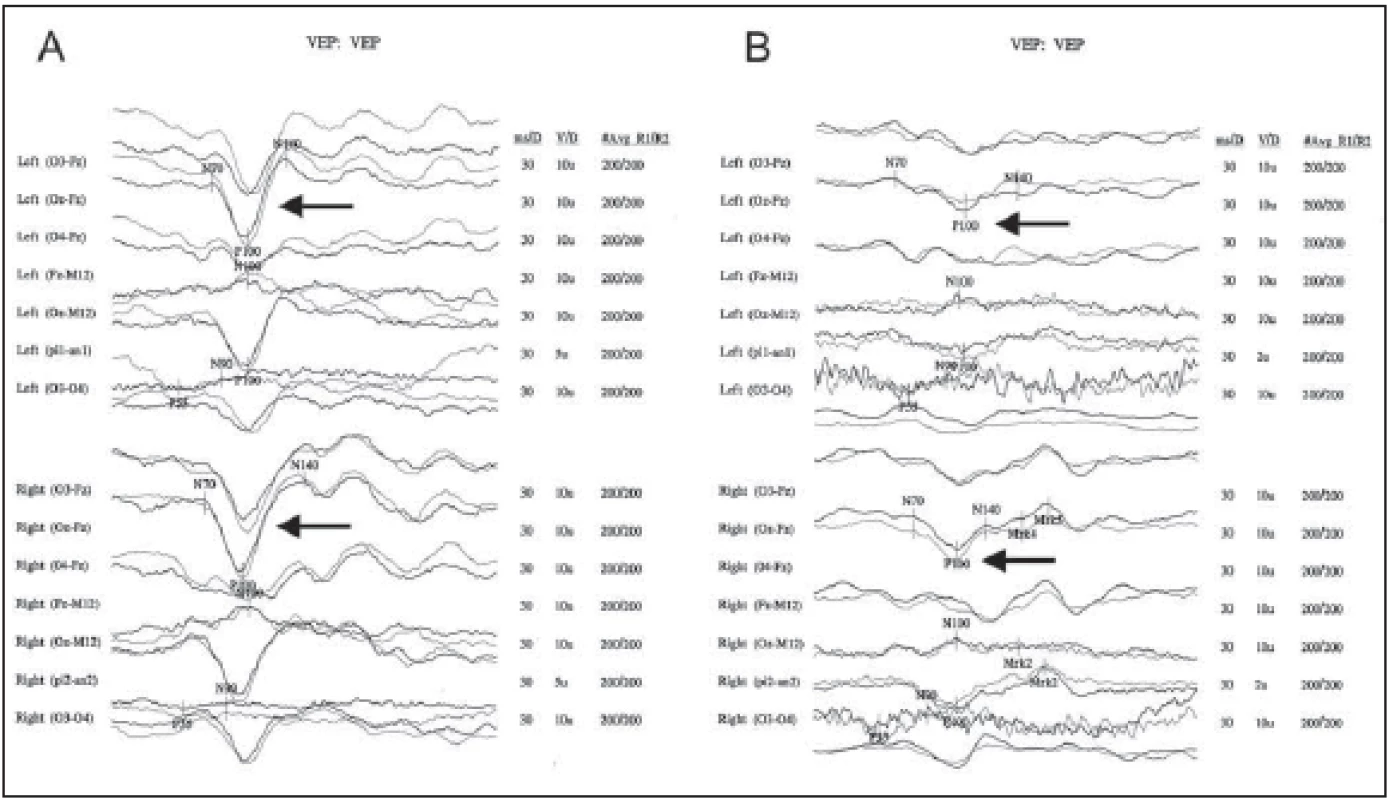
NMOSD – neuromyelitis optica spectrum disorder; NPN complex – complex of three vawes: negative-positive-negative; P100 – positive vawe
with latency of 100 ms; VEP – visual evoked potential
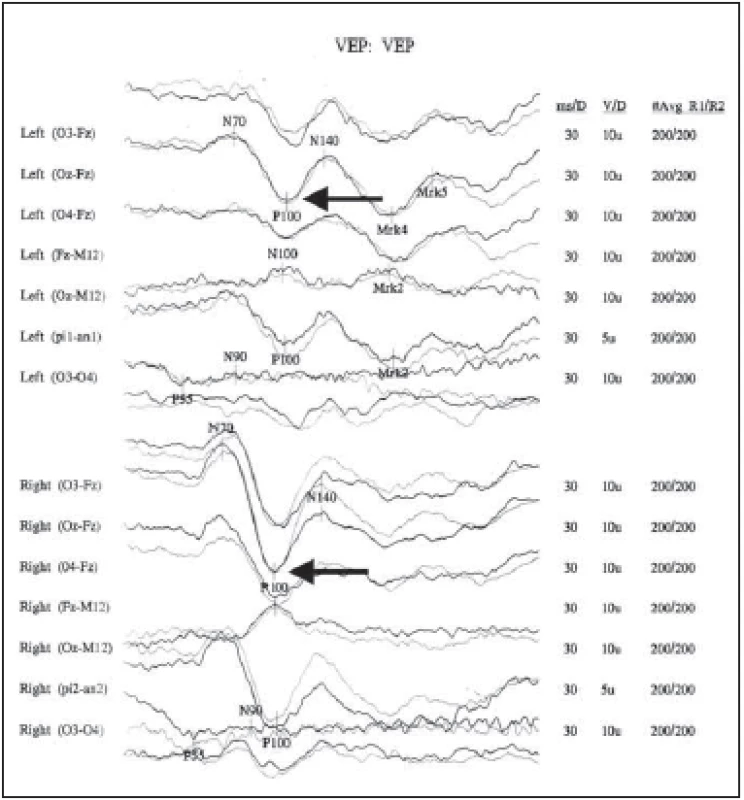
Fig. 2. Visually evoked potentials in a patient with a confi rmed diagnosis of multiple
sclerosis, with prolonged latency and decreased amplitude of P 100 wave in the left eye.
V štúdiách dobre korelovali nálezy VEP a MEP, resp. SEP z dolných končatín u pacientov s LETM z hľadiska disability. V novších MR štúdiách s použitím difúzneho tenzorového zobrazenia (DTI) sa zistilo u pacientov s NMO/NMOSD výrazné postihnutie bielej aj sivej hmoty miechy, ktoré nie je viditeľné na konvenčnom MR (T1W a T2W) [47,48]. MEP a SEP, predovšetkým z dolných končatín, v štúdiách vykazujú vysokú senzitivitu na lézie u NMO/NMOSD, dobre korelujú so stupňom disability meraným EDSS a majú schopnosť presnejšie zachytiť závažnosť a rozsah patologického procesu miechy ako konvenčné MR. EP u NMO/NMOSD odrážajú závažnosť postihnutia CNS, kým u RRSM slúžia na detekciu subklinických lézií a latentnej progresie ochorenia. U NMOSD sú naopak nálezy abnormalít v EP u asymptomatických lézií zriedkavé. Tým sa MEP a SEP stávajú ďalším parametrom, ktorý môže pomôcť odlíšiť NMO/NMOSD a RRSM.
Abnormálne BAEP sa popisujú pri RRSM až u tretiny pacientov, hoci nemajú poruchu sluchu, respektíve majú len ľahkú hypakúzu. U NMO/NMOSD bývajú BAEP normálne, aj keď pacienti majú kmeňové príznaky (čkanie a nauzea), s výnimkou jednej kubánskej štúdie [13] a jednej japonskej štúdie, kde mali pacienti zároveň poruchu sluchu, bez MR detekovateľnej lézie v kmeni [47]. Preto by mohli byť BAEP dôležité pre oddiferencovanie RRSM, kde sú abnormálne BAEP nálezy časté už v skorých štádiách ochorenia, od NMO/NMOSD, kde sú BAEP normálne.
V svetle súčasných poznatkov by sme sa v diagnostike a stanovení prognózy pacientov s NMO/NMOSD mali vyhnúť chybám, ktoré môžu vzniknúť pri interpretácii nálezov EP u NMO/NMOSD ako i u RRSM. Aj keď multimodalitné EP v súčasnosti nie sú súčasťou formálnych diagnostických kritérií NMOSD, ich úloha v diagnostike, monitorovaní priebehu, efektu liečby a určení prognózy NMOSD je nespochybniteľná. Pre hlbšie pochopenie a objasnenie postavenia EP v diagnostike NMO/NMOSD sú však potrebné ďalšie, predovšetkým prospektívne, randomizované štúdie.
Konflikt záujmov
Autori deklarujú, že v súvislosti s predmetom štúdie nemajú žiadny konflikt záujmov.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. MUDr. Gabriela Timárová, Ph.D., MPH
II. neurologická klinika
LF UK a UN Bratislava
Nemocnica ak. L. Dérera
Limbová 5
83305 Bratislava
Slovensko
e-mail: gabriela.timarova@kr.unb.sk
Sources
1. Wingerchuk DM, Lennon VA, Lucchinetti CF et al. The spectrum of neuromyelitis optica. Lancet Neurol 2007; 6 (9): 805–815. doi: 10.1016/S1474-4422 (07) 70216-8.
2. Wingerchuk DM, Lennon VA, Pittock SJ et al. Revised diagnostic criteria for neuromyelitis optica. Neurology 2006; 66 (10): 1485–1489. doi: 10.1212/01.wnl.0000216139.44259.74.
3. Nytrová P, Kleinová P, Preiningerová Lízrová J et al. Neuromyelitis optica a poruchy jejího širšího spektra – retrospektivní analýza klinických a paraklinických nálezů. Cesk Slov Neurol N 2015; 78/111 (1): 72–77. doi: 10.14735/amcsnn201572.
4. Marrie RA and Gryba C. The incidence and prevalence of neuromyelitis optica: a systematic review. Int J MS Care 2013; 15 (3): 113–118. doi: 10.7224/1537-2073.2012-048.
5. Pandit L, Asgari N, Apiwattanakul M et al. Demographic and clinical features of neuromyelitis optica: a review. Mult Scler 2015; 21 (7): 845–853. doi: 10.1177/135245851 5572406.
6. Jarius S, Wildemann B. AQP4 antibodies in neuromyelitis optica: diagnostic and pathogenetic relevans. Nat Rev Neurol 2010; 6 (7): 383–392. doi: 10.1038/nrneurol.2010.72.
7. Sellner J, Boggild M, Clanet M et al. EFNS Guidelines on diagnosis and management of neuromyelitis optica. Eur J Neurol 2010; 17 (8): 1019–1032. doi: 10.1111/j.1468-1331.2010.03066.x.
8. Bot JC, Barkhof F, Polman CH et al. Spinal cord abnormalities in recently diagnosed MS patients added value of spinal MRI examination. Neurology 2004; 62 (2): 226–233. doi: 10.1212/wnl.62.2.226.
9. Lee DH, Metz I, Berthele A et al. Supraspinal demyelinating lesions in neuromyelitis optica display a typical astrocyte pathology. Neuropathol Appl Neurobiol 2010; 36 (7): 685–687. doi: 10.1111/j.1365-2990.2010.01105.x.
10. Trebst C, Jarius S, Berthele A et al. Update on the diag-nosis and treatment of neuromyelitis optica: recommendations on the Neuromyelitis Optica Study Group (NEMOS). J Neurol 2014; 261 (1): 1–16. doi: 10.1007/s00415-013-7169-7.
11. Wingerchuk DM, Banwell B, Bennett JL et al. International Panel for NMOSD. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015; 85 (2): 177–189. doi: 10.1212/WNL.0000000000001729.
12. Leoncani L, Guerrieri S, Comi G. Visual evoked potentials as a biomarker in multiple sclerosis and associated optic neuritis. J Neuro Ophtalmology 2018; 38 (3): 350–357. doi: 10.1097/WNO.0000000000000704.
13. Cabrera-Gomez JA, Kurtzke JF, Gonzalez-Quevedo A et al. An epidemiological study of neuromyelitis optica in Cuba. J Neurol 2009; 256 (1): 35–44. doi: 10.1007/s00415-009-0009-0.
14. Kanzaki M, Mochizuki H, Ogawa G et al. Clinical features of opticospinal multiple sclerosis with anti-aquaporin 4 antibody. Eur Neurol 2008; 60 (1): 37–42. doi: 10.1159/000127978.
15. Cigánek L. Zrakové evokované potenciály vyvolané zábleskom. In: Cigánek L (ed). Evokované potenciály a ich využitie v klinickej praxi. 1st ed. Bratislava: Osveta 1991: 22–51.
16. Halliday AM, McDonald WI et al. Visual evoked response in diagnosis of multiple sclerosis. Br Med J 1973; 4 (5893): 661–664. doi: 10.1136/bmj.4.5893.661.
17. Holder GE, Celesia GG, Miyake Y et al. International Federation of Clinical Neurophysiology. International Federation of Clinical Neurophysiology: recommendations for visual system testing. Clin Neurophysiol 2010; 121 (9): 1393–1409. doi: 10.1016/j.clinph.2010.04.010.
18. Odom JV, Bach M, Brigell M et al. International Society for Clinical Electrophysiology of Vision. ISCEV standard for clinical visual evoked potentials: (2016 update). Doc Ophthalmol 2016; 133 (1): 1–9. doi: 10.1007/s10633-016-9553-y.
19. Baseler HA, Sutter EE, Klein SA et al. The topography of visual evoked response properties across the visual field. Electroencephalogr Clin Neurophysiol 1994; 90 (1): 65–81. doi: 10.1016/0013-4694 (94) 90114-7.
20. Hradílek P, Vlček F, Zapletalová O et al. Vyšetření vizuálních evokovaných potenciálů a sonografické vyhodnocení orbitální hemodynamiky u akutní unilaterální optické neuritidy. Cesk Slov Neurol N 2007; 70/103 (1): 78–83.
21. Ratchford JN, Quigg ME, Conger A et al. Optical coherence tomography helps differentiate neuromyelitis optica and MS optic neuropathies. Neurology 2009; 73 (4): 302–308. doi: 10.1212/WNL.0b013e3181af78b8.
22. Bennett JL, de Seze J, Lana-Peixoto M et al. Neuromyelitis optica and multiple sclerosis seeing differences through optical coherence tomography. Mult Scler 2015; 21 (6): 678–688. doi: 10.1177/1352458514567216
23. Oertel FC, Kuchling J, Zimmermann H et al. Microstructural visual system changes in AQP4-antibody-seropositive NMOSD. Neurol Neuroimmunol Neuroinflamm 2017; 4 (3): e334. doi: 10.1212/NXI.0000000000000334.
24. Frederiksen JL, Petrera J. Serial visual evoked potentials in 90 untreated patients with acute optic neuritis. Surv Ophthalmol 1999; 44 (Suppl 1): S54–S62. doi: 10.1016/s0039-6257 (99) 00095-8.
25. Naismith RT, Tutlam NT, Xu J et al. Optical coherence tomography is less sensitive than visual evoked potentials in optic neuritis. Neurology 2009; 73 (1): 46–52. doi: 10.1212/WNL.0b013e3181aaea32.
26. Davidson AW, Scott RF, Mitchell KW. The effect of contrast reduction on pattern-reversal VEPs in suspected multiple sclerosis and optic neuritis. Docum Ophthalmol 2004; 109 (2): 157–161. doi: 10.1007/s10633-004-3831-9.
27. Watanabe A, Matsushita T, Doi H et al. Multimodality-evoked potential study of anti-aquaporin-4 antibody-positive and -negative multiple sclerosis patients. J Neurol Sci 2009; 281 (1–2): 34–40. doi: 10.1016/j.jns.2009.02.371.
28. Neto SP, Alvarenga RM, Vasconcelos CC et al. Evaluation of pattern-reversal visual evoked potential in patients with neuromyelitis optica. Mult Scler 2013; 19 (2): 173–178. doi: 10.1177/1352458512447597.
29. Ringelstein M, Kleiter I, Ayzenberg I et al. Visual evoked potentials in neuromyelitis optica and its spectrum disorders. Mult Scler 2014; 20 (5): 617–620. doi: 10.1177/1352458513503053.
30. Zhou H, Zhao S, Yin D et al. Optic neuritis: a 5-year follow-up study of Chinese patients based on aquaporin-4 antibody status and ages. J Neurol 2016; 263 (7): 1382–1389. doi: 10.1007/s00415-016-8155-7.
31. Ringelstein M, Harmel J, Zimmermann H et al. Longitudinal optic neuritis-unrelated visual evoked potential changes in NMO spectrum disorders. Neurology 2020; 94 (4): e407–e418. doi: 10.1212/WNL.0000000000008684.
32. Ohnari K, Okada K, Takahashi T et al. Evoked potentials are usefull for diagnosis of neuromyelitis optica spectrum disorders. J Neuro Sci 2016; 364: 97–101. doi: 10.1016/j.jns.2016.02.060.
33. Shen T, You Y, Arunachalam S et al. Differing structural and functional patterns of optic nerve damage in multiple sclerosis and neuromyelitis optica spectrum disorder. Ophthalmology 2019; 126 (3): 445–453. doi: 10.1016/j.ophtha.2018.06.022.
34. Pache F, Zimmermann H, Mikolajczak J et al. MOG--IgG in NMO and related disorders: a multicenter study of 50 patients. Part 4: afferent visual system damage after optic neuritis in MOG-IgG-seropositive versus AQP4--IgG-seropositive patients. J Neuroinflam 2016; 13 (1): 282. doi: 10.1016/j.hrthm.2015.08.022.
35. Kim N, Kim J, Park C et al. Optical coherence tomography versus visual evoked potentials for detecting visual pathway abnormalities in patients with neuromyelitis optica spectrum disorder. J Clin Neurol 2018; 14 (2): 200–205. doi: 10.3988/jcn.2018.14.2.200.
36. Vabanesi M, Pisa M, Guerrieri S et al. In vivo structural and functional assessment of optic nerve damage in neuromyelitis optica spectrum disorders and multiple sclerosis. Sci Reports 2019; 9 (1): 10371. doi: 10.1038/s41598-019-46251-3.
37. Sartucci F, Murri L, Orsini C et al. Equiluminant red-green and blue-yellow VEPs in multiple sclerosis. J Clin Neurophysiol 2001; 18 (6): 583–591. doi: 10.1097/00004691-200111000-00010.
38. Norcia AM, Appelbaum LG, Ales JM et al. The steady-state visual evoked potential in vision research: a review. J Vis 2015; 15 (6): 4. doi: 10.1167/15.6.4.
39. Frohman AR, Schnurman Z, Conger A et al. Multifocal visual evoked potentials are influenced by variable contrast stimulation in MS. Neurology 2012; 79 (8): 797–801. doi: 10.1212/WNL.0b013e3182661edc.
40. Cabrera-Gomez JA, Kurtzke JF, Gonzales-Quevedo A et al. An epidemiological study of neuromyelitis optica in Cuba. J Neurol 2009; 256 (1): 35–44. doi: 10.1007/s00415-009-0009-0.
41. Tsao WC, Lyu RK, Ro LS et al. Clinical correlations of motor and somatosensory evoked potentials in neuromyelitis optica. PLOS 2014; 9 (11): e113631. doi: 10.1371/journal.pone.0113631.
42. Demura Y, Kinoshita M, Fukuda O et al. Imbalance in multiple sclerosis and neuromyelitis optica: association with deep sensation disturbance. Neurol Sci 2016; 37 (12): 1961–1968. doi: 10.1007/s10072-016-2697-4.
43. Lee DN, Lishman JR. Visual proprioceptive control of stance. J Hum Move Stud 1975; 1 (2): 87–95.
44. Kim HJ, Paul F, Lana-Peixoto MA et al. MRI characteristics of neuromyelitis optica spectrum disorder an international update. Neurology 2015; 84 (11): 1165–1173. doi: 10.1212/WNL.0000000000001367.
45. Rivero RL, Oliveira EM, Bichuetti DB et al. Diffusion tensor imaging of the cervical spinal cord of patients with neuromyelitis optica. Magn Reson Imaging 2014; 32 (5): 457–463. doi: 10.1016/j.mri.2014.01.023.
46. Qian W, Chan Q, Mak H et al. Quantitative assessment of the cervical spinal cord damage in neuromyelitis optica using diffusion tensor imaging at 3 Tesla. J Magn Reson Imaging 2011; 33 (6): 1312–1320. doi: 10.1002/jmri.22575.
47. Takanashi Y, Misu T, Oda K et al. Audiological evidence of therapeutic effect of steroid treatment in neuromyelitis optica with hearing loss. J Clin Neurosci 2014; 21 (12): 2249–2251. doi: 10.1016/j.jocn.2014.04.019.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2020 Issue supplementum 1
Most read in this issue
- Nálezy na magnetické rezonanci u neuromyelitis optica a onemocnění jejího širšího spektra
- Laboratorní vyšetření u neuromyelitis optica a onemocnění jejího širšího spektra
- Epidemiologie, klinický obraz a průběh onemocnění u neuromyelitis optica a onemocnění jejího širšího spektra
- Diferenciální diagnostika neuromyelitis optica a onemocnění jejího širšího spektra
