Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody
Authors:
P. Kešnerová 1,2; D. Viszlayová 3,4,5; D. Školoudík 2,6
Authors‘ workplace:
Neurologická klinika 2. LF UK a FN Motol, Praha
1; Neurologická klinika 1. LF UK a VFN v Praze
2; Neurologická klinika FN a FSVaZ UKF, Nitra
3; Neurologická klinika LF UP, Olomouc
4; Neurologická klinika LF UK, Hradec Králové
5; Centrum vědy a výzkumu, Fakulta zdravotnických věd, UP Olomouc
6
Published in:
Cesk Slov Neurol N 2018; 81(4): 378-391
Category:
Minimonography
doi:
https://doi.org/10.14735/amcsnn2018378
Overview
Aterosklerotická stenóza karotidy je známý rizikový faktor ischemické CMP nebo tranzitorní ischemické ataky. Změny v aterosklerotickém plátu typu krvácení do plátu, neovaskularizace, velký podíl lipidů, tenká nebo prasklá fibrózní čepička či zánět hrají pravděpodobně významnou roli v nestabilitě plátu a jsou spojeny s vyšším rizikem ischemické CMP. V současnosti neexistuje modalita, která by byla schopna současně přesně změřit stupeň stenózy a spolehlivě detekovat nestabilní aterosklerotický plát. K přesné a detailní analýze morfologie plátu je potřeba využít kombinaci jednotlivých metod. CT je široce dostupná a často první zobrazovací metoda plátu se schopností detekovat kalcifikace, ulceraci plátu a stupeň stenózy. Nicméně rozlišení mezi kumulací lipidů a krvácením do plátu je nízké. MR má schopnost rozpoznat většinu nestabilních morfologických znaků plátu, ale časová náročnost, pohybové artefakty a absence unifikovaných protokolů jsou komplikací pro širší použití. PET je efektivní nástroj k detekci metabolických procesů v plátu, zejména zánětu, ale prostorové rozlišení je nepřesné. Ultrazvuk je široce dostupná a levná metoda k monitoringu vývoje plátu, zejména za použití 3D módu, ale pro rozlišení jednotlivých znaků plátu je suboptimální. Budoucí vývoj ultrazvukových metod, např. počítačová analýza škály šedi a kontrastní ultrazvuk však výhledový potenciál ultrazvuku významně zlepšuje.
Klíčová slova:
ateroskleróza – nestabilní plát – karotická tepna – iktus – ultrazvuk
Úvod
Ateroskleróza karotické tepny je častá a relativně dobře známá příčina CMP a představuje jeden z hlavních cílů prevence iktu [1]. Ateromové pláty v karotických arteriích přispívají různým mechanizmem minimálně k 10–30 % všech ischemických CMP a tranzitorních ischemických atak (TIA). V současnosti, kromě klinických symptomů, je tíže karotické stenózy hlavním parametrem ovlivňujícím pacientovu léčbu, a to včetně rozhodnutí o intervenčním řešení. Toto paradigma, jež je užíváno po desetiletí, bylo již v minulosti mnohokrát zpochybňováno a přibývají důkazy, že složení a charakter karotického plátu hrají klíčovou roli v jeho stabilitě a riziku vzniku ipsilaterální CMP [1].
V posledních dekádách bylo diagnostické úsilí cíleno především na metody zjišťující procento stenózy se zhodnocením přesnosti diagnostiky. Úspěch v kvantifikaci stenózy však ozřejmil, že zúžení cévy není jediným rizikovým faktorem iktu a že mezi procentem karotické stenózy a rizikem ipsilaterálního iktu není lineární závislost, a to zejména u asymptomatických stenóz [1].
Současná doporučení na podkladě rozsáhlých studií dávají přednost intervenční léčbě především u těžké symptomatické stenózy (nad 70 %), u vybraných pacientů lze indikovat intervence také u stenózy nad 50 % [2]. Vyšší riziko CMP se však vyskytuje i u méně významných stenóz, mnohdy pod 50 % [3]. Naopak mnoho pacientů s asymptomatickou stenózou vysokého stupně nedostane iktus ani po dlouhé době sledování. Zde může hrát významnou roli kromě patofyziologie vývoje stenózy a rozvoje kolaterálního řečiště také medikamentózní léčba, tzv. best medical treatment (BMT) [4].
Díky tomu dlouhodobě narůstá zájem o nové diagnostické metody s možností detekce vysoce rizikového (nestabilního) karotického plátu [5,6]. Tento zájem vedl k detailnějšímu prozkoumání povrchu plátu a jeho objemu s cílem změřit plát jako celek, což znamená i kvantifikaci plátu a nejen ohodnocení stupně stenózy, tedy pouze změření nejužší části lumina cévy. Nemalé úsilí bylo zaměřeno na analýzu složení plátu odhalující charakteristiky plátu, které mohou znamenat zranitelnost či nestabilitu plátu a znamenají tak rovněž kvalitativní ohodnocení plátu.
Definovat „vulnerabilní“ či „nestabilní“ plát bylo předmětem mnoha vědeckých aktivit. Histologické nálezy z aterosklerotických plátů získaných při karotické endarterektomii (CEA) byly analyzovány a následně porovnávány se vzorky z předchozích in vivo provedených zobrazovacích metod. Navzdory nezpochybnitelnému úspěchu v definování určitých rizikových znaků plátu si musíme uvědomit, že důležitá data postrádáme, jelikož získané vzorky jsou především od symptomatických pacientů se středním až těžkým stupněm stenózy. A to s celkem variabilním intervalem mezi chirurgickým odstraněním plátu a ischemickou událostí, která může velmi významně ovlivnit výsledek histopatologického nálezu [7].
V současnosti již jsou identifikovány první morfologické charakteristiky vysoce rizikového plátu v karotidě. Jedná se především o ulcerace povrchu plátu, na lipidy bohatou nekrotickou oblast (lipid rich necrotic core; LRNC), zúženou nebo prasklou fibrózní čepičku (fibrous cap; FC), krvácení do plátu (intraplaque haemorrhage; IPH), neovaskularizaci plátu (intraplaque neovascularization; IPN) a zánětlivé změny [8–11].
Jako významné faktory progrese aterosklerotického plátu byly identifikovány tíže (procento) stenózy, tandemová stenóza, progrese celkové plochy plátu (total plaque area; TPA), resp. celkového objemu plátu (total plaque volume; TPV) [12–15].
Při hodnocení celkového rizikového potenciálu plátu je potřeba také zahrnout jeho emboligenní potenciál prostřednictvím detekce mikroembolických signálů při transkraniálním dopplerovském monitoringu (TCD) [16,17] a zobrazením ischemických ložisek mozku jako známek embolizace do mozkových tepen [18,19].
Detekce znaků nestability aterosklerotického plátu lze využít při identifikaci etiologie ischemické CMP. Největší význam je zde u kryptogenních CMP, jejichž incidence se odhaduje až na 30 % všech ischemických CMP. Lze předpokládat, že část těchto iktů by mohla být přisouzena nestenózujícímu karotickému onemocnění s přítomností nestabilního plátu. Pilotní studie ukazují, že by to mohla být až jedna třetina všech kryptogenních ischemických iktů. Nicméně je potřeba vyčkat výsledků velkých multicentrických studií, které by měly tuto hypotézu verifikovat [20,21].
Detekce nestabilních znaků plátu, vývoj plátu v čase stejně jako jeho emboligenní potenciál jsou cílem diagnostického úsilí k odhalení potenciálně nestabilního stadia plátu, které by optimálně vedlo ke změně terapie s cílem stabilizovat nebo eliminovat takový plát a tím předcházet riziku iktu. Metody, dostupné v dnešní klinické praxi mají rozdílný potenciál odhalit jednotlivé známky nestability. V této práci poskytujeme přehled těch, které se používají rutinně: CT, MR, ultrazvuk (US) a jeho rozličné modality – dvoudimenzionální (2D) a třídimenzionální (3D) US, vyšetření s echokontrastem (contrast enhanced ultrasound, CEUS), a dále TCD a PET. U každé metody uvádíme specifikace diagnostických výhod a limitaci každé z nich v detekci nestabilních znaků plátu a rovněž v monitoringu dynamiky plátu. K poskytnutí komplexního přehledu zobrazovacích metod aterosklerotického karotického onemocnění se okrajově zmiňujeme o některých z experimentálních metod. Těmi jsou intravaskulární US (IVUS), optická koherenční tomografie (OCT), mikrooptická koherenční tomografie (μOCT) a blízká infračervená spektroskopie (near infrared spectroscopy; NIRS).
Detailní analýza karotického plátu by následně mohla pomoci optimalizovat terapeutický přístup u pacientů s aterosklerotickým postižením karotidy, zpřesnit selekci pacientů vhodných pro karotickou revaskularizaci a identifikovat pacienty, u kterých by byla indikována změna konzervativní léčby – nasazení nebo eskalace terapie [6].
Počítačová tomografie
Technické provedení
K detekci plátu se užívají dvě základní techniky CTA: konvenční jednozdrojová CT (rovněž zvaná multidetektorová CT; MDCT) a dvouzdrojová CT (dual source CT; DSCT). Společné pro obě techniky je nezbytnost podání jodové kontrastní látky, aby došlo k dostatečné vizualizaci plátu a použití rentgenového záření, jehož atenuace je kvantifikována v Hounsfieldových jednotkách (HU). Výsledný obraz je reprezentován ve stupnici šedi. Rozdíl metod je v energii a počtu užívaných zářičů a rovněž v postprocedurálním zpracování obrazu.
Při konvenční CT jeden zdroj rentgenového záření poskytuje reprezentaci objektů na podkladě lineárního atenuačního koeficientu každé z anatomických struktur a je nezávislá na materiálové denzitě a hmotnostním koeficientu útlumu. Toto představuje limitaci pro tkáňovou specifikaci. Na dvouzdrojovém CT dosahujeme dvou rozdílných HU z jedné anatomické struktury tím, že jsou aplikovány dvě odlišné energie rentgenového záření, které vedou k energeticky dependentním změnám v atenuaci různých tkání. Rozlišení tkání je tedy daleko detailnější, jelikož atenuační rozdíl mezi vysoko- a nízkodávkovým zdrojem záření odhaluje více nuancí v tkáňové charakteristice. Typickým příkladem je rozlišení mezi reziduem jodového kontrastu a kalcia, který nemusí být snadno rozpoznatelný na konvenční CT, jelikož při tomto vykazují obě složky stejnou atenuaci. Na duální CT však získáme atenuační rozdíl, jelikož atenuace jodu stoupá rychleji než atenuace kalcia. Tento princip umožňuje lepší rozlišení zobrazených struktur. Další velkou výhodou DSCT je subtrakce kostní tkáně, která poskytuje lepší zobrazení vaskulatury [22].
Obě CT modality dovolují multiplanární rekonstrukce ve všech třech rovinách, vysoké prostorové rozlišení a přesnou identifikaci plátu, a to zejména pokud je použit bolus kontrastní látky [23].
Výpočetně tomografická angiografie není jediná rentgenová metoda, která se k zobrazení aterosklerotického postižení tepen používá. Dlouhodobě zlatým standardem je digitální subtrakční angiografie (DSA). Nicméně, navzdory častému využití při cerebrovaskulárním zobrazování je samotná vizualizace plátu limitována na povrchové iregularity a kvantifikaci stupně stenózy. V tomto bodě však poskytuje stejné informace i konvenční CT a je vhodnější na skríning [24]. DSA nezobrazuje detailně morfologii plátu, je limitována 2D zobrazením a v detekci vulnerabilního plátu je to spíše marginální metoda, taktéž pro svou časovou a rentgenovou zátěž.
Detekce nestabilního plátu
Výpočetně tomografická angiografie je dobře ověřená metoda ke zhodnocení stupně karotické stenózy se schopností zobrazit všechny cévy aortálního oblouku. A to zejména intrakraniální cirkulaci, vč. tortuozit a jiných anatomických abnormit. Co se týče zobrazování struktury karotického plátu, výzkum možností CT je nyní na vzestupu, zejména díky jeho široké dostupnosti v rutinní praxi. Považuje se za velice senzitivní metodu k detekci kalcifikací [25], které jsou zobrazitelné jako vysoce denzitní signály uvnitř plátu. V současnosti se považuje kalcifikovaný plát za relativně stabilní, nicméně chybí prospektivní studie k potvrzení této hypotézy. MDCT je schopna spolehlivě detekovat kalcifikace s průměrnou hodnotou 250 HU, pro rozlišení od jodového kontrastu lze využít DSCT, jak je popsáno výše [22].
Velmi dobré výsledky CTA jsou při detekci povrchových ulcerací nad 1 mm [26], kde CT dobře koreluje s DSA. MDCT detekuje ulcerace se střední až dobrou senzitivitou (60–94 %) i specificitou (70–99 %), pokud byly tyto srovnávány s histologickým nálezem [27].
Porušená FC bývá dávána do souvislosti s vulnerabilním charakterem plátu a lze ji detekovat jako kontrastní sycení v oblastech nerovností povrchu. Ve studii autorů Saba et al byla potvrzena signifikantní asociace mezi porušenou FC a kontrastním sycením nerovností plátu (κ = 0,855) [25,28].
Co se týče dalších charakteristik plátu, IPH, neovaskularizace, LRNC a fibrózní tkáň jsou detekovatelné jako struktury s nízkou denzitou. Dochází zde ale k významnému překryvu mezi těmito hypodenzními strukturami, což limituje využití této metody v analýze plátu. Nicméně, CTA ukazuje signifikantní dobrou korelaci s histologickými nálezy u velkých lipidových okrsků (κ = 0,796) a velkých hemoragií (κ = 0,72) [25] s vysokou interobservační shodou. V principu můžeme říci, že čím je nižší denzita plátu, tím je pravděpodobně menší jeho stabilita. Dynamické kontrastní zobrazení se zdá být velmi přínosnou technikou k ohodnocení stability na MDCTA. Zvýšení denzity v HU od brzké do pozdní fáze značí stabilitu plátu s větším množstvím fibrózní tkáně a menším podílem lipidů, IPH a neovaskularizací [23], pravděpodobně v důsledku rychlejšího vymytí z plátu.
Limitace metody
Dvě hlavní nevýhody provází CT vyšetření: 1. potřeba podání intravenózní kontrastní látky s jodem s potenciální možností alergické reakce a nefrotoxicity; 2. expozice rentgenovému záření. Při analyzování plátu dále plynou limitace z artefaktů na podkladě přítomnosti kalcifikací a nedostatečnému rozlišení jednotlivých hypodenzních struktur, zejména u menších IPH, LRNC a fibrózní tkáně [25]. CT je tedy velmi dobrá diagnostická metoda akutní fáze, s přihlédnutím k existujícím limitacím při analýze nestabilního plátu. Navzdory některým studiím, které využily MDCT jako monitorovacího nástroje k dlouhodobému sledování vývoje plátu [29], z důvodů zmíněných limitací CT za rutinní monitorovací metodu ke sledování dynamiky plátu nepovažujeme.
Směřování dalšího výzkumu
Dvouzdrojová CT s kostní subtrakcí se jeví jako slibná metoda k rozlišení měkkých tkání. Zahrnutí kontrastního sycení do protokolů by bylo malým krokem navíc v běžném vyšetřovacím CT procesu, jež by přineslo cenné informace o charakteru plátu. MDCT 3D geometrickým zobrazováním může přinést nové informace o různých hemodynamických faktorech, např. o tzv. shear stress (střižná síla, smykové napětí), jež se jeví jako další významný faktor v dynamice vývoje plátu. Informací o jeho patofyziologickém mechanizmu však není mnoho [27].
Magnetická rezonance
Technické provedení
Magnetická rezonance je často považována za zlatý standard a v analýze aterosklerotického plátu hraje důležitou roli. Dobrá senzitivita i specificita metody v hodnocení morfologie plátu, jeho složení a objemu je známa. V detekci nestabilních známek plátu se doporučuje několik různých sekvencí. Nejčastěji užívané jsou T1 vážené a T2 vážené fast spinecho (FSE) sekvence a proton denzitně vážené (PDW) obrazy. Tyto techniky jsou vynikající svým vysokým prostorovým rozlišením. Sekvence double inversion recovery, rovněž nazývaná „black blood imaging“ poskytuje vysoký kontrast mezi stěnou cévy a lumen. Ve všech těchto modalitách dosahujeme vysokého signal-to-noice ratio, ovšem za cenu prodloužených skenovacích časů a dochází k výskytu pohybových artefaktů [26].
Zobrazení MR může být ovlivněno změnou nastavení a v zájmu zkrácení skenovacího času jsou aplikovány různé techniky. Pro všechny sekvence je využívána technika suprese tukové tkáně, aby se maximálně eliminovaly signály z podkožního tuku a také aby se usnadnilo rozlišení mezi LRNC a IPH [30].
Kontrastní MR (contrast enhanced, CE) pomůže zobrazit některé komponenty plátu přesněji a nejčastěji jsou užívány cheláty gadolinia (Gd). Na T1 vážených skenech lze rozlišit mezi vaskulárními okrsky sycenými kontrastem, např. fibrózní tkání, od nevaskularizovaných, jako jsou např. LRNC, IPH a trombus, ovšem mechanizmus sycení Gd v karotickém plátu je komplexní.
Gd, jak známo, se distribuuje v extracelulárním extravaskulárním prostoru. Tedy vyšší sycení může být díky zvýšené perfuzi a permeabilitě, zvětšenému extracelulárnímu volumu anebo sníženému vymývání kontrastu z plátu a v karotických plátech je nepřímo přisuzováno patofyziologickým procesům, jako jsou neovaskularizace, zánět či reorganizace složení cévní stěny [31].
Detekce nestabilního plátu
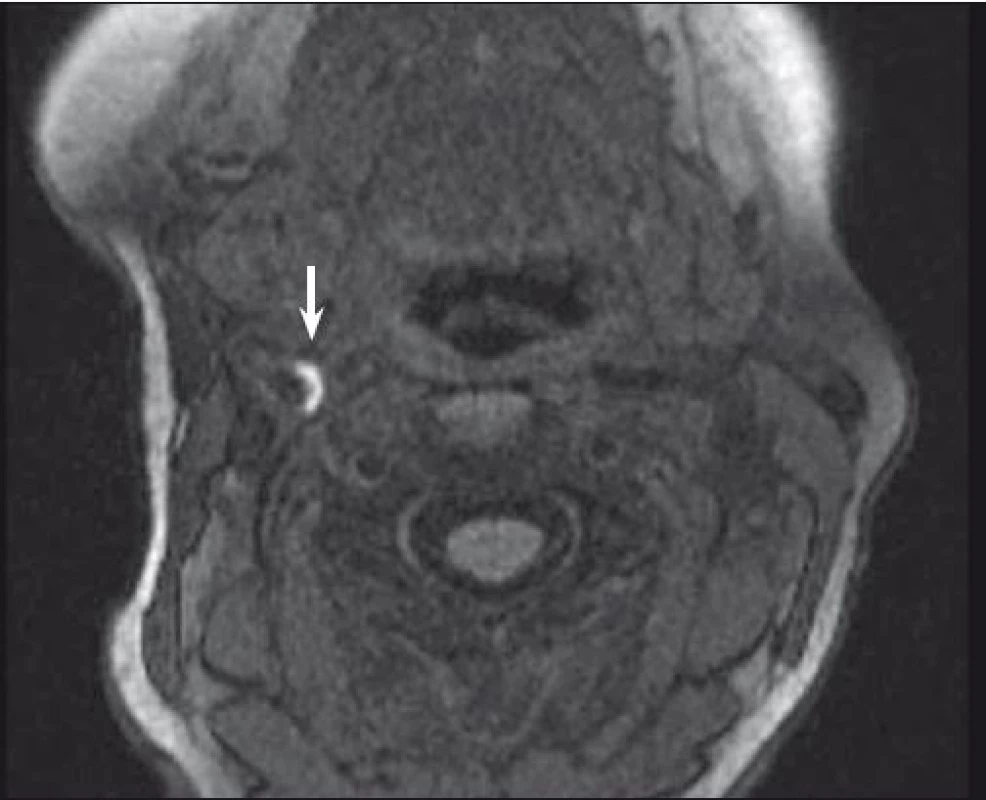
Značný potenciál MR v diagnostice nestabilního plátu byl potvrzen v mnoha studiích. Vysoký kontrast měkkých tkání, reproducibilita a vysoká interobservační shoda zajišťují této neinvazivní diagnostické metodě významnou pozici v analýze složení plátu. Jedna z nejvíce prozkoumaných komponent plátu je nepochybně IPH. Bývá detekováno se senzitivitou 82–92 % a specificitou 74–100 % [32,33]. Kombinace T1, T2 vážených a PDW obrazů pomáhá určit stáří trombu. Čerstvé IPH je hyperintenzní v T1 vážených a hypointenzní nebo izointenzní v T2 vážených a PDW sekvencích. Recentní IPH (1–6 týdnů) je hyperintenzní na všech zmíněných zobrazeních (obr. 1, 2) a starší IPH (≥ 6 týdnů) je ve všech těchto zobrazeních hypointenzní. Byla nalezena silná korelace mezi symptomy mozkové ischemie a přítomností IPH bez ohledu na stupeň stenózy [3] s hazard ratio od 4,59 (95% CI 2,91–7,24) [15] do 9,8 (95% CI 1,3–75,1; p = 0,03) [34].
Fig. 1. MRI – hyperintense part (arrow) of carotid plaque corresponding to intraplaque hemorrhage.
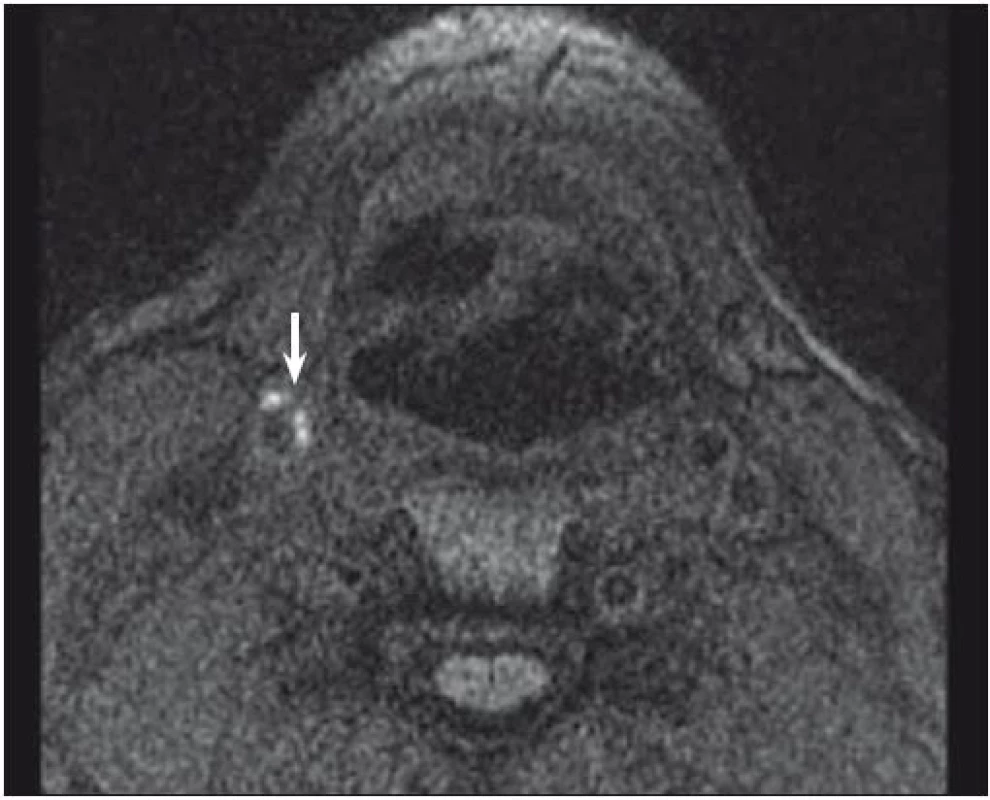
Fig. 2. MRI – hyperintense part (arrow) of carotid plaque corresponding to intraplaque hemorrhage.
Odlišení IPH od LRNC je rovněž dominantou této metody. LRNC lze detekovat na MR se senzitivitou 82–100 % a specificitou 40–100 % [27,33]. Jelikož IPH je často rozptýleno v rámci lipidových okrsků, je nutná kombinace sekvencí k odlišení těchto dvou patologií – zatímco IPH je hyperintenzní v T1 vážených a time-of-flight (TOF) sekvencích, LRNC je hyperintenzní jen v T1 vážených a izointenzní na TOF obrazech [35]. Nejen detekování LRNC v plátu, ale rovněž její kvantifikace má pravděpodobně důležitý klinický efekt, neboť vzrůstající objem lipidových okrsků může vyústit v budoucí rupturu povrchu, jak se zjistilo u středně významné karotické stenózy [36]. Silná korelace mezi IPH a LRNC s histopatologickými nálezy byla potvrzena [33,35].
Neovaskularizace a zánět jsou dvě entity asociované s nestabilitou plátu a jsou detekovatelné v CE T1 vážených sekvencích s prevalencí neovaskularizace až 97 % a zánětu až 87 % [31]. Chan et al se zaměřili na zhodnocení stupně zánětlivého procesu v plátu za použití protilátky konjugované se superparamagnetickými částicemi oxidu železa (superparamagnetic iron oxide particles; SPIO) a symptomatické pláty byly odlišeny od asymptomatických dle stupně zánětu. V této malé studii kontrastní sycení na MR významně korelovalo se stupněm zánětu plátu (r = 0,64; p < 0,001) [37]. Dynamická CE MR byla použita ke kvantifikaci sycení v plátu odpovídající neovaskularizaci a zánětu, přičemž byla potvrzena signifikantní korelace [38].
MR je také velmi dobrá metoda k detekci ulcerace plátu v angiografickém módu (MRA), kde se ulcerace zobrazují jako povrchové nerovnosti a přidání black-blood MRA pomohlo dosáhnout senzitivity MR 80 % a specificity 70 % [36].
Fibrózní povrch se zobrazuje jako hypointenzní lineární struktura v T1, T2 vážených a PDW sekvencích a její absence značí buďto ztenčení nebo rupturu fibrinového povrchu plátu [32].
Kalcifikace se zobrazují hypointenzně na všech kontrastně vážených skenech a mohou být pomocí MR detekovány s vysokou senzitivitou a specifitou [32,35].
Zobrazování plátu pomocí MR prokázalo schopnost identifikovat vysoce rizikové pláty u jak symptomatických tak u asymptomatických pacientů nezávisle na stupni stenózy [15] a mohlo by tak zlepšit stratifikaci pacientů se zvýšeným rizikem budoucích cerebrovaskulárních ipsilaterálních ischemických událostí [39].
Nepopiratelnou výhodou MR metody je také fakt, že mozková tkáň může být zhodnocena ve stejné době jako vyšetření plátu. U nestabilních plátů, zejména s přítomností IPH, byla nalezena silná asociace s lézemi bílé hmoty u symptomatické karotické stenózy [40]. Vliv nestabilního plátu na mozkovou tkáň může být ohodnocen při současně provedeném skenu mozku. Esposito-Bauer navrhl kategorizaci plátu dle MR nálezů a vysoce rizikové pláty byly charakterizovány přítomností LRNC, fibrózní tkání s možnými kalcifikacemi, povrchovými defekty, IPH nebo přítomností trombu, přičemž tyto typy plátů byly spojeny se zvýšeným rizikem iktu [39].
Limitace metody
Významnými nevýhodami MR jsou dlouhé vyšetřovací časy, přičemž vybrané sekvence jsou velmi senzitivní na pohybové artefakty. Dále pak vysoká cena za vyšetření a relativně nízká dostupnost, což je ještě více patrné při analýze plátu. Současná klinická praxe neposkytuje specifikované protokoly k MR skenování plátu, a tak jsou tyto dostupné většinou jen ve specializovaných centrech. Automatický software k analýze složení plátu je rovněž nedostupný a díky manuálnímu postprocessingu komponent plátu je výsledný popis náchylný k vysoké inter- i intraobservační variabilitě. Proces MR skenování plátu je časově náročný a není pro radiology rutinní záležitostí, což opět vytváří bariéry k zavedení MR do praxe jako běžného rutinního stratifikačního nástroje v analýze plátu [27]. Rovněž na běžně dostupných 1,5T MR přístrojích je rozlišení mezi jednotlivými komponentami plátu spíše výzvou. Aplikace silnějšího magnetického pole je cestou ke zlepšení diagnostické přesnosti a je předmětem výzkumu [32,41].
Směřování dalšího výzkumu
Jak je uvedeno výše, jednou z neoddiskutovatelných výhod MR je její schopnost skenovat více struktur během jednoho vyšetření. Tedy např. kombinace vyšetření mozkové tkáně, plátu i lumen cévy, která může být provedena v budoucnosti v rámci jednoho komplexního neurozobrazovacího procesu. Recentně byl navržen protokol současné nekontrastní MRA se skenem detekujícím IPH (simultaneous non-contrast angiography and intraplaque haemorrhage; SNAP protocol) k simultánní diagnostice luminální stenózy a přítomnostiIPH v jedné vyšetřovací době [42].
Zlepšení rozlišení struktur za použití 3T a 7T skenerů [41,43,44] a vývoj automatizovaného software k eliminaci lidské chyby při hodnocení jednotlivých komponent plátu je další cíl mnoha výzkumných aktivit [45].
Nové biomarkery, které cílí na specifické molekuly detekovatelné při transformaci plátu, jako např. při remodelaci u zánětu, jsou také předmětem výzkumu. Funkční molekulární MR sondy jsou testovány a obvykle se skládají z protilátky konjugované se SPIO nebo jiné kontrastní látky a specificky váží molekuly či buněčné komponenty [46], např. fibrin, elastin nebo zánětlivé markery jako jsou např. VCAM-1 nebo E-selectin. Tímto bychom získali možnost detekovat nestabilní známky plátu na molekulární úrovni s velmi vysokým prostorovým rozlišením a rovněž bychom měli možnost kvantifikovat stupeň zánětlivého postižení [37]. Tyto nové postupy v diagnostice aterosklerózy jsou v současné době vyhrazeny pro ex vivo zobrazování a k uvedení do klinické praxe je nutný další vývoj.
Pozitronová emisní tomografie
Technické provedení
Pozitronová emisní tomografie je hlavní molekulární zobrazovací technika, neboť jednofotonová emisní výpočetní tomografie (single emission computed tomography; SPECT) má výrazně nižší prostorové rozlišení a při zobrazování plátu není v centru zájmu. Nedostatečné prostorové rozlišení PET, mezi 3 až 5 mm, je korigováno za současného použití hybridních skenerů s CT či v poslední době rovněž s MR [47]. Nejvíce prozkoumaný radionuklidový nosič v diagnostice aterosklerózy je 18-fluorodeoxyglukóza (18FDG) (fluorodeoxyglukóza; FDG), která je částečně metabolizována v glykolýze a slouží jako marker zánětu nebo hypoxie. Po administraci FDG následně dochází ke skenování, které je provedeno v 60.– 90. min. Rozptyl nosiče v krevním oběhu může vyústit ve špatné kontrastní rozlišení pro tak malou strukturu jako je karotický plát a to tím významněji, čím dříve je zobrazení provedeno. Optimální načasování k vizualizaci plátu je předmětem mnoha debat. V menší studii Blomberg et al zjistili, že opožděné 18FDG PET/ CT zobrazení ve 180. min zlepšuje kvantifikaci zánětu v aterosklerotickém plátu oproti standardně prováděným skenům v 90. min [48]. Reproducibilita metody byla ohodnocena jako velice vysoká s příznivou inter- a intraobservační shodou [49].
Detekce nestabilního plátu
Hlavní výhodou PET proti ostatním existujícím zobrazovacím technikám je potenciál detekovat zánět přímo prostřednictvím FDG. Několik studií zaznamenalo významnou korelaci mezi koncentrací FDG a histopatologickým nálezem infiltrace makrofágů (pláty s vysokým standardized uptake value; SUV) [50,51]. Zvýšený FDG uptake u zánětlivého postižení byl pozitivně asociován s rizikem ischemických CMP nezávisle na stupni stenózy [50,52].
V detekci dalších nestabilních znaků plátu však PET postrádá anatomickou přesnost a její přínos může být v současnosti jen v kombinaci s CT či MR. Korelace s CT i MR nálezy v detekci LRNC, kalcifikací i fibrózní tkáně je však slabá [53] a také nebyla prokázána významnější korelace mezi FDG uptakem a neovaskularizací plátu [29].
Nicméně přínos PET může být v budoucnosti výrazně vyšší, především experimentální, protože metabolizmus i patofyziologické procesy v aterosklerotickém plátu mohou být zkoumány in vivo. Tato metoda je dobře zavedená a klinicky dostupná.
Limitace metody
Jak již bylo popsáno výše, špatné prostorové rozlišení, neschopnost vizualizovat neovaskularizaci, LRNC, IPH nebo fibrinové defekty jsou významnými limitacemi metody [26]. Vyšetření je drahé, dostupnost PET skenerů je nízká a zátěž radioaktivitou nevyhnutelná. Musí být rovněž započítány i dodatečné kontraindikace a limity plynoucí z CT či MR vyšetření. FDG uptake může navíc ovlivnit i pacientova příprava a dieta. Ke zhodnocení stadia aterosklerózy je potřeba sériové testování. Vystavení radiaci, zejména při PET koregistraci s CT prakticky vylučuje provádění opakovaného zobrazení. Hybridní PET/ MR a PET/ CT zobrazení také vyžaduje přesnou časovou koregistraci mezi oběma modalitami, speciálně když hodnotíme malé struktury, jako jsou karotické pláty. Pohyby pacienta mezi detekcemi obrazu mohou vyústit v chybu posunu lokace a tím i v chybnou interpretaci obrazu [47].
Směřování dalšího výzkumu
Kombinace PET s MR se jeví jako možnost v identifikaci některých problematických morfologických znaků plátu a v diagnostice změn stěny cévy [27]. Ve vývoji jsou algoritmy ke snížení dávky radiace umožňující opakované vyšetření.
Pravděpodobně nejvíce studovaným faktorem jsou nové nosiče. Řada jich je testována v procesu vzniku trombózy, neoangiogeneze, lipidové akumulace, mikrokalcifikací a dalších procesů. 18F-sodium fluoride (18F-NaF) byl objeven jako potenciální nástroj k detekci prasklých a vysoce rizikových koronárních plátů a rovněž jako prostředek k detekci mikrokalcifikací. Malá depozita kalcia v rámci plátu mohou signalizovat jeho progresi a stadium náchylné k ruptuře [54]. Jsou však zapotřebí studie se zaměřením na karotické arterie [55]. V non-FDG zobrazení je studován vztah nestabilního plátu náchylného k ruptuře a matrixové metaloproteinázy (MMP) [56]. Další nový biomarker ve studiu nestabilního plátu by mohla být [18F]-galacto-RGD PET/ CT se zobrazením αvβ3 molekuly. Jelikož tento integrin je exprimován makrofágy a endoteliálními buňkami v průběhu angiogeneze v aterosklerotických lézích, mohl by představovat marker zánětu a neoangiogeneze [57]. PET/ CT biomarkery nabízí šanci, jak zhodnotit stadium aterosklerotických lézí a ozřejmit různé aspekty progrese plátu, ale v současnosti jsou tyto nosiče stále ve velmi brzkém stadiu vývoje a širší uplatnění je předmětem budoucího výzkumu [47].
Duplexní sonografie
Technické provedení
Ultrazvuk je pravděpodobně klinicky nejvíce využívaná zobrazovací technika v diagnostice aterosklerotického plátu a je metodou volby pro pravidelný skríning a úvodní evaluaci aterosklerotického onemocnění karotid. Široká dostupnost, nízká cena a výborná tolerance pacientem bez závažnějších vedlejších efektů jsou neoddiskutovatelné výhody této dlouhodobě zavedené modality [58]. Jedná se o jedinou metodu, která poskytuje zobrazení v reálném čase s možností hodnocení hemodynamických parametrů. Transdukční sondy generují a přijímají US vlnění vznikající v piezoelektrických krystalech, frekvence se obvykle pohybují mezí 4–14 MHz a pro zobrazení karotid jsou nejvhodnější lineární sondy. Zobrazování probíhá v longitudinální a axiální rovině. Existuje několik zobrazovacích technik. Přehled a popis každé z technik je poskytnut ve vztahu k zobrazení nestabilního plátu.
Detekce nestabilního plátu
B-obraz
B-obraz (brightness mód neboli dvoudimenzionální mód) umožňuje vizualizovat několik anatomických znaků v plátu a v arteriální stěně. B-obraz se primárně užívá k zhodnocení echogenity tkání a konvenčně je jako referenční hodnota užívána echogenita sternocleidomastoidiálního svalu. Inter- i intraobservační diskrepance jsou jednou z hlavních limitací této metody a v současnosti jsou testovány různé techniky postprocessingu snižující vliv subjektivního hodnocení vyšetřujícím [59]. Cílem metody je odlišit pláty hypoechogenní, asociované zřejmě s lipidovými okrsky a hemoragickým obsahem, od hyperechogenních, které korespondují s obsahem fibrinu a kalcia a jež jsou považovány za stabilnější.
Gray scale median (GSM) je počítačové měření průměrné echogenity plátu a koreluje negativně s rizikovými faktory pro kardiovaskulární onemocnění. Není jasný konsenzus hraničních hodnot GSM k definici nestabilního plátu díky odlišným softwarovým aplikacím, ale v principu nízké hodnoty korespondují s hypoechogenními pláty [60]. Nízká echogenita je asociována se zvýšeným rizikem ischemických CMP u symptomatických [60] i asymptomatických pacientů s karotickou stenózou a nižší hodnoty GSM jsou spojeny s vyšším rizikem budoucího iktu [61]. Nicméně, jak je zjevné z definice, GSM poskytuje průměrnou hodnotu echogenity plátu a postrádá schopnost ohodnotit jednotlivé histologické komponenty plátu a jejich distribuci [62].
Analýza distribuce pixelů (pixel distribution analysis; PDA) řeší tento problém přiřazením charakteristické echogenity jednotlivým klíčovým komponentám aterosklerotického plátu a mapuje architektoniku znaků plátu (LRNC, IPH, kalcia a fibromuskulární tkáně) nejenom lokalizací, ale také jejich velikosti [63]. Toto neinvazivní vyšetření plátu by mohlo mít velmi významný klinický dopad, jelikož velké juxtaluminální tmavé okrsky (juxtaluminal black area; JBA) obsahující lipidy, nekrotické masy nebo mohou být v důsledku přítomnosti trombu, jsou v lineárním vztahu k riziku iktu [64] a tato nestabilní ložiska by mohla být narušena průchodem endovaskulárního katetru [62]. Tento mechanizmus by mohl predisponovat k embolizaci v průběhu karotického stentingu (CAS), přičemž vyšší incidence embolizace po CAS ve srovnání s CEA již byla popsána [65].
Podrobnější charakterizace plátu by tedy mohla být užívána při stratifikaci rizika v managementu invazivních procedur [64].
Ve 2D módu se FC zobrazuje jako lineární echogenní struktura na povrchu plátu. Tloušťku FC lze standardně měřit pomocí US, a tím detekovat ztenčení nebo defekt FC, jelikož obě tyto změny patří mezi rizikové faktory iktu. Jako efektivní nástroj pro detekci zúžení FC bylo navrženo měření integrovaného ultrazvukového zpětného rozptylu (integrated ultrasonic backscatter; IBS), neboť IBS byl nižší u tenkých vrstev FC než u těch silných (–10,9 ± 6,4 vs. –2,4 ± –6,2 dB; p < 0,001) a byla nalezena také dobrá korelace s histologickými nálezy. Měření IBS může pomoci detekovat zúženou FC jako známku nestability plátu [66].
Ulcerace jsou definovány jako iregularity na povrchu plátu a dle konvenčních kritérií jsou stanoveny jako konkavity větší než 2 × 2 mm v dobře zobrazitelném ohraničení plátu se zobrazením reverzního toku. Muraki et al navrhli nová, více senzitivní kritéria ulcerací. Jako ulcerace hodnotili konkavitu plátu s méně echogenní bazální hranicí oproti okolnímu povrchu plátu bez ohledu na velikost. Tyto navržené parametry byly porovnány s chirurgickými a histologickými nálezy. Senzitivita a specifita konvenčních kritérií byla 35,7 a 75,0 % oproti 85,7 a 81,3 % u nových kritérií [67]. Přítomnost nerovného plátu byla nezávisle asociována se zvýšeným rizikem ischemické CMP oproti pacientům bez plátu s hazard ratio 3,1 (95% CI 1,1–8,5) [68].
Kalcifikace jsou nejvíce echogenní strukturou v plátu. Jsou dobře detekovatelné pomocí US, a to jak pomocí GSM tak i PDA [60,63] s dobrou korelací s histologickým nálezy. Problémy se mohou objevit u vysoce kalcifikovaných plátů, kde akustické stíny mohou limitovat hodnocení plátu.
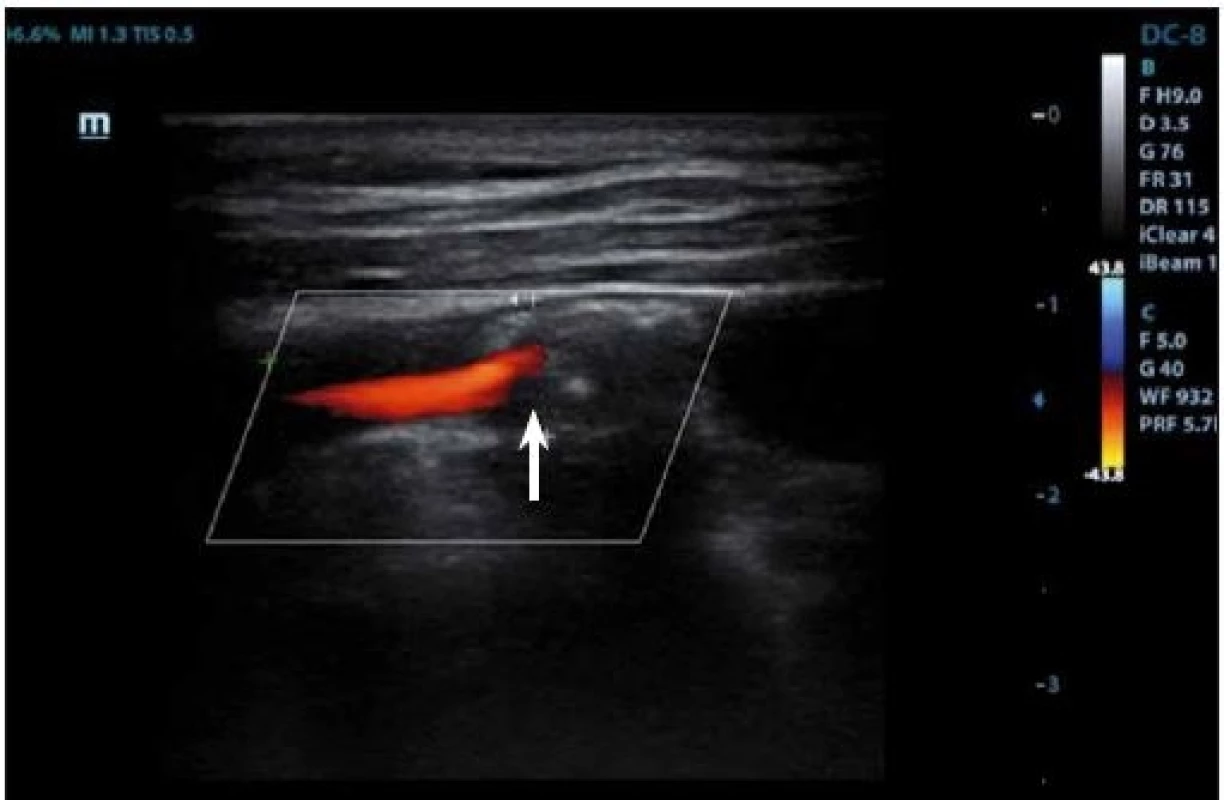
IPH je detekovatelné v plátu jako hypoechogenní struktura (obr. 3, 4) a její vznik je přisuzován úniku krve z nově vzniklých cév. Pokud se objeví fisura plátu, může dojít k formaci krevní sraženiny a trombu detekovatelném na povrchu plátu, který se v B-obraze také jeví jako hypoechogenní. Přesnost detekce IPH nebo trombu v B-obraze má senzitivitu 80–90 % a specificitu 80–91 % [27], a přítomnost těchto dvou znaků je v korelaci k nestabilitě plátu [69].
Fig. 3. Duplex sonography– hypoechogenic part (arrow) corresponding to intraplaque hemorrhage.
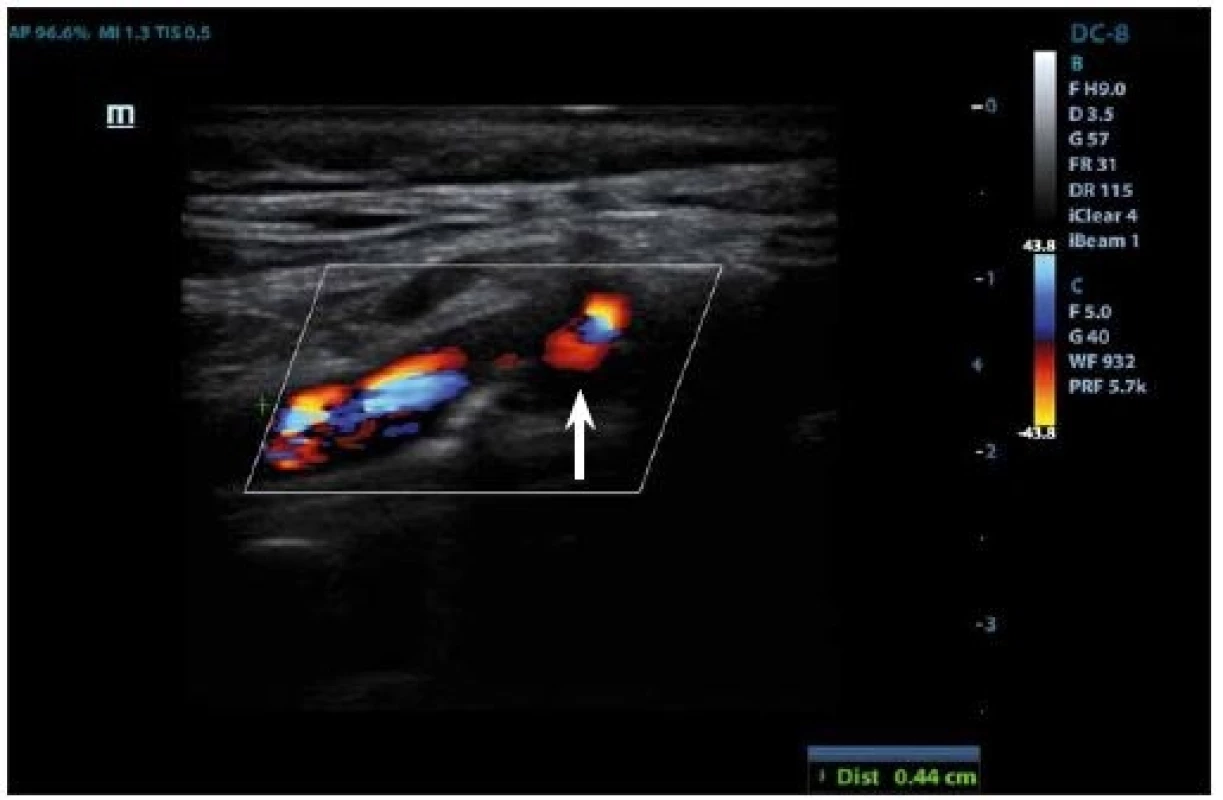
Fig. 4. Duplex sonography – hypoechogenic part (arrow) corresponding to intraplaque hemorrhage.
Neovaskularizace je další znak, který znamená pravděpodobnou nestabilitu plátu a může být nalezen na adventiciální straně arteriální stěny. V některých aterosklerotických plátech dochází k formaci nové mikrovaskulatury. Je to příznak růstu plátu a zvýšeného rizika nestability. Neovaskularizace v B-obraze se zobrazuje jako hypoechogenní okrsek s detekcí toku v barevně kódovaném dopplerovském zobrazení nebo v energetickém módu. Nicméně dominantní metoda k detekci nově formované vaskulatury je CEUS. Zánět v plátu je další anechogenní struktura plátu, která je lépe detekovatelná pomocí CEUS.
LRNC je další hypoechogenní struktura a vypadá podobně jako IPH. Rozlišení mezi těmito dvěma histopatologickými znaky v B-obraze je nesnadné a není dominancí této metody. Nicméně lipidy obsažené v plátu jsou dobře známý rizikový faktor ischemické CMP [70] stejně jako IPH [69].
Přítomnost JBA byla hodnocena ve vztahu k jejich velikosti a relevanci k riziku budoucího iktu, přičemž silná korelace byla zjištěna u populace s asymptomatickou stenózou [64]. Velikost lipidových okrsků se zdá kritická pro stabilitu plátu [70] a náchylnost ateromu k ruptuře je zvýšená v přítomnosti velkých lipidových okrsků, jak bylo zjištěno také ve studiích s MR [11]. Hodnocení morfologie plátu prostřednictvím US může výrazně zpřesnit hodnocení rizika iktu oproti pouhému hodnocení procenta stenózy [71]. Relativní riziko ischemické CMP u subjektů s hypoechogenními pláty je 4,6 (95% CI 1,1–18,9) s lineárně progresivním trendem při zvyšující se hypoechogenitě plátu [72].
Echokontrastní ultrazvukové vyšetření
Kontrastní ultrazvuk používá intravenózní podání echokontrastní látky na podkladě mikrobublin, které zvyšují intenzitu odraženého ultrazvukového svazku. Tím dochází k přesnějšímu zhodnocení lumina cévy i neovaskularizace v plátu. K potlačení signálu z tkání a zesílení signálu kontrastních mikrobublin jsou zapotřebí specifické pulzní sekvence [26]. CEUS identifikuje důležitou luminální část plátu a je unikátní v detekci neovaskularizace. IPN je asociováno se zvýšeným zánětem, IPH a degradací hmoty, což vše zvyšuje nestabilituplátu [73].
Kontrastní mikrobubliny detekované v plátu svědčí pro přítomnost neovaskularizace. Nyní se testují kvantitativní metody k hodnocení míry kontrastního sycení. Ve studii hodnotící nestabilní pláty prostřednictvím CEUS v korelaci s histologií, symptomy a CT byla užita metoda decibelového zesílení (decibel enhancement; dB-E). Vyšší dB-E bylo signifikantně asociováno se ztenčením fibrózní čepičky (< 200 μm; p = 0,01) a vyšší zánětlivou infiltrací (p = 0,03). Předoperační ipsilaterální embolické léze na CT byly v korelaci s vyšším dB-E (p = 0,01) [74]. Existuje několik známých biomarkerů spojených se zánětem nebo proteolytickou aktivitou u nestabilního plátu. V několika malých studiích byla nalezena pozitivní významná asociace mezi MMP-9 a přítomností IPN detekovaném prostřednictvím CEUS (95% CI 1,002–1,027; p = 0,021) [75]. Hladiny sérového C reaktivního proteinu pozitivně korelovaly se stupněm karotického enhacementu korespondujícího s IPN (Rs = 0,69; p < 0,01) [76]. Kombinace detekce biomarkerů a IPN detekovaného na CEUS by dále umožnila zpřesnění stability plátu [76].
Pozdní fáze zobrazování se využívá k detekci zánětu a povrchových disrupcí plátu. Zde dochází k fagocytóze kontrastní látky makrofágy, kde může být zobrazena také retence mikrobublin na povrchu plátu [77]. Tento jev byl popsán jako sycení pozdní fáze a může být objektivně identifikován díky zobrazení plátu v 6. min po podání kontrastní látky [78].
Ulcerace jsou na CEUS snadno detekovatelné, protože dochází k velmi dobré delineaci mezi plátem a lumen cévy. V porovnání s 2D módem a barevným Dopplerovským zobrazením má CEUS vyšší senzitivitu, specificitu i intra- a interobservační shodu [79]. Díky této vysoké senzitivitě na luminální změny povrchu je CEUS schopen detekovat již subklinické stadium karotické aterosklerózy lépe než konvenční US a mění tak tradičně užívanou rizikovou stratifikaci [80]. Vysoká spolehlivost metody je prokázána při diferenciální diagnostice mezi těžkou karotickou stenózou a okluzí v korelaci s ostatními metodami [81].
Třídimenzionální ultrazvukové vyšetření
Třídimenzionální US vyšetření používá speciální 3D sondy nebo kombinuje série 2D řezů, které se shromažďují v počítači a jsou rekonstruovány do 3D obrazů. Operátorova ruka a pacientova hlava musí být ve stabilní pozici, aby se zabránilo pohybovým artefaktům. Obrazy jsou získávány v celé longitudinální i axiální rovině a konvertovány do 3D rekonstrukcí [62]. Poté lze vypočítat TPA, resp. TPV.
Pláty rostou v podélné rovině tepny 2,4× rychleji než v axiální [83] a progredují a regredují cirkumferenciálně. Jelikož změny v plátu se vyvíjí ve všech třech rovinách, hodnocení plátu pouze ve 2D rovině se nezdá dostatečné. Další velkou výhodou 3D zobrazování je zlepšená detekce povrchu plátu a zobrazení nerovností a ulcerací. Tyto byly definovány jako kontinuální a výrazné deprese v plátu o objemu 1 mm³ nebo více. Ulcerace s objemem více než 5 mm³ byly asociovány s vyšším počtem ischemických cerebrálních a kardiovaskulárních událostí [84].
Ke zhodnocení odpovědi na antiaterosklerotickou terapii byly porovnávány různé prediktory kardiovaskulárního rizika.
Progrese či regrese intimomediální šíře (IMT), TPA a TPV byly měřeny prostřednictvím 3D US a pacienti byli sledováni po dobu 5 let. Progrese TPV predikovala zvýšené riziko ischemické CMP, smrti, TIA i kardiovaskulárních příhod (p = 0,001). Progrese TPA byla slabým prediktorem ischemické CMP, TIA nebo smrti, ale nezvyšovala kardiovaskulární riziko (p = 0,143). TPA byla také potvrzena jako silnější prediktor pro vývoj první ischemické CMP [13]. Změny IMT však nepredikovaly ischemickou CMP, TIA, smrt, ani riziko kardiovaskulárních příhod (p = 0,455) [14]. Měření TPV vyšlo superiorně k IMT i TPA. 3D hodnocení plátu se tedy zdá být velmi slibné pro klinickou praxi budoucnosti.
Elastografie
Hemodynamické síly, které působí na plát a viskoelastické mechanické vlastnosti jsou biomechanické faktory, jež jsou považovány za významný faktor zvyšující riziko ruptury plátu. US elastografie neboli deformační zobrazování je metoda, která si klade za cíl kvantifikovat deformaci plátu v důsledku působení vnitřních a vnějších mechanických sil. Tato metoda je dobře známa z jiných struktur, zejména parenchymatózních orgánů. Aplikace na karotické pláty je tak trochu výzva, jelikož se jedná o poměrně malou strukturu a respirační i kardiální pohyby interferují se ziskem dat. Tato jsou získávána v longitudinální i axiální rovině za použití radiofrekvenčního zobrazení či klasického B-obrazu a následně je provedena analýza. V menší studii hypoechogenní pláty vykazovaly vysokou deformabilitu a velkou heterogenitu v laterálním posunu radiálního pohybu arterie [62]. Jiná data ukázala, že nestabilní pláty mají tendenci být více elastické a heterogenní [85]. Vysoce rizikové pláty dle MR vykazovaly vyšší hodnoty při elastografii ve srovnání se stabilními pláty [86]. Tyto nálezy svědčí pro to, že nestabilní pláty mají tendenci být více elastické a náchylné k ruptuře. Nicméně je třeba další testování této metody.
Transkraniální barevně kódovaná duplexní sonografie a transkraniální Doppler
Transkraniální barevně kódovaná duplexnísonografie a TCD nejsou metody vhodné k vizualizaci karotického plátu samotného, ale poskytují zajímavé informace k monitorování jeho emboligenního potenciálu. Jedná se o rychlé, neinvazivní a vysoce přínosné metody k hodnocení rizikového chování plátu, jelikož mikroembolické signály (microembolic signals; MES) jsou jedním z projevů nestability plátu [16].
Používají se sektorové sondy o nízkých frekvencích 2–4 MHz. Standardní vyšetřovací přístup je přes transtemporální, transforaminální a transorbitální akustická okna, přičemž nejčastěji využívanou strukturou pro detekci MES je střední mozková arterie.
Ve studii Asymptomatic Carotid Emboli Study (ACES) byl TCD použit jako nástroj k identifikaci pacientů s asymptomatickou karotickou stenózou, kteří by mohli profitovat z chirurgického výkonu. TCD detekce MES byla potvrzena jako metoda vhodná k detekci vysoce rizikových plátů s emboligenním potenciálem. Absolutní roční riziko ipsilaterální ischemické CMP bylo 3,62 % u pacientů s MES oproti 0,70 % u pacientů bez známek embolizace [17]. Topakian et al navrhli, že kombinace detekce MES spolu s nálezem hypoechogenního plátu umožňuje významně lepší predikci rizika než použití každé metody samostatně. Absolutní roční riziko pro ischemickou CMP bylo u takto vysoce rizikových nálezů 8 % oproti skupině s nízkým rizikem < 1 % ročně. Takováto stratifikace rizikových pacientů by mohla být užitečná ke zlepšení indikace pacientů vhodných k CEA [87]. Tento závěr je ještě více podpořen faktem, že po provedení CEA dochází k významnému poklesu MES [88].
Limitace metody
Každá z popsaných US metod má určité nevýhody. Hodnocení plátu v B-obraze je významně závislé na zkušenosti vyšetřujícího a intra- i interobservační shoda nebyla hodnocena jako optimální [27]. Variabilita vaskulární anatomie, tělesná konstituce nebo stěna cévy mohou limitovat prostupnost US paprsku [73]. Navíc těžce kalcifikované pláty způsobují akustické stíny, což komplikuje vyšetření. Další nevýhodou US je limitovaná schopnost charakterizovat složení plátu [89,90], a to zejména rozlišení mezi IPH a LRNC, které se obě zobrazují jako hypoechogenní struktury [27]. V detekci ulcerací byl US v některých studiích hodnocen jako nízce senzitivní [28].
Pro CEUS vzniká několik limitací díky nutnosti aplikovat kontrastní látku. Tyto preparáty na principu mikrobublin jsou kontraindikovány u pacientů se známým pravolevým zkratem, alergií, těžkou plicní hypertenzí, nekontrolovaným systémovým tlakem, nestabilní angínou pectoris, endokarditidou a akutním respiračním distress syndromem [62].
Rovněž se může vyskytnout tzv. fenomén pseudoenhancementu, který může vést k nadhodnocení nálezů na vzdálenější cévní stěně díky zvýšenému signálu cévní stěny více vzdálené od sondy [91]. U 3D zobrazování můžou finanční a časové požadavky zbrzdit širší využití v klinické praxi. Navíc je zde zatím velmi limitované množství dat získaných 3D US vyšetřením v korelaci s histologií [82]. Ačkoli jsou velké naděje vkládány ve 3D analýzu plátu do budoucna, zatím se jedná spíše o klinickou výzkumnou metodu.
Směřování dalšího výzkumu
Výzkumné snahy k překlenutí výše zmíněných limitací jsou značné. 2D B-obraz se superpozicí GSM, PDA nebo jiných pokročilých analýz složení plátu zlepšují diagnostiku jeho komponent i architektury. Standardizované počítačové analýzy by mohly pomoci redukovat interobservační variabilitu.
Zavedení CEUS do běžné klinické praxe by přineslo výhodu výrazně zlepšeného popisu luminálního povrchu plátu, neovaskularizace a zánětu, a to zejména při současném zobrazení pozdní fáze. Využití pozdní fáze rovněž nabízí možnost vývoje nových kontrastních látek, které by mohly kombinovat imunohistochemické zobrazování plátu a mohlo by tak dojít k možnosti molekulárního zobrazování karotického plátu. Tyto tracery by se mohly zaměřit na podrobnější detekci zánětu v plátu za použití P-selektinu či protilátky proti adhezivní molekule 1 cévních buněk (vascular cell adhesion molecule 1)anebo by mohly cílit na IPN za použití endoteliálního růstového faktoru 1 [92].
3D US poskytuje podrobnější detaily o povrchu plátu a unikátně je schopen hodnotit plát volumetricky. Vývoj počítačové analýzy by mohl poskytnout ještě více komplexních informací o složení plátu. Jsou vyvíjeny a testovány 3D protokoly ke kvantifikaci komponent plátu a zdá se, že by mohly být slibnou vysoce spolehlivou metodou v detekci nestabilních znaků plátu [62], rovněž v kombinaci s volumetrickými měřeními [93].
Střižné síly jsou známy jako významný lokální modulátor plátu a jsou asociovány se změnami složek plátu, jejich lokální distribuci i aktivitou metaloproteinázy-2 (MMP-2) [94]. US elastografie přináší nové možnosti měření mechanických sil a má schopnost identifikovat stadium plátu náchylné k ruptuře. Studie mechanických vlastností plátu s akustickou radiofrekvencí byly úspěšně provedeny na malých souborech pacientů podstupujících CEA [95].
Kombinace metod je další cesta ke zlepšení diagnostiky nestabilního plátu. Budoucí výzkum směřuje k využití 3D CEUS s detekcí IPN a kvantifikací celkové hmoty plátu se znásobením efektu diagnostických metod [73].
Další metody
Existuje několik dalších invazivních technik, které nejsou součástí běžné klinické praxe, ale v zájmu zachování komplexity této práce by měly být krátce popsány, jelikož mohou přinést nový pohled na analýzu plátů a jsou předmětem vědeckého zájmu.
IVUS používá katetr s miniaturním převodníkem o vysoké frekvenci v rozpětí 20–50 MHz. V kombinaci s PDA dochází k vytvoření mapy histologických komponent plátu, která je převedena do barevně kódovaného obrazu a reprezentuje virtuální histologii. Ve studii Carotid Artery Plaque Virtual Histology Evaluation (CAPITAL) byla zjištěna silná korelace mezi virtuální histologií plátu a skutečným histologickým vyšetřením, které následovalo po CEA, obzvláště u nestabilních typů plátů [96].
NIRS je schopna charakterizovat chemické složení arteriální stěny. Infračervené světlo je emitováno do tkáně a je měřena proporce reflektovaného světla o širokém rozmezí vlnové délky. NIRS byla úspěšně ověřena proti histologickým nálezům u nestabilního plátu v lidských koronárních arteriích.
OCT je optický analog IVUS se zhruba 10× větším prostorovým rozlišením (10 µm). Zobrazování OCT je založeno na principu světelné polarizace a užívá jedno světelné vlákno, které vyzařuje světlo i zachycuje jeho odraz. IVUS i OCT prokázaly vysokou senzitivitu i specificitu detekce nestabilního plátu. Mikro OCT s prostorovým rozlišením menším než 1 µm bylo vyvinuto v zájmu zobrazení mikrostruktury plátu. IVUS i OCT dovolují detekovat makrofágovou denzitu, změny v FC tloušťce i některé další velmi diskrétní změny plátů.
V případě μOCT mohou být zobrazeny i buněčné komponenty plátu. Monitorováním těchto subklinických biologických procesů aterosklerózy lze zdokonalit či rozšířit definici nestabilního plátu [97]. Každopádně díky invazivnímu charakteru a nízké klinické uplatnitelnosti těchto metod jsou vhodné zejména pro vědecké účely a jejich bližší popis je mimo rozsah této práce.
Zobrazovací modality a terapeutický management
V posledních letech byl do klinické praxe zaveden nový koncept „léčit tepny místo léčby rizikových faktorů“ [98]. Je dobře známo, že BMT je efektivní v remodelaci plátu a ve snížení rizika CMP [4]. Odhaduje se, že bez léčby progreduje minimálně 50 % plátů, zatímco jen 25 % plátů regreduje. Po zavedení na plát zaměřené terapie se tento poměr obrací [98]. K monitoraci progrese či regrese plátů lze využít mnoho metod. Studie prokázaly, že změny TPA a TPV měřené pomocí US dobře korelují s kardiovaskulárním rizikem [13,99], a proto by měly být monitorovány i v průběhu léčby. Nejen hmota plátu, ale i jeho složení se může měnit vlivem terapie. Je zde tedy relevantní možnost rutinně monitorovat efekt antiaterosklerotické terapie. Což přináší důležitou otázku, zda máme optimální monitorovací nástroj.
Diagnostický potenciál různých metod se liší a totéž platí pro jejich monitorovací schopnosti. Rovněž je namístě otázka, která metoda by mohla být užitečná pro rozpoznání kandidátů vhodných pro revaskularizaci.
CT není optimální monitorovací nástroj, zejména pokud jsou nutná opakování vyšetření, jelikož dochází k expozici radiaci a rovněž renální zátěž kontrastní látkou není bez rizik. Nicméně, studie s MDCTA ukázaly, že jde o metodu efektivní a přesnou v detekování změn karotického plátu a jeho složení. V recentní studii byli pacienti monitorováni po dobu 5 let a vývoj plátu byl definován jako heterogenní a pomalý proces [29]. MDCTA je obvykle iniciálním vyšetřením akutní fáze a je proto součástí diagnostické rozvahy při výběru kandidátů k revaskularizaci. Přesto, že toto je celkem častá situace v rutinní klinické praxi, morfologie plátu není vedoucím parametrem při tomto rozhodování a jsou potřeba větší studie, které budou založeny na zobrazení nestabilního plátu pomocí CT.
MR byla použita v hodnocení efektivity farmakologické léčby a potvrzena jako dobrý monitorovací nástroj. Ve studii NIA byla prostřednictvím MR měřena regrese karotické aterosklerózy indukované statiny s přidáním niacinu a bez něho se závěrem, že u obou skupin se dosáhlo významné redukce aterosklerózy bez významnějšího efektu ve skupině s niacinem [100]. V další studii byl monitorován efekt rosuvastatinu na 1,5T MR a bylo prokázáno, že terapie statiny byla přínosná v remodelaci objemu i složení plátu [101].
MR byla rovněž potvrzena jako užitečný nástroj k výběru vhodných kandidátů pro chirurgické řešení v případě symptomatické stenózy nízkého stupně, kdy dle MR byli identifikováni pacienti s nestabilním plátem, u nichž bylo vysoké procento recidivy iCMP i přes intenzivní konzervativní terapii. U těchto selektovaných pacientů bylo provedením CEA dosaženo významné redukce rizika recidivy ischemické CMP [102].
Vysoká intenzita signálu v plátu na MR TOF značí nestabilní plát a CAS provedený u těchto pacientů byl spojen se zvýšenými počty komplikací v porovnání s chirurgickým řešením. Dle Yoshimury et al byl výběr léčebné metody na podkladě zobrazení plátu jediným nezávislým prediktivním faktorem periprocedurálních komplikací [103].
PET s FDG byla použita jako monitorovací nástroj ve studii s pioglitazonem. Tento lék byl první hypoglykemizující preparát s potvrzeným efektem na potlačení zánětu v aterosklerotickém plátu u pacientů s porušenou glukózovou tolerancí či u diabetiků, přičemž utlumení zánětlivé aktivity se jevilo být nezávislé na hypoglykemizujícím efektu pioglitazonu [104]. Touto molekulární technikou byly zkoumány i další léky, vč. hypolipidemik. Vysoké dávky atorvastatinu vedly k významnému, na dávce dependentnímu snížení v FDG uptaku, který odráží změny v zánětlivém postižení plátu [105].
PET má také potenciál detekovat metabolické změny v odpovědi na léčbu. V současnosti však nejsou data z větších studií, kde by byla PET použita jako nástroj pro výběr vhodných kandidátů k revaskularizačním procedurám [26].
Role US v monitoringu plátu je bezkonkurenční. Rychlá, neinvazivní a vysoce informativní modalita s neomezeným množstvím možných opakování je nepochybně metoda volby nejen k monitoringu dynamiky plátu, ale rovněž ke sledování terapeutického efektu. Výtěžnost detekce nestability plátu v B-obraze byla testována v mnoha studiích. Echogenita plátu byla hodnocena prostřednictvím škály šedi při vysokých dávkách atorvastatinu [106]. Podle Kadoglou et al zvýšila agresivní léčba atorvastatinem u pacientů se středním stupněm stenózy echogenitu plátu [107].
IPN a její vývoj je dalším potenciálním cílem k monitoraci pomocí CEUS. Ve studii s vysoce rizikovými pacienty s koronárním onemocněním bylo prokázáno, že detekovaná neovaskularizace u pacientů s pláty v průběhu 6 měsíců léčby atorvastatinem regredovala ve 46 % [108].
3D US umožňuje zhodnocení rizikovosti plátu s vysokou interobservační shodou [109]. Měření 3D objemu plátu může prokázat významný efekt terapie aterosklerózy již během 3 měsíců, zejména významný trend v regresi plátu při terapii atorvastatinem [110].
Role TCD a transkraniální barevně kódované sonografie při stratifikaci rizika už byla popsána. Detekce MES je významný znak nestability plátu a je podstatně častější u symptomatické než u asymptomatické stenózy [19]. Kombinace TCD s hodnocením plátu v B-obraze potvrdila nárůst efektivity US vyšetření [87] a další kombinace metod je klinicky testována. US se zdá být také slibná a široce dostupná metoda pro výběr kandidátů k revaskularizaci. Spolehlivost US při identifikaci nestabilních znaků plátu je potřeba ještě ověřit ve velkých studiích. Nicméně aktuálně dostupná data o US vyšetřování karotid dávají metodě velké naděje do budoucna.
Diskuze
Hodnocení aterosklerotického onemocnění karotid pouze na podkladě stupně stenózy je v současnosti zjevně nedostatečné a klinická potřeba dalších informací vč. charakteristiky plátu je nepopiratelná. K nejvíce prozkoumaným známkám nestability plátu patří zvětšující se objem plátu, změny na povrchu plátu vč. zúžení FC nebo ulcerace, LRNC a jejich velikosti i lokalizace, IPH, IPN, trombus a zánětlivá aktivita plátu. Pokusy nalézt jedinou diagnostickou metodu, která by byla schopná zobrazit všechny tyto znaky, jsou zatím jen předmětem mnoha výzkumných aktivit.
CT je slibná metoda k detekci povrchových nerovností a ulcerací, vynikající ve zobrazení kalcifikací a dostačující k odhalení dalších znaků plátu, jako je IPH, neovaskularizace a LRNC, ale rozlišení mezi uvedenými je nedostatečné. Pozdní kontrastní fáze se zdá být schopna identifikovat nestabilní pláty, ale dynamické protokoly jsou zatím jen testovány.
MR má největší potenciál v rozlišení nestabilní morfologie plátu a většiny jeho charakteristik. Excelentní se zdá být v detekci IPH, a to včetně ohodnocení stáří hematomu, a jeho rozlišení od LRNC již bylo mnohokrát potvrzeno. IPN a zánět mohou být detekovány postkontrastním sycením, ulcerace jsou viditelné na všech kontrastních váženích.
PET má vedoucí roli v detekci zánětu i remodelace plátu, ale prostorové rozlišení anatomických struktur je nízké.
US je rychle se rozvíjející a expandující metoda s několika novými modalitami ke zlepšení detekce nestabilního plátu. Má schopnost zachytit většinu znaků plátu a zatím nedostatečné rozlišení některých z nich může být zlepšeno použitím pokročilejších metod jako je CEUS s vynikající rozlišovací detekcí IPN nebo zánětu v pozdní fázi zobrazování, 3D US s nejpřesnějším měřením objemu plátu a monitoringu jeho dynamiky nebo počítačová analýza echogenity plátu. Zejména zmapování architektoniky plátu včetně zobrazení JBA může mít významný vliv při výběru invazivní metody. Zobrazení v reálném čase včetně zhodnocení hemodynamiky a neinvazivita metody staví US do vedoucí pozice při nutnosti opakovaných vyšetření. Možnost detekce MES je navíc další metoda, která významným způsobem indikuje nestabilitu plátu a přítomnost emboligenních signálů z plátu je dalším důležitým kritériem k indikaci invazivního řešení stenózy.
Invazivní techniky jako IVUS, OCT nebo NIRS a jejich kombinace jsou cenné výzkumné metody, ale nejsou vhodné pro klinickou praxi díky jejich invazivitě. Nicméně, tyto techniky by mohly být užitečné v plánování endovaskulárních procedur.
Opakované zobrazování aterosklerózy in vivo je důležité pro pochopení patofyziologie progrese plátu a je potenciálně užitečné k predikci kardiovaskulárních událostí i monitorování efektu léčby. Jediné vyšetření nemůže zhodnotit vývoj plátu v čase, jelikož ateroskleróza je komplexní a pomalý proces a úspěch její léčby by měl být průběžně sledován [98]. Pouze tímto způsobem můžeme dosáhnout efektivní léčby a zhodnotit potřebu délky terapie nutné k dosažení stabilizace plátu – např. bylo mnohokrát testováno trvání hypolipidemické terapie statinem, kdy čas k dosažení regrese plátu byl v průměru 19,7 měsíců [111]. Pokud BMT není efektivní, pravidelné monitorování může pomoci určit načasování intervenční, popřípadě revaskularizační terapie. Je doporučován skríning asymptomatické karotické stenózy v populaci a je potřeba optimalizovat výběr vhodných pacientů k intervencím [112] a opakované sledování vývoje onemocnění.
Vlastní analýza plátu je pravděpodobně největší dominantou MR, ale US se stává metodou, které se pravděpodobně dostane širšího využití ve studiích aterosklerózy [89]. V budoucnosti očekáváme pokrok v zobrazení každé z metod, který by poskytnul více detailních morfologických informací o karotickém plátu. Molekulární zobrazování s několika novými tracery pro CEUS a PET, analýza textury v US B-obraze, pokročilejší 3D US,dynamické protokoly s kontrastním sycením nebo zobrazení karotické stěny na 7T MR jsou jen některé z výzkumných zájmů a jejich korelace s histologickými nálezy je nutná k dalšímu vývoji těchto technik.
Závěr
I když mnohé z uvedených technik jsou velkým příslibem do budoucna, v současnosti neexistuje jediná zobrazovací modalita, která by bezpečně zobrazila všechny nestabilní znaky plátu a pouze kombinace těchto metod může přinést jeho komplexní zhodnocení. V současnosti je rozhodnutí o CEA založeno převážně na stupni stenózy. Nicméně detailní charakterizace plátu může lépe pomoci predikovat riziko ischemické CMP a dovolí přesnější selekci pacientů k intervencím. Studie na tomto poli stále probíhají [113].
Jsou potřeba především velké multicentrické studie, abychom mohli zhodnotit, zda a do jaké míry je při výběru kandidátů k invazivním procedurám komplexní analýza aterosklerotického plátu superiorním hodnocením ve srovnání s prostým hodnocením plátu dle stupně stenózy. Můžeme ovšem s jistotou říci, že podrobnější diagnostika plátu může pomoci v zavedení personalizovaného hodnocení a dovolí nám individualizovat péči s cílem snížení rizika vzniku ischemických CMP na podkladě nestabilních karotických plátů.
Seznam zkratek
18FDG – 18F-fluorodeoxyglukóza
18F-NaF – 18F-natriumfluorid
2D – dvojrozměrný, dvoudimenzionální
3D – třírozměrný, třídimenzionální
ACES – Asymptomatic Carotid Emboli Study
BMT – best medical treatment
CAPITAL – Carotid Artery Plaque Virtual Histology Evaluation
CAS – karotický stenting
CEA – karotická endarterektomie
CE MR – kontrastní magnetická rezonance
CEUS – echokontrastní ultrazvukové vyšetření
dB-E – decibelové zesílení
DSA – digitální subtrakční angiografie
DSCT – dvouzdrojová CT
FC – fibrózní čepička
FDG – F-fluorodeoxyglukóza
FSE – fast spin-echo
Gd – gadolinium
GSM – gray scale median
HU – Hounsfieldovy jednotky
IBS – integrovaný ultrasonický zpětný rozptyl
IMT – intimomediální šíře
IPH – krvácení v aterosklerotickém plátu
IPN – neovaskularizace plátu
IVUS – intravaskulární ultrazvuk
JBA – juxtaluminální tmavý okrsek
LRNC – na lipidy bohaté nekrotické jádro
MDCT – multidetektorová CT
MES – mikroembolický signál
MMP – matrixová metaloproteináza
NIRS – blízká infračervená spektroskopie, near infrared spectroscopy
OCT – optická koherenční tomografie
PDA – analýza distribuce pixelů
PDW – proton denzitně vážené
SNAP – simultaneous non-contrast angiography and intraplaque haemorrhage
SPECT – jednofotonová emisní výpočetní tomografie
SPIO – supramagnetické částice oxidu železa
SUV – standardized uptake value
TCD – transkraniální Doppler
TIA – tranzitorní ischemická ataka
TOF – time-of-flight
TPA – celkový povrch plátu
TPV – celkový objem plátu
US – ultrazvuk
μOCT – mikro-optická koherenční tomografie
Práce byla podpořena granty AZV MZ ČR č. 16-29148A, 16-30965A a 17-31016A.
Autor deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Přijato k recenzi: 18. 4. 2018
Přijato do tisku: 25. 6. 2018
MUDr. Petra Kešnerová
Neurologická klinika 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: kesnerova.petra@gmail.com
MUDr. Petra Kešnerová
Petra Kešnerová promovala na 2. LF UK v Praze v roce 2005 a již krátce po promoci se ve své klinické praxi začala specializovat na oblast iktové problematiky. Svou studijní i klinickou praxi získávala mj. na zahraničních pracovištích ve Velké Británii, Francii, Srbsku či Itálii. Od roku 2014 se stala postgraduálním studentem 2. LF UK, výzkumným členem týmu Neuro 3 v Mezinárodním centru klinického výzkumu ICRC při FNUSA v Brně a rovněž zaměstnancem Neurologické kliniky 2. LF UK a FN Motol, kde pracuje jako člen cerebrovaskulárního týmu. Předmětem jejího výzkumného zájmu je především diagnostika cévní mozkové příhody se zaměřením na neurosonologii a prevence cerebrovaskulárních onemocnění, jimž se kromě své vědecké práce věnuje i ve své ambulantní praxi. V rámci neurosonologie se podílí rovněž na řešení klinických studií, grantových projektů, i pořádání edukačních a vědeckých programů včetně mezinárodních konferencí.
Sources
1. Touzé E. Natural history of asymptomatic carotid artery stenosis. Rev Neurol (Paris) 2008; 164(10): 793–800. doi: 10.1016/ j.neurol.2008.07.005.
2. Kernan WN, Ovbiagele B, Black HR et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/ American Stroke Association. Stroke 2014; 45(7): 2160–2236. doi: 10.1161/ STR.0000000000000024.
3. Altaf N, Daniels L, Morgan PS et al. Detection of intraplaque hemorrhage by magnetic resonance imaging in symptomatic patients with mild to moderate carotid stenosis predicts recurrent neurological events. J Vasc Surg 2008; 47(2): 337–342. doi: 10.1016/ j.jvs.2007.09.064.
4. Marquardt L, Geraghty OC, Mehta Z et al. Low risk of ipsilateral stroke in patients with asymptomatic carotid stenosis on best medical treatment: a prospective, population-based study. Stroke 2010; 41(1): e11–e17. doi: 10.1161/ STROKEAHA.109.561837.
5. Mossa-Basha M, Wasserman BA. Low-grade carotid stenosis: implications of MR imaging. Neuroimaging Clin N Am 2016; 26(1): 129–145. doi: 10.1016/ j.nic.2015.09.010.
6. Paraskevas KI, Spence JD, Veith FJ et al. Identifying which patients with asymptomatic carotid stenosis could benefit from intervention. Stroke 2014; 45(12): 3720–3724. doi: 10.1161/ STROKEAHA.114.006912.
7. Kolodgie FD, Yahagi K, Mori H et al. High-risk carotid plaque: lessons learned from histopathology. Semin Vasc Surg 2017; 30(1): 31–43. doi: 10.1053/ j.semvascsurg.2017.04.008.
8. Fleiner M, Kummer M, Mirlacher M et al. Arterial neovascularization and inflammation in vulnerable patients: early and late signs of symptomatic atherosclerosis. Circulation 2004; 110(18): 2843–2850. doi: 10.1161/ 01.CIR.0000146787.16297.E8.
9. Hellings WE, Peeters W, Moll FL et al. Composition of carotid atherosclerotic plaque is associated with cardiovascular outcome: a prognostic study. Circulation 2010; 121(17): 1941–1950. doi: 10.1161/ CIRCULATIONAHA.109.887497.
10. Fisher M, Paganini-Hill A, Martin A et al. Carotid plaque pathology: thrombosis, ulceration, and stroke pathogenesis. Stroke 2005; 36(2): 253–257. doi: 10.1161/ 01.STR.0000152336.71224.21.
11. Wasserman BA, Sharrett AR, Lai S et al. Risk factor associations with the presence of a lipid core in carotid plaque of asymptomatic individuals using high-resolution MRI: the multi-ethnic study of atherosclerosis (MESA). Stroke 2008; 39(2): 329–335. doi: 10.1161/ STROKEAHA.107.498634.
12. Naylor AR, Schroeder TV, Sillesen H. Clinical and imaging features associated with an increased risk of late stroke in patients with asymptomatic carotid disease. Eur J Vasc Endovasc Surg 2014; 48(6): 633–640. doi: 10.1016/ j.ejvs.2014.08.017.
13. Mathiesen EB, Johnsen SH, Wilsgaard T et al. Carotid plaque area and intima-media thickness in prediction of first-ever ischemic stroke: a 10-year follow-up of 6584 men and women: the Tromsø Study. Stroke 2011; 42(4): 972–998. doi: 10.1161/ STROKEAHA.110.589754.
14. Wannarong T, Parraga G, Buchanan D et al. Progression of carotid plaque volume predicts cardiovascular events. Stroke 2013; 44(7): 1859–1865. doi: 10.1161/ STROKEAHA.113.001461.
15. Gupta A, Baradaran H, Schweitzer AD et al. Carotid plaque MRI and stroke risk: a systematic review and meta-analysis. Stroke 2013; 44(11): 3071–3077. doi: 10.1161/ STROKEAHA.113.002551.
16. Spence JD. Transcranial Doppler monitoring for microemboli: a marker of a high-risk carotid plaque. Semin Vasc Surg 2017; 30(1): 62–66. doi: 10.1053/ j.semvascsurg.2017.04.011.
17. Markus HS, King A, Shipley M et al. Asymptomatic embolisation for prediction of stroke in the Asymptomatic Carotid Emboli Study (ACES): a prospective observational study. Lancet Neurol 2010: 9(7): 663–671. doi: 10.1016/ S1474-4422(10)70120-4.
18. Redgrave JN, Coutts SB, Schulz UG et al. Systematic review of associations between the presence of acute ischemic lesions on diffusion-weighted imaging and clinical predictors of early stroke risk after transient ischemic attack. Stroke 2007; 38(5): 1482–1488. doi: 10.1161/ STROKEAHA.106.477380.
19. Ritter MA, Dittrich R, Thoenissen N et al. Prevalence and prognostic impact of microembolic signals in arterial sources of embolism. A systematic review of the literature. J Neurol 2008; 255(7): 953–961. doi: 10.1007/ s00415-008-0638-8.
20. Freilinger TM, Schindler A, Schmidt C et al. Prevalence of nonstenosing, complicated atherosclerotic plaques in cryptogenic stroke. JACC Cardiovasc Imaging 2012; 5(4): 397–405. doi: 10.1016/ j.jcmg.2012.01.012.
21. Bayer-Karpinska A, Schwarz F, Wollenweber FA et al. The carotid plaque imaging in acute stroke (CAPIAS) study: protocol and initial baseline data. BMC Neurol 2013; 13: 201. doi: 10.1186/ 1471-2377-13-201.
22. Das M, Braunschweig T, Mühlenbruch G et al. Carotid plaque analysis: comparison of dual-source computed tomography (CT) findings and histopathological correlation. Eur J Vasc Endovasc Surg 2009; 38(1): 14–19. doi: 10.1016/ j.ejvs.2009.03.013.
23. Horie N, Morikawa M, Ishizaka S et al. Assessment of carotid plaque stability based on the dynamic enhancement pattern in plaque components with multidetector CT angiography. Stroke 2012; 43(2): 393–398. doi: 10.1161/ STROKEAHA.111.635953.
24. Josephson SA, Bryant SO, Mak HK et al. Evaluation of carotid stenosis using CT angiography in the initial evaluation of stroke and TIA. Neurology 2004; 63(3): 457–460.
25. Wintermark M, Jawadi SS, Rapp JH et al. High-resolution CT imaging of carotid artery atherosclerotic plaques. AJNR Am J Neuroradiol 2008; 29(5): 875–882. doi: 10.3174/ ajnr.A0950.
26. Brinjikji W, Huston J 3rd, Rabinstein AA et al. Contemporary carotid imaging: from degree of stenosis to plaque vulnerability. J Neurosurg 2016; 124(1): 27–42. doi: 10.3171/ 2015.1.JNS142452.
27. Huibers A, de Borst GJ, Wan S et al. Non-invasive Carotid Artery Imaging to Identify the Vulnerable Plaque: Current Status and Future Goals. Eur J Vasc Endovasc Surg 2015; 50(5): 563–572. doi: 10.1016/ j.ejvs.2015.06.113.
28. Saba L, Tamponi E, Raz E et al. Correlation between fissured fibrous cap and contrast enhancement: preliminary results with the use of CTA and histologic validation. AJNR Am J Neuroradiol 2014; 35(4): 754–759. doi: 10.3174/ ajnr.A3759.
29. van Gils MJ, Vukadinovic D, van Dijk AC et al. Carotid atherosclerotic plaque progression and change in plaque composition over time: a 5-year follow-up study using serial CT angiography. AJNR Am J Neuroradiol 2012; 33(7): 1267–1273. doi: 10.3174/ ajnr.A2970.
30. Watanabe Y, Nagayama M. MR plaque imaging of the carotid artery. Neuroradiology 2010; 52(4): 253–274. doi: 10.1007/ s00234-010-0663-z.
31. Millon A, Boussel L, Brevet M et al. Clinical and histological significance of gadolinium enhancement in carotid atherosclerotic plaque. Stroke 2012; 43(11): 3023–3028. doi: 10.1161/ STROKEAHA.112.662692.
32. Cai JM, Hatsukami TS, Ferguson MS et al. Classification of human carotid atherosclerotic lesions with in vivo multicontrast magnetic resonance imaging. Circulation 2002; 106(11): 1368–1373.
33. Puppini G, Furlan F, Cirota N et al. Characterisation of carotid atherosclerotic plaque: comparison between magnetic resonance imaging and histology. Radiol Med 2006; 111(7): 921–930. doi: 10.1007/ s11547-006-0091-7.
34. Saam T, Hetterich H, Hoffmann V et al. Meta-analysis and systematic review of the predictive value of carotid plaque hemorrhage on cerebrovascular events by magnetic resonance imaging. J Am Coll Cardiol 2013; 62(12): 1081–1091. doi: 10.1016/ j.jacc.2013.06.015.
35. den Hartog AG, Bovens SM, Koning W et al. Current status of clinical magnetic resonance imaging for plaque characterisation in patients with carotid artery stenosis. Eur J Vasc Endovasc Surg 2013; 45(1): 7–21. doi: 10.1016/ j.ejvs.2012.10.022.
36. Underhill HR, Yuan C, Yarnykh VL. Predictors of surface disruption with MR imaging in asymptomatic carotid artery stenosis. AJNR Am J Neuroradiol 2010; 31(3): 487–493. doi: 10.3174/ ajnr.A1842.
37. Chan JM, Monaco C, Wylezinska-Arridge M et al. Imaging of the vulnerable carotid plaque: biological targeting of inflammation in atherosclerosis using iron oxide particles and MRI. Eur J Vasc Endovasc Surg 2014; 47(5): 462–469. doi: 10.1016/ j.ejvs.2014.01.017.
38. Gaens ME, Backes WH, Rozel S et al. Dynamic contrast-enhanced MR imaging of carotid atherosclerotic plaque: model selection, reproducibility, and validation. Radiology 2013; 266(1): 271–279. doi: 10.1148/ radiol.12120499.
39. Esposito-Bauer L, Saam T, Ghodrati I et al. MRI plaque imaging detects carotid plaques with a high risk for future cerebrovascular events in asymptomatic patients. PLoS One 2013; 8(7): e67927. doi: 10.1371/ journal.pone.0067927.
40. Altaf N, Morgan PS, Moody A et al. Brain white matter hyperintensities are associated with carotid intraplaque hemorrhage. Radiology 2008; 248(1): 202–209. doi: 10.1148/ radiol.2481070300.
41. den Hartog AG, Bovens SM, Koning W et al. PLACD-7T Study: Atherosclerotic Carotid Plaque Components Correlated with Cerebral Damage at 7 Tesla Magnetic Resonance Imaging. Curr Cardiol Rev 2011; 7(1): 28–34. doi: 10.2174/ 157340311795677743.
42. Wang J, Börnert P, Zhao H et al. Simultaneous noncontrast angiography and intraplaque hemorrhage (SNAP) imaging for carotid atherosclerotic disease evaluation. Magn Reson Med 2013; 69(2): 337–345. doi: 10.1002/ mrm.24254.
43. de Rotte AA, Koning W, den Hartog AG et al. 7.0 T MRI detection of cerebral microinfarcts in patients with a symptomatic high-grade carotid artery stenosis. J Cereb Blood Flow Metab 2014; 34(10): 1715–1719. doi: 10.1038/ jcbfm.2014.141.
44. de Rotte AA, Koning W, Truijman MT et al. Seven-tesla magnetic resonance imaging of atherosclerotic plaque in the significantly stenosed carotid artery: a feasibility study. Invest Radiol 2014; 49(11): 749–757. doi: 10.1097/ RLI.0000000000000079.
45. van’t Klooster R, de Koning PJ, Dehnavi RA et al. Auto-matic lumen and outer wall segmentation of the carotid artery using deformable three-dimensional models in MR angiography and vessel wall images. J Magn Reson Imaging 2012; 35(1): 156–165. doi: 10.1002/ jmri.22809.
46. Makowski MR, Botnar RM. MR imaging of the arterial vessel wall: molecular imaging from bench to bedside. Radiology 2013; 269(1): 34–51. doi: 10.1148/ radiol.13102336.
47. Cocker MS, Mc Ardle B, Spence JD et al. Imaging atherosclerosis with hybrid [18F]fluorodeoxyglucose positron emission tomography/ computed tomography imaging: what Leonardo da Vinci could not see. J Nucl Cardiol 2012; 19(6): 1211–1225. doi: 10.1007/ s12350-012-9631-9.
48. Blomberg BA, Thomassen A, Takx RA et al. Delayed ¹⁸F-fluorodeoxyglucose PET/ CT imaging improves quantitation of atherosclerotic plaque inflammation: results from the CAMONA study. J Nucl Cardiol 2014; 21(3): 588–597. doi: 10.1007/ s12350-014-9884-6.
49. Rudd JH, Myers KS, Bansilal S et al. (18)Fluorodeoxyglucose positron emission tomography imaging of atherosclerotic plaque inflammation is highly reproducible: implications for atherosclerosis therapy trials. J Am Coll Cardiol 2007; 50(9): 892–896. doi: 10.1016/ j.jacc.2007.05.024.
50. Tawakol A, Migrino RQ, Bashian GG et al. In vivo 18F-fluorodeoxyglucose positron emission tomography imaging provides a noninvasive measure of carotid plaque inflammation in patients. J Am Coll Cardiol 2006; 48(9): 1818–1824. doi: 10.1016/ j.jacc.2006.05.076.
51. Masteling MG, Zeebregts CJ, Tio RA et al. High-resolution imaging of human atherosclerotic carotid plaques with micro 18F-FDG PET scanning exploring plaque vulnerability. J Nucl Cardiol 2011; 18(6): 1066–1075. doi: 10.1007/ s12350-011-9460-2.
52. Marnane M, Merwick A, Sheehan OC et al. Carotid plaque inflammation on 18F-fluorodeoxyglucose positron emission tomography predicts early stroke recurrence. Ann Neurol 2012; 71(5): 709–718. doi: 10.1002/ ana.23553.
53. Kwee RM, Teule GJ, van Oostenbrugge RJ et al. Multimodality imaging of carotid artery plaques: 18F-fluoro-2-deoxyglucose positron emission tomography, computed tomography, and magnetic resonance imaging. Stroke 2009; 40(12): 3718–3724. doi: 10.1161/ STROKEAHA.109.564088.
54. Joshi NV, Vesey AT, Williams MC et al. 18F-fluoride positron emission tomography for identification of ruptured and high-risk coronary atherosclerotic plaques: a prospective clinical trial. Lancet 2014; 383(9918): 705–713. doi: 10.1016/ S0140-6736(13)61754-7.
55. Derlin T, Wisotzki C, Richter U et al. In vivo imaging of mineral deposition in carotid plaque using 18F-sodium fluoride PET/ CT: correlation with atherogenic risk factors. J Nucl Med 2011; 52(3): 362–368. doi: 10.2967/ jnumed.110.081208.
56. Hermann S, Starsichova A, Waschkau B et al. Non-FDG imaging of atherosclerosis: will imaging of MMPs assess plaque vulnerability? J Nucl Cardiol 2012; 19(3): 609–617. doi: 10.1007/ s12350-012-9553-6.
57. Beer AJ, Pelisek J, Heider P et al. PET/ CT imaging of integrin αvβ3 expression in human carotid atherosclerosis. JACC Cardiovasc Imaging 2014; 7(2): 178–187. doi: 10.1016/ j.jcmg.2013.12.003.
58. Lammie GA, Wardlaw J, Allan P et al. What pathological components indicate carotid atheroma activity and can these be identified reliably using ultrasound? Eur J Ultrasound 2000; 11(2): 77–86.
59. Kyriacou EC, Pattichis C, Pattichis M et al. A review of noninvasive ultrasound image processing methods in the analysis of carotid plaque morphology for the assessment of stroke risk. IEEE Trans Inf Technol Biomed 2010; 14(4): 1027–1038. doi: 10.1109/ TITB.2010.2047649.
60. Grønholdt ML, Nordestgaard BG, Schroeder TV et al. Ultrasonic echolucent carotid plaques predict future strokes. Circulation 2001; 104(1): 68–73.
61. Nicolaides AN, Kakkos SK, Kyriacou E et al. Asymptomatic Carotid Stenosis and Risk of Stroke (ACSRS) Study Group. Asymptomatic internal carotid artery stenosis and cerebrovascular risk stratification. J Vasc Surg 2010; 52(6): 1486-1496. doi: 10.1016/ j.jvs.2010.07.021.
62. Cires-Drouet RS, Mozafarian M, Ali A et al. Imaging of high-risk carotid plaques: ultrasound. Semin Vasc Surg 2017; 30(1): 44–53. doi: 10.1053/ j.semvascsurg.2017.04.010.
63. Lal BK, Hobson RW 2nd, Hameed M et al. Noninvasive identification of the unstable carotid plaque. Ann Vasc Surg 2006; 20(2): 167–174. doi: 10.1007/ s10016-006-9000-8.
64. Kakkos SK, Griffin MB, Nicolaides AN et al. The size of juxtaluminal hypoechoic area in ultrasound images of asymptomatic carotid plaques predicts the occurrence of stroke. J Vasc Surg 2013; 57(3): 609–618. doi: 10.1016/ j.jvs.2012.09.045.
65. Roubec M, Kuliha M, Jonszta T et al. Detection of intracranial arterial stenosis using transcranial color-coded duplex sonography, computed tomographic angiography, and digital subtraction angiography. J Ultrasound Med 2011; 30(8): 1069–1075.
66. Waki H, Masuyama T, Mori H et al. Ultrasonic tissue characterization of the atherosclerotic carotid artery: histological correlates or carotid integrated backscatter. Circ J 2003; 67(12): 1013–1016.
67. Muraki M, Mikami T, Yoshimoto T et al. New criteria for the sonographic diagnosis of a plaque ulcer in the extracranial carotid artery. AJR Am J Roentgenol 2012; 198(5): 1161–1166. doi: 10.2214/ AJR.11.7018.
68. Prabhakaran S, Rundek T, Ramas R et al. Carotid plaque surface irregularity predicts ischemic stroke: the northern Manhattan study. Stroke 2006; 37(11): 2696–2701. doi: 10.1161/ 01.STR.0000244780.82190.a4.
69. Salem MK, Bown MJ, Sayers RD et al. Identification of patients with a histologically unstable carotid plaque using ultrasonic plaque image analysis. Eur J Vasc Endovasc Surg 2014; 48(2): 118–125. doi: 10.1016/ j.ejvs.2014.05.015.
70. Davies MJ, Richardson PD, Woolf N et al. Risk of thrombosis in human atherosclerotic plaques: role of extracellular lipid, macrophage, and smooth muscle cell content. Br Heart J 1993; 69(5): 377–381.
71. Gupta A, Kesavabhotla K, Baradaran H et al. Plaque echolucency and stroke risk in asymptomatic carotid stenosis: a systematic review and meta-analysis. Stroke 2015; 46(1): 91–97. doi: 10.1161/ STROKEAHA.114.006091.
72. Mathiesen EB, Bønaa KH, Joakimsen O. Echolucent plaques are associated with high risk of ischemic cerebrovascular events in carotid stenosis: the tromsø study. Circulation 2001; 103(17): 2171–2175.
73. Saha SA, Gourineni V, Feinstein SB. The use of contrast-enhanced ultrasonography for imaging of carotid atherosclerotic plaques: current evidence, future directions. Neuroimaging Clin N Am 2016; 26(1): 81–96. doi: 10.1016/ j.nic.2015.09.007.
74. Faggioli GL, Pini R, Mauro R et al. Identification of carotid ‘vulnerable plaque’ by contrast-enhanced ultrasonography: correlation with plaque histology, symptoms and cerebral computed tomography. Eur J Vasc Endovasc Surg 2011; 41(2): 238–248. doi: 10.1016/ j.ejvs.2010.11.002.
75. Kim HS, Woo JS, Kim BY et al. Biochemical and clinical correlation of intraplaque neovascularization using contrast-enhanced ultrasound of the carotid artery. Atherosclerosis 2014; 233(2): 579–583. doi: 10.1016/ j.atherosclerosis.2014.01.042.
76. Chang X, Feng J, Ruan L et al. Positive correlation between neovascularization degree of carotid atherosclerosis determined by contrast-enhanced ultrasound and level of serum C-reactive protein. Vasa 2015; 44(3): 187–194. doi: 10.1024/ 0301-1526/ a000429.
77. Lindner JR, Dayton PA, Coggins MP et al. Noninvasive imaging of inflammation by ultrasound detection of phagocytosed microbubbles. Circulation 2000; 102(5): 531–538.
78. Owen DR, Shalhoub J, Miller S et al. Inflammation within carotid atherosclerotic plaque: assessment with late-phase contrast-enhanced US. Radiology 2010; 255(2): 638–644. doi: 10.1148/ radiol.10091365.
79. ten Kate GL, van Dijk AC, van den Oord SC et al. Usefulness of contrast-enhanced ultrasound for detection of carotid plaque ulceration in patients with symptomatic carotid atherosclerosis. Am J Cardiol 2013; 112(2): 292–298. doi: 10.1016/ j.amjcard.2013.03.028.
80. van den Oord SC, ten Kate GL, Sijbrands EJ et al. Effect of carotid plaque screening using contrast-enhanced ultrasound on cardiovascular risk stratification. Am J Cardiol 2013; 111(5): 754–759. doi: 10.1016/ j.amjcard.2012.11.033.
81. Hammond CJ, McPherson SJ, Patel JV et al. Assessment of apparent internal carotid occlusion on ultrasound: prospective comparison of contrast-enhanced ultrasound, magnetic resonance angiography and digital subtraction angiography. Eur J Vasc Endovasc Surg 2008; 35(4): 405–412. doi: 10.1016/ j.ejvs.2007.12.008.
82. Makris GC, Lavida A, Griffin M et al. Three-dimensional ultrasound imaging for the evaluation of carotid atherosclerosis. Atherosclerosis 2011; 219(2): 377–383. doi: 10.1016/ j.atherosclerosis.2011.05.006.
83. Spence JD, Eliasziw M, DiCicco M et al. Carotid plaque area: a tool for targeting and evaluating vascular preventive therapy. Stroke 2002; 33(12): 2916–2922.
84. Kuk M, Wannarong T, Beletsky V et al. Volume of carotid artery ulceration as a predictor of cardiovascular events. Stroke 2014; 45(5): 1437–1441. doi: 10.1161/ STROKEAHA.114.005163.
85. Zhang Q, Li C, Zhou M et al. Quantification of carotid plaque elasticity and intraplaque neovascularization using contrast-enhanced ultrasound and image registration-based elastography. Ultrasonics 2015; 62: 253–262. doi: 10.1016/ j.ultras.2015.05.025.
86. Huang C, Pan X, He Q et al. ultrasound-based carotid elastography for detection of vulnerable atherosclerotic plaques validated by magnetic resonance imaging. Ultrasound Med Biol 2016; 42(2): 365–377. doi: 10.1016/ j.ultrasmedbio.2015.09.023.
87. Topakian R, King A, Kwon SU et al. Ultrasonic plaque echolucency and emboli signals predict stroke in asymptomatic carotid stenosis. Neurology 2011; 77(8): 751–758. doi: 10.1212/ WNL.0b013e31822b00a6.
88. van Zuilen EV, Moll FL, Vermeulen FE et al. Detection of cerebral microemboli by means of transcranial Doppler monitoring before and after carotid endarterectomy. Stroke 1995; 26(2): 210–213.
89. Spence JD. Determinants of carotid plaque burden. Atherosclerosis 2016; 255: 122–123. doi: 10.1016/ j.atherosclerosis.2016.10.045.
90. Tegos TJ, Sohail M, Sabetai MM et al. Echomorphologic and histopathologic characteristics of unstable carotid plaques. AJNR Am J Neuroradiol 2000; 21(10): 1937–1944.
91. ten Kate GL, Renaud GG, Akkus Z et al. Far-wall pseudoenhancement during contrast-enhanced ultrasound of the carotid arteries: clinical description and in vitro reproduction. Ultrasound Med Biol 2012; 38(4): 593–600. doi: 10.1016/ j.ultrasmedbio.2011.12.019.
92. Alonso A, Artemis D, Hennerici MG. Molecular imaging of carotid plaque vulnerability. Cerebrovasc Dis 2015; 39(1): 5–12. doi: 10.1159/ 000369123.
93. van Engelen A, Wannarong T, Parraga G et al Three-dimensional carotid ultrasound plaque texture predicts vascular events. Stroke 2014; 45(9): 2695–2701. doi: 10.1161/ STROKEAHA.114.005752.
94. Krams R, Cheng C, Helderman F et al. Shear stress is associated with markers of plaque vulnerability and MMP-9 activity. EuroIntervention 2006; 2(2): 250–256.
95. Czernuszewicz TJ, Homeister JW, Caughey MC et al. Non-invasive in vivo characterization of human carotid plaques with acoustic radiation force impulse ultrasound: comparison with histology after endarterectomy. Ultrasound Med Biol 2015; 41(3): 685–697. doi: 10.1016/ j.ultrasmedbio.2014.09.016.
96. Diethrich EB, Pauliina Margolis M, Reid DB et al. Virtual histology intravascular ultrasound assessment of carotid artery disease: the Carotid Artery Plaque Virtual Histology Evaluation (CAPITAL) study. J Endovasc Ther 2007; 14(5): 676–686. doi: 10.1177/ 152660280701400512.
97. Celeng C, Takx RA, Ferencik M et al. Non-invasive and invasive imaging of vulnerable coronary plaque. Trends Cardiovasc Med 2016; 26(6): 538–547. doi: 10. 1016/ j.tcm.2016.03.005.
98. Spence JD, Hackam DG. Treating arteries instead of risk factors: a paradigm change in management of atherosclerosis. Stroke 2010; 41(6): 1193–1199. doi: 10.1161/ STROKEAHA.110.577973.
99. Spence JD, Parraga G. Three-simensional ultrasound of carotid plaque. Neuroimaging Clin N Am 2016; 26(1): 69–80. doi: 10.1016/ j.nic.2015.09.006.
100. Sibley CT, Vavere AL, Gottlieb I et al. MRI-measured regression of carotid atherosclerosis induced by statins with and without niacin in a randomised controlled trial: the NIA plaque study. Heart 2013; 99(22): 1675–1680. doi: 10.1136/ heartjnl-2013-303926.
101. Underhill HR, Yuan C, Zhao XQ et al. Effect of rosuvastatin therapy on carotid plaque morphology and composition in moderately hypercholesterolemic patients: a high-resolution magnetic resonance imaging trial. Am Heart J 2008; 155(3): 584.e1–584.e8. doi: 10.1016/ j.ahj.2007.11.018.
102. Yoshida K, Sadamasa N, Narumi O et al. Symptomatic low-grade carotid stenosis with intraplaque hemorrhage and expansive arterial remodeling is associated with a high relapse rate refractory to medical treatment. Neurosurgery 2012; 70(5): 1143–1150. doi: 10.1227/ NEU.0b013e31823fe50b.
103. Yoshimura S, Yamada K, Kawasaki M et al. Selection of carotid artery stenting or endarterectomy based on magnetic resonance plaque imaging reduced periprocedural adverse events. J Stroke Cerebrovasc Dis 2013; 22(7): 1082–1087. doi: 10.1016/ j.jstrokecerebrovasdis.2012.07.018.
104. Mizoguchi M, Tahara N, Tahara A et al. Pioglitazone attenuates atherosclerotic plaque inflammation in patients with impaired glucose tolerance or diabetes a prospective, randomized, comparator-controlled study using serial FDG PET/ CT imaging study of carotid artery and ascending aorta. JACC Cardiovasc Imaging 2011; 4(10): 1110–1118. doi: 10.1016/ j.jcmg.2011.08.007.
105. Tawakol A, Fayad ZA, Mogg R et al. Intensification of statin therapy results in a rapid reduction in atherosclerotic inflammation: results of a multicenter fluorodeoxyglucose-positron emission tomography/ computed tomography feasibility study. J Am Coll Cardiol 2013; 62(10): 909–917. doi: 10.1016/ j.jacc.2013.04.066.
106. Della-Morte D, Moussa I, Elkind MS et al. The short-term effect of atorvastatin on carotid plaque morphology assessed by computer-assisted gray-scale densitometry: a pilot study. Neurol Res 2011; 33(9): 991–994. doi: 10.1179/ 1743132811Y.0000000039.
107. Kadoglou NP, Sailer N, Moumtzouoglou A et al. Aggressive lipid-lowering is more effective than moderate lipid-lowering treatment in carotid plaque stabilization. J Vasc Surg 2010; 51(1): 114–121. doi: 10.1016/ j.jvs.2009.07.119.
108. Deyama J, Nakamura T, Takishima I et al. Contrast-enhanced ultrasound imaging of carotid plaque neovascularization is useful for identifying high-risk patients with coronary artery disease. Circ J 2013; 77(6): 1499–1507.
109. Bar M, Roubec M, Farana R et al. Inter-rater reliability of carotid atherosclerotic plaque quantification by 3-dimensional sonography. J Ultrasound Med 2014; 33(7): 1273–1278. doi: 10.7863/ ultra.33.7.1273.
110. Ainsworth CD, Blake CC, Tamayo A et al. 3D ultrasound measurement of change in carotid plaque volume: a tool for rapid evaluation of new therapies. Stroke 2005; 36(9): 1904–1909. doi: 10.1161/ 01.STR.0000178543.19433.20.
111. Noyes AM, Thompson PD. A systematic review of the time course of atherosclerotic plaque regression. Atherosclerosis 2014; 234(1): 75–84. doi: 10.1016/ j.atherosclerosis.2014.02.007.
112. Qureshi AI, Alexandrov AV, Tegeler CH et al. Guidelines for screening of extracranial carotid artery disease: a statement for healthcare professionals from the multidisciplinary practice guidelines committee of the American Society of Neuroimaging; cosponsored by the Society of Vascular and Interventional Neurology. J Neuroimaging 2007; 17(1): 19–47. doi: 10.1111/ j.1552-6569.2006.00085.x.
113. Truijman MT, Kooi ME, van Dijk AC et al. Plaque At RISK (PARISK): prospective multicenter study to improve diagnosis of high-risk carotid plaques. Int J Stroke 2014; 9(6): 747–754. doi: 10.1111/ ijs.12167.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2018 Issue 4
Most read in this issue
- Antiagregačná a antikoagulačná liečba pri karotickej endarterektómii
- Zobrazení periferních nervů pomocí difuzního tenzoru a MR traktografie
- Oboustranná paréza nervus abducens po úrazu hlavy a krční páteře
- Huntingtonova nemoc se začátkem v seniu – přehlížená diagnóza

