Moderní techniky MR zobrazení u roztroušené sklerózy
State-of-the-Art MRI Techniques for Multiple Sclerosis
Magnetic resonance imaging (MRI) is currently a key component of multiple sclerosis diagnostics. In addition to conventional techniques, based on the evaluat ion of the number and localization of visible brain and spinal cord lesions, in recent years we have seen a rapid development of new MRI techniques providing new quantitative biomarkers which better characterize pathological structural changes in central nervous system tissues occurring due to a demyelinating disease. This article summarizes new trends in MRI diagnostics of multiple sclerosis in terms of the technical foundations of different methods, possibilities for data analysis and their practical use.
Key words:
multiple sclerosis – magnetic resonance imaging – neuroimaging – diffusion tensor imaging – proton magnetic resonance spectroscopy
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Supported by Czech health research council of the Ministry of Health of the Czech Republic (NV15-32133A) and by funds from the Faculty of Medicine MU to junior researcher (M. Keřkovský).
Authors:
M. Keřkovský 1; J. Stulík 1; I. Obhlídalová 2; P. Praksová 2; J. Bednařík 2; M. Dostál 1,3; M. Kuhn 4–6; A. Šprláková-Puková 1; M. Mechl 1
Authors‘ workplace:
Klinika radiologie a nukleární medicíny LF MU a FN Brno
1; Neurologická klinika LF MU a FN Brno
2; Biofyzikální ústav, LF MU a FN Brno
3; Psychiatrická klinika LF MU a FN Brno
4; Institut biostatistiky a analýz, LF MU, Brno
5; Behaviorální a sociální neurovědy, CEITEC – Středoevropský technologický institut MU
6
Published in:
Cesk Slov Neurol N 2017; 80(6): 647-657
Category:
Review Article
doi:
https://doi.org/10.14735/amcsnn2017647
Overview
Magnetická rezonance (MR) je v současnosti klíčovou součástí diagnostiky roztroušené sklerózy. Kromě konvenčních technik založených na hodnocení počtu a lokalizace viditelných lézí mozku a míchy zaznamenáváme v posledních letech rychlý rozvoj nových technik MR zobrazení, které poskytují nové kvantitativní biomarkery lépe charakterizující patologické strukturální změny tkání centrálního nervového systému vzniklé v důsledku demyelinizačního onemocnění. V tomto článku jsou shrnuty nové trendy v MR diagnostice roztroušené sklerózy po stránce technických základů jednotlivých metod, možností analýzy dat i jejich praktického využití.
Klíčová slova:
roztroušená skleróza – zobrazení magnetickou rezonancí – zobrazení nervového systému – zobrazení tenzorů difuze – protonová magnetickorezonanční spektroskopie
Úvod
Roztroušená skleróza (RS) představuje chronické zánětlivé onemocnění centrálního nervového systému (CNS), které je z patomorfologického hlediska charakterizováno přítomností zánětlivé infiltrace, demyelinizace, axonálního poškození a gliózy v různých oblastech CNS. Predilekčně jsou postiženy zrakové nervy, mozkový kmen, mozeček, dále periventrikulární a subkortikální bílá hmota mozkových hemisfér [1]. Je též známo, že patologický proces u pacientů s RS není limitován pouze na bílou hmotu, nýbrž postihuje často i oblasti kortikální a hluboké subkortikální šedé hmoty mozku [2]
Magnetická rezonance (MR) hraje v současnosti klíčovou roli v diagnostice RS. MR diagnostika je založena především na využití T2 vážených sekvencí a zobrazení FLAIR (fluid attenuated inversion recovery), pomocí kterých lze detekovat hyperintenzní léze mozku či míchy. Ukazuje se však, že konvenční techniky MR zobrazení neumožňují zcela komplexní náhled na patofyziologické procesy v rámci RS. Tyto limitace lze dokumentovat např. poměrně chabou korelací MR nálezů s klinickou symptomatikou a diskrepancí mezi MR zobrazením a histopatologickými nálezy [3,4]. Dále je známo, že konvenční techniky MR mají relativně omezené možnosti detekce lézí šedé hmoty a difuzních změn v bílé hmotě [5]. V posledních letech se začínají využívat nejrůznější nové techniky MR zobrazení, jejichž rozvoj je spjat s celkovým vývojem MR technologie a které nabízejí komplexnější náhled na strukturální poškození CNS v rámci RS. U některých technik je nespornou výhodou možnost kvantifikace nejrůznějších parametrů, které se mohou stát cennými biomarkery v diagnostice a sledování vývoje demyelinizačního onemocnění. V dalších odstavcích pojednáme o vybraných technikách MR zobrazování z hlediska základů techniky a analýzy získaných dat i možností praktického využití u pacientů s RS.
Konvenční techniky
Detekce T2 hyperintenzních ložisek je základem konvenčního radiologického hodnocení MR vyšetření u pacientů s RS nebo s klinicky izolovaným syndromem (CIS), který představuje iniciální stadium demyelinizačního onemocnění [6]. Z hlediska diferenciální diagnostiky a predikce vývoje CIS do klinicky definitivní RS je zásadní zejména zhodnocení počtu a lokalizace ložisek, případně jejich postkontrastního sycení a dynamiky MR nálezu v čase. Tyto atributy jsou součástí původních tzv. McDonaldových kritérií, aktuálně v poslední revizi z roku 2010 s následným upřesněním doporučeními skupiny MAGNIMS pro radiologická diagnostická MR kritéria z 2016 (obr. 1) [7].
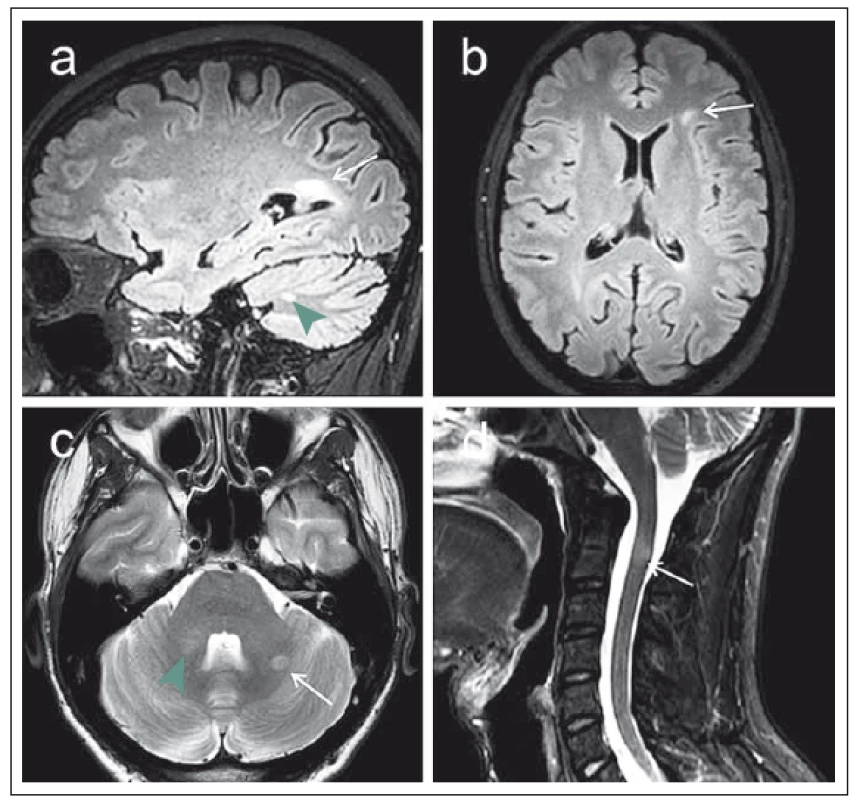
I v oblasti těchto tzv. konvenčních technik však dochází k určitému vývoji, v této souvislosti je významná zejména otázka senzitivity detekce ložisek. V oblasti zobrazení míchy je kromě T2 zobrazení k dispozici již běžně využívána sekvence STIR (short-tau inversion recovery), která disponuje lepším kontrastním rozlišením demyelinizačních lézí v porovnání s T2 váženým obrazem, a usnadňuje tak jejich detekci [8]. Zejména na 3T MR přístrojích lze s výhodou využít též nové techniky 3D zobrazení sekvencí FLAIR, které disponují vyšší senzitivitou pro detekci demyelinizačních ložisek bílé hmoty mozkové [9].
Další zajímavou možností je zobrazení „double inversion recovery“ (DIR). Tato sekvence pomocí dvou inverzních pulzů potlačuje zároveň signál mozkomíšního moku i bílé hmoty mozkové, čímž zvyšuje kontrast mezi bílou hmotou a kortexem [10]. Bylo prokázáno, že tato sekvence vykazuje vyšší senzitivitu pro detekci lézí v bílé hmotě oproti T2 a FLAIR vzhledem k vyššímu kontrastu ložisek vůči okolí, umožňuje též lepší detekci lézí infratentoriálních (obr. 2) [11]. Další výhodou techniky DIR je lepší detekce intrakortikálních lézí [12]. Již delší dobu je z histopatologických studií známo, že kortikální postižení je součástí patofyziologie tohoto onemocnění [13] a pomocí techniky DIR byly kortikální léze prokázány řadou autorů, a to i v nejčasnějších stadiích onemocnění [14] nebo u pacientů bez viditelných lézí v bílé hmotě [15]. Někteří autoři též poukazují na signifikantní korelace počtu kortikálních lézí s tíží kognitivního deficitu u pacientů s RS [16] nebo na korelace s mírou fyzické disability [14].
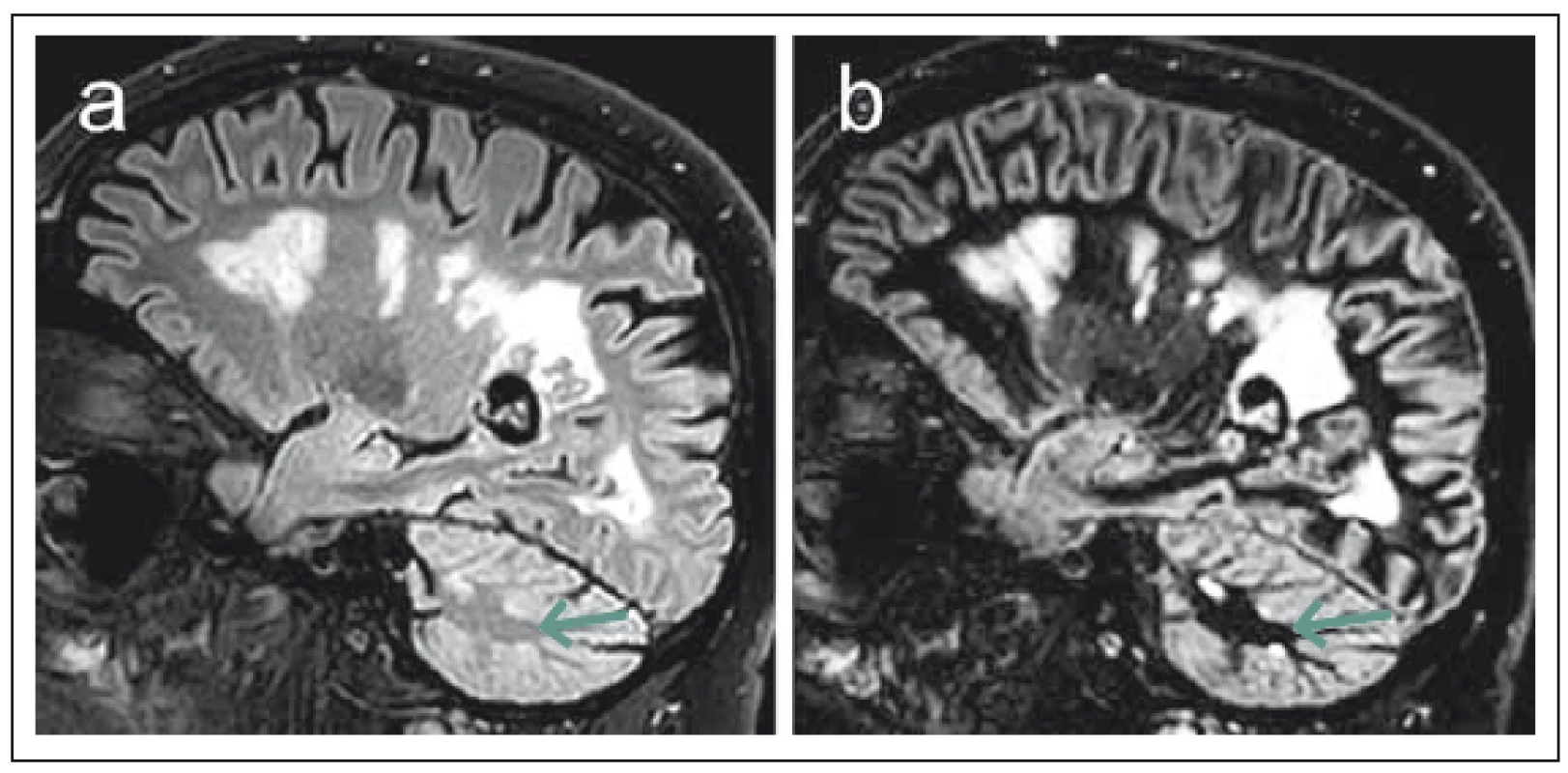
Na hranici konvenčních technik MR zobrazení lze řadit susceptibilně vážené zobrazení (susceptibility-weighted imaging, SWI). Susceptibilitou označujeme fyzikální vlastnost, která charakterizuje míru magnetizace určitého materiálu v magnetickém poli [17]. Celkovou susceptibilitu mozkové tkáně určuje převážně podíl diamagnetické vody ve tkáni, přítomnost paramagnetického železa, stupeň oxygenace krve v kapilárách a vénách a v neposlední řadě zastoupení diamagnetických složek myelinu [18]. Jednou ze zajímavých možností této techniky je zobrazení centrální venuly v rámci demyelinizačních lézí (obr. 3), což umožňují silně paramagnetické vlastnosti deoxyhemoglobinu v těchto žilních strukturách [19]. Histopatologické studie potvrzují perivenózní lokalizaci demyelinizačních plak [20], v souladu s tím řada studií pomocí SWI zobrazení prokázala přítomnost centrální vény u většiny demyelinizačních ložisek u pacientů s RS v porovnání s významně menším zastoupením tohoto nálezu u ložisek odlišné etiologie [21,22]. Autoři Tallantyre et al udávají 80% výskyt perivenulárních ložisek ze všech hodnocených T2 hyperintenzních lézí u skupiny pacientů s RS oproti 19 % u kontrolní skupiny subjektů s T2 hyperintenzními ložisky jiné etiologie. Jako hraniční hodnota pro odlišení pacientů s RS je zde uváděno 40 % perivenulárně lokalizovaných lézí [22]. V další práci autorů Kilsdonk et al je dokumentován relativně menší rozdíl v zastoupení lézí s centrální venulou u pacientů s RS (74 %) oproti pacientům s ložisky vaskulární etiologie (47 %). Při stanovení cut-off hodnoty 52 % však při společném hodnocení celkového počtu ložisek a přítomnosti centrální venuly bylo stále možné odlišit jednotlivé etiologicky různé skupiny pacientů se senzitivitou a specificitou 88 % [23]. SWI tak skýtá určitý potenciál pro odlišení demyelinizačních lézí od ložisek odlišné etiologie, což lze považovat v rámci diagnostiky RS za obecný problém. Zároveň je však třeba říci, že specificita tohoto biomarkeru není doposud zcela ověřena a byla studována jen ve vztahu k omezenému množství patologických stavů mimo RS. Jeho spolehlivost proto musí být ještě ověřena [24]. Praktickému využití této techniky též příliš nepřispívá skutečnost, že je v současnosti doménou převážně experimentálních „high-field“ MR přístrojů [25].
Další známkou, kterou lze pozorovat na sekvencích typu SWI, jsou plošné hypointenzity v rámci demyelinizačních lézí nebo jemný hypointenzní lem v periferii ložisek. Tyto nálezy jsou též některými autory uváděny jako relativně specifické pro CIS nebo RS v porovnání s jinými druhy neurologických onemocnění [23,26], ačkoli patofyziologický podklad tohoto jevu není doposud zcela objasněn; zvažován je zejména podíl depozit metabolitů železa, případně i role volných radikálů ve spojitosti se zánětlivým procesem [27].
Volumometrie
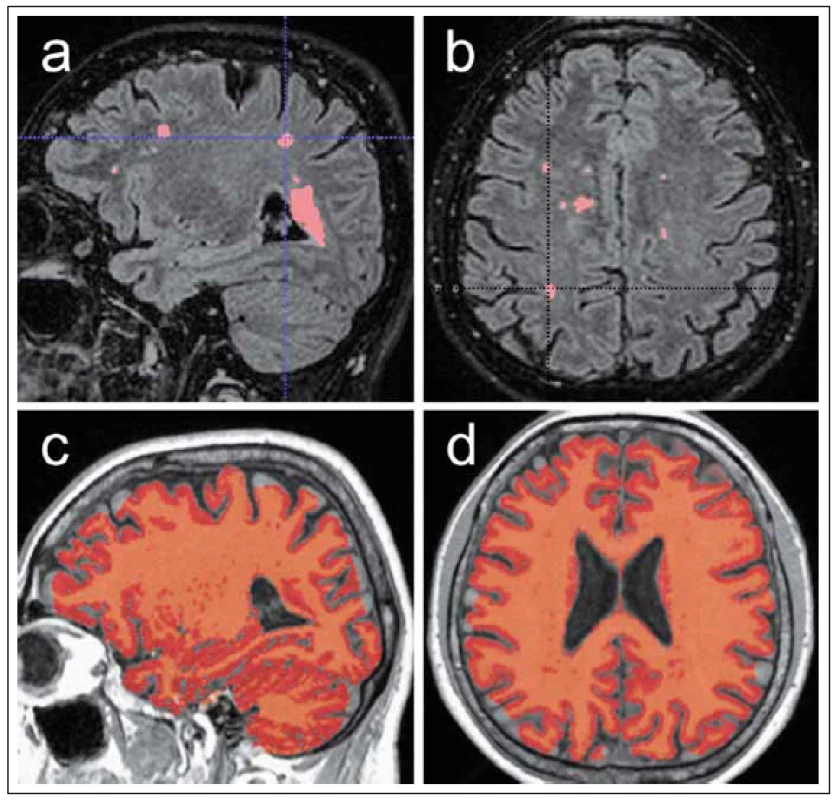
V souvislosti s nástupem nových léčebných preparátů jsou vyvíjeny velké snahy najít spolehlivé prognostické markery, pomocí nichž by bylo možné individuálně predikovat budoucí průběh a aktivitu choroby. Jako slibné se v této souvislosti jeví zejména měření počtu a objemu T2 hyperintenzních lézí a kvantifikace stupně mozkové atrofie (obr. 4). Výhodou těchto technik jsou obvykle semiautomatizované postupy a skutečnost, že jsou jako zdrojová data využity konvenční sekvence MR zobrazení, které jsou zároveň použity pro běžné radiologické hodnocení. Pro validní volumometrickou analýzu však i tyto konvenční sekvence musí splňovat určité náležitosti, a to zejména dostatečné prostorové rozlišení; pro účely hodnocení mozkové atrofie je obvykle využívána 3D T1 sekvence gradientního echa s velikostí voxelu kolem 1 mm3. Pro kvantifikaci T2 hyperintenzních lézí lze s výhodou využít 3D FLAIR sekvence turbo-spinového echa s variabilní hodnotou sklápěcího úhlu disponující obdobně vysokým rozlišením [28]. MR protokoly používané pro diagnostiku RS je tedy třeba do určité míry optimalizovat, aby data bylo možné použít pro validní měření objemu. Zejména pro účely longitudinálního sledování vývoje onemocnění u individuálních pacientů je pro dosažení co nejkonzistentnějších výsledků třeba zdůraznit také potřebu standardizace zobrazovací diagnostiky. Jedná se o provádění kontrolních vyšetření pokud možno na stejném MR přístroji za pomoci standardního diagnostického protokolu a provádění analýz obrazových dat při použití stále stejných softwarových nástrojů. Již v počátku onemocnění může zjištění počtu případně objemu hyperintenzních ložisek v T2 obraze pomoci v odhadu pacientovy prognózy. Samotná přítomnost T2 hyperintenzních ložisek v počátku onemocnění s sebou nese riziko konverze CIS do klinicky definitivní RS v dlouhodobém horizontu v 60 – 80 % oproti 20% riziku konverze při negativním vstupním MR nálezu [6]. Řada autorů však udává též asociaci počtu a celkového objemu T2 hyperintenzních ložisek detekovaných v počátku onemocnění se zvýšeným rizikem pozdější konverze do klinicky definitivní RS [29].
Podle starších studií při dalším sledování koreluje počet a objem lézí s vývojem dlouhodobé disability již relativně méně. Tento jev je označován jako klinicko-radiologický paradox [30]. Další longitudinální studie nicméně prokázaly korelaci zhoršení klinického stavu v delším časovém období s vyšším počtem a objemem ložisek detekovaných v několika prvních letech onemocnění [31]. Někteří autoři poukazují též na význam objemu T2 hyperintenzních ložisek na vstupním MR vyšetření z hlediska rozvoje krátkodobé disability se zhoršením skóre EDSS (Expanded Disability Status Scale) [32,33]. Dalším parametrem, který lze pomocí výpočetní analýzy obrazu kvantifikovat z konvenčních technik T1 3D zobrazení, je míra mozkové atrofie. Progresivní ztráta objemu mozkové tkáně je obvyklým rysem RS, za níž stojí zejména ztráta myelinu a oligodendrocytů a v neposlední řadě i ztráta neuronů a neuroglie šedé hmoty mozkové [34,35]. Již v roce 1999 autoři Dastidar et al prokázali korelaci objemu kompartmentu mozkomíšního moku vyjadřujícího stupeň atrofie s klinickým skóre EDSS [36]. Mozková atrofie bývá též považována za poměrně časnou známku RS a její vývoj v prvním roce je významným prediktivním faktorem pro budoucí zhoršení [37]. Autoři Min neboo et al poukazují na význam míry atrofie mozku pro predikci vývoje klinického postižení v prvních letech onemocnění RS [32].
Je však třeba se zmínit o tom, že měřené změny objemu mozku nemusí být dány pouze skutečnou atrofií podmíněnou ztrátou mozkové tkáně. V několika studiích byl pozorován pokles objemu mozku především v prvním roce imunomodulační léčby oproti kontrolním skupinám. Naopak v druhém a třetím roce byl pozorován protektivní efekt léčby v podobě redukce ztráty objemu mozku [38]; obdobné změny byly patrny též u pacientů léčených natalizumabem [39]. Tento jev, označovaný jako „pseudoatrofie“, by mohl být spojen s ústupem edému mozkové tkáně v úvodu léčby a je třeba s ním počítat při interpretaci výsledků studií zkoumajících protektivní účinky léčby u pacientů s RS [40].
Je též známo, že jednotlivé oblasti mozku mohou atrofovat různou rychlostí; např. atrofie corpus callosum, thalamu, hypothalamu, putamen, nucleus caudatus či mozkového kmene se ukázala jako významný prediktor konverze CIS do klinicky definitivní RS [41,42]. Za významné lze považovat zejména změny objemu thalamů a kalózního tělesa. Řada autorů uvádí silné korelace atrofizace thalamu s klinickou progresí onemocnění [43]. Autoři Vaněčková et al udávají atrofii kalózního tělesa v průběhu prvního roku onemocnění jako významný prediktor rozvoje pozdější disability. Pro kvantifikaci je zde využito jednoduché a v praxi aplikovatelné měření plochy kalózního tělesa na sagitálních MR obrazech [44]. Klinický význam atrofie v ostatních zmiňovaných oblastech je třeba ještě ověřit [43].
Regionální změny objemu mozku je obecně možné kvantifikovat pomocí různých více či méně automatizovaných technik. Jako příklad lze uvést volně dostupné softwarové nástroje VBM (voxel-based morphometry) platformy SPM (statistical parametric mapping) [45]. Obdobná je situace v případě volumometrické analýzy celkového objemu mozku, jako příklad automatizovaného řešení umožňujícího stanovení celkového objemu mozku, objemu šedé a bílé hmoty a objemu kompartmentu mozkomíšního moku můžeme uvést software SIENAX [46].
Z výše uvedeného je zřejmé, že kvantifikace počtu a objemu T2 hyperintenzních lézí i měření mozkové atrofie je cenný nástroj umožňující predikovat klinický vývoj u pacientů s RS a sledovat odpověď na léčbu. Tyto techniky tak mají reálnou šanci prosadit se v praxi a stát se standardní součástí MR diagnostiky u pacientů s RS. Většímu praktickému rozšíření těchto metod doposud brání zejména nutnost použití externích softwarových aplikací, což zvyšuje časovou náročnost a celkově v praxi komplikuje hodnocení. Byla by proto žádoucí širší implementace vysoce automatizovaných softwarových nástrojů do komerčních aplikací využívaných pro rutinní hodnocení MR vyšetření.
Zobrazení difuze
Jako difuze se označuje náhodný pohyb molekul vody ve tkáni označovaný jako tzv. Brownův pohyb. Citlivosti sekvencí spinového i gradientního echa MR zobrazení vůči tomuto jevu lze docílit použitím přídatného magnetického gradientu, jehož charakteristiku (zejm. amplitudu a časový průběh) vyjadřuje tzv. b faktor [47]. Míru difuzivity molekul vody ve tkáni se dá vyjádřit číselně hodnotou ADC (apparent diffusion coefficient). K výpočtu ADC mapy je třeba dvou měření s různou hodnotou b faktoru.
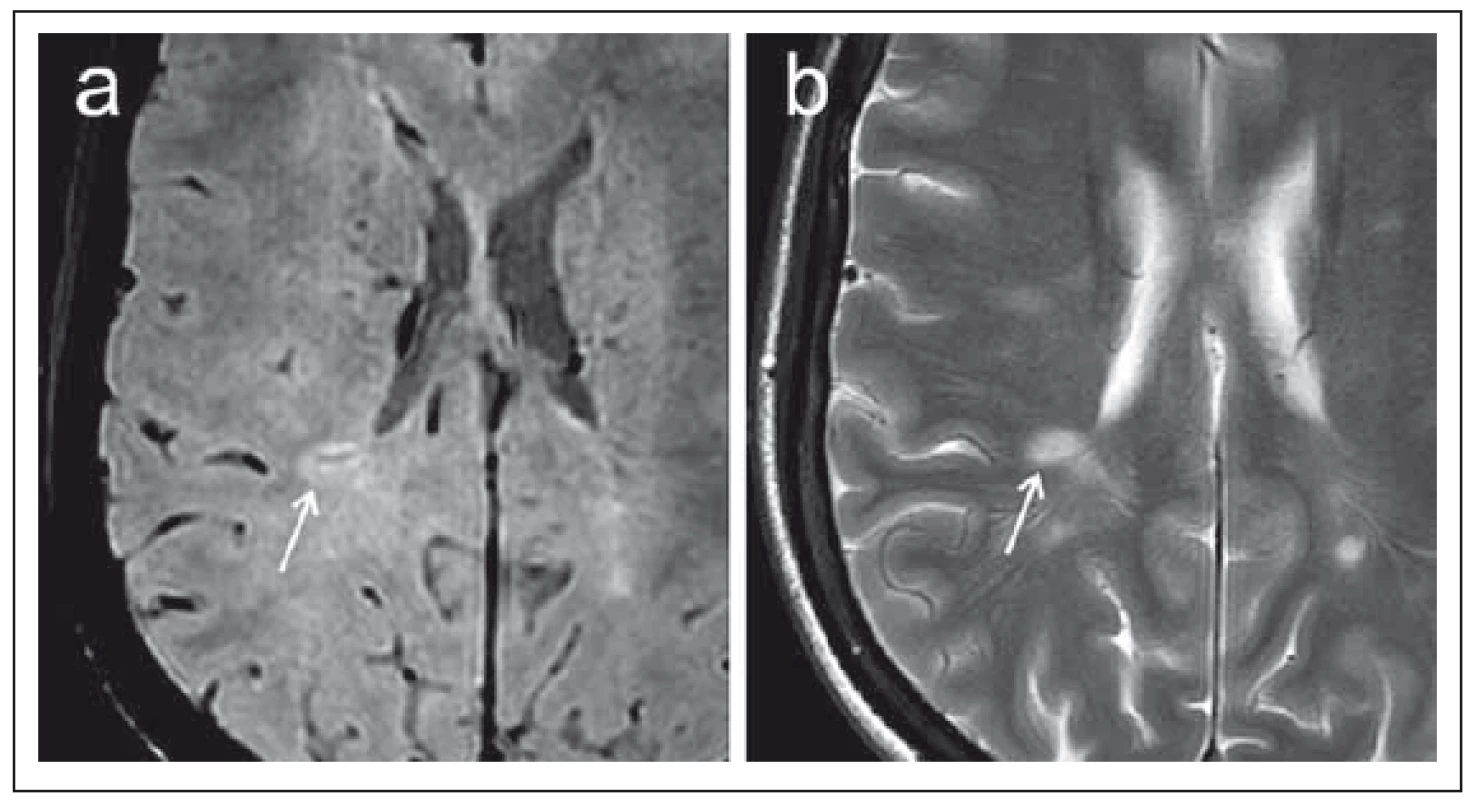
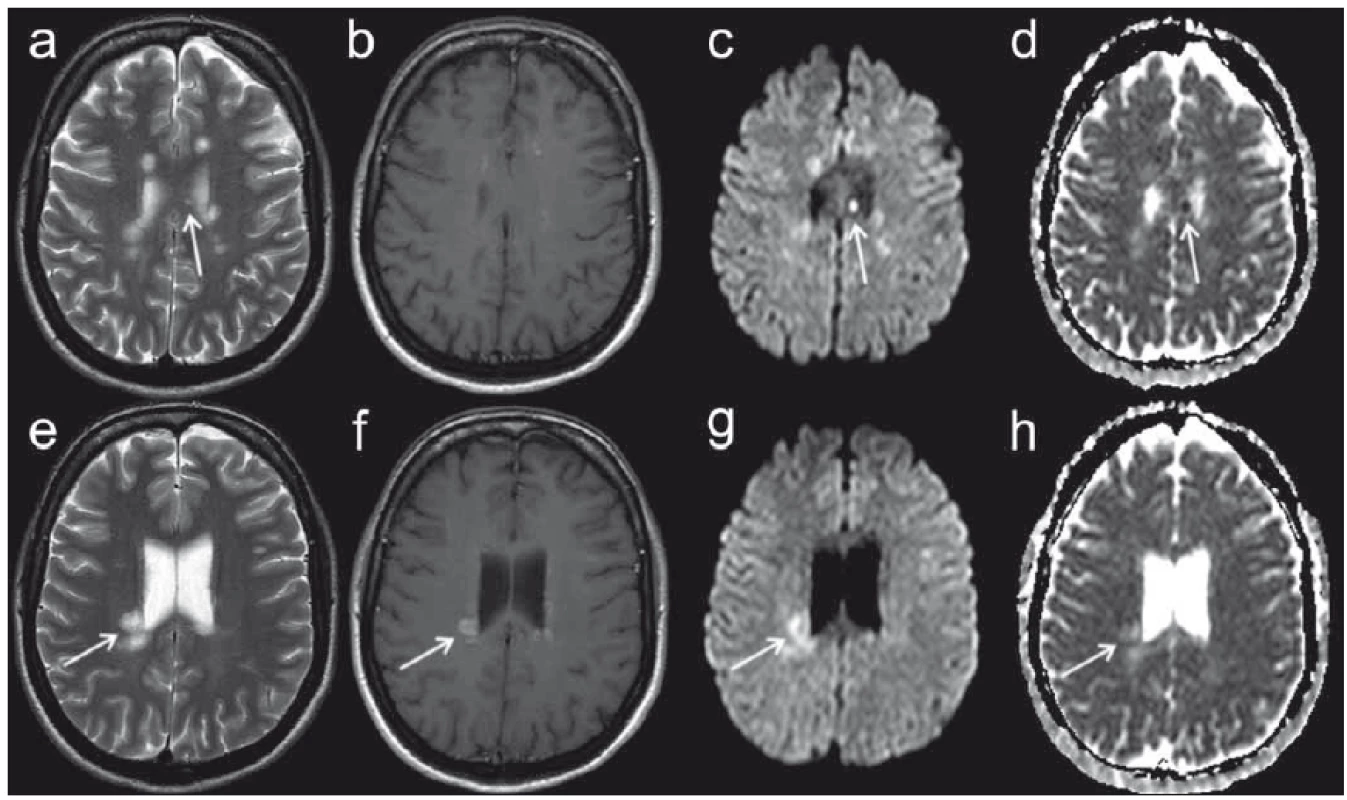
Je známo, že v rámci demyelinizačních lézí dochází ke změnám difuzivity. Autoři Christiansen et al publikovali již v roce 1993 práci analyzující ADC hodnoty u malé skupiny pacientů s RS s nálezem signifikantně vyšších ADC hodnot chronických demyelinizačních lézí v porovnání s normálně vyhlížející bílou hmotou (normal appear ing white matter; NAWM), ale též zvýšení ADC hodnot u akutních plak [48]. Obdobně Yurtsever et al udávají zvýšení ADC hodnot u aktivních lézí v porovnání s NAWM [49]. Novější údaje však poukazují na skutečnost, že difuzivita akutních demyelinizačních lézí se rapidně mění zejména v prvních 10 dnech od ataky. Autoři Eisele et al popisují obraz restrikce difuze se snížením ADC hodnot u akutních lézí v rozmezí 0 – 7 dní od vzniku klinických obtíží, pseudonormalizaci ADC hodnot v 7. – 10. dni a zvýšení ADC hodnot v rozmezí 10 dní až 4 týdnů (obr. 5) [50]. Lze tak říci, že změny difuzivity patří do obrazu RS a z pohledu neuroradiologa tak mohou mít určitý význam v diferenciální diagnostice tohoto onemocnění. V neposlední řadě můžeme uvést též změny difuzivity u ložisek progresivní multifokální leukoencefalopatie (PML), která je možnou komplikací u pacientů s RS léčených biologickou léčbou [51].
Technika zobrazení tenzoru difuze (diffusion tensor imaging; DTI) je postavena na principech difuzního MR zobrazení. Klíčovým prvkem je zde však detekce směrové závislosti difuzivity molekul vody ve tkáni v závislosti na směru použitého magnetického gradientu, tzv. anizotropie difuzivity [52]. Tuto směrovou závislost lze charakterizovat pomocí opakovaných měření s proměnnou orientací směru magnetického gradientu. Konečným výsledkem je matematická konstrukce 3D elipsoidu, jehož tvar a orientace charakterizují anizotropii difuze v jednotlivých voxelech. Tvar elipsoidu může být popsán pomocí tří hodnot, které reprezentují velikost tří jeho hlavních os. Z těchto parametrů se dá vypočíst několik skalárních veličin, z nichž prakticky nejvýznamnější jsou hodnoty frakční anizotropie (FA) udávající relativní míru anizotropie v daném voxelu a střední difuzivita (mean diff usivity; MD) či ADC, jež vyjadřují celkovou míru difuzivity nezávislé na anizotropii difuze [47].
Bylo zjištěno, že pomocí kvantifikace uvedených skalárních parametrů lze citlivě detekovat strukturální patologii tkání CNS u nejrůznějších onemocnění; zejména index FA je v současnosti považován za parametr senzitivní k narušení integrity bílé hmoty a je také jedním z nejčastěji sledovaných parametrů ve studiích využívajících DTI zobrazení [53]. V minulosti byla publikována celá řada studií využívajících DTI pro detekci patologických změn mozku či míchy u pacientů s RS. Existují např. důkazy o korelaci parametrů difuzivity s histopatologickými nálezy demyelinizace a axonální dezintegrace [54]. Tyto patologické změny vedou k nárůstu difuzivity napříč nervovými trakty způsobujícímu mimo jiné pokles hodnot parametru FA v důsledku snížené anizotropie difuzivity. V souladu s tím je zjištění, že dochází k signifikantní změně skalárních parametrů difuzivity v rámci T2 hyperintenzních ložisek v porovnání s NAWM [55]. Patrně nejpozoruhodnější je skutečnost, že lze prokázat změny difuzivity i v rámci samotné NAWM i NAGM (šedá hmota normálního vzhledu) v poměru se zdravými jedinci [56]. DTI je tak možno vnímat jako citlivější metodu pro detekci patologických změn u pacientů s RS v porovnání s konvenčními technikami MR zobrazení. Někteří autoři poukazují též na korelaci změn difuzivity mozku s tíží klinického postižení např. po stránce motorických [57] či kognitivních [58] funkcí. Technika DTI byla v minulých letech aplikována úspěšně i pro zobrazení míchy u pacientů s RS, kdy byla prokázána korelace parametrů DTI s tíží klinického postižení [59] a obdobně jako v případě mozku je poukazováno na abnormality FA v oblastech míchy bez patologického nálezu na konvenčních sekvencích [60].
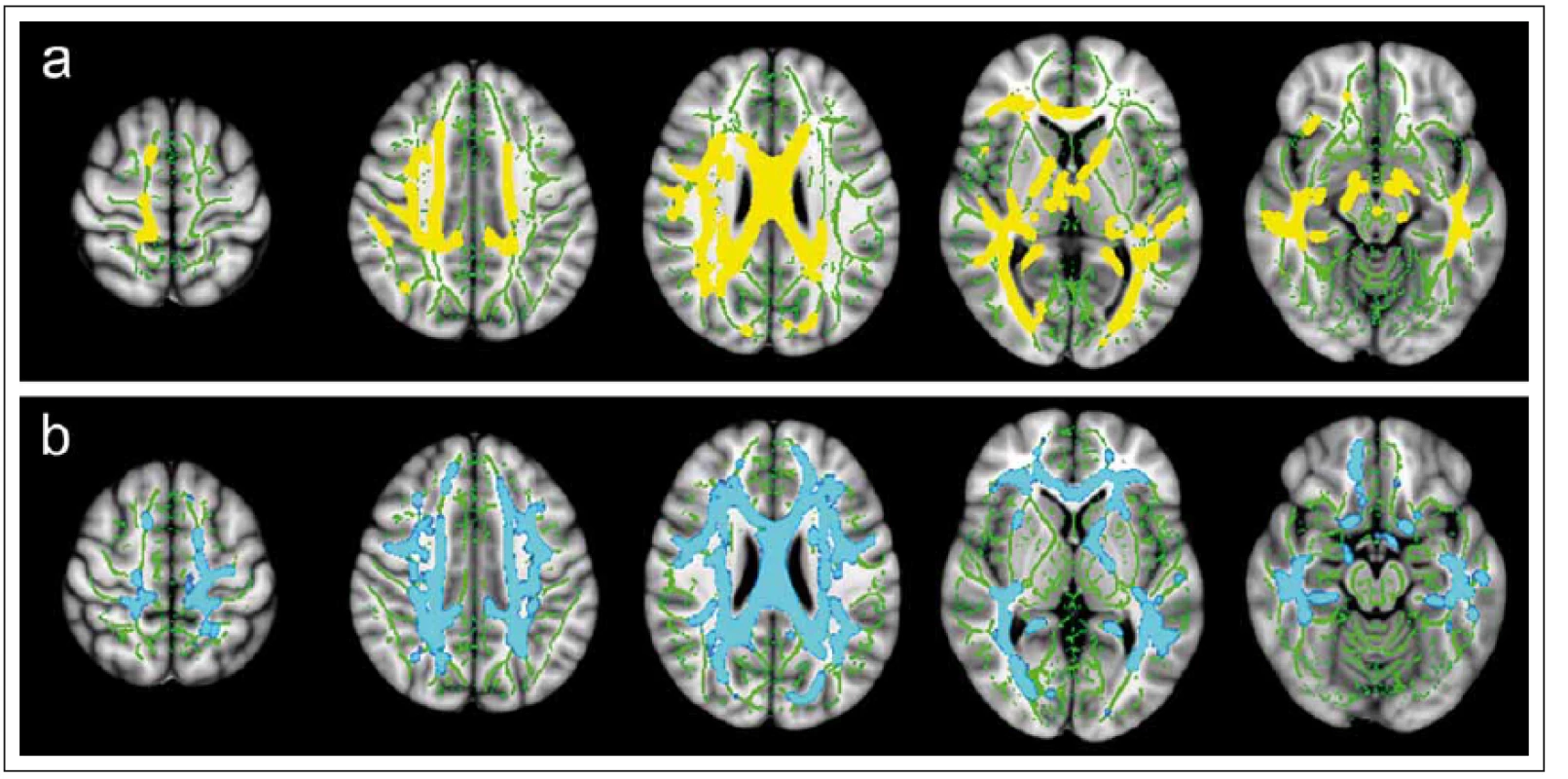
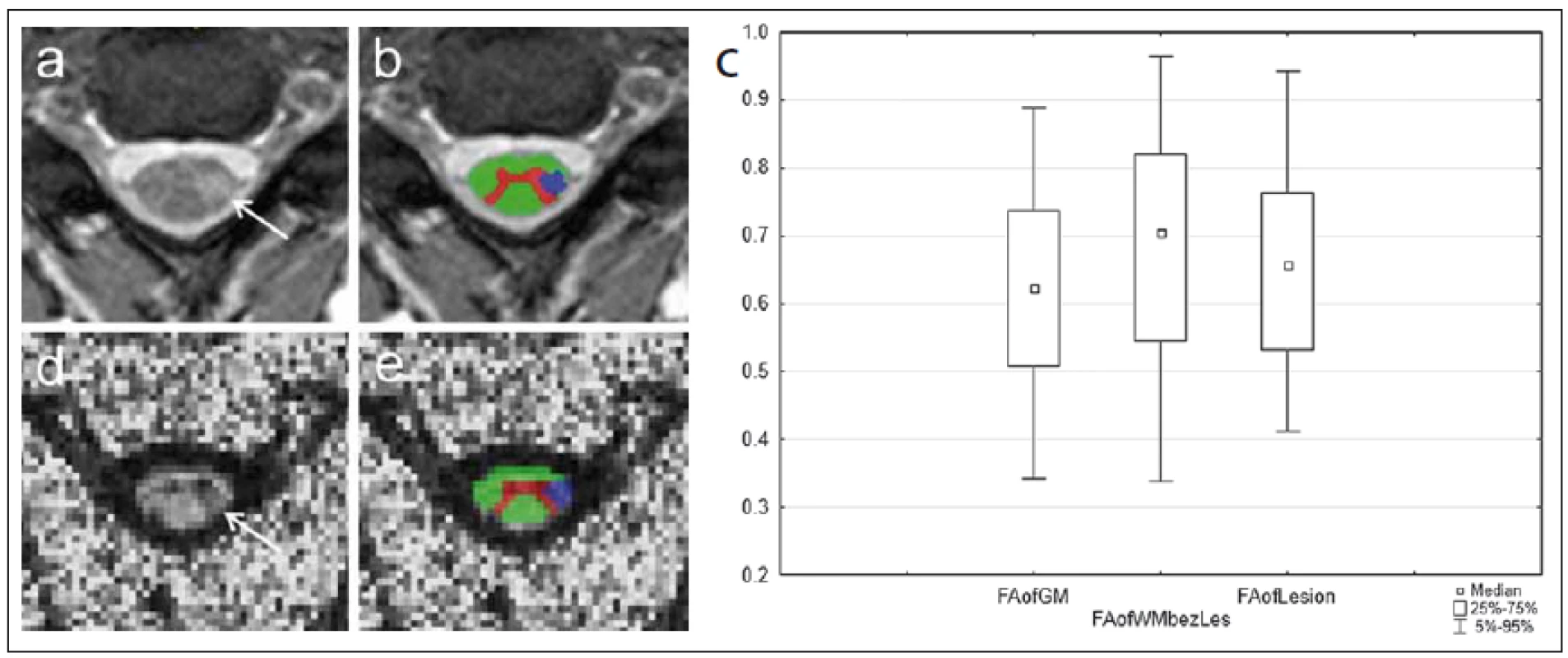
Existuje celá řada přístupů k metodice analýzy dat DTI. Za nejjednodušší lze považovat měření parametrů difuzivity v rámci manuálně definovaných oblastí zájmu (region of interest; ROI) ve zvolených oblastech mozku či míchy. Nevýhodu tohoto postupu mohou představovat nepřesnosti v umístění ROI a následné zkreslení výsledků. S tímto problémem se snaží vypořádat někt ré automatizované techniky analýzy DTI dat, jako je např. TBSS (tract-based spatial statistics). Tato metoda umožňuje analýzu difuzivity v celém měřeném objemu a je vhodná zejména pro skupinové statistické zpracování (obr. 6). Je zde využito nelineární registrace map FA následované konstrukcí skeletonu hlavních traktů bílé hmoty a projekcí voxelů jednotlivých subjektů na tento skeleton. Tím je minimalizováno nechtěné zahrnutí voxelů šedé hmoty do analýzy [61]. V případě zobrazení míchy existuje relativně méně možností výpočetní analýzy obrazových dat. I zde však již bylo popsáno několik technik využívajících semiautomatické či automatické postupy při segmentaci celé míchy nebo šedé a bílé hmoty [62], které mohou být využity i v rámci vyhodnocení difuzních parametrů (obr. 7).
Závěrem této části je třeba poznamenat, že DTI je stále spíše v pozici výzkumné aplikace než prakticky používaného diagnostického nástroje. Jednou z limitací, které brání většímu rozšíření této techniky, je poměrně velká časová náročnost DTI sekvencí. Dalším a patrně významnějším problémem je obecný nedostatek standardizace po stránce vlastní akvizice dat a jejich následné softwarové analýzy. Doposud není zcela vyřešena otázka reprodukovatelnosti měřených skalárních parametrů difuzivity při vyšetřeních na různých přístrojích [63] nebo s nastavením různých akvizičních parametrů [64], což komplikuje porovnávání výsledků různých studií a stanovení obecněji platných prahových hodnot.
Zobrazení magnetizačního transferu
Zobrazení magnetizačního transferu (magnetization transfer imaging; MTI) představuje další metodu, která jde za hranice konvenčních technik MR zobrazení a umožňuje detekovat diskrétní patologické změny tkáně mozku či míchy, k nimž dochází v rámci demyelinizačního onemocnění. Tato technika využívá odlišností v chování volných protonů obsažených v molekulách vody v porovnání s vázanými protony, u kterých v důsledku magnetických interakcí s okolními makromolekulami dochází k velmi rychlému rozfázování magnetizace a jsou proto charakterizovány velmi krátkými T2 časy. V případě, že jsou vázané protony saturovány pomocí zvláštního saturačního radiofrekvenčního pulzu („off-resonance“), dojde k výměně magnetizace (magnetizačnímu transferu) mezi těmito protony a protony volnými, což ovlivní magnetizaci volných protonů [65]. Tento jev vede k viditelnému snížení intenzity signálu v MR obraze, existují však i možnosti jeho kvantifikace. Patrně nejčastěji používaný a nejjednodušší způsob je využití indexu MTR (magnetization transfer ratio), který představuje relativní rozdíl mezi dvěma měřeními, z nichž pouze u jednoho z nich je aplikován zmiňovaný „off-resonance“ saturační pulz. MTR tak nepřímo odráží míru zastoupení makromolekul ve tkáni a umožňuje mimo jiné detekovat ztrátu myelinu a v menší míře axonální dezintegraci [66]. Na využití MTI v diagnostice RS lze nahlížet jako na určitou paralelu DTI. Byla prokázána redukce MTR akutních i chronických demyelinizačních lézí [67], obdobně jako u DTI byla i v případě MTI zaměřena pozornost na změny v rámci NAWM i NAGM s průkazem signifikantní redukce MTR u nejrůznějších fenotypů RS vč. nejčasnějších klinických stadií [68]. Abnormality MTR též dle některých autorů korelují s délkou trvání onemocnění a s tíží klinického postižení [68,69].
MR spektroskopie
MR spektroskopie je analytická metoda umožňující detekci a kvantifikaci různých sloučenin ve tkáni. K získání MR spektra je možno využít jádra různých prvků, v klinické praxi se však nejčastěji používá jádro vodíku [70]. V praxi se obvykle uplatňuje jedna ze dvou základních technik spektroskopického zobrazení. První z nich je tzv. single-voxel spektroskopie (SVS), která zobrazuje spektrum metabolitů z jediného předem definovaného voxelu. Druhou možností je spektrální akvizice z více voxelů širší oblasti mozku označovaná někdy jako „magnetic resonance spectroscopy imaging“ (MRSI) nebo „chemical shift imaging“. Pomocí obou zmiňovaných technik lze detekovat koncentraci nejrůznějších metabolitů v mozkové tkáni, jako jsou např. tuky, aminokyseliny (zejm. alanin, glutamin), laktát, N-acetylaspartát (NAA), kreatin (Cr), a myo-inositol [71].
Pro potřeby diagnostiky pacientů s RS se nejčastěji užívá detekce a kvantifikace NAA, resp. poměru NAA/ Cr, dále cholinu, laktátu a myo-inositolu. NAA je obsažen v mitochondriích neuronů, v axonech a dendritech, jeho pokles proto nastává při jejich poškození či zániku. Ke snížení jeho koncentrace ale může dojít i relativně při edému či přechodně při omezení neuronální funkce. Pokles NAA je patrný zejména v akutní fázi onemocnění (obr. 8), během remise potom může docházet k jeho částečné normalizaci. Cholin je za normálních okolností vázán v buněčných membránách, k nárůstu detekovatelné volné porce dochází při rozpadu buněk. K tomu může docházet např. při zánětu, tedy i v případě akutní fáze RS. Obdobně v akutní fázi RS pozorujeme nárůst hodnot laktátu následkem zvýšené anaerobní glykolýzy v terénu zánětu. Bylo zjištěno, že nárůst hodnot myoinositolu je spojen s vyšší metabolickou či proliferační aktivitou astrocytů v plakách RS na rozdíl od lézí bílé hmoty jiné etiologie [72].
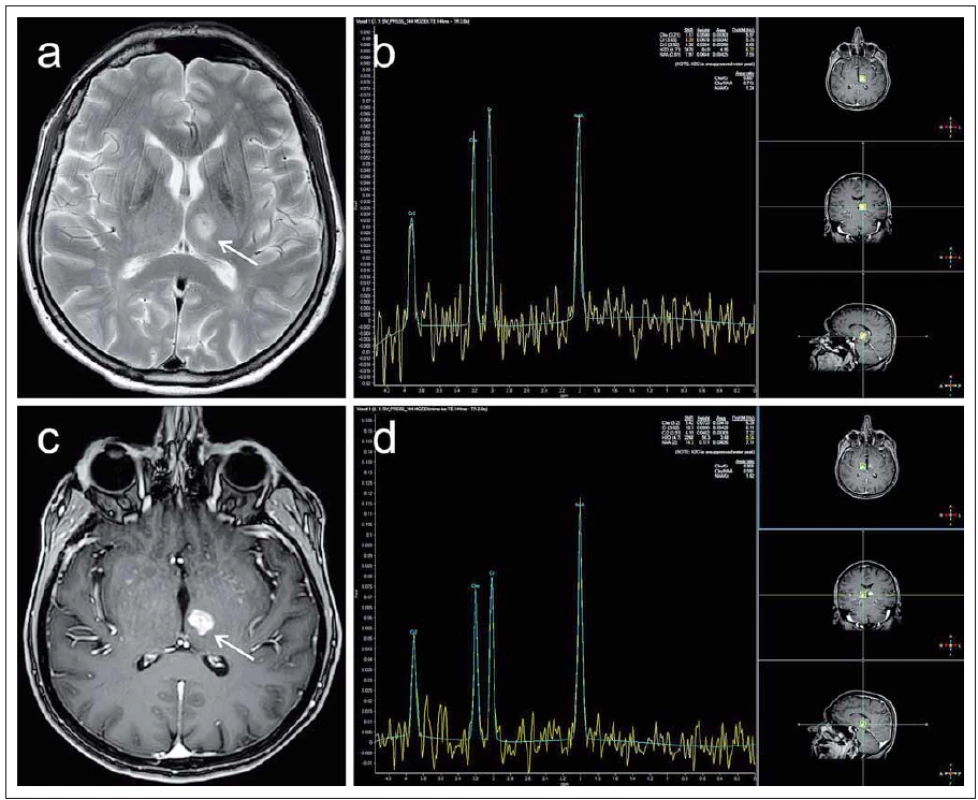
Výsledky studií vč. metaanalýz nejsou zatím jednotné. Přesto naznačují, že by pokles koncentrace NAA mohl být markerem predikce klinického postižení pacientů s RS, a to zejména u již léčených pacientů vzhledem k jeho částečné normalizaci v průběhu terapie [71,73]. Detekce sníženého obsahu NAA a zároveň zvýšených hodnot cholinu a laktátu se jeví jako potenciální marker akutního postižení bílé hmoty časově předcházející korelát v konvenčním obraze MR [72].
Závěr
Přestože konvenční radiologické hodnocení přítomnosti viditelných lézí mozku a míchy zůstává doposud hlavním nástrojem v oblasti MR diagnostiky RS, existuje nepřeberné množství důkazů o novějších technikách, jako jsou např. DTI, MTI či spektroskopie, které umožňují přesněji detekovat patologické změny tkání CNS. Tyto techniky proto mají potenciál stát se cenným nástrojem v rámci diferenciální diagnostiky v iniciálních stadiích demyelinizačního onemocnění a v dalším průběhu objektivním markerem či prediktorem klinického vývoje a odpovědi na léčbu. Určitou nevýhodou těchto technik jsou nároky na skenovací čas (zejm. DTI a spektroskopie) a obecným problémem výše diskutovaných metod je doposud nedostatek standardizace akvizičních protokolů a v některých případech i omezená reprodukovatelnost měřených dat mezi různými MR přístroji [63]. Dalším aspektem, který do určité míry brání většímu praktickému rozšíření těchto metod, je nejednotnost technik softwarové analýzy naměřených dat a poměrně malá míra implementace automatizovaných technik analýzy obrazu do komerčního softwarového vybavení dodávaného hlavními výrobci MR přístrojů. Budoucí výzkum by proto měl být zaměřen na tyto otázky úzce spojené s technikou vyšetření a na hledání nových dobře reprodukovatelných a kvantifikovatelných parametrů. Půjde-li vývoj tímto směrem, lze v budoucnu očekávat inkorporaci hodnocení těchto nových biomarkerů v rámci standardní diagnostiky u pacientů s RS.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Tato práce byla podpořena grantem MZ ČR NV15-32133A a fondy Lékařské fakulty MU na podporu juniorského výzkumníka (M. Keřkovský).
MUDr. Miloš Keřkovský, Ph.D.
Klinika radiologie a nukleární medicíny LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: kerkovsky.milos@fnbrno.cz
Přijato k recenzi: 26. 3. 2017
Přijato do tisku: 25. 10. 2017
Sources
1. Confavreux C, Vukusic S, Moreau T, et al. Relapses and progres sion of disability in multiple sclerosis. N Engl J Med 2000;343(20):1430 – 8. doi: 10.1056/ NEJM2000 11163432001.
2. Calabrese M, Favaretto A, Martini V, et al. Grey matter lesions in MS: from histology to clinical implications. Prion 2013;7(1):20 – 7. doi: 10.4161/ pri.22580.
3. Filippi M, Agosta F.Imag ing biomarkers in multiple sclerosis. J Magn Reson Imag ing 2010;31(4):770 – 88. doi: 10.1002/ jmri.22102.
4. van Waesberghe JH, Kamphorst W, De Groot CJ, et al. Axonal loss in multiple sclerosis lesions: magnetic resonance imaging insights into substrates of disability. Ann Neurol 1999;46(5):747 – 54.
5. Bakshi R, Thompson AJ, Rocca MA, et al. MRI in multiple sclerosis: current status and future prospects. Lancet Neurol 2008;7(7):615 – 25. doi: 10.1016/ S1474 - 4422(08)70137-6.
6. Miller DH, Chard DT, Ciccarelli O. Clinically isolated syndromes. Lancet Neurol 2012;11(2):157 – 69. doi: 10.1016/ S1474-4422(11)70274-5.
7. Filippi M, Rocca MA, Ciccarelli O, et al. MRI criteria for the diagnosis of multiple sclerosis: MAGNIMS consensus guidelines. Lancet Neurol 2016;15(3):292 – 303. doi: 10.1016/ S1474-4422(15)00393-2.
8. Nayak NB, Salah R, Huang JC, et al. A comparison of sagittal short T1 inversion recovery and T2-weighted FSE sequences for detection of multiple sclerosis spinal cord lesions. Acta Neurol Scand 014;129(3):198-203. doi: 10.1111/ ane.12168.
9. Patzig M, Burke M, Brückmann H, et al. Comparison of 3D cube FLAIR with 2D FLAIR for multiple sclerosis imaging at 3 Tesla. Rofo 2014;186(5):484 – 8. doi:10.1055/ s-0033-1355896.
10. Redpath TW, Smith FW. Technical note: use of a double inversion recovery pulse sequence to image selectively grey or white brain matter. Br J Radiol 1994;67(804):1258 – 63. doi: 10.1259/ 0007-1285-67-804 - 1258.
11. Wattjes MP, Lutterbey GG, Gieseke J, et al. Double inversion recovery brain imaging at 3T: diagnostic value in the detection of multiple sclerosis lesions. Am J Neuroradiol 2007;28(1):54 – 9.
12. Geurts JJ, Pouwels PJ, Uitdehaag BM, et al. Intracortical lesions in multiple sclerosis: improved detection with 3D double inversion-recovery MR imaging. Radiology 2005;236(1):254 – 60. doi: 10.1148/ radiol.2361040 450.
13. Bø L, Vedeler CA, Nyland HI, et al. Subpial demyelination in the cerebral cortex of multiple sclerosis patients. J Neuropathol Exp Neurol 2003;62(7):723 – 32.
14. Calabrese M, De Stefano N, Atzori M, et al. Detection of cortical inflammatory lesions by double inversion recovery magnetic resonance imaging in patients with multiple sclerosis. Arch Neurol 2007;64(10):1416 – 22. doi:
10.1001/ archneur.64.10.1416.
15. Calabrese M, Gallo P. Magnetic resonance evidence of cortical onset of multiple sclerosis. Mult Scler 2009;15(8):933 – 41. doi: 10.1177/ 1352458509106510.
16. Rinaldi F, Calabrese M, Gros si P, et al. Cortical lesions and cognitive impairment in multiple sclerosis. Neurol Sci 2010;31(Suppl 2):S235 – 7. doi: 10.1007/ s10072-010-0368-4.
17. Liu C, Li W, Tong KA, et al. Susceptibility-weighted imaging and quantitative susceptibility mapping in the brain. J Magn Reson Imaging 2015;42(1):23 – 41. doi: 10.1002/ jmri.24768.
18. Schenck JF. The role of magnetic susceptibility in magnetic resonance imaging: MRI magnetic compatibility of the first and second kinds. Med Phys 1996;23(6):815 – 50. doi: 10.1118/ 1.597854.
19. Haacke EM, Mittal S, Wu Z, et al. Susceptibility-weight ed imaging: technical aspects and clinical applications, part 1. Am J Neuroradiol 2009;30(1):19 – 30. doi: 10.3174/ ajnr.A1400.
20. Fog T. On the ves sel-plaque relationships in the brain in multiple sclerosis. Acta Neurol Scand Suppl 1964;40(Suppl 10):9 – 15.
21. Mistry N, Dixon J, Tal lantyre E, et al. Central veins in brain lesions visualized with high-field magnetic resonance imaging: a pathologically specific diagnostic biomarker for inflammatory demyelination in the brain. JAMA Neurol 2013;70(5):623 – 8. doi: 10.1001/ jamaneurol. 2013.1405.
22. Tal lantyre EC, Dixon JE, Donaldson I, et al. Ultra-high-field imaging distinguishes MS lesions from asymptomatic white matter lesions. Neurology 2011;76(6):534 – 9. doi: 10.1212/ WNL.0b013e31820b7630.
23. Kilsdonk ID, Wattjes MP, Lopez-Soriano A, et al. Improved differentiation between MS and vascular brain lesions us ing FLAIR* at 7 Tesla. Eur Radiol 2014;24(4):841 – 9. doi: 10.1007/ s00330-013-3080-y.
24. Enzinger C, Barkhof F, Ciccarel li O, et al. Nonconventional MRI and microstructural cerebral changes in multiple sclerosis. Nat Rev Neurol 2015;11(12):676 – 86. doi:10.1038/ nrneurol.2015.194.
25. Tallantyre EC, Morgan PS, Dixon JE, et al. A comparison of 3T and 7T in the detection of small parenchymal veins within MS lesions. Invest Radiol 2009;44(9):491 – 4. doi: 10.1097/ RLI.0b013e3181b4c144.
26. Kel ly JE, Mar S, D‘Angelo G, et al. Susceptibility-weight ed imaging helps to discriminate pediatric multiple sclerosis from acute disseminated encephalomyelitis. Pediatr Neurol 2015;52(1):36 – 41. doi: 10.1016/ j.pediatrneurol. 2014.10.014.
27. Absinta M, Sati P, Gaitán MI, et al. Seven-tesla phase imaging of acute multiple sclerosis lesions: a new window into the inflammatory process. Ann Neurol 2013;74(5):669 – 78. doi: 10.1002/ ana.23959.
28. Wetter NC, Hubbard EA, Motl RW, et al. Fully automated open-source lesion mapping of T2-FLAIR images with FSL correlates with clinical disability in MS. Brain Behav 2016;6(3):e00440. doi: 10.1002/ brb3.440.
29. Odenthal C, Coulthard A. The prognostic utility of MRI in clinically isolated syndrome: a literature review. AJNR Am J Neuroradiol 2015;36(3):425 – 31. doi: 10.3174/ ajnr.A3954.
30. Barkhof F. The clinico-radiological paradox in multiple sclerosis revisited. Curr Opin Neurol 2002;15(3):239 – 45.
31. Rudick RA, Lee JC, Simon J, et al. Significance of T2 lesions in multiple sclerosis: A 13-year longitudinal study. Ann Neurol 2006;60(2):236 – 42. doi: 10.1002/ ana.20883.
32. Minneboo A, Jasperse B, Barkhof F, et al. Predicting short-term disability progression in early multiple sclerosis: added value of MRI parameters. J Neurol Neurosurg Psychiatry 2008;79(8):917 – 23. doi: 10.1136/ jn np. 2007.124123.
33. Gauthier SA, Mandel M, Guttmann CR, et al. Predicting short-term disability in multiple sclerosis. Neurology 2007;68(24):2059 – 65. doi: 10.1212/ 01. wnl.0000264890.97479.b1.
34. De Stefano N, Arnold DL. Towards a better understand ing of pseudoatrophy in the brain of multiple sclerosis patients. Mult Scler 2015;21(6):675 – 6. doi: 10.1177/ 1352458514564494.
35. Filippi M, Rocca MA, Barkhof F, et al. As sociation between pathological and MRI findings in multiple sclerosis. Lancet Neurol 2012;11(4):349 – 60. doi: 10.1016/ S1474-4422(12)70003-0.
36. Dastidar P, Heinonen T, Lehtimäki T, et al. Volumes of brain atrophy and plaques correlated with neurological disability in secondary progressive multiple sclerosis. J Neurol Sci 1999;165(1):36 – 42.
37. Vaněčková M, Seidl Z, Krásenský J, et al. Naše zkušenosti s MR monitorováním pacientů s roztroušenou sklerózou v klinické praxi. Cesk Slov Neurol N 2010;73/ 106(4):716 – 20.
38. Zivadinov R, Stosic M, Cox JL, et al. The place of conventional MRI and newly emerging MRI techniques in monitoring different aspects of treatment outcome. J Neurol 2008;255(Suppl 1):61 – 74. doi: 10.1007/ s00415 -
008-1009-1.
39. Miller DH, Soon D, Fernando KT, et al. MRI outcomes in a placebo-control led trial of natalizumab in relapsing MS. Neurology 2007;68(17):1390 – 401. doi: 10.1212/ 01. wnl.0000260064.77700.fd.
40. Koudriavtseva T, Mainero C. Brain Atrophy as a Measure of Neuroprotective Drug Effects in Multiple Sclerosis: Influence of Inflammation. Front Hum Neurosci 2016;10 : 226. doi: 10.3389/ fnhum.2016.00226.
41. Henry RG, Shieh M, Okuda DT, et al. Regional grey matter atrophy in clinically isolated syndromes at presentation. J Neurol Neurosurg Psychiatry 2008;79(11):1236 – 44. doi: 10.1136/ jn np.2007.134825.
42. Kalincik T, Vaneckova M, Tyblova M, et al. Volumetric MRI markers and predictors of disease activity in early multiple sclerosis: a longitudinal cohort study. PLoS One 2012;7(11):e50101. doi: 10.1371/ journal.pone.0050 101.
43. Kaunzner UW, Gauthier SA. MRI in the assessment and monitoring of multiple sclerosis: an update on best practice. Ther Adv Neurol Disord 2017;10(6):247 – 61. doi: 10.1177/ 1756285617708911.
44. Vaneckova M, Kalincik T, Krasensky J, et al. Corpus callosum atrophy – a simple predictor of multiple sclerosis progression: a longitudinal 9-year study. Eur Neurol 2012;68(1):23 – 7. doi: 10.1159/ 000337683.
45. Mechelli A, Price CJ, Friston KJ, et al. Voxel-based morphometry of the human brain: Methods and applications. Current Medical Imaging Reviews 2005;1(2):105 – 13.
46. Smith SM, Zhang Y, Jenkinson M, et al. Accurate, robust, and automated longitudinal and cross-sectional brain change analysis. Neuroimage 2002;17(1): 479 – 89.
47. Mukherjee P, Berman JI, Chung SW, et al. Diffusion tensor MR imaging and fiber tractography: theoretic underpinnings. Am J Neuroradiol 2008;29(4):632 – 41. doi: 10.3174/ ajnr.A1051.
48. Christiansen P, Gideon P, Thomsen C, et al. Increased water self-diffusion in chronic plaques and in apparently normal white matter in patients with multiple sclerosis. Acta Neurol Scand 1993;87(3):195 – 9.
49. Yurtsever I, Hakyemez B, Taskapilioglu O, et al. The contribution of diffusion-weighted MR imaging in multiple sclerosis during acute attack. Eur J Radiol 2008;65(3):421 – 6. doi: 10.1016/ j.ejrad.2007.05.002.
50. Eisele P, Szabo K, Griebe M, et al. Reduced diffusion in a subset of acute MS lesions: a serial multiparametric MRI study. AJNR Am J Neuroradiol 2012;33(7):1369 – 73. doi: 10.3174/ ajnr.A2975.
51. Vaněčková M, Seidl Z, Čáp F, et al. Návrh bezpečnostní MR monitorace u pacientů s roztroušenou sklerózou léčených natalizumabem. Cesk Slov Neurol N 2016;79(6):663 – 9.
52. Basser PJ, Mattiello J, LeBihan D. MR diffusion tensor spectroscopy and imaging. Biophys J 1994;66 : 259 – 67. doi: 10.1016/ S0006-3495(94)80775-1.
53. Assaf Y, Pasternak O. Diffusion tensor imaging (DTI) - based white matter mapping in brain research: a review. J Mol Neurosci 2008;34(1):51 – 61. doi: 10.1007/ s12031-007-0029-0.
54. Mottershead JP, Schmierer K, Clemence M, et al.High field MRI correlates of myelin content and axonal density in multiple sclerosis – a post-mortem study of the spinal cord. J Neurol 2003;250(11):1293 – 301. doi: 10.1007/ s00415-003-0192-3.
55. Filippi M, Iannucci G, Cercignani M, et al. A quantitative study of water diffusion in multiple sclerosis lesions and normal-appear ing white matter using echo-planar imaging. Arch Neurol 2000;57(7):1017 – 21.
56. Yu CS, Lin FC, Liu Y, et al. Histogram analysis of diffusion measures in clinically isolated syndromes and relapsing-remitting multiple sclerosis. Eur J Radiol 2008;68(2):328 – 34. doi: 10.1016/ j.ejrad.2007.08.036.
57. Hubbard EA, Wetter NC, Sutton BP, et al. Diffusion tensor imaging of the corticospinal tract and walking performance in multiple sclerosis. J Neurol Sci 2016;363 : 225 – 31. doi: 10.1016/ j.jns.2016.02.044.
58. Meijer KA, Muhlert N, Cercignani M, et al. White matter tract abnormalities are associated with cognitive dysfunction in secondary progressive multiple sclerosis. Mult Scler 2016;22(11):1429 – 37. doi: 10.1177/ 1352458515622694.
59. Valsasina P, Rocca MA, Agosta F, et al. Mean diffusivity and fractional anisotropy histogram analysis of the cervical cord in MS patients. Neuroimage 2005;26(3):822 – 8. doi: 10.1016/ j.neuroimage.2005.02.033.
60. Hesseltine SM, Law M, Babb J, et al. Diffusion tensor imaging in multiple sclerosis: assessment of regional differences in the axial plane within normal-appearing cervical spinal cord. Am J Neuroradiol 2006;27(6):1189 – 93.
61. Smith SM, Jenkinson M, Johansen-Berg H, et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage 2006;31(4):1487 – 505. doi: 10.1016/ j.neuroimage.2006.02.024.
62. De Leener B, Taso M, Cohen-Adad J, et al. Segmentation of the human spinal cord. MAGMA 2016;29(2):125 – 53. doi: 10.1007/ s10334-015-0507-2.
63. Kivrak AS, Paksoy Y, Erol C, et al. Comparison of apparent diffusion coefficient values among different MRI platforms: a multicenter phantom study. Diagn Interv Radiol 2013;19(6):433 – 7. doi: 10.5152/ dir. 2013.13034.
64. Santarelli X, Garbin G, Ukmar M, et al. Dependence of the fractional anisotropy in cervical spine from the number of diffusion gradients, repeated acquisition and voxel size. Magn Reson Imaging 2010;28(1):70 – 6. doi: 10.1016/ j.mri.2009.05.046.
65. Henkelman RM, Stanisz GJ, Graham SJ. Magnetization transfer in MRI: a review. NMR Biomed 2001;14(2): 57 – 64.
66. Schmierer K, Scaravilli F, Altmann DR, et al. Magnetization transferratio and myelin in postmortem multiple sclerosis brain. Ann Neurol 2004;56(3):407 – 15. doi: 10.1002/ ana.20202.
67. Ropele S, Fazekas F. Magnetization transfer MR imaging in multiple sclerosis. Neuroimaging Clin N Am 2009;19(1):27 – 36. doi: 10.1016/ j.nic.2008.09. 004.
68. Filippi M, Rocca MA. Magnetization transfer magnetic resonance imaging of the brain, spinal cord, and optic nerve. Neurotherapeutics 2007;4(3):401 – 13. doi: 10.1016/ j.nurt.2007.03.002.
69. Hayton T, Furby J, Smith KJ, et al. Grey matter magnetization transferratio independently correlates with neurological deficit in secondary progressive multiple sclerosis. J Neurol 2009;256(3):427 – 35. doi: 10.1007/ 00415-009-0110-4.
70. Bertholdo D, Watcharakorn A, Castillo M. Brain proton magnetic resonance spectroscopy: introduction and overview. Neuroimaging Clin N Am 2013;23(3):359 – 80. doi: 10.1016/ j.nic.2012.10.002.
71. Aboul-Enein F. MR Spectroscopy in Multiple Sclerosis – A New Piece of the Puzzle or Just a New Puzzle In: Kim DH et al, eds. Magnetic Resonance Spectroscopy. Rijeka (Croatia): InTech 2012 : 48 – 72.
72. Ge Y. Multiple sclerosis: the role of MR imaging. AJNR Am J Neuroradiol 2006;27(6):1165 – 76.
73. Llufriu S, Kornak J, Ratiney H, et al. Magnetic resonance spectroscopy markers of disease progression in multiple sclerosis. JAMA Neurol 2014;71(7):840 – 7. doi: 10.1001/ jamaneurol.2014.895.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 6
Most read in this issue
- Krátký test slovní paměti pomocí věty u Alzheimerovy nemoci
- Moderní techniky MR zobrazení u roztroušené sklerózy
- H-reflex – jeho role v neurofyziologii a klinice
- Kdy operovat zlomeniny spánkové kosti?
