Neurorehabilitace chůze po cévní mozkové příhodě
Gait Neurorehabilitation in Stroke Patients
Stroke is one of the leading causes of severe disability in western population. Regaining walking ability in patients after stroke to encourage their return to previous life activities, more independent living and related social participation are currently one of the key challenges in the rehabilitation. Functional gait improvement and optimization of gait mechanism are to a great extent dependent on choice of appropriate neurorehabilitation strategy. Basic essence of neurorehabilitation is neuroplasticity stimulation with respect to potentiation of multisensory processing. Multisensory afferent input is optimally provided by variable intensive task-specific training with respect to actual patient’s capabilities. The gait (as task-specific movement) should be practiced intensively and under variable conditions to restore the walking ability. Up-to-date for gait neurorehabilitation are mostly used: over ground gait training with therapist, robotic assisted gait training, treadmill gait training, and also gait training based on biofeedback or in virtual environment. Combination of more gait training modalities and conventional rehabilitation approaches seem to be the most beneficial neurorehabilitation strategy to reach the maximum of walking ability recovery in patients after stroke. The aim of this review is to focus on the basic principles of gait neurorehabilitation with respect to current state of knowledge regarding gait control mechanisms and neural plasticity accompanying motor recovery post stroke.
Key words:
gait – stroke – neurorehabilitation – neuroplasticity
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
A. Krobot 1,2; B. Kolářová 1,3; P. Kolář 1,3; B. Schusterová 1,3; J. Tomsová 1,3
Authors‘ workplace:
Oddělení rehabilitace, FN Olomouc
1; Neurologická klinika LF UP a FN Olomouc
2; Ústav fyzioterapie, Fakulta zdravotnických věd UP a FN Olomouc
3
Published in:
Cesk Slov Neurol N 2017; 80/113(5): 521-526
Category:
Review Article
doi:
https://doi.org/10.14735/amcsnn2017521
Overview
Cévní mozková příhoda (CMP) je jedna z hlavních příčin chronické disability populace v rozvinutých zemích. Obnova maximálně možné lokomoční samostatnosti, umožňující vyšší míru sociální komunikace (participace), patří k hlavním cílům neurorehabilitace nemocných po CMP. Optimální obnova samostatného krokového stereotypu nemocných po CMP je do značné míry také podmíněna volbou individuálně i časově přiměřené neurorehabilitační strategie. Její podstatou je maximálně možná multisenzorická stimulace neuroplasticity, hlavně cílenou pohybovou aktivitou. Tedy především vlastní chůzí, v přiměřené intenzitě a ve více variacích lokomočního tréninku a s ohledem na aktuální možnosti pacienta. Dnes se v neurorehabilitaci chůze nejčastěji využívají terapeutem vedená chůze, roboticky asistovaná chůze, chůze na chodícím pásu, dále chůze v odlehčení, ve virtuální realitě nebo s využitím přídatné senzorické zpětné vazby. Cílem přehledu je racionální argumentace efektivity neurorehabilitačních strategií určených k optimalizaci chůze u pacientů po CMP na podkladě rozsáhlých metaanalýz s ohledem na mechanizmy řízení chůze, na neurální podstatu funkční obnovy pohybu i na stávající rehabilitační strategie v obecném rámci.
Klíčová slova:
chůze – cévní mozková příhoda – neurorehabilitace – neuroplasticita
Úvod
Dosažení maximální možné pohybové samostatnosti je určující strategií rehabilitace [1,2]. Nejběžnější rehabilitační intervencí, která vede ke zlepšení chůze, je její vlastní trénink [3]. V užším kontextu můžeme terapeutické modality trénování chůze, které vždy vycházející z potenciace mechanizmů neuroplasticity, souhrnně označit jako neurorehabilitaci chůze. Neurorehabilitaci chůze zde tedy chápeme jako terapeuticky nebo přístrojově vedenou lokomoční aktivitu, a to multisenzorickou stimulací nervového systému a s ohledem na minimalizaci nežádoucích pohybových kompenzačních strategií.
Předmětem článku je stručné shrnutí efektivity terapeutických modalit neurorehabilitace chůze, které vedou ke zlepšení chůze u nemocných po cévní mozkové příhodě (CMP), na podkladě stávající medicíny založené na důkazech (EBM).
Chůze u pacientů po CMP
CMP je velmi častá příčina morbidity i mortality v rozvinutých zemích. Významně se tam podílí na chronické disabilitě populace [4– 6]. Téměř dvě třetiny přeživších nemocných mají problémy s mobilitou až 6 měsíců po cerebrovaskulární atace. Více než jedna polovina z nich není doživotně schopna samostatné chůze. Tedy chůze bez technické pomůcky či personální asistence [7].
Funkční pohybovou ztrátu po CMP nejvíce determinují lokalizace a rozsah finálního poškození centrálního nervového systému (CNS). Pokud pro neurorehabilitaci chůze schematicky zvažujeme nejčastější (supratentoriální) poškození CNS, potom abnormity chůze po CMP vykazují přes zdánlivě typický rámec poměrně vysokou interindividuální variabilitu [8]. Do celkové posturálně lokomoční ztráty se vždy kromě svalové slabosti (hemiparézy) promítá více okolností. Rezultují jak z recentní cerebrovaskulární ataky (somatosenzorický deficit, spasticita, bolest, poruchy vizuospaciální percepce, kognitivní deficity), tak z dřívějších či jiných onemocnění a úrazů [9]. Kombinace všech faktorů utváří komplexní klinický obraz hemiparetické chůze.
Pro hemiparetickou chůzi jsou charakteristické nižší rychlost a vytrvalost ve srovnání se zdravými, asymetrické zatěžování dolních končetin s odlehčením končetiny paretické, zhoršená selektivní kontrola pohybu a zpomalená posturální reaktivita [3,9,10]. Vlastní realizaci samostatné chůze u nemocných po CMP pak funkčně limitují zejména zhoršená prostorová orientace a snížená adaptabilita na měnící se podmínky prostředí [9,10].
Neurofyziologické mechanizmy řízení chůze – poznámky pro neurorehabilitaci
Předpokládá se, že základní lokomoční vzor je do značné míry generován evolučně determinovanou interneuronální sítí (tzv. CPGs – Central Pattern Generators) [11,12]. CPGs recipročně stimulují aktivitu svalů dolních končetin a představují tak jakýsi servomechanizmus chůze. Aktivita CPGs (alespoň na míšní úrovni) je významně modulována zejména proprioceptivní aferencí z dolních končetin, která se zdá být klíčovým spouštěčem automacie chůze [9]. Nicméně klinická praxe i EBM studie potvrzují, že samostatná lidská chůze je řízena koordinovanou souhrou všech etáží centrálního nervového systému (spinálních, subkortikálních a kortikálních) [11–15]. Volní strategie řešení dané konkrétní situace jsou vytvářeny kortexem v součinnosti s podkorovými a spinálními okruhy [13], zatímco rytmicita či automacie chůze jsou řízeny majoritně subkortikálními oblastmi [13–15]. Na všech etážích řízení pohybu je charakter chůze regulován senzorickými informacemi (zejména proprioceptivními, zrakovými, sluchovými a informacemi z vestibulárního systému). Jedinec se tedy při chůzi nejen ortográdně „přesouvá v prostoru“, ale současně se adekvátně přizpůsobuje aktuálním změnám prostředí [11–15].
Pro klinická východiska neurorehabilitace chůze jsou tyto poznámky zásadní. V tomto kontextu musíme neurorehabilitaci chůze chápat především jako cílenou snahu o maximálně možnou facilitaci senzorické aference na všech etážích CNS. Usnadňuje přípravu, provedení i kontrolu lidské lokomoce ve vertikále.
Neurální podstata funkční obnovy pohybu po CMP
Funkční obnova, ke které po CMP dochází, je poměrně variabilní. Strukturální a funkční změny v CNS vznikají bezprostředně po cerebrovaskulární atace a trvají měsíce až roky [16]. Tyto změny nejsou lokalizovány pouze na místo vlastní léze. Vždy jsou ovlivněny i další struktury CNS funkčně propojené s poškozenou oblastí [17,18].
Základem pro funkční úpravu po CMP je neuroplasticita. Jde o schopnost nervového systému modifikovat svoji funkci, zčásti i strukturu, jako odpověď na podněty z prostředí. Dnes je shoda, že tato schopnost adaptace je elementární vlastnost CNS. Je podkladem učení se novým dovednostem [2,18]. Neuroplasticitu determinují především charakter a intenzita aferentních vstupů [18,19]. Jedná se hlavně o:
a) Realizaci konkrétní aktivity (activity-dependent plasticity)
Modifikace synaptických spojů a reorganizace kortexu se dějí především s ohledem na konkrétně vykonávanou (pohybovou) aktivitu. Jen tehdy se potencují neurální interakce potřebné k jejímu vykonání. A naopak se utlumují jiné, korespondující s méně používanými pohyby [19,20].
b) Multisenzorická stimulace
Neuroplasticitu podporuje zejména multisenzorická stimulace [19– 21]. Bohatá aference při současné stimulaci více senzorických systémů vede k variabilnějším pohybovým aktivitám. Předpokládá se, že může mít dosti zásadní vliv na redukci ischemické léze, stimulaci neurogeneze, a tedy vést ke zlepšení motorických a kognitivních funkcí [16,18,19,21].
c) Opakování
Pravidelné a intenzivní opakování určitého pohybového úkolu podporuje vznik „nových“ motorických programů, či adaptativní reorganizaci stávajících, aby se výsledná realizace motorického úkolu lépe přizpůsobila funkční ztrátě [16,22,23].
Neurorehabilitační strategie u pacientů po CMP
Stávající neurorehabilitační algoritmy vychází z imperativu potenciace neuroplasticity. Charakterizuje je intenzivní senzorická stimulace a současně funkčně definovaný cíl (účel) pohybu.
Rehabilitace je prokazatelně účinná forma terapie k dosažení maximálně možné obnovy samostatnosti u pacientů po cerebrovaskulární atace [1]. Otázkou však zůstává, jakou konkrétní taktiku rehabilitace můžeme označit za nejefektivnější. Tradiční rehabilitační postupy, jak je dnes vnímáme, jsou vedeny výhradně terapeutem. Metodicky se rozdělují na terapeutické techniky či koncepty, které v různé míře vychází z dílčích poznatků o řízení pohybu [1]. V současné době narůstají důkazy pro další modely neurorehabilitace: nejčastěji s využitím zpětné senzorické vazby či prvků virtuální reality, pohyb v představě nebo terapie s využitím robotických technologií (chodníky, exoskelety) [2,6,9]. Trendem je rovněž využívání funkční elektrické stimulace (FES) nebo aktuálně i hluboké mozkové stimulace [9]. Za zlatý standard rehabilitace pro funkční obnovu pohybu pacientů po CMP se považuje kombinace vždy více rehabilitačních přístupů s ohledem na specifické patologie a individuální potřeby pacienta [1].
Na podkladě rozsáhlých metaanalýz je tak dnes nepochybné, že efektivní rehabilitace není podmíněna favorizací jedné konkrétní rehabilitační metodiky nebo jednoho typu terapie vůči jiné [1,2]. Ale spíše respektováním obecných principů, které pozitivně stimulují neuroplasticitu a optimalizují tak s cerebrovaskulární atakou související pohybovou ztrátu. V obecné rovině, avšak i pro neurorehabilitaci chůze, jde vlastně o prolínající se motorická a kognitivní zadání:
a) Nácvik funkční aktivity zaměřené na konkrétní úkol (task-oriented training)
V rámci pohybové rekonvalescence pacienti po CMP benefitují především z drilového tréninku cílených a maximálně volně si uvědomovaných funkčních aktivit, které zohledňují aktuální kognitivně motorický potenciál nemocného [2,24].
b) Opakování cílených pohybů
Jako velmi efektivní, právě s ohledem na zlepšení lokomočních aktivit dolních končetin, je nezbytné časté a pravidelné opakování funkčně zaměřeného úkolu. Spíše než opakování švihové fáze je důležitější nácvik dílčích částí stojné fáze krokového stereotypu [24]. Nezbytné je do jednotlivých opakování vkládat drobné variace provedení pohybu. Nemocným zvládnutelná variabilita pohybových nároků vede k úspěšnějšímu výsledku neurorehabilitace nežli pouze strojový dril [25].
c) Intenzivní a dlouhotrvající trénování konkrétní pohybové aktivity
Důkazy silně podporují pozitivní vliv intenzity terapie na kvalitu pohybu u pacientů po CMP [26]. Dle Cochrane Review [1,24] se jako účinný ukázal trénink trvající min. 30– 60 min denně. Terapie chůze se proto doporučuje alespoň 45 min pravidelně každý den [27]. Obecným pravidlem je zahájit pohybový trénink již na iktových jednotkách v prvních dnech po cerebrovaskulární atace [28,29]. Současně příliš včasná mobilizace (24–48 hod po atace) nemá podle Cochrane Review [28] vliv na výsledné funkční zlepšení pohybu. Pro získání co možná největší konečné posturálně lokomoční nezávislosti je žádoucí zahájit vertikalizaci a bipední lokomoci včas. Tedy již od časného subakutního stadia, které se z hlediska neuroplasticity považuje za klíčové [28]. Po stabilizaci celkového stavu pak postupně zvyšovat intenzitu i koordinační náročnost funkčního tréninku [18,30]. V přiměřeně intenzivním lokomočním tréninku je důležité pokračovat i v chronickém stadiu. Výsledkem je zlepšení rychlosti a vytrvalosti chůze a velmi pravděpodobně též zlepšení některých kognitivních (deklarativních) funkcí, jako jsou sebekontrola, orientovaná pozornost a další [31].
d) Kognitivní trénink – kognitivně-motorická interference
Cochrane Review [32] sice udává, s ohledem na relativně malou kvantitu dostupných dat, že nebyl prokázán zřejmý benefit kognitivního tréninku na zlepšení pohybu u pacientů po CMP (nebo se získaným poškozením mozku). Nicméně sílí poznatky svědčící o jeho důležitosti u pacientů po CMP [33–35]. Pro optimálnější funkční úpravu po CMP je zřejmě nejúčinnější kombinace pohybového a kognitivního tréninku, tzv. kognitivně-motorická interference [33–35]. Příkladem kognitivně motorické interference jsou obvyklé situace denního života. Nemocný musí v rámci lokomoce, pro něj stále relativně náročné, navíc řešit ještě další (kognitivní) zadání. Nejznámějším příkladem je počítání během chůze. V klinické praxi jde samozřejmě o náročnější kombinace úkolů.
e) Multisenzorická stimulace
Současné využití více senzorických modalit k facilitaci pohybu můžeme rovněž zařadit mezi obecné principy efektivní neurorehabilitace [19,25]. V rámci aktuálních terapeutických přístupů se klade důraz na současné a cílené působení senzitivních, senzorických, motorických a kognitivních procesů [25,36]. Například situace, kdy se nemocný snaží vyhnout skupině lidí, kterou vidí, slyší, či s ní verbálně komunikuje.
Terapeutické modality neurorehabilitace chůze u pacientů po CMP
Objektivně úspěšná neurorehabilitace chůze vyplývá z výše uvedených obecných východisek. Veškeré strategie a koncepce neurorehabilitace chůze směřují k jednoznačnému cíli: samostatné, vytrvalé a dostatečně rychlé lokomoci v proměnlivém zevním prostředí.
V současné době se v neurorehabilitaci chůze nejčastěji používají tyto modality [9]:
Konvenční trénink chůze s oporou nebo dopomocí terapeuta
Historicky, ale stále nejčastěji jde o běžnou chůzi s oporou nebo asistencí či pouze se supervizí terapeuta/ ů. V nezbytné míře se využívají individuální technické pomůcky (chodítka, berle). Výhodou chůze s dopomocí terapeuta/ ů je individualizovaný přístup a možnosti bezprostřední korekce pacienta s ohledem na jeho aktuální funkční deficit (obr. 1A). Určitou nevýhodou může být náročnost pro terapeuta. Koriguje všechny komponenty pohybu nemocného, při současně vysokých nárocích na vlastní mentální a fyzickou kondici. Vedení chůze zkušeným terapeutem se v uvedených aspektech považuje za nenahraditelné jiným typem terapie [4,25].
Roboticky asistovaná chůze
Jde o všechny terapeutické situace, kdy se krokový stereotyp ve vertikále realizuje s určitou nastavitelnou mírou podpůrné i aktivní hybné asistence robotickým exoskeletem [6,9]. Vysoké pořizovací náklady a nároky na personální zajištění často limitují využití těchto technologií pouze na specializovaná pracoviště.
Trénink chůze na chodícím páse
Pohyb v krokovém stereotypu je stimulován pohybujícím se pásem (obr. 1B). Ve srovnání s běžnou chůzí je pacient nucen více používat paretickou dolní končetinu a realizuje větší počet krokových cyklů při vyšších rychlostech [3]. Předpokládá se, že chůze na chodícím páse významně facilituje aktivitu spinálních CPGs mnohočetným opakováním krokových cyklů (forsírovaným pohybem pásu) [6,15].
Chůze na chodícím páse s odlehčením (body-weight support therapy)
Používá se u nemocných, kteří jsou schopni chůze pouze s výraznou dopomocí. Závěsné zařízení umožňuje odlehčit část pacientovi hmotnosti (obr. 1C), ovšem facilitace krokového stereotypu je spíše diskutabilní [3,6].
Chůze s dopomocí přídatné zpětné vazby
Nejčastěji se využívá přídatná sluchová a vizuální zpětná vazba. Během auditorní zpětné vazby pacient přizpůsobuje chůzi externě danému rytmu, zatímco při vizuální zpětné vazbě je chůze vedena vizuálními značkami (na podlaze nebo chodícím pásu, obr. 1C) [9,31].
Chůze na chodícím pásu ve virtuálním prostředí
Na chodícím pásu v interaktivním virtuálním prostředí může pacient trénovat chůzi s ohledem na měnící se podmínky prostředí (např. překračování lávky, vyhnutí se překážce atd. (obr. 1D)). Výhoda této terapie je, že podmínky zevního prostředí můžeme modifikovat s ohledem na momentální kondici i kognici nemocného. Trénink chůze ve virtuálním prostředí je navíc potencován interaktivní multisenzorickou stimulací [9,37,38].
Sumárně je k dosažení maximálně možné nezávislosti v chůzi nezbytný intenzivní trénink a uvědomované zvládnutí jednotlivých fází krokového stereotypu jako konkrétní funkční aktivity. A to v senzoricky bohatém prostředí při dostatečně variabilních nárocích. Samozřejmě s ohledem na morfologický, neurologický i funkční potenciál nemocného [23,37,39].

Efektivita modalit neurorehabilitace chůze u pacientů po CMP na podkladě EBM
Každá z uvedených terapetických modalit chůze má svá specifika a v určitých aspektech odlišný mechanizmus stimulace bipední lokomoce. V rozsáhlých metaanalýzách bylo prokázáno, že pravidelný trénink na chodících pásech i další již zmíněné variace rehabilitace chůze (roboticky asistovaná chůze, chůze v odlehčení, chůze ve virtuální realitě nebo využití přídatné zpětné vazby) vedou u pacientů po CMP ke statisticky významnému zlepšení ve vybraných parametrech chůze (tab. 1) [6,40,41,42]. Rychlost a vytrvalost chůze se signifikantně zlepšují v případech, kdy je trénink chůze realizován minimálně 3× týdně, po dobu 4 týdnů v subakutních i chronických stadiích po CMP (tab. 2) [6]. Velmi efektivní terapií chůze je kombinace rehabilitace chůze na chodících pásech a konvenční terapie [30,38,44].
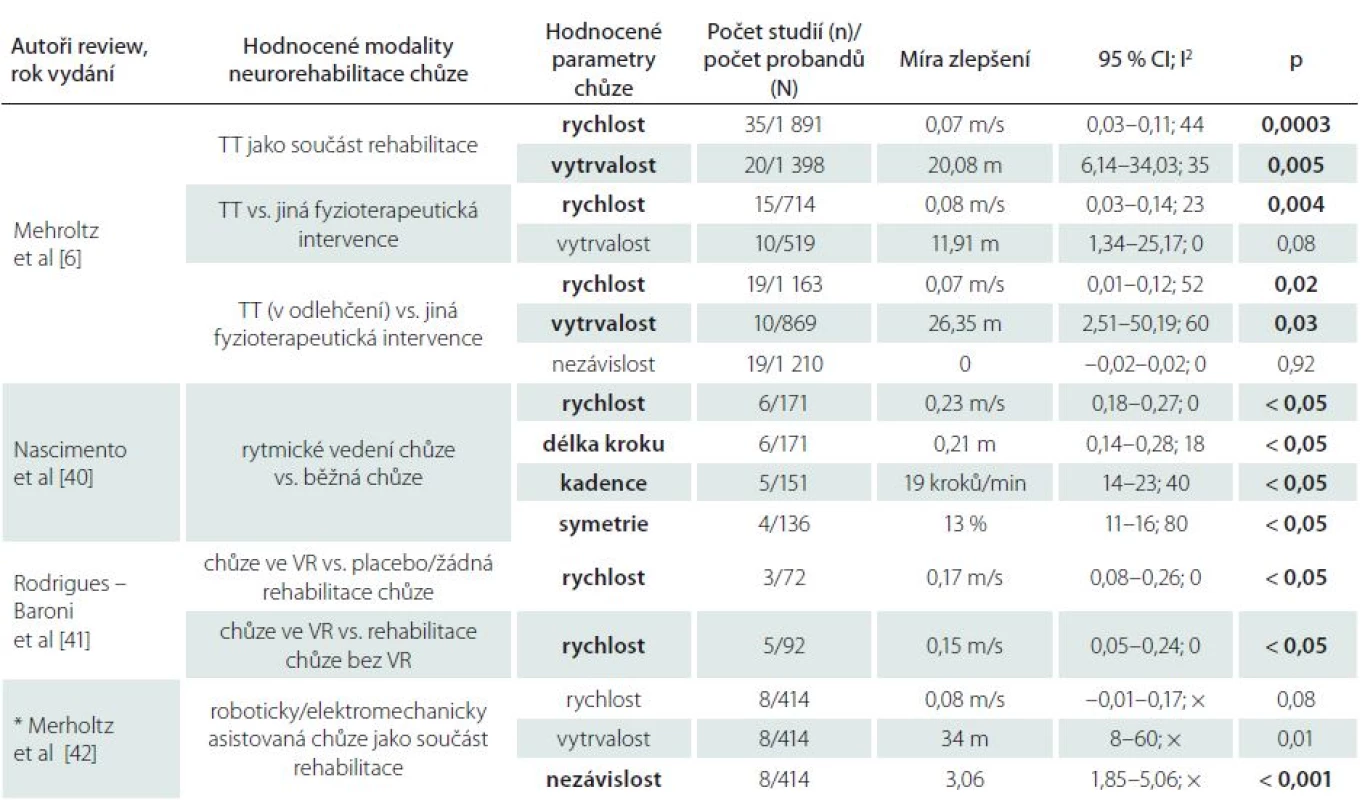
![Vliv stadia po CMP, intenzity a trvání terapie chůze na vybrané parametry chůze u pacientů po CMP dle [6].](https://www.csnn.eu/media/cache/resolve/media_object_image_small/media/image/92829462e7da07ba31613a140ead39f3.jpg)
Závěr
Neurorehabilitace chůze, stejně jako všechny neurorehabilitační strategie, vychází především z facilitace neuroplasticity. A to terapeuticky cíleně vedenou multisenzorickou aferencí k dosažení samostatné lokomoce v proměnlivém zevním prostředí.
Za zlatý standard rehabilitace se pro funkční obnovu pohybu pacientů po CMP na podkladě stávající EBM považuje kombinace více rehabilitačních přístupů. V případě neurorehabilitace chůze se jako nejúčinnější jeví kombinace více modalit, zejména chůze vedená terapeutem a chůze na chodícím pásu při dostatečně variabilních nárocích, v senzoricky bohatém prostředí, za současné uvědomované participace pacienta.
Cílem neurorehabilitace chůze je maximálně možná funkční obnova samostatné chůze pro fyzickou i sociální nezávislost nemocných po cévní mozkové příhodě.
Souhrn nezbytných bodů úspěšné neurorehabilitace chůze:
- Intenzita tréninku
- Variace krokového mechanizmu
- Variabilita prostředí
- Kombinace více terapeutických modalit
- Multisenzorická stimulace
- Kognitivně-motorická interference
- Aktivní participace pacienta
Práce vznikla za podpory interního grantu Univerzity Palackého IGA FZV 2016_006.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Alois Krobot, Ph.D.
Oddělení rehabilitace FN Olomouc
I. P. Pavlova 185/6
779 00 Olomouc
e-mail: alois.krobot@fnol.cz
Přijato k recenzi: 15. 8. 2016
Přijato do tisku: 31. 7. 2017
Sources
1. Pollock A, Baer G, Campbell P, et al. Physical rehabilitation approaches for the recovery of function and mobility following stroke. Cochrane Database Syst Rev 2014;22(4):CD001920. doi: 10.1002/ 14651858.CD001920.pub3.
2. Faralli A, Bigoni M, Mauro A, et al. Noninvasive strategies to promote functional recovery after stroke. Neural Plast 2013;2013:854597. doi: 10.1155/ 2013/ 854597.
3. Eng JJ, Tang PF. Gait training strategies to optimize walking ability in people with stroke: a synthesis of the evidence. Expert Rev Neurother 2007;7(10):1417– 36.
4. Evers SM, Struijs JN, Ament AJ, et al. International comparison of stroke cost studies. Stroke 2004;35(5):1209– 15.
5. Truelsen T, Piechowski-Jóźwiak B, Bonita R, et al. Stroke incidence and prevalence in Europe: a review of available data. Eur J Neurol. 2006;13(6):581– 98.
6. Mehrholz J, Pohl M, Elsner B. Treadmill training and body weight support for walking after stroke. CochraneDatabase Syst Rev. 2014;23(1):CD002840. doi: 10.1002/ 14651858.CD002840.pub3.
7. Jørgensen HS, Nakayama H, Raaschou HO, et al. Recovery of walking function in stroke patients: the Copenhagen Stroke Study. Arch Phys Med Rehabil. 1995;76(1):27– 32.
8. Woolley SM. Characteristics of gait in hemiplegia. Top Stroke Rehabil 2001;7:1– 18.
10. Balaban B, Tok F. Gait disturbances in patients with stroke. PM R 2014;6(7):635– 42. doi: 10.1016/ j.pmrj.2013.12.017.
9. Belda-Lois JM, Mena-del Horno S, Bermejo-Bosch I, et al. Rehabilitation of gait after stroke: a review towards a top-down approach. J Neuroeng Rehabil 2011;13(8):66. doi: 10.1186/ 1743-0003-8-66.
10. Perry J., Burnfield JM. Gait Analysis: Normal and Pathological Function. 2nd ed. New Jersey: SLACK Incor-porated 2010.
11. Krouchev N, Drew T. Motor cortical regulation of sparse synergies provides a framework for the flexible control of precision walking. Front Comput Neurosci 2013;11(7):83. doi: 10.3389/ fncom.2013.00083.
12. Rossignol S, Dubuc R, Gossard JP. Dynamic sensorimotor interactions in locomotion. Physiol Rev 2006;86(1):89– 154.
13. Takakusaki K, Chiba R, Nozu T, et al. Brainstem control of locomotion and muscle tone with special reference to the role of the mesopontine tegmentum and medullary reticulospinal systems. J Neural Transm (Vienna) 2016;123(7):695– 729. doi: 10.1007/ s00702-015-1475-4.
14. Courtine G, Song B, Roy RR, et al. Recovery of supraspinal control of stepping via indirect propriospinal relay connections after spinal cord injury. Nat Med 2008;14(1):69– 74.
15. Dietz V, Schrafl-Altermatt M. Control of functional movements in healthy and post-stroke subjects: Role of neural interlimb coupling. Clin Neurophysiol 2016;127(5):2286– 93. doi: 10.1016/ j.clinph.2016.02.014.
16. Page SJ, Gater DR, Bach-Y-Rita P. Reconsidering the motor recovery plateau in stroke rehabilitation. Arch Phys Med Rehabil 2004;85(8):1377– 81.
17. Enzinger C, Johansen-Berg H, Dawes H, et al. Functional MRI correlates of lower limb function in stroke victims with gait impairment. Stroke 2008;39:1507– 13.
18. Pekna M, Pekny M, Nilsson M. Modulation of neural plasticity as a basis for stroke rehabilitation. Stroke 2012;43(10):2819– 28.
19. Johansson BB. Functional and cellular effects of environmental enrichment after experimental brain infarcts. Restor Neurol Neurosci 2004;22(3– 5):163– 74.
20. Lakhani B, Borich MR, Jackson JN, et al. Motor Skill Acquisition Promotes Human Brain Myelin Plasticity. Neural Plast 2016;2016:7526135. doi: 10.1155/ 2016/ 7526135.
21. Janssen H, Bernhardt J, Collier JM, et al. An enriched environment improves sensorimotor function post-ischemic stroke. Neurorehabil Neural Repair 2010;24:802– 13. doi: 10.1177/ 1545968310372092.
22. Lee T, Swanson L, Hall A. What is repeated in a repetition? Effects of practice conditions on motor skill acquisition. Phys Ther. 1991; 71(2):150– 6.
23. Van Peppen RP, Kwakkel G, Wood-Dauphinee S, et al. The impact of physical therapy on functional outcomes after stroke: what’s the evidence? Clinical rehabilitation 2004;18:833– 62.
24. French B, Thomas LH, Leathley MJ, et al. Repetitive task training for improving functional ability after stroke. Cochrane Database Syst Rev 2007;17;(4):CD006073.
25. Veerbeek JM, van Wegen E, van Peppen R, et al. What is the evidence for physical therapy poststroke? A systematic review and meta-analysis. PLoS One 2014; 4;9(2):e87987. doi: 10.1371/ journal.pone.0087987.
26. Lang CE, Lohse KR, Birkenmeier RL.Dose and timing in neurorehabilitation: prescribing motor therapy after stroke. Curr Opin Neurol 2015;28(6):549– 55. doi:10.1097/ WCO.0000000000000256.
27. Intercollegiate Stroke Working Party. National clinical guideline for stroke, 4th edition. London: Royal College of Physicians 2012.
28. Bernhardt J, Thuy MN, Collier JM, et al. Very early versus delayed mobilisation after stroke. CochraneDatabase Syst Rev 2009;21(1):CD006187. doi: 10.1002/ 14651858.CD006187.pub2.
29. Herisson F, Godard S, Volteau C, et al. Early Sitting in Ischemic Stroke Patients (SEVEL): A Randomized Controlled Trial. PLoS One 2016;11(3):e0149466. doi: 10.1371/ journal.pone.0149466. eCollection 2016.
30. Eich HJ, Mach H, Werner C, et al. Aerobic treadmill plus Bobath walking training improves walking in subacute stroke: a randomized controlled trial. Clin Rehabil 2004;18(6):640– 51.
31. Cha Y, Kim Y, Hwang S, et al. Intensive gait training with rhythmic auditory stimulation in individuals with chronic hemiparetic stroke: a pilot randomized controlled study. NeuroRehabilitation 2014;35(4):681– 8. doi: 10.3233/ NRE-141182.
32. Chung CS, Pollock A, Campbell T, et al. Cognitive rehabilitation for executive dysfunction in adults with stroke or other adult non-progressive acquired brain damage. Cochrane Database Syst Rev 2013;30(4):CD008391. doi: 10.1002/ 14651858.CD008391.pub2.
33. Barrett AM, Muzaffar T. Spatial cognitive rehabilitation and motor recovery after stroke. Curr Opin Neurol 2014;27(6):653– 8. doi: 10.1097/ WCO.0000000000000148.
34. Al-Yahya E, Dawes H, Smith L, et al. Cognitive motor interference while walking: a systematic review and meta-analysis. Neurosci Biobehav Rev 2011;35(3):715– 28. doi: 10.1016/ j.neubiorev.2010.08.008.
35. Wang XQ, Pi YL, Chen BL, et al. Cognitive motor interference for gait and balance in stroke: a systematic review and meta-analysis. Eur J Neurol 2015;22(3):555– e37. doi: 10.1111/ ene.12616.
36. Brown T, Mapleston J, Naim A, et al. Relationship of cognitive and perceptual abilities to functional independence in adults who have had a stroke. Occup Ther Int 2013;20:11– 22. doi: 10.1002/ oti.1334.
37. Corbetta D, Imeri F, Gatti R. Rehabilitation that incorporates virtual reality is more effective than standard rehabilitation for improving walking speed, balance and mobility after stroke: a systematic review. J Physiother 2015;61(3):117– 24. doi: 10.1016/ j.jphys.2015.05.017.
38. Lever KE, George S, Thomas S, et al. Virtual reality for stroke rehabilitation (Review). Cochrane Database of Systematic Reviews 2015;2,CD008349.
39. van de Port IG, Wood-Dauphinee S, Lindeman E,et al. Effects of exercise training programs on walkingcompetency after stroke: a systematic review. Am J PhysMed Rehabil. 2007; 86(11):935– 51. doi: 10.1002/ 14651858.CD008349.pub3
40. Nascimento LR, de Oliveira CQ, Ada Let al. Walking training with cueing of cadence improves walking speed and stride length after stroke more than walking training alone: a systematic review. J Physiother 2015;61(1):10– 5. doi: 10.1016/ j.jphys.2014.11.015.
41. Rodrigues-Baroni JM, Nascimento LR, Ada L, et al. Walking training associated with virtual reality-based training increases walking speed of individuals with chronic stroke: systematic review with meta-analysis. Braz J Phys Ther 2014;18(6):502– 12. doi: 10.1590/ bjpt-rbf.2014.0062.
42. Mehrholz J, Werner C, Kugler J, et al. Electrome-chanical-assisted training for walking after stroke. Cochrane Database Syst Rev 2007;(4):CD006185.
43. Ada L, Dean CM, Hall JM, et al. A treadmill and overground walking program improves walking in persons residing in the community after stroke: a placebo-controlled, randomized trial. Arch Phys Med Rehabil 2003;84(10):1486– 91.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 5
Most read in this issue
- Esenciální tremor – vzniká nový nozologický koncept?
- Leberova hereditární neuropatie optiku
- Statiny indukovaná nekrotizující autoimunitní myopatie
- Terapia pokročilých štádií Parkinsonovej choroby invazívnymi postupmi
