Periodické pohyby končetinami ve spánku jsou závažnější u narkolepsie s kataplexií než u narkolepsie bez kataplexie
Periodic Limb Movements During Sleep are More Severe in Narcolepsy with Cataplexy than in Narcolepsy without Cataplexy
Introduction:
Periodic limb movements in sleep (PLMS) are repetitive stereotyped movements of extremities, particularly of the legs. Some studies identified narcolepsy to be associated with higher PLMS occurrence.
Methods:
A retrospective study including 78 patients with narcolepsy with cataplexy (NC) and 29 patients with narcolepsy without cataplexy (NwoC) aged 19 to 86 years, 50 women and 57 men. All subjects underwent a clinical examination including video-polysomnography 8 hours at night time and the multiple sleep latency test (MSLT).
Results:
PLMS characterized by the periodic leg movements index (PLMI – number of periodic leg movements per 1 hour) ≥ 15 were found in 40% of the total of 107 patients – 43% of NC and 32% of NwoC. PLMS was associated with higher age and with lower sleep efficacy. The mean PLMI of NC and NwoC was different 24.3 ± 30.2 and 12.6 ± 20.8, resp. Similar values were identified when subjects not using antidepressants during the study were evaluated in these same subgroups. PLMI values (31.2 ± 33.3) were higher in patients using antidepressants than in patients never taking antidepressants (15.4 ± 23.7), irrespective of whether antidepressants were used before the study only or before and during the study. However, patients with the history of antidepressants use were older.
Conclusion:
PLMS are frequent comorbidity in NC and it is more frequent in NC than in NwoC.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Key words:
narcolepsy with cataplexy – narcolepsy without cataplexy – periodic limb movements in sleep – antidepressants – comorbidity
Chinese summary - 摘要
在睡眠中周期性肢体动作严重与猝倒发作性睡病比嗜睡症无猝倒
摘要
简介:
在睡眠中周期性肢体运动(PLMS)特别重复动作睡眠时下肢。一些报告描述PLMS的发病率较高
发作性睡病。
方法:
78例患者从患嗜睡症与猝倒症(NK)和29的回顾性研究患者发作性睡病猝倒无(NbezK)(年龄从19年〜86岁,50名妇女和57男性)。所有患者进行临床检查,视频多导睡眠图晚上8点
在晚上的时间,多睡眠潜伏期试验。
结果:
每小时PLMS的特点是周期性运动(PLMI)≥15表明总集107例,40%的组中的NK的43%,并在基
NbezK 32%。发生PLMS与年龄和较低的时间有关效率。直径在PLMI NK(24.3±SD = 30.2)是从平均PLMI不同NbezK(12.6±20.8)和非常相似的结果在上述时所获得组进行了评价只有谁是在考试的时候治疗的患者抗抑郁药。 PLMI患者接受抗抑郁药,无论以前或在时间记录(31.2±33.3)高于谁从未接受过抗抑郁药的患者高(15.4±23.7),但患者的抗抑郁药治疗的历史是老年人。
结论:
PLMS频繁合并症NK,往往比NbezK。
关键词:
发作性睡病与猝倒 - 发作性睡病猝倒没有 - 在周期性肢体运动睡眠 - 抗抑郁药 - 合并症
:
J. Krpešová; D. Kemlink; V. Ibarburu; S. Dostálová; J. Bušková; J. Piško; P. Kovalská; I. Příhodová; K. Šonka
:
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN v Praze
:
Cesk Slov Neurol N 2017; 80/113(1): 70-74
:
Original Paper
Úvod:
Periodické pohyby končetinami ve spánku (PLMS) jsou repetiční pohyby zejména dolními končetinami ve spánku. Několik prací popisuje vyšší výskyt PLMS u narkolepsie.
Metodika:
Retrospektivní studie se 78 pacienty trpícími narkolepsií s kataplexií (NK) a 29 pacienty s narkolepsií bez kataplexie (NbezK), (věk od 19 let do 86 let, 50 žen a 57 mužů). Všichni nemocní absolvovali klinické vyšetření, video-polysomnografii 8 hod v noční době a test mnohočetné latence usnutí.
Výsledky:
PLMS charakterizované počtem periodických pohybů za hodinu (PLMI) ≥ 15 vykazovalo z celkového souboru 107 pacientů 40 %, ve skupině NK 43 % a ve skupině NbezK 32 %. Výskyt PLMS byl asociován s vyšším věkem a s nižší spánkovou efektivitou. Průměr PLMI u NK (24,3 ± SD = 30,2) byl rozdílný od průměru PLMI u NbezK (12,6 ± 20,8) a velmi podobných výsledků bylo dosaženo, když v uvedených skupinách byli hodnoceni pouze nemocní, kteří nebyli v době vyšetření léčeni antidepresivy. PLMI nemocných léčených antidepresivy, ať již dříve nebo i v době záznamu (31,2 ± 33,3), byl vyšší než u nemocných, kteří antidepresiva nikdy neužívali (15,4 ± 23,7), ale nemocní s anamnézou léčby antidepresivy byli starší.
Závěr:
PLMS jsou častou komorbiditou NK, častější než u NbezK.
Klíčová slova:
narkolepsie s kataplexií – narkolepsie bez kataplexie – periodické pohyby končetin ve spánku – antidepresiva – komorbidity
Úvod
Narkolepsie, hypersomnie centrálního původu, se v medicínském písemnictví objevuje ve druhé polovině 19. století. Kromě základního příznaku – nadměrné denní spavosti – se postupně přidávala znalost dalších projevů, a to zejména projevů disociovaného REM spánku – kataplexie, spánkové obrny a hypnagogické halucinace. Po objevu deficitu hypokretinových neuronů v laterálním hypothalamu u nemocných, kteří trpí kataplexií [1,2], byla ve druhém vydání Mezinárodní klasifikace poruch spánku narkolepsie rozdělena na dvě samostatné nozologické jednotky: narkolepsii s kataplexií (NK) a narkolepsii bez kataplexie (NbezK) [3]. Etiopatogeneze NK je nyní do značné míry známa – předpokládá se, že vymizení hypokretinových neuronů v hypothalamu má původ v autoimunitní reakci zprostředkované T buňkami zaměřené právě na hypokretinové neurony [4,5], pro kterou také svědčí mimo jiné velmi silná asociace s HLA (Human Leukocytes Antigen) třídy I zvláště s alelou HLA DQB1*06:02 [6]. Naopak o příčinách vzniku symptomů NbezK se téměř nic neví. NK je častější než NbezK a je jí v literatuře věnována větší pozornost.
Periodické pohyby končetinami ve spánku (Periodic Limb Movements in Sleep; PLMS) jsou opakující se, většinou stereotypní pohyby končetin (převážně dolních) a výjimečně i trupu vyskytující se ve spánku [3]. PLMS jsou známy od poloviny 20. století a jejich skórovací kritéria byla nedávno nově definována [7]. Vyskytují se v kterémkoli spánkovém stadiu NREM, výjimečně v REM spánku, a mohou se objevit i při bdělosti v noci. Pohyb nejčastěji spočívá v extenzi palce nebo zahrnuje flexi v hleznu anebo i další segmenty na dolní končetině až má charakter trojflexe (flexe v koleni, hlezně a kyčli). PLMS však může postihovat i svaly na horní končetině a trupu. Pohyby při PLMS jsou buď oboustranné nebo jednostranné, přičemž lateralita pohybu se může měnit. Nemocní jsou si PLMS málokdy vědomi. PLMS se registruje z obou dolních končetin povrchovou elektromyografií (EMG) z oblasti nad musculus tibialis anterior při noční video-polysomnografii [7] či alternativně pomocí aktigrafů s vysokou snímací frekvencí v oblasti hlezen nebo palců dolních končetin [8]. Intenzita PLMS se vyjadřuje počtem pohybů za hodinu (Periodic Limb Movements Index; PLMI). Patologické hodnoty PLMI jsou od 5 výše, ale studie často udávají jako cut-off hodnotu významného PLMS PLMI ≥ 15. PLMS se asi v 80 % vyskytují spolu se syndromem neklidných nohou/Willisově-Ekbomově nemoci (Restless Legs Syndrome; RLS/Willis-Ekbom Disease; WED) [9]. Antidepresiva (zejména selektivní inhibitory zpětného vychytávání serotoninu (Selective Serotonin Reuptake Inhibitors; SSRI)) mohou vyvolat RLS/WED a PLMS podle naší zkušenosti [10] a také dle retrospektivních studií [11] i otevřené prospektivní studie se sertralinem [12].
Výskyt PLMS u narkolepsie byl na malých a nehomogenních skupinách nemocných referován již od 80. let minulého století [13]. Dauvilliers et al v roce 2007 jako první analyzovali výskyt PLMS u velké skupiny nemocných (169) v porovnání s kontrolami a potvrdili vyšší výskyt PLMS u narkolepsie, jejich studie však ještě zahrnovala NK a NbezK dohromady [14]. Protože ale informace z jiných pacientských kohort byly rozdílné – např. nízký výskyt PLMS u německých nemocných [15] – nebo byly provedeny u malých skupin NK [16,17] a protože recentní práce se zaměřily pouze na asociaci PLMS s NK [16–18] a nikoliv na NbezK, rozhodli jsme se analyzovat výskyt PLMS v naší populaci nemocných s NK a NbezK.
Soubor a metodika
Tato studie je retrospektivní zhodnocení výsledků nemocných s diagnózou NK a NbezK z neurologicky zaměřeného centra pro poruchy spánku a bdění v univerzitní nemocnici.
Byli vyhledáni nemocní s jednoznačnou diagnózou NK a NbezK, kteří v letech 2008–2015 absolvovali klinické vyšetření, noční video-polysomnografii a test mnohočetné latence usnutí (Multiple Sleep Latency Test; MSLT) a v době vyšetření byli staří 18 a více let. Tato studie analyzuje první diagnostická vyšetření nemocných, kteří neměli žádnou zkušenost s léky ovlivňujícími spánek, a vyšetření nemocných, kterým bylo po dřívějším stanovení diagnózy opakované komplexní vyšetření provedeno, např. pro podezření na rozvoj komorbidní poruchy spánku, pro verifikaci diagnózy stanovené před platností současných diagnostických kritérií. Léčení nemocní byli požádáni, aby vynechali terapii proti narkolepsii nejméně 2 týdny před plánovaným vyšetřením. Případné nevysazení léčby bylo zaznamenáno.
Při video-polysomnografii a MSLT nemocný ležel na pohodlném lůžku v samostatné místnosti. Video-polysomnografie byla provedena podle doporučení Americké asociace spánkové medicíny z roku 2007 [7]. Registrace trvala 8 hod v období 22:00–6:00 hod a zahrnovala minimálně tři svody elektroencefalografie (F4-M1, C4-M1, O2-M1 nebo F3-M2, C3-M2, O1-M2), dva svody pro registraci očních pohybů (E1--M2 a E2-M2) a EMG snímané dvěma povrchovými elektrodami v oblasti musculi mentales nebo elektrodami umístěnými nad a pod bradovým výběžkem vlevo i vpravo. Byly registrovány dýchací pohyby hrudníku a břicha roztažnými pásy, proud vzduchu před nosem a ústy termistory a případně také tlakovými kanylami v ústí nosních průduchů. Video-polysomnografie dále zahrnovala měření saturace periferní krve kyslíkem pulzním oxymetrem umístěným na prstu ruky, čidlo zaznamenávající polohu trupu a mikrofon na krku k zachycení dechových zvuků. Analýza videozáznamu, který byl pořízen, není předmětem této studie. Pohyby dolními končetinami byly registrovány bilaterálně svody povrchové elektromyografie (EMG) z oblasti musculi tibiales anteriores. Jako pohyb splňující kritéria PLMS byl brán pohyb, který vyvolal alespoň na jedné dolní končetině vzestup EMG aktivity o více než 8 μV nad klidovou úroveň o trvání 0,5–10 s. Minimální počet konsekutivních pohybů byl čtyři a interval mezi začátky jednotlivých pohybů musel být mezi 5 a 90 s. Pohyb na končetině pravé a levé byl považován za jeden pohyb, pokud interval začátku pohybu vlevo a vpravo byl kratší než 5 s [7]. Pro tuto studii jsme PLMS definovali podobně jako v jiných studiích hodnotou PLMI ≥ 15. Apnoe byla definována jako pokles amplitudy dechové křivky o ≥ 90 % o trvání ≥ 10 s. Hypopnoe byla definována jako pokles amplitudy dechové křivky o ≥ 50 % o trvání ≥ 10 s provázený poklesem saturace o ≥ 3 %. Kvantifikovaným výsledkem hodnocení poruchy dýchání ve spánku byl počet apnoí a hypopnoí za hodinu spánku (Apnoe/Hypopnoe Index; AHI).
Pro účely této studie byly zpracovány následující parametry noční video-polysomnografie: latence usnutí (čas od zhasnutí do první epochy hodnocené jako spánek), celkové trvání spánku (součet trvání všech spánkových stadií), spánková efektivita (podíl trvání součtu všech spánkových stadií vzhledem k celkové příležitosti spát – interval mezi večerním zhasnutím a ranním rozsvícením), počet probuzení delších než 0,25 min, procentuální trvání jednotlivých spánkových stadií, latence REM spánku, AHI a PLMI.
Následující den byl proveden MSLT podle standardního protokolu s pěti měřeními v 9:00, 11:00, 13:00, 15:00 a v 17:00. Registrace při MSLT zahrnovala EEG svody jako při noční video-polysomnografii, povrchovou EMG v oblasti bradových svalů a svody zachycující pohyb očí [19]. Výsledkem byla průměrná latence usnutí a počet testů, při kterých se objevil REM spánek (Sleep Onset REM period; SOREM, přítomnost REM spánku během prvních 15 min od usnutí).
Všichni nemocní zhodnotili subjektivně svoji denní spavost v týdnu předcházejícím vyšetřením Epworthskou škálou spavosti (Epworth Sleepiness Scale; ESS) [20]. HLA DQB1*06:02 typizace byla k dispozici u 98 nemocných.
Výsledky nemocných s NK a NbezK byly porovnány u všech nemocných a následně u nemocných s NK a NbezK, kteří nikdy nebo nejméně 2 týdny před vyšetřením nebyli léčeni antidepresivy. Ve třetím kroku byly porovnány výsledky nemocných bez anamnézy léčby antidepresivy s výsledky nemocných, kteří někdy za život antidepresiva užívali, a to nejdříve pro skupinu nemocných s NK a pak také pro obě skupiny NK a NbezK dohromady.
Průměry PLMI, AHI a počty probuzení neměly normální rozložení a jejich průměry byly porovnány neparametricky pomocí Mannova-Whitneyho P-M-W U testu. U ostatních kvantitativních parametrů bylo rozložení normální a k porovnání průměrů byl použit oboustranný t test. Statistické zpracování bylo provedeno programem STATISTICA StatSoft, Inc.(2013).
Studii schválila etická komise Všeobecné fakultní nemocnice v Praze a nemocní písemně vyslovili souhlas s výzkumným zpracováním klinických a polysomnografických dat.
Výsledky
Do studie bylo zahrnuto 107 dospělých pacientů, kteří splňovali diagnostická kritéria NK (78 nemocných) a NbezK (29 nemocných). Soubor tvořilo 50 žen a 57 mužů, jejich věk v době vyšetření byl od 19 do 86 (průměr 45,0 ± SD = 17,7) let. Charakteristiky obou skupin nemocných jsou v tab. 1. HLA DQB1*06:02 bylo k dispozici u 74 nemocných s NK (z toho u 72 bylo pozitivní) a u 24 nemocných s NbezK (pozitivní bylo u 10). Hypnagogické halucinace se vyskytovaly u 49 % nemocných s NK a u 18 % s NbezK. Spánková obrna byla referována 41 % nemocnými s NK a pouze 11 % nemocnými s NbezK. Porucha chování v REM spánku byla zjištěna u 24 % nemocných s NK a u žádného nemocného s NbezK. Obstrukční spánková apnoe (AHI ≥ 5) byla přítomna u 33 % nemocných s NK a 24 % nemocných s NbezK. Žádný nemocný nesplňoval podmínky pro stanovení diagnózy centrální spánková apnoe. RLS/WED byl přítomen u 16 % nemocných celého souboru, u NK to bylo v 19 % a u NbezK v 7 %. Ve skupině nemocných s NK bylo 17 nemocných, kteří v době vyšetření brali antidepresiva: osm escitalopram, dva sertralin, dva venlafaxin, dva tianeptin, tři klomipramin a jeden nemocný bral jako druhé antidepresivum trazodon. Ve skupině NbezK pouze jeden nemocný užíval trazodon. Stimulancia nevysadilo před vyšetřením 11 nemocných s NK (10 modafinil a jeden metylfenidát) a tři nemocní s NbezK brali modafinil.
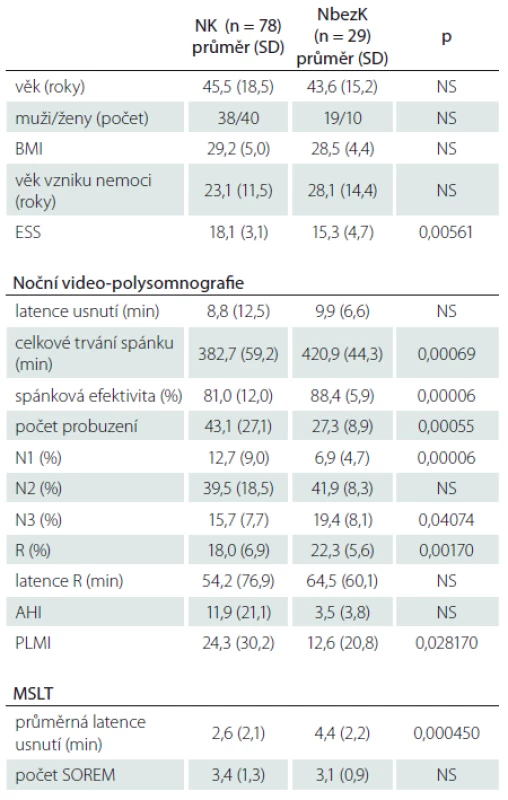
Základní informace o nemocných s NK a NbezK a jejich výsledky z noční video-polysomnografie a MSLT jsou obsaženy v tab 1. PLMS (PLMI ≥ 15) byly zjištěny u 40 % z celkového počtu nemocných, přičemž u NK to bylo 43 % a NbezK 32 %. Výskyt PLMS byl u všech nemocných dohromady asociován s vyšším věkem pacientů a s nižší spánkovou efektivitou. Hranici PLMI ≥ 5 překročilo 66 % nemocných s NK a 39 % s NbezK.
Porovnání stejných parametrů u nemocných s NK, kteří nebyli nikdy nebo nejméně 2 týdny před vyšetřením léčeni antidepresivy, obsahuje tab. 2. Hranici PLMI ≥ 5 v této skupině překročilo 55 % pacientů (vs. 76 % pacientů léčených AD; p = 0,049), hranici PLMI ≥ 15 překročilo 33 % (vs. 53 % pacientů léčených AD; p není signifikantní).
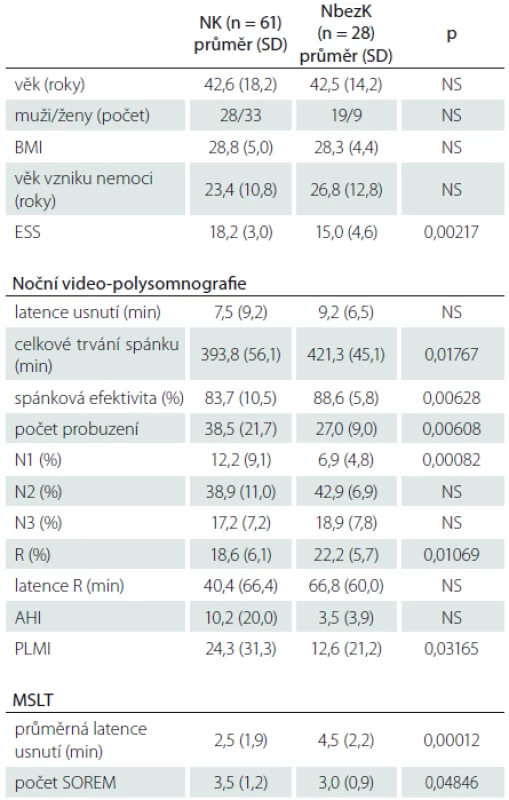
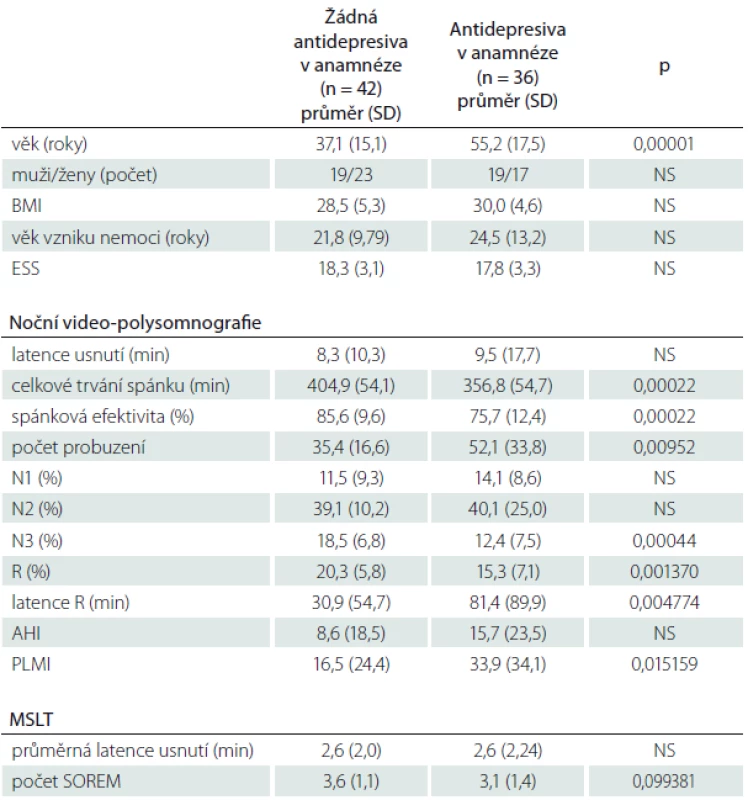
Výsledky a jejich srovnání u nemocných s NK, kteří nikdy před vyšetřením nebrali antidepresiva, s výsledky nemocných, kteří v minulosti nebo i v době vyšetření antidepresiva užívali, obsahuje tab. 3.
Při porovnání hodnot PLMI nemocných s NK a NbezK dohromady, kteří užívali antidepresiva v době před vyšetřením, ale v době vyšetření již antidepresiva neužívali (n = 22), a PLMI nemocných obou těchto skupin, kteří antidepresiva užívali i v průběhu vyšetření video-polysomnografií (n = 18), nebyl také nalezen rozdíl.
Diskuze
- PLMI je u NK dvakrát vyšší než u nemocných s NbezK, což je klinicky významné a patofyziologicky zajímavé. Význam tohoto výsledku snižuje fakt, že struktura spánku (procentuální podíly jednotlivých spánkových stadií) byla u nemocných obou skupin rozdílná. Vyšší PLMI u NK než u NbezK je plně v souhlase s prací Pizza et al [17], jejichž studie zahrnovala pouze nemocné bez předchozí léčby narkolepsie.
- Možnou potenciaci vzniku PLMS expozicí antidepresivům naznačuje vedlejší výsledek této studie. Je to dvojnásobná hodnota PLMI u nemocných exponovaných antidepresivům proti hodnotě nemocných bez antidepresiv, a to jak ve skupině NK, tak i ve skupině NK a NbezK dohromady. Význam tohoto výsledku značně oslabuje podstatně vyšší věk nemocných s expozicí antidepresivům. PLMS resp. jejich intenzita se totiž s věkem zvyšuje ve všeobecné populaci [21] a také u NK [14,18].
- PLMI u nemocných s NK a také u nemocných NbezK se zdá vyšší, než ukazují kohortové studie běžné populace stejně tak jako podíl nemocných z obou skupin, kteří splňují kritéria PLMS [22]. Porovnání s obecnou českou populací však naše studie neumožňuje, protože takto nebyla zaměřena. Lokální prevalenční studie výskytu PLMS v České republice nejsou k dispozici, což je i pro orientační srovnání důležité, neboť výskyt PLMS vykazuje etnické rozdíly [22].
- Studie potvrdila, že nemocní s NK mají horší strukturu spánku než nemocní s NbezK vč. snížené efektivity spánku, zvýšeného počtu probuzení, sníženého trvání N3 a R a recentně popsaného prodlouženého trvání N1 [23]. Horší struktura spánku u NK může do určité míry souviset s PLMS [24]. Nemocní s NK byli více spaví (subjektivně i objektivně) než nemocní s NbezK, což také odpovídá literárním údajům. Tyto rozdíly nebyly způsobeny antidepresivní medikací.
Zcela recentně vyšla průřezová studie u 158 japonských nemocných s NK a 295 nemocných s NbezK, kteří nebyli nikdy léčeni. Jejich výsledky jsou velmi podobné našim nejen v rozdílu v PLMI, ale i v rozdílech dalších polysomnografických parametrů [25].
V etiologii PLMS se pravděpodobně uplatňuje dysfunkce dopaminergního systému [26]. U NK se však zřejmě etiopatogeneze PLMS částečně liší od PLMS spojených se RLS/WED, protože klinický projev není stejný. U NK je menší periodicita pohybů [16] a PLMS u NK vyvolávají menší kolísání srdeční frekvence [27]. Vysoký výskyt a vysoká intenzita PLMS u NK zřejmě souvisí s deficitem hypokretinu, protože hypokretinové neurony mají pozitivní vliv na dopaminergní transmisi [28], např. excitují dopaminergní jádra předního tegmenta [29]. PLMS byly také zjištěny u psů s mutací genu pro hypokretinový receptor 2 [30]. Nedostatečnou dopaminergní transmisi při PLMS u NK dokládá i pozitivní vliv dopaminergní léčby [31]. Pravděpodobný vyšší výskyt PLMS u NbezK než u běžné populace lze spekulativně spojovat s parciálním deficitem hypokretinových neuronů u NbezK [32]; ten se však nepovažuje za jistě prokázaný.
Klinický význam a indikaci k léčení PLMS u NK a NbezK je potřeba posuzovat individuálně, protože jen u některých nemocných PLMS vedou ke klinickým symptomům, které obtěžují. Pizza et al dokonce uzavřeli svoji studii z roku 2013 tvrzením, že PLMS mají u NK omezený vliv na klinickou manifestaci [17].
Naše práce naznačuje, že antidepresiva mohou vést k PLMS pravděpodobně i u NK, a to i v případě, že nemocný s NK byl exponován antidepresivu jen přechodnou dobu, podobně jako zřejmě expozice antidepresivu může indukovat poruchu chování v REM spánku [33]. Potvrzení nebo vyvrácení podezření na tento nežádoucí účinek antidepresiv vyžaduje studii na vyšším množství nemocných a přesněji dokumentované farmakologické anamnéze (identifikované jednotlivé typy antidepresiv a trvání expozice) a také prospektivní studie nemocných léčených jednotlivými typy antidepresiv. Tento případný nežádoucí účinek však zatím nic nemění na tom, že antidepresiva jsou základní lék proti disociovaným projevům REM spánku, zejména kataplexie [34].
Význam naší práce limituje její retrospektivní charakter a omezený počet nemocných.
Závěr
Intenzita PLMS vyjádřená PLMI je vyšší u NK než u NbezK a u obou skupin je výskyt PLMS vyšší, než se udává v běžné populaci. Nemocní s NK mají horší kvalitu nočního spánku vč. prodlouženého trvání N1 a mírně vyšší denní spavost než nemocní s NbezK.
Práce vznikla za podpory grantu Ministerstva zdravotnictví České republiky NT 13238-4/2012 a grantu Univerzity Karlovy v Praze PRVOUK P26/LF1/4.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Karel Šonka, DrSc.
Neurologická klinika
1. LF UK a VFN v Praze
Kateřinská 30
120 00 Praha 2
e-mail: ksonka@lf1.cuni.cz
Přijato k recenzi: 28. 12. 2015
Přijato do tisku: 1. 12. 2016
Sources
1. Peyron C, Faraco J, Rogers W, et al. A mutation in a case of early onset narcolepsy and a generalized absence of hypocretin peptides in human narcoleptic brains. Nat Med 2000;6(9):991– 7.
2. Thannickal TC, Moore RY, Nienhuis R, et al. Reduced number of hypocretin neurons in human narcolepsy. Neuron 2000;27(3):469– 74.
3. American Academy of Sleep Medicine. International classification of sleep disorders. 2nd ed. Westchester, Illinois: American Academy of Sleep Medicine 2005.
4. Partinen M, Kornum BR, Plazzi G, et al. Narcolepsy as an autoimmune disease: the role of H1N1 infection and vaccination. Lancet Neurol 2014;13(6):600– 13. doi: 10.1016/ S1474-4422(14)70075-4.
5. Liblau RS, Vassalli A, Seifinejad A, et al. Hypocretin (orexin) biology and the pathophysiology of narcolepsy with cataplexy. Lancet Neurol 2015;14(3):318– 28. doi: 10.1016/ S1474-4422(14)70218-2.
6. Tafti M, Hor H, Dauvilliers Y, et al. DQB1 locus alone explains most of the risk and protection in narcolepsy with cataplexy in Europe. Sleep 2014;37(1):19– 25. doi: 10.5665/ sleep.3300.
7. Iber C, Ancoli-Israel S, Chesson A. The AASM Manual for the scoring of sleep and associated events: rules, terminology and technical specifications. 1st ed. Westchester, Illinois: American Academy of Sleep Medicine 2007.
8. Kemlink D, Pretl M, Sonka K, et al. A comparison of polysomnographic and actigraphic evaluation of periodic limb movements in sleep. Neurol Res 2008;30(3):234– 8.
9. Kemlink D, Vávrová J. Syndrom neklidných nohou. Cesk Slov Neurol N 2011;74/ 107(2):141– 9.
10. Buskova J, Vorlova T, Pisko J, et al. Severe sleep-related movement disorder induced by sertraline. Sleep Med 2012;13(6):769– 70. doi: 10.1016/ j.sleep.2012.01.006.
11. Yang C, White DP, Winkelman JW. Antidepressants and periodic leg movements of sleep. Biol Psychiatry 2005;58(6):510– 4.
12. Zhang B, Hao Y, Jia F, et al. Sertraline and periodic limb movements during sleep: an 8-week open-label study in depressed patients with insomnia. Sleep Med 2013;14(12):1405– 12. doi: 10.1016/ j.sleep.2013.07.019.
13. Wittig R, Zorick F, Piccione P, et al. Narcolepsy and disturbed nocturnal sleep. Clin Electroencephalogr 1983;14(3):130– 4.
14. Dauvilliers Y, Pennestri MH, Petit D, et al. Periodic leg movements during sleep and wakefulness in narcolepsy. J Sleep Res 2007;16(3):333– 9.
15. Mayer G, Kesper K, Peter H, et al. Comorbidity in narcoleptic patients. Dtsch Med Wochenschr 2002;127(38):1942– 6.
16. Ferri R, Zucconi M, Manconi M, et al. Different periodicity and time structure of leg movements during sleep in narcolepsy/ cataplexy and restless legs syndrome. Sleep 2006;29(12):1587–94.
17. Pizza F, Tartarotti S, Poryazova R, et al. Sleep-disordered breathing and periodic limb movements in narcolepsy with cataplexy: a systematic analysis of 35 consecutive patients. Eur Neurol 2013;70(1– 2):22– 6. doi: 10.1159/ 000348719.
18. Nevsimalova S, Pisko J, Buskova J, et al. Narcolepsy: clinical differences and association with other sleep disorders in different age groups. J Neurol 2013;260(3):767– 75. doi: 10.1007/ s00415-012-6702-4.
19. Littner MR, Kushida C, Wise M, et al. Practice parameters for clinical use of the multiple sleep latency test and the maintenance of wakefulness test. Sleep 2005;28(1):113– 21.
20. Johns MW. A new method for measuring daytime sleepiness: the Epworth sleepiness scale. Sleep 1991;14(6):540– 5.
21. Vaz Fragoso CA, Van Ness PH, Araujo KL, et al. Age-related differences in sleep-wake symptoms of adults undergoing polysomnography. J Am Geriatr Soc 2015;63(9):1845– 51. doi: 10.1111/ jgs.13632.
22. Scofield H, Roth T, Drake C. Periodic limb movements during sleep: population prevalence, clinical correlates, and racial differences. Sleep 2008;31(9):1221– 7.
23. Pizza F, Vandi S, Iloti M, et al. Nocturnal sleep dynamics identify narcolepsy Type 1. Sleep 2015;38(8):1277– 84. doi: 10.5665/ sleep.4908.
24. Bahammam A. Periodic leg movements in narcolepsy patients: impact on sleep architecture. Acta Neurol Scand 2007;115(5):351– 5.
25. Sasai-Sakuma T, Kinoshita A, Inoue Y. Polysomnographic assessment of sleep comorbidities in drug-naive narcolepsy-spectrum disorders – a Japanese cross--sectional study. PloS One 2015;10(8):e0136988. doi: 10.1371/ journal.pone.0136988.
26. Montplaisir J, Michaud M, Denesle R, et al. Periodic leg movements are not more prevalent in insomnia or hypersomnia but are specifically associated with sleep disorders involving a dopaminergic impairment. Sleep Med 2000;1(2):163– 7.
27. Dauvilliers Y, Pennestri MH, Whittom S, et al. Autonomic response to periodic leg movements during sleep in narcolepsy-cataplexy. Sleep 2011;34(2):219– 23.
28. Silber MH, Rye DB. Solving the mysteries of narcolepsy: the hypocretin story. Neurology 2001;56(12):1616– 8.
29. Korotkova TM, Sergeeva OA, Eriksson KS, et al. Excitation of ventral tegmental area dopaminergic and non-dopaminergic neurons by orexins/ hypocretins. J Neurosci 2003;23(1):7– 11.
30. Okura M, Fujiki N, Ripley B, et al. Narcoleptic canines display periodic leg movements during sleep. Psychiatry Clin Neurosci 2001;55(3):243– 4.
31. Boivin DB, Lorrain D, Montplaisir J. Effects of bromocriptine on periodic limb movements in human narcolepsy. Neurology 1993;43(10):2134– 6.
32. Thannickal TC, Nienhuis R, Siegel JM. Localized loss of hypocretin (orexin) cells in narcolepsy without cataplexy. Sleep 2009;32(8):993– 8.
33. Buskova J, Kemlink D, Ibarburu V, et al. Antidepressants substantially affect basic REM sleep characteristics in narcolepsy-cataplexy patients. Neuro Endocrinol Lett 2015;36(5):430– 3.
34. Šonka K, Nevšímalová S. Klinický standard pro diagnostiku a léčbu narkolepsie. In: Suchý M, Bednařík J, eds. Klinické doporučené postupy v neurologii I. Olomouc: Univerzita Palackého v Olomouci 2012: 77– 107.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2017 Issue 1
Most read in this issue
- Current Perception of Contraindications and Complications of Nerve Conduction Studies and Needle Electromyography
- Essential Neurological Examination – Time for Change?
- Extirpation of Colloid Cyst by an Endoscopic Approach
- Periodic Limb Movements During Sleep are More Severe in Narcolepsy with Cataplexy than in Narcolepsy without Cataplexy
